珊瑚共生链霉菌、发酵生产放线菌素d的方法及应用
技术领域
1.本发明属于生物技术领域,涉及一种用于菌种,具体涉及珊瑚共生链霉菌、发酵生产放线菌素d的方法及应用
背景技术:
2.珊瑚是热带海洋的第一大无脊椎动物。珊瑚的表面以及内部组织中都含有密集而多样的微生物群落,珊瑚共附生微生物可以产生许多结构多样的化合物,这些化合物具有广泛的生物活性,其中包括针对多种病原体的抗菌化合物,正成为抗菌药物筛选的重要来源。
3.放线菌素d(actinomycin d)是19世纪40年代waksman等人从土壤微小链霉菌(streptomyces parvullus)中发现并分离的多肽类抗生素。此后,又从链霉菌属的多个种中发现了放线菌素d。例如灰色链霉菌(s.griseus),弗氏链霉菌(s.fradiae),抗生链霉菌(s.antibioticus),金羊毛链霉菌(s.chrysomallus)等。放线菌素d起初研究时表现出抗菌活性。但在研究的进一步发展过程中,放线菌素d展现出优良的抗肿瘤活性,在治疗某些恶性肿瘤的临床医学方面收到良好的成效,因此,当前放线菌素d主要作为抗癌药物被应用。
4.近年来,放线菌素d的抗菌活性逐渐引起人们的关注,据报道,放线菌素d对一些病原菌如革兰氏阳性细菌具有相当强的抗性,在抗菌药物的研究上也呈现出广阔的应用前景。无乳链球菌(streptococcus agalactiae)是一种链球菌属的革兰阳性病原菌,能引起人体、多种陆生和水生生物产生脑膜炎、肺炎和败血症等多种疾病,具有较高的致病和致死率。近年来,无乳链球菌病害在水产领域爆发频繁,其中以罗非鱼无链球菌病害最为严重,对罗非鱼的健康养殖和罗非鱼产业的可持续发展构成严重威胁。因此,研发针对该菌的抗菌药物或益生菌具有重要应用前景。
技术实现要素:
5.本发明的目的是提供了一种珊瑚共生链霉菌。
6.为了实现上述目的,本发明的技术方案为:提供一种珊瑚共生链霉菌,该珊瑚共生链霉菌为链霉菌(streptomyces sp)hnm0560,于2019年11月22日保藏于中国典型培养物保藏中心(cctcc),菌种保藏编号cctcc m 2019966,保藏地址为:湖北省武汉市武昌区八一路珞珈山。
7.本发明的另一目的在于提供一种珊瑚共生链霉菌发酵生产放线菌素d的方法,包括以下步骤:
8.s1、培养hnm0560种子液;
9.s2、将培养获得的hnm0560的种子液接种至发酵培养基中发酵培养,获得发酵液;
10.s3、从发酵液中分离放线菌素d。
11.进一步地,步骤s2中,所述发酵培养基包括可溶性淀粉、酵母浸粉、蛋白胨、自来水、海水,ph 7.0。
12.进一步地,所述可溶性淀粉8~15g、酵母浸粉2~8g、蛋白胨1~5g、自来水400~600ml、海水400~600ml。
13.进一步地,步骤s2中,所述发酵条件为26~30℃、150~180rpm、5~7天。
14.进一步地,所述发酵条件为28℃、180rpm、7天。
15.进一步地,珊瑚共生链霉菌发酵生产放线菌素d的方法,还包括以下步骤:
16.s3
‑
1、将所述发酵液过滤,获得菌体;
17.s3
‑
2、将菌体用丙酮浸提,减压蒸干,获得放线菌素d粗浸膏;
18.s3
‑
3、将放线菌素d粗浸膏经lh
‑
20凝胶柱色谱分离(80%的甲醇水溶液洗脱),得到放线菌素d。
19.进一步地,所述放线菌素d最高产量达到58mg/l。
20.本发明的再一目的在于提供一种放线菌素d在防治罗非鱼无乳链球菌中的应用。
21.进一步地,防治罗非鱼无乳链球菌的最小抑菌浓度为0.25μg/ml,优于阳性药妥布霉素(32μg/ml)。
22.本发明提供的链霉菌hnm0560在没有经过任何培养基及发酵条件优化的前提下,其放线菌素d的产量可达58mg/l。本发明所提供的生产放线菌素d的方法是发酵链霉菌hnm0560,发酵稳定、化合物分离工艺简便。所述的放线菌素d对罗非鱼无乳链球菌活性具有较强的抑制活性,提供了该化合物新的活性。链霉菌hnm0560具有很好的工业化潜力与应用前景。
具体实施方式
23.下面对本发明的实施案例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
24.一、链霉菌(streptomyces)hnm0560的分离和鉴定
25.1、链霉菌hnm0560的分离
26.菌株分离培养基的组成如下:可溶性淀粉10g,干酪素0.3g,硝酸钾2g,七水合硫酸镁0.05g,氯化钠2g,磷酸氢二钾2g,碳酸钙0.02g,七水合硫酸亚铁0.01g,重铬酸钾0.1g,蒸馏水500ml,陈海水500ml,琼脂20g,ph 7.2~7.4。
27.称取1g珊瑚样品(采自海南文昌海域),用10毫升无菌海水进行研磨,再用无菌海水稀释10倍、100倍、1000倍,分别吸取100μl稀释液,涂布分离培养基平板上,在28℃的恒温培养箱中倒置培养1~4周。根据平板上菌落的形态特征,用无菌竹签挑出平板上的放线菌菌落进行纯化。获得了一株菌,将其命名为菌株hnm0560。
28.挑取纯化后的菌株hnm0560的单菌落于无菌20%甘油中
‑
20℃冰箱中保存。
29.2、链霉菌hnm0560的鉴定
30.采用通用引物27f和1492r pcr扩增其16s rrna基因序列,测得菌株hnm0560的16s rrna基因序列有效片段长度为1491bp。在eztaxon数据库中进行有效种的序列相似性搜索,发现菌株hnm0560与链霉菌属的菌株高度相关,说明菌株hnm0560是链霉菌属的放线菌。
31.根据16s rrna基因序列分析,将菌株hnm0560鉴定为链霉菌。
32.链霉菌hnm0560已于2019年11月22日保藏于在中国典型培养物保藏中心(cctcc),保藏编号为cctcc m 2019966。
33.应用链霉菌hnm0560生产放线菌素d
34.二、应用链霉菌hnm0560生产放线菌素d
35.种子培养基的制备方法如下(ph7.5):将酵母浸粉4g,麦芽浸粉10g,葡萄糖4g,自来水500ml,陈海水500ml定容至il。121℃灭菌20分钟。
36.发酵培养基的制备方法如下(ph9.0):将可溶性淀粉10克、酵母浸粉4克、蛋白胨2克、自来水500ml、海水500ml、ph 7.0。定容至il。121℃灭菌20分钟。
37.1、菌株发酵
38.1.1、种子培养
39.将链霉菌hnm0560接种100ml种子培养基。28℃、180rpm培养96小时,得到种子液。
40.1.2、发酵培养
41.(1.2
‑
1)在500ml的三角瓶中装200ml发酵培养基。
42.(1.2
‑
2)在发酵培养基中接种2ml种子液,28℃、180rpm培养7天,收获发酵液。
43.2、有效成分的分离纯化
44.2.1、将1升发酵液用3层纱布过滤,得到菌体。
45.2.2、将菌体用200ml丙酮浸提(室温过夜静置),再用3层纱布过滤并收集滤液,减压蒸干得粗浸膏,即为放线菌素d粗提物。
46.2.3、将放线菌素d粗浸膏经lh
‑
20凝胶柱色谱分离(80%的甲醇水溶液洗脱),得到放线菌素d。做hplc分析。
47.hplc分析参数:采用ymc
‑
pack c18,150
×
4.6mml.d.,s
‑
5μm.12nm。流动相为甲醇水溶液梯度洗脱,流速为1.0ml/min;检测波长240nm。
48.hplc主要活性成分的保留时间约为17.8min。
49.3、有效成分的鉴定
50.3.1、外观
51.红色粉末。
52.3.2、溶解性
53.易溶于甲醇,乙醇,丙酮,dmso,不溶于水。
54.3.3、质谱
55.esi
‑
ms m/z:1255.6302[m
‑
h]
‑
,分子式c
62
h
86
n
12
o6,与文献报道放线菌素d的结果一致。
[0056]
3.4、紫外光谱
[0057]
紫外光谱测试仪器为mariner system5304 instrumento。
[0058]
活性组份的紫外光谱201、240和445nm处有最大吸收峰。与文献报道放线菌素d紫外特征一致。
[0059]
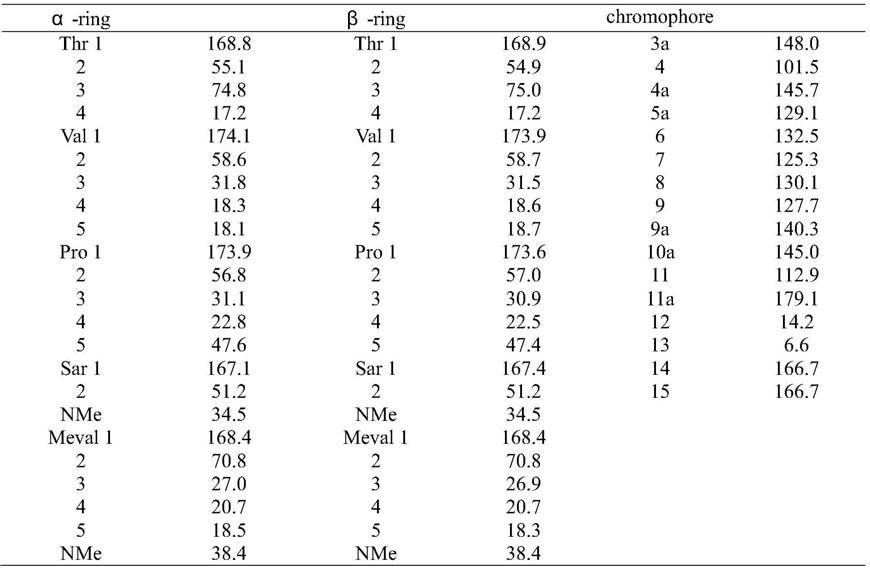
3.5、核磁图谱碳氢信号归属
[0060]
核磁图谱测试仪器为varian nova 600mhz,所用溶剂为dmso
‑
d6。活性组分碳氢信号归属如表1和2所示。与文献报道一致。
[0061]
表1和2活性组份的碳氢谱核磁信号归属:
[0062]
综合上述结果,所述活性组份的结构式见式(ⅰ),为放线菌素d。
[0063]
式(ⅰ)
[0064]
三、检测化合物抗罗非鱼无乳链球菌活性
[0065]
牛脑培养基:脑心浸液肉汤38.5克,自来水1000ml,ph 7.4~7.6。溶解后,121℃灭菌20分钟。
[0066]
1、制备菌液
[0067]
通过血球计数板计数,用牛脑培养基将罗非鱼无乳链球菌制备成(3~6)
×
106cfu/ml的菌液。
[0068]
2、制备待测溶液
[0069]
以无菌dmso为溶剂将化合物和阳性药妥布霉素配制为1280μg/ml的母液。然后用无菌dmso依次稀释得到浓度为1280、640、320、160、80、40、20、10、5、2.5、1.25μg/ml的稀释液。
[0070]
3、测定化合物抑制罗非鱼无乳链球菌最小抑菌浓度
[0071]
3.1、取无菌96孔细胞培养板每孔加入:80ul牛脑培养基。
[0072]
3.2、取完成步骤3.1的96孔细胞培养板,分组处理如下:
[0073]
阳性对照组(11个孔):分别加入20ul步骤2制备的11个稀释度的阳性对照药物稀释液;
[0074]
实验组(11个孔):分别加入20ul步骤2制备的11个稀释度的化合物稀释液;
[0075]
阴性对照(11个孔):分别加入20ul无菌dmso。
[0076]
3.3、取完成步骤3.2的96孔细胞培养板,每孔加入100ul步骤1得到的菌液,28℃培养48小时后观察各孔中菌的生长状况:如该孔中呈混浊状态,说明相应浓度的化合物无抗罗非鱼无乳链球菌活性;如该孔中呈澄清状态,说明相应浓度的化合物具有抗罗非鱼无乳链球菌活性。罗非鱼无乳链球菌生长被完全抑制的孔所对应的化合物的最小终浓度即为该化合物对罗非鱼无乳链球菌的最低抑菌浓度,mic值。
[0077]
放线菌素d抗罗非鱼无乳链球菌活性的mic为0.25μg/ml,阳性药妥布霉素的mic为32μg/ml。说明放线菌素d的罗非鱼无乳链球菌活性优于阳性药。
[0078]
表1活性组份的碳谱核磁信号归属
[0079][0080]
表2活性组份的氢谱核磁信号归属
[0081][0082]
以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属于本发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

