包含芳基硫酸酯酶a的重组载体及其在用于治疗异染性脑白质营养不良的干细胞治疗中的用途
1.1.引言
2.本文描述了包含表达盒的重组慢病毒载体,所述表达盒包含表达芳基硫酸酯酶a基因的核酸构建体。所述载体可用于异染性脑白质营养不良的基因治疗。还公开了制备所述载体的方法。本文提供了包含所述载体的多能干细胞。还提供了培养所述干细胞以保持其多能性的方法,保持转染的干细胞多能性的介质和培养方法。
3.2.背景
4.异染性脑白质营养不良(mld)是一种罕见的溶酶体贮积症,其由芳基硫酸酯酶a(arsa)基因中导致arsa缺乏的突变引起。这种酶催化硫苷脂到半乳糖脑苷脂的降解途径的第一步。arsa缺乏导致硫苷脂在中枢神经系统(cns)的少突胶质细胞、小胶质细胞和某些神经元以及外周神经系统(pns)的施旺细胞和巨噬细胞中的累积。这导致小胶质细胞激活、进行性变性、脱髓鞘和各种致命的神经症状,如严重的进行性运动和认知损害。
5.观察到三种类型的mld:1.在婴儿期早期到晚期(最多到2岁)的婴儿发作型mld,其为最常观察到的,占全部发病的50
‑
60%;2.青春期早期至晚期(2
‑
16岁)的青少年发作型mld,占全部发病的30
‑
40%;和3.在16岁以后的成年期的成人发作型,占全部发病的5
‑
10%。据估计,每100000名新生儿中有1.4
‑
1.8名婴儿携带mld,即每年约有1900名新患者。目前,全世界约有41000名患者。早期无典型症状。90%以上的患者诊断错误,错失了及时治疗疾病的机会。如果不经治疗,患者可能在婴儿期晚期的1
‑
2年内或青春期的6
‑
8年内遭受瘫痪和失明。
6.目前尚无临床证实的mld治愈,直到最近,大多数mld患者的治疗还限于支持性护理。目前正在开发多种治疗方案,并处于临床试验阶段。大多数是酶替代治疗(ert)和造血干细胞移植(hsct)。提供功能性arsa的酶替代治疗(ert)一直是具有挑战性的,因为arsa是一种无法穿透血脑屏障(bbb)的高分子量蛋白质,因此显示有限的作用。如果造血干细胞不能穿过bbb,它们就不能分化为分泌有限的arsa酶的小胶质细胞,所述arsa酶被受体神经细胞吸收。
7.造血干细胞移植(hsct)可以使选定的患有溶酶体贮积病的患者亚群受益。此外,干细胞移植消除了患者经历化学治疗的需要,所述化学治疗称为基于白消安的调理,以去除原始骨髓细胞并为基因校正的干细胞生长创造空间。该过程可能引入包括神经系统在内的多种病变的风险。通过仔细滴定(titration)治疗,调理治疗可以更加可耐受,移植后患者可以快速恢复,无明显副作用。此外,同种异体细胞移植存在移植物抗宿主病(gvhd)的风险,这可能是导致广泛发病的原因。与使用骨髓(bm)相比,使用来自匹配的无关供体的脐带血(ucb)的hsct降低了急性或慢性gvhd的风险。
8.然而,由于其较低的细胞剂量和免疫学上的不成熟,使用ucb有更高的移植失败的可能性(kamani等人(2012)biol.blood marrow transplant.18(8):1265
‑
1272;locatelli和pagliara(2012)pediatr.blood cancer.59(2):372
‑
376)。hsct在mld中也显示出差的结果,结果不可预测,被证实在晚期婴儿发作患者中基本上无效。这凸显了在该领域中对创新
的治疗方法的需求。
9.3.概述
10.本文提供了携带arsa基因盒以诱导来自干细胞的arsa表达的慢病毒载体。在一个实施方案中,载体用于mld基因治疗的临床试验。公开的载体实现了对arsa的有效诱导。在某些实施方案中,以mrna和蛋白水平评估载体的基因表达活性。在某些实施方案中,表征了arsa表达对患者的影响。
11.本文提供了有效诱导arsa基因并产生足够水平的arsa以改善mld的生理参数并用于临床基因治疗的载体。
12.本发明的一个实施方案是包含表达盒的重组慢病毒载体(lv),所述表达盒包含核酸构建体,所述核酸构建体包含编码arsa多肽的arsa基因。在一个实施方案中,lv是自身失活(sin)慢病毒载体。
13.在某些实施方案中,所述载体包含在arsa基因5’启动子和arsa 3’增强子控制下的重组arsa基因。在一个实施方案中,所述重组arsa基因包括外显子和内含子。在一个实施方案中,所述载体不包含arsa基因内含子。
14.在一个实施方案中,所述载体包含绝缘子。
15.在一个实施方案中,所述载体包含rev响应元件(rre)。
16.在一个实施方案中,所述载体包含中央聚嘌呤区(central polypurine tract)。
17.在一个实施方案中,所述载体包含翻译后调节元件。
18.在一个实施方案中,所述转录后调节元件是修饰的土拨鼠转录后调节元件(“wpre”)。
19.在某些实施方案中,所述修饰的wpre具有如seq id no:3所示的核酸序列。
20.在载体的某些实施方案中,所述arsa基因是人arsa基因。在某些实施方案中,所述arsa基因具有如seq id no:2所示的核酸序列。
21.本发明的另一个实施方案是用载体转导的宿主细胞。
22.在某些实施方案中,所述细胞是干细胞。
23.在某些实施方案中,所述细胞为自体干细胞。
24.在某些实施方案中,所述细胞为造血干细胞。
25.本文提供了在本文提供的培养基中使包含载体的慢病毒生长的方法。还提供了一种适合用于慢病毒的冷冻保存的介质。
26.本文提供了一种培养包含本文公开的载体的干细胞的方法,其中所述干细胞保持多能性。在某些实施方案中,培养基包含tpo、scf、flt3和il
‑
3因子。在某些实施方案中,培养基包含抑制mtor和rock活性的激酶抑制剂。在某些实施方案中,所公开的培养基中的hsc保持多能性并增加对lv感染的敏感性。
27.在某些实施方案中,培养基保持干细胞的多能性,并包含cp1、葡萄糖、2
‑
20%(或5
‑
10%)的白蛋白和赫赛汀。在一个实施方案中,干细胞是单核细胞干细胞。
28.本文公开了一种治疗受试者的异染性脑白质营养不良(mld)的方法,所述方法包括将包含表达arsa基因的载体的干细胞移植到受试者中。
29.还提供了一种保持如本文所述的宿主细胞的多能性和增加的对lv感染的敏感性的方法,包括在包含tpo、scf、flt3和il
‑
3因子的介质中孵育宿主细胞。
30.在一个实施方案中,介质还包含抑制mtor和rock活性的激酶抑制剂。
31.在一个实施方案中,介质包含cp1、葡萄糖、2
‑
20%的白蛋白和赫赛汀。
32.在一个实施方案中,白蛋白为5
‑
10%。
33.在一个实施方案中,介质适用于干细胞的冷冻保存。
34.本文提供了一种治疗受试者的异染性脑白质营养不良(mld)的方法,所述方法包括:用本文所述的载体转导来自所述受试者的干细胞;和将所述转导的细胞移植到所述受试者中,其中所述细胞表达所述arsa基因。
35.在一个实施方案中,所述细胞是源自骨髓的干细胞。
36.在一个实施方案中,所述细胞是人造血干细胞或祖细胞。
37.本文提供了一种调节转基因的表达的方法,包括将本文所述的载体递送到造血干细胞或祖细胞。
38.在一个实施方案中,所述方法增加了基因治疗期间造血干细胞或祖细胞的存活机会。
39.在一个实施方案中,该方法防止造血干细胞或祖细胞的凋亡。
40.本文提供了一种药物组合物,其包含表达arsa基因的载体,所述药物组合物用于治疗受试者的异染性脑白质营养不良(mld)。
41.4.附图简述
42.出于说明本发明的目的,在附图中描绘了本发明的某些实施方案。然而,本发明不限于附图中描绘的实施方案的精确的安排和手段。
43.图1显示可以在本发明中使用的载体图。为了制备经设计用于产生lv
‑
arsa的载体,慢病毒质粒骨架ab.pccl.sin.cppt.u6mir
‑
10
‑
decoy.hpgk.gfp.wpre购自addgene(addgene质粒#46602;http://n2t.net/addgene:46602;rrid:addgene_46602)。用bsmbi去除u6
‑
mir
‑
10
‑
decoy并重新连接载体。然后用agei和sali去除gfp。(idf)sali
–
wpre
‑
sacii通过pcr亚克隆到定点诱变(sdm)载体中。wpre通过将atg替换为agg进行突变;sdm载体现在是sali
‑
wpre
‑
突变的
‑
sacii。harsa cdna通过pcr亚克隆到sdm wpre.muta1中。sdm载体然后是agei
‑
harsa
‑
sali
‑
wpre.mut1
‑
sacii。随后使用agei和sacii酶切将gfp.wpre盒替换为harsa.wpre.mut1盒。(idf)
44.图2显示造血干细胞(hsc)基因修饰和hsc移植的过程的示意图。首先,在优化基因设计和实验室规模制备后,将携带功能arsa基因的大规模慢病毒生产外包,以在当前的gmp条件下进行制备。第二,采用cd34阳性选择来动员和纯化hsc。第三,用携带功能arsa基因的慢病毒感染hsc。第四,将基因修饰的hsc冷冻,并将样品送至qc和qa检测。第五,招募患者来接受骨髓消融联合化疗以清除旧的hsc。第六,将基因修饰的hsc输注到患者体内以重新构建骨髓。最后,患者随访至少3年。
45.图3是hscgt的示意性时间线。在招募患者进行hscgt前60天进行第一次hsc采集。第一次采集hsc的目的是为hsc后备。在hsgt失败的情况下,可以回输自体hsc以挽救患者的生命。第二次hsc采集用于cd34纯化和基因修饰。在收到qc和qa报告之前,处理时间约为3周。最后,招募患者进行化学调理(chemo
‑
conditioning)并清除具有arsa基因缺陷的旧hsc。患者输注了基因修饰的hsc并进行了随访。
46.图4a
‑
d(a
‑
c)显示移植后受试者的脑部扫描:a.健康对照;b.hscgt之前;c.hscgt
后7个月;d.随时间推移的arsa活性。
47.图5a
‑
d显示移植后1年受试者的脑部扫描。病变区域稳定,未观察到病变扩大。
48.图6显示治疗的mld患者的运动/iq得分。mld患者于2014年9月30日在基因治疗前出现运动/iq急剧下降。治疗后,患者的运动/iq在两年内逐渐恢复。
49.图7a
‑
b显示通过lam pcr获得的lv在基因组中的整合位点。插入位点在整个基因组中为894个。
50.图8a
‑
c显示a.插入位点通常分布在整个基因组。没有观察到有偏倚的插入偏好;b.lv在基因组中的插入位点的分组。虽然插入位点主要存在于蛋白编码基因、ncrna和假(pseudo)区域,但其中只有10个插入到功能基因的启动子和外显子中;c.对所有检测到的可能影响细胞生物学的插入位点进行go分析。
51.图9a
‑
c显示移植过程和结果;移植后10个月,nsg scid小鼠的肿瘤发生风险没有增加。a.显示基因修饰的cd34人hsc移植后(每只小鼠300000个hsc)基于辐射的骨髓消融的示意图;b.基因修饰的cd34 hsc显示正常的cfu形成并分化为红细胞和单核细胞;c.移植后10个月后,nsg scid小鼠中约30%的外周血含有人cd45阳性单核细胞。
52.图10显示外周血中的arsa酶活性。所有三名患者中的arsa活性均升高至正常水平。
53.图11显示质粒克隆8
‑
seq id no:1的核酸序列。第一个阴影区域显示arsa基因(seq id no:2)。第二个阴影区域是wpre mut 1(“t”到“g”突变位点为粗体)(seq id no:3)。第三个阴影区域是ltr(seq id no:4)。
54.图12a
‑
b显示载体拷贝数(“vcn”)随时间的变化:a.pbmnc的变化;b.vcn随着时间的推移随cd3、cd14、cd15和cd19的变化。
55.5.详述
56.造血干细胞基因移植(hscgt)利用在再输注后慢病毒介导的arsa在自体hsc中的过表达,已成为一种具有潜在吸引力的治疗。在该治疗中,hsc被分离,基因修饰,并作为自体移植物返回到患者。校正的hsc表达高水平的功能性arsa,额外的好处是能够监测宿主基因组中慢病毒介导的arsa基因插入位点。长期益处需要移植足够高数量的基因修饰的hsc,所述hsc可以重新填充经调理的骨髓(“bm”),产生所有造血谱系的校正的治疗性血细胞。当移植到患者体内时,这在数量上是比正常供体细胞更好的功能性酶来源,因为校正的hsc可以通过血脑屏障(“bbb”)并诱导小胶质细胞分泌足够的功能性arsa酶,所述的功能性arsa酶由arsa缺陷的受体神经细胞吸收。hsc的自我更新确保比以前尝试的治疗更长时间地保持功效。自体移植还与显著降低的移植相关的发病率有关,避免了严重免疫排斥的风险。
57.hsc及其子代的有效长期基因修饰需要一种技术,该技术允许将校正的dna稳定整合到基因组中,而不影响hsc功能。最有效的递送系统是病毒载体。已经开发出敏感的分子工具来以每位患者数千个整合体的高效率检索载体整合位点,并监测移植的基因校正的干细胞及其子细胞。
58.安全性是该方法的主要关注点,因为病毒载体整合到宿主基因组中,并可能带来导致癌症相关基因或癌基因的突变发生的风险。新一代修饰的基于自身失活慢病毒的hscgt具有显著提高的安全性,在超过5年的随访后,临床试验中没有癌症风险增加的证据。在最近仅在早期发作型mld的晚期婴儿中进行的临床试验之后,更多研究人员的目标是治
愈已进展到mld中期的mld患者。
59.5.1定义
60.本说明书中使用的术语在本发明的上下文和使用每个术语的具体上下文中通常具有其在本领域中的普通含义。某些术语在下文或说明书中的其他地方讨论,以在描述本发明的方法和如何使用它们时为从业者提供额外的指导。此外,可以理解的是,同样的事物可以用多于一种的方式说明。因此,供选择的语言和同义词可以用于本文讨论的任何一个或多个术语,并且对于本文是否详细阐述或讨论术语没有设定任何特殊意义。提供了某些术语的同义词。一个或多个同义词的记载不排除其他同义词的使用。说明书中任何地方的实例的使用,包括本文讨论的任何术语的实例,仅是说明性的,决不限制本发明或任何示例性术语的范围和含义。同样,本发明不限于其优选的实施方案。
61.造血干细胞(hsc)是多能干细胞,其产生所有血细胞类型,包括髓系(单核细胞和巨噬细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、巨核细胞/血小板、树突状细胞)和淋巴谱系(t细胞、b细胞、nk细胞)。(biffi,2018)
[0062]“重组”与其在本领域中的用法一致,用于指包含这样的部分的核酸序列,所述部分不作为单一序列的部分一起天然存在或已经相对于天然存在的序列重新排列。重组核酸通过涉及人工的过程产生和/或由人工产生的核酸生成(例如,通过一个或多个复制、扩增、转录等的循环)。重组病毒是包含重组核酸的病毒。重组细胞是包含重组核酸的细胞。(kohn,us2015/00224209)
[0063]
如本文所用的,术语“重组慢病毒载体”或“重组lv”是指人工产生的多核苷酸载体,其由lv和多个另外的作为人为干预和操作的结果的区段组装。(kohn,us2015/00224209)
[0064]
短语“治疗有效量”在本文中用于指足以引起受试者的临床上显著的病症的改善,或延迟或最小化或减轻与疾病相关的一种或多种症状,或导致受试者的生理上期望的有益变化的量。
[0065]
术语“治疗(treat)”、“治疗(treatment)”等是指减缓、缓解、改善或减轻至少一种疾病的症状或在疾病发作后逆转疾病的手段。
[0066]
本技术中使用的术语“受试者”是指具有免疫系统的动物,例如鸟类和哺乳动物。哺乳动物包括犬科动物、猫科动物、啮齿动物、牛科动物、马科动物、猪科动物、绵羊科动物和灵长类动物。鸟类包括但不限于家禽、鸣禽和猛禽。因此,本发明可用于兽医学,例如治疗伴侣动物、农场动物、动物园中的实验室动物和野外动物。本发明特别适用于人类医学应用。
[0067]
术语“有其需要”是已知或疑似患有疾病或处于患上疾病的风险的受试者,所述疾病包括但不限于多发性硬化症和其他与t细胞相关的自身免疫疾病,或与中枢神经系统或血
‑
脑屏障或血
‑
脊髓屏障相关的疾病。
[0068]
需要治疗的受试者是已经患上该疾病的受试者。需要预防的受试者将是具有该疾病的风险因素的受试者。
[0069]
当涉及数值时,术语“约”是指该数值的
±
0.5%。
[0070]
本文使用的术语“药剂”是指产生或能够产生作用的物质,包括但不限于化学品、药物、药品、生物制剂、小分子、抗体、核酸、肽和蛋白。
[0071]
5.2基因载体
[0072]
可用于本发明的arsa基因或其他基因可以用合适的基因载体,即适合递送目的基因(转基因)的载体,例如病毒载体表达。适合用于基因治疗的病毒载体是本领域熟知的。来自几个不同家族的病毒已被修饰以生成用于基因递送的病毒载体。可以用于本发明的病毒包括逆转录病毒、慢病毒、腺病毒、腺相关病毒、单纯疱疹病毒、小核糖核酸病毒和甲病毒。在一个实施方案中,病毒是逆转录病毒。在一个实施方案中,逆转录病毒是慢病毒。本发明可以用于控制包含在载体中的转基因的表达。本发明还可用于控制载体的表达。在一个实施方案中,本文公开的载体可以用于递送一种或多种可用于治疗本发明中所述的障碍的转基因。通过根据本发明的载体系统递送一种或多种治疗基因可以单独使用或与其他治疗或用于治疗的药剂组合使用。
[0073]
在一个实施方案中,可以使用可商购的ab.pccl.sin.cpptu6mir
‑
10
‑
deoy.hpgk.gfp.wpre的骨架载体。在一个实施方案中,用bsmbi将u6
‑
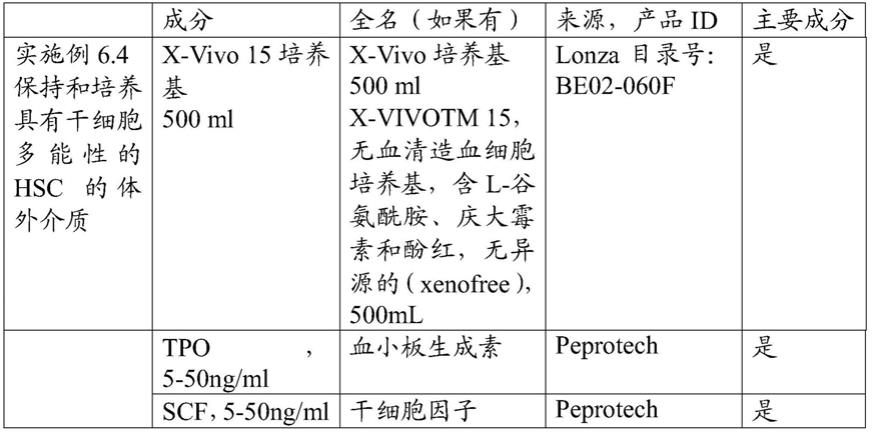
mir
‑
10
‑
decoy从骨架去除并重新连接(relegate)载体。在一个实施方案中,使用agei/sali去除gfp。使用pcr将sali
‑
wpre
‑
sacii亚克隆到sdm载体中。在一个实施方案中,将野生型atg突变为agg以获得wpre突变。在一个实施方案中,载体是sdm sal i
‑
wpre突变的
‑
sacii。在一个实施方案中,通过pct将harsacdna亚克隆到sdm wpre.muta1中。在一个实施方案中,载体是sdm载体:agei
‑
harsa
‑
sal1
‑
wpre mut 1
‑
sacii。在一个实施方案中,使用agei/sacii酶切以harsa.wpre mut 1盒替换gfp.wpre盒。在一个实施方案中,lv产物的转基因载体用mdl/vsv.g转染到293ft中。在一个实施方案中,载体显示在图1中。
[0074]
5.2.1不依赖tat的和自身失活的慢病毒载体
[0075]
在某些实施方案中,lv构建体包含不依赖tat的自身失活(sin)构型。因此,在各种实施方案中,期望在本文所述的lv中采用相对于野生型ltr具有降低的启动子活性的ltr区域。可以提供这样的构建体,其有效地“自身失活”(sin),提供生物安全特征。sin载体是其中转导细胞中全长载体rna的产生大大减少或完全消除的载体。该特征使具有复制能力的重组体(rcr)出现的风险最小化。此外,它降低了位于载体整合位点附近的细胞编码序列异常表达的风险。
[0076]
此外,sin设计降低了ltr和驱动转基因表达的启动子之间的干扰的可能性。sin lv通常可以允许内部启动子的完全的活性。
[0077]
sin设计提高了lv的生物安全性。大多数hiv ltr由u3序列组成。u3区域包含增强子和启动子元件,其调节感染的细胞中hiv基因组的基础和诱导表达,并响应细胞激活。这些启动子元件中有几个是病毒复制所必需的。一些增强子元件在病毒分离株中高度保守,并且作为关键毒力因子已经参与到病毒发病机制中。增强子元件可以起到影响病毒的不同细胞靶标的复制速率的作用。
[0078]
由于病毒转录从5
′
ltr的u3区域的3
′
末端开始,这些序列不是病毒mrna的一部分,并且来自3
′
ltr的其拷贝在整合的前病毒中充当用于生成两个ltr的模板。如果逆转录病毒载体构建体中u3区域的3
′
拷贝改变,则载体rna仍在生产细胞中由完整的5
′
ltr产生,但不能在靶细胞中再生。这样的载体的转导导致子代病毒中的两个ltr均失活。因此,逆转录病毒是自身失活的(sin),并且那些载体被称为sin转移载体。
[0079]
在某些实施方案中,通过在载体dna,即用于产生载体rna的dna的3
′
ltr的u3区域
中引入缺失来实现自身失活。在rt过程中,该缺失被转移到前病毒dna的5
′
ltr。通常,希望消除足够的u3序列以大大减少或完全消除ltr的转录活性,从而大大减少或消除转导细胞中全长载体rna的产生。然而,通常希望保留那些参与病毒rna聚腺苷酸化的ltr的元件,所述聚腺苷酸化是通常分散在u3、r和u5上的功能。因此,在某些实施方案中,希望从ltr中消除尽可能多的在转录上重要的基序,同时保留聚腺苷酸化决定簇。
[0080]
zufferey等人(1998)j virol.72(12):9873
‑
9880和第5,994,136号美国专利中详细描述了sin设计。然而,如其中所述的,对3
′
ltr处的缺失程度存在限制。首先,u3区域的5'末端在载体转移中发挥另一种基本功能,这是整合所需的(末端二核苷酸 att序列)。因此,末端二核苷酸和att序列可以代表可以缺失的u3序列的5'边界。此外,一些松散定义的区域可以影响r区域中下游聚腺苷酸化位点的活性。u3序列从3
′
ltr中过度缺失可以降低载体转录本的聚腺苷酸化,对生产细胞中载体的滴度和靶细胞中的转基因表达都有不利影响。
[0081]
在某些实施方案中,从ltr中去除的慢病毒序列被来自非慢病毒逆转录病毒的相当的序列替换,从而形成杂交ltr。特别地,ltr内的慢病毒r区域可以全部或部分被来自非慢病毒逆转录病毒的r区域替换。在某些实施方案中,慢病毒tar序列,即与tat蛋白相互作用以增强病毒复制的序列,被从r区域中去除,优选全部去除。然后用来自非慢病毒逆转录病毒的r区域的相当的部分替换tar序列,从而形成杂交r区域。ltr可以被进一步修饰以去除和/或用非慢病毒序列替换慢病毒u3和u5区域的全部或部分。
[0082]
在某些实施方案中,sin构型提供了包含缺乏其tar序列的全部或部分的杂交慢病毒r区域的逆转录病毒ltr,从而消除通过tat的任何可能的激活,其中tar序列或其部分被来自非慢病毒逆转录病毒的r区域的相当的部分替换,从而形成杂交r区域。在一个实施方案中,逆转录病毒ltr包含杂交r区域,其中所述杂交r区域包含hiv r的部分。可作为r区域来源的合适的慢病毒包括例如hiv(hiv
‑
1和hiv
‑
2)、eiv、siv和fiv。可作为非慢病毒序列来源的合适的逆转录病毒包括例如momsv、momlv、friend、mscv、rsv和泡沫病毒(spumavirus)。在一个实施方案中,慢病毒是hiv并且非慢病毒逆转录病毒是momsv。
[0083]
在一个实施方案中,包含杂交r区域的ltr是左侧(5
′
)ltr并且还包含杂交r区域上游的启动子序列。在某些实施方案中,启动子起源于非慢病毒并且包括例如来自非慢病毒逆转录病毒的u3区域(例如,momsv u3区域)。在一个实施方案中,左侧(5
′
)ltr还包含杂交r区域下游的慢病毒u5区域。在一个实施方案中,u5区域是包括基因组整合所必需的hiv att位点的hiv u5区域。
[0084]
在一个实施方案中,包含杂交r区域的ltr是右侧(3
′
)ltr并且还包含在杂交r区域上游的修饰的(例如,截短的)慢病毒u3区域。修饰的慢病毒u3区域可以包括att序列,但缺少任何具有启动子活性的序列,从而导致载体成为sin,因为病毒转录不能超越染色体整合后的第一轮复制。在一个具体的实施方案中,杂交r区域上游的修饰的慢病毒u3区域由最多到慢病毒u3 att位点和包括慢病毒u3 att位点的慢病毒u3区域的3'末端组成。
[0085]
在某些实施方案中,载体耐受明显的u3缺失,包括去除ltr tata框(例如,从
‑
418到
‑
18的缺失),而载体滴度没有显著降低。这些缺失使得ltr区域基本上转录失活,因为ltr的转录能力降低到约90%或更低。
[0086]
还已经证明,如果转移载体构建体中的上游ltr的一部分被组成型活性启动子序列替代,则tat的反式作用功能变得非必要(参见,例如,dull等人(1998)j virol.72(11):
8463
‑
8471)。在一个实施方案中,表达arsa的盒被置于pccl lv骨架中,所述骨架是sin载体,在5
′
ltr中cmv增强子/启动子被取代。
[0087]
将认识到cmv启动子通常提供高水平的非组织特异性表达。其他具有相似组成活性的启动子包括但不限于rsv启动子和sv40启动子。也可以使用哺乳动物启动子,例如β
‑
肌动蛋白启动子、泛素c启动子、延伸因子启动子、微管蛋白启动子等。
[0088]
前述sin构型是说明性的且非限制性的。许多sin构型是本领域技术人员已知的。如上所述,在某些实施方案中,ltr转录减少了约95%至约99%。在某些实施方案中,可以使ltr至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%转录失活。
[0089]
绝缘子元件
[0090]
在某些实施方案中,为了进一步提高生物安全性,将绝缘子插入本文所述的lv中。绝缘子是存在于整个基因组的dna序列元件。它们结合修饰染色质并改变区域基因表达的蛋白质。将绝缘子置于本文所述的载体中提供了各种潜在的益处,尤其包括:1)保护所述载体免受侧翼染色体表达的位置效应斑的影响(即屏障活性);和2)保护侧翼染色体免受由载体引起的基因表达的插入反式激活的影响(增强子阻断)。因此,绝缘子可以帮助保留嵌入基因组或遗传环境中的基因或转录单位的独立功能,在所述基因组或遗传环境中其表达原本可能受到基因组或遗传环境中的调节信号的影响(参见,例如burgess
‑
beusse等人.(2002)proc.natl.acad.sci.usa,99:16433;和zhan等人.(2001)hum.genet.,109:471)。在当下语境中,绝缘子可以有助于保护慢病毒表达的序列免受整合位点效应的影响,该整合位点效应可以由基因组dna中存在的顺式作用元件介导,并导致转移的序列的表达失调。在各种实施方案中,提供了lv,其中将绝缘子序列插入到一个或两个ltr中或插入到整合到细胞基因组中的载体区域中的别处。
[0091]
在各种实施方案中,本文所述的载体还包含包装信号。“包装信号”、“包装序列”或“psi序列”是足以引导其序列包含包装信号的核酸包装成逆转录病毒颗粒的任何核酸序列。该术语包括天然存在的包装序列及其工程变体。许多不同的逆转录病毒,包括慢病毒的包装信号是本领域已知的。
[0092]
在某些实施方案中,本文所述的lv包含rev响应元件(rre)以增强未剪接的rna的核输出。rre是本领域技术人员熟知的。这样的序列可以从genbank或位于url hiv
‑
web.lanl.gov/content/index的数据库中轻松获得。
[0093]
在各种实施方案中,本文所述的载体还包括中央聚嘌呤区。据报道,通过促进病毒cdna通过中央dna瓣(flap)的核输入,已知在慢病毒(例如hiv
‑
1)载体构建体中插入包含中央聚嘌呤区(cppt)的片段显著提高转导效率。
[0094]
在某些实施方案中,本文所述的lv可以包含多种转录后调节元件(pre)中的任一种,其在转录本中的存在增加异源核酸(例如,βas3)在蛋白水平上的表达。pre在某些实施方案中可以特别有用,尤其是涉及具有适度启动子的慢病毒构建体的实施方案。
[0095]
一种类型的pre是位于表达盒内的内含子,它可以刺激基因表达。然而,内含子可以在慢病毒的生命周期事件期间被剪除。因此,如果内含子用作pre,它们通常被置于与载体基因组转录本相反的方向上。
[0096]
不依赖剪接事件的转录后调节元件提供在病毒生命周期中不被去除的优点。一些
实例是单纯疱疹病毒的转录后加工元件、乙型肝炎病毒(hpre)和土拨鼠肝炎病毒(wpre)的转录后调节元件。其中wpre通常是优选的,因为它包含在hpre中未发现的另外的顺式作用元件。该调节元件通常位于载体内,以便于包含在转基因的rna转录本中,但在转基因翻译单位的终止密码子外。
[0097]
wpre是一种rna输出元件,其介导rna从细胞核到细胞质的有效转运。其通过插入顺式作用核酸序列来增强转基因的表达,使得元件和转基因包含在单一转录本中。在有义方向上存在wpre时,显示转基因表达增加了多达7到10倍。逆转录病毒载体以cdna而不是完整的含有内含子的基因的形式转移序列,因为内含子通常在导致逆转录病毒颗粒形成的事件顺序期间被剪除。内含子介导初级转录本与剪接机制的相互作用。因为由于剪接和转运机制之间的耦合,剪接机制对rna的加工促进了其细胞质输出,因此cdna通常低效率地表达。因此,在载体中包含wpre导致转基因的表达增强。
[0098]
土拨鼠肝炎病毒转录后调节元件(wpre)是一种嗜肝dna病毒序列,其广泛用作各种类型的质粒或病毒基因载体中的顺式作用调节模块。wpre通常对于使用为基因治疗配置的整合逆转录病毒载体实现足够的表达水平是必需的;因此,已经对其作用机制进行了详细研究。当置于基因转移盒的30个未翻译的区域中时,wpre在rna转录本生物发生的早期通过增加核和细胞质mrna水平二者来增强转基因的表达。(zufferey r,donello je,trono d,hope tj.woodchuck hepatitis virus posttranscriptional regulatory element enhances expression of transgenes delivered by retroviral vectors.j virol 1999;73:2886
–
2892)(higashimoto t,urbinati f,perumbeti a,jiang g,zarzuela a,chang lj等人.the woodchuck hepatitis virus post
‑
transcriptional regulatory element reduces readthrough transcription from retroviral vectors.gene therapy 2007;14:1298
–
1304.)
[0099]
尽管wpre部分与依赖于crm1的输出机制耦合,但其转录后效应不是由增加的rna输出或增加的转录率或更长的rna物质的半衰期导致的,而是由改善的30个末端转录本加工导致的。(popa i,harris me,donello je,hope tj.crm1
‑
dependent function of a cis
‑
acting rna export element.mol cell biol 2002;22:2057
–
2067.)wpre看起来增加了聚腺苷酸化转录本的量,并且明显增加了rna的聚a尾的尺寸。(schambach a,galla m,maetzig t,loew r,baum c.improving transcriptional termination of self
‑
inactivating gamma
‑
retroviral and lentiviral vectors.mol ther 2007;15:1167
–
1173.)聚a基序包含在γ逆转录病毒或人类免疫缺陷病毒(hiv)
‑
1衍生的基因转移盒的长末端重复序列(ltr)中。当置于30个ltr的上游时,wpre改善转录本终止,因此可以显著减少转录本通读,尤其是使用源自moloney的载体时。(higashimoto等人.2007gene therapy 14:1298
‑
1304)(schambach等人.2007mol ther 15:1167
‑
1173)。
[0100]
5.3转导的宿主细胞和细胞转导方法
[0101]
本文所述的重组lv和得到的病毒能够将核酸(例如,编码arsa基因序列的核酸)转移到哺乳动物细胞中。为了递送到细胞,本发明的载体优选与合适的包装细胞系结合使用或与包含必需的逆转录病毒基因(例如gag和pol)的其他载体质粒在体外一起共转染到细胞中,以形成能够包装本发明的载体并感染细胞的无复制能力的病毒粒子。
[0102]
本文所述的重组lv和得到的病毒能够将核酸(例如,编码arsa的核酸)序列转移到
哺乳动物细胞中。为了递送到细胞,本发明的载体优选与合适的包装细胞系结合使用或与包含必需的逆转录病毒基因(例如gag和pol)的其他载体质粒在体外一起共转染到细胞中,以形成能够包装本发明的载体并感染细胞的无复制能力的病毒粒子。
[0103]
通常,载体通过转染被引入包装细胞系。包装细胞系产生含有载体基因组的病毒颗粒。转染方法是本领域技术人员熟知的。在包装载体和转移载体共转染到包装细胞系后,从培养基回收重组病毒并通过本领域技术人员使用的标准方法滴定。因此,可以通过磷酸钙转染、脂质转染或电穿孔将包装构建体引入人细胞系,通常与显性可选择的标志物,如新霉素、dhfr、谷氨酰胺合成酶一起引入,然后在适当药物存在下选择和分离克隆。在某些实施方案中,可选择的标志物基因可以物理连接到构建体中的包装基因。
[0104]
其中包装功能被配置为由合适的包装细胞表达的稳定细胞系是已知的。通常,对于病毒颗粒的产生,可以使用与慢病毒gag和pol基因的表达相容的任何细胞,或任何可以被工程改造以支持这样的表达的细胞。例如,可以使用诸如293t细胞和ht1080细胞的生产细胞。
[0105]
其中具有引入的慢病毒载体的包装细胞形成生产细胞。因此,生产细胞是可以产生或释放携带目标治疗基因(例如arsa)的包装的感染性病毒颗粒的细胞或细胞系。这些细胞还可以是贴壁依赖性的,这意味着当这些细胞附着到诸如玻璃或塑料的表面时,它们将最佳地生长、存活或保持功能。当载体有复制能力时,用作慢病毒载体包装细胞系的贴壁依赖性细胞系的一些实例是hela或293细胞和perc.6细胞。
[0106]
因此,在某些实施方案中,提供了将基因递送到细胞然后将其整合到细胞的基因组中的方法,包括使细胞与含有本文所述的慢病毒载体的病毒粒子接触。细胞(例如,以组织或器官的形式)可以与病毒粒子离体接触(例如,被感染),然后被递送到受试者(例如,哺乳动物、动物或人),在所述受试者中所述基因(例如,arsa)将被表达。在各种实施方案中,细胞可以是受试者自体的(即,来自受试者)或其可以是非受试者自体的(即,同种异体的或异种的)。此外,因为本文所述的载体能够被递送至分裂细胞和非分裂细胞两者,所以细胞可以来自多种细胞,包括例如骨髓细胞、间充质干细胞(例如,从脂肪组织获得)和其他源自人和动物来源的原代细胞。供选择地,可以将病毒粒子直接体内给予受试者或给予到受试者的局部区域(例如,骨髓)。
[0107]
当然,如上所述,本文所述的慢病毒载体将特别适用于从骨髓、外周血或脐带血获得的人造血祖细胞或造血干细胞的转导。
[0108]
5.4基因治疗
[0109]
在另外的其他实施方案中,本发明涉及一种用于转导人造血干细胞的方法,包括在通过上述慢病毒载体在包括造血干细胞的人细胞群中实现人造血祖细胞转导的条件下,将所述细胞群与所述载体之一接触。干细胞可以在体内或体外转导,这取决于最终应用。即使在人基因治疗,例如人干细胞的基因治疗的情况下,也可以在体内转导干细胞,或供选择地,在体外转导,然后将转导的干细胞输注到人受试者中。在该实施方案的一方面,可以使用本领域技术人员熟知的方法从人,例如人患者中取出人干细胞并如上所述进行转导。然后将转导的干细胞重新引入相同或不同的人体内。
[0110]
5.4.1.干细胞/祖细胞基因治疗
[0111]
在各种实施方案中,本文所述的慢病毒载体特别适用于从骨髓、外周血或脐带血
获得的人造血祖细胞或造血干细胞(hsc)的转导。当离体转导细胞、外周血细胞或肿瘤细胞时,载体颗粒与细胞一起孵育,使用的剂量通常约为1至50感染复数(moi)的数量级,其也对应于每105个细胞1
×
105至50
×
105个病毒载体转导单位。这当然包括对应于1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45和50moi的载体量。通常,载体的量可以用hela转导单位(tu)表示。
[0112]
注意到仅当载体浓度在2
×
107tu/ml以下时,才发现实现的基因转移的剂量相关的增加(通过qpcr测量的平均vc/细胞)。较高的载体浓度不增加转导功效,事实上,通常对转导程度具有负面影响(数据未显示)。基于这些发现,ccl
‑
βas3
‑
fb载体以2
×
107tu/ml(moi=40)的标准浓度使用。
[0113]
在某些实施方案中,基于细胞的治疗涉及提供干细胞和/或造血前体细胞,用编码arsa基因的慢病毒转导细胞,然后将转化的细胞引入有需要的受试者(例如,患有mld的受试者)中。在某些实施方案中,该方法涉及从受试者分离细胞群,例如干细胞群,任选地在组织培养物中扩增细胞,并施用慢病毒载体,其在细胞内的存在导致在体外细胞中产生arsa。然后将细胞返回给受试者,例如,它们可以在受试者中提供arsa。
[0114]
在一些实施方案中,可以使用细胞群,其可以是来自细胞系或来自受试者以外的个体的细胞。从受试者分离干细胞、免疫系统细胞等并将它们返回到受试者的方法是本领域熟知的。这样的方法用于例如骨髓移植、外周血干细胞移植。
[0115]
在要使用干细胞的情况下,将认识到这样的细胞可以源自多种来源,包括骨髓(bm)、脐带血(cb)cb、动员的外周血干细胞(mpb sc)等。在某些实施方案中,考虑使用诱导多能干细胞(hsc)。分离造血干细胞(hsc)、转导这样的细胞并将其引入哺乳动物受试者的方法是本领域技术人员熟知的。
[0116]
5.4.2载体的直接引入
[0117]
在某些实施方案中,考虑通过直接引入载体来直接治疗受试者。可以配制慢病毒组合物用于通过任何可用途径递送,包括但不限于肠胃外(例如静脉内)、皮内、皮下、口服(例如,吸入)、经皮(局部)、经粘膜、直肠和阴道。常用的递送途径包括吸入、肠胃外和经粘膜。
[0118]
在各种实施方案中,药物组合物可以包括lv与药学上可接受的载体的组合。如本文所用的,语言“药学上可接受的载体”包括与药物给药相容的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。也可将补充的活性化合物掺入组合物中。
[0119]
在一些实施方案中,活性剂,即本文所述的慢病毒和/或与载体一起给药的其他药剂,与将保护化合物免于从体内快速消除的载体一起制备,例如控释制剂,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,例如乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。制备这样的组合物的方法对本领域技术人员来说是显而易见的。合适的材料也可以从alza corporation和nova pharmaceuticals,inc.商购。脂质体也可以用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法制备。在一些实施方案中,组合物靶向特定细胞类型或被病毒感染的细胞。例如,可以使用针对细胞表面标志物,例如内源性标志物或在感染的细胞表面上表达的病毒抗原的单克隆抗体来使组合物具有靶向。
[0120]
为了便于给药和剂量均匀,以剂量单位形式配制组合物是有利的。如本文所用的
剂量单位形式是指适合作为用于待治疗的受试者的单位剂量的物理上离散的单位;每个单位包含经计算以产生期望的治疗效果的预定量的lv,连同药物载体。
[0121]
单位剂量不需要作为单次注射给药,但可以包括在设定的时间段内连续输注。本文描述的lv的单位剂量可以以慢病毒载体的转导单位(t.u.)方便地描述,如通过滴定细胞系如hela或293上的载体所定义的。在某些实施方案中,单位剂量的范围可以是103、104、105、106、107、108、109、10
10
、10
11
、10
12
、10
13
t.u.和更高。
[0122]
药物组合物可以根据需要以不同的时间间隔和在不同的时间段内给药,例如,每周一次,持续约1至约10周;约2至约8周;约3至约7周;约4周;约5周;约6周等。可能需要无限期地给予治疗组合物。技术人员将理解,某些因素可以影响有效治疗受试者所需的剂量和时机,所述因素包括但不限于疾病或障碍的严重程度、先前的治疗、受试者的总体健康状况和/或年龄,以及其他存在的疾病。对患有lv的受试者的治疗可以包括单一治疗,或在许多情况下可以包括一系列治疗。
[0123]
给予基因治疗载体的示例性剂量和用于确定合适剂量的方法是本领域已知的。还应理解,lv的适宜剂量可以取决于特定的接受者和给药方式。任何特定受试者的适宜的剂量水平可以取决于各种因素,包括受试者的年龄、体重、一般健康状况、性别和饮食,给药时间,给药途径,排泄率,其他给予的治疗剂等。
[0124]
在某些实施方案中,慢病毒基因治疗载体可以通过例如静脉注射、局部给药或通过立体定向注射递送到受试者(参见,例如,chen等人.(1994)proc.natl.acad.sci.usa,91:3054)。在某些实施方案中,载体可以口服或吸入递送并且可以被包封或以其他方式操作以保护它们免于降解、增强进入组织或细胞的吸收等。药物制剂可以包含在可接受的稀释剂中的lv,或者可以包含其中包埋lv的缓释基质。供选择地或另外地,当载体可以从重组细胞完整地产生时,如本文所述的逆转录病毒或慢病毒载体的情况下,药物制剂可以包含一种或多种产生载体的细胞。包含本文描述的lv的药物组合物可以包括在容器、包装或分配器中,任选地连同给药说明书一起。
[0125]
5.4.3造血干细胞移植
[0126]
干细胞能够分化成多种细胞类型。能够分化成所有细胞类型的细胞被称为全能的。在哺乳动物中,只有受精卵和早期胚胎细胞是全能的。干细胞是存在于大多数(如果不是全部)多细胞生物的细胞。它们的特征在于通过有丝分裂细胞分裂的自我更新的能力并分化成多种特化细胞类型。哺乳动物干细胞的两大类是:从囊胚的内细胞团分离的胚胎干细胞和在成体组织中存在的成体干细胞。在发育中的胚胎中,干细胞可以分化成所有特化的胚胎组织。在成年生物体中,干细胞和祖细胞充当身体的修复系统,补充特化细胞,同时还维持再生器官,如血液、皮肤或肠道组织的正常转换。
[0127]
造血干细胞移植(hsct)是移植源自骨髓(在这种情况下被称为骨髓移植)或血液的造血干细胞。干细胞移植是血液学和肿瘤学领域的一种医疗过程,最常用于患有血液疾病、骨髓疾病或某些类型的癌症的人。
[0128]
伴随着干细胞生长因子gm
‑
csf和g
‑
csf的可用性,可以使用从外周血收集的干细胞进行造血干细胞移植过程。在一个实施方案中,造血干细胞移植是使用骨髓进行的。收集外周血干细胞提供更多的移植物,不需要对供体进行全身麻醉来收集移植物,使得移植时间更短,并且可以实现更低的长期复发率。
[0129]
造血干细胞移植仍然是具有许多可能的并发症的有风险的过程;传统上,它是为患有危及生命的疾病的患者保留的。虽然偶尔在实验上用于非恶性和非血液学适应症,如严重致伤残的自身免疫疾病和心血管疾病,但看起来致命并发症的风险太高而无法获得更广泛的接受。
[0130]
hsct的候选者包括儿科病例、儿童或成人。最近已经开发了非清髓性或所谓的“微移植”过程,其需要更小剂量的准备性化疗和放疗。这已经使得hsct可以在老年人和其他另外被认为太虚弱而无法承受常规治疗方案的患者中进行。本发明旨在通过提高其安全性和/或功效来拓宽这样的治疗的治疗性应用。
[0131]
5.5培养hsc
[0132]
转染后,将细胞铺在滋养培养物上。然后每3
‑
4天向培养物供给生长培养基,该培养基可以补充或不补充一种或多种生长因子。当80
‑
95%融合时,hsc细胞系可以使用标准技术,例如通过胰蛋白酶消化进行传代。多达大约第20代,在一些实施方案中,保持选择是有益的(例如,通过为含有新霉素抗性基因的细胞添加g418)。细胞也可以在液氮中冷冻以长期储存。可以如上所述分离克隆细胞系。一般而言,这样的克隆细胞系可以使用标准技术,例如通过有限稀释或使用克隆环分离,并扩增。克隆细胞系通常可以如本领域所提供的那样进行饲养和传代。用仙台病毒转导的hsc集落在铺在滋养细胞上后2天开始形成。用慢病毒转导的hsc集落在铺在滋养细胞上后7天开始形成。
[0133]
5.6包含hsc的基质
[0134]
本发明还包括包含hsc的基质、水凝胶、支架等。hsc可以接种到天然基质,例如生物材料上。在某些实施方案中,支架通过3d打印获得。hsc可以悬浮在适合例如注射的水凝胶溶液中。用于这样的组合物的适合的水凝胶包括自组装肽,例如rad16。在一个实施方案中,可以使包含细胞的水凝胶溶液硬化,例如在模具中硬化,以形成具有分散于其中的细胞的用于植入的基质。也可以培养在这样的基质中的hsc,以便细胞在植入前进行有丝分裂扩增。水凝胶是例如通过共价键、离子键或氢键交联以产生捕获水分子的三维开放晶格结构,以形成凝胶的有机聚合物(天然或合成的)。形成水凝胶的材料分别包括离子交联的多糖,如藻酸及其盐、肽、聚磷嗪(polyphosphazine)和聚丙烯酸酯,或通过温度或ph值交联的嵌段聚合物,如聚环氧乙烷
‑
聚丙二醇嵌段共聚物。在一些实施方案中,本发明的水凝胶或基质是可生物降解的。在本发明的一些实施方案中,制剂包含可原位聚合的凝胶(参见,例如,美国公开专利申请2002/0022676;anseth等人.,j.control release,78(1
‑
3):199
‑
209(2002);wang等人.,biomaterials,24(22):3969
‑
80(2003)。
[0135]
在一些实施方案中,聚合物至少部分可溶于水溶液,例如水、缓冲盐溶液或醇水溶液,所述聚合物具有带电侧基或其一价离子盐。具有可以与阳离子反应的酸性侧基的聚合物的实例是聚(磷腈)、聚(丙烯酸)、聚(甲基丙烯酸)、丙烯酸和甲基丙烯酸的共聚物、聚(乙酸乙烯酯)和磺化聚合物,例如磺化聚苯乙烯。也可以使用通过丙烯酸或甲基丙烯酸与乙烯基醚单体或聚合物的反应形成的具有酸性侧基的共聚物。酸性基团的实例是羧酸基团、磺酸基团、卤化(优选氟化)醇基团、酚oh基团和酸性oh基团。
[0136]
可以将hsc或其共培养物接种到三维框架或支架上并植入体内。这样的框架可以与任何一种或多种生长因子、细胞、药物或其他刺激组织形成或以其他方式增强或改善本发明的实践的组分组合植入。
[0137]
可以用于本发明的支架的实例包括非织造垫、多孔泡沫或自组装肽。非织造垫可以使用由乙醇酸和乳酸(例如pga/pla)的合成可吸收共聚物(vicryl,ethicon,inc.,somerville,n.j.)组成的纤维形成。由例如聚(s
‑
己内酯)/聚(乙醇酸)(pcl/pga)共聚物组成的泡沫通过诸如冷冻干燥或冻干的方法形成(参见例如第6,355,699号美国专利),其也可用作支架。
[0138]
hsc也可以接种到生理学可接受的陶瓷材料上或与其接触,所述陶瓷材料包括但不限于磷酸单、二、三、α
‑
三、β
‑
三和四钙,羟磷灰石,氟磷灰石,硫酸钙,氟化钙,氧化钙,碳酸钙,磷酸镁钙,生物活性玻璃如bioglass.rtm.,及其混合物。目前可商购的多孔生物相容性陶瓷材料包括surgibone.rtm.(canmedica corp.,加拿大),endobon.rtm.(merck biomaterial france,法国),ceros.rtm.(mathys,ag,bettlach,瑞士)和矿化的胶原骨移植产品,如healos.tm.(depuy,inc.,raynham,mass.)和vitoss.rtm.、rhakoss.tm.和cortoss.rtm.(orthovita,malvern,pa.)。框架可以是天然和/或合成材料的混合物、共混物或复合材料。
[0139]
在另一个实施方案中,hsc可以接种到毡上或与毡接触,所述毡可以例如由多纤丝纱线组成,所述多纤丝纱线由诸如pga、pla、pcl共聚物或共混物或透明质酸的生物可吸收材料制成。
[0140]
在另一个实施方案中,hsc可以接种到可以是复合结构的泡沫支架上。这样的泡沫支架可以被模制成有用的形状,例如身体中待修复、替换或增强的特定结构的一部分的形状。在一些实施方案中,在接种本发明的细胞之前,例如用0.1m乙酸处理框架,然后在聚赖氨酸、pbs和/或胶原蛋白中孵育以增强细胞附着。可以修饰基质的外表面以改善细胞的附着或生长以及组织的分化,例如通过等离子体涂覆基质,或添加一种或多种蛋白质(例如,胶原蛋白、弹性纤维、网状纤维)、糖蛋白、糖胺聚糖(例如硫酸肝素、4
‑
硫酸软骨素、6
‑
硫酸软骨素、硫酸皮肤素、硫酸角蛋白等)、细胞基质和/或其他材料,例如但不限于明胶、藻酸盐、琼脂、琼脂糖和植物胶等。
[0141]
在一些实施方案中,支架包含使其不形成血栓的材料或用使其不形成血栓的材料处理支架。这些处理和材料还可以促进和维持内皮生长、迁移和细胞外基质沉积。这些材料和处理的实例包括但不限于天然材料,例如基底膜蛋白,例如层粘连蛋白和iv型胶原蛋白,合成材料,例如eptfe,以及分段聚氨酯脲硅氧烷,例如purspan.tm.(the polymer technology group,inc.,berkeley,calif.)。支架还可以包含抗血栓剂,例如肝素;在接种干细胞之前,也可以对支架进行处理以改变表面电荷(例如,用等离子体包被)。
[0142]
5.7hsc的保存
[0143]
可以保存hsc,即将其放置在允许长期储存的条件下,或通过例如细胞凋亡或坏死抑制细胞死亡的条件下。可以使用例如包含细胞凋亡抑制剂、坏死抑制剂的组合物来保存hsc。在一个实施方案中,本发明提供了一种保存干细胞群的方法,包括将所述干细胞群与包含细胞凋亡抑制剂的干细胞收集组合物接触,其中所述细胞凋亡抑制剂以与未与细胞凋亡抑制剂接触的干细胞群相比,足以减少或防止干细胞群的细胞凋亡的量和时间存在。在一个具体实施方案中,所述细胞凋亡抑制剂是胱天蛋白酶
‑
3抑制剂。在另一个具体的实施方案中,所述细胞凋亡抑制剂是jnk抑制剂。在一个更具体的实施方案中,所述jnk抑制剂不调节所述干细胞的分化或增殖。在另一个实施方案中,所述干细胞收集组合物包含在不同
相中的所述细胞凋亡抑制剂和所述携氧全氟化碳。在另一个实施方案中,所述干细胞收集组合物包含在乳液中的所述细胞凋亡抑制剂和所述携氧全氟化碳。在另一个实施方案中,所述干细胞收集组合物另外包含乳化剂,例如卵磷脂。在另一个实施方案中,所述细胞凋亡抑制剂和所述全氟化碳在接触干细胞时为约0℃至约25℃。在另一个更具体的实施方案中,所述细胞凋亡抑制剂和所述全氟化碳在接触干细胞时为约2℃至约10℃,或为约2℃至约5℃。在另一个更具体的实施方案中,所述接触在所述干细胞群的运输期间进行。在另一个更具体的实施方案中,所述接触在所述干细胞群的冷冻和解冻期间进行。
[0144]
在另一个实施方案中,本发明提供保存hsc群的方法,包括使所述干细胞群与细胞凋亡抑制剂和器官保存化合物接触,其中所述细胞凋亡抑制剂以与未与细胞凋亡抑制剂接触的干细胞群相比,足以减少或防止干细胞群的细胞凋亡的量和时间存在。
[0145]
通常,在hsc收集、富集和分离过程中,优选地最小化或消除因缺氧和机械应力引起的细胞应激。因此,在该方法的另一个实施方案中,干细胞或干细胞群在所述保存期间暴露于收集、富集或分离期间的缺氧条件少于六小时,其中缺氧条件是低于正常血氧浓度的氧浓度。在一个更具体的实施方案中,所述干细胞群在所述保存期间暴露于所述缺氧条件少于两小时。在另一个更具体的实施方案中,所述干细胞群在收集、富集或分离期间暴露于所述缺氧条件少于一小时或少于三十分钟,或不暴露于缺氧条件。在另一个具体实施方案中,所述干细胞群在收集、富集或分离期间不暴露于剪切应力。
[0146]
5.8冷冻保存的hsc
[0147]
可以将hscs冷冻保存,例如在小容器,例如安瓿中的冷冻保存介质中。合适的冷冻保存介质包括但不限于培养基,包括例如生长培养基,或细胞冷冻介质,例如市售细胞冷冻介质,例如c2695、c2639或c6039(sigma)。冷冻保存介质优选包含浓度为例如约5
‑
10%(v/v)的dmso(二甲基亚砜)。冷冻保存介质可以包含另外的试剂,例如甲基纤维素和/或甘油。在冷冻保存期间,hscs优选以大约1℃/min冷却。优选的冷冻保存温度为约
‑
80℃至约
‑
180℃,优选约
‑
125℃至约
‑
140℃。冷冻保存的细胞可以在解冻使用前转移到液氮中。在一些实施方案中,例如,一旦安瓿达到约
‑
90℃,它们就被转移到液氮储存区。冷冻保存的细胞优选在约25℃至约40℃的温度下,优选至约37℃的温度下解冻。
[0148]
可以保存本文公开的hsc,例如,冷冻保存以备随后使用。冷冻保存细胞例如干细胞的方法是本领域熟知的。hsc可以以易于向个体给药的形式制备。例如,本文提供了包含在适合用于医疗用途的容器内的hsc。这样的容器可以是例如无菌塑料袋、烧瓶、广口瓶或其他容器,hsc可以从所述容器中容易地被分配。例如,容器可以是血袋或其他适合用于向接受者静脉内给予液体的塑料的、医学上可接受的袋。容器优选地是允许组合的干细胞群冷冻保存的容器。冷冻保存的hsc可以包括源自单个供体或多个供体的hsc。hsc可以与预期接受者完全hla匹配,或部分或完全hla错配。
[0149]
在另一个具体实施方案中,容器是袋、烧瓶或广口瓶。在更具体的实施方案中,所述袋是无菌塑料袋。在一个更具体的实施方案中,所述袋适合用于、允许或有助于hsc的静脉内给药。袋可以包括多个内腔或隔室,所述内腔或隔室相互连接以允许在给药之前或期间混合hsc和一种或多种其他溶液,例如药物。在另一个具体实施方案中,组合物包含一种或多种有助于组合的干细胞群冷冻保存的化合物。在另一个具体实施方案中,所述hsc包含在生理学上可接受的水溶液中。在一个更具体的实施方案中,所述生理学上可接受的水溶
液是0.9%nacl溶液。在另一个具体实施方案中,所述hsc与所述干细胞群的接受者hla匹配。在另一个具体实施方案中,所述组合的干细胞群包含与所述干细胞群的接受者至少部分hla错配的hsc。
[0150]
5.9药物制剂
[0151]
如上所述,本发明的一个实施方案是一种药物组合物,其包含治疗有效量的人hsc和药学上可接受的载体。短语“药学上可接受的”是指这样的分子实体和组合物,其为生理上可耐受的,并且当给予人时,通常不产生过敏或类似的不良反应,例如胃部不适、头晕等,并且经联邦监管机构或州政府批准或在美国药典或其他普遍认可的用于动物,更具体地用于人的药典中列出的。“载体”是指与治疗剂一起给予的稀释剂、佐剂、赋形剂或溶媒。这样的药物载体可以是无菌液体,例如盐的水溶液和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当静脉内给予药物组合物时,盐水溶液是优选的载体。盐水溶液以及葡萄糖和甘油水溶液也可以用作液体载体,特别是用于注射液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。如果需要,该组合物还可以包含少量润湿剂或乳化剂,或ph缓冲剂。
[0152]
这些组合物可以采用溶液、混悬剂、乳剂、片剂、丸剂、胶囊、粉剂、缓释制剂、扁囊剂、糖锭剂、锭剂、分散剂、栓剂、软膏剂、巴布剂(泥敷剂)、糊剂、粉剂、敷料、乳膏剂、膏药、贴剂、气雾剂、凝胶剂、适合肠胃外给予患者的液体剂型以及可以重构以提供适合肠胃外给予患者的液体剂型的无菌固体(例如,结晶或无定形固体)的形式。这样的组合物将包含治疗有效量的化合物,优选纯化形式的化合物,连同合适形式的载体,以便于提供用于向患者适当给药的形式。制剂应适合给药方式。
[0153]
适用于经皮给药的药物组合物可以作为旨在与接受者的表皮在长时间段内保持密切接触的离散贴剂来提供。
[0154]
适用于鼻腔和肺部给药的药物组合物可以包含固体载体,例如可以通过穿过鼻子快速吸入给药的粉末。用于鼻腔给药的组合物可以包含液体载体,例如喷雾剂或滴剂。供选择地,可以通过深吸入或穿过吸嘴安装来实现直接穿过吸入肺部。这些组合物可以包含活性成分的水溶液或油溶液。用于吸入的组合物可以以专门适配的装置供应,包括但不限于加压喷雾器、雾化器或吹入器,其可以经构造以便提供预定剂量的活性成分。
[0155]
适用于肠胃外给药的药物组合物包括水性和非水性无菌注射液或混悬剂,其可以含有抗氧化剂、缓冲剂、抑菌剂和使组合物与受试者的血液基本等渗的溶质。可存在于这样的组合物中的其他组分包括水、醇、多元醇、甘油和植物油。适用于肠胃外给药的组合物可以存在于单位剂量或多剂量容器中,例如密封的安瓿和小瓶,并且可以在冷冻干燥(冻干)条件下储存,仅需要在使用前添加无菌载体。即用型注射液和混悬剂可以由无菌粉末、颗粒和片剂制备。可以用于提供本发明肠胃外剂型的合适溶媒是本领域技术人员熟知的。实例包括:注射用水usp;水性溶媒,例如氯化钠注射液、林格氏注射液、葡萄糖注射液、葡萄糖和氯化钠注射液和乳酸林格氏注射液;与水混溶的溶媒,例如乙醇、聚乙二醇和聚丙二醇;和非水性溶媒,例如玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。
[0156]
治疗有效剂量的选择将由本领域技术人员考虑本领域普通技术人员将已知的若
干因素来确定。这样的因素包括抑制剂的具体形式,及其药代动力学参数,如生物利用度、代谢和半衰期,所述药代动力学参数将在通常用于获得药物化合物监管批准的常规开发过程中建立。考虑剂量的其他因素包括要治疗的病症或疾病或在正常个体中获得的益处,患者的体重,给药途径,给药是急性还是慢性,伴随药物,以及其他熟知的影响给药的药剂功效的因素。因此,精确的剂量应根据本领域技术人员的判断和每个患者的情况,并根据标准的临床技术来决定。
[0157]
在某些实施方案中,用解热剂和/或抗组胺剂(对乙酰氨基酚和盐酸苯海拉明)治疗患者,以使在hsc治疗中与冷冻保存组分相关的任何可能的dmso输注毒性最小化。
[0158]
5.10分析
[0159]
可以将本文公开的转染的hsc用于分析中,以确定与未暴露于这样的条件的hsc相比,培养条件、环境因素、分子(例如,生物分子、无机小分子等)等对干细胞增殖、扩增和/或分化的影响。
[0160]
在一个优选的实施方案中,分析hsc在与分子接触时增殖、扩增或分化的改变。例如,在一个实施方案中,本发明提供了一种确定调节多个hsc增殖的化合物的方法,包括在允许增殖的条件下将所述多个hsc与所述化合物接触,其中如果与未与所述化合物接触的多个hsc相比,所述化合物引起所述hsc的增殖的可检测的变化,那么所述化合物被确定为调节hsc增殖的化合物。在一个具体实施方案中,所述化合物被确定为增殖抑制剂。在另一个具体实施方案中,所述化合物被确定为增殖增强剂。
[0161]
在另一个实施方案中,本发明提供了一种确定调节多个hsc扩增的化合物的方法,包括在允许扩增的条件下使所述多个hsc与所述化合物接触,其中如果与未与所述化合物接触的多个hsc相比,所述化合物引起所述多个hsc扩增的可检测变化,那么所述化合物被确定为调节hsc扩增的化合物。在一个具体实施方案中,所述化合物被确定为扩增抑制剂。在另一个具体实施方案中,所述化合物被确定为扩增增强剂。
[0162]
在另一个实施方案中,本文公开了一种确定调节hsc分化的化合物的方法,包括在允许分化的条件下使所述hsc与所述化合物接触,其中如果与未与所述化合物接触的hsc相比,所述化合物引起所述hsc分化的可检测变化,那么所述化合物被确定为调节hsc增殖的化合物。在一个具体实施方案中,所述化合物被确定为分化抑制剂。在另一个具体实施方案中,所述化合物被确定为分化增强剂。
[0163]
在一个实施方案中,hsc是使用本发明中的方法从受试者获得的。在一个实施方案中,受试者是患有特定疾病或障碍的患者。在一个实施方案中,hsc由t细胞制备。在一个实施方案中,ips由成纤维细胞制备。
[0164]
5.11mld的hsc基因治疗:临床检验
[0165]
本发明提供了一种用于临床检验mld的hsc基因治疗的方法。i期和ii期临床试验包括以下步骤:1.产生自体hsc。2.第三代lv编码arsa,包括自身失活ltr和内部pgk启动子。3.基于白消安的调理。hscgt的详细过程如图1所示。
6.实施例
[0166]
参考以下非限制性实施例可以更好地理解本发明,所述实施例是为了更全面地说明本发明的优选实施方案而提供的。它们决不应被解释为限制本发明的宽的范围。
[0167]
实施例6.1harsa
‑
lv的载体设计
[0168]
为了制备经设计用于lv
‑
arsa产生的载体,慢病毒质粒骨架ab.pccl.sin.cppt.u6mir
‑
10
‑
decoy.hpgk.gfp.wpre购自addgene(addgene质粒#46602;http://n2t.net/addgene:46602;rrid:addgene_46602)。用bsmbi去除u6
‑
mir
‑
10
‑
decoy并重新连接载体。然后用agei和sali去除gfp。(idf)
[0169]
sali
‑
wpre
‑
sacii通过pcr亚克隆到定点诱变(sdm)载体中。wpre通过将atg替换为agg进行突变;sdm载体现在是sali
‑
wpre
‑
突变的
‑
sacii。harsa cdna通过pcr亚克隆到sdm wpre.muta1中。sdm载体则是agei
‑
harsa
‑
sali
‑
wpre.mut1
‑
sacii。随后使用agei和sacii酶切将gfp.wpre盒替换为harsa.wpre.mut1盒。(idf)
[0170]
末端转基因载体在带有慢病毒质粒mdl/vsv.g的293ft细胞中增殖。
[0171]
质粒构建的示意性设计如图1所示。
[0172]
实施例6.2用于符合gmp要求的临床应用的lv
‑
arsa的大规模制备方案
[0173]
最佳转染条件是基于载体lv
‑
arsa:mld:与水泡性口炎g蛋白(vsv
‑
g)的比率设计的。通过将包装构建体、产生vsv
‑
g包膜的质粒、含有rev响应元件的质粒转染到293t细胞中,产生用vsv
‑
g蛋白假型化的lv,并制备了所述载体。为了产生高水平滴度的lv,核心质粒和包装质粒的比例为4:2:1:1,实现了高产量的lv。(zanta
‑
boussif,2009)
[0174]
对于大规模lv生产,使用不含抗生素的无血清或低血清(3%)293ft培养基。为了临床级lv生产的下游加工,开发了一种新配方以在
‑
80度下保存lv而不失去lv活性:0.5
‑
5%人白蛋白 1%肝素 0.9%nacl。(idf)
[0175]
实施例6.3将arsa
‑
lv转导到hsc中的方案
[0176]
根据以下方案用lv转导细胞。我们使用重组人纤连蛋白片段(retronectin)包被分析法用于lv附着和lv在介质中的悬浮,以实现高产率hsc感染。retronectin试剂显著提高了通过逆转录病毒载体将基因转导到造血干细胞中的效率(hanenberg等人.1996)。包被两小时后,从培养瓶(culture flank)去除病毒,将人hsc以5x10^6/ml的浓度转移到lv病毒包被的培养板中。六小时后,收集细胞用于arsa表达。使用免疫印迹和qpcr来评价感染效率。arsa表达应在lv转导后显著提高。
[0177]
实施例6.4保持和培养具有干细胞多能性的hsc的体外介质
[0178]
为了增强hsc多能性和对lv感染的敏感性,在包含tpo、scf、flt3、il
‑
3因子和抑制mtor和rock的激酶抑制剂的介质中培养hsc。详细配方(receipt)为:x
‑
vivo培养基(sigma)500ml;tpo,5
‑
50ng/ml;scf,5
‑
50ng/ml;flt3,5
‑
50ng/ml;il
‑
3,10
‑
50ng/ml;鱼精蛋白,2ug/ml。参见表1。
[0179]
实施例6.4.1干细胞的冷冻保存介质
[0180]
用于干细胞冷冻保存的介质包含cp1、葡萄糖、白蛋白2
‑
20%(cp1 30%,葡萄糖,70mg/l,0.9%nacl%。参见表1。
[0181][0182][0183]
表1.介质成分
[0184]
实施例6.5移植过程
[0185]
收集一批造血干细胞备用。然后,收集另一批患者的hsc,并用慢病毒介导的arsa功能基因转导。将基因校正的hsc冷冻,并检查样品以确保它们具有功能且arsa酶活性升高,没有其他污染物。最后,按照调理方案,将基因校正的细胞重新输给患者。干细胞可以在基因修饰后立即移植到患者。供选择地,在将细胞移植到患者之前,可以冷冻基因修饰的干细胞并进行一系列质量控制检查。这允许更多的时间检查干细胞和基因功能的关键参数,因此降低移植失败或严重并发症的风险。患者的血液系统完全植入,移植后检测到高水平的arsa酶。移植后40个月,患者状况保持稳定,康复进展令人满意。
[0186]
实施例6.6移植后运动能力的改善
[0187]
从2012年到2014年,由于其认知和运动退化,患者不得不每月住院两周。2014年9月,患者成功地完成了化学调理和移植。2015年,患者在移植后表现出改善的运动能力和平衡能力。
[0188]
患者在其13岁时患有嗜睡,记忆力、运动能力、书写和语言下降。她因注意力缺陷障碍被误诊和治疗超过2年。15岁时,她最终被诊断出患有mld,通过arsa基因突变而arsa活
性低、mri成像和临床症状证实。支持治疗未阻止疾病的进展。在进行干细胞基因移植之前,她无法步行上下楼梯,无法管理个人卫生,并经历癫痫发作、严重便秘和偶尔尿失禁。17岁时进行造血干细胞基因移植。早期结果表明疾病稳定。她的运动能力和平衡能力、卫生管理能力和书写能力都有所改善,便秘和泌尿问题已经解决,没有癫痫发作的记录。
[0189]
实施例6.7载体拷贝数
[0190]
表2显示了载体拷贝数。
[0191][0192]
实施例6.8临床方案和患者
[0193]
来自深圳大学第一附属医院(深圳市第二人民医院)的有症状的mld患者参加临床试验。评价了慢病毒造血干细胞基因治疗mld的安全性和有效性。
[0194]
<纳入标准>
[0195]
mld纳入标准:1.通过arsa基因诊断确诊为mld;mri成像和低arsa a活性(低于20%或正常水平)。患者的症状和病变尚未发展到mld末期。
[0196]
<排除标准>
[0197]
mld排除标准:1.无mld的临床症状;2.arsa活性>健康对照的50%;3.mld末期;4.其他并发症,即癌症;5.hiv rna和/或hcv rna和/或hbv dna阳性患者;6.经受同种异体造血干细胞移植并有供体来源的残留细胞迹象的患者。两个干预组的样本大小均为16。对于第一个干预组,给予患者慢病毒造血干细胞基因治疗。对于对照组,不给予基因治疗。测量神经评分和arsa活性(mld)。从患者采集血样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

