抗埃博拉病毒单克隆抗体、其制备方法及用途
1.本技术是申请日为2017年03月10日、申请号为cn201710141834.8、发明名称为“抗埃博拉病毒单克隆抗体、其制备方法及用途”的中国专利申请的分案申请。
技术领域
2.本发明属于免疫学、分子生物学领域,涉及一种抗埃博拉病毒的单克隆抗体、其制备方法及用途。
背景技术:
3.埃博拉(ebola virus)又译作伊波拉病毒,是一种十分罕见的病毒,1976年在苏丹南部和刚果(金)(旧称扎伊尔)的埃博拉河地区被发现后,引起医学界的广泛关注和重视,“埃博拉”由此而得名。埃博拉病毒是一种能引起人类和灵长类动物产生埃博拉出血热的烈性传染病病毒,生物安全等级为4级(艾滋病为3级,sars为3级,级数越大防护越严格);埃博拉病毒主要是通过病人的血液、唾液、汗水和分泌物等途径传播,病毒潜伏期可达2至21天,但通常只有5天至10天左右;病毒感染患者死亡率在50%至90%之间;致死原因主要为中风、心肌梗塞、低血容量休克或多发性器官衰竭。2014年西非埃博拉疫情爆发以来,截至2014年12月02日,世界卫生组织关于埃博拉疫情报告称,几内亚、利比里亚、塞拉利昂、马里、美国以及已结束疫情的尼日利亚、塞内加尔与西班牙累计出现埃博拉确诊、疑似和可能感染病例17290例,其中6128人死亡。
4.针对埃博拉出血热,目前尚无批准上市的特异性预防和和治疗药物。根据我国卫生和计划生育委员会发布的《埃博拉出血热防控方案(第二版)》,严格隔离控制传染源、密切接触者追踪、管理和加强个人防护是防控埃博拉出血热的关键措施。thomson reuters(汤森路透)对埃博拉出血热预防和治疗药物研发整体态势分析结果显示:疫苗、中和抗体、小分子抗病毒药物、rna干扰药物和核苷酸类药物是抗埃博拉病毒的5个重要研究方向,但目前均处于研究阶段。
5.由于缺乏可用疫苗,感染埃博拉病毒后的治疗显得更为重要。中和抗体、小分子抗病毒药物、rna干扰药物和核苷酸类药物是埃博拉病毒治疗性药物研究重点。
6.美国mapp公司与加拿大defrus公司联合研制的zmapp抗体是一种在烟草表达系统生产的抗埃博拉病毒实验性治疗药物,由c2g4、c4g7和c13c6三个嵌合抗体组成,分别识别埃博拉病毒表面糖蛋白(glycoprotein,gp)的gp2、gp1
‑
c、sgp结构域,通过阻断埃博拉病毒表面抗原gp与宿主细胞表面受体相互作用以及介导adcc等免疫效应发挥抗病毒机制。非人灵长类动物感染模型研究结果显示,zmapp抗体具有良好的中和埃博拉病毒活性。2014年西非埃博拉疫情爆发以来,基于“同情性用药”原则在紧急状态下被批准用于埃博拉出血热患者的治疗;目前已有9名患者接受此治疗,6名患者获得较好疗效、2名患者因为年龄偏大及用药时间晚等原因死亡、1名患者在治愈后复发。zmapp抗体临床给药方案、安全性等问题还有待进一步观察。
7.目前我国尚无有效的应对埃博拉病毒感染患者的治疗措施。然而,近2万名中国公
民在非洲疫区工作和生活、中非有大量的商务贸易往来等客观因素为我国防控埃博拉疫情带来巨大的挑战。中国cdc以及我军派遣的援非医疗队在疫区一线工作,直接面对埃博拉患者,成为埃博拉出血热感染的高危人群。因此,研制具有更好抗病毒效果的抗体药物迫在眉睫。
技术实现要素:
8.本发明的目的是通过去除岩藻糖糖基化技术大大提高抗埃博拉病毒蛋白抗体的adcc(抗体依赖细胞介导的细胞毒性)活性。具体地,本发明包括以下几个方面:
9.本发明第一方面涉及抗埃博拉病毒糖蛋白(glycoprotein,gp)单克隆抗体或其抗原结合部分,其轻链和重链可变区的氨基酸序列选自如下所示的(1)-(3)中的一组:
10.(1)轻链可变区的氨基酸序列如seq id no:4所示,重链可变区的氨基酸序列如seq id no:6所示;
11.(2)轻链可变区的氨基酸序列如seq id no:10所示,重链可变区的氨基酸序列如seq id no:12所示;
12.(3)轻链可变区的氨基酸序列如seq id no:16所示,重链可变区的氨基酸序列如seq id no:18所示。
13.diqmtqspaslsvsvgetvsitcraseniysslawyqqkqgkspqllvysatiladgvpsrfsgsgsgtqyslkinslqsedfgtyycqhfwgtpytfgggtkleik(seq id no:4)
14.evaleesggglmqpggsmklscvasgftfsnywmnwvrqspekglewvaeirlksnnyathyaesvkgrftisrddskrsvylqmntlraedtgiyyctrgngnyramdywgqgtsvtvss(seq id no:6)
15.diqmtqspaslsasvgetvtitcraseniysylawyqqkqgkspqllvynaktliegvpsrfsgsgsgtqfslkinslqpedfgsyfcqhhfgtpftfgsgteleik(seq id no:10)
16.evqlqesgpelempgasvkisckasgssftgfsmnwvkqsngkslewignidtyyggttynqkfkgkatltvdkssstaymqlksltsedsavyycarsayygstfaywgqgtlvtvsa(seq id no:12)
17.divmtqsqkfmstsvgdrvsltckasqnvgtavawyqqkpgqspklliysasnrytgvpdrftgsgsgtdftltisnmqsedladyfcqqyssypltfgagtklelr(seq id no:16)
18.qltlkesgpgilkpsqtlsltcslsgfslstsgvgvgwfrqpsgkglewlaliwwdddkyynpslksqlsiskdfsrnqvflkisnvdiadtatyycarrdpfgydnamgywgqgtsvtvss(seq id no:18)
19.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的重链恒定区选自来源于人的igg、igm、ige、igd和iga。
20.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的重链恒定区选自来源于人的igg1、igg2、igg3和igg4。
21.在本发明的一个具体实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的重链恒定区来源于人的igg1。
22.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的轻链恒定区来源于人的κ或λ。
23.在本发明的一个具体实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的轻链恒定区来源于人的κ。
24.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分为
全抗体、双特异性抗体、scfv、fab、fab'、f(ab')2或fv。
25.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体的轻链氨基酸序列如seq id no:3所示,重链氨基酸序列如seq id no:5所示。
26.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体的轻链氨基酸序列如seq id no:9所示,重链氨基酸序列如seq id no:11所示。
27.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体的轻链氨基酸序列如seq id no:15所示,重链氨基酸序列如seq id no:17所示。
28.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分为抗体mil77
‑
1或其抗原结合部分。
29.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分为抗体mil77
‑
2或其抗原结合部分。
30.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分为抗体mil77
‑
3或其抗原结合部分。
31.在本发明的一个实施方案中,所述抗埃博拉病毒单克隆抗体或其抗原结合部分的岩藻糖的含量占总含糖量的5%以下,例如2.5%以下,例如1.8%以下,例如1.0%以下,例如0.5%以下。
32.本发明还涉及核酸分子,其含有编码本发明第一方面任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分的序列。
33.在本发明的一个实施方案中,所述核酸分子含有seq id no:19所示的序列,和/或seq id no:20所示的序列。
34.在本发明的一个实施方案中,所述核酸分子含有seq id no:21所示的序列,和/或seq id no:22所示的序列。
35.在本发明的一个实施方案中,所述核酸分子含有seq id no:23所示的序列,和/或seq id no:24所示的序列。
36.在本发明的一个实施方案中,所述核酸分子含有seq id no:1所示的序列,和/或seq id no:2所示的序列。
37.在本发明的一个实施方案中,所述核酸分子含有seq id no:7所示的序列,和/或seq id no:8所示的序列。
38.在本发明的一个实施方案中,所述核酸分子含有seq id no:13所示的序列,和/或seq id no:14所示的序列。
39.本发明还涉及重组载体,其含有本发明任一项的核酸分子。
40.在本发明中,所述载体可以为克隆载体或表达载体。所述载体含有本发明任一项所述的核酸分子,所述载体可以通过例如将上述核酸分子插入克隆载体或表达载体而得到,或者可以通过人工合成得到。
41.在本发明中,所述表达载体例如为原核表达载体,真核表达载体,噬菌体载体或病毒载体。其中所述原核表达载体例如为pet载体、pgex载体,所述真核表达载体例如为pcdna3.1、pegfp
‑
c1、ppic9k,所述噬菌体载体例如为λ噬菌体载体λgt、λgt
‑
λb,所述病毒载体例如为逆转录病毒、慢病毒、腺病毒或腺相关病毒载体。
42.在本发明的一个实施方案中,所述载体为真核表达载体ptgs
‑
frt
‑
dhfr。
43.在本发明的一个实施方案中,将真核表达载体ptgs
‑
frt
‑
dhfr做了进一步改造。在本发明的一个实施方案中,所述改造方法为去除潮霉素选择标签,并加入谷氨酰胺合成酶表达盒子。在本发明的具体实施方案中,所述表达载体为载体gs。
44.本发明还涉及重组细胞,其含有本发明任一项的重组载体。
45.在本发明的一个实施方案中,所述细胞为哺乳动物细胞,所述哺乳动物细胞为适合表达抗体的细胞,例如为来源于人、鼠或猴的哺乳动物细胞。在本发明的具体实施方案中,所述哺乳动物细胞为cho细胞,例如为cho-k1细胞;
46.在本发明的一个实施方案中,所述哺乳动物细胞对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能,例如通过完全或部分抑制岩藻糖修饰途径中相关蛋白的功能来实现。在本发明的一个实施方案中,所述哺乳动物细胞为岩藻糖修饰途径相关基因敲除的细胞。
47.在本发明的具体实施方案中,其中所述岩藻糖修饰途径相关基因为gft基因。
48.在本发明的具体实施方案中,通过敲除哺乳动物细胞的gft基因获得了对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能的细胞;具体地,针对gft基因slc35c1的序列(编号genbank:bae16173.1)优化设计了两个gft zinc
‑
finger nuclease锌指酶序列g1f1、g2f2,进而达到基因敲除的目的。
49.在本发明的具体实施方案中,所述对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能的哺乳动物细胞是经过目标培养基驯化后的细胞。
50.在本发明的实施方案中,所述目标培养基是指无血清、化学成分确定的动物细胞培养基。
51.在本发明的实施方案中,所述目标培养基中含有pluronic f
‑
68、葡萄糖、培养基干粉maxgrow 202、碳酸氢钠、氯化钠和hepes;
52.在本发明的具体实施方案中,所述目标培养基的成分为pluronic f
‑
68 1.0g/l、葡萄糖8.8g/l、培养基干粉maxgrow 202 7.44g/l、碳酸氢钠1.98g/l、氯化钠3.47g/l和1mhepes 15ml/l,并调节ph至7.0
±
0.1。在本发明的具体实施方案中,所述目标培养基用于细胞驯化和种子培养。在本发明的具体实施方案中,所述目标培养基为表1
‑
1的种子培养基。
53.在本发明的实施方案中,所述驯化培养的方法为本领域所公知,例如先将细胞在含有10%小牛血清的目标培养基中贴壁培养,按照50%的比例逐级去除血清,例如小牛血清浓度从10%逐级降至5%、2.5%、1.25%、直至完全不含血清,然后继续传代数次,至宿主细胞完全悬浮,成倍增长稳定,最终获得能够在目标培养基中生长的稳定宿主细胞。
54.本发明还涉及组合物,其含有本发明任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分、本发明任一项的核酸分子、本发明任一项的重组载体或者本发明任一项的重组细胞,以及任选的药学上可接受的载体或赋形剂。
55.本发明还涉及本发明任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分的制备方法,其包括使用本发明任一项的核酸分子、本发明任一项的重组载体或者本发明任一项的重组细胞的步骤。
56.在本发明的一个实施方案中,其具体包括以下步骤:
57.1)将本发明任一项的核酸分子的核苷酸序列克隆入表达载体中,得到重组表达载
体;
58.2)将重组表达载体转入宿主细胞,得到重组细胞;
59.3)将步骤2)获得的重组细胞在目标培养基中进行培养,获得能够表达抗体的细胞株;
60.4)逐步放大培养步骤3)获得的细胞株,收获培养上清;
61.5)将步骤4)获得的培养上清进行纯化获得本发明任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分。
62.在本发明的一个实施方案中,所述细胞为哺乳动物细胞,所述哺乳动物细胞为适合表达抗体的细胞,例如为来源于人、鼠或猴的哺乳动物细胞。在本发明的具体实施方案中,所述哺乳动物细胞为cho细胞,例如为cho-k1细胞;
63.在本发明的一个实施方案中,所述哺乳动物细胞对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能,例如通过完全或部分抑制岩藻糖修饰途径中相关蛋白的功能来实现。在本发明的一个实施方案中,所述哺乳动物细胞为岩藻糖修饰途径相关基因敲除的细胞。
64.在本发明的具体实施方案中,其中所述岩藻糖修饰途径相关基因为gft基因。
65.在本发明的具体实施方案中,通过敲除哺乳动物细胞的gft基因获得了对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能的细胞;具体地,针对gft基因slc35c1的序列(编号genbank:bae16173.1)优化设计了两个gft zinc
‑
finger nuclease锌指酶序列g1f1、g2f2,进而达到基因敲除的目的。在本发明的具体实施方案中,所述gft基因敲除的细胞为chok1
‑
af。
66.在本发明的一个实施方案中,所述重组表达载体是在载体ptgs
‑
frt
‑
dhfr的基础上改造获得,优选地,所述改造是指去除潮霉素选择标签,并加入谷氨酰胺合成酶表达盒子。
67.在本发明的实施方案中,所述重组表达载体是gs载体。
68.在本发明中,所述目标培养基是适合哺乳动物细胞生长、适合抗体表达的培养基,其为本领域所公知,优选为无血清培养基。在本发明的实施方案中,所述步骤3)中的目标培养基是指无血清、化学成分确定的动物细胞培养基。
69.在本发明的实施方案中,所述目标培养基中含有pluronic f
‑
68、葡萄糖、培养基干粉maxgrow 202、碳酸氢钠、氯化钠和hepes;
70.在本发明的具体实施方案中,所述目标培养基的成分为pluronic f
‑
68 1.0g/l、葡萄糖8.8g/l、培养基干粉maxgrow 202 7.44g/l、碳酸氢钠1.898g/l、氯化钠3.47g/l和1mhepes 15ml/l,并调节ph至7.0
±
0.1。在本发明的具体实施方案中,所述目标培养基用于细胞驯化和种子培养。在本发明的具体实施方案中,所述目标培养基为表1
‑
1的种子培养基。
71.在本发明的实施方案中,所述驯化培养的方法为本领域所公知,例如先将细胞在含有10%小牛血清的目标培养基中贴壁培养,按照50%的比例逐级去除血清,例如小牛血清浓度从10%逐级降至5%、2.5%、1.25%、直至完全不含血清,然后继续传代数次,至宿主细胞完全悬浮,成倍增长稳定,最终获得能够在目标培养基中生长的稳定宿主细胞。
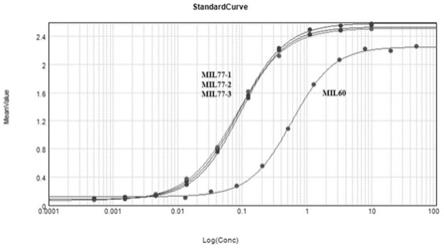
72.在本发明的实施方案中,步骤3)的具体方法为:将步骤2)获得的重组宿主细胞在
目标培养基中进行培养,向培养基中加入适当浓度的msx(例如50μm msx),在培养箱中培养一段时间,挑选出可以在此培养基中存活并表达抗体的细胞,然后进行亚克隆筛选,获得能够高效表达抗体的单克隆细胞株。
73.在本发明的实施方案中,步骤4)的具体方法为:将能够高效表达抗体的单克隆细胞株经过目标培养基多步扩大培养,培养基为生产培养基:种子培养基为1:1,培养周期为12
‑
14天,培养第3、6、9天加入10%体积的流加培养基,培养结束后收获上清。
74.在本发明的具体实施方案中,所述种子培养基即为目标培养基。
75.在本发明的实施方案中,所述生产培养基中含有氢氧化钠、培养基干粉maxpro 302、维生素b12、硫酸亚铁、磷酸二氢钠一水合物、葡萄糖、l
‑
半胱氨酸盐酸盐一水合物、pluronic f
‑
68、氯化钠、hcl、碳酸氢钠和hepes。
76.在本发明的具体实施方案中,所述生产培养基中含有氢氧化钠0.8g/l、培养基干粉maxpro 302 11.5g/l、1g/l维生素b12贮存液(1
‑
2)ml/l、10g/l硫酸亚铁贮存液(0.4
‑
0.6)ml/l、磷酸二氢钠一水合物0.35g/l、葡萄糖8.8g/l、l
‑
半胱氨酸盐酸盐一水合物(0.3
‑
0.375)g/l、pluronic f
‑
68 1g/l、氯化钠1.55g/l、5m hcl 5.6ml/l、碳酸氢钠1.22g/l和1m hepes 7.5ml/l,并调节ph至7.0
±
0.1。在本发明的具体实施方案中,所述生产培养基用于抗体生产。在本发明的具体实施方案中,所述生产培养基为表1
‑
2的生产培养基。
77.在本发明的实施方案中,所述流加培养基中含有氢氧化钠、无水磷酸氢二钠、流加培养基干粉maxfeed 402、l
‑
酪氨酸二钠盐二水物、l
‑
半胱氨酸盐酸盐一水物、天冬酰胺、葡萄糖、维生素b12、硫酸亚铁、pluronic f
‑
68、氯化钠、hcl、碳酸氢钠。
78.在本发明的具体实施方案中,所述流加培养基中含有5m氢氧化钠7.325ml、无水磷酸氢二钠3.09g/l、流加培养基干粉maxfeed 402 39.03g/l、50g/l l
‑
酪氨酸二钠盐二水物23.8ml、50g/l l
‑
半胱氨酸盐酸盐一水物23.2ml、葡萄糖50g/l、1.75g/l维生素b12贮存液0.3ml/l、5g/l七水硫酸亚铁贮存液0.3ml/l、pluronic f
‑
68 0.3g/l、氯化钠0.24g/l和碳酸氢钠0.366g/l。在本发明的具体实施方案中,所述流加培养基用于流加培养。在本发明的具体实施方案中,所述流加培养基为表1
‑
3的流加培养基。
79.在本发明的实施方案中,所述步骤5)的纯化依次包括亲和层析、阴离子交换层析和阳离子交换层析。
80.在本发明的具体实施方案中,所述步骤5)的纯化步骤具体包括:首先收集过蛋白a亲和层析柱ph在3.4
‑
3.6范围(用280nm进行监测)的洗脱液,调ph值至7~9,上样到阴离子交换层析柱,280nm进行监控和收集样品,将收集液ph值调节至5~7,上样到阳离子交换层析柱,收集样品,超滤浓缩后获得抗埃博拉病毒糖蛋白人源化单克隆抗体。
81.在本发明的实施方案中,所述蛋白a亲和层析柱选自mabselect sure、prosep ultra plus、prosep va ultra、mabcapture a或具有类似功能的蛋白a亲和层析介质。
82.在本发明的实施方案中,所述阴离子交换层析柱选自q sepharose ff、fractogel tmae、poros hq、captol q或具有类似功能的阴离子交换层析介质。
83.在本发明的实施方案中,所述阳离子交换层析柱选自poros hs、poros xs、sp sepharose ff、fractogel so3‑
、fractogel sh hicap或具有类似功能的阳离子交换层析介质。
84.本发明还涉及本发明任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分、任一
项的核酸分子、任一项的重组载体或者任一项的重组细胞用于制备预防或治疗埃博拉出血热的药物的用途。
85.本发明还涉及本发明任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分、任一项的核酸分子、任一项的重组载体或者任一项的重组细胞用于制备抗埃博拉病毒的药物的用途。
86.以下对本发明做进一步描述:
87.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
88.在本发明中,术语“抗体”是指通常由两对相同的多肽链(每对具有一条“轻”(l)链和一条“重”(h)链)组成的免疫球蛋白分子。抗体轻链可分类为κ和λ轻链。重链可分类为μ、δ、γ、α或ε,并且分别将抗体的同种型定义为igm、igd、igg、iga和ige。在轻链和重链内,可变区和恒定区通过大约12或更多个氨基酸的“j”区连接,重链还包含大约3个或更多个氨基酸的“d”区。各重链由重链可变区(v
h
)和重链恒定区(c
h
)组成。重链恒定区由3个结构域(c
h
1、c
h
2和c
h
3)组成。各轻链由轻链可变区(v
l
)和轻链恒定区(c
l
)组成。轻链恒定区由一个结构域c
l
组成。抗体的恒定区可介导免疫球蛋白与宿主组织或因子,包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)的结合。v
h
和v
l
区还可被细分为具有高变性的区域(称为互补决定区(cdr)),其间散布有较保守的称为构架区(fr)的区域。各v
h
和v
l
由按下列顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4从氨基末端至羧基末端排列的3个cdr和4个fr组成。各重链/轻链对的可变区(v
h
和v
l
)分别形成抗体结合部位。氨基酸至各区域或结构域的分配遵循kabat sequences of proteins of immunological interest(national institutes of health,bethesda,md.(1987and 1991)),或chothia&lesk(1987)j.mol.biol.196:901
‑
917;chothia等人(1989)nature 342:878
‑
883的定义。术语“抗体”不受任何特定的产生抗体的方法限制。例如,其包括,特别地,重组抗体、单克隆抗体和多克隆抗体。抗体可以是不同同种型的抗体,例如,igg(例如,igg1,igg2,igg3或igg4亚型),iga1,iga2,igd,ige或igm抗体。
89.在本发明中,术语抗体的“抗原结合部分”是指全长抗体的一个或多个部分,所述部分保持结合抗体所结合的相同抗原(例如,pcsk9)的能力,与完整抗体竞争对抗原的特异性结合。通常参见,fundamental immunology,ch.7(paul,w.,ed.,第2版,raven press,n.y.(1989),其以其全文通过引用合并入本文,用于所有目的。可通过重组dna技术或通过完整抗体的酶促或化学断裂产生抗原结合部分。在一些情况下,抗原结合部分包括fab、fab'、f(ab')2、fd、fv、dab和互补决定区(cdr)片段、单链抗体(例如,scfv)、嵌合抗体、双抗体(diabody)和这样的多肽,其包含足以赋予多肽特异性抗原结合能力的抗体的至少一部分。
90.在本发明中,术语“fd片段”意指由v
h
和c
h
1结构域组成的抗体片段;术语“fv片段”意指由抗体的单臂的v
l
和v
h
结构域组成的抗体片段;术语“dab片段”意指由v
h
结构域组成的抗体片段(ward等人,nature341:544
‑
546(1989));术语“fab片段”意指由v
l
、v
h
、c
l
和c
h
1结构域组成的抗体片段;术语“f(ab')2片段”意指包含通过铰链区上的二硫桥连接的两个fab
片段的抗体片段。
91.在一些情况下,抗体的抗原结合部分是单链抗体(例如,scfv),其中v
l
和v
h
结构域通过使其能够产生为单个多肽链的连接体配对形成单价分子(参见,例如,bird等人,science 242:423
‑
426(1988)和huston等人,proc.natl.acad.sci.usa 85:5879
‑
5883(1988))。此类scfv分子可具有一般结构:nh2‑
v
l
‑
接头
‑
v
h
‑
cooh或nh2‑
v
h
‑
接头
‑
v
l
‑
cooh。合适的现有技术接头(连接肽)由重复的ggggs氨基酸序列或其变体组成。例如,可使用具有氨基酸序列(ggggs)4的接头,但也可使用其变体(holliger等人(1993),proc.natl.acad.sci.usa 90:6444
‑
6448)。可用于本发明的其他接头由alfthan等人(1995),protein eng.8:725
‑
731,choi等人(2001),eur.j.immunol.31:94
‑
106,hu等人(1996),cancer res.56:3055
‑
3061,kipriyanov等人(1999),j.mol.biol.293:41
‑
56和roovers等人(2001),cancer immunol.描述。在本发明的实施方案中,所述连接肽的序列为(ggggs)3。
92.在一些情况下,抗体是双特异性抗体,其能够分别和两种抗原或抗原表位结合,其包括特异性结合第一抗原的抗体的轻链、重链或其抗原结合部分,以及特异性结合第二抗原的抗体的轻链、重链或其抗原结合部分。在本发明的实施方案中,所述双特异性抗体中结合第一抗原的抗体的轻链、重链或其抗原结合部分可以为本发明任一项的抗体或其抗原结合部分,所述特异性结合第二抗原的抗体的轻链、重链或其抗原结合部分可以为其它抗egfr抗体或其抗原结合部分或者针对其它抗原的抗体或其抗原结合部分。
93.在一些情况下,抗体是双抗体,即,双价抗体,其中v
h
和v
l
结构域在单个多肽链上表达,但使用太短的连接体以致不允许在相同链的两个结构域之间配对,从而迫使结构域与另一条链的互补结构域配对并且产生两个抗原结合部位(参见,例如,holliger p.等人,proc.natl.acad.sci.usa 90:6444
‑
6448(1993),和poljak r.j.等人,structure 2:1121
‑
1123(1994))。
94.可使用本领域技术人员已知的常规技术(例如,重组dna技术或酶促或化学断裂法)从给定的抗体(例如单克隆抗体2e12)获得抗体的抗原结合部分(例如,上述抗体片段),并且以与对于完整抗体的方式相同的方式就特异性筛选抗体的抗原结合部分。
95.在本发明中,所述抗原结合部分包括单链抗体(scfv)、嵌合抗体、双抗体、scfv
‑
fc二价分子、dab和互补决定区(cdr)片段、fab片段、fd片段、fab'片段、fv和f(ab')2片段。
96.在本发明中,所述λ轻链恒定区包括各种同种异型,如λⅰ、λⅱ、λⅲ、λ
ⅵ
。在本发明的的实施方案中,所述λ轻链恒定区为λⅱ型。
97.本发明涉及的抗体核酸分子也可以利用传统的基因工程重组技术或化学合成方法获得。一方面,本发明涉及的抗体核酸分子的序列包含了抗egfr抗体的重链可变区或抗体分子的部分核酸序列。另一方面,本发明涉及的抗体核酸分子的序列也包括抗埃博拉病毒蛋白抗体的轻链可变区或抗体分子的部分核酸序列。另一方面,本发明涉及的抗体核酸分子的序列还包括重链或轻链可变区的cdr序列。互补决定区(complementary determinant region,cdr)是与抗原表位结合的部位,本发明中的cdr序列通过imgt/v
‑
quest(http://imgt.cines.fr/textes/vquest/)进行确定。但是不同的划分方法得到的cdr序列稍有不同。
98.本发明涉及含有所述核酸分子的重组表达载体,也涉及转化了这些分子的宿主细
胞。而且,本发明还涉及利用包含了所述核酸分子的宿主细胞在特定条件下培养并分离得到发明所述抗体的方法。
99.在本发明中,术语“载体”指的是,可将编码某蛋白的多聚核苷酸插入其中并使蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内表达得以表达。举例来说,载体包括:质粒;噬菌粒;柯斯质粒;人工染色体如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。用作载体的动物病毒种类有逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可能含有多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。载体还有可能包括有协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。
100.在本发明中,术语“宿主细胞”指的是导入载体的细胞,包括如下许多细胞类型,如大肠杆菌或枯草菌等原核细胞,如酵母细胞或曲霉菌等真菌细胞,如s2果蝇细胞或sf9等昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞的动物细胞。
101.本发明的抗体片段可以利用水解完整的抗体分子获得(参见morimoto et al.,j.biochem.biophys.methods 24:107
‑
117(1992)and brennan et al.,science 229:81(1985))。另外,这些抗体片段也可以直接由重组宿主细胞产生(reviewed in hudson,curr.opin.immunol.11:548
‑
557(1999);little et al.,immunol.today,21:364
‑
370(2000))。比如,fab'片段可以直接从e.coli细胞中获得或化学藕联形成f(ab')2片段(carter et al.,bio/technology,10:163
‑
167(1992))。再如,f(ab')2片段可以用亮氨酸拉链gcn4连接获得。另外,fv、fab或f(ab')2片段也可以直接从重组宿主细胞培养液中直接分离得到。本领域的普通技术人员完全知晓制备抗体片段的其它技术。
102.在本发明中,“特异性结合”指的是,指两分子间的非随机结合反应,如抗体和产生该抗体的抗原间的反应。此处,结合第一种抗原的抗体对第二种抗原的结合亲和力是检测不到或很弱。在某些实施方式中,一个某抗原特异性抗体是指以亲和力(kd)≤10
‑5m(如10
‑6m、10
‑7m、10
‑8m、10
‑9m、10
‑
10
m等)结合该抗原,其中kd指解离率与结合率的比值(koff/kon),其可以采用本领域技术人员熟悉的方法进行测定。
103.在本发明中,所述adcc活性是指表达igg fc受体的nk细胞、巨噬细胞和中性粒细胞等效应细胞,通过与已结合在病毒感染细胞和肿瘤细胞等靶细胞表面的igg抗体的fc段结合,而杀伤这些靶细胞的作用。
104.在本发明中,所述对细胞的驯化培养是指使细胞能够在新培养基中生长繁殖的过程。
105.在本发明中,所述的抗埃博拉病毒单克隆抗体主要识别埃博拉病毒表面的糖蛋白gp(glycoprotein)。在本发明的实施方案中,所述mil77
‑
1、mil77
‑
2、mil77
‑
3分别识别糖蛋白的gp2、gp1
‑
c端和sgp结构域。
106.在本发明中,所述埃博拉病毒表面的糖蛋白gp(glycoprotein)也叫包膜糖蛋白,是埃博拉病毒的关键组成部分,在病毒侵入宿主及发挥毒性作用中起关键性作用。gp含有
gp1和gp2两个亚单位,其中gp1亚基含有粘蛋白结构域(mucin
‑
like domain),该结构域被认为与埃博拉病毒的毒性相关。gp在病毒表面可形成三聚体。sgp是gp早期大量表达的产物。
107.在本发明中,20种常规氨基酸和其缩写遵从常规用法。参见immunology
‑
a synthesis(第2版,e.s.golub和d.r.gren,eds.,sinauer associates,sunderland,mass.(1991)),其通过引用合并入本文。
108.在本发明中,如未特别指明,则百分比(%)是指重量百分比。
109.发明的有益效果
110.本发明通过去除岩藻糖修饰技术获得了性质更均一、几乎或完全不含有岩藻糖修饰的抗埃博拉病毒单克隆抗体,该抗体具有更高的adcc活性,以及良好的抗原结合活性和病毒中和活性,因而具有更好的临床应用前景。
附图说明
111.图1:pcr扩增mil77
‑
1/vh、mil77
‑
1/vκ、mil77
‑
2/vh、mil77
‑
2/vκ、mil77
‑
3/vh、mil77
‑
3/vκ基因片段的琼脂糖电泳结果;其中:
112.1:mil77
‑1‑
vh;2:mil77
‑2‑
vh;3:mil77
‑3‑
vh;m:dl2,000dna marker;4:mil77
‑1‑
vl;5:mil77
‑2‑
vl;6:mil77
‑3–
vl。
113.图2a:流式细胞术检测cho
‑
k1细胞表面岩藻糖的表达水平。
114.图2b:流式细胞术检测基因敲除后cho
‑
k1细胞表面岩藻糖的表达水平。
115.图3:宿主细胞驯化过程中细胞生长曲线图。
116.图4:本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3的icief叠加图谱。
117.图5:mil77
‑
1、mil77
‑
2和mil77
‑
3本发明抗体的sec
‑
hplc色谱图。
118.图6a:本发明抗体非还原ce
‑
sds叠加图谱。
119.图6b:本发明抗体还原ce
‑
sds叠加图谱。
120.图7:本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3的糖型叠加图谱(hilic
‑
hplc法)(注:n
‑
乙酰葡糖胺,甘露糖,岩藻糖,半乳糖,唾液酸)。
121.图8a:mil77
‑
1抗体完整蛋白分子量图谱。
122.图8b:mil77
‑
2抗体完整蛋白分子量图谱。
123.图8c:mil77
‑
3抗体完整蛋白分子量图谱。
124.图9:mil77
‑
1、mil77
‑
2和mil77
‑
3本发明抗体及mil60与fcγriiia(158v)结合曲线。
125.图10:mil77
‑
1、mil77
‑
2、mil77
‑
3与c1q的结合曲线。
126.图11:抗体体外中和活性检测原理图。
具体实施方式
127.1.抗埃博拉病毒单克隆抗体或其抗原结合部分,其轻链和重链可变区的氨基酸序列选自如下所示的(1)-(3)中的一组:
128.(1)轻链可变区的氨基酸序列如seq id no:4所示,重链可变区的氨基酸序列如seq id no:6所示;
129.(2)轻链可变区的氨基酸序列如seq id no:10所示,重链可变区的氨基酸序列如seq id no:12所示;
130.(3)轻链可变区的氨基酸序列如seq id no:16所示,重链可变区的氨基酸序列如seq id no:18所示。
131.2.实施方式1的抗埃博拉病毒单克隆抗体或其抗原结合部分,其重链恒定区选自来源于人的igg、igm、ige、igd和iga。
132.3.实施方式2的抗埃博拉病毒单克隆抗体或其抗原结合部分,其重链恒定区选自来源于人的igg1、igg2、igg3和igg4。
133.4.实施方式1的抗埃博拉病毒单克隆抗体或其抗原结合部分,其轻链恒定区来源于人的κ或λ。
134.5.实施方式1的抗埃博拉病毒单克隆抗体或其抗原结合部分,其为全抗体、双特异性抗体、scfv、fab、fab'、f(ab')2或fv。
135.6.实施方式1的抗埃博拉病毒单克隆抗体或其抗原结合部分,其轻链和重链的氨基酸序列选自如下所示的1)-3)中的一组:
136.1)轻链氨基酸序列如seq id no:3所示,重链氨基酸序列如seq id no:5所示;
137.2)轻链氨基酸序列如seq id no:9所示,重链氨基酸序列如seq id no:11所示;
138.3)轻链氨基酸序列如seq id no:15所示,重链氨基酸序列如seq id no:17所示。
139.7.实施方式1
‑
6任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分,其岩藻糖的含量占总含糖量的5%以下,例如2.5%以下,例如1.8%以下,例如1.0%以下,例如0.5%以下。
140.8.核酸分子,其含有编码实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分的序列。
141.9.实施方式8的核酸分子,其含有选自如下a)-c)中的一组所示的核苷酸序列:
142.a)seq id no:19所示的序列,和/或seq id no:20所示的序列;
143.b)seq id no:21所示的序列,和/或seq id no:22所示的序列;
144.c)seq id no:23所示的序列,和/或seq id no:24所示的序列。
145.10.实施方式8的核酸分子,其含有选自如下i)-iii)中的一组所示的核苷酸序列:
146.i)seq id no:1所示的序列,和/或seq id no:2所示的序列;
147.ii)seq id no:7所示的序列,和/或seq id no:8所示的序列;
148.iii)seq id no:13所示的序列,和/或seq id no:14所示的序列。
149.11.重组载体,其含有实施方式8
‑
10任一项的核酸分子。
150.12.重组细胞,其含有实施方式11的重组载体;
151.优选地,所述细胞为哺乳动物细胞,例如为cho细胞,例如为cho-k1细胞;
152.进一步优选地,所述哺乳动物细胞对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能,例如所述哺乳动物细胞为岩藻糖修饰途径相关基因敲除的细胞。
153.13.实施方式12的重组细胞,其中所述岩藻糖修饰途径相关基因为gft基因。
154.14.组合物,其含有实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合
部分、实施方式8
‑
10任一项的核酸分子、实施方式11的重组载体或者实施方式12或13的重组细胞,以及任选的药学上可接受的载体或赋形剂。
155.15.实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分的制备方法,其包括使用实施方式8
‑
10任一项的核酸分子、实施方式11的重组载体或者实施方式12或13的重组细胞的步骤。
156.16.实施方式15的制备方法,其具体包括以下步骤:
157.1)将实施方式8
‑
10任一项的核酸分子的核苷酸序列克隆入表达载体中,得到重组表达载体;
158.2)将重组表达载体转入宿主细胞,得到重组细胞;
159.3)将步骤2)获得的重组细胞在目标培养基中进行培养,获得能够表达抗体的细胞株;
160.4)逐步放大培养步骤3)获得的细胞株,收获培养上清;
161.5)将步骤4)获得的培养上清进行纯化获得实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分。
162.17.实施方式16的制备方法,其中所述细胞为哺乳动物细胞,例如为cho细胞,例如为cho-k1细胞;
163.优选地,所述哺乳动物细胞对其表达的蛋白部分地、几乎完全地或者完全地不具有岩藻糖修饰功能,例如所述哺乳动物细胞为岩藻糖修饰途径相关基因(例如gft基因)敲除的细胞。
164.18.实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分、实施方式8
‑
10任一项的核酸分子、实施方式11的重组载体或者实施方式12或13的重组细胞用于制备预防或治疗埃博拉出血热的药物的用途。
165.19.实施方式1
‑
7任一项的抗埃博拉病毒单克隆抗体或其抗原结合部分、实施方式8
‑
10任一项的核酸分子、实施方式11的重组载体或者实施方式12或13的重组细胞用于制备抗埃博拉病毒的药物的用途。
166.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
167.实施例1:抗体mil77核苷酸序列的获得
168.抗体氨基酸序列为重组抗体序列,来自专利wo2009/094755 a1和us2004/0053865 a1。选择在哺乳动物细胞中使用频率较高的密码子进行反向翻译,通过生物信息学技术合理优化,利用分子建模和分子生物学突变实验,获得了本发明抗体mil77的核苷酸序列。
169.其中,抗体mil77
‑
1的轻链核苷酸序列为:
170.gacatccagatgactcagtctccagcctccctatctgtatctgtgggagaaactgtctccatcacatgtcgagcaagtgagaatatttacagtagtttagcatggtatcagcagaaacagggaaaatctcctcagctcctggtctattctgcaacaatcttagcagatggtgtgccatcaaggttcagtggcagtggatcaggcactcagtattccctcaagatcaacagcctgcagtctgaagattttgggacttattactgtcaacatttttggggtactccgtacacgttcggaggggggaccaagctggaaataaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcag
ttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt(seq id no:1),其中带有下划线的序列为可变区序列(seq id no:19);
171.抗体mil77
‑
1的重链核苷酸序列为:
172.gaggtggcccttgaggagtctggaggaggcttgatgcaacctggaggatccatgaaactctcctgtgttgcctcaggattcactttcagtaactactggatgaactgggtccgccagtctccagagaaggggcttgagtgggttgctgaaattagattgaaatctaataattatgcaacacattatgcggagtctgtgaaagggaggttcaccatttcaagagatgattccaaaaggagtgtctacctgcaaatgaataccttaagagctgaagacactggcatttattactgtacccgggggaatggtaactacagggctatggactactggggtcaaggaacctcagtcaccgtctcctcagctagcaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgactgtgccctctagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaagagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaa(seq id no:2),其中带有下划线的序列为可变区序列(seq id no:20)。
173.抗体mil77
‑
1的轻链氨基酸序列为:
174.diqmtqspaslsvsvgetvsitcraseniysslawyqqkqgkspqllvysatiladgvpsrfsgsgsgtqyslkinslqsedfgtyycqhfwgtpytfgggtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:3);其中带下划线的为可变区序列(seq id no:4)。
175.抗体mil77
‑
1的重链氨基酸序列为:
176.evaleesggglmqpggsmklscvasgftfsnywmnwvrqspekglewvaeirlksnnyathyaesvkgrftisrddskrsvylqmntlraedtgiyyctrgngnyramdywgqgtsvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:5),其中带有下划线的序列为可变区序列;其中带下划线的为可变区序列(seq id no:6)。。
177.抗体mil77
‑
2的轻链核苷酸序列为:
178.gacatccagatgactcagtctccagcctccctatctgcatctgtgggagaaactgtcaccatcacatgtcgagcaagtgagaatatttacagttatttagcatggtatcagcagaaacagggaaaatctcctcagctcctggtctataatgccaaaaccttaatagagggtgtgccatcaaggttcagtggcagtggatcaggcacacagttttctctgaagatcaacagcctgcagcctgaagattttgggagttatttctgtcaacatcattttggtactccattcacattcggctcggggacagagttggaaataaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt(seq id no:7),其中带有下划线的序列为可变区序列(seq id no:21);
179.抗体mil77
‑
2的重链核苷酸序列为:
180.gaggtgcagctgcaggagtctggacctgagctggagatgcctggcgcttcagtgaagatatcctgcaaggcttctggttcctcattcactggcttcagtatgaactgggtgaagcagagcaatggaaagagccttgagtggattggaaatattgatacttactatggtggtactacctacaaccagaaattcaagggcaaggccacattgactgtggacaaatcctccagcacagcctacatgcagctcaagagcctgacatctgaggactctgcagtctattactgtgcaagatcggcctactacggtagtacttttgcttactggggccaagggactctggtcactgtctctgcagctagcaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgactgtgccctctagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaagagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaa(seq id no:8),其中带有下划线的序列为可变区序列(seq id no:22)。
181.抗体mil77
‑
2的轻链氨基酸序列为:
182.diqmtqspaslsasvgetvtitcraseniysylawyqqkqgkspqllvynaktliegvpsrfsgsgsgtqfslkinslqpedfgsyfcqhhfgtpftfgsgteleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:9),其中带有下划线的序列为可变区序列(seq id no:10);
183.抗体mil77
‑
2的重链氨基酸序列为:
184.evqlqesgpelempgasvkisckasgssftgfsmnwvkqsngkslewignidtyyggttynqkfkgkatltvdkssstaymqlksltsedsavyycarsayygstfaywgqgtlvtvsaastkgpsvfplapsskstsggtaal
no: 15),其中带有下划线的序列为可变区序列(seq id no: 16);
190.抗体mil77
‑
3的重链氨基酸序列为:
191.qltlkesgpgilkpsqtlsltcslsgfslstsgvgvgwfrqpsgkglewlaliwwdddkyynpslksqlsiskdfsrnqvflkisnvdiadtatyycarrdpfgydnamgywgqgtsvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:17),其中带有下划线的序列为可变区序列(seq id no:18)。
192.实施例2:抗体mil77
‑
1、mil77
‑
2和mil77
‑
3基因的克隆
193.1.实验材料
194.phusion聚合酶、taq dna聚合酶、限制性内切酶、pgem
‑
t
‑
easy载体、pyrobest dna polymerase均为neb公司产品;
195.dntp、dna marker标准为takara产品;
196.dna回收试剂盒为qiagen公司产品;
197.trans2
‑
blue感受态为全式金公司产品;
198.小提中量质粒试剂盒(dp107
‑
02)为天根生化公司产品;
199.大提质粒试剂盒(dp117)为天根生化公司产品;
200.opd为sigma公司产品;
201.fitc标记的羊抗人抗体:为pierce公司产品;
202.引物设计为biosun软件;
203.引物合成(genewiz),金唯智生物科技(北京)有限公司;
204.基因测序由北京诺赛基因组研究中心有限公司完成。
205.2.实验方法和结果
206.通过pcr的方法合成抗体的轻重链可变区基因,即为mil77
‑
1、mil77
‑
2和mil77
‑
3抗体的轻重链可变区基因。测序正确的克隆,装配表达质粒。使用pcr技术全合成mil77
‑
1/vh、mil77
‑
2/vh和mil77
‑
3/vh、mil77
‑
1/vκ、mil77
‑
2/vκ和mil77
‑
3/vκ基因片段,并引入合适的酶切位点,在抗体轻链可变区基因5’和3’端引入clai和bsiwi位点,在抗体重链可变区基因5’和3’端引入ecor i和nhe i位点。
207.2.1引物设计
208.根据基因全合成的原理,利用计算机辅助设计软件,设计引物,考虑引物的二级结构、gc含量等相关参数。每条基因设计10条引物,分别编号为p1、p2、p3、p4、p5、p6、p7、p8、p9和p10,用于基因全合成。
209.2.2全基因合成
210.1)引物合成后以无菌水稀释,方法如下:
211.a)取引物管12000rpm离心2min,引物按100μm的浓度稀释,
‑
20℃保存;
212.b)取少量引物p2~p9混合成终浓度为10μm作为使用液;
213.c)取少量引物p1和p10混合稀释成终浓度为10μm作为使用液p1/p10;
214.2)基因全合成,采用pyrobest dna polymerase,方法如下:
215.a)取1μl p2~p9混合引物作为模版,配制如下overlap pcr体系:
[0216][0217]
b)将以上pcr体系进行如下反应:
[0218][0219]
反应结束后,降到室温。
[0220]
加入引物p1/p10,进行如下pcr反应:
[0221][0222]
反应结束后,降至室温。
[0223]
c)1~2%琼脂糖凝胶电泳分离pcr产物,抗体重链基因回收440bp大小片段,轻链基因回收410bp大小片段。
[0224]
d)回收加尾(pyrobest dna polymerase不能在pcr产物3’端加尾a,所以不能直接连接t载体),作如下10μl体系:
[0225][0226]
反应条件如下:72℃20mins,反应结束后,降到室温。
[0227]
e)取加尾产物,连接pgem
‑
teasy载体:
[0228][0229]
室温连接2h或者4℃连接过夜,连接产物转化jm109大肠杆菌,涂布在含有100μg/ml氨苄青霉素(终浓度)的lb琼脂培养基上。获得的克隆在含有100μg/ml氨苄青霉素(终浓度)的lb液体培养基中培养,用质粒提取试剂盒(博大泰克公司)提取质粒,获得的质粒进行核酸测序鉴定。
[0230]
在上述步骤中,overlap pcr扩增后经过琼脂糖凝胶电泳分析,获得特异大小的目的条带(图1);产物经过回收、加尾、克隆等分子生物学技术,成功克隆入pgem
‑
teasy载体;经过测序鉴定,合成的基因与目的序列一致。
[0231]
琼脂糖电泳结果:vh约为440bp目的基因片段,vκ约为410bp目的片断,分别命名为mil77
‑
1/vh、mil77
‑
2/vh和mil77
‑
3/vh和mil77
‑
1/vκ、mil77
‑
2/vκ和mil77
‑
3/vκ。
[0232]
实施例3:mil77
‑
1、mil77
‑
2和mil77
‑
3抗体的制备
[0233]
1.实验材料
[0234]
委托hyclone加工的干粉培养基,经配制后用于宿主细胞的驯化、细胞株筛选以及抗体制备过程中培养细胞,细胞筛选时向配置的培养基中加入从sigma购买的蛋氨酸砜亚胺(methionine sulfoximine,msx),用从sigma购买的台盼蓝干粉自己配制成溶液后用于进行细胞计数。
[0235]
2.实验方法和结果
[0236]
2.1抗体真核表达载体的构建
[0237]
选择本技术人获得的表达载体ptgs
‑
frt
‑
dhfr(专利授权号:zl200510064335.0),去除潮霉素选择标签,通过psha1和xho1酶切位点加入gs(glutamine synthetase,谷氨酰胺合成酶)表达盒子,作为筛选标记;其中gs cdna从表达gs的细胞系cho中通过rt
‑
pcr获得。经过改造后的载体命名为gs载体。将获得mil77
‑
1、mil77
‑
2和mil77
‑
3抗体轻重链可变区基因克隆载体用相应的内切酶消化(轻链可变区基因用clai和bsiwi消化,重链可变区基因用ecor i和nhe i消化)后,与经相同内切酶消化的载体连接。经过转化等分子生物学常用技术,构建获得真核表达载体。具体实施如下:
[0238]
a)将mil77
‑
1、mil77
‑
2和mil77
‑
3轻重链可变区基因构建到pgem
‑
teasy载体中,获得的载体分别命名为mil77
‑
1/vκ、mil77
‑
2/vκ和mil77
‑
3/vκ和mil77
‑
1/vh、mil77
‑
2/vh和mil77
‑
3/vh;
[0239]
b)取mil77
‑
1/vκ、mil77
‑
2/vκ和mil77
‑
3/vκ分别用clai和bsiwi消化,得到mil77
‑
1、mil77
‑
2和mil77
‑
3轻链可变区基因;
[0240]
c)取1μg gs载体,用clai和bsiwi消化。用t4 dna连接酶连接所得的经clai和bsiwi消化的gs载体和用clai和bsiwi消化的抗体mil77
‑
1、mil77
‑
2和mil77
‑
3轻链可变区基因。连接产物转化xli
‑
blue大肠杆菌,涂布在含有100μg/ml氨苄青霉素(终浓度)的lb琼脂培养基上。获得的克隆在含有100μg/ml氨苄青霉素(终浓度)的lb液体培养基中培养,用质粒提取试剂盒(天根生化公司)提取质粒。所提取的质粒经clai和bsiwi消化后,用1%琼
脂糖凝胶电泳分析,选择一个携带有抗体mil77
‑
1、mil77
‑
2和mil77
‑
3轻链可变区基因的克隆。获得的携带抗体mil77
‑
1、mil77
‑
2和mil77
‑
3轻链可变区基因的质粒命名为ptgs
‑
mil77vκ
‑
1、ptgs
‑
mil77vκ
‑
2、ptgs
‑
mil77vκ
‑
3。
[0241]
d)取mil77
‑
1/vh、mil77
‑
2/vh和mil77
‑
3/vh用ecor i和nhe i消化,得到mil77
‑
1、mil77
‑
2和mil77
‑
3重链可变区基因;
[0242]
e)取1μg ptgs
‑
mil77vκ载体,用ecor i和nhe i消化。用t4dna连接酶连接所得的经ecor i和nhe i消化的ptgs
‑
mil77vκ
‑
1、2、3载体和用mil77
‑
1/vh、mil77
‑
2/vh、mil77
‑
3/vh载体消化的抗体mil77
‑
1、mil77
‑
2和mil77
‑
3重链可变区基因。连接产物转化xli
‑
blue大肠杆菌,涂布在含有100μg/ml氨苄青霉素(终浓度)的lb琼脂培养基上。获得的克隆在含有100μg/ml氨苄青霉素(终浓度)的lb液体培养基中培养,用质粒提取试剂盒(天根生化公司)提取质粒。所提取的质粒经ecor i和nhe i消化后,用1%琼脂糖凝胶电泳分析,选择一个携带有抗体mil77
‑
1、mil77
‑
2和mil77
‑
3重链可变区基因的克隆。
[0243]
在ptgs
‑
mil77vκ
‑
1、2、3基础上获得的携带抗体mil77
‑
1、mil77
‑
2和mil77
‑
3重链可变区基因的质粒命名为mil77
‑
1、mil77
‑
2、mil77
‑
3。
[0244]
2.2宿主细胞岩藻糖敲除及悬浮驯化
[0245]
将从atcc购买的cho
‑
k1细胞进行gmt4基因的敲除使其自身表达的蛋白几乎或完全不具有岩藻糖基化修饰,获得岩藻糖敲除宿主细胞命名为chok1
‑
af,具体方法是通过基因工程技术改造表达系统,定点敲除抗体表达宿主细胞cho
‑
k1中岩藻糖修饰途径的关键蛋白gft,从而有效降低抗体岩藻糖修饰水平。该方法可以同时阻断岩藻糖基化经典途径及补偿途径,从而达到完全去除岩藻糖基化的目的。具体技术路线为,利用锌指酶技术,针对gft基因slc35c1的序列(编号genbank:bae16173.1)优化设计了两个gft zinc
‑
finger nuclease锌指酶序列g1f1、g2f2,用以分别结合目的基因的双链dna。构建相应的表达载体质粒pcdna3.1
‑
g1f1、pcdna3.1
‑
g2f2,并将两个质粒共转染cho
‑
k1细胞。利用糖结合凝集素lca(lens culinaris agglutinin)对蛋白岩藻糖基的特异性亲和力,将共转染后的细胞使用biotin
‑
lca染色、结合anti
‑
biotin microbeads和macs ld柱进行负性分选,进一步克隆化培养,利用流式技术(lca
‑
staining facs)分析细胞克隆岩藻糖敲除水平;经多轮负性筛选、克隆化培养,获得了不含岩藻糖修饰的克隆1g7。流式细胞术结果显示,与原宿主细胞cho
‑
k1相比,1g7细胞表面岩藻糖的表达显著下降(图2a和图2b)。提取1g7细胞总rna,反转录后调取gdp转运蛋白编码基因,经测序确认该基因突变成功,不能正常表达。将获得的细胞克隆命名为chok1
‑
af。
[0246]
进一步进行驯化培养,将宿主细胞gmt4
‑
‑
cho
‑
k1在种子培养基(参见表1-1)(含10%小牛血清)中进行贴壁培养,逐级去除血清(10%
‑‑
>5%
‑‑
>2.5%
‑‑
>1.25%
‑‑
>完全不含血清),转置摇瓶培养,继续传代数次后,宿主细胞完全悬浮,成倍增长稳定,最终获得能够在种子培养基中生长的稳定宿主细胞。宿主细胞驯化过程中细胞生长的结果如图3所示。
[0247]
2.3特有培养基的制备
[0248]
按照表1
‑
1、1
‑
2、1
‑
3成分进行培养基的配制。经0.22μm膜无菌过滤后,供细胞培养使用。
[0249]
表1
‑
1:种子培养基
[0250][0251]
表1
‑
2:生产培养基
[0252][0253]
表1
‑
3:流加培养基
[0254][0255]
2.4mil77
‑
1、mil77
‑
2、mil77
‑
3抗体的制备
[0256]
使用电转染方法将步骤3.2获得的mil77
‑
1、mil77
‑
2、mil77
‑
3抗体真核表达载体分别转入目的宿主细胞(实施例3步骤3.2筛选获得的宿主细胞)中,向种子培养基中加入75μmmsx,在37℃co2培养箱中培养2~4周,挑选出可以在此培养基中存活的细胞,通过elisa法检测获得能够表达抗体的细胞。经过有限稀释法进行亚克隆筛选,经过6~8周的培养及筛选,获得能够高效表达mil77
‑
1、mil77
‑
2、mil77
‑
3抗体的单克隆细胞株。
[0257]
细胞株经过培养基多步的扩大培养,接种密度为0.5
×
106cells/ml,每三天传代一次,扩充至足够细胞量后转移至发酵培养基(培养基为生产培养基:种子培养基(1:1)),在发酵培养基中的培养周期为12
‑
14天,培养第3、6、9天加入10%体积的流加培养基,培养结束后收获上清,将上清进行纯化。
[0258]
采用akta(ge公司)进行mil77抗体的分离纯化。首先收集过蛋白a亲和层析柱(mabselect sure)ph在3.4
‑
3.6范围(用280nm进行监测)的洗脱液,调ph值至8.0,上样到阴离子交换层析柱(q
‑
sepharose ff),280nm进行监控和收集样品。将收集液ph值调节至5.5,上样到阳离子交换层析柱(poros)收集样品。超滤浓缩、除菌过滤后获得mil77
‑
1、mil77
‑
2、mil77
‑
3抗体,无菌分装。
[0259]
按照上述方法制备得到抗体mil77
‑
1、mil77
‑
2、mil77
‑
3用于下面的实施例。
[0260]
实施例4:mil77
‑
1、mil77
‑
2、mil77
‑
3抗体的分析以及活性鉴定
[0261]
1.实验材料
[0262]
用从thermo购买的离子交换色谱柱(型号:propac wcx
‑
10,4.0mm
×
250mm,生产
商:戴安公司)进行离子交换色谱(简称iec)分析,从sigma购买的hepes、以及从国药集团购买的nacl配置iec流动相,上海雅心生物技术有限公司购买的羧肽酶(cpb)进行样品处理。
[0263]
用从tosoh购买的凝胶色谱柱(型号:tsk
‑
gel sw3000,7.8mm
×
300mm,生产商:tosoh)进行尺寸排阻色谱(简称sec)分析,从国药集团购买的磷酸钾以及氯化钾配置sec流动相。
[0264]
2.mil77
‑
1、mil77
‑
2、mil77
‑
3抗体的分析
[0265]
(1)电荷变量
[0266]
仪器:毛细管等电聚焦电泳仪(protein simple,ice3)
[0267]
测定法及结果:分别取本发明抗体本发明抗体,依照《重组抗埃博拉病毒单克隆抗体联合(mil77)等电点及电荷变量测定法(icief法)》,具体步骤:取mil77的产品溶液,分别按质量比为1:100(cpb酶:mil77样品)的比例加入cpb酶溶液(1mg/ml),超纯水稀释至2mg/ml,振荡混匀,于37℃水浴锅水浴30分钟,取出,恢复室温备用。将进样溶液在12000rpm条件下,离心3分钟。量取160μl上层清液并加入内插管中,将内插管放入样品瓶中待测。采用protein simple的ice3进行等电聚焦电泳。测定mil77
‑
1中等电点为8.71
±
0.08且信号强度最高的峰为主峰,等电点小于主峰的为酸性峰,等电点高于主峰的为碱性峰;mil77
‑
2中等电点为8.27
±
0.08且信号强度最高的峰为主峰,等电点小于主峰的为酸性峰,等电点高于主峰的为碱性峰;mil77
‑
3中8.85
±
0.08且信号强度最高的两个相邻峰为主峰,等电点小于主峰的为酸性峰,等电点高于主峰的为碱性峰(如图4所示);按面积归一化法计算各个样品的酸性峰、主峰和碱性峰比例,结果见表2。
[0268]
表2:本发明抗体本发明抗体电荷变量(icief)结果
[0269]
[0270][0271]
结论:根据上述本发明抗体本发明抗体电荷变量测定结果,并参考初步稳定性结果,确定mil77
‑
1主峰比例应不低于43.4%;mil77
‑
2主峰比例应不低于34.1%;mil77
‑
3主峰比例应不低于42.8%,并列入质量标准。
[0272]
(2)分子排阻色谱法(sec
‑
hplc)
[0273]
仪器:高效液相色谱仪(agilent,1100/1200/1260)
[0274]
测定法及结果:参照《中华人民共和国药典》2010年版三部附录ⅲd分子排阻色谱法,凝胶色谱柱为tsk
‑
gel g3000 swxl 7.8
×
300mm,流动相为0.2m磷酸钾缓冲液、0.25m的氯化钾(ph 6.2),流速为0.5ml/min,进样器:6℃,柱温:30℃,波长280nm检测,运行时间30min,本发明抗体本发明抗体用流动相稀释至0.5mg/ml,进样100μl。系统适用性样品的单体与多聚体峰分离度应不小于1.5,3针系统适用性溶液主峰峰面积的rsd应不大于2.0%。
[0275]
分别取本发明抗体本发明抗体适量,依照上述方法进行测定,其典型图谱如图5所示,按面积百分比法计算纯度,结果见表3。
[0276]
表3:本发明抗体本发明抗体纯度结果(分子排阻色谱法)
[0277][0278]
结论:根据上述本发明抗体本发明抗体的分子排阻色谱法纯度测定结果,将本发明抗体本发明抗体的纯度(分子排阻色谱法)规定为“单体比例应不低于95.0%”,并列入质量标准。
[0279]
(3)非还原ce
‑
sds
[0280]
仪器:毛细管电泳仪(beckman coulter,pa 800plus)
[0281]
测定法及结果:参照《中华人民共和国药典》2010年版二部附录
ⅴ
g毛细管电泳法,制定了《重组抗埃博拉病毒单克隆抗体联合(mil77)纯度测定法(非还原ce
‑
sds法)》。分别取本发明抗体本发明抗体按照表4配制进样溶液,进样溶液于70℃水浴10min,离心后取上层清液进样分析。进样电压:5kv,进样时间20sec;分离电压:15kv,分离时间:40min;极性:负极到正极(反向);检测波长:220nm。系统适用性样品的hhl和蛋白主峰的分离度应不小于1.0,且3针系统适用性溶液的主峰比例的相对标准偏差(rsd)应不大于2.0%。
[0282]
表4:进样溶液配制方法
[0283]
试剂体积sample buffer50μl1m iam1.5μl25mg/ml样品溶液4μlh2o44.5μl
[0284]
本发明抗体本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3非还原ce
‑
sds的典型图谱分别如图6a所示,检测结果见表5。
[0285]
表5:本发明抗体本发明抗体非还原ce
‑
sds测定结果
[0286][0287]
结论:根据上述本发明抗体本发明抗体非还原型ce
‑
sds测定结果,确定本发明抗体本发明抗体的非还原型ce
‑
sds纯度为“免疫球蛋白纯度应不低于90.0%”,并列入质量标准。
[0288]
(4)还原ce
‑
sds
[0289]
仪器:毛细管电泳仪(beckman coulter,pa 800plus)
[0290]
测定法及结果:参照《中华人民共和国药典》2010年版二部附录
ⅴ
g毛细管电泳法,制定了《重组抗埃博拉病毒单克隆抗体联合(mil77)纯度测定法(还原ce
‑
sds法)》。分别取本发明抗体本发明抗体,按照表6配制进样溶液。进样溶液于70℃水浴10min,离心后,取上清进样分析。进样电压:5kv,进样时间20sec;分离电压:15kv,分离时间:40min;极性:负极到正极(反向);检测波长:220nm。系统适用性溶液的带糖重链峰(hc)和不带糖重链峰(nghc)的分离度应不小于1.5,且3针系统适用性溶液轻链和重链比例之和的相对标准偏差(rsd)应不大于2.0%。
[0291]
表6:进样溶液配制方法
[0292][0293][0294]
本发明抗体本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3的还原ce
‑
sds的典型图谱分别如图6b所示,检测结果见表7。
[0295]
表7:本发明抗体还原ce
‑
sds测定结果
[0296][0297]
结论:根据上述本发明抗体还原型ce
‑
sds纯度测定结果,确定本发明抗体的还原型ce
‑
sds纯度为“免疫球蛋白轻链和重链含量之和应不低于95.0%”,并列入质量标准。
[0298]
(5)n
‑
糖糖型分析
[0299]
仪器:高效液相色谱仪(agilent,1260)
[0300]
测定法及结果:依照《重组抗埃博拉病毒单克隆抗体联合(mil77)n
‑
糖糖型检测(高效液相色谱荧光法)》。分别取本发明抗体以10kd超滤管除盐,至90μl体积,加入10μl的g7 pngasef酶切缓冲液和2.5μl pngasef,于37℃孵育酶切12~18hr。之后,加入300μl
‑
20℃的无水乙醇混匀,4℃放置30min后,12000rpm离心5min,取上清至离心管内,置于真空离心浓缩仪中干燥。加入dmso和乙酸混合液(350:150):2
‑
ab:sodium cyanoborohydride(reductant)=100μl:5mg:6mg的混合液10μl,65℃反应3小时。加入40μl流动相a(100mm甲酸铵ph4.5)和160μl流动相b(100%乙腈),混匀12000rpm离心3min,取上清上样分析。
[0301]
液相方法条件:色谱柱acquity uplc beh glycan 2.1
×
150mm;柱温60℃;上样量10μl;流速0.25ml/min;激发波长:330nm;检测波长:420nm,增益为8,(可调整,以不超过荧光检测器最大量程为准)。流动相梯度见表8。
[0302]
表8:n
‑
糖糖型分析洗脱梯度
[0303][0304]
本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3的n
‑
糖糖型的典型图谱分别如图7所示,本发明抗体中含岩藻糖的糖型为g0f。按面积百分比法计算相关n
‑
糖型的面积百分比,不包括空白溶液图谱中存在的峰,结果如表9所示。
[0305]
表9:本发明抗体含岩藻糖糖型测定结果
[0306][0307]
结论:根据上述本发明抗体n
‑
糖糖型测定结果,确定含岩藻糖糖型总和应不高于5.0%,并列入质量标准。
[0308]
(6)完整蛋白分子量分析
[0309]
将本发明抗体脱盐后,tripletof 4600(ab sciex)分析,质谱数据去卷积分析,液相条件:色谱柱r1/20(2.1
×
30mm,applied biosystems),流动相a:0.1%fa水;流动相b:0.1%fa乙腈,流速为1ml/min,柱温:50℃,波长280nm检测。质谱条件:离子源:电喷雾离子源(esi),检测模式:正离子模式,检测质荷比范围:600~4000,其它主要参数为cur:35.0,
gs1:55.0,gs2 55.0,tem:400.0,isvf:5500.0,ce:30.0,dp:300.0。
[0310]
得到本发明抗体完整蛋白分子量,mil77
‑
1、mil77
‑
2和mil77
‑
3的完整蛋白典型图谱分别如图8a、8b、8c所示。
[0311]
mil77
‑
1检测到的完整蛋白中主要的糖修饰类型为:g0/g0、g0/g1和(g1/g1)或(g0/g2),其中g0/g0为最主要的完整蛋白类型,其末端赖氨酸大部分被切除(
‑
k/
‑
k);与理论的分子相比,本发明抗体的完整蛋白分子量与其理论值一致。
[0312]
mil77
‑
2检测到的完整蛋白中主要的糖修饰类型为:g0/g0、g0/g1和(g1/g1)或(g0/g2),其中g0/g0为最主要的完整蛋白类型,且其末端赖氨酸大部分被切除(
‑
k/
‑
k);与理论的分子相比,本发明抗体的完整蛋白分子量与其理论值一致。
[0313]
mil77
‑
3检测到的完整蛋白中主要的糖修饰类型为:g0/g0、g0/g1和(g1/g1)或(g0/g2),其中g0/g0为最主要的完整蛋白类型,mil77
‑
3除了末端赖氨酸被缺失(
‑
k/
‑
k)外,其重链n端的谷氨酰胺被焦谷氨酸化(pe/pe);与理论的分子相比,本发明抗体的完整蛋白分子量与其理论值一致。
[0314]
(7)与fcγriiia(158v)结合活性
[0315]
本实验首先将anti
‑
his单抗体(1μg/ml)包被到酶标板中,4℃孵育过夜后,以5%脱脂奶粉/pbs在37℃封闭1.5小时,洗板后加入1μg/ml的fcγriiia,37℃孵育1小时。将本发明抗体和mil60抗体(批号:m20130101,非岩藻糖敲除抗体作为阴性对照;制备方法参见中国专利公开cn 104278038a)分别与anti
‑
humanκ单抗体以1:2的比例混匀,37℃孵育1小时后稀释混合液,将mil60稀释到50μg/ml时,进行2.5倍的梯度稀释获得10个浓度点(包括50μg/ml);mil77
‑
1、mil77
‑
2、mil77
‑
3本发明抗体稀释到10μg/ml时,进行3倍的梯度稀释获得10个浓度点(包括10μg/ml)。酶标板洗板后每孔加入稀释后的抗体和anti
‑
humanκ的混合物100μl,37℃孵育2小时。洗板后将anti
‑
humanigg f(ab
′
)2
‑
hrp以1:5000的比例稀释,以100μl/孔的量加入到酶标板中,37℃孵育1小时。洗板后加入tmb室温显色30min,2mol/l h2so4终止后450nm处读取od值。
[0316]
结果如表10所示,mil77
‑
1与fcγrⅲa的结合活性的ec50在0.062~0.064μg/ml之间,批间一致;mil77
‑
2与fcγrⅲa的结合活性的ec50在0.054~0.073μg/ml之间,批间无显著差异;mil77
‑
3与fcγrⅲa的结合活性的ec50在0.060~0.077μg/ml之间,批间无显著差异;而mil60与fcγrⅲa的结合活性的ec50为0.484~0.528μg/ml,本发明抗体的结合活性约为非岩藻糖敲除mil60(阴性对照)的6
‑
8倍(图9,表10)。
[0317]
表10:本发明抗体及mil60 fcγriiia结合活性检测结果
[0318][0319]
上述实验结果表明,本发明的抗体与mil60相比,与fcγrⅲa具有更好的结合活性,因而具有更强的adcc(抗体依赖细胞介导的细胞毒性)活性。
[0320]
(8)与c1q结合活性
[0321]
抗体与c1q的结合是激活补体系统的前提和关键,抗体与c1q的结合活性影响抗体的cdc(补体介导的细胞毒作用)活性。首先用碳酸包被缓冲液(ph 9.6)稀释mil77
‑
1(批号:m20141101)、mil77
‑
2(批号:m20141102)、mil77
‑
3(批号:m20141103)至250μg/ml时,进行3倍的梯度稀释获得10个浓度点,将稀释样品以100ml/孔4℃包被过夜,洗板后以200ml/孔加入封闭液(pbst 0.1%明胶),37℃封闭1小时后洗板,随后将c1q蛋白用pbst 0.1%明胶稀释液稀释至2μg/ml,以100μl/孔的量加入到酶标板中,37℃孵育2小时,洗板后加入100μl/孔的anti
‑
c1q
‑
hrp(1:500的比例稀释),37℃孵育1小时后洗板,然后加入100μl/孔的tmb室温显色30分钟,2n h2so4终止后450nm处读取od值。
[0322]
表11:本发明抗体c1q结合活性检测结果
[0323][0324]
上述实验结果表明,如图10和表11所示,从拟合的四参数方程曲线上看,mil77
‑
1、mil77
‑
2、mil77
‑
3抗体对应曲线的最高平台期和ec50存在一定的差异。其中mil77
‑
1与c1q结合活性的ec50值在0.818
‑
0.960μg/ml之间,批间无显著差异;mil77
‑
2与c1q结合活性的ec50值在0.772
‑
0.968μg/ml之间,批间无显著差异;mil77
‑
3与c1q结合活性的ec50值在0.965
‑
1.222μg/ml之间,批间无显著差异。
[0325]
(9)与埃博拉病毒表面抗原gp蛋白的biacore结合动力学
[0326]
本发明抗体mil77
‑
1、mil77
‑
2和mil77
‑
3是分别针对埃博拉病毒表面gp蛋白gp2、gp1
‑
c、sgp区域的单克隆抗体,与gp蛋白的结合活性直接影响到本发明抗体的治疗效果。采用间接捕获的方法,先用25μg/ml的anti
‑
human igg(fc)通过氨基偶联共价结合于cm5芯片表面,之后再结合配体和分析物。分别将mil77
‑1‑
m20141101、mil77
‑1‑
20141202、mil77
‑2‑
m20150101、mil77
‑2‑
20141202、mil77
‑2‑
20141203、mil77
‑2‑
20150101、mil77
‑3‑
m20141203、mil77
‑3‑
20141202)以hbs
‑
ep buffer稀释至1μg/ml,作为配体。将gp用hbs
‑
ep buffer分别稀释至40μg/ml、20μg/ml、10μg/ml、5μg/ml、2.5μg/ml、1.25μg/m、0.625μg/ml,作为分析物。在biacore wizard模式下,以多循环方式,以mil77为配体,以gp为分析物,进行动力学分析实验。每个样品的测试包括3个start up、1个零浓度对照、7个梯度浓度样品和1个重复样品,每个循环结束之后用3m magnesium chloride再生液使芯片再生。分析物的每个浓度循环设置捕获时间30s,配体溶液流速30μl/min;配体与分析物结合时间180s,分析物溶液流速30μl/min;解离时间1200s。检测完成后将原始数据导入biacoretm x100分析软件,扣除零浓度对照,并且扣除参比通道以消除容积效应,用动力学分析方法以1:1binding模式拟合数据。
[0327]
由表12可见,mil77
‑
1其m201412011和20141202批之间的结合速率k
a
、解离速率k
d
和平衡解离常数一致,平衡解离常数在5.063
‑
5.381
×
10
‑8m之间,表明mil77
‑
1具有与埃博
拉病毒表面抗原gp蛋白较强的亲和力,且批间一致性良好;
[0328]
mil77
‑
2其m20150101、20141202、20141203、20150101批之间的结合速率k
a
、解离速率k
d
和平衡解离常数一致,平衡解离常数在3.195
‑
3.617
×
10
‑8m之间,表明mil77
‑
1具有与埃博拉病毒表面抗原gp蛋白较强的亲和力,且批间一致性良好;
[0329]
mil77
‑
3其m20141203和20141202批之间的结合速率k
a
、解离速率k
d
和平衡解离常数一致,平衡解离常数在0.917
‑
1.193
×
10
‑8m之间,表明mil77
‑
1具有与埃博拉病毒表面抗原gp蛋白较强的亲和力,且批间一致性良好。
[0330]
表12:本发明抗体与gp蛋白的结合动力学常数
[0331][0332]
(10)体外假病毒感染细胞中和活性
[0333]
本发明抗体的体外假病毒感染细胞中和活性测定是通过采用抑制假病毒感染细胞的方法测定。首先制备含荧光素酶报告基因的埃博拉假病毒(扎伊尔型),将两个质粒(一个是表达埃博拉gp蛋白质粒,一个是表达hiv病毒骨架蛋白质粒)共转染293t细胞,在真核表达系统里包装出来假病毒,将感染滴度的假病毒加入相应的细胞培养体系中,mil77
‑
1(m20141101)、mil77
‑
2(m20141102)、mil77
‑
3(m20141103)采用的huh7细胞体系;mil77
‑
1(m20141202)、mil77
‑
2(m20141202;m20141203;m20150101)、mil77
‑
3(m20141202)采用的hek293细胞体系。
[0334]
用梯度稀释的抗体与之结合,从而不同程度的逆转埃博拉假病毒感染细胞,再用荧光素酶报告基因检测试剂盒测定荧光素酶报告基因在细胞中的表达水平间接反映待测抗体的中和活性,检测原理如图11所示。根据不同浓度抗体逆转病毒感染的能力拟合的四参数方程曲线,计算得出半数抑制浓度(ic
50
)。
[0335]
实验发现在huh7细胞体系和hek293细胞体系中,本发明抗体对埃博拉假病毒都有较强的抑制作用,且该抑制效应呈现良好的浓度依赖关系。本发明抗体mil77
‑
1(m20141101)、mil77
‑
2(m20141102)、mil77
‑
3(m20141103)在huh7细胞体系中其半数抑制浓度(ic
50
)分别为0.799μg/ml、0.359μg/ml、0.563μg/ml。在hek293细胞体系中本发明抗体mil77
‑
1(m20141202)药物半数抑制浓度(ic
50
)为4.59μg/ml;mil77
‑
2(m20141202;m20141203;m20150101)药物半数抑制浓度(ic
50
)分别为0.058μg/ml、0.023μg/ml、0.017μg/
ml,mil77
‑
2的三批间无显著差别;mil77
‑
3(m20141202)药物半数抑制浓度(ic
50
)为1.39μg/ml。
[0336]
由于所使用的细胞体系不同,所获得的物半数抑制浓度(ic
50
)会有一定的波动,但从拟合的曲线判断,本发明抗体均具有中和ebola假病毒的活性,且这一中和效应在一定范围内具有剂量依赖性。
[0337]
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

