一株德氏根霉lut
‑8‑
53及其在生物转化法制备木犀草素中的应用
(一)技术领域
1.本发明属于生物化工技术领域,具体地说,是关于一种以木犀草苷为原料微生物转化制备木犀草素的方法。
(二)
背景技术:
2.木犀草素(luteolin),化学名3',4',5,7
‑
四羟基黄酮,cas号491
‑
70
‑
3,分子式为c
15
h
10
o6,分子量为286.24,是一种天然的黄酮类化合物,其结构见图1。因最初从木犀草科的木犀草(reseda odorata linn.)中分离出而得名。现代药理学研究表明木犀草素有多种药理活性,如消炎、抗过敏、降尿酸、抗肿瘤、抗菌、抗病毒等,临床可用于止咳、祛痰、消炎、降尿酸、治疗心血管疾病等。
3.木犀草素天然存在于金银花、杜虹花、叶青兰、锦灯笼、鹿茸草、黄芩、半枝莲、紫苏和独一味等多种植物中,因此可以从这些植物中分离获得,但其含量相对较低,如金银花中木犀草素含量仅为0.05~0.08%[胥秀英,郑一敏,傅善权,等.高效液相色谱法测定金银花中木犀草素的含量.食品科学,2006,27(5):221
‑
222];异叶青兰植株不同部位中的木犀草素平均含量为0.31%[王晓娟,白音夫.hplc法测定民族药材异叶青兰不同部位中木犀草素的含量.中国民族医药杂志,2015,21(2):55
‑
56];半枝莲中木犀草素含量为0.052%[程迪迪,刘彩红.hplc法测定半枝莲中木犀草素和芹菜素的含量.泰山医学院学报,2016,37(12):1340
‑
1341]。在植物中,木犀草素更多的是与葡萄糖结合成苷存在,即木犀草素
‑7‑
o
‑
β
‑
d葡萄糖苷,又称木犀草苷(luteoloside,cynaroside,cas号为5373
‑
11
‑
5,分子式为c
21
h
20
o
11
,分子量为448.4)。在一些植物中,木犀草苷含量显著高于木犀草素,如金银花叶中的木犀草素含量为0.0266%,而木犀草苷的含量为0.323%,后者是前者的12.1倍[王柯,王艳艳,赵东保,等.hplc法测定金银花不同部位中木犀草素及其苷的含量.河南大学学报(自然科学版),2011,41(1):39
‑
43];从中药材酸浆宿萼中提取木犀草苷的得率可以达到1.28%[邓亚雷,王飞飞,曲丽萍.酸浆中木犀草苷提取工艺优化.食品安全质量检测学报,2021,12(4):1332
‑
1337]。木犀草苷具有木犀草素类似的生理活性,但某些活性远不如木犀草素,如李惠香等研究表明,木犀草素的抗炎活性显著优于木犀草苷[李惠香,张倩,柳亚男,等.木犀草素与木犀草苷的抗炎活性对比研究.烟台大学学报,2018,31(2):114
‑
120]。
[0004]
木犀草素作为药物或保健食品应用的前景广阔,但从植物材料中提取生产木犀草素的产率低,致使其价格较高。虽然有半合成方法的报道,但是半合成的前体仍然是植物来源的橙皮苷,原料成本较高。如上所述,有些植物材料中木犀草苷含量较高,其生产成本相对较低,如果以木犀草苷为原料,水解切除葡萄糖残基而转化为木犀草素,则可以拓宽其生产的途径。采用酸水解法,往往存在苷元结构容易被破坏,产生较多的副产物,导致产物收率低等问题,相比之下,酶法水解具有不破坏苷元结构、转化率高、副产物少的优点。目前,已有将酶法转化应用于木犀草素提取的研究报道,如孟庆焕等用果胶酶辅助乙醇提取法,从牡丹种皮中提取木犀草素的得率提高了4.3倍[孟庆焕,祖元刚,王化,等.酶解辅助乙醇
0.5g/l溶剂为自来水,初始ph 6.0
–
6.5。
[0015]
所述的德氏根霉lut
‑8‑
53菌株在发酵前,通常需要先经平板培养基活化培养制备孢子悬液,或经过种子培养基扩大培养制备种子液,然后用孢子悬液或种子液以体积浓度5%
‑
10%的量(优选5%),接入产酶培养基进行产酶培养,所述德氏根霉lut
‑8‑
53发酵培养方法为:
[0016]
(1)活化培养:将德氏根霉lut
‑8‑
53接种于马铃薯平板培养基(pda),于28
–
30℃恒温培养1
–
2d,获得德氏根霉lut
‑8‑
53孢子,加无菌生理盐水制备孢子悬液;所述的pda平板培养基终浓度组成为:马铃薯200g/l,葡萄糖20g/l,琼脂20g/l,溶剂为自来水,ph自然(实测6.5);
[0017]
(2)种子扩大培养:挑取步骤(1)活化培养后德氏根霉lut
‑8‑
53孢子,加无菌生理盐水制备的孢子悬液,以体积浓度5%
–
10%的量(优选5%)接入马铃薯液体培养基(pdb)中,于30℃、200
–
250r/min恒温振荡条件下培养1
–
2d,得种子液;所述pdb液体培养基终浓度组成为:马铃薯200g/l,葡萄糖20g/l,mgso4·
7h2o 1g/l,溶剂为自来水,ph自然(实测6.5);
[0018]
(3)发酵培养:用步骤(1)活化培养后德氏根霉lut
‑8‑
53孢子悬液,或步骤(2)制备的种子液按体积浓度5%
–
10%的接种量接入产酶培养基,于30℃、200
–
250r/min恒温振荡条件下培养2
–
3d,获得发酵液(优选干菌体浓度为3.26
–
3.82g/l)。所述产酶培养基终浓度组成为:蔗糖10
–
15g/l,蛋白胨5
–
10g/l,酵母浸粉3
–
5g/l,nacl 5g/l,mgso4·
7h2o 1g/l,cacl
2 0.5g/l溶剂为自来水,初始ph 6.0
–
6.5。
[0019]
进一步,优选所述产酶培养基终浓度组成为:蔗糖15g/l,蛋白胨10g/l,酵母浸粉5g/l,nacl 5g/l,mgso4·
7h2o 1g/l,cacl
2 0.5g/l,溶剂为自来水,初始ph 6.0。
[0020]
本发明所述的木犀草素分离纯化的方法为:在生物转化反应结束后,转化体系用等体积的乙酸乙酯萃取1
–
2次,合并萃取液于圆底烧瓶中,45℃下减压蒸干乙酸乙酯后,加入原转化体系体积1/10
–
1/5的甲醇溶解残留物;甲醇溶液用滤纸过滤,滤液于45℃下减压干燥,(优选滤液转入另一洁净圆底烧瓶中,45℃下减压蒸干甲醇后,加少量甲醇溶解残留物,甲醇溶液转入洁净培养皿中,减压干燥后),即得木犀草素粗品。
[0021]
与现有技术相比,本发明的有益效果主要体现在:本发明提供一种利用德氏根霉lut
‑8‑
53发酵获得生物催化剂,以木犀草苷为底物,在底物浓度为5g/l时,木犀草素的转化得率为85.2%。本发明的技术优势有:(1)相比于酸水解法转化,转化专一性好,转化效率高,副产物少。(2)相比于纯酶法转化,生物催化剂的制备成本低,底物投料浓度高,产物得率高。本发明以及价格较低的木犀草苷为原料,微生物转化获得木犀草素,是一种可选的木犀草素生产方法,工艺具有生产成本低、生产效率高、环境污染小等优点。
(四)附图说明
[0022]
图1木犀草苷转化为木犀草素的化学反应式。
[0023]
图2德氏根霉lut
‑8‑
53菌落照片。
[0024]
图3hplc法分析木犀草素浓度的标准曲线。
[0025]
图4转化样品的hplc分析图谱,a为标准品木犀草苷和木犀草素的hplc图谱;b为实施例6的木犀草苷转化0h的hplc图谱;c为实施例6的木犀草苷经生物转化8h的hplc图谱。
(五)具体实施方式
[0026]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0027]
实施例1转化菌株的分离与筛选
[0028]
将干燥的花生壳粉碎并过40目筛,得到花生壳粉。取25g花生壳粉于三角瓶中,加入25ml无菌水润湿(保持疏松状态),于28℃恒温培养5d,再加入100ml无菌水制成悬液,然后用无菌水分别稀释1
×
10
‑6、1
×
10
‑7、1
×
10
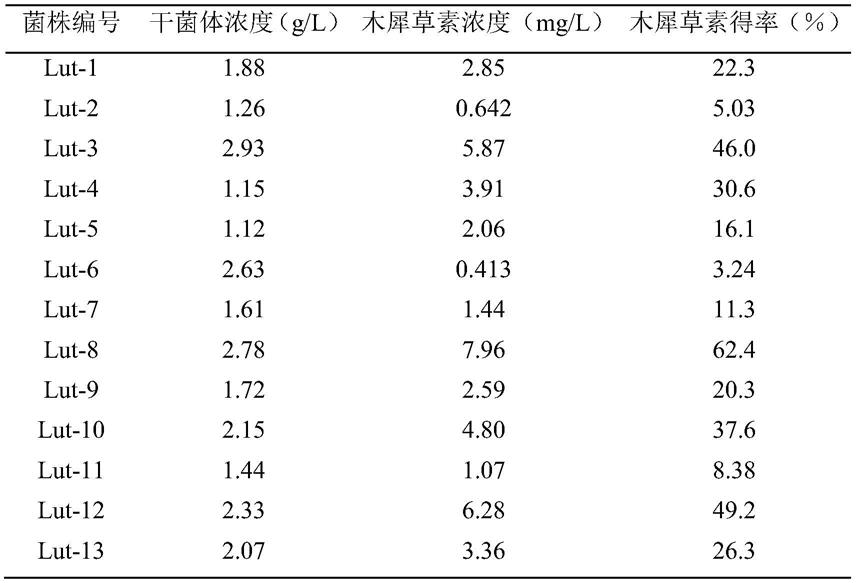
‑8倍后,分别吸取0.1ml稀释液涂布于马铃薯葡萄糖琼脂平板培养基(pda)上,于28℃恒温培养2d,挑取颜色和形态不同的霉菌菌落转接新鲜pda平板,置于28℃恒温培养2d,得孢子丰富的菌株13株(菌株编号见表1),保存于4℃冰箱中备用。
[0029]
接种环分别挑取上述各个菌株的平板培养基上的孢子3环,接种到装有50ml初始产酶培养基中(250ml三角瓶装),于30℃、200r/min振荡培养2d,加入木犀草苷甲醇溶液(即1mg的木犀草苷溶于0.5ml甲醇),使转化体系中木犀草苷浓度为20mg/l。转化体系于30℃、150r/min恒温振荡12h。转化反应结束后,转化液经布氏漏斗抽滤除去菌体,用50ml乙酸乙酯萃取1次,乙酸乙酯分液于圆底烧瓶中,减压蒸干后用1ml甲醇溶解残留物,经0.45μm微孔滤膜过滤后,hplc分析样品中木犀草素的浓度。
[0030]
hplc分析不同菌株发酵液转化样品中木犀草素浓度,计算木犀草素的转化得率(表1),由此比较不同菌株产酶转化木犀草苷为木犀草素的能力。13个菌株中,编号为lut
‑
8的菌株转化木犀草苷生成木犀草素得率最高,转化液中木犀草素的浓度为7.96mg/l,转化得率为62.4%。
[0031]
表1 不同菌株转化木犀草苷生成木犀草素的浓度和得率
[0032][0033]
所述的pda平板培养基,按如下组成和方法配制:马铃薯洗净去皮切成边长约为1cm的小方块,称取200g,加自来水1000ml,煮沸20min,4层纱布过滤去渣,滤液补足到
1000ml,再加入20g葡萄糖、20g琼脂,ph自然(实测6.5),加热至琼脂溶化后分装于三角瓶中,经高压蒸汽121℃灭菌20min,凝固前倒入直径9cm的无菌培养皿,每皿15
–
20ml。
[0034]
所述的初始产酶培养基按如下组成和方法配制:蔗糖10g/l,蛋白胨5g/l,酵母浸粉3g/l,nacl 5g/l,mgso4·
7h2o 1g/l,溶剂为自来水,初始ph 6.0。
[0035]
所述hplc分析方法为:lc
‑
20ad高效液相色谱仪(日本岛津仪器有限公司),色谱柱为phenomenex luna c18柱(5μm,250mm
×
4.6mm),柱温为室温;体积比20∶80的乙腈和双蒸水(含0.5%体积浓度的冰醋酸)混合液为流动相,流速1.0ml/min,检测波长350nm,进样量20μl。由相同分析条件下的标准品木犀草素浓度—峰面积标准曲线(图3),计算出测定样品中的木犀草素的浓度。
[0036]
所述的木犀草素转化得率按以下公式计算:
[0037][0038]
式中,286.2为木犀草素的分子量,448.4为木犀草苷的分子量。
[0039]
实施例2:转化菌种的诱变选育
[0040]
对菌株lut
‑
8进行紫外线照射诱变,筛选转化木犀草苷为木犀草素得率高的突变菌株,具体方法为:
[0041]
(1)孢子液的制备:菌株lut
‑
8接种pda平板,28℃培养2d后,平板中加5ml无菌生理盐水,用接种环搅动使孢子悬浮后,全部孢子悬液转入含45ml无菌生理盐水的三角瓶中,室温振荡15min。孢子悬液经过滤除去菌丝(三角漏斗垫2层擦镜纸过滤),在显微镜下用血球计数板对悬液中的孢子计数,用无菌生理盐水做适当倍数稀释,调整孢子数量在1
×
108个/ml。
[0042]
(2)诱变:诱变在红光下操作。分别取2.0ml上述孢子悬液和一枚无菌回形针于直径6cm的无菌培养皿中(共5皿),培养皿置于磁力搅拌器上,在预热30min的15w紫外灯下,距离30cm分别照射1、2、3、4、5min。取0.5ml上述照射处理后的孢子液,用无菌水作适当倍数稀释后,分别移取0.1ml涂布pda平板。以同样操作,做未经紫外线照射的孢子液稀释涂平板作为对照,以计算致死率。接种后的pda平板用黑布包裹,于28℃培养1d,对平板上的菌落进行计数,计算致死率。
[0043]
(3)筛选:挑取致死率在90%以上pda平板上的菌落转接新鲜pda平板,按实施例1所述的方法,对突变菌株进行筛选。经过2轮筛选,从85个菌株中筛选获得一株编号为lut
‑8‑
53的菌株。将菌株lut
‑8‑
53孢子接种到装有50ml初始产酶培养基中(250ml三角瓶装,组成同实施例1),于30℃、200r/min振荡培养2d,获得含菌体的发酵液。向50ml含菌体的发酵液中加入不同浓度的木犀草苷甲醇溶液(分别用0.5ml甲醇溶解的1mg木犀草苷,使木犀草苷加入浓度为20mg/l;用1.0ml甲醇溶解的0.15g木犀草苷,使木犀草苷加入浓度为3g/l;用1.0ml甲醇溶解的0.25g木犀草苷,使木犀草苷加入浓度为5g/l),转化体系于30℃、150r/min恒温振荡12h,同实施例1方法计算木犀草素的转化得率。在木犀草苷浓度为20mg/l时,转化12h,木犀草素的转化得率达到97.3%,是出发菌株转化得率62.4%的1.56倍;在木犀草苷浓度为3g/l时,转化12h,木犀草素的转化得率达到82.2%,是出发菌株转化得率37.2%的2.21倍。在木犀草苷浓度为5g/l时,转化12h,木犀草素的转化得率达到68.1%,是出发菌株转化得率26.6%的2.56倍,可以看出,筛选获得的菌株lut
‑8‑
53产酶转化木犀草
苷为木犀草素的活力大幅度提高。
[0044]
菌株lut
‑8‑
53经过转接传代5次,每代菌株发酵制备的发酵液转化木犀草苷,木犀草素的转化得率波动范围小于10%,说明该菌株遗传稳定性良好。
[0045]
实施例3:转化菌株的分类鉴定
[0046]
菌株lut
‑8‑
53接种于马铃薯琼脂平板培养基上,于28℃培养2d,形成铺满全部培养皿的菌落,菌丝稠密,生长初期呈灰白色,后逐渐变为灰棕色;表面孢子囊丰富,匍匐菌丝和假根较多;孢囊梗直立或弯曲,有分枝;孢子囊呈球形,灰褐色或褐色;孢囊孢子呈球形或椭圆形,直径6
–
10μm。德氏根霉lut
‑8‑
53的菌落照片见图2。
[0047]
将菌株lut
‑8‑
53交由生工生物工程(上海)有限公司测得其rdna核糖体内转录间隔区(rdna
‑
its)的核苷酸序列如seq id no.1所示。该序列在ncbi(national center for biotechnology information,https://www.ncbi.nlm.nih.gov)进行blast比对,与31株已知的德氏根霉(rhizopus delemar)有大于99%的同源性。根据菌株lut
‑8‑
53菌落特征和rdna
‑
its核苷酸序列比对结果,可以确定菌株lut
‑8‑
53的生物学分类位置为(参考mycobank,http://www.mycobank.org):真菌界(fungi),毛霉门(mucoromycota),毛霉纲(mucoromycetes),毛霉目(mucorales),毛霉科(mucoraceae),根霉属(rhizopus),德氏根霉(rhizopus delemar)。
[0048]
rdna
‑
its序列为:
[0049]
gtggaagtaaaaatcgtaacaaggtttccgtaggtgaacctgcggaaggatcattaattatgttaaagcgccttacctcttagggtttcctctggggtaagtgattgcttctacactgtgaaaatttggctgagagactcagactggtcatgggtagacctatctggggtttgatcgatgccactcctggtttcaggagcacccttcataataaacctagaaattcagtattataaagtttaataaaaaacaacttttaacaatggatctcttggttctcgcatcgatgaagaacgtagcaaagtgcgataactagtgtgaattgcatattcagtgaatcatcgagtctttgaacgcagcttgcactctatggtttttctatagagtacgcctgctgcagtatcatcacaaacccacacataacatttgtttatgtggtaatgggtcgcatcgctgttttattacagtgagcacctaaaatgtgtgtgattttctgtctggcttgctaggcaggaatattacgctggtctcaggatctttttctttggttcgcccaggaagtaaagtacaagagtataatccagcaactttcaaactatgatctgaagtcaggtgggattacccgctgaacttaagcatatcaataggccggagga。
[0050]
综上,从花生壳粉的微生物富集物中分离的菌株lut
‑
8,经紫外线诱变后,筛选获得了菌株lut
‑8‑
53,即德氏根霉(rhizopus delemar)lut
‑8‑
53,该菌株保藏于广东省微生物菌种保藏中心,保藏编号:gdmcc no:61727,保藏日期2021年6月21日,地址:广东省广州市先烈中路100号大院59号楼5楼;邮编510070。
[0051]
实施例4:转化工艺1
[0052]
以德氏根霉lut
‑8‑
53为转化菌种,制备含菌体的发酵液转化木犀草苷为木犀草素,优选的工艺可以按如下步骤操作:
[0053]
(1)将4℃冰箱中保存的德氏根霉lut
‑8‑
53平板菌种接种于新鲜pda平板,于28℃恒温培养2d,所述的pda平板培养基组成和制备方法同实施例1;
[0054]
(2)加5ml的无菌生理盐水于步骤(1)制备的lut
‑8‑
53平板培养物中,用接种环搅动菌丝,使孢子悬浮到生理盐水中,吸取2.5ml孢子悬液接种至50ml产酶培养基中,于30℃、250r/min恒温振荡条件下培养3d后,得干菌体浓度为3.37g/l的发酵液。所述的产酶培养基终浓度组成为:蔗糖15g/l,蛋白胨10g/l,酵母浸粉5g/l,nacl 5g/l,mgso4·
7h2o 1g/l,
cacl
2 0.5g/l,溶剂为自来水,初始ph 6.0。250ml的三角瓶装50ml产酶培养基,8层纱布扎口,高压蒸汽121℃灭菌20min。
[0055]
(3)0.25g的木犀草苷溶于1ml甲醇中,加入步骤(2)制备的50ml发酵液中构成转化体系,使转化体系中木犀草苷的浓度为5g/l(转化体系体积按50ml计)。转化体系于30℃、150r/min恒温振荡12h。
[0056]
(4)转化反应结束后,转化液经布氏漏斗抽滤除去菌体,滤液用50ml乙酸乙酯萃取2次,乙酸乙酯分液于圆底烧瓶中,减压蒸干乙酸乙酯后,用5ml甲醇溶解残留物,经0.45μm微孔滤膜过滤,取滤液采用hplc分析样品中木犀草素的浓度。
[0057]
hplc分析表明,按本实施例方法,用含德氏根霉lut
‑8‑
53菌体的发酵液转化木犀草苷,在其浓度为5g/l时,转化结束后,转化体系中的木犀草素浓度为2.83g/l,转化得率为88.7%。
[0058]
实施例5:转化工艺2
[0059]
以德氏根霉lut
‑8‑
53为转化菌种,制备含菌体的发酵液转化木犀草苷为木犀草素,优选的工艺可以按如下步骤操作:
[0060]
(1)将4℃冰箱中保存的德氏根霉lut
‑8‑
53平板菌种接种于新鲜pda平板培养基,平板于30℃恒温培养2d,所述的pda平板培养基组成和制备方法同实施例1;
[0061]
(2)加5ml的无菌生理盐水于步骤(1)制备lut
‑8‑
53平板培养物中,用接种环搅动菌丝,使孢子悬浮到生理盐水中,吸取5.0ml孢子悬液接种至100ml产酶培养基中,于30℃、250r/min恒温振荡条件下培养3d后,得干菌体浓度为3.26g/l的发酵液。所述的产酶培养基终浓度组成为:蔗糖15g/l,蛋白胨10g/l,酵母浸粉5g/l,nacl 5g/l,mgso4·
7h2o 1g/l,cacl
2 0.5g/l,溶剂为自来水,初始ph 6.0。250ml的三角瓶装100ml产酶培养基,8层纱布扎口,高压蒸汽121℃灭菌20min。
[0062]
(3)0.5g的木犀草苷溶于2ml甲醇中,加入步骤(2)制备的100ml发酵液中构成转化体系,使转化体系中木犀草苷的浓度为5g/l(转化体系体积按100ml计)。转化体系于35℃、200r/min恒温振荡8h。
[0063]
(4)转化反应结束后,转化液经布氏漏斗抽滤除去菌体,滤液用100ml乙酸乙酯萃取2次,乙酸乙酯分液于圆底烧瓶中,减压蒸干乙酸乙酯后,用10ml甲醇溶解残留物,经0.45μm微孔滤膜过滤,取滤液采用hplc分析样品中木犀草素的浓度。
[0064]
hplc分析表明,按本实施例方法,用含德氏根霉lut
‑8‑
53发酵制备的发酵液转化木犀草苷,在其浓度为5g/l时,转化结束后,转化体系中的木犀草素浓度为2.77g/l,转化得率为86.8%。
[0065]
实施例6:转化放大及木犀草素的分离
[0066]
在实施例5的基础上,增加了德氏根霉lut
‑8‑
53种子扩大培养步骤,发酵和转化体系放大到500ml,具体工艺步骤如下:
[0067]
(1)将4℃冰箱中保存的德氏根霉lut
‑8‑
53平板菌种接种于新鲜pda平板培养基,平板于30℃恒温培养1d,所述的pda平板培养基组成和制备方法同实施例1;
[0068]
(2)加5ml的无菌生理盐水于步骤(1)制备lut
‑8‑
53平板培养物中,用接种环搅动菌丝,使孢子悬浮到生理盐水中,吸取2.5ml孢子悬液接种至50ml马铃薯液体培养基(pdb)中,于30℃、200r/min恒温振荡条件下培养1d,得干菌体浓度为1.27g/l的种子液。所述的
pdb配制方法为:马铃薯洗净去皮切成边长约为1cm的小方块,称取200g,加自来水1000ml,煮沸20min,4层纱布过滤去渣,滤液补足到1000ml,再加入葡萄糖20g,mgso4·
7h2o 1g,ph自然(实测6.5)。250ml的三角瓶装50ml的pdb培养基,8层纱布扎口,高压蒸汽121℃灭菌20min。
[0069]
(3)步骤(2)种子液以体积浓度10%(即50ml)的接种量接种至500ml产酶培养基中,于30℃、200r/min恒温振荡条件下培养2d后,得干菌体浓度为3.82g/l的发酵液。所述的产酶培养基终浓度组成为:蔗糖15g/l,蛋白胨10g/l,酵母浸粉5g/l,nacl 5g/l,mgso4·
7h2o 1g/l,cacl
2 0.5g/l,溶剂为自来水,初始ph 6.0。2l的三角瓶装500ml产酶培养基,8层纱布扎口,高压蒸汽121℃灭菌20min。
[0070]
(4)2.5g的木犀草苷溶于10ml甲醇中,加入步骤(2)制备的500ml发酵液中构成转化体系,使转化体系中木犀草苷的浓度为5g/l(转化体系体积按500ml计)。转化体系于35℃、200r/min恒温振荡8h。
[0071]
(5)转化反应结束后,转化液经布氏漏斗抽滤除去菌体,滤液用500ml乙酸乙酯萃取2次,合并萃取液于圆底烧瓶中,45℃下减压蒸干乙酸乙酯后,再加入100ml甲醇溶解残留物;甲醇溶液用滤纸过滤后,转入另一洁净圆底烧瓶中,45℃下减压蒸干甲醇后,加10ml甲醇溶解残留物,甲醇溶液转入洁净培养皿中,减压干燥后得2.71g干燥品。
[0072]
称取步骤(5)制备的木犀草素样品1mg溶解于5ml甲醇中,经0.45μm微孔滤膜过滤后,hplc分析样品中木犀草素的浓度,结果表明,按本实施例方法,制备的木犀草素纯度为50.1%,转化得率为85.2%。木犀草素标准品、未转化样品和转化样品的hplc分析图谱见图4。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

