23005。
8.本发明还提供一种牛传染性鼻气管炎病毒的抗体检测试剂盒,其包含所述的抗牛传染性鼻气管炎病毒的单克隆抗体。
9.优选地,所述试剂盒还包含截短的牛传染性鼻气管炎病毒gb蛋白,其氨基酸序列如seq id no: 2所示。
10.优选地,所述试剂盒还包含酶标板;所述截短的牛传染性鼻气管炎病毒gb蛋白被预先包被在酶标板上或临用前包被在酶标板上。
11.优选地,所述截短的牛传染性鼻气管炎病毒gb蛋白在酶标板上的包被量为0.1~5μg/孔;所述单克隆抗体的工作浓度为0.2~2μg/ml。
12.优选地,所述试剂盒还包含抗原包被液;所述抗原包被液为0.02mol/l、ph值为6.5
±
0.2的磷酸盐缓冲液。
13.优选地,所述试剂盒还包含封闭液;所述封闭液为含0.1% casein和5%蔗糖的pbs溶液。
14.优选地,所述试剂盒还包含样品稀释液;所述样品稀释液为含1.5% bsa的pbs溶液。
15.本发明还提供一种非诊断目的的牛传染性鼻气管炎病毒的抗体检测方法,其特征在于:使用任一所述的试剂盒进行检测,包括如下步骤:(1)用0.02mol/l、ph值为6.5
±
0.2的磷酸盐缓冲液将所述截短的牛传染性鼻气管炎病毒gb蛋白包被在酶标板上,包被量为0.1~5μg/孔,孵育;洗酶标板;(2)加入含0.1% casein和5%蔗糖的pbs溶液,封闭;洗酶标板;(3)设置样品孔、阴性对照孔和阳性对照孔;将待检样品用含1.5% bsa的pbs溶液按1:2稀释后,加入样品孔中;再向所有孔内加入浓度为0.2~2μg/ml的酶标单克隆抗体溶液,孵育;洗酶标板;(4)加入显色液,孵育;(5)加入终止液,轻轻混匀后在酶标仪中读取450nm处的吸光值;(6)计算s/n值,s/n值=样品孔的od
450nm
值/阴性对照孔的od
450nm
值;若s/n值>0.7,则样品中不含有牛传染性鼻气管炎病毒的抗体;若s/n值≤0.7,则样品中含有牛传染性鼻气管炎病毒的抗体。
16.本发明采用经过筛选鉴定的ibrv重组gb蛋白和抗ibrv单克隆抗体(1f24)作为特异性的包被抗原和单抗,通过优化抗原包被量、包被液、封闭液、抗体使用量、样品稀释液和样品稀释度,研制了牛传染性鼻气管炎病毒的竞争elisa抗体检测试剂盒(简称为本发明的试剂盒)。使用该试剂盒对460份已知背景的牛血清样品进行检测,对结果进行统计学分析,运用roc(受试者工作特性曲线)方法确定了该试剂盒的临界值及判定标准,从而建立了牛传染性鼻气管炎病毒的竞争elisa抗体检测方法(简称为本发明的方法)。经实验证明,本发明的试剂盒和方法具有以下优点:(1)特异性强:本发明制备和筛选的单克隆抗体(1f24)能特异性识别牛传染性鼻气管炎病毒bartha nu/67株和牛传染性鼻气管炎病毒gb蛋白,与牛支原体pd株、a型牛多杀性巴氏杆菌pm1株、b型牛多杀性巴氏杆菌pm572株、牛病毒性腹泻/粘膜病病毒oregon c24v株和野生型杆状病毒rbv
‑
null株均不反应。
17.(2)敏感性好:采用本发明的试剂盒对30份经中和试验鉴定的ibrv抗体弱阳性血清样品进行检测。结果显示,29份血清样品的s/n值都在0.400~0.700之间,仅有1份血清样品的s/n值为0.722。本发明的试剂盒与中和试验的阳性符合率为96.67%。
18.(3)灵敏度高:将ibrv标准阳性血清按1:8、1:16、1:32、1:64、1:128、1:256、1:512、1:1024进行稀释,采用本发明的竞争elsia方法与中和实验同时进行检测,本发明的方法灵敏度可达1:256的稀释度,中和试验可检测到1:32的稀释度。
19.(4)与其他方法的检测结果一致性好:分别采用本发明的试剂盒、中和试验以及美国爱德士公司(idexx laboratories, inc.)的传染性牛鼻气管炎病毒gb抗体检测试剂盒(简称为idexx试剂盒)同时检测170份牛血清样品,比较三种检测方法之间的符合率。结果表明:本发明的试剂盒与中和试验的阳性符合率为92.77%,阴性符合率为100%,总符合率为96.47%;idexx试剂盒与中和试验的阳性符合率为93.98%,阴性符合率为97.70%,总符合率为95.88%;本发明的试剂盒与idexx试剂盒的阳性符合率为91.25%,阴性符合率为95.56%,总符合率为93.53%。与idexx试剂盒相比,本发明的试剂盒与中和试验的符合率更好,且特异性更高。
20.(5)检测效率高:中和试验操作繁琐,整个检测过程至少需要72个小时;idexx试剂盒需要过夜孵育待检血清,整个检测过程需要13
‑
19小时;而本发明的试剂盒检测过程不足1小时,与中和试验和idexx试剂盒相比,操作更简便,且检测时间大大缩短。
21.本发明提供的杂交瘤细胞已进行了专利保藏,保藏信息如下:参椐的生物材料(株):1f24分类命名:杂交瘤细胞保藏日期:2021年7月14日保藏编号:cgmcc no. 23005保藏机构:中国微生物菌种保藏管理委员会普通微生物中心地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
附图说明
22.图1. gb目的基因片段pcr扩增产物的凝胶电泳图;图中m:dna marker dl2000;泳道1:gb目的基因片段。
23.图2. 重组穿梭质粒rbac
‑
gb的pcr鉴定结果;图中m:dna marker dl5000;泳道1:gb特异性引物的扩增产物;泳道2:m13通用引物的扩增产物。
24.图3. 重组杆状病毒的pcr鉴定结果;图中泳道1:以p2代杆状病毒基因组为模板的pcr产物;泳道2:sf9空白对照;泳道3:阴性对照(野生型杆状病毒rbv
‑
null株);泳道4:阳性对照(重组穿梭质粒rbac
‑
gb)。
25.图4. 重组杆状病毒的间接免疫荧光鉴定结果;图中a:正常sf9细胞;b:感染了重组杆状病毒的sf9细胞。
26.图5. gb蛋白的western blot鉴定结果;图中泳道1:正常sf9细胞;泳道2:重组杆状病毒sf9细胞培养上清;泳道3:重组杆状病毒sf9细胞沉淀。
27.图6. gb蛋白的sds
‑
page分析;图中m:180kda蛋白 marker;泳道1:high five空白对照;泳道2:细胞培养上清;泳道3:流穿峰;泳道4:20mm咪唑洗杂;泳道5:50mm咪唑洗杂。
28.图7. 本发明的1f24单抗的western blot鉴定结果。
29.图8. 本发明的1f24单抗的间接免疫荧光鉴定结果。a. 使用单抗1f24检测感染ibrv的mdbk。b. 使用小鼠阴性血清检测感染ibrv的mdbk。
30.图9. 本发明的 1f24单抗的特异性鉴定结果。泳道1:ibrv bartha nu/67株;泳道2:牛支原体pd株;泳道3:a型牛多杀性巴氏杆菌pm1株;泳道4:b型牛多杀性巴氏杆菌 pm572株;泳道5:bvdv oregon c24v株;泳道6:野生型杆状病毒rbv
‑
null株。
31.图10. 本发明的试剂盒对460份血清s/n值的检测结果对应的roc曲线。
具体实施方式
32.下面结合实施例对本发明进行详细阐述,需要理解的是,下述实施例仅作为对本发明的解释和说明,不以任何方式限制本发明的范围。
33.动物:6~8周龄雌性balb/c小鼠购自北京维通利华实验动物技术有限公司。
34.细胞:sf9细胞、high five细胞、mdbk细胞、骨髓瘤细胞sp2/0细胞由北京市农林科学院畜禽疫病研究中心提供,上述细胞均可商购获得。大肠杆菌dh5α感受态细胞:购自北京全式金生物技术有限公司,货号cd201
‑
01。dh10bac感受态细胞:购自invitrogen,货号10361012。
35.病毒和细菌:牛传染性鼻气管炎病毒(ibrv)bartha nu/67标准株由北京市农林科学院畜禽疫病研究中心提供,为已知的牛疱疹病毒ⅰ型毒株,已在文献xu j, zhang x, zhou s, shen j, yang d, wu j, li x, li m, huang x, sealy je, iqbal m, li y. a dna aptamer efficiently inhibits the infectivity of bovine herpesvirus 1 by blocking viral entry. sci rep. 2017 sep 18;7(1):11796. doi: 10.1038/s41598
‑
017
‑
10070
‑
1. pmid: 28924154; pmcid: pmc5603541.中公开。牛支原体pd株、a型牛多杀性巴氏杆菌pm1株、b型牛多杀性巴氏杆菌pm572株、牛病毒性腹泻/粘膜病病毒oregon c24v株(bvdv oregon c24v株)、野生型杆状病毒rbv
‑
null株,由北京市农林科学院畜禽疫病研究中心提供。以上病毒和细菌本实验室亦有保存,申请人声明可自申请日起二十年内向公众发放用于必要的验证实验。
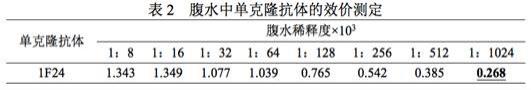
36.血清:ibrv标准阳性血清和标准阴性血清,购自中国兽医药品监察所。由北京市农林科学院制备、鉴定和保存的460份血清样品,包括ibrv抗体阴性血清300份、ibrv抗体阳性血清160份,均采用中和试验鉴定,确认其背景。由北京市农林科学院制备、鉴定和保存的ibrv抗体弱阳性血清30份,均采用中和试验鉴定,确认其背景。田间采集的牛传染性鼻气管炎灭活疫苗免疫血清和非免疫血清,共计170份,均采用中和试验鉴定,其中83份血清为ibrv抗体阳性,87份血清为ibrv抗体阴性,由北京市农林科学院收集、鉴定和保存。
37.载体:pfastbac
tm
1,为昆虫细胞表达载体,由北京市农林科学院畜禽疫病研究中心提供,可商购获得。
38.试剂耗材:卡那霉素、x
‑
gal、氨苄青霉素、无内毒素质粒小提中量试剂盒购自天根生化科技(北京)有限公司。庆大霉素、四环素、casein、卵清蛋白、硫酸铵购自北京索莱宝科技有限公司。iptg购自sigma
‑
aldrich公司。hf502c昆虫细胞无血清培养基购自苏州市沃美生物技术有限公司。dmem、澳洲胎牛血清、小牛血清、马血清购自gibco公司。bsa购自calbiochem公司。明胶、蔗糖、naio4、nabh4、(nh4)2so4购自北京化学试剂公司。6孔板、t175细
胞培养瓶、细胞摇瓶、酶标板、96孔细胞培养板、48孔板、无菌飞片均购自corning公司。洗板机(biorad,型号immunowash
tm
1575),多功能微孔板检测仪(perkinelmer,型号victornivo
tm
)。
39.溶液配制:pbs:称取磷酸氢二钠(含12个结晶水)2.9g、磷酸二氢钾0.2g、氯化钠8g、氯化钾0.2g,加入1000ml纯化水搅拌溶解。终止液:量取纯化水876ml,缓慢加入硫酸(2mol/l)124ml,搅拌均匀,而后加纯化水定容至1000ml。定量分装,2~8℃保存。
40.酶结合物稀释液:称取磷酸氢二钠(含12个结晶水)2.9g、磷酸二氢钾0.2g、氯化钠8g、氯化钾0.2g,加入800ml纯化水搅拌溶解,再加入15gbsa,加入1mlproclin300、1mltritonx
‑
100,而后加纯化水定容至1000ml,过滤除菌。
41.若未特别说明,以下实施例所使用的试剂均为本领域常规试剂,可商购获得或按照本领域常规方法配制而得,规格为实验室纯级即可。若未特别说明,以下实施例所使用的实验方法和条件均为本领域常规实验方法和条件,可参考相关实验手册、公知文献或厂商说明书。除非另有定义,本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。
42.实施例1.ibrv重组gb蛋白的设计与表达1.序列优化及引物合成从genbank数据库下载ibrv的gb基因序列(geneid:4783419),利用在线分析网站(http://www.cbs.dtu.dk/services/tmhmm/)分析该序列,设计出截短的gb基因序列(seqidno:1),其编码截短的gb蛋白(seqidno:2)。为使截短的gb蛋白在昆虫细胞中分泌表达,根据昆虫细胞偏好性对截短的gb基因序列进行密码子优化,得到目的基因序列(seqidno:3)。委托生工生物工程(上海)股份有限公司合成目的基因。根据杆状病毒表达载体的碱基序列及目的基因序列,设计1对同源臂扩增引物,并在上、下游引物序列中分别添加酶切位点ndei(catatg)和xhoi(ctcgag),送至北京擎科生物科技有限公司进行引物合成,同时合成通用引物m13。
43.表1引物序列表引物名称序列5
’‑3’
酶切位点gb
‑
fcggcgcattctgcctttgcgcatatgggcgccggagacggtcndeigb
‑
rcttgtggtggtggtggtggtgctcgaggcgccgcgggcccggcxhoipuc/m13ragcggataacaatttcacacagg puc/m13fcccagtcacgacgttgtaaaacg 2.杆状病毒转移载体的构建与鉴定利用引物gb
‑
f和gb
‑
r通过pcr扩增目的基因。50μlpcr反应体系如下:10μl5
×
primestarbuffer(mg
2
plus)(takara,货号9158a)、4μldntpmix、0.5μlprimestarhsdnapolymerase(takara,货号r010q)、1μlgb
‑
f、1μlgb
‑
r、1μldna模板和32.5μlddh2o;反应程序为:94℃变性2min;98℃变性10s、56℃退火15s、72℃延伸90s,30个循环;72℃延伸10min。pcr结束后,用1%琼脂糖凝胶电泳检测产物,获得了大小约为1470bp的扩增条带,与预期结果相符(图1)。使用胶回收试剂盒(omegabio
‑
tek,货号omega.d2500
‑
01)按照试剂
盒说明书中的操作步骤回收目的基因片段。
44.将回收的目的基因片段和pfastbac
tm
1载体分别进行双酶切。酶切体系为:2μl neb buffer3.1,6μl pfastbac
tm
1质粒/目的基因片段,2μl xho i内切酶(neb,货号#r0146s),2μl nde i内切酶(neb,货号#r0111s),8μl ddh2o。将酶切体系混匀后置于37℃恒温水浴中反应2h。凝胶电泳检测酶切结果,使用胶回收试剂盒(omega bio
‑
tek,货号omega.d2500
‑
01)参照试剂盒说明书回收酶切产物。
45.利用南京诺唯赞生物科技有限公司的clonexpress
®ꢀ
ii one step cloning kit试剂盒(货号c112
‑
01/02)将经过双酶切的目的基因片段定向克隆到经过双酶切的pfastbac
tm
1载体上。连接体系如下:0.65μl pfastbac
tm
1线性化载体、3μl目的基因片段、4μl 5
×
ceⅱbuffer、2μl exnase
ꢀⅱ
、10.35μl ddh2o。37℃连接30min,获得转移载体pfast
‑
gb。通过热激法将构建好的转移载体pfast
‑
gb转化入大肠杆菌dh5α感受态细胞中,次日挑取阳性克隆送北京擎科生物科技有限公司测序鉴定。
46.3. 重组穿梭质粒的构建及鉴定将鉴定正确的转移载体pfast
‑
gb转化入新鲜制备的dh10bac感受态细胞(invitrogen,10361012)中。转化步骤如下:向感受态细胞悬液中加入1
µ
g pfast
‑
gb转移载体,混匀冰浴30min后将其置于42℃水浴80s,然后迅速将其冰浴200s;向管中加入900
µ
l无抗的soc培养基,37℃ 190 rpm震荡培养4小时;取100μl菌液均匀涂布于含卡那霉素(50
µ
g/ml)、庆大霉素(7
µ
g/ml)、四环素(10
µ
g/ml)、x
‑
gal和iptg的lb固体培养基上,37℃培养24h。挑取单个白色菌落,利用特异性引物(gb
‑
f和gb
‑
r)和m13通用引物对其进行pcr鉴定。将鉴定正确的菌液划线培养于含卡那霉素、庆大霉素和四环素的lb固体培养基上,次日再次进行pcr鉴定,获得阳性菌。如图2所示,特异性引物扩增得到大小约为1470 bp的目的条带(泳道1),m13通用引物扩增得到大小约为3770bp(2300bp 插入片段)的条带(泳道2),均与目的片段大小相符,表明重组穿梭质粒(命名为rbac
‑
gb)构建成功。扩大培养阳性菌,采用pure link hi pure plasmid dna purification kits(invitrogen,货号k2100)按照试剂盒说明书提取重组穿梭质粒(rbac
‑
gb)。
47.4. 重组杆状病毒的拯救与传代利用expifectamine sf transfection reagent转染试剂盒(invitrogen,货号a38915)将重组穿梭质粒转染至sf9细胞(昆虫卵巢细胞)。步骤如下:在6孔板中按照0.8
×
106个细胞/孔、1.0
×
106个细胞/孔、1.2
×
106个细胞/孔的密度铺上长势良好的sf9细胞,28℃培养箱中培养2h,使其完全贴壁。将20
ꢀµ
l的sf transfection reagent转染试剂加入到500
ꢀµ
l的opti
‑
mem(gibco
tm
)中,混匀后,25℃孵育5min。将1μg的重组穿梭质粒(rbac
‑
gb)加入到上述溶液中,轻轻混匀,25℃孵育5min。将上述溶液逐滴加入到单层生长的细胞孔中,28℃培养。每天观察细胞状态,待第4天细胞出现较明显病变时,离心收集细胞培养上清得到p0代杆状病毒。将p0代杆状病毒继续盲传至p3代,待鉴定。
48.5. 重组gb蛋白在sf9细胞中的表达及鉴定(1)pcr鉴定提取p2代杆状病毒基因组,利用特异性引物gb
‑
f和gb
‑
r,按照上述pcr反应体系和反应程序进行pcr鉴定。凝胶电泳结果显示,在1470bp左右出现特异性条带(图3),说明gb基因与杆状病毒发生同源重组并成功感染了sf9细胞。
49.(2)间接免疫荧光分析将p2代杆状病毒接种于6孔板中,感染生长良好的sf9细胞,27℃细胞培养箱避光培养72h,当细胞出现变大变圆、细胞边缘不整齐、胞内颗粒状物增多后,吸弃培养基,pbs洗3次以除尽培养基;加4%多聚甲醛室温固定10min,pbs洗3次以除尽多聚甲醛;加0.1%triton 100透化15min,pbs洗3次以除尽triton;加5%bsa室温封闭2h,弃掉封闭液,加抗6
×
his标签的单抗(abcam,货号ab18184)(用封闭液按1:5000稀释),37℃孵育1h后用pbst洗5次;加入fitc标记的山羊抗小鼠igg(sigma
‑
aldrich,货号f5387)(用封闭液按1:1000稀释),室温避光孵育1h,pbst洗5次。荧光显微镜下观察并拍照。结果如图4所示,未感染重组杆状病毒的sf9细胞无荧光(图4a),感染了重组杆状病毒的sf9细胞能检测到明亮的绿色荧光(图4b),表明重组gb蛋白在sf9细胞中成功表达。
50.(3)western blot鉴定将p2代杆状病毒接种于不透气的t175细胞培养瓶中,感染处于对数生长期的sf9细胞,待细胞病变达到70%左右时,将细胞悉数吹下,100
×
g离心6min,分别收取细胞培养上清和细胞沉淀。细胞沉淀用160
µ
l灭菌水重悬。分别将细胞培养上清和细胞沉淀悬浮液与蛋白上样缓冲液混合,沸水浴10min后迅速冰浴5min。sds
‑
page结束后,按照常规转印方法进行转印。转印完毕后pvdf膜用含5%脱脂奶的pbst溶液封闭2h。按照常规western blot操作步骤进行,一抗用抗6
×
his标签的单抗(abcam,货号ab18184)(用封闭液按1:5000稀释)、二抗用hrp标记的山羊抗鼠igg(sigma
‑
aldrich,货号a9309)(用封闭液按1:10000稀释)。结果如图5所示,细胞培养上清(泳道2)和细胞沉淀(泳道3)中均出现特异性条带,表明重组gb蛋白在sf9细胞中成功表达,并且可分泌到细胞培养上清中。
51.(4)重组gb蛋白的高效表达与纯化将p3代杆状病毒接种于细胞摇瓶中,感染处于对数生长期的high five细胞,于接毒后60h离心分别收取细胞培养上清。经离心抽滤后,4℃条件下用蠕动泵挂his柱(qiagen, 货号70971)。然后用梯度浓度的咪唑(20mm、50mm和400mm)纯化并洗脱重组gb蛋白,对各洗脱峰进行sds
‑
page鉴定。结果如图6所示,gb蛋白挂his柱后,50mm咪唑洗脱峰可见较大量的目的蛋白(泳道5)。
52.实施例2. 抗ibrv单克隆抗体的制备与筛选1. 动物免疫首次免疫:将纯化的ibrv病毒液(bartha nu/67标准株)与等体积弗氏完全佐剂(sigma
‑
aldrich,货号f5881)混合并乳化完全后,免疫6~8周龄spf级雌性balb/c小鼠,免疫剂量为50
µ
g/只。首次免疫2周后,将等体积的ibrv病毒液(bartha nu/67标准株)与弗氏不完全佐剂(sigma
‑
aldrich,货号f5506)充分乳化后,进行第2次、第3次和第4次免疫,免疫剂量为50
µ
g/只,每次免疫间隔2周。
53.2. 血清效价测定利用三免后的小鼠阳性血清建立杂交瘤筛选的间接elisa方法,用棋盘法进行最佳抗原包被浓度和最佳阳性血清稀释度的标定。间接elisa方法如下:包被:将实施例1制备的重组gb蛋白以5μg/ml、2.5μg/ml一直倍比稀释至0.1562μg/ml后,按照每孔100μl加入酶标板,酶标板最后一行加入pbst作为抗原阴性对照,37℃孵育1h后,4℃过夜。
54.封闭:用洗板机洗板5次后,每孔加入300μl 5%的脱脂奶(pbst稀释),37℃封闭2h。
55.孵一抗:用pbst对三免后小鼠的阳性及阴性血清依次从1: 400、1: 800一直倍比稀释至1: 12800,洗板后加入,100μl/孔,37℃孵育1h。
56.孵二抗:用pbst将hrp标记的山羊抗小鼠igg(sigma
‑
aldrich,货号a9309)进行1:10000倍稀释,洗板后加入,100μl/孔,37℃孵育1h。
57.显色:洗板后加入tmb显色液(solarbio,货号pr1210),100μl/孔,37℃避光反应15min,加入50μl 2m硫酸终止。读取450nm波长处的吸光值(od
450nm
)。
58.选取od
450nm
值最接近1.0的孔所对应的抗原浓度和血清稀释度为最佳抗原包被浓度(0.625μg/ml)和最佳阳性血清稀释度(1: 6400)。四免后一周进行小鼠眼球采血,采用最佳抗原包被浓度和最佳阳性血清稀释度,按照上述间接elisa方法测定小鼠血清效价。选择效价最高的两只小鼠,于细胞融合前3天进行腹腔加强免疫,免疫剂量为50
µ
g/只。
59.3. 细胞融合和筛选无菌环境下取加强免疫后的balb/c小鼠的脾脏研制成脾细胞悬液,将小鼠脾细胞与sp2/0骨髓瘤细胞按照5:1的细胞数量比进行融合,融合后铺于6块96孔细胞培养板,用含有20%胎牛血清的hat培养基(sigma
‑
aldrich,货号h0262)进行选择性培养,7
‑
12d逐步换用ht培养基(sigma
‑
aldrich,货号h0137)。融合后第10天,分别用实施例1制备的重组gb蛋白和ibrv作为包被抗原,按照上述间接elisa方法对杂交瘤细胞进行初步筛选,重组gb蛋白的包被量为62.5ng/孔,ibrv的包被量为500ng/孔。隔2天重复检测一次,筛选出对重组gb蛋白和ibrv均为抗体阳性的孔。将6块板中所有检测结果为强阳性的孔的融合细胞转到48孔板进行扩大培养,同时选择5个elisa值高的孔进行第一次亚克隆。按照同样的方法再进行2次亚克隆,直到阳性率为100%。获得了1株能稳定分泌单克隆抗体的杂交瘤细胞株,编号为1f24,冻存于液氮罐。杂交瘤细胞株1f24已在中国微生物菌种保藏管理委员会普通微生物中心进行保藏,保藏号为cgmcc no. 23005。
60.4. 单克隆抗体的鉴定(1)western blot鉴定将实施例1制备的重组gb蛋白与蛋白上样缓冲液按照1:5的比例混合均匀,100℃煮沸10min并立即放置于冰上冷却。按照5
µ
l/孔上样后进行sds
‑
page,使用常规湿转方法将聚丙烯酰胺凝胶上的蛋白转印至pvdf膜上。pvdf膜用5%的脱脂奶室温封闭1h;将杂交瘤细胞株1f24的细胞培养上清作为一抗,室温孵育1h;pbst洗膜3次,每次10min;使用hrp标记的山羊抗小鼠igg(sigma
‑
aldrich,货号a9309)(1:10000)作为二抗,室温孵育1h;pbst洗膜3次,每次10min;化学发光并拍照保存。结果显示,1f24单抗与重组gb蛋白发生了特异性反应(图7)。
61.(2)间接免疫荧光鉴定向6孔板中加入无菌飞片和等量mdbk细胞悬液,于37℃,5%co2培养箱中培养细胞成单层,按100 tcid50的病毒量接种ibrv。接毒24h后,用4%多聚甲醛固定10 min,pbs洗3次;0.1% tritonx
‑
100作用15 min,pbs洗3次;用含5% bsa的pbs作为封闭液室温下封闭1h,pbs洗3次;在不同培养孔中分别加1f24杂交瘤细胞培养上清并设置阴性对照和阳性对照(阴性对照为空白对照孔,阳性对照孔加入1:100倍稀释的小鼠ibrv阳性血清),37℃孵育1h,pbs洗3次,每次5min;加fitc标记的山羊抗小鼠igg(sigma
‑
aldrich,货号f5387)(用封
闭液按1:1000稀释),室温避光作用1h,pbs洗3次,每次5min;加dapi(sigma
‑
aldrich,货号d9542)(去离子水1:10000稀释),室温避光作用6min,去离子水洗2次,用防淬灭剂固定在载玻片上,荧光显微镜下观察。结果如图8所示,1f24单抗能与感染了ibrv的mdbk细胞产生特异性绿色荧光(图8a)。
62.(3)单克隆抗体的亚型鉴定使用mouse monoclonal antibody isotyping reagents(sigma
‑
aldrich,货号iso2)按照试剂盒说明书进行单抗亚类鉴定。结果表明,1f24单抗为igg1亚类。
63.(4)腹水的制备及效价测定向spf级balb/c小鼠腹腔注射0.5ml无菌液体石蜡致敏,7d后腹腔注射106个1f24杂交瘤细胞。每天观察小鼠腹腔变化,待其胀至行动不便时,进行腹水采集。所得腹水经thermo的protein a/g纯化柱纯化后,测定浓度并于
‑
80℃保存备用。利用建立的间接elisa方法测定腹水的效价。
64.(5)杂交瘤细胞株1f24分泌单抗的稳定性检测在8个月后,从液氮中取出冻存的杂交瘤细胞株1f24并复苏,然后进行间接elisa检测。结果显示,单克隆抗体的上清效价达到了1:6400,表明杂交瘤细胞株1f24分泌单克隆抗体的活性没有降低。
65.(6)单克隆抗体的特异性鉴定分别取40μl灭活的牛传染性鼻气管炎病毒bartha nu/67株病毒液,牛支原体pd培养液、a型牛多杀性巴氏杆菌pm1菌液、b型牛多杀性巴氏杆菌pm572菌液、牛病毒性腹泻/粘膜病病毒oregon c24v病毒液、野生型杆状病毒rbv
‑
null病毒液与蛋白上样缓冲液混合,沸水浴10min后迅速冰浴5min。sds
‑
page结束后,按照常规转印方法进行转印。转印完毕后pvdf膜用含5%脱脂奶的pbst溶液封闭2h。以1f24单抗为一抗,hrp标记的山羊抗小鼠igg(sigma
‑
aldrich,货号a9309)(1:10000稀释)为二抗,按照常规western blot操作步骤鉴定单克隆抗体的特异性。结果如图9所示,1f24单抗能特异性识别牛传染性鼻气管炎病毒bartha nu/67株(泳道1),与牛支原体pd株(泳道2)、a型牛多杀性巴氏杆菌pm1株(泳道3)、b型牛多杀性巴氏杆菌pm572株(泳道4)、牛病毒性腹泻/粘膜病病毒oregon c24v株(泳道5)、野生型杆状病毒rbv
‑
null株(未插入任何外源基因的杆状病毒)(泳道6)不反应。
66.实施例3. ibrv竞争elisa抗体检测方法的建立1、辣根过氧化物酶标记单抗采用过碘酸钠法对1f24单抗进行辣根过氧化物酶(hrp)标记,步骤如下:(1)称取5mg的hrp(sigma
‑
aldrich,sre0082)溶解于1000 μl的双蒸水中,继续加
入500 μl新配的0.1m naio4,混匀,4℃避光孵育30min。
67.(2)加入500 μl新配的0.2m 乙二醇(sigma
‑
aldrich,324558)溶液,混匀,4℃避光孵育30min。
68.(3)将5mg纯化的1f24单抗加入到上述溶液中,混匀后装入预先处理好的透析袋(solarbio,mw14000),在0.1m ph9.6的碳酸盐缓冲液中过夜透析,透析期间换液三次。
69.(4)将透析完后的液体倒入新的离心管,并加入200μl新配的5mg/ml nabh4,混匀,4℃避光孵育2h。
70.(5)将上述液体倒入洁净烧杯中,并缓慢加入等体积的过饱和(nh4)2so4溶液,3000rpm离心30min,弃上清,沉淀用适量预冷的0.1m ph7.2的pbs溶液重悬。
71.(6)将上述溶液装入透析袋中,0.1m ph9.6的碳酸盐缓冲液中过夜透析,中间换液三次。
72.(7)次日收集透析袋中液体,测定浓度,分装保存于30%的甘油溶液中。
73.2、抗原包被浓度和酶标单抗最佳稀释度的确定用磷酸盐缓冲液(0.02mol/l,ph值6.5
±
0.2)将浓度为2mg/ml的gb重组蛋白(实施例1制备)做1:500、1:1000、1:2000、1:4000稀释后作为包被抗原,按100μl/孔的量包被酶标板。将浓度为1 mg/ml的hrp标记的1f24单抗用酶结合物稀释液按1:1000、1:2000、1:4000、1:8000的比例稀释。用ibrv标准阳性血清和标准阴性血清,与hrp标记的1f24单抗进行竞争elisa,通过棋盘滴定试验,以最高的n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)所对应的浓度分别作为抗原最佳包被浓度和酶标单抗最佳浓度。结果表明,抗原最佳包被浓度为2
µ
g/ml,酶标单抗最佳浓度为0.5
µ
g/ml。
74.3、包被液的选择碳酸盐缓冲液(cb)(0.05mol/l,ph值9.6
±
0.2):称取无水碳酸钠1.59g、碳酸氢钠2.93g,加纯化水定容至1000ml。
75.磷酸盐缓冲液(pb)(0.02mol/l,ph值6.5
±
0.2):称取磷酸氢二钠(含12个结晶水)2.043g、磷酸二氢纳(含2个结晶水)2.227g,加纯化水定容至1000ml。
76.tris缓冲液(tb)(0.01mol/l,ph值8.0
±
0.2):称取tris 1.21g,加纯化水800ml溶解后用hcl调ph值至8.0
±
0.2,再加纯化水定容至1000ml。
77.配制上述三种缓冲液,作为包被液。将gb重组蛋白(实施例1制备)用不同的包被液
分别稀释为2
µ
g/ml,按100μl/孔的量包被酶标板。用ibrv标准阳性血清和标准阴性血清,与hrp标记的1f24单抗(0.5
µ
g/ml)进行竞争elisa,筛选n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)最大的包被液作为最佳包被液。结果显示,磷酸盐缓冲液pb(0.02mol/l,ph值6.5
±
0.2)为最佳包被液。
78.表5使用不同包被液包被后的测定结果包被液cbpbtbn0.9681.5451.234p0.2210.1540.189n/p4.38010.0326.5294、封闭液的选择分别配制含1%bsa 5%蔗糖的pbs溶液(每100mlpbs中加入1gbsa和5g蔗糖)、含0.1�sein 5%蔗糖的pbs溶液(每100mlpbs中加入0.1gcasein和5g蔗糖)、含5%明胶 5%蔗糖的pbs溶液(每100mlpbs中加入5g明胶和5g蔗糖)、含1.5%卵清蛋白 5%蔗糖的pbs溶液(每100mlpbs中加入1.5g卵清蛋白和5g蔗糖),作为封闭液。使用最佳包被液配制2
µ
g/ml的gb蛋白溶液,按100μl/孔的量包被酶标板。分别用这4种封闭液,在2
‑
8℃条件下封闭16~24小时。用ibrv标准阳性血清和标准阴性血清,与hrp标记的1f24单抗(0.5
µ
g/ml)进行竞争elisa,根据n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)确定最佳封闭液。结果显示,以含0.1�sein 5%蔗糖的pbs溶液作为封闭液时,阴性血清od
450nm
值较高且n/p值最大,因此含0.1�sein 5%蔗糖的pbs溶液为最佳封闭液。
79.表6不同封闭液封闭后的测定结果
封闭液1%bsa 5%蔗糖0.1�sein 5%蔗糖5%明胶 5%蔗糖1.5%卵清蛋白 5%蔗糖n1.2751.5470.8261.168p0.2260.1440.1980.165n/p5.64210.7434.1727.079
5、样品稀释液的选择分别配制含1.5%(g/ml)bsa的pbs溶液、含5%(v/v)小牛血清的pbs溶液、含5%(v/v)马血清的pbs溶液,作为样品稀释液。使用最佳包被液配制2
µ
g/ml的gb蛋白溶液,按100μl/孔的量包被酶标板。使用最佳封闭液封闭。分别用3种样品稀释液对ibrv标准阳性血清和标准阴性血清按1:2的比例进行稀释,然后与hrp标记的1f24单抗(0.5
µ
g/ml)进行竞争elisa,根据n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)确定最佳样品稀释液。结果显示,使用1.5%bsa的pbs溶液作为样品稀释液时n/p值最大,因此1.5%bsa的pbs为最佳样品稀释液。
80.表7不同样品稀释液的测定结果样品稀释液1.5%bsa5%小牛血清5%马血清n1.5441.5051.436p0.1030.1580.115n/p14.9909.52512.4876、血清最佳稀释倍数的确定使用最佳包被液配制2
µ
g/ml的gb蛋白溶液,按100μl/孔的量包被酶标板。使用最
佳封闭液封闭。用最佳样品稀释液将ibrv标准阳性血清和标准阴性血清分别按1:2、1:5、1:10、1:20、1:40、1:80稀释后,与hrp标记的1f24单抗(0.5
µ
g/ml)进行竞争elisa,以n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)确定最佳稀释倍数。结果显示,血清稀释倍数为1:2时n/p值最大,所以血清最佳稀释倍数为1:2。
81.表8血清最佳稀释倍数的检测结果血清稀释度1:21:51:101:201:401:80n1.5911.1320.9850.8870.8240.697p0.1040.2040.1590.1780.1660.169n/p值15.2985.5496.1954.9834.9644.1247、反应时间的确定使用最佳包被液配制2
µ
g/ml的gb蛋白溶液,按100μl/孔的量包被酶标板。使用最佳封闭液封闭。用最佳样品稀释液将ibrv标准阳性血清和标准阴性血清分别按1:2稀释后,与hrp标记的1f24单抗(0.5
µ
g/ml)进行竞争elisa。将加样后孵育时间+显色后孵育时间分别设置为在37℃条件下反应15 10分钟、30 10分钟、45 10分钟、60 10分钟,以n/p值(n表示阴性血清od
450nm
均值,p表示阳性血清od
450nm
均值)确定最佳反应时间。结果显示,在加样后37℃孵育30分钟、显色后37℃孵育10分钟的条件下n/p值最大,所以选择30 10分钟为最佳反应时间。
82.表9最佳反应时间的筛选反应时间37℃15 10分钟37℃30 10分钟37℃45 10分钟37℃60 10分钟n0.8751.5471.6261.768p0.0960.1460.1980.265n/p9.11510.5968.2126.6728、ibrv竞争elisa抗体检测试剂盒的制备抗原包被板的制备:将ibrvgb重组蛋白(实施例1制备)用磷酸盐缓冲液(0.02mol/l,ph值6.5
±
0.2)稀释到2
µ
g/ml,以100μl/孔的量加入酶标板中,置2~8℃包被16~24小时。pbst洗板3次,甩掉孔中液体,拍干。加封闭液(含有0.1�sein和5%蔗糖的pbs溶液),150μl/孔,置2~8℃封闭16~24小时。弃封闭液,置室温(15~25℃)干燥20~24小时后,放入干燥剂,装铝箔袋密封,置2~8℃保存。
83.试剂盒组装:将制备好的抗原包被板、酶标单抗(hrp标记的抗ibrv单抗,分泌该单抗的杂交瘤细胞的保藏号为cgmccno.23005)、样品稀释液(含1.5%bsa的pbs溶液)、pbst固体洗液、tmb显色液、终止液(2mh2so4)分别无菌包装后,全部装入试剂盒中,并在试剂盒外壳上贴上试剂盒标签。
84.试剂盒操作步骤如下:(1)平衡:将抗原包被板从冷藏环境中取出,置室温下平衡至室温(15~25℃)后使用。其它液体试剂在使用前轻轻旋转或振荡混匀。
85.(2)洗涤液配制:用500ml纯化水完全溶解5gpbst固体洗液,备用。
86.(3)样品准备:在血清稀释板中,用样品稀释液将待检样品按照1:2进行稀释。阴性对照和阳性对照(ibrv标准阴性血清和标准阳性血清)直接使用不做稀释。每份样品在添加到抗原包被板之前应混匀。
87.(4)加样:在血清稀释板上加入阴性对照、阳性对照60μl/孔,样品孔加入60μl稀释的样品,再向以上各孔加入60μl酶标单抗(0.5
µ
g/ml)。振荡混匀,每孔吸取100μl转移至抗原包被板对应孔内,每块板可检测样品92份,设阳性对照2孔、阴性对照2孔。每次加样后均需更换吸头,并准确记录每个样品在板上的位置。
88.(5)孵育:置37℃恒温培养箱内孵育30分钟。
89.(6)洗板:将各孔的液体弃入废液筒,每孔加入洗涤液280
µ
l,弃去洗涤液,连续洗涤5次。在最后一次洗涤液弃去后,将孔中残留的洗涤液在吸水纸上拍干。
90.(7)显色:将显色液的a、b组分等比例混匀后,每孔加入100
µ
l。置37℃恒温培养箱内孵育10分钟。
91.(8)终止:各孔加入50
µ
l终止液,终止反应。
92.(9)测定:测定并且记录样品和对照血清在450nm波长处的吸光值(od
450nm
值)。
93.试剂盒临界值的确定采用上述试剂盒,按照试剂盒操作步骤对460份牛血清样品(ibrv抗体阴性血清300份、ibrv抗体阳性血清160份)进行检测,测定所有样品的od
450nm
值,并计算s/n值。s/n值=样品od
450nm
值/阴性对照od
450nm
平均值。阴性对照od
450nm
平均值=(阴性对照1号孔的od
450nm
值+阴性对照2号孔的od
450nm
值)/2。
94.以血清背景结果与本试剂盒的检测结果为基础,采用spss16.0分析所检样品(460份牛血清样品)的s/n值与敏感性、特异性的对应关系,以真阳性(敏感性)为纵坐标,假阳性率(100
‑
特异性)为横坐标,绘制roc曲线(图10),曲线上的每一个点分别代表该s/n值所对应的敏感性和特异性。以roc曲线下面积值(auc)为评判标准,评价诊断方法的准确性。在auc>0.5的情况下,auc越接近1,说明诊断效果越好,auc在0.5~0.7时有较低的准确性,auc在0.7~0.9时有一定的准确性,auc在0.9以上时有较高的准确性。根据roc曲线结果的分析,本发明的试剂盒对460份血清s/n值检测结果所对应的roc曲线下面积值为0.978,标准误差为0.00556,95%的置信区间为0.961
‑
0.990,z统计量为86.048,显著性水平p(area=0.5)<0.0001,说明本发明的试剂盒检测方法具有很高的准确度,可进行下一步临界值的确定。
95.以约登指数最大的切点分别作为s/n值的临界值。约登指数(youden)是评价筛查试验真实性的一种方法,约登指数是敏感性与特异性之和减1,表示筛检方法鉴别阴性样品和阳性样品的总能力,指数越大说明筛查效果越好,其真实性越大。通过计算每个样品的s/n值对应的约登指数,并分别选择约登指数最大时的s/n值作为本方法的临界值。从表10中可以看出,最大约登指数是0.909,所对应的s/n值为0.696,接近0.7。因此,将本方法的s/n值临界值确定为0.7,并确定本方法的判定标准为:如果s/n值>0.7,将样品判定为ibrv抗体阴性;如果s/n值≤0.7,将样品判定为ibrv抗体阳性。
96.表10不同s/n值所对应的敏感性、特异性结果
标准(s/n值)敏感性(%)特异性(%)约登指数标准(s/n值)敏感性(%)特异性(%)约登指数<0.30701000.000≤0.67787.5960.835≤0.5431.251000.313≤0.67988.7595.330.841≤0.54231.8799.670.315≤0.68190.6295.330.860≤0.59651.8899.670.516≤0.68390.62950.856≤0.59852.599.330.518≤0.68492.5950.875
≤0.59952.5990.515≤0.68692.594.670.872≤0.60555990.540≤0.69696.2594.670.909≤0.60755.6398.670.543≤0.71196.2592.330.886≤0.61557.598.670.562≤0.71396.8792.330.892≤0.61657.598.330.558≤0.74396.8785.330.822≤0.62459.3898.330.577≤0.74497.584.330.818≤0.62559.3897.670.571≤0.75897.581.330.788≤0.64169.3797.670.670≤0.7698.1280.670.788≤0.64271.2597.330.686≤0.77398.12780.761≤0.6457597.330.723≤0.77498.75780.768≤0.64675970.720≤0.78698.7574.670.734≤0.65176.87970.739≤0.78899.3773.670.730≤0.65476.8796.670.735≤0.80199.3771.670.710≤0.65978.7596.670.754≤0.80310071.670.717≤0.66178.7596.330.751≤1.82510000.000≤0.67587.596.330.838
ꢀꢀꢀꢀ
实施例4.本发明的ibrv竞争elisa抗体检测试剂盒的性能检验1.敏感性检验采用实施例3制备的ibrv竞争elisa抗体检测试剂盒(简称本发明的试剂盒)检测30份由北京市农林科学院制备、鉴定和保存的ibrv抗体弱阳性血清。结果如表11所示,29份血清样品s/n值都在0.400~0.700之间,只有1份血清样品s/n值为0.722,在0.700~0.750之间,与中和试验的阳性符合率为96.67%。
97.表11本发明的试剂盒对30份弱阳性血清的检测结果 本发明的试剂盒本发明的试剂盒中和试验血清编号od
450nm
值s/n值效价mp10.7720.5001:2mp20.8640.5601:4mp30.7600.4931:4mp40.6910.4481:4mp50.9030.5851:4mp60.8330.5401:4mp70.8990.5831:4mp80.9910.6421:2mp90.9270.6011:2mp100.9850.6391:2mp110.8050.5221:2mp120.7390.4791:4mp130.9790.6351:4mp141.0270.6661:4mp151.0270.6661:4mp161.1140.7221:2
mp171.0140.6571:4mp180.9320.6041:4mp191.0020.6501:8mp200.8550.5541:8mp210.9000.5841:8mp220.9450.6121:8mp231.0140.6571:8mp240.9320.6041:8mp251.0020.6501:8mp260.8550.5541:8mp270.9000.5841:8mp280.8050.5221:8mp290.7390.4791:8mp300.9790.6351:8nc
`x
1.543
ꢀꢀ
pc
`x
0.087
ꢀꢀ
注:s/n值=样品od
450nm
值/阴性对照od
450nm
值。nc
`x
代表阴性对照(ibrv标准阴性血清),pc
`x
代表阳性对照(ibrv标准阳性血清)。
98.2. 一致性检验分别采用中和实验、本发明的试剂盒以及美国爱德士公司的idexx牛传染性鼻气管炎病毒(ibr)gb x3抗体检测试剂盒(简称为idexx试剂盒,产品编码99
‑
41299)对170份田间采集的牛传染性鼻气管炎灭活疫苗免疫和非免疫血清样品进行检测。本发明的试剂盒的操作步骤参照实施例3,idexx试剂盒的操作步骤参照试剂盒说明书。
99.中和实验的具体操作步骤如下:(1)提前一天将mdbk细胞传至96孔板,以保证试验用细胞处于对数生长期。
100.(2)将血清置于56℃水浴灭活30分钟。
101.(3)用无血清dmem将待检血清和ibrv标准阴性血清和标准阳性血清从1:4、1:8依次稀释至1:256,分别将待检血清和标准阴阳性血清加到96孔细胞培养板孔中,每孔60μl,每组重复2孔,最后一行加待检血清做血清毒性对照。
102.(4)每孔加200tcid
50
/100μl的病毒悬液60μl。在血清毒性对照孔中加入60μl无血清dmem代替病毒稀释液。
103.(5)用无血清dmem将100tcid
50
/100μl的病毒液做3次10倍连续稀释,每一个稀释度4孔,每孔加病毒悬液60μl,做病毒回归对照。
104.(6)将培养板置于37℃ co2培养箱中和1小时。
105.(7)吸取100μl上述混合液,加入到单层生长的mdbk细胞中去,37℃孵育1小时后,用维持液替换掉孔中液体,37℃ co2培养箱培养4日。
106.(8)用倒置显微镜观察细胞病变情况。检查回归滴度,病毒回归对照在100tcid
50
/100μl和10tcid
50
/100μl均出现病变,1tcid
50
/100μl孔半数细胞出现病变,0 tcid
50
/100μl孔未出现细胞病变。阴性血清对照均出现细胞病变,血清毒性对照未出现病变。
107.结果见表12,在170份血清中,中和实验的检测结果为ibrv抗体阳性的血清83份,ibrv抗体阴性的血清87份。本发明的试剂盒的检测结果为ibrv抗体阳性的血清77份,ibrv抗体阴性的血清93份;idexx试剂盒的检测结果为ibrv抗体阳性的血清80份,ibrv抗体阴性的血清90份。
108.表12 三种方法对170份临床血清的检测结果汇总
ꢀꢀ
本发明试剂盒本发明试剂盒本发明试剂盒idexx试剂盒idexx试剂盒idexx试剂盒中和试验中和试验血清编号检验编号od
450nm
s/n判定od
450nm
阻断率(%)判定效价判定210.9610.601 0.00199.93 1:16 420.1140.071 0.0894.61 1:32 630.8980.562 0.06595.62 1:32 740.9450.591 0.02198.58 1:8 950.3030.190 0.04596.97 1:8 1260.4760.298 0.10293.13 1:16 1370.7760.485 0.12591.58 1:16 1480.6780.424 0.06595.62 1:8 1690.4110.257 0.11292.45 1:8 19100.6880.430 0.03797.51 1:16 21110.3060.191 0.07894.74 1:32 28121.0280.643 0.15689.49 1:16 30130.2720.170 0.03797.51 1:8 31140.2120.133 0.0795.28 1:16 35150.9970.624 0.88640.30
‑
1:16 37161.0790.675 0.10592.92 1:16 40170.8450.528 0.01399.12 1:8 41180.9020.564 0.06395.75 1:8 42190.9610.601 0.10193.19 1:8 43200.3430.215 0.12491.64 1:8 44210.9920.62 0.26782.01 1:16 50220.9660.604 0.09293.80 1:16 54231.3800.863
‑
0.10393.06 1:8 57240.2150.135 0.09993.33 1:8 58250.1530.096 0.15589.56 1:8 60260.4360.273 0.04297.17 1:16 61270.1080.068 0.05996.02 1:16 66281.3400.838
‑
0.08694.20 1:8 67290.5860.367 0.16788.75 1:8 73300.1970.123 0.12691.51 1:16 75310.7230.452 0.14190.50 1:32 76320.4690.293 0.06695.55 1:16 77331.3670.855
‑
0.03597.64 1:8 85340.1880.118 0.193.26 1:8 87350.6730.421 0.10592.92 1:16 90360.7870.492 0.04896.77 1:32 92371.0490.656 0.93237.20
‑
1:8 109380.6570.411 0.05196.56 1:8 129390.2080.130 0.09593.60 1:8 141400.4950.309 0.02198.58 1:16 165410.7340.459 0.05596.29 1:16 166420.2100.131 0.1391.24 1:16 1022430.5540.347 0.13490.97 1:8 1238440.2510.157 0.1192.59 1:16 1404451.0460.654 0.06395.75 1:16 1520460.1570.098 0.08794.14 1:8
1613470.2850.178 0.18787.40 1:32 2003480.7000.438 0.02698.25 1:8 2047490.2510.157 0.06195.89 1:8 2057500.3630.227 0.05796.16 1:16 2085510.4400.275 0.04497.04 1:16 2275520.5810.363 0.12691.51 1:16 3088530.2800.175 0.14890.03 1:8 4062540.4990.312 0.07594.95 1:32 4063550.3870.242 0.12991.31 1:16 5084560.2800.175 0.06395.75 1:16 5098570.4320.270 0.07694.88 1:32 6002580.2470.155 0.07694.88 1:16 7013591.6021.002
‑
0.06795.49 1:8 7101600.9740.609 0.02898.11 1:8 7224610.6100.382 0.05296.50 1:8 8010620.4600.288 0.12191.85 1:8 8044630.1290.081 0.10992.65 1:16 8054641.5150.947
‑
0.21185.78 1:16 8073650.3570.223 0.13490.97 1:8 9843660.8130.509 0.09793.46 1:16 9846670.6930.434 0.08994.00 1:16 9847680.9780.612 0.09193.87 1:16 11003690.6390.400 0.03897.44 1:8 13090701.3530.846
‑
0.91638.27
‑
1:16 13125710.8040.503 0.95635.58
‑
1:4 14063720.4990.312 0.13291.11 1:8 14071730.1720.108 0.12291.78 1:16 15003740.1470.092 1.01431.67
‑
1:4 15032750.3620.226 0.03897.44 1:32 15081760.1290.081 0.13890.70 1:16 16002770.8050.504 0.12491.64 1:32 16016780.7260.454 0.04297.17 1:8 18013790.5530.346 0.05696.23 1:8 18044801.0520.658 0.15689.49 1:16 30201810.1690.106 0.14190.50 1:8 130103820.1020.064 0.12291.78 1:16 140103831.0400.650 0.08494.34 1:32 nc
`x
1.599
ꢀꢀ
0.156
ꢀꢀꢀꢀꢀ
pc
`x
0.114
ꢀꢀ
1.484
ꢀꢀꢀꢀ
12210841.4640.947
‑
0.91633.58
‑
<1:2
‑
140959851.3400.867
‑
1.2549.06
‑
<1:2
‑
141176861.6021.036
‑
1.3561.67
‑
<1:2
‑
141283871.5611.010
‑
1.12118.71
‑
<1:2
‑
141284881.4130.914
‑
2.011
‑
45.83
‑
<1:2
‑
140957891.4670.949
‑
1.548
‑
12.26
‑
<1:2
‑
140950901.4390.931
‑
1.3224.13
‑
<1:2
‑
140637911.3870.897
‑
1.755
‑
27.27
‑
<1:2
‑
131058921.3850.896
‑
1.2469.64
‑
<1:2
‑
140526931.4020.907
‑
1.2558.99
‑
<1:2
‑
140216941.3900.899
‑
1.547
‑
12.18
‑
<1:2
‑
141063951.5340.992
‑
0.98728.43
‑
<1:2
‑
141061961.5320.991
‑
1.01126.69
‑
<1:2
‑
140528971.5040.973
‑
1.21112.18
‑
<1:2
‑
130845981.4840.960
‑
1.855
‑
34.52
‑
<1:2
‑
141064991.3930.901
‑
1.644
‑
19.22
‑
<1:2
‑
1410721001.3030.843
‑
1.21112.18
‑
<1:2
‑
1407401011.3810.893
‑
1.512
‑
9.64
‑
<1:2
‑
1409541021.3570.878
‑
1.714
‑
24.29
‑
<1:2
‑
1408461031.5551.006
‑
2.135
‑
54.82
‑
<1:2
‑
1407441041.3420.868
‑
1.2549.06
‑
<1:2
‑
1402111051.3540.876
‑
2.312
‑
67.66
‑
<1:2
‑
1407381061.3280.859
‑
1.2578.85
‑
<1:2
‑
1405311071.4130.914
‑
1.3541.81
‑
<1:2
‑
1403241081.4860.961
‑
1.456
‑
5.58
‑
<1:2
‑
1410641091.2890.834
‑
1.512
‑
9.64
‑
<1:2
‑
1402121101.5320.991
‑
1.611
‑
16.82
‑
<1:2
‑
1409531111.5100.977
‑
0.87936.26
‑
<1:2
‑
1411781121.3790.892
‑
0.91733.50
‑
<1:2
‑
1407421131.5140.979
‑
0.98828.35
‑
<1:2
‑
1408471141.3250.857
‑
1.02225.89
‑
<1:2
‑
1403231151.3790.892
‑
1.3313.48
‑
<1:2
‑
1408451161.2940.837
‑
1.451
‑
5.22
‑
<1:2
‑
1303161171.2850.831
‑
1.2549.06
‑
<1:2
‑
1407411181.4690.950
‑
1.578
‑
14.43
‑
<1:2
‑
1408481191.5370.994
‑
2.344
‑
69.98
‑
<1:2
‑
1410741201.4040.908
‑
2.125
‑
54.10
‑
<1:2
‑
1411771211.4020.907
‑
1.877
‑
36.11
‑
<1:2
‑
1410681221.3620.881
‑
0.58957.29 <1:2
‑
1409571231.3940.902
‑
1.3253.92
‑
<1:2
‑
1408471241.2520.810
‑
1.2449.79
‑
<1:2
‑
1410731251.2480.807
‑
1.3253.92
‑
<1:2
‑
1403231261.3990.905
‑
1.466
‑
6.31
‑
<1:2
‑
1312731271.4500.938
‑
1.754
‑
27.19
‑
<1:2
‑
1410671281.2210.790
‑
1.854
‑
34.45
‑
<1:2
‑
1402121291.3230.856
‑
1.11119.43
‑
<1:2
‑
1407431301.3900.899
‑
1.22511.17
‑
<1:2
‑
1402131311.5120.978
‑
1.3621.23
‑
<1:2
‑
1403221321.4210.919
‑
2.131
‑
54.53
‑
<1:2
‑
1405281331.3560.877
‑
1.3323.41
‑
<1:2
‑
1405301341.4010.906
‑
1.521
‑
10.30
‑
<1:2
‑
1602111351.4250.922
‑
1.422
‑
3.12
‑
<1:2
‑
1412821361.2580.814
‑
1.05823.28
‑
<1:2
‑
1403201371.2710.822
‑
1.02325.82
‑
<1:2
‑
1407381381.3050.844
‑
1.21112.18
‑
<1:2
‑
1409491391.4920.965
‑
2.023
‑
46.70
‑
<1:2
‑
1402141401.4220.920
‑
1.741
‑
26.25
‑
<1:2
‑
00941411.3250.857
‑
0.45766.86 <1:2
‑
1411771421.3740.889
‑
1.21212.11
‑
<1:2
‑
1407391431.4300.925
‑
1.3521.96
‑
<1:2
‑
1411761441.3910.900
‑
1.443
‑
4.64
‑
<1:2
‑
1203181451.1460.741
‑
1.521
‑
10.30
‑
<1:2
‑
1410621461.1890.769
‑
1.11019.51
‑
<1:2
‑
1212761471.5210.984
‑
1.21212.11
‑
<1:2
‑
1409581481.1520.745
‑
1.3124.86
‑
<1:2
‑
1408481491.3430.869
‑
1.412
‑
2.39
‑
<1:2
‑
1411091501.3640.882
‑
1.3541.81
‑
<1:2
‑
1409541511.3620.881
‑
1.452
‑
5.29
‑
<1:2
‑
1604201521.3900.899
‑
1.03325.09
‑
<1:2
‑
1405271531.1970.774
‑
1.15216.46
‑
<1:2
‑
1407391541.4290.924
‑
1.789
‑
29.73
‑
<1:2
‑
1405291551.2750.825
‑
0.96629.95
‑
<1:2
‑
1410741561.2620.816
‑
1.854
‑
34.45
‑
<1:2
‑
1403171571.2180.788
‑
1.2549.06
‑
<1:2
‑
1403201581.3740.889
‑
1.3114.93
‑
<1:2
‑
1507541591.5010.971
‑
1.454
‑
5.44
‑
<1:2
‑
1402151601.3130.849
‑
1.789
‑
29.73
‑
<1:2
‑
1406361611.3230.856
‑
0.94531.47
‑
<1:2
‑
1410671621.2890.834
‑
0.99727.70
‑
<1:2
‑
1411811631.3260.858
‑
0.96530.02
‑
<1:2
‑
1406371641.2570.813
‑
1.02225.89
‑
<1:2
‑
1501131651.2680.820
‑
1.13917.40
‑
<1:2
‑
1410661661.3530.875
‑
1.19513.34
‑
<1:2
‑
1211701671.6361.058
‑
1.3214.21
‑
<1:2
‑
89461681.4840.960
‑
1.411
‑
2.32
‑
<1:2
‑
1310541691.3310.861
‑
1.522
‑
10.37
‑
<1:2
‑
1204261701.5090.976
‑
1.541
‑
11.75
‑
<1:2
‑ꢀ
nc1.546
ꢀꢀ
0.124
ꢀꢀꢀꢀꢀ
pc0.105
ꢀꢀ
1.379
ꢀꢀꢀꢀ
注:本发明的试剂盒检测结果的判定标准:如果s/n值>0.7,样品应判定为ibrv抗体阴性;如果s/n值≤0.7,样品应判定为ibrv抗体阳性。idexx试剂盒检测结果的判定标准:阻断率%<45为ibrv抗体阴性;55>阻断率%≥45为可疑;阻断率%≥55为ibrv抗体阳性。s/n值=样品od
450nm
值/阴性对照od
450nm
值。nc
`x
和nc代表阴性对照(ibrv标准阴性血清),pc
`x
和pc代表阳性对照(ibrv标准阳性血清)。
[0109] 本发明的试剂盒与中和试验的检测结果比较:本发明的试剂盒检测出77份阳性,其中77份与中和试验一致;检出93份阴性,其中87份与中和试验一致(表12)。因此,本发明的试剂盒与中和试验的总符合率为96.47%,其中阳性符合率为92.77%,阴性符合率为100%(统计结果见表13)。
[0110]
表13本发明的试剂盒与中和试验的符合率
ꢀꢀ
中和试验中和试验合计
ꢀꢀ
‑ꢀ
本发明的试剂盒 77077本发明的试剂盒
‑
68793总计 8387170阳性符合率
ꢀꢀꢀ
92.77%=(77/83)
×
100%阴性符合率
ꢀꢀꢀ
100%=(87/87)
×
100%总符合率
ꢀꢀꢀ
96.47%=(77 87)/170
×
100%idexx试剂盒与中和试验的检测结果比较:idexx试剂盒检测出80份阳性,其中78份与中和试验一致;检出90份阴性,其中85份与中和试验一致(表12)。因此,idexx试剂盒与中和试验的总符合率为95.88%,其中阳性符合率为93.98%,阴性符合率为97.70%(统计结果见表14)。
[0111]
表14idexx试剂盒与中和试验符合率
ꢀꢀ
中和试验中和试验合计
ꢀꢀ
‑ꢀ
idexx试剂盒 78280
idexx试剂盒
‑
58590总计 8387170阳性符合率
ꢀꢀꢀ
93.98%=(78/83)
×
100%阴性符合率
ꢀꢀꢀ
97.70%=(85/87)
×
100%总符合率
ꢀꢀꢀ
95.88%=(78 85)/170
×
100%本发明的试剂盒与idexx试剂盒的比较:在检测的170份血清中,两种试剂盒共同检测出73份阳性和86份阴性,本发明的试剂盒与idexx试剂盒的阳性符合率91.25%,阴性符合率为95.56%,总符合率93.53%(表15)。
[0112]
表15本发明的试剂盒与idexx试剂盒的符合率
ꢀꢀ
idexx试剂盒idexx试剂盒合计
ꢀꢀ
‑ꢀ
本发明的试剂盒 73477本发明的试剂盒
‑
78693合计 8090170阳性符合率
ꢀꢀꢀ
91.25%=(73/80)
×
100%阴性符合率
ꢀꢀꢀ
95.56%=(86/90)
×
100%总符合率
ꢀꢀꢀ
93.53%=(73 86)/170
×
100%
3.灵敏度检验将ibrv标准阳性血清按1:8、1:16、1:32、1:64、1:128、1:256、1:512、1:1024进行稀释,用本发明的试剂盒和idexx试剂盒分别按照说明书对各个稀释度的标准阳性血清进行检测,同时用中和试验对1:2、1:4、1:8、1:16、1:32、1:64、1:128稀释度的标准阳性血清进行检测,以确定试剂盒的灵敏度。结果如表16所示,本发明的试剂盒可检测到1:256的稀释度,idexx试剂盒可检测到1:128的稀释度,中和试验可检测到1:32的稀释度。
[0113]
表16试剂盒灵敏度试验 本发明试剂盒本发明试剂盒idexx试剂盒idexx试剂盒中和试验稀释倍数od
450nm
s/nod
450nm
阻断率%检测结果1:2//// 1:4//// 1:80.1450.0920.06795.33 1:160.1890.1200.20885.49 1:320.2910.1850.31278.22 1:640.4190.2660.49665.44
‑
1:1280.6550.4160.62656.34
‑
1:2560.8810.5600.87239.18/1:5121.2040.7650.93934.55/1:10241.2720.8081.17318.22/nc
`x
1.574/0.103//pc
`x
0.103/1.434//注:本发明的试剂盒检测结果的判定标准:如果s/n值>0.7,样品应判定为ibrv抗
体阴性;如果s/n值≤0.7,样品应判定为ibrv抗体阳性。idexx试剂盒检测结果的判定标准;阻断率%<45为ibrv抗体阴性;55>阻断率%≥45为可疑;阻断率%≥55为ibrv抗体阳性。中和试验的检测结果:“ ”代表该稀释度能中和病毒;
“‑”
代表该稀释度不能中和病毒。s/n值=样品od
450nm
值/阴性对照od
450nm
值。nc
`x
代表阴性对照(ibrv标准阴性血清),pc x
代表阳性对照(ibrv标准阳性血清)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

