1.本发明属于生物技术领域,涉及一种具有抗真菌作用的抗菌肽及其制备方法和应用。
背景技术:
2.真菌疾病影响着植物和动物,同时也对全球的粮食安全以及人类健康产生很大的影响。真菌感染可导致人类患有严重甚至威胁生命的疾病。长期服用强力抗生素的患者可能会增加真菌感染的风险,因为抗生素会同时杀死有害和有益的微生物,导致身体某些部位如肠道和口腔的微生物平衡发生变化。然而,真菌感染相比于病毒和细菌感染很少受到外界的关注,因为后者传播迅速并且对人类健康有很大影响。但一些真菌病原体也会引起严重的疾病,随着医学上治疗艾滋病、癌症以及器官移植等方面的进步,导致免疫系统受损的人数增加,这些人很容易受到真菌感染。医院感染中,白色念珠菌(candida albicans)是最常见的真菌病原体之一,其在人类中的发生率很高,与全身性真菌相关感染的死亡率接近50%,在一些发展中国家,一些真菌病原体引起的死亡率可达到100%。当前用抗真菌药物治疗真菌感染存在一些问题,首先可用于治疗人类真菌病原体的抗真菌药物种类有限,由于真菌在进化上接近人类,抗真菌药物开发的差异靶点相对较少,并且一些抗真菌药物具有产生副作用的倾向。目前临床上仅有五大类抗真菌药物,分别为多烯类、烯丙胺类、氮唑类、嘧啶类似物和棘白菌素,这些抗菌药物主要通过口服、局部或静脉输液来治疗人类的真菌感染。其次,许多真菌物种对某些抗真菌药物具有内在抗性,这种抗性的机制尚未完全阐明。
3.抗菌肽(antimicrobial peptides,amps)自20世纪80年代末被发现以来,一直被视为解决抗微生物耐药性危机的药物之一。amps是一种具有广谱抗菌和免疫调节作用的低分子量蛋白,对感染性细菌、病毒和真菌等具有活性,因此amps已被定义为针对病原微生物的新治疗策略的有效候选药物。amps长度在12到50个氨基酸之间,通常带正电荷并具有两亲性,可与细胞膜发生相互作用。amps在序列和结构方面多样,通常根据它们的构象可分为α
‑
螺旋、β
‑
折叠、环状或具有延伸结构的肽。而wang(2015)根据多肽链的连接模式对amps进行分类,分别为线性多肽链ucll(如ll
‑
37和蛙皮素)、侧链连接肽ucss(如防御素和硫醚抗生素)、侧链与骨干连接的多肽链ucsb(如lassos)、具有无缝骨架的环状肽ucbb(例如环肽类)。目前抗真菌药物大多数是与病原微生物的膜结合,或者通过抑制某些生物合成来靶向膜上的麦角固醇。而amps主要通过破坏细胞膜的不同机制杀死病原微生物。与此同时,还发现amps靶向病原微生物关键细胞的过程。很明显,与传统的抗真菌药物相比,amps作用机制具有非特异性,这种特性有望限制病原微生物产生耐药性。
4.在有关文献中已经报道了一些amps对白色念珠菌具有良好的抗菌活性,例如人乳铁蛋白(hlf)是一种结合铁并具有蛋白酶作用的肽,hlf存在于唾液和人体其他分泌物中,已经发现它对白色念珠菌具有活性,hlf1
‑
11在早期抑制白色念珠菌生物膜形成,干扰生物膜细胞密度和代谢活性,并诱导生物膜和菌丝相关基因的下调表达;实验表明ll
‑
37和rk
‑
31影响念珠菌的细胞膜渗透率,对白色念珠菌具有较高的杀菌活性,人ll
‑
37可以通过与酵母细胞壁碳水化合物的相互作用抑制白色念珠菌对组织的粘附,ll
‑
37还可裂解为对白色念珠菌具有较高杀真菌活性的短肽;histatin
‑
5是唾液蛋白histatin
‑
3的一个片段,包含有24个氨基酸。该肽具有很强的杀真菌活性,能够杀死酵母和丝状念珠菌。即使在低浓度下(15
‑
30μm),histatin
‑
5也可以通过与一个候选的67kda蛋白结合,然后干扰非溶解性atp外排发挥其杀菌活性。此外,histatin
‑
5能够显著干扰白色念珠菌生物膜的形成。
5.基于amps的重要作用,许多学者开展新型amps的寻找及制备研究。寻找和制备amps有三种途径:化学合成,生物工程(重组技术)和从植物、动物、微生物及其它生物中筛选天然的amps。虽然生物工程可以大规模生产amps,但生物工程仍然存在不正确转录而导致折叠不准确的蛋白质、表达蛋白活性较低甚至没活性、核心技术仅被为数不多的科学家和公司掌握等问题。尽管存在大量的天然生物活性amps,并且它们具有作为抗真菌剂的巨大潜力,但天然amps的分离通常工艺繁琐、过程繁琐、含量偏低、价格昂贵,不适合进行规模化生产。amps分子在临床应用中仍存在一些问题。主要缺点可能是在治疗浓度下对哺乳动物细胞产生潜在毒性。此外,在生物体液中生理离子和盐浓度存在下,一些amps会失去活性。对amps的作用机理和构效关系认识的提高,可以识别需要改进肽的特定特征及关键修饰,以获得适合临床应用的amps。因此,在许多情况下,根据已知的或设计的amps序列信息,利用多肽的化学合成方法可以经济的产生更有效的amps分子。此外化学合成方法还具有制备简单、不易降解、结构容易修饰和抗菌活性容易优化等优点。
技术实现要素:
6.本发明的目的在于克服现有技术的不足,一种具有抗真菌作用的抗菌肽及其制备方法和应用。
7.本发明是通过以下技术方案实现的:
8.本发明提供了一种具有抗真菌作用的抗菌肽,其氨基酸序列为ac
‑
wkkwfr
‑
nh2,依据抗菌肽的氨基酸序列,利用固相合成的方法从抗菌肽的c端到n端人工合成。其分子量为991.1da,等电点为12.4,对白色念珠菌具有抗菌活性,对白色念珠菌最小抑菌浓度为50μg/ml。
9.本发明同时提供了抗菌肽的制备方法,包括以下步骤:
10.(1)取适量树脂置于固相反应器中,加dmf(二甲基甲酰胺)洗涤1次,然后用dcm(二氯甲烷)溶胀10
‑
15min,抽掉dcm;
11.(2)加dblk溶液(六氢吡啶 dmf)脱保护2次(时间分别为10min和15min)。中间用dmf洗涤1次。脱完保护后,用dmf洗涤6次;
12.(3)取少量树脂滴加凯撒试剂茚检,如树脂显蓝色则继续进行氨基酸偶联反应。
13.(4)取4eq(投料比,材料与树脂比)的氨基酸、4eq的hbtu(苯并三氮唑
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯)、4eq的hobt(1
‑
羟基苯并三氮唑)置于反应器中,加dmf溶解后,滴加8eq的diea,室温下反应2小时,然后dmf洗涤3次;
14.(5)取少量树脂滴加凯瑟试剂茚检,树脂若透明无色,重复(2)到(4)步进行下一个氨基酸偶联反应直至反应结束。
15.(6)从树脂上用切割液切割合成的多肽,然后吹干、洗涤和冷干,即得抗菌肽。
16.本发明利用常规的hplc法和质谱法对制备的抗菌肽的纯度及分子量进行检测;采用常规的微量稀释测定法测定所得抗菌肽对白色念珠菌的抗菌活性;采用结晶紫染色法检测抗菌肽对白色念珠菌细胞壁完整性的影响;使用紫外分光光度计法检测抗菌肽对白色念珠菌细胞膜渗透率的影响;采用电子显微镜检测抗菌肽处理白色念珠菌后的细胞微观结构变化;利用结晶紫法检测抗菌肽抑制白色念珠菌生物膜形成的效果;通过测定2’,7
’‑
二氯荧光素(2’,7
’‑
dichlorofluorescein,dcf)荧光强度来检测抗菌肽处理对白色念珠菌胞内ros产生的影响;利用电泳迁移率变动分析检测抗菌肽与白色念珠菌基因组dna结合能力;通过测定血红蛋白释放来检测抗菌肽的溶血活性;通过测定最小抑菌浓度来评估白色念珠菌对抗菌肽的耐药性;通过抗菌肽对感染大蜡螟幼虫的体内抗菌活性检测来评价抗菌肽对感染白色念珠菌大蜡螟幼虫的治疗效果。
17.本发明所述制备的抗菌肽对对白色念珠菌具有抗菌活性,对白色念珠菌的最小抑菌浓度为50μg/ml,最小杀菌浓度为125μg/ml。抗菌肽可破坏白色念珠菌细胞壁完整性,短时间内造成细胞膜渗透率增加。抗菌肽处理的白色念珠菌细胞结构异常且不规则,造成细胞胞浆原生质紊乱,电子密度不均一,细胞内部出现多个空泡。可与白色念珠菌基因组dna结合,诱导胞内ros的增加。对兔红细胞的溶血活性较低,抗菌肽连续处理14天未见白色念珠菌耐药性产生。抗菌肽处理能显著提高感染白色念珠菌的大蜡螟幼虫存活率,处理72h后可完全清除幼虫体内感染的真菌。
18.本发明的有益效果如下:本发明具有制备简单、生产周期短、产品不易降解、结构容易修饰和抗菌活性容易优化等优点。本发明制备的抗菌肽具有纯度高、抗菌活性好、作用机制独特、溶血活性低、不诱发耐药性产生等特点。该抗菌肽制品为白色粉末,分子量为991.1da,氨基酸序列为ac
‑
wkkwfr
‑
nh2,具有典型的两亲性结构,碱性氨基酸聚集在同一边。对白色念珠菌具有抗菌活性,对白色念珠菌最小抑菌浓度为50μg/ml。与抗生素两性霉素b具有协同增效作用。与传统抗生素相比,该制品主要是通过作用于没有特异性受体的细胞壁、细胞膜及胞内的作用机制来抑杀真菌,因此不易诱导微生物对其产生耐药性。对白色念珠菌侵染大蜡螟的治疗效果上,不同剂量的抗菌肽均能显著提高感染白色念珠菌的幼虫存活率。处理72h后可完全清除幼虫体内感染的白色念珠菌。组织病理学分析表明,抗菌肽处理感染的大蜡螟显示出较少的白色念珠菌细胞。本发明制备方法可规模化工厂化生产,生产周期短,制品得率和纯度较高,且不受外在环境得到影响。
附图说明
19.图1实施例所得抗菌肽纯度检测。
20.图2实施例所得抗菌肽分子量检测。
21.图3实施例所得抗菌肽对c.albicans细胞壁完整性的影响。
22.图4实施例所得抗菌肽对c.albicans细胞膜通透率的影响。
23.图5实施例所得抗菌肽处理10h后c.albicans的扫描电镜图像。
24.图6实施例所得抗菌肽处理10h后c.albicans的透射电镜图像。
25.图7实施例中不同浓度的抗菌肽对c.albicans生物膜形成的抑制作用。
26.图8实施例中不同浓度的抗菌肽处理c.albicans基因组dna后凝胶电泳图像。
27.图9实施例所得抗菌肽对c.albicans胞内ros的影响。
28.图10实施例所得抗菌肽溶血活性分析。
29.图11大蜡螟体内感染c.albicans菌落数测定。
30.图12实施例所得抗菌肽治疗对大蜡螟体内感染c.albicans菌落数的影响。
31.图13感染c.albicans大蜡螟幼虫采用实施例所得抗菌肽治疗后组织病理学分析。
具体实施方式
32.下面结合实施例,更具体地说明本发明的内容。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
33.在本发明中,若无特别指明,实施例采用的方法为本领域通用技术,所有的仪器设备和原材料等均可从市场购得或是本行业常用的。
34.实施例1:抗菌肽的制备及检测
35.按照下述步骤进行抗菌肽的制备:
36.抗菌肽的氨基酸序列为ac
‑
wkkwfr
‑
nh2,依据抗菌肽的氨基酸序列进行多肽的制备,从多肽c端开始一直到多肽n端。步骤如下:
37.(1)取适量树脂置于固相反应器中,加dmf(二甲基甲酰胺)洗涤一次,然后用dcm(二氯甲烷)溶胀10
‑
15min,抽掉dcm;
38.(2)加dblk溶液(六氢吡啶 dmf)脱保护2次(时间分别为10min和15min)。中间用dmf洗涤1次。脱完保护后,用dmf洗涤6次;
39.(3)取少量树脂滴加凯撒试剂茚检,如树脂显蓝色则继续进行氨基酸偶联反应。
40.(4)取4eq(投料比,材料与树脂比)的氨基酸、4eq的hbtu(苯并三氮唑
‑
n,n,n',n'
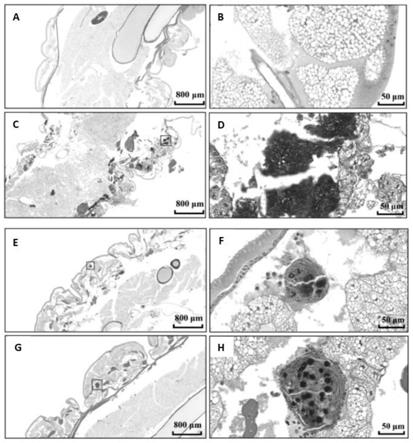
‑
四甲基脲六氟磷酸酯)、4eq的hobt(1
‑
羟基苯并三氮唑)置于反应器中,加dmf溶解后,滴加8eq的diea,室温下反应2小时,然后dmf洗涤3次;
41.(5)取少量树脂滴加凯瑟试剂茚检,树脂若透明无色,重复(2)到(4)步进行下一个氨基酸偶联反应直至反应结束。
42.(6)从树脂上用切割液切割合成的多肽,然后吹干和洗涤。
43.对合成的多肽利用hplc和质谱仪对其纯度及分子量进行检测分析。经hp lc检测,制备的抗菌肽出峰时间为10.509min(图1),峰图左右对称且纯度较高,达到98.24%。经ms质谱测定,抗菌肽分子量为991.1(图2)。
44.实施例2:抗菌肽对白色念珠菌的抗菌活性检测
45.通过微量稀释测定法测定抗菌肽对白色念珠菌(c.albicans)的最小抑菌浓度(minimal inhibitory concentration,mic)。将
‑
80℃保存的c.albicans甘油菌在冰上解冻,取100μl甘油菌至2ml新鲜sdb培养基(葡萄糖40g,蛋白胨10g,加灭菌水定容至1l)中,30℃,160r/min过夜培养。次日进行转接,从过夜菌中取100μl的c.albicans菌液至2ml新鲜的sdb培养基中,30℃,160r/min培养至对数生长期。用新鲜的sdb培养基制备菌悬液(浓度为1.0
×
105cfu/ml)。利用二倍稀释法将10μl用灭菌水稀释的不同浓度的实施例1所得抗菌肽加入到96孔酶标板中,再将90μl白色念珠菌菌悬液加入不同浓度的抗菌肽对应的孔中,菌液加灭菌水为阳性对照,sdb培养基加灭菌水为阴性对照。放置于30℃培养箱中恒温培养24h,用酶标仪(multiskan fc,中国)检测96孔酶标板的od
600
值。
46.抗菌肽的最小杀真菌浓度(minimal fungicidal concentration,mfc)测定方法
参照mic测定方法。将96孔酶标板30℃恒温培养24h后从各自孔中取50μl菌液(取前混匀)至对应的sda培养基(葡萄糖40g,蛋白胨10g,琼脂20g加灭菌水定容至1l)中并用涂布珠涂抹均匀。放入30℃恒温培养箱中培养24h后对sda平板上c.albicans的菌落进行计数,无菌落生长的最低浓度作为抗菌肽对c.albicans的mfc。
47.经测定抗菌肽对c.albicans的mic和mfc分别为50和125μg/ml。
48.实施例3:抗菌肽对白色念珠菌细胞壁完整性影响
49.取对数生长期白色念珠菌,用新鲜的sdb培养基制备c.albicans菌悬液(浓度为2.0
×
107cfu/ml),以终浓度为2mic的抗菌肽处理c.albicans菌悬液,灭菌水处理作为对照(ck)。各组放置于30℃培养箱中培养10h取出,3000r/min离心10min收集菌体,用磷酸盐缓冲液(phosphate buffer saline,pbs)洗涤3次。添加5%的结晶紫染色10min,加入pbs使菌液悬浮并离心至菌液为无色,取5μl菌液沉淀至载玻片上,再滴加10%鞣酸固定,盖上盖玻片后倒置显微镜(moticae2000,中国)下观察,随机观察100个细胞并计算c.albic ans细胞壁的完整率。每组实验重复三次。
50.检测结果如图3(图中a:灭菌水处理(ck);b:抗菌肽处理)所示,ck组c.albicans细胞壁完整率为95.67%(表1),形态呈圆形或椭圆形,细胞外以及胞质可见被染成淡紫色或无色完整的细胞壁结构(图3a)。抗菌肽处理组c.albicans细胞壁完整率分别为40.27%和32.86%,显著低于ck组(p<0.05)(图3b),可见部分c.albicans细胞壁及细胞质被染成深紫色。
51.抗菌肽对c.albicans细胞壁完整性影响
[0052][0053]
表1
[0054]
不同字母代表差异显著(p<0.05)。
[0055]
实施例4:抗菌肽对白色念珠菌细胞膜渗透率影响
[0056]
从
‑
80℃超低温冰箱中取出c.albicans,加入到新鲜的sdb培养基,置于恒温摇床30℃,160r/min条件下过夜培养。3000r/min离心10min,留沉淀,用pbs重新悬浮使菌体至终浓度为2.0
×
107cfu/ml。白色念珠菌菌液分别用终浓度为1mic的抗菌肽、两性霉素b处理。用10%triton x
‑
100处理悬浮菌液作为阳性对照,pbs作为阴性对照。将各组置于摇床中30℃,100r/min分别处理0h、0.5h、1h、2h、4h、8h和12h后。使用0.22μm水系针筒过滤器过滤培养后的c.albicans,并收集滤液。用紫外分光光度计(soptop 752,中国)测量滤液的od
260
值,紫外分光光度计用经水系针筒过滤器过滤后的pbs校零。用下述公式计算抗菌化合物处理白色念珠菌后细胞膜渗透率:
[0057][0058]
其中od
260amp
为抗菌肽处理c.albicans后用水系针筒过滤器过滤菌液的吸光度,od
260triton x
为10%triton x
‑
100处理c.albicans后用水系针筒过滤器过滤菌液的吸光度。
[0059]
结果如图4,可知抗菌肽处理组可以在短时间内造成c.albicans细胞膜渗透率的
增加。与ck相比,用抗菌肽处理c.albicans仅0.5h,渗透率从9.90%分别增加到19.4%。随着作用时间的增加渗透率也在逐步增加,处理12h时渗透率达到27.77%,显著高于ck。
[0060]
实施例5:抗菌肽处理白色念珠菌后电镜观察
[0061]
(1)扫描电镜观察
[0062]
取对数生长期的c.albicans,用新鲜的sdb培养基制备c.albicans菌悬液(浓度为2.0
×
107cfu/ml),用终浓度为1mic的抗菌肽处理c.albicans菌悬液,无菌水作为对照。各组放置于摇床30℃,100r/min培养10h取出,3000r/min离心10min收集细胞,pbs洗涤,沉淀物中加入1ml电镜固定液于4℃冰箱固定过夜。用pbs洗涤3次,并在分级乙醇系列(50%、70%、80%、95%和100%)中脱水。冻干和金涂层后,在su
‑
8100扫描电镜(hitachi,日本)下观察。从图5中可以看出,对照组c.albicans细胞呈现圆形或椭圆形,菌体饱满,细胞表面光滑(图5a)。与对照组相比,抗菌肽处理10h后,c.albicans具有严重的损伤和膜的形态改变。细胞表面主要呈波纹状皱缩(图5b),膜破裂、穿孔、内容物的泄露(图5c)以及细胞膜脱落(图5d)等现象。
[0063]
(2)透射电镜观察
[0064]
取对数生长期的c.albicans,用新鲜的sdb培养基制备c.albicans菌悬液(浓度为2.0
×
107cfu/ml),用终浓度为1mic的抗菌肽处理c.albicans,无菌水作为对照。各组放置于摇床30℃,100r/min培养10h取出,3000r/min离心10min收集菌体,pbs洗涤,沉淀物中加入1ml电镜固定液于4℃冰箱固定过夜。用pbs洗涤3次,并用1%锇酸在pbs中固定2h。将样本用pbs洗涤3次,在分级乙醇系列(50%、70%、80%、95%和100%)中脱水,然后用无水丙酮脱水。将样本分别转移至无水丙酮和环氧树脂(1:1和1:2)的混合物中2h及过夜。然后转移到环氧树脂中并保持在37℃下过夜。超薄切片(60~80nm)用醋酸铀酰和柠檬酸铅染色,在ht
‑
7700透射电镜(hitachi,日本)下观察。对照组c.albicans细胞形态呈圆形或椭圆形,细胞结构完整(图6a),抗菌肽处理c.albicans 10h后大部分菌体细胞内部发生明显变化。观察到c.albicans细胞形成细胞质液泡、电子密度不均一(图6b)以及膜被破坏(图6c)等现象。
[0065]
实施例6:抗菌肽对白色念珠菌生物膜形成的影响
[0066]
用新鲜的sdb培养基过夜培养c.albicans,次日转接到新鲜的sdb培养基中培养至对数生长期,再用sdb培养基将菌液稀释至浓度为1.0
×
105cfu/ml,将180μl菌液加入到含有20μl不同浓度的抗菌肽的96孔酶标板中,菌液加灭菌水作为阳性对照(control),sdb培养基加灭菌水作为阴性对照。在30℃恒温培养箱中温育24h。然后把96孔酶标板中菌液吸出,加入200μl的pbs除去孔中未粘附的细胞,吸出pbs加入200μl的99%甲醇固定15min,吸出甲醇放入超净台中吹干,加入200μl的1%的结晶紫在超净台放置5min,用流线型自来水清洗孔后,放入超净台内吹干。最后每孔加入200μl的33%的冰醋酸并用酶标仪(multiskan fc,中国)测定od
600
值。经测定,与对照相比,抗菌肽在2mic的浓度下抑制率达到98.28%,仅有1.72%的c.albicans生物膜残留(图7);图7中control:菌液加灭菌水。误差线代表标准误差,不同字母代表差异显著(p<0.05)。
[0067]
实施例7:抗菌肽与白色念珠菌基因组dna结合分析
[0068]
使用真菌基因组dna提取试剂盒(solarbio,中国)提取c.albicans的基因组dna。测定所提取的dna的浓度(od
260
/od
280
)并保存在
‑
20℃冰箱备用。为分析抗菌肽能否与
c.albicans的dna结合,将5μl不同浓度梯度的抗菌肽与5μl所提取的c.albicans dna(40ng/μl,灭菌水稀释)在室温下温育1.5h,灭菌水处理c.albicans dna作为对照(ck),加入2μl的6
×
dna loading buffer后,利用1%琼脂糖凝胶(0.5
×
tbe缓冲液配制)进行电泳检测,凝胶中加入溴化乙锭(终浓度为10mg/ml),98v电压下进行电泳。电泳后在凝胶成像系统的uv照射下进行拍照观察c.albicans的dna迁移变化,通过检测dna在凝胶中的阻滞情况来分析抗菌肽与白色念珠菌基因组dna结合情况。
[0069]
电泳结果显示,抗菌肽与c.albicans基因组dna发生结合(图8)。与抗菌肽发生结合的基因组dna的迁移距离明显不同于对照组dna迁移的距离。c.albicans dna电泳迁移率变化呈现出抗菌肽浓度依赖性关系。
[0070]
实施例8:抗菌肽处理白色念珠菌后胞内ros检测
[0071]
取对数生长期c.albicans,用新鲜的sdb培养基制备浓度为2.0
×
107cfu/ml的c.albicans菌悬液,用终浓度为1/2mic、1mic和2mic的抗菌肽对其处理,灭菌水为对照(control)。30℃恒温培养箱培养10h取出,3500r/min离心10min收集细胞,用细胞外液(beyotime,中国)洗涤2次,每组样品用pbs重悬使菌液浓度为2.0
×
107cfu/ml,并加入100μl终浓度为10μm的2’,7
’‑
二氢二氯荧光素二乙酯(2’,7
’‑
dichlorodi
‑
hydrofluorescein diacetate,dcfh
‑
da)溶液(yingxin,中国),30℃避光孵育30min。每孔取200μl各组菌液于96孔板黑板中,用多功能酶标仪(spectramax i3,美国)检测2’,7
’‑
二氯荧光素(2’,7
’‑
dichlorofluorescein,dcf)荧光强度(激发波长/发射波长:488/525nm)。
[0072]
结果显示(图9,control(ck):灭菌水处理。误差线代表标准误差,不同字母代表差异显著(p<0.05)),抗菌肽处理10h后,1mic以及2mic时,较ck(control)组ros分别显著增高了236.64%以及328.24%。说明抗菌肽能促进c.albicans胞内ros的积累,并呈现剂量依赖效应。
[0073]
实施例9:抗菌肽溶血活性分析
[0074]
通过测定4%新鲜兔红细胞悬浮液在414nm处的血红蛋白释放来评估抗菌肽的溶血活性。取新鲜兔红细胞,2000r/min离心5min,弃上清,红细胞用pbs洗涤3次并重悬。将重悬的兔红细胞与抗菌肽按1:1比例混合,37℃下振荡孵育1h,500
×
g离心10min,取80μl所得的上清液于414nm检测吸收值,阳性对照为0.1%triton x
‑
100,阴性对照为pbs。按以下公式计算抗菌肽的溶血活性。
[0075][0076]
其中od
peptide
为抗菌肽处理的兔红细胞上清液在414nm下的吸光值,od
pbs
为pbs处理兔红细胞后上清液在414nm下的吸光值,od
triton x
为triton x
‑
100处理兔红细胞后上清液在414nm下的吸光值。
[0077]
如图10示,在所测试的浓度下,抗菌肽对兔红细胞的溶血活性均比较低。在7.8125μg/ml~125μg/ml浓度下,抗菌肽对兔红细胞的溶血活性仅为2%~4%,即使在1000μg/ml的高浓度下,抗菌肽对兔红细胞的溶血活性也低于10%。
[0078]
实施例10:白色念珠菌对抗菌肽耐药性测定
[0079]
用终浓度为0.75mic、1mic和1.25mic的抗菌肽以及两性霉素b处理1.0
×
105cfu/
ml的c.albicans菌液(肽:菌=1:9)。分别培养24h后,通过上述实施例2中微量稀释测定法测定抗菌肽处理的c.albicans的mic。每天利用相同的方法对其传代培养和mic测定,总计14d。通过观察mic值来评估c.albicans的耐药性。
[0080]
耐药性测定结果显示,重复用0.75mic、1mic和1.25mic的抗菌肽处理c.albicans细胞,抗菌肽对处理的c.albicans的mic未发生变化,均为50μg/ml,在检测的时间范围内均未观察到c.albicans对抗菌肽产生耐药性。
[0081]
实施例11:抗菌肽对感染大蜡螟幼虫的治疗效果评价
[0082]
(1)不同浓度的c.albicans感染大蜡螟幼虫
[0083]
将过夜培养的c.albicans菌悬液3000r/min离心10min,弃上清,再用pbs洗涤并重悬至所需浓度。将幼虫轻轻固定在注射平台上,用注射器分别取5μl不同浓度c.albicans菌悬液(浓度为1.0
×
105cfu/ml~2.0
×
107cfu/ml),经幼虫左后足注射到体内。设置未感染组和注射同体积pbs组作为对照。每组20只幼虫。37℃下观察7d。每天记录幼虫存活情况。
[0084]
不同浓度的c.albicans感染大蜡螟幼虫存活率结果不同。未感染组(control)和注射pbs组(pbs)7d的存活率为100%,1.0
×
105cfu/ml、1.0
×
106cfu/ml、1.0
×
107cfu/ml和1.5
×
107cfu/ml感染组感染7d的存活率分别为90%、90%、70%以及40%,2.0
×
107cfu/ml感染组在感染后的第2d全部死亡。根据大蜡螟存活率的结果,选用1.5
×
107cfu/ml感染组用于后续的抗菌肽治疗的研究。
[0085]
(2)感染c.albicans大蜡螟幼虫体内菌落测定
[0086]
向大蜡螟幼虫体内注射5μl不同浓度的c.albicans菌悬液(浓度依次为1.0
×
107cfu/ml、1.5
×
107cfu/ml和2.0
×
107cfu/ml)。注射相同体积的pbs作为空白对照组。在感染6h、12h、24h、36h、48h、60h以及72h后,每组随机选择三只幼虫提取血淋巴,用乙醇对其表面消毒,用解剖刀轻轻划破幼虫尾巴附近(远离肠道)使得幼虫血淋巴溢出并收集血淋巴。吸取5μl血淋巴置于95μl的pbs中。再用pbs连续稀释不同倍数后,取50μl滴于含有200μg/ml氯霉素的sda固体平板上,用涂布珠将液体混匀,30℃孵育48h后对菌落计数。每组至少涂3个sda固体平板。
[0087]
结果如图11(误差线代表标准误差,不同字母代表差异显著(p<0.05))所示。可以看出,1.0
×
107cfu/ml感染组在感染6h以及12h的菌落数呈现上升趋势,在感染12h之后呈明显的下降趋势。1.5
×
107cfu/ml感染组在感染6h、12h以及24h的菌落数呈现上升趋势,在感染24h之后呈明显的下降趋势。2.0
×
107cfu/ml感染组在感染6h、12h、24h以及36h的菌落数呈明显的上升趋势,感染36h后,大蜡螟幼虫全部死亡。空白对照组(注射pbs)大蜡螟幼虫血淋巴中未检测出c.albicans。
[0088]
(3)抗菌肽对大蜡螟毒性测定
[0089]
向幼虫体内注射5μl不同浓度(10mg/kg、20mg/kg和40mg/kg)的抗菌肽,注射同体积pbs作为对照组。每个浓度注射20只幼虫。37℃下观察7d。每天记录幼虫存活情况。经过测定,体内注射不同浓度(10mg/kg、20mg/kg以及40mg/kg)抗菌肽,均对大蜡螟幼虫存活率无影响,表明抗菌肽对大蜡螟无毒性。
[0090]
(4)大蜡螟幼虫感染c.albicans菌用抗菌肽治疗后存活率分析
[0091]
挑选健康的的大蜡螟幼虫,每只幼虫均注射5μl浓度为1.5
×
107cfu/ml的c.albicans菌液,37℃放置2h。然后对已感染的幼虫使用微量注射器将pbs稀释的不同剂量
的抗菌肽(10mg/kg、20mg/kg和40mg/kg)注射到幼虫体内。注射同等体积的pbs以及两性霉素b(2mg/kg)分别作为未治疗组和阳性对照组,同时设置未感染组。每个处理注射20只幼虫。注射后,37℃下观察7d。每天记录幼虫存活情况。
[0092]
治疗7d后,未感染组(control)大蜡螟的存活率为100%;未治疗组(感染 pbs)大蜡螟存活率为35%。与未治疗组相比,所有剂量的抗菌肽均能提高大蜡螟幼虫的存活率,在10mg/kg、20mg/kg和40mg/kg浓度下大蜡螟存活率分别为50%、70%和70%,中高剂量处理(20mg/kg和40mg/kg)的抗菌肽存活率与阳性对照两性霉素b(2mg/kg)处理大蜡螟存活率相同。
[0093]
(5)感染大蜡螟幼虫抗菌肽治疗后体内菌落分析
[0094]
挑选健康的大蜡螟幼虫,按照上述方法(实施例11(4))对感染c.albicans大蜡螟幼虫注射不同剂量(10mg/kg、20mg/kg和40mg/kg)的抗菌肽进行治疗。注射同等体积的pbs以及两性霉素b(2mg/kg)分别作为未治疗组和阳性对照组。未感染以及未感染注射pbs的大蜡螟幼虫作为空白对照。在治疗6h、12h、24h、36h、48h、60h以及72h时收集各组幼虫,每组三只。并用乙醇对其表面消毒,收集血淋巴。将20μl血淋巴置于80μl pbs中。再用pbs连续稀释不同倍数后,取50μl滴于含有200μg/ml氯霉素的sda固体平板上,用涂布珠将液体混匀,30℃孵育48h对菌落计数。每组至少涂3个sda固体平板。
[0095]
各治疗组处理以后大蜡螟幼虫体内c.albicans菌落数均低于未治疗组(感染 pbs)(图12,误差线代表标准误差,不同字母代表差异显著(p<0.05))。与未治疗组相比,抗菌肽(10mg/kg、20mg/kg和40mg/kg)处理可显著降低感染c.albicans大蜡螟幼虫的体内的菌落数。治疗72h时,较低浓度的抗菌肽(20mg/kg)处理即可完全清除感染c.albicans大蜡螟幼虫体内的菌落数。两性霉素b在治疗72h内大蜡螟幼虫的体内的菌落数呈现下降趋势。空白组(不感染,仅注射pbs)血淋巴中未检测出c.albicans菌落。
[0096]
(6)感染大蜡螟幼虫抗菌肽治疗后组织病理学分析
[0097]
按照上述方法(实施例11(4))对感染c.albicans大蜡螟幼虫注射5μl的抗菌肽(20mg/kg)进行治疗。注射同等体积的pbs以及两性霉素b(2mg/kg)分别作为未治疗组和阳性对照组,同时设置未感染组。在37℃下孵育幼虫24h后,每组随机取3只幼虫,幼虫用多聚甲醛固定液(servicebio,中国)固定24h后横切和纵切。样品先用高浓度乙醇进行脱水处理,然后使用二甲苯脱水,最后加入石蜡。用切片机制作组织切片备用(4μm),石蜡切片脱蜡至水,依次用苏木素和伊红染色,脱水封片后在正置光学显微镜(nikon eclipse e 100,日本)下观察。
[0098]
所得结果如图13,,中a和b:未感染。感染24h后,c和d:未治疗;e和f:20mg/kg抗菌肽;g和h:2mg/kg两性霉素b。图b、d、f、h分别是图a、c、e、g所示区域的放大图。图c、e、g中的方块表示c.albicans细胞。
[0099]
与未感染组相比(图13a,b),未治疗组显示c.albicans细胞在整个生物体各个部位传播(图13c,d);而用20mg/kg的抗菌肽(图13e,f)以及2mg/kg的两性霉素b(图13g,h)治疗的幼虫显示出较少的c.albicans细胞的存在。结果表明,与未治疗组相比,抗菌肽以及两性霉素b可明显减弱c.albicans对大蜡螟幼虫的侵染。
[0100]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属
于本发明所涵盖专利范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

