高表达人促卵泡激素的重组cho细胞株及其构建方法
技术领域
1.本发明涉及助孕技术附属装置的技术领域,特别是涉及一种高表达人促卵泡激素的重组cho细胞株及其构建方法。
背景技术:
2.who统计显示,全球约有4500万~5200万名的夫妇受不孕不育影响,我国育龄夫妇中不孕不育率高达10%,累及人口达1000多万,其中因为排卵障碍而导致的不孕不育约占1/3,不孕不育已成为严重的社会问题,人促卵泡激素在治疗排卵障碍性疾病、体外受精和胚胎移植助孕技术有重要意义。
3.fsh是一种由脑垂体前叶嗜碱性细胞分泌的糖蛋白类促性腺激素,是调控哺乳动物生长、性成熟和繁殖的核心激素,与促黄体生成素、促甲状腺激素、绒毛膜促性腺激素共同组成糖蛋白激素家族,具有促进和维持正常性腺发育和生殖的功能。该家族是目前己知的结构最为复杂的蛋白质激素,它们虽然功能不同,结构却极为相似,均可由解离的α亚基和β亚基以非共价键结合形成异二聚体。在同一物种,4种激素的α亚基完全相同,由同一基因编码,而β亚基则是特异的,决定着激素的特定生理功能。一般认为α亚基负责信号转导作用,而β亚基是功能亚基,参与受体结合,后来发现α亚基和β亚基均参与受体结合及信号转导作用。
4.目前fsh制剂根据其来源及制备工艺主要分为三大类。第一类是从下丘脑垂体中得到的,简称垂体fsh,因其含量较低,纯度不高,杂质含量高,副作用较大,而逐渐被淘汰。第二类是从绝经后妇女的尿中提取出来的尿源fsh,但存在生物资源有限,个体及批间差异大,尿液中残留的蛋白成分导致fsh的生物学活性降低,且生产成本较高的问题。另一类是重组的人促卵泡素,根据其来源分为大肠杆菌原核表达的fsh,但因其不具有糖基化修饰功能,不能产生有活性的fsh,而且表达产物往往以包涵体的形式存在,二硫键不能正确折叠,无法形成完全正确的空间构象。酵母细胞表达的fsh,但由于巴氏毕赤酵母糖基化模式与哺乳动物细胞的差异,表达产物虽然具有类似的结合能力,但体外活性仅为天然产物活性的1/3。有学者尝试利用昆虫细胞及植物细胞表达fsh,但均存在与天然fsh糖基化差异较大,活性不高及产业化困难的问题。
技术实现要素:
5.为解决上述技术问题,本发明提供一种纯度高、成本低、生物活性稳定的高表达人促卵泡激素的重组cho细胞株及其构建方法。
6.本发明的高表达人促卵泡激素的重组cho细胞株,包括cho
‑
s细胞株、pcho1.0载体、高表达元件和目的蛋白氨基酸序列。
7.本发明的高表达人促卵泡激素的重组cho细胞株,fshα亚基氨基酸序列为(92aa):apdvqdcpectlqenpffsqpgapilqcmgccfsrayptplrskktmlvqknvtsestccvaksynrvtvmggfkvenhtachcstcyyhks。
8.本发明的高表达人促卵泡激素的重组cho细胞株,fshβ亚基氨基酸序列为(111aa):nsceltnitiaiekeecrfcisinttwcagycytrdlvykdparpkiqktctfkelvyetvrvpgcahhadslytypvatqchcgkcdsdstdctvrglgpsycsfgemke本发明的高表达人促卵泡激素的重组cho细胞株,pcho1.0载体采用cmv启动子与人延伸因子ef
‑
1/2启动子的杂合启动子。
9.本发明的高表达人促卵泡激素的重组cho细胞株的构建方法,包括以下方案:(1)基于重组质粒pcho1.0
‑
fα和pcho1.0
‑
fβ共转染cho细胞构建方案。
10.(2)基于双表达重组质粒pcho1.0
‑
fα
‑
fβ转染cho细胞构建方案。
11.与现有技术相比本发明的有益效果为:本发明采用具有明确产权背景的cho
‑
s悬浮细胞株与pcho1.0高表达载体组合,采用无血清cd培养基及大规模悬浮细胞培养工艺,筛选获得稳定、高表达工程细胞株。通过高表达元件、杂合启动子、信号肽、kozak序列的合理设计构建并筛选稳定、高表达的工程细胞株。建立的cho
‑
s工程细胞系支持高密度、无血清悬浮培养工艺,该工程细胞株筛选全程均采用无血清、无动物源成分的化学成分界定(cd)培养基,为后期工艺开发奠定基础。建立了高通量无血清培养基筛选平台,提高目标蛋白的表达量及蛋白质量,建立稳定高产的无血清细胞罐悬浮培养工艺。优选的工程细胞株经培养后,表达量不低于200mg/l,收集培养上清经纯化后采用sds
‑
page、western blot及n端氨基酸测序对目的产物进行初步确证,经大鼠卵巢增重法(steelman
‑
pohley法)测定目的产物比活最高可达16036 iu/mg,达到国内外先进水平,该重组cho细胞株支持从构建、筛选到培养全程无血清cd培养基工艺,全程无血清及蛋白成分,无动物来源成分,支持悬浮培养和生物反应器生产,更易于规模放大,方便产业化。
附图说明
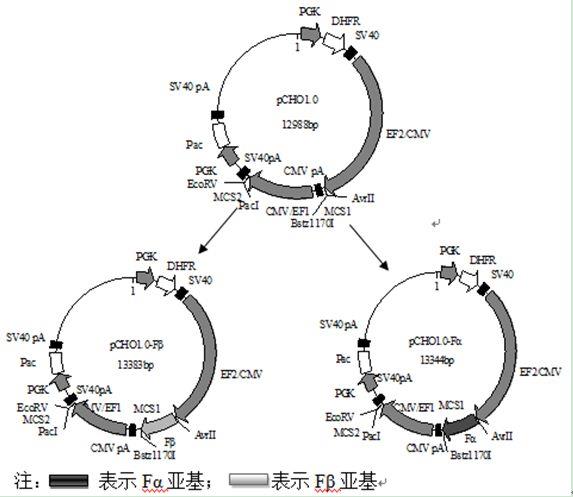
12.图1是共转染重组质粒pcho1.0
‑
fα和pcho1.0
‑
fβ构建示意图;图2是双表达重组质粒pcho1.0
‑
fα
‑
fβ的构建示意图;图3是目的蛋白sds
‑
page及western blot分析的示意图;图4是目的蛋白hplc纯度分析示意图;图5是量反应平行线法检测目的蛋白比活性示意图。
具体实施方式
13.下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
14.实施例:一、人工合成hfsh α亚基及β亚基基因,克隆至pmd
‑
18t载体,经酶切连接亚克隆至pcho1.0载体,构建重组共转染质粒pcho1.0
‑
fα、pcho1.0
‑
fβ及重组双表达质粒pcho1.0
‑
fα
‑
fβ,见图1,图2。转染cho
‑
s悬浮细胞,通过嘌呤霉素及mtx加压筛选,经fsh检测试剂盒测定表达量。通过多轮有限稀释法获得高表达重组阳性单克隆细胞株,并对细胞株进行产量评估,优选表达量高、活性好、表达稳定的细胞株作为工程细胞株。细胞株构建、筛选过程如下:(1) 重组表达质粒的构建
①
共转染重组质粒pcho1.0
‑
fα和pcho1.0
‑
fβ的构建方案
②
双表达重组质粒pcho1.0
‑
fα
‑
fβ的构建方案(2)cho
‑
s细胞的转染及筛选:分别提取上述已成功构建共转染重组质粒pcho1.0
‑
fα、pcho1.0
‑
fβ及重组双表达质粒pcho1.0
‑
fα
‑
fβ,转染前质粒均经nrui限制性内切酶进行线性化处理。复苏cho
‑
s细胞,监测细胞密度及活度,待细胞密度达到1
‑2×
10
6 viable cells/ml时,即进行细胞传代,根据细胞状态及密度,每2
‑
3天传代一次。待细胞浓度及活度达到要求后,取对数期细胞进行转染,其中共转染质粒pcho1.0
‑
fα与pcho1.0
‑
fβ按质量比3:1共转染cho
‑
s细胞,双表达质粒pcho1.0
‑
fα
‑
fβ直接转染cho
‑
s细胞,同时设立pcho1.0空质粒对照组。振摇培养48 h后检测各组rhfsh瞬时表达量,作为初步评估。以不同浓度的嘌呤霉素和mtx进行两阶段加压,实时检测细胞浓度及活度,待细胞活度≥90%,活细胞密度≥1.0
×
10
6 cells/ml,进行多克隆工程细胞产量评估,选取评估产量较高的多克隆细胞群,进行有限稀释,经96孔板、24孔板、6孔板、100ml摇瓶及250ml摇瓶逐步放大,选取rhfsh表达量高且表达稳定的单克隆细胞株作为优选工程细胞株。
15.(3)表达产物的鉴定及活性测定:收集细胞培养上清经纯化后采用sds
‑
page法进行分子量大小检测,经western blot进行鉴别分析,经hplc法进行纯度检测,经大鼠卵巢增重法(steelman
‑
pohley法)进行活性检测。
16.(4)重组细胞株表达及传代稳定性检测:重组细胞株在无mtx、无嘌呤霉素压力存在的条件下,连续传代20代(60天),分别取上清第0代、第5代、第10代、第15代及第20代细胞培养物上清检测目的产物表达量,并提取各代次细胞总rna,经rt
‑
pcr法扩增目的基因,并进行测序,评估细胞株的表达稳定性及遗传稳定性。
17.二、以重组双表达质粒pcho1.0
‑
fα
‑
fβ的构建、转染cho
‑
s细胞及有限稀释法筛选过程为例进行详细描述。
18.双表达重组质粒pcho1.0
‑
fα
‑
fβ的构建(1)fshα亚基基因的克隆
①
fshα亚基基因合成及引物设计:根据genbank中编码fsh蛋白α亚基(nm_000735)cdna序列,合成目的基因序列(pmd18t
‑
fa),并运用primer5.0软件设计引物,序列如下:fa(avrii): 5'
‑ꢀ
atgccctaggccaccatggattactacaga
ꢀ‑
3'(下划线部分为avrii酶切位点),ra(bstz17i):5'
‑ꢀ
cagtgtatacttaagatttgtgataataac
ꢀ‑
3'(下划线部分为bstz17i酶切位点),扩增片段大小为376 bp。目的基因及引物均由北京三博远志生物技术有限责任公司合成。
19.②
fshα亚基基因的扩增及克隆:以pmd18t
‑
fa质粒为模板,fa(avrii)和ra(bstz17i)为引物进行pcr扩增。反应体系为:10
×
ex taq buffer(mg2 plus)5 μl,dntp(2.5 mmol/l)4 μl,上下游引物(20 pmol/μl)各2 μl,模版dna 0.5 μl,ex taq 0.5 μl,补加ddh2o至总体积50 μl。反应条件为:94℃预变性2 min;94℃ 30 s,43℃ 30 s,72℃ 22 s,共30个循环;最后72℃延伸5 min。扩增产物经1%琼脂糖凝胶电泳鉴定。回收目的基因片段,与载体pmd18
‑
t连接,转化感受态大肠杆菌dh5α,提取质粒,经pcr及酶切鉴定后,经测序正确的质粒命名为pmd18t
‑
fα。
20.③
重组表达质粒pcho1.0
‑
fα的构建:将测序正确的pmd18t
‑
fα质粒经avrii和bstz1170i双酶切,回收fα基因片段,与经同样酶酶切的pcho1.0载体按体积比5:3于16℃连
接过夜,连接产物转化感受态大肠杆菌dh5α,提取质粒,经pcr及酶切鉴定后,送吉林省库美生物科技有限公司测序,测序正确的质粒命名为pcho1.0
‑
fα。
21.(2)fshβ亚基基因的克隆
①
fshβ亚基引物设计及合成:根据genbank中编码fsh蛋白β亚基(nm_001018080)cdna序列,运用primer5.0软件设计引物,序列如下:fb(ecorv):5'
‑ꢀ
atgcgatatcgccac catgaagacactccagt
ꢀ‑
3'(下划线部分为ecorv酶切位点),rb(paci):5'
‑ꢀ
cag tttaattaattattctttcatttcaccaa
ꢀ‑
3'(下划线部分为paci酶切位点),扩增片段大小为418 bp。
22.②
fsh β亚基基因的扩增及克隆:以pmd18t
‑
fb质粒为模板,fb(ecorv)和rb(paci)为引物进行pcr扩增。反应体系为:10
×
ex taq buffer(mg2 plus)5 μl,dntp(2.5 mmol/l)4 μl,上下游引物(20 pmol/μl)各2 μl,模版dna 0.5 μl,ex taq 0.5 μl,补加ddh2o至总体积50 μl。反应条件为:94℃预变性2 min;94℃ 30 s,45℃ 30 s,72℃ 23s,共30个循环;最后72℃延伸5 min。扩增产物经1%琼脂糖凝胶电泳鉴定。回收目的基因片段,与载体pmd18
‑
t连接,转化感受态大肠杆菌dh5α,提取质粒,经pcr鉴定后,送吉林省库美生物科技有限公司测序,测序正确的质粒命名为pmd18t
‑
fβ。
23.(3)重组表达质粒pcho1.0
‑
fα
‑
fβ的构建将测序正确的pmd18t
‑
fβ质粒经ecorv和paci双酶切,回收fβ基因片段,与经同样酶酶切的pcho1.0
‑
fα质粒按体积比5:3于16℃连接过夜,连接产物转化感受态大肠杆菌dh5α,筛选阳性克隆,提取质粒,经pcr及酶切鉴定正确后,送吉林省库美生物科技有限公司测序,测序正确的质粒命名为pcho1.0
‑
fα
‑
fβ。
24.(4)cho
‑
s细胞的转染及加压采用去内毒素试剂盒提取已构建成功的共转染质粒pcho1.0
‑
fα、pcho1.0
‑
fβ、双表达质粒pcho1.0
‑
fα
‑
fβ及pcho1.0空质粒。转染时质粒经nrui线性化处理。复苏cho
‑
s细胞,确定细胞密度及活度,细胞密度达到1
‑2×
10
6 viable cells/ml,即进行细胞传代,根据细胞状态及密度,每2
‑
3天传代一次。转染前24 h,以5
‑6×
10
5 viable cells/ml接种于含有30 ml cd forti agt cho完全培养基,在37℃,含8% co2,相对湿度为70
‑
80%,转速为120 rpm的摇床培养细胞;转染当天,确定细胞活度不低于95%,活细胞密度为1
×
10
6 viable cells/ml左右;将60 μg dna加入终体积1.5 ml的 optiprotm sfm (1
×
)培养基中进行稀释,轻轻混匀,其中共转染质粒pcho1.0
‑
fα与pcho1.0
‑
fβ按质量比均为1:1、3:1各做两组,pcho1.0
‑
fα
‑
fβ做一组,以线性化空载体pcho1.0作为阴性对照,未转染细胞cho
‑
s作为空白对照;吸取50 μl freestyle max reagent,加入终体积为1.5 ml的 optipro sfm (1
×
)培养基稀释转染试剂,轻轻混匀;立即将转染试剂稀释液加入dna稀释液中,轻轻混匀,室温放置15 min;逐滴、分区、缓慢地将dna
‑
转染试剂混合物加入含细胞液中,摇床培养细胞,48 h后检测各组rhfsh瞬时表达量。静态加压至第7
‑
10天,细胞计数,若恢复至5.0
×
10
5 viable cells/ml,待细胞活度增加至30%
‑
50%时,以3.0
×
10
5 viable cells/ml转移至摇瓶中,37℃,8% co2,相对湿度70
‑
80%,120 rpm条件下培养至活度≥85%,活细胞密度≥1.0
×
10
6 cells/ml,第一阶段加压结束,检测各组rhfsh表达量。待第一阶段加压完毕,提高嘌呤霉素及mtx浓度进行第二阶段加压筛选,每3
‑
4天,以3.0
×
10
5 viable cells/ml传代,至活度≥90%,第二阶段加压结束,进行多克隆的产量评估,于第3、5、7、9、12、14天取样,
每次取样后需按以下比例补加葡萄糖:第3天,补加终浓度至4g/l glucose;第5天,补加终浓度至4g/l glucose;第7天,补加终浓度至6g/l glucose;以确定细胞密度、活度和产量直至细胞活度下降至50%或培养的第14天结束培养。
25.(5)有限稀释法筛选单克隆工程细胞株评估合格后经两轮有限稀释法进行单克隆工程细胞株的筛选,以确保单克隆细胞株的单一来源,按0.5
‑
1个细胞/孔,铺96孔板,经24孔板、6孔板、100ml摇瓶及250ml摇瓶逐步放大,选取rhfsh表达量高且表达稳定的单克隆细胞株作为优选工程细胞株。
26.(6)表达产物的鉴定及活性测定收集细胞培养上清经纯化后采用sds
‑
page法进行检测可见预期位置的目的条带,western blot检测可见特异性反应条带,见图3;经hplc检测纯度不低于99%,见图4;可达经大鼠卵巢增重法(steelman
‑
pohley法)测定目的产物比活最高可达16036 iu/mg,见图5。测得比活 pt= 16036iu/mg;可信限率为 fl= 21.743%;可信限范围为14176~18564 iu/mg。
27.(7)重组细胞株表达及传代稳定性检测重组细胞株在无mtx、无嘌呤霉素压力存在的条件下,连续传代20代(60天),分别取上清第0代、第5代、第10代、第15代及第20代细胞培养物上清检测目的产物表达量,未见目的蛋白明显下降,证实该重组细胞株能够稳定表达目的产物;同时提取各代次细胞总rna,经rt
‑
pcr法扩增目的基因,测序结果显示均与目的基因序列一致,表明该细胞株在传代过程中未发生基因变异,传代稳定性良好。
28.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

