1.本发明属于生物医学影像材料技术,具体涉及一种细胞核靶向上转换荧光探针及其制备方法和应用。
背景技术:
2.众所周知,只有药物进入细胞核并且破坏核内的dna,才能真正杀死癌细胞,目前相关领域内已经提出多种具有细胞核靶向功能的药物载体,用于将化疗药物直接运输至细胞核内。此外,高效的细胞核靶向输运离不开精确的影像示踪观察,目前,通常借助影像技术(荧光、pet、ct扫描、磁共振成像等)实时跟踪观察药物载体的细胞核靶向输运。但是,ct和mri成像虽然具有很高的空间分辨率,但灵敏度较低;荧光影像虽然具有很高的灵敏度,但空间分辨率较低、组织穿透深度较浅。
3.因此,亟待开发一种具有细胞核靶向功能且组织穿透力强的荧光探针,便于全方位观察药物载体靶向进入细胞核。
技术实现要素:
4.发明目的:本发明旨在提供一种细胞核靶向上转换荧光探针及其制备方法和应用,实现针对恶性肿瘤的细胞核靶向输运和上转换荧光影像精确定位。
5.
技术实现要素:
为实现上述目的,本发明提出以下技术方案:
6.一方面,本发明提出一种细胞核靶向上转换荧光探针,所述荧光探针为粒径小于50nm的壳核结构,其中,所述荧光探针的内核为稀土离子掺杂的上转换荧光纳米颗粒,所述荧光探针的外壳为介孔氧化硅包裹层;所述介孔氧化硅包裹层的介孔中装载有化疗药物,所述介孔氧化硅包裹层外表面嫁接tat多肽作为细胞核靶向配体。
7.所述荧光探针以稀土离子掺杂的上转换荧光纳米颗粒ucnps作为内核,可以用于nir
‑
vis、nir
‑
nir上转换荧光成像,具有较高的灵敏度和皮肤组织穿透深度;所述荧光探针中介孔氧化硅层的介孔孔道用于装载化疗药物,从而实现诊疗一体化;介孔氧化硅层外表面嫁接的细胞核靶向配体赋予了荧光探针靶向细胞核输运功能,从而实现细胞核靶向输运和上转换荧光示踪定位。
8.另一方面,本发明还提出一种制备所述细胞核靶向上转换荧光探针的方法,包括步骤:
9.s1、制备稀土离子掺杂的上转换荧光纳米颗粒;
10.s2、用盐酸对所述上转换荧光纳米颗粒进行亲水改性;
11.s3、对进行亲水改性后的上转换荧光纳米颗粒进行介孔氧化硅层包裹;
12.s4、在所述介孔氧化硅层外表面嫁接细胞核靶向配体:先利用氨基羧基结合反应,对细胞核靶向配体进行氨基硅烷修饰;然后基于硅羟基键结合的原理,将进行氨基硅烷修饰后的配体通过共价键结合的形式嫁接于介孔氧化硅层的外表面,得到所述细胞核靶向上转换荧光探针。
13.对于所述制备方法,以下还提供了若干可选方式,但并不作为对上述总体方案的额外限定,仅仅是进一步的增补或优选,在没有技术或逻辑矛盾的前提下,各可选方式可单独针对上述总体方案进行组合,还可以是多个可选方式之间进行组合。
14.可选的,所述步骤s3中,对进行亲水改性后的上转换荧光纳米颗粒进行介孔氧化硅层包裹的具体步骤为:将进行亲水改性后的上转换荧光纳米颗粒溶于水,并加入表面活性剂ctac作为造孔剂,加入tea作为催化剂,再加入硅源teos,整个过程在80度水浴中进行,反应1~2h后,离心收集样品,最后分散在去离子水中,得到介孔氧化硅层包裹的上转换荧光纳米颗粒。
15.再一方面,本发明还提出所述细胞核靶向上转换荧光探针在细胞核靶向输运过程中进行荧光示踪定位的应用。
16.有益效果:与现有的具有细胞核靶向功能的药物载体相比,本发明至少具有以下优势:
17.1、本发明提出的荧光探针不仅能够通过介孔氧化硅层的介孔孔道装载化疗药物并靶向输送至细胞核,还能够通过稀土离子掺杂的上转换荧光纳米颗粒ucnps实现nir
‑
vis、nir
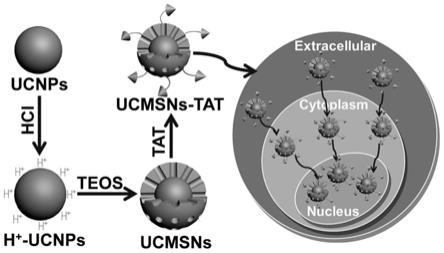
‑
nir上转换荧光成像,利用稀土离子掺杂的上转换荧光纳米颗粒具有较高灵敏度和皮肤组织穿透深度的特点,实现细胞核靶向输运和上转换荧光示踪定位。
18.2、本发明合成工艺简单易行、制备成本低、效率高,所制得的材料具有非常好的分散性、稳定性以及生物相容性,在生物医学影像领域具有广阔的应用前景,尤其适用于细胞核靶向药物输运和荧光影像示踪观察。
附图说明
19.图1为实施例1涉及的细胞核靶向上转换荧光探针在合成过程中各个阶段产物的结构示意图;
20.图2为实施例2涉及的细胞核靶向上转换荧光探针的合成流程图;
21.图3为实施例1涉及的细胞核靶向上转换荧光探针合成过程中每步产物的tem照片:图3(a)为上转换荧光纳米颗粒ucnps,图3(b)为进行亲水改性后的上转换荧光纳米颗粒h
‑
ucnps,图3(c)为包裹了介孔氧化硅层的上转换荧光纳米颗粒ucmsns;
22.图4为实施例1涉及的细胞核靶向上转换荧光探针ucmsns
‑
tat在细胞水平的生物安全性评价结果对比图;图4(a)为培养了24h的存活率,图4(b)为培养了48h的存活率;
23.图5为实施例1涉及的细胞核靶向上转换荧光探针ucmsns
‑
tat通过尾静脉注射入荷mcf
‑
7/adr耐药肿瘤小鼠后的荧光成像图:图5(a)为明场像,图5(b)为上转换荧光成像,图5(c)为图5(a)和图5(b)的叠加图。
具体实施方式
24.下面将结合附图和具体实施例对本发明作更进一步的说明。但应当理解的是,本发明可以以各种形式实施,以下在附图中出示并且在下文中描述的一些示例性和非限制性实施例,并不意图将本发明限制于所说明的具体实施例。
25.实施例1:
26.本实施例旨在提供一种细胞核靶向上转换荧光探针,所述荧光探针为粒径小于
50nm的壳核结构,其中,所述荧光探针的内核为稀土离子掺杂的上转换荧光纳米颗粒,所述荧光探针的外壳为介孔氧化硅包裹层;所述介孔氧化硅包裹层的介孔中装载有化疗药物,所述介孔氧化硅包裹层外表面嫁接tat多肽作为细胞核靶向配体。
27.本实施例中所述荧光探针的结构如图1所示,本实施例优选采用钆掺杂的上转换荧光纳米颗粒,化学式为nayf4:yb/er/tm/gd。本实施例将钆掺杂上转换荧光纳米颗粒ucnps与介孔氧化硅msns复合于同一结构体系中,得到包裹了介孔氧化硅层的上转换荧光纳米颗粒ucmsns,保证了良好的分散性和稳定性。通过嫁接细胞核核靶向配体tat,得到具有细胞核靶向功能的上转换荧光探针ucmsns
‑
tat,用于细胞核靶向药物输运和荧光影像示踪观察。
28.实施例2:
29.本实施例针对实施例1中所述的细胞核靶向上转换荧光探针,提出其制备方法,具体流程如图2所示,包括以下步骤:
30.s1、采用高温分解法制备钆掺杂的上转换荧光纳米颗粒
31.1.1、稀土氯化物的准备。分别称取1.28mmol(388.3008mg)ycl3‑
6h2o,0.36mmol(139.4964mg)ybcl3‑
6h2o,0.04mmol(15.2684mg)ercl3‑
6h2o,0.02mmol(5.5087mg)tmcl3,0.3mmol(79.083mg)gdcl3‑
6h2o。这些粉末放置于同一个样品瓶中,然后用4ml去离子水溶解,转入100ml三口烧瓶中。
32.1.2、向三口瓶中加入15ml油酸,30ml十八烯,室温下搅拌1h。然后开始通5min氩气,除去瓶中的空气,体系开始进行缓慢的除水过程。先升温到80度,保持1h或者更长时间(将自由水除尽);随后升到120度,保持1h;然后升到156度左右,保持1h,获得黄色澄清液。停止加热,让体系自然降温至室温。
33.1.3、naoh(上海凌锋)
‑
200mg,nh4f(sigma)
‑
296.3mg,用10ml甲醇溶解,超声加速分散。然后小心加入体系中。室温下搅拌2h,促进离子之间的交换和前驱体的形成。期间,将氩气撤去,塞住三口瓶。
34.1.4、2h后,体系开始进入除甲醇环节。同样是缓慢进行。先通5min氩气,然后升温到50度,1h;80~100度,1h。直到体系中看不见白色气泡为止,表明甲醇已除完。也可以升到120度,保持1h;确保甲醇基本去除干净。
35.1.5、甲醇除完之后。将冷凝管接好,然后开始升温,将最后的温度稳定在280度左右,并保持1.5h。自然降至室温。
36.1.6、清洗过程:首先,向体系中加入20ml无水乙醇,搅拌30min。然后分装到两个50ml离心管中,用11000r/min,离心10min;收集到略带黄色的产物(第一次)。随后,各加入5~10ml环己烷,小心摇晃,并超声,可以发现产物迅速溶解,得到浑浊溶液,然后加入15ml无水乙醇,超声约5min,离心收集(第二次)。重复清洗3~5次。最后产物用20ml环己烷分散,获得100mm内核。
37.步骤s1所制备的钆掺杂上转换荧光纳米颗粒的粒径尺寸约为19nm,其化学组成为nayf4:yb/er/tm/gd。具有钆掺杂上转换荧光纳米颗粒在980nm近红外光的激发下,不仅可以发出可见光,还可以发出紫外光和800nm近红外光。
38.s2、用盐酸对所述上转换荧光纳米颗粒进行亲水改性
39.将2.5ml 100mm ucnps的环己烷溶液加入到5ml去离子水中,随后滴加20μl的浓盐
酸,密封搅拌2h。ucnps便从上层的环己烷转移到去离子水中,离心收集。整个过程用去离子水清洗并且超声分散,重复三次,最后改性后的h
‑
ucnps分散在10ml去离子水中。
40.s3、对进行亲水改性后的上转换荧光纳米颗粒进行介孔氧化硅层包裹
41.将2g ctac和0.02g tea溶于20ml去离子水中,室温下搅拌1.5h。随后加入h
‑
ucnps的去离子水溶液,继续搅拌1.5h。然后将整个反应体系转移到80度水浴中,逐滴加入200μl teos,反应1h后立即取出来。之后先用乙醇反复清洗3遍,再将其溶于质量分数为1wt%的nacl的甲醇溶液中,室温下搅拌3h,整个过程持续3遍,直至ctac完全除去为止。最后,将产物ucmsns分散至10ml去离子水中。
42.s4、在所述介孔氧化硅层外表面嫁接细胞核靶向配体
43.将38mg edc,57mg nhs和200μg tat溶解于8ml去离子水中,搅拌5分钟后,加入45μl aptes,继续反应24h。然后逐滴加入2ml ucmsns的去离子水溶液,继续反应24h后,用去离子水清洗三遍,最后,将产物ucmsns
‑
tat分散在5ml去离子水中。
44.图3显示了ucmsns的合成过程中每步产物的tem照片。其中,图3(a)为上转换荧光纳米颗粒ucnps;图3(b)为进行亲水改性后的上转换荧光纳米颗粒h
‑
ucnps;图3(c)为包裹了介孔氧化硅层的上转换荧光纳米颗粒ucmsns。从图中可以看出,每步合成的产物均呈现规则均一的球形,且具有非常好的分散性和稳定性,便于后续的生物学效应研究。
45.为验证上述细胞核靶向上转换荧光探针ucmsns
‑
tat在细胞水平的荧光成像效果,我们进行了以下实验:首先,将不同浓度的ucmsns
‑
tat与mcf
‑
7/adr耐药细胞共培养24h和48h后,利用mtt试剂检测ucmsns
‑
tat的细胞相容性。其次,将ucmsns
‑
tat与mcf
‑
7/adr细胞共培养24h后,利用dapi染色细胞核,然后在共聚焦显微镜下观察ucmsns
‑
tat靶向进入mcf
‑
7/adr细胞核内的荧光影像。
46.图4显示了mcf
‑
7/adr耐药细胞与不同浓度的ucmsns
‑
tat共培养24h和48h后存活率,其表明了细胞核靶向上转换荧光探针ucmsns
‑
tat在细胞水平的生物安全性评价,其中,图4(a)为培养了24h的存活率,图4(b)为培养了48h的存活率。从图中可以看出,mcf
‑
7/adr耐药细胞与不同浓度的ucmsns
‑
tat共培养24h和48h后,仍然保持接近100%左右的存活率,表明ucmsns
‑
tat具有非常好的生物相容性。
47.图5为细胞核靶向上转换荧光探针ucmsns
‑
tat通过尾静脉注射入荷mcf
‑
7/adr耐药肿瘤小鼠后的荧光成像图,其中,图5(a)为明场像,图5(b)为上转换荧光成像,图5(c)为图5(a)和图5(b)的叠加图。从图中可以看出,mcf
‑
7/adr耐药肿瘤区出现了明显的荧光信号,说明ucmsns
‑
tat可以靶向富集到肿瘤部位。
48.综上所述,本实施例首先采用高温热分解法,制备粒径尺寸约为19nm的钆掺杂上转换荧光纳米颗粒ucnps(nayf4:yb/er/tm/gd);然后,直接用微量浓盐酸对其进行亲水改性(记作h
‑
ucnps);接着,以表面活性剂ctac作为造孔剂,在h
‑
ucnps表面均匀包裹一层厚度可控的介孔氧化硅,得到尺寸在50nm以下的介孔氧化硅包裹的ucnps(记作ucmsns)。最后,在ucmsns的外表面修饰细胞核靶向配体多肽tat,从而得到具有细胞核靶向功能的上转换荧光探针(记作ucmsns
‑
tat)。其中,内核ucnps具有上转换荧光成像功能;介孔氧化硅结构可以用于后续载药,tat可以高效靶向细胞核。本发明的合成工艺简单易行、制备成本低、效率高。所制得的材料具有非常好的分散性、稳定性以及生物相容性,并且整体尺寸可以控制在50nm以下,可望减少免疫系统(res)的吞噬,在生物医学影像领域具有广阔的应用前
景,尤其适用于细胞核靶向药物输运和荧光影像示踪观察。
49.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。