用于免疫疗法的组合物和方法
交叉引用
1.本技术要求2018年12月7日提交的中国专利申请号201811501797.8;2019年1月25日提交的pct申请号pct/cn2019/073252;2019年4月12日提交的中国专利申请号201910297171.8;以及2019年7月26日提交的pct申请号pct/cn2019/097996的优先权,其每一个通过引用全部并入本文。
背景技术:
2.作为免疫疗法的一个实例,过继性t细胞疗法涉及肿瘤特异性t细胞的分离和离体扩增,以获得比单独接种可获得的t细胞数量更多的t细胞。然后将肿瘤特异性t细胞注入癌症患者体内,使他们的免疫系统能够通过可攻击和杀死癌症的t细胞压倒剩余的肿瘤。虽然有多种形式的过继性t细胞治疗癌症,但它们总体上存在各种缺陷。其中包括细胞耗竭、制备时间长和工程化细胞组成无效。
技术实现要素:
3.鉴于上述情况,非常需要替代组合物和方法来进行免疫疗法。本公开内容的组合物和方法解决了这种需要,并且还提供了另外的优点。特别地,本公开内容的各个方面提供了用于免疫细胞调节的系统。
4.一方面,本公开内容提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法,包括:将包含所述工程化免疫细胞的免疫细胞群体输注到有需要的受试者中,其中所述工程化免疫细胞已经不超过2周或1周未经历离体扩增,并且其中所述群体的进一步特征在于:所述群体中的中央记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富。在一些实施方案中,工程化免疫细胞已经经历了少于13、12、10、9、8、7、6、5、4、3、2或1天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于6、5、4、3、2或1天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于5天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于72、48、36、32或24小时的离体扩增。在一些实施方案中,tcm是cd45ro
cd62l
。在一些实施方案中,tem是cd45ro
cd62l
‑
。在一些实施方案中,群体的特征还在于其在pd1和lag3中的丰度较低。在一些实施方案中,与经历离体扩增不超过2周或1周或10或9天的可比群体中的细胞耗竭相比,观察到群体中细胞耗竭减少。
5.在一些方面,群体的耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。
6.在一些实施方案中,工程化免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。在一些实施方案中,所述car包含:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,tcr或car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、
cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。在一些实施方案中,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。在一些实施方案中,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少2个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,car进一步包含信号肽,并且其中所述信号肽源自igg1、gm
‑
csf和/或cd8α。在一些实施方案中,工程化免疫细胞来自外周血、脐带血、骨髓和/或诱导多能干细胞。在一些实施方案中,工程化免疫细胞来自外周血,并且其中所述外周血细胞是t细胞。在一些实施方案中,与经历离体扩增不超过2周或1周的可比群体相比,在群体中观察到更大的记忆和/或干性。在一些实施方案中,与tem相比,tcm多2倍。在一些实施方案中,与tem相比,tcm多4倍。在一些实施方案中,输注是静脉内的。在一些实施方案中,施用包括输注约1x104/kg体重的工程化免疫细胞。在一些实施方案中,施用包括输注约3x105/kg体重的工程化免疫细胞。在一些实施方案中,至少10%的免疫细胞表达car和/或tcr。在一些实施方案中,至少20%的免疫细胞表达car和/或tcr。在一些实施方案中,至少40%的免疫细胞表达car和/或tcr。在一些实施方案中,方法进一步包括向有需要的受试者施用第二药剂。在一些实施方案中,所述第二药剂是治疗有效量的免疫刺激剂、免疫抑制剂、抗真菌剂、抗生素、抗血管生成剂、化疗剂、放射性剂和/或抗病毒剂。在一些方面,免疫刺激剂是il
‑
2。在一些方面,方法还包括在所述施用后从有需要的所述受试者获得外周血。在一些方面,所述受试者中的所述工程化免疫细胞从所述外周血中量化。在一些实施方案中,量化所述受试者中的生长因子水平。在一些实施方案中,生长因子选自il
‑
10、il
‑
6、肿瘤坏死因子α(tnf
‑
α)、il
‑
1β、il
‑
2、il
‑
4、il
‑
8、il
‑
12和/或ifn
‑
γ。在一些方面,方法包括重复输注。在一些实施方案中,所述免疫细胞群体对于有需要的所述受试者是同种异体的。在一些方面,所述免疫细胞群体对于有需要的所述受试者是自体的。在一些方面,受试者患有癌症。在一些实施方案中,癌症是血液学的。在一些方面,所述血液癌症是白血病、骨髓瘤、淋巴瘤和/或其组合。在一些实施方案中,所述白血病是慢性淋巴细胞白血病(cll)、急性髓样白血病(aml)、t细胞急性淋巴细胞白血病(t
‑
all)、b细胞急性淋巴细胞白血病(b
‑
all)和/或急性淋巴细胞白血病(all)。在一些实施方案中,所述淋巴瘤是套细胞淋巴瘤(mcl)、t细胞淋巴瘤、霍奇金淋巴瘤和/或非霍奇金淋巴瘤。在一些实施方案中,癌症是实体的。在一些实施方案中,实体癌选自:肾母细胞瘤、尤因氏肉瘤、神经内分泌瘤、胶质母细胞瘤、神经母细胞瘤、黑色素瘤、皮肤癌、乳腺癌、结肠癌、直肠癌、前列腺癌、肝癌、肾癌、胰腺癌、肺癌、胆道癌、宫颈癌、子宫内膜癌、食道癌、胃癌、头颈癌、甲状腺髓样癌、卵巢癌、神经胶质瘤或膀胱癌。在一些实施方案中,所述有需要的受试者具有bcr
‑
abl突变,并且所述突变在bcr
‑
abl激酶结构域中。在一些实施方案中,所述有需要的受试者在所述bcr
‑
abl激酶结构域中具有t315i和/或v299l突变。在一些方面,所述受试者显示对酪氨酸激酶抑制剂的
抗性。在一些方面,所述受试者患有肿瘤或在化疗后易患肿瘤。在一些方面,在所述施用之前使用化学疗法对所述受试者进行预治疗。在一些方面,所述化学疗法包括施用氟达拉滨、环磷酰胺和/或阿糖胞苷。在一些实施方案中,所述受试者具有微小残留病变(mrd),并且所述mrd是急性淋巴细胞白血病。
7.在一些实施方案中,受试者的免疫细胞群体的进一步特征在于,与经历离体扩增不超过2周或1周的可比群体(例如c
‑
cart)的增殖、细胞毒性和/或骨髓迁移相比,在所述群体中观察到更大的增殖、细胞毒性和/或骨髓迁移。在一些实施方案中,可使用确定以下水平的测定法来评价受试者细胞群体(诸如f
‑
cart):迁移、增殖、细胞毒性和效应活性。可使用趋化性测定来确定迁移水平。一方面,迁移可指迁移到骨髓中。一方面,迁移可指从骨髓中迁移出来。一方面,迁移还可指向靶标例如趋化因子或癌细胞的移动。一方面,趋化因子系统包括超过40种趋化因子和超过18种趋化因子受体。趋化因子受体的定义是它们能够诱导细胞(诸如工程化免疫细胞)向趋化细胞因子(趋化性)的梯度方向迁移。趋化因子受体是7个跨膜域、g蛋白偶联细胞表面受体的家族,根据它们对某些趋化因子的特定偏好,它们被指定为cxcr1到cxcr5、ccr1到ccr11、xcr1和cx3cr1。趋化因子是小的分泌蛋白,可根据所有趋化因子中存在的2个保守半胱氨酸残基是否被中间氨基酸隔开,分为2个主要亚家族,分别是cxc或cc趋化因子。在一些实施方案中,可在工程化免疫细胞群体中量化迁移或趋化性。一方面,可使用cxcr4和配体sdf
‑
1(cxcl12)轴在体外评估对癌症的迁移或趋化性。一方面,与表达cxcr4的cd3、cd4和/或cd8 c
‑
cart相比,表达cxcr4的cd3、cd4和/或cd8 f
‑
cart的百分比更高。一方面,与cd3、cd4和/或cd8阳性c
‑
cart上的cxcr4相比,在cd3、cd4和/或cd8阳性f
‑
cart中观察到cxcr4的更大平均荧光强度(mfi)。cxcr4的表达可指示免疫细胞群体向表达cxcr4配体、cxcl12的靶标的迁移潜力增加。一方面,受体诸如cxcr4的mfi可在工程化免疫细胞群体中量化以确定细胞上cxcr4受体的密度。工程化免疫细胞(诸如f
‑
cart)上的mfi或cxcr4密度增加,可表明细胞的迁移潜力增加。在一些情况下,可通过确定向靶标(例如基质细胞衍生因子1(sdf1),也称为c
‑
x
‑
c基序趋化因子12(cxcl12))迁移的细胞数量来测量在f
‑
cart和c
‑
cart群体中的迁移。在一个实施方案中,可在体外或体内建立sdf
‑
1(人或鼠)的梯度并用于确定工程化免疫细胞(诸如f
‑
cart)向靶标的迁移或趋化性。一方面,与c
‑
cart的cxcr4的百分比或mfi相比,f
‑
cart的cxcr4的百分比或mfi可为约10%、20%、30%、40%、50%、60%、70%、80%、90%或高达约100%以上。一方面,与当包含工程化免疫细胞的群体和可比群体接触靶标时经历离体扩增不超过2周或1周的包含工程化免疫细胞的可比群体相比,在包含工程化免疫细胞的群体中细胞毒性至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1.0倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
8.一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,包含工程化免疫细胞的细胞群体在体内的增殖得到增强,并且在包含工程化免疫细胞的群体中增殖至少高0.5倍、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、50倍、100倍、500倍、1000倍、5000倍或10000倍。一方面,增殖可使用羧基荧光素琥珀酰亚胺酯(cfse)测定法在体外量化。一方面,增殖可使用细胞计数器在体外量化,例如使用细胞计数器。可通过细胞计数方法测量的变量包括例如:细胞大小、细胞计数、细胞形态(形状和结构)、细胞周期阶段、dna含量以及细胞表面或细胞质中特定蛋白质的存在与否。细胞计数器
可评估在细胞增殖过程中可观察到的细胞团块。细胞团块可用作评估增殖增强的因素,例如在工程化细胞群体中。在另一方面,细胞计数器可用于对细胞进行计数。一方面,细胞计数器(诸如流式细胞仪)可用于量化样品(例如血液、细胞培养物、骨髓、肿瘤及其任何组合)中的多个细胞。流式细胞仪可利用细胞表面蛋白来量化细胞,诸如工程化免疫细胞。可使用的细胞标志物可以是:cd45、cd2、信标、car、tcr、cd3、cd4、cd8、cd62及其任何组合。
9.一方面,可通过使用定量pcr(qpcr)量化受试者中工程化免疫细胞的拷贝数来体内确定工程化免疫细胞的增殖和/或持久性。一方面,工程化免疫细胞的拷贝数计算为每微升的血细胞数。一方面,工程化免疫细胞的拷贝数计算为每微克的dna拷贝数。一方面,持久性也可在体内计算。
10.一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在包含工程化免疫细胞的群体中骨髓迁移至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍或10倍。
11.一方面,靶标可以是癌细胞或趋化因子。在一些情况下,趋化因子是基质细胞衍生因子
‑
1(sdf
‑
1)。在一些情况下,sdf
‑
1在施用包含工程化免疫细胞的细胞疗法的受试者的骨髓中表达。一方面,与经历离体扩增不超过2周或1周的可比群体相比,包含工程化免疫细胞的群体具有更大百分比的cxcr4阳性细胞。一方面,与经历离体扩增不超过2周或1周的可比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或100%。一方面,与经历离体扩增不超过2周或1周的可比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。一方面,与经历离体扩增不超过2周或1周的可比群体的细胞表面上的cxcr4密度相比,包含工程化免疫细胞的群体在cxcr4阳性细胞的细胞表面上具有更大的cxcr4密度。一方面,密度是通过评估cxcr4阳性细胞的细胞表面上的cxcr4的平均荧光强度(mfi)测量的。cxcr4阳性细胞可以是cd3 、cd4 、cd8 及其任何组合。在一些实施方案中,可使用体内测定来测量细胞毒性。一方面,与在施用经历离体扩增不超过2周或1周的可比群体的可比受试者中观察到的癌症负担相比,当所述受试者施用包含工程化免疫细胞的群体时,在受试者中观察到癌症负担降低。一方面,与施用经历离体扩增不超过2周或1周的可比群体的可比受试者相比,癌症负担在用包含工程化免疫细胞的群体治疗的受试者中降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。
12.一方面,在表达f
‑
cart和c
‑
cart上的car对其显示特异性的靶标的哺乳动物肿瘤中,f
‑
cart相对于c
‑
cart的数目更多。一方面,在表达f
‑
cart和c
‑
cart上的car对其显示特异性的靶标的哺乳动物股骨中,f
‑
cart相对于c
‑
cart的数目更多。f
‑
cart和c
‑
cart可通过cd45、cd2和/或car的表达在哺乳动物的肿瘤和/或股骨中量化。一方面,与c
‑
cart相比,哺乳动物肿瘤和/或股骨中f
‑
cart多约1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍或至多约20倍。
13.一方面,在体外测定中测量工程化免疫细胞诸如f
‑
cart的细胞毒性并与c
‑
cart的细胞毒性进行比较。在一些方面,细胞毒性在体内测定中测量。一方面,细胞毒性可通过量
化细胞诸如car
‑
t 细胞工程化免疫细胞分泌的ifnγ水平来测量。一方面,与c
‑
cart或当与car对其显示特异性的靶标接触时经历不超过2周或1周的离体扩增的可比细胞相比,f
‑
cart可分泌和/或表达更高水平的ifnγ和/或il
‑
2。一方面,当与表达car对其显示特异性的靶标的细胞接触时,与c
‑
cart相比,f
‑
cart分泌和/或表达增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或至多约100%的ifnγ和/或il
‑
2。一方面,在体内观察到更大的细胞毒性。一方面,细胞毒性可通过量化患有癌症的哺乳动物的肿瘤减少水平来测量,所述患有癌症的哺乳动物用工程化免疫细胞诸如具有对癌症具有特异性的car受体的f
‑
cart治疗。哺乳动物的癌症减少可通过量化具有包含荧光蛋白的肿瘤细胞的哺乳动物的荧光水平来测量。在具有包含荧光蛋白的肿瘤细胞的哺乳动物中较低的荧光可表明工程化免疫细胞对癌症的细胞毒性。在一些情况下,与用c
‑
cart细胞治疗的哺乳动物相比,用f
‑
cart治疗的哺乳动物的癌症减少可增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或至多约100%。一方面,可量化细胞增殖的水平。细胞增殖可指细胞计数、培养中细胞的团块和/或细胞分裂。细胞增殖可使用体内或体外测定进行量化。在一些情况下,细胞增殖可通过使用细胞计数器和/或通过体外测定诸如羧基荧光素琥珀酰亚胺酯(cfse)对许多细胞进行量化来测量。一方面,当与car对其显示特异性的靶标接触时,f
‑
cart与c
‑
cart相比可增殖更多。一方面,与c
‑
cart的可比群体相比,当与表达car对其显示特异性的靶标的细胞接触时,在f
‑
cart的群体中观察到更大的增殖,所述增殖可增加约10%、20%、30%、40%、50%、60%、70%、80%、90%或至多约100%。另一方面,本公开内容提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法,包括将包含所述工程化免疫细胞的免疫细胞群体输注到有需要的受试者中,其中所述工程化免疫细胞已经不超过2周或1周,或少于13、12、10、9、8、7或6天未经历离体扩增,并且其中至少2%的所述群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少5%的群体是tscm。在一些实施方案中,至少10%的群体是tscm。在一些实施方案中,至少15%的群体是tscm。在一些实施方案中,至少20%的群体是tscm。在一些实施方案中,至少40%的群体是tscm。在一些实施方案中,至少50%的群体是tscm。在一些实施方案中,至少2%、5%、10%、20%、40%、50%或至少60%的群体是tscm。在一些实施方案中,tscm是cd45ro
‑
cd62l
。在一些实施方案中,工程化免疫细胞已经经历了少于1周的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于72、48、36、32或24小时的离体扩增。在一些实施方案中,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。在一些实施方案中,所述car包含:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,tcr或car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。在一些实施方案中,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。在一些实施方案中,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、
gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少两个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,car进一步包含信号肽,并且其中所述信号肽源自igg1、gm
‑
csf和/或cd8α。在一些实施方案中,工程化免疫细胞来自外周血、脐带血、骨髓和/或诱导多能干细胞。在一些实施方案中,所述工程化免疫细胞来自外周血,并且其中所述外周血细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,输注是静脉内的。在一些实施方案中,施用包括输注约1x104/kg体重的工程化免疫细胞。在一些实施方案中,施用包括输注约1x105/kg体重的工程化免疫细胞。在一些实施方案中,施用包括输注约3x105/kg体重的工程化免疫细胞。在一些实施方案中,至少20%的免疫细胞表达car和/或tcr。在一些实施方案中,至少40%的免疫细胞表达car和/或tcr。在一些方面,方法进一步包括向有需要的受试者施用第二药剂。在一些实施方案中,所述第二药剂是治疗有效量的免疫刺激剂、免疫抑制剂、抗真菌剂、抗生素、抗血管生成剂、化疗剂、放射性剂和/或抗病毒剂。在一些实施方案中,免疫刺激剂是il
‑
2。在一些方面,方法还包括在输注后从有需要的所述受试者获得外周血。在一些实施方案中,对来自所述外周血的所述工程化免疫细胞进行量化。在一些实施方案中,量化细胞因子的水平。在一些实施方案中,细胞因子是il
‑
10、il
‑
6、肿瘤坏死因子α(tnf
‑
α)、il
‑
1β、il
‑
2、il
‑
4、il
‑
8、il
‑
12和/或ifn
‑
γ。在一些实施方案中,方法包括重复输注。
14.在一些方面,本文提供的群体的进一步特征在于,与经历离体扩增不超过2周或1周的可比群体中的细胞耗竭相比,观察到群体中细胞耗竭减少。
15.一方面,群体的耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。在一些实施方案中,群体的进一步特征在于,与经历离体扩增不超过2周或1周的可比群体的增殖、细胞毒性和/或骨髓迁移相比,在所述群体中观察到更大的增殖、细胞毒性和/或骨髓迁移。一方面,细胞毒性在体外测定中测量。一方面,细胞毒性在体内测定中测量。一方面,与当包含工程化免疫细胞的所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的包含工程化免疫细胞的可比群体相比,在包含工程化免疫细胞的群体中细胞毒性至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1.0倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
16.一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在包含工程化免疫细胞的群体中体内和/或体外增殖至少高0.5倍、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、50倍、100倍、500倍、1000倍、5000倍或10000倍。
17.一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在包含工程化免疫细胞的群体中骨髓迁移至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍或10倍。
18.一方面,靶标可以是癌细胞或趋化因子。在一些情况下,趋化因子是基质细胞衍生因子
‑
1(sdf
‑
1)。在一些情况下,sdf
‑
1在施用包含工程化免疫细胞的细胞疗法的受试者的骨髓中表达。一方面,与经历离体扩增不超过2周或1周的可比群体相比,包含工程化免疫细胞的群体具有更大百分比的cxcr4阳性细胞。一方面,与经历离体扩增不超过2周或1周的可
比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或100%。一方面,与经历离体扩增不超过2周或1周的可比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。一方面,与经历离体扩增不超过2周或1周的可比群体的细胞表面上的cxcr4密度相比,包含工程化免疫细胞的群体在cxcr4阳性细胞的细胞表面上具有更大的cxcr4密度。一方面,密度是通过评估所述cxcr4阳性细胞的所述细胞表面上的cxcr4的平均荧光强度(mfi)测量的。cxcr4阳性细胞可以是cd3 、cd4 、cd8 及其任何组合。在一些实施方案中,可使用体内测定来测量细胞毒性。一方面,与在施用经历离体扩增不超过2周或1周的可比群体的可比受试者中观察到的癌症负担相比,当所述受试者施用包含工程化免疫细胞的群体时,在受试者中观察到癌症负担降低。一方面,与施用经历离体扩增不超过2周或1周的可比群体的可比受试者相比,癌症负担在用包含工程化免疫细胞的群体治疗的受试者中降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。另一方面,本公开内容提供了一种产生表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的群体的方法,包括:(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸,其中所述car包含(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域;从而产生表达所述car的工程化免疫细胞群体。一方面,激活部分结合:cd3/t细胞受体复合物和/或提供共刺激。一方面,激活部分是抗cd3抗体和/或抗cd28抗体中的任何一种。在一些实施方案中,激活部分与固相缀合。在一些实施方案中,固相是珠、板和/或基质中的至少一种。一方面,固相是珠。一方面,引入包括用病毒载体和/或转座子载体转导细胞群体。一方面,病毒载体是逆转录病毒载体、慢病毒载体和/或腺相关病毒载体。在一些实施方案中,转座子载体是睡美人载体和/或piggybac载体。一方面,步骤(a)和(b)在48小时内进行。一方面,步骤(a)和(b)在24小时内进行。一方面,步骤(a)和(b)在3小时内进行。一方面,步骤(a)和(b)在1小时内进行。在一些实施方案中,步骤(a)和(b)在30min内进行。在一些实施方案中,步骤(a)和(b)同时进行。在一些实施方案中,转导包括添加感染剂。在一些实施方案中,感染剂是聚凝胺。在一些实施方案中,以约104/ml至约108/ml的密度接种所述细胞群体。在一些实施方案中,所述病毒载体以约0.1至约10的传染性平均值(mean of infectivity,moi)平板接种。在一些实施方案中,方法进一步包括用细胞因子刺激细胞群体。在一些实施方案中,细胞因子是il2、il7、il15和/或il21。在一些实施方案中,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。在一些实施方案中,所述car包含:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,所述tcr或car的所述配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、
notch
‑1‑
4和/或claudin18.2。在一些实施方案中,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。在一些实施方案中,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少两个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,方法还包括在所述工程化之前富集所述免疫细胞。在一些实施方案中,富集包括收集单核细胞部分。在一些实施方案中,富集包括从单核细胞部分中分选免疫细胞。在一些实施方案中,所述富集包括基于一种或多种标志物的表达来分选所述免疫细胞。在一些方面,一种或多种标志物包括cd3、cd28、cd4和/或cd8。在一些方面,使用抗cd3抗体或其抗原结合片段,和/或抗cd28抗体或其抗原结合片段来分选所述免疫细胞。在一些实施方案中,使用与所述抗cd3抗体或其抗原结合片段缀合的珠和/或与所述抗cd28抗体或其抗原结合片段缀合的珠来分选所述免疫细胞。在一些实施方案中,所述工程化免疫细胞群体的特征在于所述群体中的细胞记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富。一方面,至少2%的群体是干细胞样记忆性t细胞(tscm)。一方面,至少5%的群体是干细胞样记忆性t细胞(tscm)。一方面,至少10%的群体是干细胞样记忆性t细胞(tscm)。一方面,至少15%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少20%的群体是tscm。在一些实施方案中,至少25%的群体是tscm。在一些实施方案中,至少40%的群体是tscm。在一些实施方案中,至少50%的群体是tscm。在一些实施方案中,至少2%、5%、10%、20%、40%、50%或至少60%的群体是tscm。一方面,方法还包括在(a)和(b)完成后72小时内将所述工程化免疫细胞群体输注给有需要的受试者的步骤。一方面,群体的进一步特征在于,与(a)和(b)不是同时进行的可比方法的可比群体中的细胞耗竭相比,观察到群体中细胞耗竭减少。一方面,群体的耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。
19.在一个实施方案中,群体的进一步特征在于,与经历(a)和(b)不是同时进行的可比方法的可比群体中的增殖、细胞毒性和/或骨髓迁移相比,在所述群体中观察到更大的增殖、细胞毒性和/或骨髓迁移。一方面,细胞毒性在体外测定中测量。一方面,细胞毒性在体内测定中测量。一方面,与当包含工程免疫细胞的群体和可比群体接触靶标时(a)和(b)进行超过24小时的可比群体相比,细胞毒性被量化,并且在包含工程化免疫细胞的群体中至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1.0倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
20.一方面,与当所述群体和可比群体接触靶标时(a)和(b)进行超过24小时的可比群体相比,在包含工程化免疫细胞的群体中体内和/或体外增殖至少高0.5倍、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、50倍、100倍、500倍、1000倍、5000倍或10000倍。
21.一方面,与当所述群体和可比群体接触靶标时(a)和(b)进行超过24小时的可比群体相比,在包含工程化免疫细胞的群体中骨髓迁移至少高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍或10倍。
22.一方面,靶标可以是癌细胞或趋化因子。趋化因子是基质细胞衍生的因子
‑
1(sdf
‑
1),其可在接受施用包含工程化免疫细胞的群体的受试者的骨髓中表达。在一些实施方案
中,与(a)和(b)进行超过24小时的可比群体相比,包含工程化免疫细胞的群体具有更大百分比的cxcr4阳性细胞。一方面,与(a)和(b)进行超过24小时的可比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%或100%。一方面,与(a)和(b)进行超过24小时的可比群体表达的cxcr4阳性细胞的中值百分比相比,包含工程化免疫细胞的群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。一方面,与(a)和(b)进行超过24小时的可比群体的细胞表面上的cxcr4密度相比,包含工程化免疫细胞的群体在cxcr4阳性细胞的细胞表面上具有更大的cxcr4密度。细胞表面受体的密度,诸如cxcr4,可通过评估cxcr4阳性细胞的细胞表面上的cxcr4的平均荧光强度(mfi)测量。一方面,细胞毒性在体内测定中测量。在一些情况下,与在施用(a)和(b)进行超过24小时的可比群体的可比受试者中观察到的癌症负担相比,当所述受试者施用包含工程化免疫细胞的群体时,在受试者中观察到癌症负担降低。一方面,与施用(a)和(b)进行超过24小时的可比群体的可比受试者相比,癌症负担在用包含工程化免疫细胞的群体治疗的受试者中降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。
23.一方面,本文提供了一种包括细胞输注设备的照护点设备,配置为输注免疫细胞群体,所述免疫细胞群体包含未经历离体扩增2周或更多周或少于13、12、10、9、8、7、6、5、4、3、2、1天的工程化免疫细胞,其中所述免疫细胞群体的进一步特征在于:所述群体中的细胞记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富;或其中所述群体的至少2%是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少5%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少10%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少15%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少20%的群体是tscm。在一些实施方案中,至少40%的群体是tscm。在一些实施方案中,至少50%的群体是tscm。在一些实施方案中,至少2%、5%、10%、20%、40%、50%或至少60%的群体是tscm。在一些实施方案中,与tem相比,tcm多2倍。在一些实施方案中,与tem相比,tcm多4倍。在一些实施方案中,工程化免疫细胞已经经历了少于5天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于3天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于2天的离体扩增。在一些实施方案中,工程化免疫细胞已经经历了少于1天的离体扩增。在一些实施方案中,免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些方面,所述群体的特征还在于观察到所述群体中细胞耗竭减少,并且其中所述耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。
24.本文提供了一种包括细胞处理设备的照护点设备,配置为(a)从受试者接收包含免疫细胞的细胞群体;以及(b)用激活部分激活所述免疫细胞群体,同时将编码至少嵌合抗原受体(car)的多核苷酸引入所述免疫细胞,其中所述car包含(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域;以及(c)从进行(b)的时间起2周或更短时间内向所述受试者输注(b)的所述免疫细胞群体。在一些实施方案中,步骤(c)在从进行(b)的时间起1周或更短的时间内进行。在一些实施方案中,免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,所述car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、
cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。在一些实施方案中,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。在一些实施方案中,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少两个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,car进一步包含信号肽,并且其中所述信号肽源自igg1、gm
‑
csf和/或cd8α。在一些实施方案中,免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,激活部分结合:cd3/t细胞受体复合物和/或提供共刺激。在一些实施方案中,激活部分是抗cd3抗体和/或抗cd28抗体中的任何一种。在一些实施方案中,病毒载体和/或转座子载体包含多核苷酸。一方面,病毒载体是逆转录病毒载体、慢病毒载体和/或腺相关病毒载体。在一些实施方案中,步骤(a)和(b)在24小时内进行。在一些实施方案中,步骤(a)和(b)在3小时内进行。在一些实施方案中,步骤(a)和(b)在1小时内进行。在一些实施方案中,步骤(a)和(b)在30分钟内进行。在一些方面,所述群体的特征还在于观察到所述群体中细胞耗竭减少,并且其中所述耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。
25.一方面,本文提供了一种包含表达嵌合抗原受体(car)和/或t细胞受体(tcr)的工程化免疫细胞的细胞群体,其中所述群体的进一步特征在于(i)群体中的中央记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富;和/或(ii)至少2%的所述细胞群体是干细胞样记忆性t细胞(tscm),并且其中car包含(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。一方面,至少5%的群体是tscm。一方面,至少10%的群体是tscm。在一些实施方案中,与tem相比,tcm多2倍。在一些实施方案中,与tem相比,tcm多4倍。在一些实施方案中,免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,所述car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。一方面,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。一方面,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少两个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还
包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,car进一步包含信号肽,并且其中所述信号肽源自igg1、gm
‑
csf和/或cd8α。一方面,免疫细胞是t细胞、nk细胞和/或nkt细胞。一方面,群体是冷冻保存的。一方面,群体不是冷冻保存的。一方面,群体是新鲜来源的或包含新鲜来源的细胞。一方面,所述群体的特征还在于观察到所述群体中细胞耗竭减少,并且其中所述耗竭减少的特征在于所述群体包含较少的表达pd1和lag3的细胞。
26.一方面,本文提供了一种治疗有需要的受试者的癌症的方法,包括输注不超过约2x106个表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞群体,其中所述工程化免疫细胞在不超过2周或1周内未进行离体扩增。一方面,与表达相同嵌合抗原受体(car)和/或工程化t细胞受体(tcr)但已经进行离体扩增不超过2周或1周的10倍以上的工程化免疫细胞群体相比,所述工程化免疫细胞群体在体内表现出相当水平的抗肿瘤活性。一方面,所述工程化免疫细胞群体已经用表达所述car和/或tcr的构建体同时激活和转导。一方面,工程化免疫细胞群体已经一周没有经历离体扩增。一方面,工程化免疫细胞群体已经72小时没有经历离体扩增。一方面,不超过约1x106个工程化免疫细胞的群体是从外周血单核细胞(pmbc)通过用表达所述car和/或tcr的构建体同时激活和转导的方法制备的。在一些实施方案中,所述输注发生在用表达所述car和/或tcr的构建体同时激活和转导的1周内。在一些实施方案中,同时激活包括在48小时内进行激活和转导。在一些实施方案中,同时激活包括在24小时内进行激活和转导。在一些实施方案中,同时激活包括在3小时内进行激活和转导。在一些实施方案中,同时激活包括在1小时内进行激活和转导。在一些实施方案中,同时激活包括在30分钟内进行激活和转导。在一些实施方案中,同时激活包括同时进行激活和转导。在一些实施方案中,至少2%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少5%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少10%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少15%的群体是干细胞样记忆性t细胞(tscm)。在一些实施方案中,至少20%的群体是tscm。在一些实施方案中,至少40%的群体是tscm。在一些实施方案中,至少50%的群体是tscm。在一些实施方案中,至少2%、5%、10%、20%、40%、50%或至少60%的群体是tscm。在一些实施方案中,输注不超过约105个工程化免疫细胞。在一些实施方案中,输注不超过约104个工程化免疫细胞。在一些实施方案中,输注不超过约103个工程化免疫细胞。在一些实施方案中,工程化免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些实施方案中,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。在一些实施方案中,所述car包含:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,所述tcr或car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。在一些实施方案中,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。在一些实施方案中,细胞内信号传
导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些实施方案中,car包含至少2个细胞内信号传导结构域。在一些实施方案中,car包含至少3个细胞内信号传导结构域。在一些实施方案中,car还包含铰链。在一些实施方案中,铰链来自cd28、igg1和/或cd8α。在一些实施方案中,car进一步包含信号肽,并且其中所述信号肽源自igg1、gm
‑
csf和/或cd8α。在一些实施方案中,工程化免疫细胞来自外周血、脐带血、骨髓和/或诱导多能干细胞。在一些实施方案中,工程化免疫细胞来自外周血,并且其中所述外周血细胞是t细胞。一方面,方法还包括在所述施用后从有需要的所述受试者获得外周血。一方面,所述受试者中的所述工程化免疫细胞从所述外周血中量化。一方面,量化所述受试者中的生长因子水平。在一些情况下,生长因子选自il
‑
10、il
‑
6、肿瘤坏死因子α(tnf
‑
α)、il
‑
1β、il
‑
2、il
‑
4、il
‑
8、il
‑
12和/或ifn
‑
γ。在一些实施方案中,方法包括重复输注。在一些实施方案中,所述免疫细胞群体对于有需要的所述受试者是同种异体的。在一些实施方案中,所述免疫细胞群体对于有需要的所述受试者是自体的。在一些实施方案中,受试者患有癌症。一方面,癌症可以是靶标。一方面,癌症是血液学的。一方面,所述血液癌症是白血病、骨髓瘤、淋巴瘤和/或其组合。在一些实施方案中,白血病是慢性淋巴细胞白血病(cll)、急性髓样白血病(aml)、t细胞急性淋巴细胞白血病(t
‑
all)、b细胞急性淋巴细胞白血病(b
‑
all)和/或急性淋巴细胞白血病(all)。在一些实施方案中,所述淋巴瘤是套细胞淋巴瘤(mcl)、t细胞淋巴瘤、霍奇金淋巴瘤和/或非霍奇金淋巴瘤。在一些实施方案中,癌症是靶标并且是实体的。在一些实施方案中,实体癌靶标选自:肾母细胞瘤、尤因氏肉瘤、神经内分泌瘤、胶质母细胞瘤、神经母细胞瘤、黑色素瘤、皮肤癌、乳腺癌、结肠癌、直肠癌、前列腺癌、肝癌、肾癌、胰腺癌、肺癌、胆道癌、宫颈癌、子宫内膜癌、食道癌、胃癌、头颈癌、甲状腺髓样癌、卵巢癌、神经胶质瘤或膀胱癌。在一些实施方案中,在所述施用之前用化学疗法对所述受试者进行预治疗。在一些实施方案中,所述化学疗法包括施用氟达拉滨、环磷酰胺和/或阿糖胞苷。一方面,群体的进一步特征在于,与经历离体扩增不超过2周或1周的可比群体的增殖、细胞毒性和/或骨髓迁移相比,在所述群体中观察到更大的增殖、细胞毒性和/或骨髓迁移。一方面,细胞毒性在体外测定中测量。一方面,细胞毒性在体内测定中测量。
27.一方面,本文提供了本文提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法,包括将包含所述工程化免疫细胞的免疫细胞群体输注到有需要的受试者中,其中所述工程化免疫细胞已经不超过2周或1周未经历离体扩增,并且其中所述群体的进一步特征在于与经历离体扩增不超过2周或1周的可比群体的所述增殖相比,在所述群体中观察到更大的增殖。一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在所述群体中所述增殖至少高1倍。
28.本文提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法,包括将包含所述工程化免疫细胞的免疫细胞群体输注到有需要的受试者中,其中所述工程化免疫细胞已经不超过2周或1周未经历离体扩增,并且其中所述群体的进一步特征在于与经历离体扩增不超过2周或1周的可比群体的所述细胞毒性相比,在所述群体中观察到更大的细胞毒性。一方面,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在所述群体中所述细胞毒性至少
高0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1.0倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
29.本文提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法,包括:将包含所述工程化免疫细胞的免疫细胞群体输注到有需要的受试者中,其中所述工程化免疫细胞已经不超过2周或1周未经历离体扩增,并且其中所述群体的进一步特征在于与经历离体扩增不超过2周或1周的可比群体的所述骨髓迁移相比,观察到所述群体的更大的骨髓迁移。在一些实施方案中,与当所述群体和可比群体接触靶标时经历离体扩增不超过2周或1周的可比群体相比,在所述群体中所述骨髓迁移至少高1倍。一方面,所述群体的特征还在于:所述群体中的中央记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富。一方面,tcm是cd45ro cd62l 。一方面,tem是cd45ro cd62l
‑
。一方面,工程化免疫细胞已经经历了少于5天的离体扩增。一方面,工程化免疫细胞已经经历了少于4天的离体扩增。一方面,工程化免疫细胞已经经历了少于72天的离体扩增。一方面,工程化免疫细胞已经经历了少于48天的离体扩增。一方面,工程化免疫细胞已经经历了少于24天的离体扩增。一方面,靶标是癌细胞、tcr或car的配体或趋化因子。在一些实施方案中,所述趋化因子是基质细胞衍生因子
‑
1(sdf
‑
1),并且其中所述sdf
‑
1在所述受试者的骨髓中表达。在一些情况下,与经历离体扩增不超过2周或1周的可比群体相比,群体具有更大百分比的cxcr4阳性细胞。一方面,与经历离体扩增不超过2周或1周的可比群体表达的cxcr4阳性细胞的中值百分比相比,群体具有更大的cxcr4阳性细胞的中值百分比,所述中值百分比大至少10%。一方面,与经历离体扩增不超过2周或1周的可比群体的细胞表面上的cxcr4密度相比,群体在cxcr4阳性细胞的细胞表面上具有更大的cxcr4密度。一方面,密度是通过评估所述cxcr4阳性细胞的所述细胞表面上的cxcr4的平均荧光强度(mfi)测量的。一方面,细胞毒性在体内测定中测量。在一些情况下,与在施用经历离体扩增不超过2周或1周的可比群体的可比受试者中观察到的癌症负担相比,在施用所述群体的所述受试者中观察到癌症负担降低。一方面,与施用经历离体扩增不超过2周或1周的可比群体的可比受试者相比,癌症负担在用群体治疗的受试者中降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。一方面,与施用经历离体扩增不超过2周或1周的可比群体的可比受试者相比,癌症负担在用群体治疗的受试者中降低至少0.5倍、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。一方面,与在施用经历离体扩增不超过2周或1周的可比群体的可比受试者中观察到的癌症负担相比,在施用所述群体的所述受试者中观察到完全缓解(cr)。在一些实施方案中,与在施用经历离体扩增不超过2周或1周的可比群体的可比受试者中观察到的癌症负担相比,在施用所述群体的所述受试者中观察到部分反应(pr)。一方面,群体包含至多1x104个细胞/kg/体重的工程化免疫细胞。一方面,群体包含约1x104个细胞/kg/体重的工程化免疫细胞至至多约1x105个细胞/kg/体重的工程化免疫细胞。在一些情况下,工程化免疫细胞是t细胞、nk细胞和/或nkt细胞。在一些情况下,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。一方面,car包括:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。一方面,所述tcr或car的配体是vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、
flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。一方面,跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。一方面,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。在一些情况下,car包含至少2个细胞内信号传导结构域。在一些情况下,car包含至少3个细胞内信号传导结构域。在一些情况下,car还包含铰链。铰链可来自cd28、igg1和/或cd8α。一方面,工程化免疫细胞来自外周血、脐带血、骨髓和/或诱导多能干细胞。在一些情况下,工程化免疫细胞来自外周血,并且所述外周血细胞是t细胞。援引并入
30.本说明书中提到的所有出版物、专利和专利申请都通过引用并入本文,如同每个单独的出版物、专利或专利申请被明确地并单独地指出通过引用并入本文。
附图说明
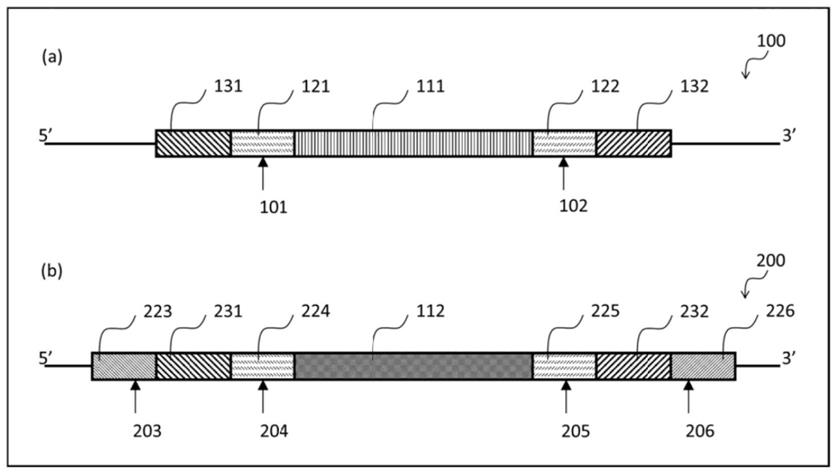
31.本发明的新颖特征在所附权利要求书中具体地阐述。通过参考以下对其中利用到本发明原理的说明性实施方案加以阐述的详细描述及附图,将会获得对本发明特征和优点的更好的理解,在这些附图中:
32.图1示出了f
‑
cart细胞中感染复数(multiplicity of infection,moi)对car阳性百分比的比率。
33.图2示出了常规cart(c
‑
cart)和快速cart(f
‑
cart)生成的细胞的car阳性表达百分比之间的比较。
34.图3示出了使用流式细胞术对对照(起始材料)和f
‑
cart细胞进行的表型分析。
35.图4a示出了抗cd19f
‑
cart对抗cd19 c
‑
cart细胞的细胞增殖的线性图示。图4b示出了抗cd19f
‑
cart对抗cd19 c
‑
cart细胞的增殖倍数。
36.图5描绘了抗cd19f
‑
cart细胞对抗cd19 c
‑
cart细胞在50小时内的体外杀伤效力。
37.图6a示出了当与molt4(cd19
‑
)或raji(cd19 )肿瘤细胞以1:1的比例共培养时,粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)在对照细胞(非转导)、f
‑
cart和c
‑
cart中的表达。图6b示出了当与molt4(cd19
‑
)或raji(cd19 )肿瘤细胞以1:1的比例共培养时,tnf
‑
α在对照细胞(非转导)、f
‑
cart和c
‑
cart中的表达。图6c示出了当与molt4(cd19
‑
)或raji(cd19 )肿瘤细胞以1:1的比例共培养时,il
‑
2在对照细胞、f
‑
cart和c
‑
cart中的表达。图6d示出了当与molt4(cd19
‑
)或raji(cd19 )肿瘤细胞以1:1的比例共培养时,ifn
‑
γ在对照细胞(非转导)、f
‑
cart和c
‑
cart中的表达。
38.图7a描绘了移植molt4或raji肿瘤细胞并用对照t细胞(非转导)、c
‑
cart或f
‑
cart细胞以2e6、5e5或5e4个细胞/小鼠的总剂量处理的小鼠的生物发光成像。图7b示出了注射0.5x106个细胞/小鼠的对照(非转导)t细胞、c
‑
cart或f
‑
cart细胞后生物发光成像天数的图解概要。
39.图8示出了移植raji肿瘤细胞并随后用0.5x106个细胞/小鼠的对照(非转导)、t细胞、c
‑
cart或f
‑
cart细胞处理的小鼠体重变化。
40.图9示出了移植raji肿瘤细胞并随后用对照、t细胞、c
‑
cart或f
‑
cart细胞处理的小鼠的肿瘤体积。
41.图10示出了移植raji肿瘤细胞并随后用对照(非转导)或高剂量(2x106个细胞/小鼠)、中等剂量(5x105个细胞/小鼠)或低剂量(5x104个细胞/小鼠)的f
‑
cart细胞处理的小鼠外周血中细胞的定量。
42.图11a示出了在用k562
‑
cd19 细胞刺激后,第6天对三个单个供体的f
‑
cart和c
‑
cart细胞上的lag3对pd
‑
1进行的表型分析。图11b示出了在用k562
‑
cd19 细胞刺激后,第10天对三个单个供体的f
‑
cart和c
‑
cart细胞上的lag3对pd
‑
1的进行的表型分析。图11c示出了在用k562
‑
cd19 细胞刺激后,第6天对第10天三个单个供体上的pd1 lag3 细胞的平均表达。
43.图12描绘了流式细胞图,示出了在用k562
‑
cd19 细胞刺激后三个单个供体的f
‑
cart细胞中tscm、tcm、teff和tem细胞的数量。
44.图13a示出了输注后至多56天受试者xf001中fast
‑
car
细胞的扩增、持久性和拷贝数。图13b示出了用fast
‑
car
细胞输注后受试者xf001的体温。图13c示出了输注fast
‑
car
细胞后受试者xf001血液中il
‑
6的浓度。图13d示出了输注fast
‑
car
细胞后受试者xf001血液中c反应蛋白(crp)的浓度。
45.图14a示出了用fast
‑
car
细胞输注后受试者f01的体温。图14b示出了受试者f01的外周血中的fast
‑
car
细胞拷贝数、fast
‑
car
拷贝数和骨髓中的fast
‑
car
拷贝数。图14c示出了用fast
‑
car
细胞输注后受试者f01的外周血中生长因子(inf
‑
γ、il
‑
10、scd25、il
‑
6和crp)的水平和体温。
46.图15描绘了f
‑
cart在9个不同受试者中的治疗结果和功效。细胞因子释放综合征(crs)、神经毒性(nt)、完全缓解(cr)、平均残留疾病(mrd)、异体干细胞移植(allo
‑
sct)。
47.图16a示出了流式细胞术图,示出了单个供体的f
‑
cart对c
‑
cart细胞中tscm、tcm、teff和tem细胞的数量。图16b示出了流式细胞术结果的概要。图16c示出了在用k562
‑
cd19 细胞刺激后三个单个供体的f
‑
cart对c
‑
cart中tscm、tcm、tem和teff的百分比的图解概要。
48.图17a示出了在工程化后第8、12和18天f
‑
cart对c
‑
cart细胞的倍数扩增。图17b示出了在f
‑
cart和c
‑
cart细胞工程化后第6天和第10天的pd
‑
1和lag3百分比。图17c示出了用pd
‑
1和lag3染色的单个供体的c
‑
cart和f
‑
cart细胞的流式细胞术结果。图17d示出了从健康供体制备的c
‑
cart和f
‑
cart的共培养测定的体外细胞毒性的维持:用cd19
肿瘤细胞培养的c
‑
cart、用cd19
肿瘤细胞培养的f
‑
cart、用cd19
肿瘤细胞培养的非转导细胞和仅肿瘤细胞(hela
‑
cd19)。图18示出了从健康供体制备的c
‑
cart和f
‑
cart的il
‑
2和ifnγ分泌:用cd19
肿瘤细胞培养的c
‑
cart、用cd19
肿瘤细胞培养的f
‑
cart、用cd19
肿瘤细胞培养的非转导细胞以及仅培养基对照。
49.图19a示出了人类样品gc007ff
‑
cart和c
‑
cart细胞的扩增。图19b示出了样品gc007f中f
‑
cart和c
‑
cart的细胞表型。图19c示出了样品gc007f的细胞表型的饼图。图19d示出了通过t细胞亚群百分比的细胞表型数据的图解概要。图19e显示了第6天和第9天分别在c
‑
cart和f
‑
cart细胞中pd1 lag3 car
‑
t细胞的百分比。
50.图20a示出了在从患者制备的c
‑
cart和f
‑
cart的实时细胞分析(rtca)测定中体外细胞毒性的维持:用cd19
肿瘤细胞培养的c
‑
cart、用cd19
肿瘤细胞培养的f
‑
cart、用cd19
肿瘤细胞培养的非转导细胞和仅肿瘤细胞(hela
‑
cd19)。图20b示出了在共培养细胞的上清液的elisa中细胞因子部分的维持。图20c示出了在荧光素酶测定中确定的从患者制备的f
‑
car对c
‑
cart中细胞毒性的维持。
51.图21a示出了移植raji肿瘤细胞并用对照(仅培养基)、t细胞、c
‑
cart或f
‑
cart细胞以2e6个细胞/小鼠(高剂量)或5e4个细胞/小鼠(低剂量)的剂量处理的nog小鼠的生物发光成像。
52.图22a示出了白血病小鼠模型的肿瘤移植和治疗示意图。图22b示出了在治疗后第10天用f
‑
cart或c
‑
cart细胞治疗的小鼠骨髓的表型分析。图22c示出了f
‑
cart和c
‑
cart处理的小鼠股骨中cd45 cd2 cart 细胞的数量。图22d示出了f
‑
cart和c
‑
cart处理的小鼠的cd4级分对cd8级分中的cxcr4的表达。图22e示出了f
‑
cart和c
‑
cart处理的小鼠的cd4级分对cd8级分中的cxcr4百分比。图22f示出了在f
‑
cart和c
‑
cart处理的小鼠的cd4级分对cd8级分中的cxcr4级分的mfi。图22g示出了transwell迁移测定f
‑
cart对c
‑
cart细胞和小鼠sdf
‑
1α的结果的图示。图22h示出了transwell迁移测定f
‑
cart对c
‑
cart细胞和人sdf
‑
1α的结果的图示。
53.图23a示意性地图示了癌细胞的hla
‑
a*02对ny
‑
eso
‑
1片段的呈递,以及表达工程化的tcr的t细胞对ny
‑
eso
‑
1片段的识别。图23b图示了ftcrt细胞和ctrct细胞增殖能力的比较,这两种细胞都经过工程化以结合ny
‑
eso
‑
1的片段。图23c图示了ftcrt细胞和ctrct细胞中淋巴细胞亚群的比较,这两种细胞都经过工程化以结合ny
‑
eso
‑
1的片段。图23d图示了ftcrt细胞和ctrct细胞中淋巴细胞耗竭的比较,这两种细胞都经过工程化以结合ny
‑
eso
‑
1的片段。图23e图示了ftcrt细胞和ctrct的靶细胞细胞毒性的比较,这两种细胞都经过工程化以结合ny
‑
eso
‑
1的片段。图23f图示了ftcrt细胞和ctrct细胞的靶细胞细胞毒性的不同比较,这两种细胞都经过工程化以结合ny
‑
eso
‑
1的片段。
54.图24a图示了通过常规cart方法和fcart方法在gc022细胞中的car转导效率。图24b图示了通过常规cart方法和fcart方法产生的表达car的gc022细胞对靶细胞的细胞毒性。图24c图示了通过常规cart方法和fcart方法产生的表达car的gc022细胞的细胞扩增能力。图24d图示了通过常规cart方法和fcart方法产生的表达car的gc022细胞对靶细胞的细胞毒性,其中表达car的gc022细胞通过抗原刺激扩增。图24e图示了通过常规cart方法和fcart方法产生的表达car的gc022细胞中淋巴细胞亚群的比较。图24f图示了通过常规cart方法和fcart方法产生的表达car的gc022细胞中耗竭的比较。图24g描绘了移植有肿瘤细胞并用对照t细胞(非转导)或通过常规cart方法和fcart方法产生的表达car的gc022细胞处理的小鼠的生物发光成像。图24h示出了注射对照(非转导)t细胞或通过常规cart方法和fcart方法产生的表达car的gc022细胞后数天的生物发光成像的图解概要。图24i示出了移植有肿瘤细胞并随后用对照(非转导)t细胞或通过常规cart方法和fcart方法产生的表达car的gc022细胞处理的小鼠的体重变化。
具体实施方式
55.除非另有说明,否则本文公开的一些方法的实践采用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的常规技术,这些技术在本领域技术范围内。参见例如sambrook和green,molecular cloning:a laboratory manual,第4版
(2012);the series current protocols in molecular biology(f.m.ausubel等人编辑);the series methods in enzymology(academic press,inc.),pcr 2:apractical approach(m.j.macpherson,b.d.hames和g.r.taylor编著(1995)),harlow和lane编著(1988)antibodies,a laboratory manual,and culture of animal cells:a manual of basic technique和specialized applications,第6版(r.i.freshney编著(2010))。
56.如说明书和权利要求书中所使用的,除非上下文另有明确指示,否则单数形式“一个(a)”、“一种(an)”和“该/所述(the)”包括复数指代物。例如,术语“(a)嵌合跨膜受体多肽”包括多个嵌合跨膜受体多肽。
57.术语“约”或“大约”是指在本领域普通技术人员确定的特定值的可接受误差范围内,该误差范围部分将取决于如何测量或确定该值,即测量系统的局限性。例如,按照本领域的实践,“约”可以表示在1或多于1的标准偏差之内。或者,“约”可以表示给定值的至多20%、至多10%、至多5%或至多1%的范围。或者,特别是关于生物系统或过程,该术语可表示数值在一个数量级内,优选地在值的5倍之内,更优选地在值的2倍之内。在本技术和权利要求书中描述了特定值的情况下,除非另有说明,否则应假设术语“约”表示在特定值的可接受的误差范围内。
58.如本文所用,“细胞”通常可指生物细胞。细胞可以是生物体的基本结构、功能和/或生物单位。细胞可源自具有一个或多个细胞的任何生物体。一些非限制性实例包括:原核细胞、真核细胞、细菌细胞、古细菌细胞、单细胞真核生物的细胞、原生动物细胞、来自植物的细胞、动物细胞、来自无脊椎动物(例如,果蝇、刺胞动物、棘皮动物、线虫等)的细胞、来自脊椎动物(例如,鱼、两栖动物、爬行动物、鸟类、哺乳动物)的细胞、来自哺乳动物(例如,猪、牛、山羊、绵羊、啮齿动物、大鼠、小鼠、非人类灵长类动物、人类等)的细胞等。有时细胞并非源自天然有机体(例如,细胞可以是合成的,有时称为人造细胞)。特别感兴趣的是来自例如哺乳动物(包括试验动物和人)的免疫细胞。
59.如本文所用,术语“抗原”是指能够被选择性结合剂结合的分子或其片段。例如,抗原可以是可被选择性结合剂例如受体结合的配体。作为另一个实例,抗原可以是可被选择性结合剂例如免疫蛋白(例如抗体)结合的抗原分子。抗原也可以指能够在动物中使用以产生能够与该抗原结合的抗体的分子或其片段。在一些情况下,抗原可以结合至底物(例如细胞膜)。或者,抗原可以不与底物结合(例如,分泌的分子,例如分泌的多肽)。
60.如本文所用,术语“抗体”是指具有免疫球蛋白样功能的蛋白质结合分子。术语抗体包括抗体(例如,单克隆和多克隆抗体)及其衍生物、变体和片段。抗体包括但不限于不同类别(即iga、igg、igm、igd和ige)和亚类(诸如igg1、igg2等)的免疫球蛋白(ig)。其衍生物、变体或片段可以指保留相应抗体的结合特异性(例如,完全和/或部分)的功能衍生物或片段。抗原结合片段包括fab、fab'、f(ab')2、可变片段(fv)、单链可变片段(scfv)、微型抗体、双抗体和单域抗体(“sdab”或“纳米抗体”或“骆驼”)。术语抗体包括已经优化、工程化或化学偶联的抗体和抗体的抗原结合片段。已经优化的抗体的实例包括亲和力成熟的抗体。已经工程化的抗体的实例包括fc优化抗体(例如,在片段可结晶区优化的抗体)和多特异性抗体(例如,双特异性抗体)。在一些情况下,抗体可表现出对至少1、2、3、4、5或更多种不同抗原的结合特异性。在一些情况下,抗体可对最多5、4、3、2或1个抗原表现出结合特异性。
61.如本文所用,术语“核苷酸”通常是指碱基
‑
糖
‑
磷酸的组合。核苷酸可以包含合成
核苷酸。核苷酸可包含合成核苷酸类似物。核苷酸可以是核酸序列的单体单元(例如,脱氧核糖核酸(dna)和核糖核酸(rna))。术语核苷酸可以包括核糖核苷三磷酸腺苷三磷酸(atp)、尿苷三磷酸(utp)、胞嘧啶三磷酸(ctp)、鸟苷三磷酸(gtp)和脱氧核苷三磷酸,例如datp、dctp、ditp、dutp、dgtp、dttp或其衍生物。此类衍生物可以包括例如[αs]datp、7
‑
脱氮
‑
dgtp和7
‑
脱氮
‑
datp,以及赋予包含它们的核酸分子核酸酶抗性的核苷酸衍生物。如本文所用,术语核苷酸可以指双脱氧核苷三磷酸(ddntp)及其衍生物。双脱氧核苷三磷酸的说明性实例可包括但不限于ddatp、ddctp、ddgtp、dditp和ddttp。核苷酸可以是未标记的,或者通过众所周知的技术可检测地标记的。标记也可以用量子点进行。可检测的标记可以包括例如,放射性同位素、荧光标记、化学发光标记、生物发光标记和酶标记。核苷酸的荧光标记可包括但不限于荧光素、5
‑
羧基荧光素(fam)、2
′7′‑
二甲氧基
‑4′5‑
二氯
‑6‑
羧基荧光素(joe)、罗丹明、6
‑
羧基罗丹明(r6g)、n,n,n
′
,n
′‑
四甲基
‑6‑
羧基罗丹明(tamra)、6
‑
羧基
‑
x
‑
罗丹明(rox)、4
‑
(4
′
二甲基氨基苯基偶氮)苯甲酸(dabcyl)、级联蓝(cascade blue)、俄勒冈州绿(oregon green)、德克萨斯红(texas red)、花菁和5
‑
(2'
‑
氨基乙基)氨基萘
‑1‑
磺酸(edans)。荧光标记的核苷酸的具体实例可包括购自加利福尼亚州福斯特市珀金埃尔默公司(perkin elmer,foster city,calif.)的[r6g]dutp、[tamra]dutp、[r110]dctp、[r6g]dctp、[tamra]dctp、[joe]ddatp、[r6g]ddatp、[fam]ddctp、[r110]ddctp、[tamra]ddgtp、[rox]ddttp、[dr6g]ddatp、[dr110]ddctp、[dtamra]ddgtp和[drox]ddttp,购自伊利诺伊州阿灵顿高地安玛西亚(amersham,arlington heights,ill.)的fluorolink脱氧核苷酸、fluorolink cy3
‑
dctp、fluorolink cy5
‑
dctp、fluorolink fluor x
‑
dctp、fluorolink cy3
‑
dutp和fluorolink cy5
‑
dutp;购自印第安纳州印第安纳波利斯宝灵曼(boehringer mannheim,indianapolis,ind.)的荧光素
‑
15
‑
datp、荧光素
‑
12
‑
dutp、四甲基
‑
罗丹明
‑6‑
dutp、ir770
‑9‑
datp、荧光素
‑
12
‑
ddutp、荧光素
‑
12
‑
utp和荧光素
‑
15
‑2′‑
datp;和得自俄勒冈州尤金分子探针(molecular probes,eugene,oreg.)的染色体标记的核苷酸、bodipy
‑
fl
‑
14
‑
utp、bodipy
‑
fl
‑4‑
utp、bodipy
‑
tmr
‑
14
‑
utp、bodipy
‑
tmr
‑
14
‑
dutp、bodipy
‑
tr
‑
14
‑
utp、bodipy
‑
tr
‑
14
‑
dutp、级联蓝
‑7‑
utp、级联蓝
‑7‑
dutp、荧光素
‑
12
‑
utp、荧光素
‑
12
‑
dutp、俄勒冈州绿488
‑5‑
dutp、罗丹明绿
‑5‑
utp、罗丹明绿
‑5‑
dutp、四甲基罗丹明
‑6‑
utp、四甲基罗丹明
‑6‑
dutp、德克萨斯红
‑5‑
utp、德克萨斯红
‑5‑
dutp和德克萨斯红
‑
12
‑
dutp。核苷酸也可以通过化学修饰来标记或标示。化学修饰的单核苷酸可以是生物素
‑
dntp。生物素化的dntp的一些非限制性实例可以包括生物素
‑
datp(例如,生物
‑
n6
‑
ddatp、生物素
‑
14
‑
datp)、生物素
‑
dctp(例如,生物素
‑
11
‑
dctp、生物素
‑
14
‑
dctp)和生物素
‑
dutp(例如,生物素
‑
11
‑
dutp、生物素
‑
16
‑
dutp、生物素
‑
20
‑
dutp)。
[0062]
术语“多核苷酸”、“寡核苷酸”和“核酸”可互换使用,是指任意长度的核苷酸的聚合形式,无论是单链、双链或多链形式的脱氧核苷酸或核糖核苷酸或其类似物。多核苷酸可以是细胞外源的或内源的。多核苷酸可以存在于无细胞的环境中。多核苷酸可以是基因或其片段。多核苷酸可以是dna。多核苷酸可以是rna。多核苷酸可以具有任何三维结构,并且可以执行任何已知或未知的功能。多核苷酸可包含一种或多种类似物(例如,改变的主链、糖或核碱基)。如果存在的话,可以在聚合物组装之前或之后对核苷酸结构进行修饰。类似物的一些非限制性实例包括5
‑
溴尿嘧啶、肽核酸、异种核酸、吗啉代(morpholino)、锁核酸、乙二醇核酸、苏糖核酸、双脱氧核苷酸、虫草素、7
‑
脱氮
‑
gtp、荧光团(例如,与糖连接的若丹
明或荧光素)、含硫醇的核苷酸、生物素连接的核苷酸、荧光碱基类似物、cpg岛、甲基
‑7‑
鸟苷、甲基化的核苷酸、肌苷、硫代尿苷、假尿苷、二氢尿苷、queussine和怀俄苷(wyosine)。多核苷酸的非限制性实例包括基因或基因片段的编码或非编码区,由连锁分析定义的基因座(基因座)、外显子、内含子、信使rna(mrna)、转移rna(trna)、核糖体rna(rrna)、短干扰rna(sirna)、短发夹rna(shrna)、微rna(mirna)、核酶、cdna、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列的分离dna、任何序列的分离rna、包括无细胞dna(cfdna)和无细胞rna(cfrna)的无细胞的多核苷酸、核酸探针和引物。核苷酸的序列可以被非核苷酸组分中断。
[0063]
如本文所用,术语“基因”是指参与编码rna转录物的核酸(例如,诸如基因组dna的dna和cdna)及其相应的核苷酸序列。如本文所用的涉及基因组dna的术语包括中间的非编码区以及调节区,并且可以包括5’和3’末端。在某些用途中,该术语涵盖转录的序列,包括5’和3’非翻译区(5'
‑
utr和3'
‑
utr)、外显子和内含子。在某些基因中,转录区将包含编码多肽的“开放阅读框”。在该术语的一些用途中,“基因”仅包含编码多肽所需的编码序列(例如,“开放阅读框”或“编码区”)。在一些情况下,基因不编码多肽,例如核糖体rna基因(rrna)和转移rna(trna)基因。在一些情况下,术语“基因”不仅包括转录序列,而且另外还包括非转录区,包括上游和下游调节区、增强子和启动子。基因可以指“内源基因”或在生物体基因组中其天然位置的天然基因。基因可以是指“外源基因”或非天然基因。非天然基因可以是指通常在宿主生物体中没有发现但通过基因转移引入宿主生物体中的基因。非天然基因也可以是指生物体基因组中不在其天然位置的基因。非天然基因还可以是指包含突变、插入和/或缺失的天然存在的核酸或多肽序列(例如,非天然序列)。
[0064]
如本文所用,术语“靶多核苷酸”和“靶核酸”是指本公开内容的致动部分(actuator moiety)靶向的核酸或多核苷酸。靶多核苷酸可以是dna(例如,内源的或外源的)。dna可指产生mrna转录物和/或从dna模板调节mrna转录的各种调节区的模板。靶多核苷酸可以是较大多核苷酸的一部分,例如染色体或染色体区域。靶多核苷酸可以指染色体外序列(例如附加型序列、微环序列、线粒体序列、叶绿体序列等)或染色体外序列的区域。靶多核苷酸可以是rna。rna可以是例如可用作编码蛋白质的模板的mrna。包含rna的靶多核苷酸可包括调节蛋白质从mrna模板翻译的各种调节区。靶多核苷酸可编码基因产物(例如,编码rna转录物的dna或编码蛋白质产物的rna)或包含调节基因产物表达的调节序列。一般而言,术语“靶序列”是指靶核酸单链上的核酸序列。靶序列可以是基因、调节序列、基因组dna、包括cfdna和/或cfrna的无细胞核酸、cdna、融合基因和包括mrna、mirna、rrna和其他的rna的一部分。靶多核苷酸在被致动部分靶向时可导致基因表达和/或活性改变。靶多核苷酸在被致动部分靶向时可产生经编辑的核酸序列。靶核酸可包含可不通过单个核苷酸置换与核酸样品中的任何其他序列相关的核酸序列。靶核酸可包含可不通过2、3、4、5、6、7、8、9或10个核苷酸置换与核酸样品中的任何其他序列相关的核酸序列。在一些实施方案中,置换可不会发生在靶核酸5’末端的5、10、15、20、25、30或35个核苷酸内。在一些实施方案中,置换可不会发生在靶核酸3’末端的5、10、15、20、25、30、35个核苷酸内。
[0065]
术语“表达”是指一种或多种从dna模板转录多核苷酸的过程(例如转录成mrna或其他rna转录物)和/或转录的mrna随后翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可统称为“基因产物”。如果多核苷酸来源于基因组dna,则表达可包括在真核细胞中剪接mrna。关于表达,“上调”通常是指多核苷酸(例如,rna,诸如mrna)和/或多肽序列相对于其
在野生型状态下的表达水平增加,而“下调”通常是指多核苷酸(例如,rna,诸如mrna)和/或多肽序列相对于其在野生型状态下的表达水平降低。
[0066]
如本文所用,术语“补体”、“互补物”、“互补的”和“互补性”通常是指与给定序列完全互补并可杂交的序列。在一些情况下,如果给定区域上的碱基序列能够互补地结合其结合配偶体的碱基序列,从而形成例如a
‑
t、a
‑
u、g
‑
c和g
‑
u碱基对,则与给定核酸杂交的序列被称为给定分子的“补体”或“反向补体”。通常,可与第二序列杂交的第一序列可与第二序列特异性或选择性杂交,使得与第二序列或第二序列组的杂交比在杂交反应期间与非靶序列的杂交更优选(例如,在给定的一组条件下,如本领域通常使用的严格条件下,热力学上更稳定)。通常,可杂交序列在它们各自长度的全部或一部分上具有一定程度的序列互补性,诸如在25%
‑
100%之间的互补性,包括至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和100%的序列互补性。序列同一性,例如出于评估互补性百分比的目的,可通过任何合适的比对算法进行测量,包括但不限于needleman
‑
wunsch算法(参见,例如www.ebi.ac.uk/tools/psa/emboss_needle/nucleotide.html上可用的emboss needle比对器,任选使用默认设置)、blast算法(参见,例如blast.ncbi.nlm.nih.gov/blast.cgi上可用的blast比对工具,任选使用默认设置),或smith
‑
waterman算法(参见,例如www.ebi.ac.uk/tools/psa/emboss_water/nucleotide.html上可用的emboss water比对器,任选使用默认设置)。可使用所选算法的任何合适参数,包括默认参数,来评估最佳比对。
[0067]
互补性可以是完美的,也可以是实质性的/充分的。两个核酸之间的完美互补可意味着两个核酸可以形成双链体,其中双链体中的每个碱基都通过watson
‑
crick配对与互补碱基键合。充分或充分互补可以是指一条链中的序列与相对链中的序列不完全和/或完全互补,但两条链上的碱基之间发生充分的结合以在一组杂交条件(例如,盐浓度和温度)下形成稳定的杂交复合物。这些条件可以通过使用序列和标准数学计算来预测杂交链的tm来预测,或者通过使用常规方法的tm经验测定来预测。
[0068]
如本文所用,关于表达或活性的术语“调节”是指改变表达或活性的水平。调节可发生在转录水平和/或翻译水平。
[0069]
术语“肽”、“多肽”和“蛋白质”在本文中可互换使用以指由肽键连接的至少两个氨基酸残基的聚合物。该术语并不意味着特定长度的聚合物,也不旨在暗示或区分肽是否是使用重组技术、化学或酶促合成产生的,还是天然存在的。该术语适用于天然存在的氨基酸聚合物以及包含至少一种修饰氨基酸的氨基酸聚合物。在一些情况下,聚合物可以被非氨基酸中断。该术语包括任何长度的氨基酸链,包括全长蛋白质和具有或不具有二级和/或三级结构(例如结构域)的蛋白质。该术语还包括已被修饰的氨基酸聚合物,所述修饰例如,通过二硫键形成、糖基化、脂化、乙酰化、磷酸化、氧化和任何其他操作诸如与标记组分缀合。如本文所用,术语“氨基酸”通常指天然和非天然氨基酸,包括但不限于修饰的氨基酸和氨基酸类似物。修饰的氨基酸可包括天然氨基酸和非天然氨基酸,非天然氨基酸已经被化学修饰以包括氨基酸上非天然存在的基团或化学部分。氨基酸类似物可以指氨基酸衍生物。术语“氨基酸”包括d
‑
氨基酸和l
‑
氨基酸。
[0070]
术语“衍生物”、“变体”和“片段”,当在本文中用于提及多肽时,是指与野生型多肽
相关(例如通过氨基酸序列、结构(例如,二级和/或三级)、活性(例如酶活性)和/或功能)的多肽。与野生型多肽相比,多肽的衍生物、变体和片段可包含一个或多个氨基酸改变(例如,突变、插入和缺失)、截短、修饰或其组合。
[0071]
如本文所用,术语“同一性百分比(%)”是指在比对序列并在必要时引入间隙以获得最大同一性百分比(即,为了最佳比对,可以在候选序列和参考序列之一或两者中引入间隙,并且为了比较目的可以忽略非同源序列)之后,候选序列的氨基酸(或核酸)残基与参考序列的氨基酸(或核酸)残基相同的百分比。出于确定同一性百分比的目的,可以通过本领域技术范围内的各种方式实现比对,例如,使用公开可用的计算机软件,诸如blast、align或megalign(dnastar)软件。通过使用blast将测试序列与比较序列进行比对,确定比对的测试序列中与比较序列相同位置的氨基酸或核苷酸相同的氨基酸或核苷酸的数量,并用相同的氨基酸或核苷酸的数量除以比较序列中的氨基酸或核苷酸的数量,可计算出两个序列的同一性百分比。
[0072]
如本文所用,术语“外周血淋巴细胞”(pbl)及其语法等价物可指在血液(例如外周血)中循环的淋巴细胞。外周血淋巴细胞可指未定位于器官的淋巴细胞。外周血淋巴细胞可包括t细胞、nk细胞、b细胞或其任何组合。
[0073]
如本文可互换使用的,术语“受试者”、“个体”、“患者”是指脊椎动物,优选为哺乳动物,例如人。哺乳动物包括但不限于鼠类、猿猴、人类、农场动物、运动动物和宠物。还包括体内获得或体外培养的生物实体的组织、细胞及其后代。
[0074]
如本文所用,术语“治疗(treatment)”、“治疗(treating)”是指用于获得有益或期望结果的方法,包括但不限于治疗益处和/或预防益处。例如,治疗可以包括施用本文公开的系统或细胞群体。治疗益处是指对一种或多种治疗中的疾病、病况或症状的任何治疗上相关的改善或作用。为了预防益处,可将组合物施用于有发展特定疾病、病况或症状风险的受试者,或施用于报告疾病的一种或更多种生理症状的受试者,即使该疾病、病况或症状可能尚未显现。
[0075]
如本文所用,术语“til”或肿瘤浸润淋巴细胞及其语法等价物可指从肿瘤分离的细胞。例如,til可以是已经迁移到肿瘤的细胞。til也可以是已经浸润肿瘤的细胞。til可以是肿瘤内发现的任何细胞。例如,til可以是t细胞、b细胞、单核细胞、自然杀伤(nk)细胞或其任何组合。til可以是混合的细胞群体。til群体可包含不同表型的细胞、不同分化程度的细胞、不同谱系的细胞或其任何组合。
[0076]
术语“有效量”或“治疗有效量”是指组合物的量,例如包含免疫细胞诸如淋巴细胞(例如,t淋巴细胞和/或nk细胞)的组合物,所述免疫细胞包括本公开内容的系统,所述组合物在对有需要的受试者施用时足以产生所期望的活性。在本公开内容的上下文中,术语“治疗有效”是指足以延迟表现、阻止进展、缓解或减轻通过本公开内容的方法治疗的病症的至少一种症状的组合物的量。
[0077]
一方面,本公开内容提供了一种施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法的方法。一方面,方法包括将将包含工程化免疫细胞的免疫细胞群体输注到有需要的受试者中。一方面,工程化免疫细胞已经2周或更多周没有经历离体扩增。一方面,所述群体的特征还在于:所述群体中的中央记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富。一方面,本公开内容提供了包含表达嵌合抗原受体(car)
和/或t细胞受体(tcr)的工程化免疫细胞的细胞群体。一方面,细胞群体的特征还在于(i)群体中的中央记忆t细胞(tcm)比效应记忆t细胞(tem)更丰富;和/或(ii)至少2%的所述细胞群体是干细胞样记忆性t细胞(tscm)。一方面,本公开内容提供了一种治疗有需要的受试者的癌症的方法,包括输注不超过约1x106个表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞群体。一方面,不超过约1x106个工程化免疫细胞的细胞细胞群体已经2周或更多周没有经历离体扩增。
[0078]
在一些实施方案中,工程化免疫细胞已经经历了少于1周的离体扩增。一方面,工程化免疫细胞已经经历了少于6天、少于5天、少于4天、少于3天、少于2天、少于1天、少于12小时、小于6小时、小于3小时的离体扩增或没有扩增。一方面,工程化免疫细胞已经经历了少于1周、少于72小时、少于48小时或少于24小时的离体扩增。
[0079]
一方面,本公开内容提供了一种治疗有需要的受试者的癌症的方法,包括输注不超过约1x106个表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞群体。一方面,不超过约1x106个工程化免疫细胞的细胞群体已经2周或更多周没有经历离体扩增。在一些方面,与表达相同嵌合抗原受体(car)和/或工程化t细胞受体(tcr)但已经经历离体扩增2周或更多周的10倍以上的工程化免疫细胞群体相比,所述工程化免疫细胞群体在体内表现出相当水平的抗肿瘤活性。在一些方面,与表达相同嵌合抗原受体(car)和/或工程化t细胞受体(tcr)但已经经历离体扩增2周或更多周的18倍、15倍、12倍、10倍、8倍、6倍、5倍、4倍、3倍、2倍、1倍以上的工程化免疫细胞群体相比,所述工程化免疫细胞群体在体内表现出相当水平的抗肿瘤活性。
[0080]
在一些实施方案中,工程化免疫细胞是表型的并且包括中央记忆t细胞(tcm)。在一些实施方案中,tcm细胞是cd45ro cd62l 。在一些实施方案中,工程化免疫细胞包括效应记忆t细胞(tem)。在一些实施方案中,tem是cd45ro cd62l
‑
。在一些实施方案中,工程化免疫细胞是表型的并且包含效应t细胞(teff)。在一些实施方案中,teff细胞是cd45ro
‑
cd62l
‑
。在一些实施方案中,工程化免疫细胞是表型的并且包含干中央记忆t细胞(tscm)。在一些实施方案中,tscm细胞是cd45ro
‑
cd62l
。在一些实施方案中,对于给定因子,可以在本文提供的方法中使用的细胞可以是阳性的或阴性的。在一些实施方案中,本文提供的方法中利用的细胞可以是cd3 细胞、cd3
‑
细胞、cd5 细胞、cd5
‑
细胞、cd7 细胞、cd7
‑
细胞、cd14 细胞、cd14
‑
细胞、cd8 细胞、cd8
‑
细胞、cd103 细胞、cd103
‑
细胞、cd11b 细胞、cd11b
‑
细胞、bdca1 细胞、bdca1
‑
细胞、l
‑
选择素(selectin) 细胞、l
‑
选择素
‑
细胞、cd25 、cd25
‑
细胞、cd27 、cd27
‑
细胞、cd28 细胞、cd28
‑
细胞、cd44 细胞、cd44
‑
细胞、cd56 细胞、cd56
‑
细胞、cd57 细胞、cd57
‑
细胞、cd62l 细胞、cd62l
‑
细胞、cd69 细胞、cd69
‑
细胞、cd45ro 细胞、cd45ro
‑
细胞、cd127 细胞、cd127
‑
细胞、cd132 细胞、cd132
‑
细胞、il
‑
7 细胞、il
‑7‑
细胞il
‑
15 细胞、il
‑
15
‑
细胞、凝集素样受体g1阳性细胞、凝集素样受体g1阴性细胞或其分化的或去分化的细胞。细胞表达的因子的实例不旨在是限制性的,并且本领域技术人员将理解,对于本领域已知的任何因子,细胞可以是阳性或阴性的。在一些实施方案中,细胞对于两种或多种因子可以是阳性的。例如,细胞可以是cd4
和cd8
。在一些实施方案中,细胞对于两种或多种因子可以是阴性的。例如,细胞可以是cd25
‑
、cd44
‑
和cd69
‑
。在一些实施方案中,细胞对于一种或多种因子可以是阳性的,而对于一种或多种因子可以是阴性的。例如,细胞可以是cd4 和cd8
‑
。在一些方面,本文提供的细胞标志物可用于选择、富集或消减细胞
群。在一些方面,富集包括选择单核细胞部分。在一些方面,富集包括从单核细胞部分分选免疫细胞群。在一些实施方案中,可以针对具有或不具有一种或多种给定因子来选择细胞(例如,可以基于一种或多种因子的存在或不存在来分离细胞)。在一些实施方案中,所选择的细胞也可以在体外转导和/或扩增。所选择的细胞可以在输注之前在体外扩增。在一些实施方案中,可以用本文提供的载体转导选择的细胞。应当理解,本文公开的任何方法中使用的细胞可以是本文公开的任何细胞的混合物(例如,两种或多种不同的细胞)。例如,本公开的方法可以包括细胞,并且细胞是cd4
细胞和cd8
细胞的混合物。在另一个实例中,本公开的方法可以包括细胞,并且细胞是cd4
细胞和幼稚细胞的混合物。在一些情况下,细胞可以是由cd45ro(
‑
)、ccr7( )、cd45ra( )、cd62l (l
‑
选择素)、cd27 、cd28 和il
‑
7rα 组成的干细胞样记忆性t细胞,干细胞样记忆性细胞可以还表达cd95、il
‑
2rβ、cxcr3和lfa
‑
1,并显示出许多干细胞样记忆性细胞特有的功能属性。本文提供的细胞也可以是包含l
‑
选择素和ccr7的中央记忆tcm细胞,其中中央记忆细胞可以分泌例如il
‑
2,但不分泌ifnγ或il
‑
4。细胞也可以是包含l
‑
选择素或ccr7的效应记忆tem细胞,并产生例如效应细胞因子,例如ifnγ和il
‑
4。在一些情况下,可以将细胞群引入受试者中。例如,细胞群可以是t细胞和nk细胞的组合。在其他情况下,群可以是幼稚细胞(cell)和效应细胞的组合。细胞群可以是til。
[0081]
在一些实施方案中,本文提供的方法可包括细胞群体的激活。如本文所用,激活可以指细胞从静止状态转变为活性状态的过程。该过程可包括对抗原的应答、迁移和/或表型或遗传改变为功能活性状态。在一些方面,激活可以指t细胞激活的逐步过程。在一些情况下,t细胞可能需要一个或多个信号来被激活。例如,t细胞可能需要至少两个信号来被完全激活。第一信号可在tcr与抗原
‑
mhc复合物接合后出现,且第二信号可通过共刺激分子的接合而出现。在体外,抗cd3抗体(或其功能变体)可以模拟第一信号,且抗cd28抗体(或其功能变体)可以模拟第二信号。
[0082]
在一些方面,本文提供的方法可包括细胞群体的激活。激活可以通过使细胞群体与表面接触来进行,该表面具有附着于其上的可以刺激cd3 tcr复合物相关信号的试剂和可以刺激细胞表面上的共刺激分子的配体。特别地,t细胞群体可以例如通过与抗cd3抗体或其抗原结合片段、或固定化在表面上的抗cd2抗体接触,或通过与有时与钙离子载体结合的蛋白激酶c激活剂(例如苔藓抑素)接触而体外刺激。为了共刺激t细胞表面上的辅助分子,可以使用结合辅助分子的配体。例如,可以在可刺激t细胞增殖的条件下使细胞群体与抗cd3抗体和抗cd28抗体接触。在一些情况下,4
‑
1bb可用于刺激细胞。例如,可用4
‑
1bb和il
‑
21或另一种细胞因子刺激细胞。为了激活cd4 t细胞或cd8 t细胞,可以使用抗cd3抗体和抗cd28抗体。例如,提供信号的试剂可以在溶液中或与固相表面缀合。颗粒与细胞的比例可取决于相对于靶细胞的粒度。在另外的实施方案中,细胞(例如t细胞)可以与试剂包被的珠结合,其中珠和细胞可以随后被分离,并任选地培养。每个珠可以用抗cd3抗体或抗cd28抗体包被,或者在一些情况下用两者的组合包被。在替代实施方案中,在培养之前,不分离试剂包被的珠和细胞,而是一起培养。细胞表面蛋白可通过使顺磁珠(3x28个珠)接触t细胞而缀合,抗cd3抗体和抗cd28抗体可附着至顺磁珠。在一个实施方案中,将细胞和珠(例如,1:1的比例的m
‑
450cd3/cd28 t顺磁珠)在缓冲液中组合,该缓冲液例如为磷酸盐缓冲盐水(pbs)(例如,没有诸如钙和镁的二价阳离子)。可以使用任何细胞浓度。
可以将混合物培养约数小时(例如约3小时)至约14天,或两者之间的任何小时整数值。在另一个实施方案中,可以将混合物培养约21天或培养至多约21天。适用于t细胞培养的条件可包括适当的培养基(例如,最低必需培养液或rpmi培养基1640或x
‑
vivo 5,(lonza)),其可以包含增殖和存活力所需的因子,包括血清(例如,胎牛或人血清)、白介素2(il
‑
2)、胰岛素、ifn
‑
g、il
‑
4、il
‑
7、gm
‑
csf、il
‑
10、il
‑
21、il
‑
15、tgfβ和tnfα或细胞生长的任何其他添加剂。用于细胞生长的其他添加剂包括但不限于,表面活性剂、人血浆蛋白粉和还原剂,例如n
‑
乙酰基
‑
半胱氨酸和2
‑
巯基乙醇。培养基可以包括rpmi 1640、a1 m
‑
v、dmem、mem、α
‑
mem、f
‑
12、x
‑
vivo 1和x
‑
vivo 20、优化剂(optimizer),具有添加的氨基酸、丙酮酸钠和维生素(无血清或补充有适当量的血清(或血浆)或确定的激素集,和/或足以使t细胞生长和扩增的量的细胞因子。抗生素(例如青霉素和链霉素)可以仅包括在实验培养物中,可能不包括在要输注至受试者体中的细胞培养物中。靶细胞可以维持在支持生长的必要条件下;例如,适当的温度(例如,37℃)和气氛(例如,空气加5%co2)。在一些情况下,已经暴露于不同刺激时间的t细胞可以表现出不同的特性。在一些情况下,可以使用抗人cd3、cd28、cd2或其任何组合的可溶性单特异性四聚体抗体。在一些实施方案中,激活可以利用激活部分、共刺激剂及其任何组合。在一些方面,激活部分结合:cd3/t细胞受体复合物和/或提供共刺激。在一些方面,激活部分是抗cd3抗体和/或抗cd28抗体中的任何一种。在一些方面,固相是珠、板和/或基质中的至少一种。在一些方面,固相是珠。替代地或附加地,激活部分可以不与底物缀合,例如,激活部分可以在介质中自由漂浮。
[0083]
在一些情况下,可以通过与组织或细胞共培养来激活或扩增细胞群体。细胞可以是抗原呈递细胞。人工抗原呈递细胞(aapc)可以表达t细胞受体和共刺激分子的配体,并可以激活和扩增t细胞以转移,同时在一些情况下提高其效能和功能。可以对aapc工程化以表达用于t细胞激活的任何基因。可以对aapc工程化以表达用于t细胞扩增的任何基因。aapc可以是珠、细胞、蛋白质、抗体、细胞因子或任何组合。aapc可以向可以经历基因组移植的细胞群体递送信号。例如,aapc可以递送信号1、信号2、信号3或任何组合。信号1可以是抗原识别信号。例如,信号1可以是tcr通过肽
‑
mhc复合物的连接,或者是针对cd3的激动性抗体的结合,其可导致cd3信号转导复合物的激活。信号2可以是共刺激信号。例如,共刺激信号可以是分别与icos
‑
l、cd70和4
‑
1bbl结合的抗cd28、诱导型共刺激物(icos)、cd27和4
‑
1bb(cd137)。信号3可以是细胞因子信号。细胞因子可以是任何细胞因子。细胞因子可以是il
‑
2、il
‑
7、il
‑
12、il
‑
15、il
‑
21或其任何组合。在一些情况下,人工抗原呈递细胞(aapc)可用于激活和/或扩增细胞群体。在一些情况下,人工制品可能不会诱导同种异型特异性。在一些情况下,aapc可能不表达hla。可以对aapc进行基因修饰以稳定表达可用于激活和/或刺激的基因。在一些情况下,k562细胞可用于激活。k562细胞也可以用于扩增。k562细胞可以是人红白血病细胞系。可以将k562细胞工程化以表达目标基因。k562细胞可以不内源性表达hla i类、ii类或cd1d分子,但可表达icam
‑
1(cd54)和lfa
‑
3(cd58)。可以将k562工程化以向t细胞递送信号1。例如,可以将k562细胞工程化以表达hla i类。在一些情况下,可以将k562细胞工程化以表达另外的分子,例如b7、cd80、cd83、cd86、cd32、cd64、4
‑
1bbl、抗cd3、抗
‑
cd3 mab、抗cd28、抗cd28mab、cd1d、抗cd2、膜结合的il
‑
15、膜结合的il
‑
17、膜结合的il
‑
21、膜结合的il
‑
2、截短的cd19或任何组合。在一些情况下,除了cd80和cd83之外,工程化k562细胞还可以表达抗cd3 mab的膜形式、克隆okt3。在一些情况下,除了cd80和cd83之
外,工程化k562细胞还可以表达抗cd3 mab的膜形式、克隆okt3、抗
‑
cd28 mab的膜形式。
[0084]
aapc可以是珠。球形聚苯乙烯珠可用抗cd3和抗cd28的抗体包被,并用于t细胞激活。珠可具有任何尺寸。在一些情况下,珠可以是3和6微米或可以是约3和6微米。珠的尺寸可以是4.5微米或可以是约4.5微米。可以任何细胞与珠的比例使用珠。例如,可以使用每毫升一百万个细胞的三比一的珠与细胞比。aapc也可以是刚性球形颗粒、聚苯乙烯乳胶微珠、磁性纳米粒或微粒、纳米尺寸的量子点、4,聚(乳酸
‑
co
‑
乙醇酸)(plga)微球、非球形颗粒、5,碳纳米管束、6,椭球plga微粒、7,纳米蠕虫(nanoworm)、含流体脂质双层的系统、8,2d支持的脂质双层(2d
‑
slb)、9,脂质体、10,raft体(raftsome)/微结构域脂质体、11,slb颗粒或其任何组合。在一些情况下,aapc可以扩增cd4 t细胞。例如,可以将aapc工程化以模拟hla ii类限制性cd4 t细胞的抗原加工和递送通路。可以将k562工程化以表达hla
‑
d、dpα、dpβ链、ii、dmα、dmβ、cd80、cd83或其任何组合。例如,可以用hla限制肽对工程化k562细胞进行脉冲,以扩增hla限制的抗原特异性cd4 t细胞。在一些情况下,可以将aapc与外源引入的细胞因子结合使用,以进行t细胞激活、扩增或任何组合。将基因组移植的细胞施用到受试者中后,细胞也可以在体内扩增,例如在受试者的血液中。
[0085]
在一些实施方案中,本文提供的方法可以包括细胞群体的转导。在一些实施方案中,方法包括引入编码细胞受体(如嵌合抗原受体和/或t细胞受体)的多核苷酸。在一些情况下,可以进行细胞的转染。
[0086]
在一些实施方案中,产生了包含编码细胞受体例如car和/或tcr的多核苷酸的病毒上清液。在一些实施方案中,病毒载体可以是逆转录病毒载体、慢病毒载体和/或腺相关病毒载体。包装细胞可用于形成能够感染宿主细胞的病毒颗粒。此类细胞可以包括293细胞(例如,用于包装腺病毒)和psi2细胞或pa317细胞(例如,用于包装逆转录病毒)。病毒载体可以通过产生将核酸载体包装到病毒颗粒的细胞系来产生。载体可以包含包装和随后整合到宿主所需的最小病毒序列。载体可包含被待表达的多核苷酸的表达盒替代的其他病毒序列。缺失的病毒功能可以通过包装细胞系反式提供。例如,aav载体可以包含来自aav基因组的itr序列,该itr序列是包装和整合到宿主基因组中所需要的。病毒dna可以包装在细胞系中,该细胞系可以包含编码其他aav基因(即rep和cap)的辅助质粒,而缺少itr序列。该细胞系也可以用腺病毒作为辅助病毒而感染。辅助病毒可促进aav载体的复制和辅助质粒中aav基因的表达。腺病毒的污染可以通过例如腺病毒比aav更敏感的热处理来减少。可以使用将核酸递送至细胞的另外方法,例如,如通过引用并入本文的us20030087817中所述。
[0087]
在一些实施方案中,宿主细胞可以用本文所述的一种或多种载体瞬时或非瞬时转染。细胞可以如它在受试者中自然发生的那样被转染。细胞可以取自或源自于受试者并被转染。细胞可以源自于从受试者获得的细胞,例如细胞系。在一些实施方案中,本文所述的一种或多种载体转染的细胞用于建立包含一个或多个载体衍生序列的新细胞系。用于真核宿主细胞的载体的非限制性实例包括但不限于pbs、pqe
‑
9(qiagen)、噬菌体脚本(phagescript)、psix174、pbluescript sk、pbsks、pnh8a、pnh16a、pnh18a、pnh46a(stratagene);ptrc99a、pkk223
‑
3、pkk233
‑
3、pdr54o、prit5(pharmacia)。真核的pwl
‑
neo、psv2cat、pog44、pxt1、psg(stratagene)psvk3、pbpv、pmsg、psvl(pharmiacia)。此外,可以使用任何其他质粒和载体,只要它们在选择的宿主中是可复制的和可存活的即可。可将任何载体和可商购的那些(及其变体或衍生物)工程化以包括用于该方法的一个或多个重组
位点。此类载体可以从例如,向量实验有限公司(vector laboratories inc.)、英杰公司(invitrogen)、普洛麦格(promega)、安诺伦(novagen)、neb、科莱诗(clontech)、柏林格曼海姆(boehringer mannheim)、法玛西亚(pharmacia)、依皮森特(epicenter)、奥利金科技有限公司(origenes technologies inc.)、斯特拉塔基因(stratagene)、珀金埃尔默(perkinelmer)、帕哈密跟(pharmingen)和研究遗传公司(research genetics)获得。其他目标载体包括真核表达载体,例如pfastbac、pfastbacht、pfastbacdual、psfv和ptet
‑
splice(invitrogen)、peuk
‑
c1、ppur、pmam、pmamneo、pbi101、pbi121、pdr2、pcmvebna和pyacneo(科莱诗)、psvk3、psvl、pmsg、pch110和pkk232
‑
8(法玛西亚有限公司)、p3'ss、pxt1、psg5、ppbac、pmbac、pmclneo、and pog44(斯特拉塔基因有限公司)和pyes2、pac360、pblueba
‑
chis a、b和c、pvl1392、pbluebac111、pcdm8、pcdna1、pzeosv、pcdna3 prep4、pcep4和pebvhis(英杰公司)及其变体或衍生物。其他载体包括puc18、puc19、pbluescript、psport、粘粒、噬菌粒、yac(酵母人工染色体)、bac(细菌人工染色体)、p1(大肠杆菌(escherichia coli)噬菌体)、pqe70、pqe60、pqe9(quagan)、pbs载体、phagescript载体、bluescript载体、pnh8a、pnh16a、pnh18a、pnh46a(斯特拉塔基因)、pcdna3(英杰公司)、pgex、ptrsfus、ptrc99a、pet
‑
5、pet
‑
9、pkk223
‑
3、pkk233
‑
3、pdr540、prit5(法玛西亚)、psport1、psport2、pcmvsport2.0和psysport1(英杰公司)及其变体或衍生物。另外的目标载体还可包括来自英杰公司的ptrxfus、pthiohis、plex、ptrchis、ptrchis2、prset、pblueba
‑
chis2、pcdna3.1/his、pcdna3.1(
‑
)/myc
‑
his、psectag、pebvhis、ppic9k、ppic3.5k、pa081s、ppicz、ppicza、ppiczb、ppiczc、pgapza、pgapzb、pgapzc、pblue
‑
bac4.5、pbluebachis2、pmelbac、psinrep5、psinhis、pind、pind(sp1)、pvgrxr、pcdna2.1、pyes2、pzer01.1、pzero
‑
2.1、pcr
‑
blunt、pse280、pse380、pse420、pvl1392、pvl1393、pcdm8、pcdna1.1、pcdna1.1/amp、pcdna3.1、pcdna3.1/zeo、pse、sv2、prc/cmv2、prc/rsv、prep4、prep7、prep8、prep9、prep 10、pcep4、pebvhis、pcr3.1、pcr2.1、pcr3.1
‑
uni和pcrbac;来自法玛西亚的x excell、x gt11、ptrc99a、pkk223
‑
3、pgex
‑
1x t、pgex
‑
2t、pgex
‑
2tk、pgex
‑
4t
‑
1、pgex
‑
4t
‑
2、pgex
‑
4t
‑
3、pgex
‑
3x、pgex
‑
5x
‑
1、pgex
‑
5x
‑
2、pgex
‑
5x
‑
3、pezz18、prit2t、pmc1871、psvk3、psvl、pmsg、pch110、pkk232
‑
8、psl1180、pneo和puc4k;来自安诺伦的pscreen
‑
lb( )、pt7blue(r)、pt7blue
‑
2、pcite
‑4‑
abc( )、pocus
‑
2、ptag、pet
‑
32l1c、pet
‑
30lic、pbac
‑
2cp lic、pbacgus
‑
2cp lic、pt7blue
‑
2 lic、pt7blue
‑
2、x screen
‑
1、x b1uestar、pet
‑
3abcd、pet
‑
7abc、pet9abcd、pet11 abcd、pet12abc、pet
‑
14b、pet
‑
15b、pet
‑
16b、pet
‑
17b
‑
pet
‑
17xb、pet
‑
19b、pet
‑
20b( )、pet
‑
21abcd( )、pet
‑
22b( )、pet
‑
23abcd( )、pet
‑
24abcd( )、pet
‑
25b( )、pet
‑
26b( )、pet
‑
27b( )、pet
‑
28abc( )、pet
‑
29abc( )、pet
‑
30abc( )、pet
‑
31b( )、pet
‑
32abc( )、pet
‑
33b( )、pbac
‑
1、pbacgus
‑
1、pbac4x
‑
1、pbacgus4x
‑
1、pbac
‑
3cp、pbacgus
‑
2cp、pbacsurf
‑
1、plg、signal plg、pyx、vecta
‑
neo、selecta vecta
‑
hyg和selecta vecta
‑
gpt;来自科莱诗的plexa、pb42ad、pgbt9、pas2
‑
1、pgad424、pact2、pgad gl、pgad gh、pgad10、pgilda、pezm3、pegfp、pegfp
‑
1、pegfpn、pegfp
‑
c、pebfp、pgfpuv、pgfp、p6xhis
‑
gfp、pseap2
‑
basic、pseap2
‑
对照、pseap2
‑
启动子、pseap2
‑
增强子、p i3gal
‑
基础(basic)、pl3gal
‑
对照、p i3gal
‑
启动子、p i3gal
‑
增强子、pcmv、ptet
‑
off、ptet
‑
on、ptk
‑
hyg、pretro
‑
off、pretro
‑
on、pires1neo、pires1hyg、plxsn、plncx、plapsn、pmamneo、pmamneo
‑
cat、pmamneo
‑
luc、ppur、psv2neo、pyex4t
‑
1/2/3、pyex
‑
s1、pbacpak
‑
his、pbacpak8/9、pacuw31、bacpak6、ptriplex、2xgt10、xgt11、pwe15和x triplex;来自斯特拉塔基因的λzap ii、pbk
‑
cmv、pbk
‑
rsv、pbluescript ii ks /
‑
、pbluescript ii sk /
‑
、pad
‑
gal4、pbd
‑
gal4 cam、psurfscript、λfix ii、λdash、λembl3、λembl4、supercos、pcr
‑
scrigt amp、pcr
‑
script cam、pcr
‑
script direct、pbs /
‑
、pbc ks /
‑
、pbc sk /
‑
、phag
‑
escript、pcal
‑
n
‑
ek、pcal
‑
n、pcal
‑
c、pcal
‑
kc、pet
‑
3abcd、pet
‑
llabcd、psputk、pesp
‑
1、pcmvlaci、poprsvi/mcs、popi3 cat、pxt1、psg5、ppbac、pmbac、pmclneo、pmclneo poly a、pog44、p0g45、pfrti3gal、pne0i3gal、prs403、prs404、prs405、prs406、prs413、prs414、prs415和prs416、ppc86、pdbleu、pdbtrp、ppc97、p2.5、pgad1
‑
3、pgad10、pact、pact2、pgadgl、pgadgh、pas2
‑
1、pgad424、pgbt8、pgbt9、pgad
‑
gal4、plexa、pbd
‑
gal4、phisi、phisi
‑
1、placzi、pb42ad、pdg202、pjk202、pjg4
‑
5、pnlexa、pyestrp,及其变体或衍生物。在一些实施方案中,载体可以是微环载体。本文提供的载体可用于递送编码car和/或tcr的多肽。
[0088]
转导和/或转染可以通过以下任何一种方法进行非病毒转染、基因枪、化学转染、电穿孔、核转染、热休克转染、脂质转染、显微注射或病毒转染。在一些实施方案中,提供的方法包括病毒转导,并且病毒转导包括慢病毒。病毒颗粒可用于将包含编码细胞受体的多肽序列的病毒载体离体或体内递送到细胞中。在一些情况下,如本文公开的病毒载体可以pfu(噬菌斑形成单位)为单位被测量。在一些情况下,本公开的组合物和方法的重组病毒或病毒载体的pfu可为约108至约5
×
10
10
pfu。在一些情况下,本公开的重组病毒为至少约1
×
108、2
×
108、3
×
108、4
×
108、5
×
108、6
×
108、7
×
108、8
×
108、9
×
108、1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109、9
×
109、1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
和5
×
10
10
pfu。在一些情况下,本公开的重组病毒为至多约1
×
108、2
×
108、3
×
108、4
×
108、5
×
108、6
×
108、7
×
108、8
×
108、9
×
108、1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109、9
×
109、1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
和5
×
10
10
pfu。在一些方面,本公开的病毒载体可以作为载体基因组被测量。在一些情况下,本公开的重组病毒是1
×
10
10
至3
×
10
12
载体基因组,或1
×
109至3
×
10
13
载体基因组,或1
×
108至3
×
10
14
载体基因组,或至少约1
×
101、1
×
102、1
×
103、1
×
104、1
×
105、1
×
106、1
×
107、1
×
108、1
×
109、1
×
10
10
、1
×
10
11
、1
×
10
12
、1
×
10
13
、1
×
10
14
、1
×
10
15
、1
×
10
16
、1
×
10
17
和1
×
10
18
载体基因组,或者是1
×
108至3
×
10
14
载体基因组,或者至多约1
×
101、1
×
102、1
×
103、1
×
104、1
×
105、1
×
106、1
×
107、1
×
108、1
×
109、1
×
10
10
、1
×
10
11
、1
×
10
12
、1
×
10
13
、1
×
10
14
、1
×
10
15
、1
×
10
16
、1
×
10
17
和1
×
10
18
载体基因组。在一些情况下,本文提供的病毒载体可以使用感染复数(moi)来测量。在一些情况下,moi可以指载体或病毒基因组与核酸可以被递送到的细胞的比例或倍数。在一些情况下,moi可为1
×
106。在一些情况下,moi可为1
×
105至1
×
107。在一些情况下,moi可为1
×
104至1
×
108。在一些情况下,本公开的重组病毒为至少约1
×
101、1
×
102、1
×
103、1
×
104、1
×
105、1
×
106、1
×
107、1
×
108、1
×
109、1
×
10
10
、1
×
10
11
、1
×
10
12
、1
×
10
13
、1
×
10
14
、1
×
10
15
、1
×
10
16
、1
×
10
17
和1
×
10
18
moi。在一些情况下,本公开的重组病毒为1
×
108至3
×
10
14
moi,或至多约1
×
101、1
×
102、1
×
103、1
×
104、1
×
105、1
×
106、1
×
107、1
×
108、1
×
109、1
×
10
10
、1
×
10
11
、1
×
10
12
、1
×
10
13
、1
×
10
14
、1
×
10
15
、1
×
10
16
、1
×
10
17
和1
×
10
18
moi。在一些情况下,病毒载体以每个细胞约1
×
105、2
×
105、3
×
105、4
×
105、5
×
105、6
×
105、7
×
105、8
×
105、9
×
105、1
×
106、2
×
106、3
×
106、4
×
106、5
×
106、6
×
106、7
×
106、8
×
106、9
×
106、1
×
107、2
×
107、3
×
107,或至多约9
×
109个基因组拷贝/病毒颗粒的感染复数(moi)被引入。
[0089]
用本文所述的任何核酸递送平台的细胞的转染(例如转导)效率可以为或可为约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.9%或大于99.9%。在一些实施方案中,方法可以包括将感染剂添加到包含细胞群体的组合物中。感染剂可包含聚凝胺。在一些方面,感染剂可以增强病毒感染的效率。感染因子可将病毒感染性提高约100至1,000倍。可以浓度为每毫升约5ug至10ug的聚凝胺添加到组合物中。
[0090]
在一些实施方案中,本文提供的方法可以包括将细胞受体引入细胞的非病毒方法。非病毒方法可以包括但不限于crispr相关蛋白(cas蛋白,例如cas9)、锌指核酸酶(zfn)、转录激活类效应因子核酸酶(talen),argonaute核酸酶和大范围核酸酶。核酸酶可以是天然存在的、基因修饰的和/或重组的核酸酶。也可以使用基于转座子的系统(例如piggybac,睡美人(sleeping beauty))进行非病毒方法。
[0091]
在一些实施方案中,本文提供的方法可以利用piggybac系统将外源多肽引入细胞。piggybac系统包含两个组件,转座子和转座酶。piggybac转座酶促进转座子在随机分散在基因组中的“ttaa”位点处特异性地整合。基因组中预期的“ttaa”的频率在dna序列的每256个碱基对中约为1。与其他转座子不同,pb转座酶还能够以完全无缝的方式切除转座子,不留下序列或突变。此外,piggybac提供很大的载货容量(已证明超过200kb),而没有已知的上限。pb性能水平可通过密码子优化策略、突变、缺失、添加、置换或其任何组合来提高。在一些情况下,pb可能具有更大的携带容量(cargo)(大约9.1
‑
14.3kb),更高的转座活性,并且其无足迹的特性使其成为基因编辑工具具有吸引力。在一些方面,pb可包括一些特征:高效转座;大的携带容量;长期稳定表达;转基因以单拷贝整合;通过非侵入性标记而不是诸如pcr的传统方法在体内追踪靶基因;易于确定整合位点及其组合。
[0092]
在一些方面,本文提供的方法可以利用睡美人(sb)系统将编码细胞受体的多肽引入细胞。sb通过体外进化从鲑鱼基因组中发现的古代tc1/mariner转座子化石工程化。sb itr(230bp)包含长度为32bp的不完全直接重复序列(dr),其可以用作转座酶的识别信号。itr中dr元素之间的结合亲和力和间隔参与转座活动。sb转座酶可以是39kda蛋白质,具有dna结合多肽、核定位信号(nls)和催化结构域,特征是保守氨基酸基序(dde)。诱变sb转座酶的一级氨基酸序列的各种筛选导致高活性转座酶形式(version)。在一些情况下,可以使用修饰的sb。修饰的sb可以在原始sb转座子的itr内包含突变、缺失和添加。修饰的sb可以包括:pt2、pt3、pt2b、pt4、sb100x及其组合。修饰的sb的非限制性实例可选自sb10、sb11(比sb10高3倍)、sb12(比sb10高4倍)、hsb1
‑
hsb5(比sb10高多达10倍)、hsb13
‑
hsb17(hsb17比sb10高17倍)、sb100x(比sb10高100倍)、sb150x(比sb10高130倍)及其任何组合。在一些情况下,sb100x与原始重建转座酶(sb10)相比具有100倍高活性。在一些方面,sb转座切除在携带位点留下足迹(3bp)。整合发生在基因组的ta二核苷酸中,并导致由宿主修复机制产生的靶位点重复。在一些情况下,sb似乎拥有几乎无偏差的、接近随机的整合分布。转座子整合可以在野生型系统中被人工靶向(约10%)到预定的基因组基因座,然而在本文提供的嵌合系统中,sb转座子整合可以被定向到预定的基因座,效率超过10%。
[0093]
在一些方面,可以采用非病毒方法将外源多核酸引入细胞群体。在一些方面,非病毒载体或核酸可以在不使用病毒的情况下被递送,并且可以根据核酸的量进行测量。通常,
任何合适量的核酸可以用于本公开的组合物和方法。在一些情况下,核酸可以是至少约1pg、10pg、100pg、1pg、10pg、100pg、200pg、300pg、400pg、500pg、600pg、700pg、800pg、900pg、1μg、10μg、100μg、200μg、300μg、400μg、500μg、600μg、700μg、800μg、900μg、1ng、10ng、100ng、200ng、300ng、400ng、500ng、600ng、700ng、800ng、900ng、1mg、10mg、100mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1g、2g、3g、4g或5g。在一些情况下,核酸可至多为约1pg、10pg、100pg、1pg、10pg、100pg、200pg、300pg、400pg、500pg、600pg、700pg、800pg、900pg、1μg、10μg、100μg、200μg、300μg、400μg、500μg、600μg、700μg、800μg、900μg、1ng、10ng、100ng、200ng、300ng、400ng、500ng、600ng、700ng、800ng、900ng、1mg、10mg、100mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1g、2g、3g、4g或5g。
[0094]
在一些实施方案中,将car和/或tcr序列引入细胞的非病毒方法可包括电穿孔。电穿孔可以使用例如转染系统(赛默飞世尔科学(thermofisher scientific))或核转染(biosystems)进行。可以调节电穿孔参数以优化转染效率和/或细胞存活力。电穿孔设备可以具有多种电波形式的脉冲设置,例如指数衰减、时间常数和方波。每种细胞类型具有唯一的最佳场强(e),这取决于所施加的脉冲参数(例如电压、电容和电阻)。施加最佳场强通过诱导跨膜电压引起电通透,这使核酸穿过细胞膜。在一些情况下,可以调节电穿孔脉冲电压、电穿孔脉冲宽度、脉冲数、细胞密度和尖端类型,以优化转染效率和/或细胞存活力。
[0095]
在一些实施方案中,可以改变电穿孔脉冲电压以优化转染效率和/或细胞存活力。在一些情况下,电穿孔电压可以小于约500伏。在一些情况下,电穿孔电压可为至少约500伏、至少约600伏、至少约700伏、至少约800伏、至少约900伏、至少约1000伏、至少约1100伏、至少约1200伏、至少约1300伏、至少约1400伏、至少约1500伏、至少约1600伏、至少约1700伏、至少约1800伏、至少约1900伏、至少约2000伏、至少约2100伏、至少约2200伏、至少约2300伏、至少约2400伏、至少约2500伏、至少约2600伏、至少约2700伏、至少约2800伏、至少约2900伏或至少约3000伏。在一些情况下,最佳转染效率和/或细胞存活力所需的电穿孔脉冲电压可以是细胞类型特异性的。例如,对于巨噬细胞,1900伏的电穿孔电压可能是最佳的(例如,提供最高的生存力和/或转染效率)。在另一个实例中,对于jurkat细胞或原代人细胞例如t细胞,约1350伏的电穿孔电压可能是最佳的(例如,提供最高的存活力和/或转染效率)。在一些情况下,对于给定的细胞类型,电穿孔电压的范围可能是最佳的。例如,对于人578t细胞,约1000伏至约1300伏的电穿孔电压可能是最佳的(例如,提供最高的存活力和/或转染效率)。在一些情况下,原代细胞可以是原代淋巴细胞。在一些情况下,原代细胞群体可以是淋巴细胞群体。
[0096]
在一些实施方案中,可以改变电穿孔脉冲宽度以优化转染效率和/或细胞存活力。在一些情况下,电穿孔脉冲宽度可以小于约5毫秒。在一些情况下,电穿孔宽度可为至少约5毫秒、至少约6毫秒、至少约7毫秒、至少约8毫秒、至少约9毫秒、至少约10毫秒、至少约11毫秒、至少约12毫秒、至少约13毫秒、至少约14毫秒、至少约15毫秒、至少约16毫秒、至少约17毫秒、至少约18毫秒、至少约19毫秒、至少约20毫秒、至少约21毫秒、至少约22毫秒、至少约23毫秒、至少约24毫秒、至少约25毫秒、至少约26毫秒、至少约27毫秒、至少约28毫秒、至少约29毫秒、至少约30毫秒、至少约31毫秒、至少约32毫秒、至少约33毫秒、至少约34毫秒、至少约35毫秒、至少约36毫秒、至少约37毫秒、至少约38毫秒、至少约39毫秒、至少约40毫秒、
至少约41毫秒、至少约42毫秒、至少约43毫秒、至少约44毫秒、至少约45毫秒、至少约46毫秒、至少约47毫秒、至少约48毫秒、至少约49毫秒或至少约50毫秒。在一些情况下,最佳转染效率和/或细胞存活力所需的电穿孔脉冲宽度可能是细胞类型特异性的。例如,对于巨噬细胞,30毫秒的电穿孔脉冲宽度可能是最佳的(例如,提供最高的存活力和/或转染效率)。在另一个实例中,对于jurkat细胞,约10毫秒的电穿孔宽度可能是最佳的(例如,提供最高的存活力和/或转染效率)。在一些情况下,对于给定的细胞类型,电穿孔宽度的范围可能是最佳的。例如,对于人578t细胞,约20毫秒至约30毫秒的电穿孔宽度可能是最佳的(例如,提供最高的存活力和/或转染效率)。
[0097]
在一些实施方案中,可以改变电穿孔脉冲的数量以优化转染效率和/或细胞存活力。在一些情况下,电穿孔可包含单个脉冲。在一些情况下,电穿孔可包含多于一个脉冲。在一些情况下,电穿孔可包括2个脉冲、3个脉冲、4个脉冲、5个脉冲、6个脉冲、7个脉冲、8个脉冲、9个脉冲或10个或更多个脉冲。在一些情况下,最佳转染效率和/或细胞存活力所需的电穿孔脉冲数可能是细胞类型特异性的。例如,对于巨噬细胞,使用单个脉冲的电穿孔可能是最佳的(例如,提供最高的存活力和/或转染效率)。在另一个实例中,对于原代细胞,使用3个脉冲的电穿孔可能是最佳的(例如,提供最高的存活力和/或转染效率)。在一些情况下,对于给定的细胞类型,电穿孔宽度的范围可能是最佳的。例如,对于人细胞,使用约1至约3个脉冲的电穿孔可能是最佳的(例如,提供最高的存活力和/或转染效率)。
[0098]
在一些情况下,可以改变电穿孔的起始细胞密度以优化转染效率和/或细胞存活力。在一些情况下,电穿孔的起始细胞密度可以小于约1
×
105个细胞。在一些情况下,电穿孔的起始细胞密度可为至少约1
×
105个细胞、至少约2
×
105个细胞、至少约3
×
105个细胞、至少约4
×
105个细胞、至少约5
×
105个细胞、至少约6
×
105个细胞、至少约7
×
105个细胞、至少约8
×
105个细胞、至少约9
×
105个细胞、至少约1
×
106个细胞、至少约1.5
×
106个细胞、至少约2
×
106个细胞、至少约2.5
×
106个细胞、至少约3
×
106个细胞、至少约3.5
×
106个细胞、至少约4
×
106个细胞、至少约4.5
×
106个细胞、至少约5
×
106个细胞、至少约5.5
×
106个细胞、至少约6
×
106个细胞、至少约6.5
×
106个细胞、至少约7
×
106个细胞、至少约7.5
×
106个细胞、至少约8
×
106个细胞、至少约8.5
×
106个细胞、至少约9
×
106个细胞、至少约9.5
×
106个细胞、至少约1
×
107个细胞、至少约1.2
×
107个细胞、至少约1.4
×
107个细胞、至少约1.6
×
107个细胞、至少约1.8
×
107个细胞、至少一个约2
×
107个细胞、至少约2.2
×
107个细胞、至少约2.4
×
107个细胞、至少约2.6
×
107个细胞、至少约2.8
×
107个细胞、至少约3
×
107个细胞、至少约3.2
×
107个细胞、至少约3.4
×
107个细胞、至少约3.6
×
107个细胞、至少约3.8
×
107个细胞、至少约4
×
107个细胞、至少约4.2
×
107个细胞、至少约4.4
×
107个细胞、至少约4.6
×
107个细胞、至少约4.8
×
107个细胞、或至少约5
×
107个细胞。在一些情况下,最佳转染效率和/或细胞存活力所需的电穿孔起始细胞密度可能是细胞类型特异性的。例如,对于巨噬细胞,1.5
×
106个细胞的电穿孔的起始细胞密度可能是最佳的(例如,提供最高的存活力和/或转染效率)。在另一个实例中,对于人细胞,5
×
106个细胞的电穿孔的起始细胞密度可能是最佳的(例如,提供最高的存活力和/或转染效率)。在一些情况下,对于给定的细胞类型,电穿孔的起始细胞密度范围可能是最佳的。例如,对于诸如t细胞的人细胞,电穿孔的起始细胞密度在5.6
×
106和5
×
107个细胞之间可能是最佳的(例如,提供最高的存活力和/或转染效率)。
[0099]
将编码car和/或tcr的核酸序列整合到具有例如crispr、piggy bac和/或睡美人系统的细胞基因组中的效率可以是或可以是约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.9%或超过99.9%。
[0100]
在一些实施方案中,本文提供的用于产生表达嵌合抗原受体(car)的工程化免疫细胞群体的方法可包括(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸。在一些实施方案中,car包含(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,步骤(a)和(b)在48小时内进行。在一些实施方案中,步骤(a)和(b)在24小时内进行。在一些实施方案中,步骤(a)和(b)在3小时内进行。在一些实施方案中,步骤(a)和(b)在1小时内进行。在一些实施方案中,步骤(a)和(b)在30min内进行。在一些实施方案中,步骤(a)和(b)同时进行。在一些实施方案中,步骤(a)和(b)可在约1周、6天、5天、4天、3天、2天、1天、20小时、15小时、13小时、10小时、8小时、6小时、5小时、4小时、3小时、2小时、1小时、45分钟、40分钟、35分钟、30分钟、25分钟、20分钟、15分钟、10分钟、5分钟、3分钟、1分钟内和/或同时进行。在一些方面,本文提供的方法还可包括从(a)和(b)完成约1周内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约5天内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约72小时内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约24小时内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约12小时内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约6小时内将工程化免疫细胞群体输注给受试者。在一些方面,本文提供的方法还可包括从(a)和(b)完成约3小时内将工程化免疫细胞群体输注给受试者。
[0101]
在一些实施方案中,本文提供的用于产生表达嵌合抗原受体(car)的工程化免疫细胞群体的方法可包括(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸。在一些方面,方法可进一步包括冷冻保存包含表达car和/或tcr的工程化免疫细胞的群体。细胞工程化后可随时进行冷冻保存。冷冻保存可在(a)和(b)后约1小时、2小时、3小时、4小时、5小时、10小时、15小时、20小时、24小时、2天、3天、4天、5天、6天、1周、1.5周、2周或2周以上进行。一方面,包含工程化免疫细胞的群体可以是新鲜来源的。例如,可以从受试者获得新鲜来源的群体并且在没有冷冻保存的情况下应用本文提供的方法。
[0102]
在一些实施方案中,本文提供的用于产生表达嵌合抗原受体(car)的工程化免疫细胞群体的方法可包括(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸,其中(a)和(b)进行不超过约48小时。在一些情况下,(a)和(b)可进行最多不超过48小时、36小时、24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时、1小时或更少。在一些情况下,当过程(a)和(b)不完全重叠时,进行(a)和(b)的总时间可不超过48小时。在一些情况下,当过程(a)和(b)不完全重叠时,进行(a)和(b)的总时间可最多不超过48小时、36小时、24小时、22小时、20小时、18小时、16小时、14小时、12小时、10小时、9小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时、1小时或更少。
[0103]
在一个实例中,本文提供的用于产生表达嵌合抗原受体(car)的工程化免疫细胞群体的方法可包括(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸,其中(a)和(b)进行不超过约24小时。在另一个实例中,本文提供的用于产生表达嵌合抗原受体(car)的工程化免疫细胞群体的方法可包括(a)用激活部分激活包含免疫细胞的细胞群体;并同时(b)引入编码至少car的多核苷酸,其中进行(a)和(b)的总时间可不超过24小时。
[0104]
在一些方面,与没有同时激活和转导的可比方法相比,与效应记忆t细胞相比,本文提供的方法可产生更多的中央记忆t细胞。在一些方面,由于使用本文提供的fast
‑
car方法产生细胞,与效应记忆t细胞(tem)相比,中央记忆t细胞(tcm)可至少增加1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍或更多。在一些方面,由于使用本文提供的fast
‑
car方法产生细胞,与tem相比,tcm可至多增加50倍、45倍、40倍、35倍、30倍、25倍、20倍、15倍、10倍、9倍、8倍、7倍、6倍、5倍、4倍、3倍、2倍、1倍或更少。在一些实施方案中,与没有同时激活和转导的可比方法相比,本文提供的方法可产生更多的tscm。在一些实施方案中,至少2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、95%或至多约100%的细胞群体是tscm。在一些实施方案中,至多100%、95%、90%、80%、70%、60%、50%、45%、40%、35%、30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或更少的细胞群体是tscm。tscm可以是cd45ro
‑
cd62l 。在一些实施方案中,本文提供的方法可包括施用包含表达嵌合抗原受体(car)和/或工程化t细胞受体(tcr)的工程化免疫细胞的细胞疗法。在一些方面,方法可包括将包含工程化免疫细胞的免疫细胞群体输注到有需要的受试者中。在一些方面,工程化免疫细胞已经2周或更多周没有经历离体扩增。在一些方面,工程化免疫细胞包含至少2%的干细胞样记忆性t细胞(tscm)。
[0105]
在一些情况下,受试者细胞(例如,t细胞)可以不在同时激活和转导之前预先激活(例如,通过cd3/cd28珠)。在这种情况下,在同时激活和转导之后,受试者细胞的激活和转导的持续时间可以基本相同。
[0106]
在一些实施方案中,通过本文提供的方法产生的群体的特征还在于其在pd1和lag3中的丰度较低。在一些方面,通过本文提供的方法产生的群体可包含与耗竭相关的细胞标志物的表达较低。与细胞耗竭相关的标志物包括:pd
‑
1、lag3、ctla
‑
4、tim
‑
3、2b4/cd244/slamf4、cd160、tigit、cxcr5、icos,仅举几例。在一些方面,细胞耗竭标志物可以包括:il
‑
2产生的丧失、增殖能力的丧失、离体细胞溶解活性的丧失、tnf
‑
α、ifn
‑
γ和cc(β)趋化因子的产生受损、脱粒;颗粒酶b的高水平表达,对il
‑
7和il
‑
15的反应较差,gata
‑
3、bcl
‑
6和helios的表达改变,在cd4 的情况下,耗竭可包括偏向t滤泡辅助(tfh)细胞表型,il
‑
4、il
‑
6和/或il
‑
21的分泌,转录因子:bcl
‑
6、irf4、stat4的表达及其任何组合。
[0107]
在一些方面,本文提供的方法中使用的免疫细胞是t细胞、nk细胞、nkt细胞、干细胞、诱导多能干细胞、b细胞,仅举几例。在一些实施方案中,本文提供的方法中使用的细胞获自外周血、脐带血、骨髓和/或诱导多能干细胞。细胞可以从许多非限制性来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾脏组织和肿瘤。此外,可以使用任何t细胞系。或者,细胞可以从健康供体、诊断为癌症的患者或诊断为感染的患者中获得。在另一种情况下,细胞可以是呈现不同表型特征的混
合细胞群体的一部分。细胞也可以从细胞治疗库中获得。一方面,还可以在工程化之前选择细胞群体。选择可以包括以下中的至少一种:磁分离、流式细胞术选择、抗生素选择。一方面,细胞群体可包括血细胞,诸如外周血单核细胞(pbmc)、淋巴细胞、单核细胞或巨噬细胞。一方面,免疫细胞可以是淋巴细胞、b细胞或t细胞。细胞还可从全血(whole food)、单采血液成分法或受试者的肿瘤样品中获得。细胞可以是肿瘤浸润淋巴细胞(til)。在一些情况下,单采血液成分法可以是白细胞清除术。白细胞清除术可以是从血液中分离血细胞的过程。在白细胞清除术期间,可以从受试者手臂上的针中取出血液,通过将全血分为红细胞、血浆和淋巴细胞的机器的循环,然后通过另一只手臂上的针将血浆和红细胞返回受试者。在一些情况下,在施用治疗方案和细胞疗法之后分离细胞。例如,单采血液成分法可以依次或与细胞施用同时进行。在一些情况下,在施用细胞产品之前和之后至多约6周进行单采血液成分法。在一些情况下,在施用细胞产品后
‑
3周、
‑
2周、
‑
1周、0、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年、3年、4年、5年、6年、7年、8年、9年或至多约10年进行单采血液成分法。在一些情况下,通过单采血液成分法获得的细胞可以经历特异性裂解测试(例如细胞毒性测试)、细胞因子释放、代谢组学研究、生物能量学研究、细胞因子产生的细胞内fac、elisa点检测和淋巴细胞亚群分析。在一些情况下,细胞产品或单采产品的样品可以冷冻保存,用于对输注的细胞表型和功能进行回顾性分析。
[0108]
本文提供的方法可包括激活t细胞并同时将载体引入(例如,转导或转染)t细胞。载体可以是病毒载体(例如,慢病毒载体)。t细胞可以是休眠的(例如,静止的)t细胞或非休眠的(例如,激活的)t细胞。t细胞可以是耗竭t细胞。在一些情况下,用载体引入的t细胞可以是包含休眠t细胞、非休眠t细胞和/或耗竭t细胞的t细胞群体。t细胞群体可以是休眠t细胞、非休眠t细胞和耗竭t细胞的混合物。
[0109]
与用病毒载体转导休眠t细胞而不同时激活t细胞的效率相比,用病毒载体转导细胞同时激活t细胞的效率可更高。同时激活t细胞的转导细胞的效率可比不同时激活t细胞的转导休眠t细胞的效率至少高2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。由于同时转导和激活的效率可很高,本文提供的方法中使用的病毒载体的量可很低。用于同时转导和激活的病毒载体的量可以比用于不同时激活t细胞而转导休眠t细胞的量至少低2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。
[0110]
在本文所述的方法中使用的t细胞可以从冷冻细胞(例如,冷冻保存的细胞)中恢复。与激活的t细胞相比,休眠的t细胞可具有较低的恢复效率(例如,细胞群体中恢复的活细胞的百分比)。例如,冷冻保存24小时后休眠t细胞的恢复效率可以是至多约80%、70%、60%、50%、40%、30%、20%或更低。冷冻保存24小时后激活t细胞的恢复效率可以是至少约40%、50%、60%、70%、75%、80%、85%、90%、95%或更高。激活的t细胞的恢复效率可在24小时后保持。
[0111]
使用本文所述的同时转导和激活方法制备的工程化细胞可以有效地控制或抑制肿瘤生长。例如,与使用包括在相同或基本相同的条件下(例如,动物模型、剂量和实验条件)用病毒载体转导休眠t细胞而不同时激活的方法制备的工程化细胞相比,本文制备的工程化细胞在控制肿瘤生长方面可具有更高的效率。使用本文所述的同时转导和激活方法制备的工程化细胞可以有效控制与工程化t细胞(例如car
‑
t细胞)的施用相关的副作用。副作
用包括但不限于细胞因子释放综合征(crs)和噬血细胞淋巴组织细胞增生症(hlh),也称为巨噬细胞激活综合征(mas)。crs的症状包括高烧、恶心、短暂性低血压、缺氧等。使用本文所述的同时转导和激活方法制备的工程化细胞比使用包括用病毒载体转导休眠t细胞而不同时激活的方法制备的工程化细胞具有更少的crs。与使用包括用病毒载体转导休眠t细胞而不同时激活的方法制备的工程化细胞相比,使用本文所述的同时转导和激活方法制备的工程化细胞产生的促炎细胞因子可以更低。促炎细胞因子可以是ifn
‑
γ、tnfα、gm
‑
csf、il
‑
2和/或il
‑
6。
[0112]
在一些实施方案中,本文提供的方法包括将t细胞受体(tcr)引入细胞。在一些实施方案中,tcr包含(i)对配体特异的配体结合域和(ii)跨膜域。
[0113]
在一些实施方案中,tcr可以是二硫键连接的膜锚定异二聚体蛋白。本文提供的tcr可包含可变α(α)和/或β(β)链。在一些方面,α和/或β链可表达为具有不变cd3链分子的复合物的一部分。在一些方面,tcr可包含可变γ(γ)和/或δ(δ)链,称为γδt细胞。在一些方面,tcr链可包含细胞外结构域:可变(v)区、恒定(c)区、免疫球蛋白超家族(igsf)结构域形成反平行β
‑
片。在一些实施方案中,恒定区靠近细胞膜,然后是跨膜域和短细胞质尾部,而可变区,诸如配体结合域,与肽/mhc复合物结合。在一些实施方案中,肽可以是配体。在一些方面,tcrα
‑
链和β
‑
链的可变域可各自具有高变区或互补决定区(cdr)。
[0114]
在一些实施方案中,本文提供嵌合抗原受体。car包括:(i)对配体特异的配体结合域,(ii)跨膜域,和(iii)细胞内信号传导结构域。在一些实施方案中,受试者方法的car的配体结合域可以通过跨膜域连接到细胞内信号传导结构域。跨膜域可以是跨膜区段。受试者car的跨膜域可以将car锚定到细胞(例如免疫细胞)的质膜上。在一些实施方案中,跨膜区段包含多肽。连接car的配体结合域和细胞内信号传导结构域的跨膜多肽可以具有任何合适的多肽序列。在一些情况下,跨膜多肽包含内源或野生型跨膜蛋白的跨膜部分的多肽序列。在一些实施方案中,跨膜多肽包含与内源或野生型跨膜蛋白的跨膜部分相比具有至少1个(例如,至少2、3、4、5、6、7、8、9、10或更多个)氨基酸置换、缺失和插入的多肽序列。在一些实施方案中,跨膜多肽包含非天然多肽序列,诸如多肽接头的序列。多肽接头可以是柔性的或刚性的。多肽接头可以是结构化或非结构化的。在一些实施方案中,跨膜多肽通过配体结合域将信号从细胞的胞外区传递到胞内区。cd28的天然跨膜部分可用于car中。在其他情况下,也可在car中使用cd8α的天然跨膜部分。在一些实施方案中,受试者car的跨膜域来自cd8α、cd4、cd28、cd45、pd
‑
1和/或cd152。
[0115]
在一些实施方案中,受试者方法的car的细胞内信号传导结构域可包含参与免疫细胞信号传导的信号传导结构域或其任何衍生物、变体或片段。car的细胞内信号传导结构域可以诱导包含car的免疫细胞的活性。细胞内信号传导结构域可以转导效应子功能信号并指导细胞执行特定功能。信号传导结构域可以包括其他分子的信号传导结构域。虽然通常可以在car中使用另一个分子的信号传导结构域,但在许多情况下,没有必要使用整个链。在一些情况下,信号传导结构域的截短部分用于car中。在一些实施方案中,细胞内信号传导结构域包含参与免疫细胞信号传导的多个信号传导结构域,或其任何衍生物、变体或片段。例如,细胞内信号传导结构域可以包含至少2个免疫细胞信号传导结构域,例如至少2、3、4、5、7、8、9或10个信号传导结构域。在一些方面,受试者car包含至少2个细胞内信号传导结构域。在一些方面,受试者car包含至少3个细胞内信号传导结构域。
[0116]
免疫细胞信号传导结构域可以以刺激方式或抑制方式参与调节tcr复合物的初级激活。细胞内信号传导结构域可以是t细胞受体(tcr)复合物的信号传导结构域。受试者car的细胞内信号传导结构域可包含fcγ受体(fcγr)、fcε受体(fcεr)、fcα受体(fcαr)、新生儿fc受体(fcrn)、cd3、cd3ζ、cd3γ、cd3δ、cd3ε、cd4、cd5、cd8、cd21、cd22、cd28、cd32、cd40l(cd154)、cd45、cd66d、cd79a、cd79b、cd80、cd86、cd278(也称为icos)、cd247ζ、cd247η、dap10、dap12、fyn、lat、lck、mapk、mhc复合物、nfat、nf
‑
κb、plc
‑
γ、ic3b、c3dg、c3d和zap70的信号传导结构域。在一些实施方案中,信号传导结构域包括基于免疫受体酪氨酸的激活基序或itam。包含itam的信号传导结构域可包含氨基酸序列yxxl/i的两个重复序列,由6
‑
8个氨基酸隔开,其中每个x独立地为任何氨基酸,产生保守基序yxxl/ix(6
‑
8)yxxl/i。例如,当配体结合域与表位结合时,可以通过磷酸化来修饰包含itam的信号传导结构域。磷酸化的itam可以作为其他蛋白质(例如参与各种信号传导通路的蛋白质)的停靠位点。在一些实施方案中,初级信号传导结构域包含修饰的itam域,例如突变的、截短的和/或优化的itam域,其与天然itam域相比具有改变(例如,增加或减少)的活性。在一些实施方案中,受试者car的细胞内信号传导结构域包含fcγr信号传导结构域(例如,itam)。fcγr信号传导结构域可选自fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγriiia(cd16a)和fcγriiib(cd16b)。在一些实施方案中,细胞内信号传导结构域包含fcεr信号传导结构域(例如,itam)。fcεr信号传导结构域可选自fcεri和fcεrii(cd23)。在一些实施方案中,细胞内信号传导结构域包含fcαr信号传导结构域(例如,itam)。fcαr信号传导结构域可选自fcαri(cd89)和fcα/μr。在一些实施方案中,细胞内信号传导结构域包含cd3ζ信号传导结构域。在一些实施方案中,初级信号传导结构域包含cd3ζ的itam。在一些实施方案中,细胞内信号传导结构域来自cd3ζ、cd28、cd54(icam)、cd134(ox40)、cd137(4
‑
1bb)、gitr、cd152(ctla4)、cd273(pd
‑
l2)、cd274(pd
‑
l1)、dap10和/或cd278(icos)。
[0117]
在一些实施方案中,受试者car的细胞内信号传导结构域包含基于免疫受体酪氨酸的抑制基序或itim。包含itim的信号传导结构域可包含在免疫系统的一些抑制性受体的细胞质尾部中发现的保守氨基酸序列(s/i/v/lxyxxi/v/l)。包含itim的初级信号传导结构域可以被酶诸如src激酶家族成员(例如lck)修饰,例如磷酸化。磷酸化后,其他蛋白质,包括酶,可以被招募到itim。这些其他蛋白质包括但不限于诸如磷酸酪氨酸磷酸酶shp
‑
1和shp
‑
2的酶、称为ship的肌醇磷酸酶,以及具有一个或多个sh2结构域的蛋白质(例如zap70)。细胞内信号传导结构域可包括btla、cd5、cd31、cd66a、cd72、cmrf35h、dcir、epo
‑
r、fcγriib(cd32)、fc受体样蛋白2(fcrl2)、fc受体样蛋白3(fcrl3)、fc受体样蛋白4(fcrl4)、fc受体样蛋白5(fcrl5)、fc受体样蛋白6(fcrl6)、蛋白g6b(g6b)、白细胞介素4受体(il4r)、免疫球蛋白超家族受体易位相关1(irta1)、免疫球蛋白超家族受体易位相关2(irta2)、杀伤细胞免疫球蛋白样受体2dl1(kir2dl1)、杀伤细胞免疫球蛋白样受体2dl2(kir2dl2)、杀伤细胞免疫球蛋白样受体受体2dl3(kir2dl3)、杀伤细胞免疫球蛋白样受体2dl4(kir2dl4)、杀伤细胞免疫球蛋白样受体2dl5(kir2dl5)、杀伤细胞免疫球蛋白样受体3dl1(kir3dl1)、杀伤细胞免疫球蛋白样受体3dl2(kir3dl2)、白细胞免疫球蛋白样受体亚家族b成员1(lir1)、白细胞免疫球蛋白样受体亚家族b成员2(lir2)、白细胞免疫球蛋白样受体亚家族b成员3(lir3)、白细胞免疫球蛋白样受体亚家族b成员5(lir5)、白细胞免疫球蛋白样受体亚家族b成员8(lir8)、白细胞相关免疫球蛋白样受体1(lair
‑
1)、肥大细胞功能
相关抗原(mafa)、nkg2a、天然细胞毒性触发受体2(nkp44)、ntb
‑
a、程序性细胞死亡蛋白1(pd
‑
1)、pilr、siglecl1、唾液酸结合ig样凝集素2(siglec2或cd22)、唾液酸结合ig样凝集素3(siglec3或cd33)、唾液酸结合ig样凝集素5(siglec5或cd170)、唾液酸结合ig样凝集素6(siglec6)、唾液酸结合ig样凝集素7(siglec7)、唾液酸结合ig样凝集素10(siglec10)、唾液酸结合ig样凝集素11(siglec11)、唾液酸结合ig样凝集素4(siglec4)、唾液酸结合ig样凝集素8(siglec8)、唾液酸结合ig样凝集素9(siglec9)、血小板和内皮细胞粘附分子1(pecam
‑
1)、信号调节蛋白(sirp 2)和信号阈值调节跨膜衔接因子1(sit)的信号传导结构域(例如,itim)。在一些实施方案中,细胞内信号传导结构域包含修饰的itim域,例如突变的、截短的和/或优化的itim域,其与天然itim域相比具有改变(例如,增加或减少)的活性。在一些实施方案中,细胞内信号传导结构域包含至少2个itam域(例如,至少3、4、5、6、7、8、9或10个itam域)。在一些实施方案中,细胞内信号传导结构域包含至少2个itim域(例如,至少3、4、5、6、7、8、9或10个itim域)(例如,至少2个初级信号传导结构域)。在一些实施方案中,细胞内信号传导结构域包括itam域和itim域。
[0118]
在一些情况下,受试者car的细胞内信号传导结构域可以包括共刺激结构域。在一些实施方案中,例如来自共刺激分子的共刺激结构域可以为免疫细胞信号传导提供共刺激信号,诸如来自itam和/或itim域的信号传导,例如用于激活和/或失活免疫细胞活性。在一些实施方案中,共刺激结构域可操作以调节免疫细胞中的增殖和/或存活信号。在一些实施方案中,共刺激信号传导结构域包含mhc i类蛋白、mhc ii类蛋白、tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号淋巴细胞激活分子(slam蛋白)、激活nk细胞受体、btla或toll配体受体的信号传导结构域。在一些实施方案中,共刺激结构域包括选自下分子的信号传导结构域:2b4/cd244/slamf4、4
‑
1bb/tnfsf9/cd137、b7
‑
1/cd80、b7
‑
2/cd86、b7
‑
h1/pd
‑
l1、b7
‑
h2、b7
‑
h3、b7
‑
h4、b7
‑
h6、b7
‑
h7、baff r/tnfrsf13c、baff/blys/tnfsf13b、blame/slamf8、btla/cd272、cd100(sema4d)、cd103、cd11a、cd11b、cd11c、cd11d、cd150、cd160(by55)、cd18、cd19、cd2、cd200、cd229/slamf3、cd27配体/tnfsf7、cd27/tnfrsf7、cd28、cd29、cd2f
‑
10/slamf9、cd30配体/tnfsf8、cd30/tnfrsf8、cd300a/lmir1、cd4、cd40配体/tnfsf5、cd40/tnfrsf5、cd48/slamf2、cd49a、cd49d、cd49f、cd5、cd53、cd58/lfa
‑
3、cd69、cd7、cd8α、cd8β、cd82/kai
‑
1、cd84/slamf5、cd90/thy1、cd96、cds、ceacam1、cracc/slamf7、crtam、ctla
‑
4、dap12、dectin
‑
1/clec7a、dnam1(cd226)、dppiv/cd26、dr3/tnfrsf25、ephb6、gads、gi24/vista/b7
‑
h5、gitr配体/tnfsf18、gitr/tnfrsf18、hla类i、hla
‑
dr、hvem/tnfrsf14、ia4、icam
‑
1、icos/cd278、ikaros、il2rβ、il2rγ、il7rα、整联蛋白α4/cd49d、整联蛋白α4β1、整联蛋白α4β7/lpam
‑
1、ipo
‑
3、itga4、itga6、itgad、itgae、itgal、itgam、itgax、itgb1、itgb2、itgb7、kirds2、lag
‑
3、lat、light/tnfsf14、ltbr、ly108、ly9(cd229)、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、淋巴毒素
‑
α/tnf
‑
β、nkg2c、nkg2d、nkp30、nkp44、nkp46、nkp80(klrf1)、ntb
‑
a/slamf6、ox40配体/tnfsf4、ox40/tnfrsf4、pag/cbp、pd
‑
1、pdcd6、pd
‑
l2/b7
‑
dc、psgl1、relt/tnfrsf19l、selplg(cd162)、slam(slamf1)、slam/cd150、slamf4(cd244)、slamf6(ntb
‑
a)、slamf7、slp
‑
76、taci/tnfrsf13b、tcl1a、tcl1b、tim
‑
1/kim
‑
1/havcr、tim
‑
4、tl1a/tnfsf15、tnf rii/tnfrsf1b、tnf
‑
α、trance/rankl、tslp、tslp r、vla1和vla
‑
6。在一些实施方案中,细胞内信号传导结构域包含多个共刺激结构域,例如至少两个,例如至少3、4或5个共刺激结构域。共刺激信号传导区域可以提
供与初级效应激活信号协同的信号,并且可以完成激活t细胞的要求。在一些实施方案中,向car添加共刺激结构域可增强本文提供的免疫细胞的功效和持久性。
[0119]
表1中提供了共刺激信号传导结构域的示例。
[0120]
作为实例,car可包含cd3ζ链(有时称为第一代car)。作为另一个实例,car可以包含cd
‑
3ζ链和单个共刺激结构域(例如,cd28或4
‑
1bb)(有时称为第二代car)。作为另一个实例,car可以包含cd
‑
3ζ链和两个共刺激结构域(cd28/ox40或cd28/4
‑
1bb)(有时称为第三代car)。与诸如cd8的共受体一起,这些信号部分可以产生激酶通路的下游激活,从而支持基因转录和功能性细胞反应。
[0121]
在一些实施方案中,受试者car可包含铰链或间隔区。铰链或间隔区可以指配体结合域和跨膜域之间的区段。在一些实施方案中,铰链可用于为配体结合域例如scfv提供灵活性。在一些实施方案中,铰链可用于检测细胞表面上car的表达,例如当检测scfv的抗体没有功能或不可用时。在一些情况下,铰链源自免疫球蛋白分子,可根据靶标上第一表位或第二表位的位置需要进行优化。在一些情况下,铰链可不属于免疫球蛋白分子,而是属于另一个分子,诸如cd8α分子的天然铰链。cd8α铰链可以包含半胱氨酸和脯氨酸残基,它们在cd8共受体和mhc分子的相互作用中发挥作用。在一些实施方案中,半胱氨酸和脯氨酸残基
可以影响car的性能并且因此可以被工程化以影响car性能。
[0122]
铰链可以是任何合适的长度。在一些实施方案中,car的铰链可以是尺寸可调的并且可以在一定程度上补偿标准化表达car的细胞和靶细胞之间的正交突触距离。表达car的细胞和靶细胞之间的免疫突触的这种地形图也可以定义由于细胞表面靶分子上的膜远端表位而不能被car功能性桥接的距离,即使具有短铰链car,也不能使突触距离接近信号传导的近似值。同样,已经描述了近膜car靶抗原表位,其信号输出仅在长铰链car的背景下观察到。可以根据可使用的单链可变片段区来调整本文公开的铰链。在一些方面,铰链可来自cd28、igg1和/或cd8α。
[0123]
作为一个实例,car可包含细胞外配体结合域、跨膜域和细胞内信号传导结构域,如图3所示。car通常可包含源自单链抗体的配体结合域、铰链域(h)或间隔区、提供对质膜的锚定的跨膜域(tm)和负责t细胞激活的信号传导结构域。car可包含免疫细胞信号传导结构域,诸如cd3ζ链。car可包含免疫细胞信号传导结构域和第一共刺激结构域,诸如cd3ζ链和4
‑
1bb。car可包含免疫细胞信号传导结构域和至少两个共刺激结构域,诸如cd3ζ链、4
‑
1bb和ox40。在一些实施方案中,通用car也可用于本文提供的方法中。通用car可以包含与结合单克隆抗体上的标签(例如,异硫氰酸荧光素或生物素)的蛋白质结构域融合的细胞内信号传导结构域。免疫细胞信号传导结构域和共刺激结构域的各种组合可用于受试者car。在一些实施方案中,免疫细胞信号传导结构域可以来自cd3、cd4和/或cd8。共刺激结构域可以来自4
‑
1bb、ox40、cd28等。
[0124]
在一些实施方案中,受试者tcr或受试者car的配体可以是以下任何一种或可以是以下任何一种的一部分:vegfr
‑
2、cd19、cd20、cd30、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd80、cd86、cd81、cd123、cd171、cd276、b7h4、bcma、cd133、egfr、gpc3、pmsa、cd3、ceacam6、c
‑
met、egfrviii、erbb2、erbb3、her3、erbb4/her
‑
4、epha2、igf1r、gd2、o
‑
乙酰基gd2、o
‑
乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cea、ca125、cd151、ctla
‑
4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewis、tnfr1、tnfr2、pd1、pd
‑
l1、pd
‑
l2、hvem、mage
‑
a、间皮素、ny
‑
eso
‑
1、rank、rorl、tnfrsf4、cd40、cd137、tweak
‑
r、ltpr、lifrp、lrp5、muc1、tcrα、tcrβ、tlr7、tlr9、ptch1、wt
‑
1、robol、frizzled、ox40、cd79、notch
‑1‑
4和/或claudin18.2。在一些实施方案中,受试者tcr或受试者car的配体可以是以下任何一种或可以是以下任何一种的一部分:癌细胞、内源性细胞、脉管系统的细胞、肿瘤微环境的细胞及其任何组合中。
[0125]
在一些实施方案中,受试者car进一步包含信号肽。在一些方面,本公开内容的car可以包含信号肽,使得当car在细胞诸如免疫细胞内表达时,新生蛋白被引导至内质网,随后引导至细胞表面,在那里它可以表达。信号肽的核心可包含一长段疏水性氨基酸,具有形成单个α
‑
螺旋的趋势。信号肽可以以一段短的带正电荷的氨基酸开始,这有助于在易位过程中加强多肽的正确拓扑结构。在信号肽的末端可以有一段被信号肽酶识别和切割的氨基酸。信号肽酶可在易位期间或完成后切割,产生游离信号肽和成熟蛋白质。然后游离信号肽被特异性蛋白酶消化。信号肽可以在分子的氨基末端。在一些实施方案中,受试者car可具有通式:信号肽
‑
配体结合域
‑
间隔域
‑
跨膜域/细胞内t细胞信号传导结构域。信号肽可以是igg1、gm
‑
csf和/或cd8α或可以源自igg1、gm
‑
csf和/或cd8α。
[0126]
在一些实施方案中,方法可包括施用,施用包括输注本文提供的工程化细胞。在一
些方面,输注可以是静脉内的。在一些实施方案中,施用包括输注约1x102/kg体重的工程化免疫细胞。在一些实施方案中,施用包括输注约1x103/kg体重。在一些实施方案中,施用包括输注约1x104/kg体重。在一些方面,施用包括输注约1x105/kg体重。在一些方面,施用包括输注约3x105/kg体重。在一些方面,施用包括输注约1x105/kg体重至约3
×
105/kg体重。在一些方面,施用包括输注约0.5x105/kg体重至约1
×
105/kg体重。在一些方面,施用包括输注约1x104/kg体重至约4
×
105/kg体重。在一些方面,施用包括输注约0.5x105/kg体重至约1
×
105/kg体重。在一些方面,施用包括输注约0.5x105/kg体重至约1.5
×
105/kg体重。在一些实施方案中,施用包括输注约1x103/kg体重。
[0127]
在一些实施方案中,向受试者施用总共约5x10
10
个细胞。在一些情况下,约5x10
10
个细胞代表施用于受试者的细胞的中值量。在一些实施方案中,约5x10
10
个细胞是影响受试者的治疗反应所必需的。在一些实施方案中,可向受试者施用总浓度或剂量(细胞/kg体重)至少约1x106个细胞、至少约2x106个细胞、至少约3x106个细胞、至少约4x106个细胞、至少约5x106个细胞、至少约6x106个细胞、至少约6x106个细胞、至少约8x106个细胞、至少约9x106个细胞、1x107个细胞、至少约2x107个细胞、至少约3x107个细胞、至少约4x107个细胞、至少约5x107个细胞、至少约6x107个细胞、至少约6x107个细胞、至少约8x107个细胞、至少约9x107个细胞、至少约1x108个细胞、至少约2x108个细胞、至少约3x108个细胞、至少约4x108个细胞、至少约5x108个细胞、至少约6x108个细胞、至少约6x108个细胞、至少约8x108个细胞、至少约9x108个细胞、至少约1x109个细胞、至少约2x109个细胞、至少约3x109个细胞、至少约4x109个细胞、至少约5x109个细胞、至少约6x109个细胞、至少约6x109个细胞、至少约8x109个细胞、至少约9x109个细胞、至少约1x10
10
个细胞、至少约2x10
10
个细胞、至少约3x10
10
个细胞、至少约4x10
10
个细胞、至少约5x10
10
个细胞、至少约6x10
10
个细胞、至少约6x10
10
个细胞、至少约8x10
10
个细胞、至少约9x10
10
个细胞、至少约1x10
11
个细胞、至少约2x10
11
个细胞、至少约3x10
11
个细胞、至少约4x10
11
个细胞、至少约5x10
11
个细胞、至少约6x10
11
个细胞、至少约6x10
11
个细胞、至少约8x10
11
个细胞、至少约9x10
11
个细胞或至少约1x10
12
个细胞或根据体重给药(细胞/kg体重)。例如,可以向受试者施用约5x10
10
个细胞。在另一个实例中,从3x106个细胞开始,细胞可以扩增到约5x10
10
个细胞并施用于受试者。在一些情况下,细胞会扩增到用于治疗的足够数量。例如,5x107个细胞可进行快速扩增,以产生用于治疗用途的足够数量。在一些实施方案中,向受试者施用总共少于约1x106个细胞。在一些情况下,约1x106个细胞代表施用于受试者的细胞的中值量。在一些情况下,向受试者施用至多约9x105个细胞、至多约8x105个细胞、至多约7x105个细胞、至多约6x105个细胞、至多约5x105个细胞、至多约4x105个细胞、至多约3x105个细胞、至多约2x105个细胞、至多约1x105个细胞、至多约9x104个细胞、至多约8x104个细胞、至多约7x104个细胞、至多约6x104个细胞、至多约5x104个细胞、至多约4x104个细胞、至多约3x104个细胞、至多约2x104个细胞、至多约1x104个细胞、至多约9x103个细胞、至多约8x103个细胞、至多约7x103个细胞、至多约6x103个细胞、至多约5x103个细胞、至多约4x103个细胞、至多约3x103个细胞、至多约2x103或最多约1x103个细胞或根据体重给药(细胞/kg体重)。
[0128]
在一些实施方案中,本文提供的方法没有细胞扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于3周的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于2周的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于1
周的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于5天的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于3天的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于2天的离体扩增。在一些方面,工程化细胞,诸如免疫细胞,已经经历了少于1天的离体扩增。在一些情况下,可以通过单次施用向受试者施用全部数量的细胞(例如,f
‑
cart细胞)。或者,可以多轮例如通过间隔至少1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、16小时、20小时、24小时或更长时间的两次单独施用向受试者施用全部数量的细胞(例如,f
‑
cart细胞)。
[0129]
在一些情况下,用于治疗用途的足够数量可以是大约5x104。可以输注任何数量的细胞用于治疗用途,并且这些细胞可以包含在药物组合物中。例如,患者可会被输注1x104到5x10
12
/kg/体重之间(包括1x104/kg/体重和5x10
12
/kg/体重)的多个细胞。可以为患者输注尽可能多的为其产生的细胞。在一些方面,细胞的产生没有扩增。在一些情况下,输注患者体内的细胞并非都是工程化的。例如,至少90%的输注患者体内的细胞可以被工程化。在其他情况下,至少40%的输注患者体内的细胞可以被工程化。在患者中治疗有效所需的细胞的量可根据细胞的活力和细胞被修饰的效率而变化。在一些情况下,基因修饰后的细胞活力的产物(例如增殖)可以对应于可用于施用于受试者的治疗性细胞等分试样。在一些情况下,修饰后细胞活力的增加可对应于施用对患者治疗有效所必需的细胞的量的减少。在一些方面,至少约5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或至多约100%的所述免疫细胞表达所述car和/或所述tcr。在一些方面,可选择工程化细胞用于施用。在一些方面,至少20%的免疫细胞表达car和/或tcr。在一些方面,至少25%的免疫细胞表达car和/或tcr。在一些方面,至少30%的免疫细胞表达car和/或tcr。在一些方面,至少40%的免疫细胞表达car和/或tcr。
[0130]
在一些实施方案中,受试者方法可进一步包括向有需要的受试者施用第二药剂。第二药剂可以是治疗有效量的免疫刺激剂、免疫抑制剂、抗真菌剂、抗生素、抗血管生成剂、化疗剂、放射性剂和/或抗病毒剂。第二药剂可以是药物组合物。
[0131]
在一些实施方案中,可将免疫刺激剂引入细胞或受试者。免疫刺激剂可以是特异性的或非特异性的。特异性免疫刺激剂可提供抗原特异性,诸如疫苗或抗原。非特异性免疫刺激剂可增强免疫反应或刺激免疫反应。非特异性免疫刺激剂可以是佐剂。免疫刺激剂可以是疫苗、集落刺激剂、干扰素、白介素、病毒、抗原、共刺激剂、免疫原性剂、免疫调节剂或免疫治疗剂中的任何一种。免疫刺激剂可以是细胞因子,诸如白细胞介素。一种或多种细胞因子可以与所提供方法的细胞一起引入。细胞因子可用于促进细胞毒性t淋巴细胞(包括过继转移的肿瘤特异性细胞毒性t淋巴细胞)在肿瘤微环境中扩增。在一些情况下,il
‑
2可用于促进本文所述的细胞的扩增。也可使用诸如il
‑
15的细胞因子。还可利用免疫治疗领域的其他相关细胞因子,诸如il
‑
2、il
‑
7、il
‑
12、il
‑
15、il
‑
21或其任何组合。在一些情况下,il
‑
2、il
‑
7和il
‑
15用于培养本发明的细胞。白细胞介素可以是il
‑
2或aldeskeukin。
[0132]
在一些方面,可向受试者施用免疫刺激剂。aldesleukin可以以低剂量或高剂量施用。高剂量aldeskeukin方案可包括每8小时静脉内施用aldeskeukin,如耐受,最多约14剂,剂量约为0.037mg/kg(600,000iu/kg)。免疫刺激剂(例如,aldeskeukin)可在细胞施用后24小时内施用。免疫刺激剂(例如,aldeskeukin)可在细胞输注后约15分钟内(约每8小时一
次)以输注形式施用至多约4天。可以以约100,000iu/kg、200,000iu/kg、300,000iu/kg、400,000iu/kg、500,000iu/kg、600,000iu/kg、700,000iu/kg、800,000iu/kg、900,000iu/kg或至多约1,000,000iu/kg的剂量施用免疫刺激剂(例如,aldeskeukin)。在一些情况下,可以以约100,000iu/kg至300,000iu/kg、300,000iu/kg至500,000iu/kg、500,000iu/kg至700,000iu/kg、700,000iu/kg至约1,000,000iu/kg的剂量施用aldeskeukin。免疫刺激剂(例如,aldeskeukin)可以施用约1剂到约14剂。免疫刺激剂(例如aldeskeukin)可以施用至少约1剂、2剂、3剂、4剂、5剂、6剂、7剂、8剂、9剂、10剂、11剂、12剂、13剂、14剂、15剂、16剂、17剂、18剂、19剂或至多约20剂。在一些情况下,免疫刺激剂诸如aldeskeukin可以施用约1剂至3剂、3剂至5剂、5剂至8剂、8剂至10剂、10剂至14剂、从14剂至20剂。在一些情况下,aldeskeukin施用超过20剂。在一些情况下,免疫刺激剂,诸如aldeskeukin,可以与细胞施用依次施用或同时施用。例如,免疫刺激剂可以从大约第
‑
14、
‑
13、
‑
12、
‑
11、
‑
10、
‑
9、
‑
8、
‑
7、
‑
6、
‑
5、
‑
4、
‑
3、
‑
2、
‑
1、0、1、2、3、4、5、6、7、8、9、10、11、12、13天或至多约第14天施用。在一些情况下,在施用细胞群体后第0天至第4天施用免疫刺激剂,诸如aldeskeukin。在一些情况下,施用免疫刺激剂(例如,aldeskeukin)约10min、15min、20min、30min、40min、50min、1小时、2小时或至多约3小时的时间段。在一些情况下,免疫刺激剂(例如,aldeskeukin)可以在施用工程化细胞前约24小时至施用工程化细胞后约4天施用。免疫刺激剂(例如aldeskeukin)可以从施用工程化细胞后第
‑
7、
‑
6、
‑
5、
‑
4、
‑
3、
‑
2、
‑
1、0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19天或至多约20天施用。
[0133]
在一些实施方案中,免疫刺激剂是集落刺激因子。集落刺激因子可以是g
‑
csf(非格司亭)。非格司亭可储存在300mcg/ml和480ug/1.6ml小瓶中。非格司亭可以每天以皮下注射施用。非格司亭施用可以是约5mcg/kg/天。非格司亭施用可为约1mcg/kg/天,非格司亭施用可为约2mcg/kg/天,非格司亭施用可为约3mcg/kg/天,非格司亭施用可为约4mcg/kg/天,非格司亭施用可为约5mcg/kg/天,非格司亭施用可为约6mcg/kg/天,非格司亭施用可为约7mcg/kg/天,非格司亭施用可为约8mcg/kg/天,非格司亭施用可为约9mcg/kg/天,非格司亭施用可为约10mcg/kg/天。在一些情况下,非格司亭可以以约0.5mcg/kg/天至约1.0mcg/kg/天、约1.0mcg/kg/天至1.5mcg/kg/天、约1.5mcg/kg/天至约2.0mcg/kg/天、约2.0mcg/kg/天至约3.0mcg/kg/天、约2.5mcg/kg/天至约3.5mcg/kg/天、约3.5mcg/kg/天至约4.0mcg/kg/天、约4.0mcg/kg/天至约4.5mcg/kg/天的剂量施用。非格司亭施用可以每天持续直到嗜中性粒细胞计数至少约1.0x109/l x 3天或至少约5.0x109/l。免疫刺激剂诸如非格司亭可以从施用工程化细胞后第
‑
7、
‑
6、
‑
5、
‑
4、
‑
3、
‑
2、
‑
1、0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19天或至多约20天施用。
[0134]
在一些实施方案中,方法还可包括向受试者施用免疫抑制剂。在一些情况下,受试者可以接受免疫抑制剂作为治疗方案的一部分。免疫抑制剂可以指放射治疗剂、生物剂或化学剂。在一些情况下,免疫抑制剂可包括化学剂。例如,化学剂可包含选自以下的至少一个成员:环磷酰胺、氮芥、苯丁酸氮芥、美法仑、异环磷酰胺、噻替哌、六甲蜜胺、白消安、氟达拉滨、亚硝基脲、铂、甲氨蝶呤、硫唑嘌呤、巯嘌呤、丙卡巴肼、达卡巴嗪、替莫唑胺、卡莫司汀、洛莫司汀、链脲菌素、氟尿嘧啶、放线菌素d、蒽环类抗生素、丝裂霉素c、博来霉素和光神霉素。化学剂可以是环磷酰胺或氟达拉滨。
[0135]
此外,免疫抑制剂可包括糖皮质激素、细胞生长抑制剂、抗体、抗亲免素或其任何
衍生物。糖皮质激素可以抑制过敏反应、炎症和自身免疫性疾病。糖皮质激素可以是泼尼松、地塞米松和氢化可的松。免疫抑制疗法可以包括抑制免疫系统的任何疗法。免疫抑制疗法可以帮助减轻、最小化或消除接受者的移植排斥反应。例如,免疫抑制疗法可以包括免疫抑制药物。可在移植前、移植中和/或移植后使用的免疫抑制药物,但其不限于mmf(吗替麦考酚酯(cellcept))、atg(抗胸腺细胞球蛋白)、抗cd154(cd4ol)、抗cd40(2c10、askp1240、ccfz533x2201)、阿仑单抗(campath)、抗cd20(利妥昔单抗)、抗il
‑
6r抗体(托珠单抗、actemra)、抗il
‑
6抗体(sarilumab、奥洛组单抗(olokizumab))、ctla4
‑
ig(阿巴西普(abatacept)/orencia)、贝拉西普(belatacept)(lea29y)、西罗莫司(rapimune)、依维莫司、他克莫司(普乐可复(prograf))、达(克)珠单抗(赛尼哌(ze
‑
napax))、巴利昔单抗(舒莱(simulect))、英夫利昔单抗(类克(remicade))、环孢素、脱氧精胍菌素、可溶性补体受体1、眼镜蛇毒因子、坎普他汀(compstatin)、抗c5抗体(依库珠单抗(eculizumab)/soliris)、甲泼尼龙、fty720、依维莫司、来氟米特、抗il
‑
2r
‑
ab、雷帕霉素、抗cxcr3抗体、抗icos抗体、抗ox40抗体和抗cd122抗体。此外,一种或多于一种免疫抑制剂/药物可以一起或依次使用。一种或多于一种免疫抑制剂/药物可用于诱导治疗或维持治疗。在诱导和维持阶段可以使用相同或不同的药物。在一些情况下,达(克)珠单抗(赛尼哌)可用于诱导治疗,他克莫司(普乐可复)和西罗莫司(rapimune)可用于维持治疗。达(克)珠单抗(赛尼哌)也可用于诱导治疗,低剂量他克莫司(普乐可复)和低剂量西罗莫司(rapimune)可用于维持治疗。还可以使用非药物方案实现免疫抑制,包括但不限于全身照射、胸腺照射和全部和/或部分脾切除术。
[0136]
在一些情况下,可以施用细胞生长抑制剂以进行免疫抑制。细胞抑制剂可抑制细胞分裂。细胞抑制剂可以是嘌呤类似物。细胞抑制剂可以是烷化剂、抗代谢药诸如甲氨蝶呤、咪唑硫嘌呤或巯基嘌呤。细胞抑制剂可以是环磷酰胺、甲氯乙胺、苯丁酸氮芥、美法仑、异环磷酰胺、噻替哌、六甲基三聚氰胺、白消安、氟达拉滨、亚硝基脲、铂、甲氨蝶呤、硫唑嘌呤、巯基嘌呤、甲基苄肼、达卡巴嗪、替莫唑胺、卡氯芥、洛莫司汀、链脲佐菌素、氟尿嘧啶、放线菌素d、蒽环类抗生素、丝裂霉素c、博来霉素和光神霉素中的至少一个。
[0137]
在一些情况下,免疫抑制剂诸如氟达拉滨可以作为治疗方案的一部分施用。磷酸氟达拉滨可以是合成的嘌呤核苷,与生理核苷的不同之处在于糖部分可以是阿拉伯糖,而不是核糖或脱氧核糖。氟达拉滨可以是嘌呤拮抗剂抗代谢药。氟达拉滨可以以50mg小瓶的形式提供,为白色冻干固体块状的氟达拉滨磷酸盐粉末。用2ml无菌注射用水重新配制至浓度为25mg/ml后,溶液的ph值为7.7。氟达拉滨粉在2
‑
8℃下可稳定至少18个月;重新配制后,氟达拉滨在室温下可稳定至少16天。由于不存在防腐剂,重新配制的氟达拉滨通常会在8小时内施用。对于特定的相容性信息,应查阅专门的参考资料。氟达拉滨可在血清中去磷酸化,在细胞内转运并转化为核苷酸三磷酸氟达拉滨;这种2
‑
氟
‑
ara
‑
atp分子被认为是药物的细胞毒性作用所必需的。氟达拉滨抑制dna聚合酶、核糖核苷酸还原酶、dna引物酶,并可干扰链延长以及rna和蛋白质的合成。氟达拉滨可在100ml 0.9%氯化钠usp中静脉输注15至30分钟。剂量将基于体表面积(bsa)。如果患者肥胖(bmi>35),药物剂量将使用实际体重计算。在一些情况下,免疫抑制剂诸如氟达拉滨可以以约20mg/m2至约30mg/m2的受试者体表面积施用。在一些情况下,免疫抑制剂诸如氟达拉滨可以以约5mg/m2至约10mg/m2的受试者体表面积、约10mg/m2至约15mg/m2、约15mg/m2至约20mg/m2的受试者体表面积、约20mg/m2至
约25mg/m2的受试者体表面积、约25mg/m2至约30mg/m2的受试者体表面积、约30mg/m2至约40mg/m2的受试者体表面积施用。在一些情况下,免疫抑制剂诸如氟达拉滨可以以约1mg/m2、2mg/m2、3mg/m2、4mg/m2、5mg/m2、6mg/m2、7mg/m2、8mg/m2、9mg/m2、10mg/m2、11mg/m2、12mg/m2、13mg/m2、14mg/m2、15mg/m2、16mg/m2、17mg/m2、18mg/m2、19mg/m2、20mg/m2、21mg/m2、22mg/m2、23mg/m2、24mg/m2、25mg/m2、26mg/m2、27mg/m2、28mg/m2、29mg/m2、30mg/m2、31mg/m2、32mg/m2、33mg/m2、34mg/m2、35mg/m2、36mg/m2、37mg/m2、38mg/m2、39mg/m2、40mg/m2、41mg/m2、42mg/m2、43mg/m2、44mg/m2、45mg/m2、46mg/m2、47mg/m2、48mg/m2、49mg/m2、50mg/m2、51mg/m2、52mg/m2、53mg/m2、54mg/m2、55mg/m2、56mg/m2、57mg/m2、58mg/m2、59mg/m2、60mg/m2、61mg/m2、62mg/m2、63mg/m2、64mg/m2、65mg/m2、66mg/m2、67mg/m2、68mg/m2、69mg/m2、70mg/m2、71mg/m2、72mg/m2、73mg/m2、74mg/m2、75mg/m2、76mg/m2、77mg/m2、78mg/m2、79mg/m2、80mg/m2、81mg/m2、82mg/m2、83mg/m2、84mg/m2、85mg/m2、86mg/m2、87mg/m2、88mg/m2、89mg/m2、90mg/m2、91mg/m2、92mg/m2、93mg/m2、94mg/m2、95mg/m2、96mg/m2、97mg/m2、98mg/m2、99mg/m2、至多约100mg/m2的受试者体表面积施用。在一些情况下,免疫抑制剂诸如氟达拉滨在100ml 0.9%氯化钠usp中的剂量为25mg/m2,并在约15至约30分钟内输注。
[0138]
在一些情况下,免疫抑制剂诸如环磷酰胺可以作为治疗方案的一部分施用。环磷酰胺可以是氮芥衍生的烷化剂。在肝脏中转化为活性代谢物后,环磷酰胺起到烷化剂的作用;该药物还具有有效的免疫抑制活性。静脉施用后的血清半衰期为3
‑
12小时;施用后至多72小时可在血清中检测到药物和/或其代谢物。按照指示用无菌注射用水重新配制后,环磷酰胺可在室温下稳定24小时,或在2
‑
8℃下保持6天。环磷酰胺可在250ml d5w中稀释并在一小时内输注。剂量将基于受试者的体重。如果受试者肥胖(bmi>35),药物剂量将使用所述的实际体重计算。在一些情况下,免疫抑制剂诸如环磷酰胺可以以约1mg/kg至约3mg/kg、约3mg/kg至约5mg/kg、约5mg/kg至约10mg/kg、约10mg/kg至约20mg/kg、20mg/kg至约30mg/kg、约30mg/kg至约40mg/kg、约40mg/kg至约50mg/kg、约50mg/kg至约60mg/kg、约60mg/kg至约70mg/kg、约70mg/kg至约80mg/kg、约80mg/kg至约90mg/kg、约90mg/kg至约100mg/kg施用。在一些情况下,免疫抑制剂诸如环磷酰胺以超过受试者的50mg/kg施用。在一些情况下,免疫抑制剂诸如环磷酰胺可以以受试者的约1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg、25mg/kg、26mg/kg、27mg/kg、28mg/kg、29mg/kg、30mg/kg、31mg/kg、32mg/kg、33mg/kg、34mg/kg、35mg/kg、36mg/kg、37mg/kg、38mg/kg、39mg/kg、40mg/kg、41mg/kg、42mg/kg、43mg/kg、44mg/kg、45mg/kg、46mg/kg、47mg/kg、48mg/kg、49mg/kg、50mg/kg、51mg/kg、52mg/kg、53mg/kg、54mg/kg、55mg/kg、56mg/kg、57mg/kg、58mg/kg、59mg/kg、60mg/kg、61mg/kg、62mg/kg、63mg/kg、64mg/kg、65mg/kg、66mg/kg、67mg/kg、68mg/kg、69mg/kg、70mg/kg、71mg/kg、72mg/kg、73mg/kg、74mg/kg、75mg/kg、76mg/kg、77mg/kg、78mg/kg、79mg/kg、80mg/kg、81mg/kg、82mg/kg、83mg/kg、84mg/kg、85mg/kg、86mg/kg、87mg/kg、88mg/kg、89mg/kg、90mg/kg、91mg/kg、92mg/kg、93mg/kg、94mg/kg、95mg/kg、96mg/kg、97mg/kg、98mg/kg、99mg/kg、至多约100mg/kg施用。在一些情况下,免疫抑制剂诸如环磷酰胺可在至少约1天至约3天、3天至5天、5天至7天、7天至约10天、10天至约14天、14天至约20天内施用。在一些情况下,环磷酰胺的剂量可为约60mg/kg,并在250ml 5%葡萄糖水溶液中稀释并在一小时内输注。
[0139]
免疫抑制剂可以是例如环磷酰胺和氟达拉滨的方案。例如,可以将环磷酰胺氟达拉滨方案施用于接受工程化细胞疗法的受试者。环磷酰胺氟达拉滨方案可以以60mg/kg qd 2天和25mg/m
2 qd 5天的方案施用。可以在施用本发明的工程化细胞之前1小时至14天施用化疗方案,例如环磷酰胺氟达拉滨。可以以不同剂量施用化疗方案。例如,受试者可以接受较高的初始剂量,随后接受较低的剂量。受试者可以接受较低的初始剂量,随后接受较高的剂量。
[0140]
在一些情况下,免疫抑制剂可以是抗体。可以以治疗有效剂量施用抗体。抗体可以是多克隆抗体或单克隆抗体。可以施用的多克隆抗体可以是抗淋巴细胞或抗胸腺细胞抗原。单克隆抗体可以是抗il
‑
2受体抗体、抗cd25抗体或抗cd3抗体。也可以使用抗cd20抗体。b细胞消融疗法,诸如与cd20反应的药剂,例如rituxan,也可用作免疫抑制剂。
[0141]
免疫抑制剂也可以是抗亲免素。抗亲免素可以是环孢素、他克莫司、依维莫司或西罗莫司。另外的免疫抑制剂可以是干扰素,诸如ifn
‑
β、阿片类药物、抗tnf结合剂、霉酚酸酯或芬戈莫德。
[0142]
在一些实施方案中,方法还可包括对受试者施用放射疗法。放射疗法可包括辐射。全身辐射可以以12gy施用。辐射剂量可以包括对包括健康组织的整个身体的12gy的累积剂量。辐射剂量可包括5gy至20gy。辐射剂量可以是5gy、6gy、7gy、8gy、9gy、10gy、11gy、12gy、13gy、14gy、15gy、16gy、17gy、18gy、19gy或至多20gy。辐射可以是全身辐射或身体局部辐射。在辐射是全身辐射的情况下,它可以是均匀的或不均匀的。例如,当辐射可不均匀时,身体较窄的区域(诸如颈部)可比较宽的区域(诸如臀部)接受更高的剂量。
[0143]
在一些实施方案中,本文提供的方法还可进一步包括施用化疗剂。化疗剂或化合物可以是用于治疗癌症的化合物。可与所公开的方法组合使用的示例性化疗剂包括但不限于核分裂阻止物质(长春花生物碱)。这些包括长春新碱、长春碱、长春地辛和navelbine
tm
(长春瑞滨,5
’‑
noranhydroblastine)。在其他情况下,化疗癌症药物包括拓扑异构酶i抑制剂,诸如喜树碱化合物。如本文所用,“喜树碱化合物”包括camptosar
tm
(伊立替康hcl)、hycamtin
tm
(托泊替康hcl)和其他源自喜树碱及其类似物的化合物。可用于本文公开的方法和组合物中的另一类化疗癌症剂是鬼臼毒素衍生物,诸如依托泊苷、替尼泊苷和米托鬼臼肼。本公开内容还包括称为烷化剂的其他化疗癌症剂,其使肿瘤细胞中的遗传物质烷基化。这些包括但不限于顺铂、环磷酰胺、氮芥、三亚甲基硫代磷酰胺、卡莫司汀、白消安、苯丁酸氮芥、洛莫司汀、尿嘧啶氮芥、氯苯匹嗪(chlomaphazin)和达卡巴嗪。本公开内容包括作为化疗剂的抗代谢物。这类药物的实例包括阿糖胞苷、氟尿嘧啶、甲氨蝶呤、巯基嘌呤、咪唑硫嘌呤和丙卡巴肼。可用于本文公开的方法和组合物中的另一类化学治疗癌症剂包括抗生素。实例包括但不限于阿霉素、博莱霉素、放线菌素d、柔红霉素、光神霉素、丝裂霉素、丝裂霉素c和道诺霉素。存在许多可用于这些化合物的市售脂质体制剂。本公开内容还包括其他化疗癌症剂,包括但不限于抗肿瘤抗体、达卡巴嗪、氮杂胞苷、安吖啶、美法仑、异环磷酰胺和米托蒽醌。
[0144]
在一些实施方案中,方法还可包括向受试者施用抗病毒剂。在一些情况下,抗病毒剂可以作为治疗方案的一部分施用。在一些情况下,可以将疱疹病毒预防剂作为治疗方案的一部分施用于受试者。疱疹病毒预防剂可以是伐昔洛韦(伐昔洛韦片(valtrex))。在hsv血清学检查呈阳性的受试者中,可口服使用伐昔洛韦片以预防疱疹病毒感染的发生。可以
施用的其他抗病毒剂包括但不限于抗乙型肝炎病毒(hbv)、抗丙型肝炎病毒(hcv)、抗人乳头瘤病毒(hpv)和抗爱泼斯坦
‑
巴尔病毒(ebv)。
[0145]
在一些实施方案中,方法还可包括向受试者施用抗生素。抗生素可以以治疗有效剂量施用。抗生素可以杀伤或抑制细菌的生长。抗生素可以是广谱抗生素,可以靶向多种细菌。第三代或第四代广谱抗生素可以是头孢菌素或喹诺酮。抗生素也可以是靶向特定类型细菌的窄谱抗生素。抗生素可以靶向细菌细胞壁,诸如青霉素类和头孢菌素类。抗生素可以靶向细胞膜,诸如多黏菌素类。抗生素会干扰必需的细菌酶,诸如抗生素:利福霉素类、台勾霉素类(lipiarmycins)、喹诺酮类和磺胺类。抗生素也可以是蛋白质合成抑制剂,诸如大环内酯类、林可胺类和四环素类。抗生素也可以是环状脂肽(诸如达托霉素)、甘氨酰环素类(glycylcyclines)(诸如替加环素)、噁唑烷二酮类(诸如利奈唑胺)和脂霉素类(诸如非达米星)。在一些情况下,抗生素可以是第1代、第2代、第3代、第4代或第5代。第一代抗生素可具有窄谱。第一代抗生素的实例可以是青霉素类(青霉素g或青霉素v)、头孢菌素类(头孢唑啉、头孢噻吩、头孢匹林、头孢瞳吩(cephalethin)、头孢拉定或cephadroxin)。在一些情况下,抗生素可以是第二代。第二代抗生素可以是青霉素(阿莫西林或氨苄西林)、头孢菌素(头孢呋辛、头孢孟多、头孢西丁、头孢克洛、cephrozil、氯碳头孢)。在一些情况下,抗生素可以是第三代。第三代抗生素可以是青霉素(羧苄西林和替卡西林)或头孢菌素(头孢肟、头孢曲松、头孢噻肟、头孢唑肟和头孢他啶)。抗生素也可以是第4代抗生素。第4代抗生素可以是cephipime。抗生素也可以是第5代。第5代抗生素可以是cephtaroline或头孢吡普(cephtobiprole)。在一些情况下,抗生素可以是细菌壁靶向剂、细胞膜靶向剂、细菌酶干扰剂、杀菌剂、蛋白质合成抑制剂或抑菌剂。细菌壁靶向剂可以是青霉素衍生物(青霉烷类)、头孢菌素类(头孢烯类)、单菌胺类和碳青霉烯类。β
‑
内酰胺类抗生素具有杀菌或抑菌作用,通过抑制细菌细胞壁肽聚糖层的合成发挥作用。在一些情况下,抗生素可以是蛋白质合成抑制剂。蛋白质合成抑制剂可以是氨苄西林,它充当转肽酶的不可逆抑制剂,细菌需要转肽酶来制造细胞壁。它抑制二元裂变中细菌细胞壁合成的第三阶段和最后阶段,最终导致细胞裂解;因此,氨苄西林通常具有杀菌作用。在一些情况下,杀菌剂可以是头孢菌素或喹诺酮。在其他情况下,抑菌剂是甲氧苄啶、磺胺甲噁唑或喷他脒。
[0146]
在一些情况下,可以施用预防pcp肺炎的药物。例如,可以施用甲氧苄啶和磺胺甲噁唑以预防肺炎。甲氧苄氨嘧啶和磺胺甲噁唑(tmp/smx;示例性磺胺药物)的剂量可以是每周3次,每天1片po,在不连续的日子里,在第一剂化疗时或之后,并持续至少约6个月,直到至少连续2项实验室研究的cd4计数大于200。在一些情况下,甲氧苄啶可以以160mg施用。甲氧苄啶可以以约100至约300mg施用。甲氧苄啶可以以约100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg或至多约300mg施用。在一些情况下,磺胺甲噁唑以800mg施用。磺胺甲噁唑可以以约500mg至约1000mg施用。磺胺甲噁唑以约500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg或至多约1000mg施用。在一些情况下,可以以治疗有效量施用tmp/smx方案。tmp/smx可每天约1x至约10x施用。tmp/smx可每天1x、2x、3x、4x、5x、6x、7x、8x、9x、10x、11x、12x、13x、14x、15x、16x、17x、18x、19x或至多约20x施用。在一些情况下,tmp/smx可在每周基础上施用。例如,tmp/smx可每周1x、2x、3x、4x、5x、6x或至多约7x施用。tmp/smx方案可从施用细胞疗法(诸如ast
‑
cart)后约第
‑
14、
‑
13、
‑
12、
‑
11、
‑
10、
‑
9、
‑
8、
‑
7、
‑
6、
‑
5、
‑
4、
‑
3、
‑
2、
‑
1、0、1、2、3、4、5、6、7、8、9、10、11、12、13天或至多约第14天施用。
[0147]
在一些实施方案中,本文提供的方法可以与抗血管生成剂组合使用。用于所公开的方法和组合物的合适的抗血管生成剂包括抗vegf抗体,包括人源化和嵌合抗体、抗vegf适体和反义寡核苷酸。可与所提供的方法和组合物一起使用的其他血管生成抑制剂包括血管抑制素、内皮抑制素、干扰素、白细胞介素1(包括α和β)、白细胞介素12、视黄酸和金属蛋白酶
‑
1和金属蛋白酶
‑
2(timp
‑
1和timp
‑
2)的组织抑制剂。也可以使用小分子,包括拓扑异构酶,诸如雷佐生(razoxane),一种具有抗血管生成活性的拓扑异构酶ii抑制剂。
[0148]
在一些实施方案中,方法可包括施用额外的疗法,诸如抗真菌疗法。在一些情况下,向接受施用包含工程化细胞的组合物的受试者施用抗真菌剂。抗真菌剂可以是可杀伤或阻止真菌生长的药物。抗真菌剂的靶标可以包括甾醇生物合成、dna生物合成和β
‑
葡聚糖生物合成。抗真菌剂也可以是叶酸合成抑制剂或核酸交联剂。叶酸合成抑制剂可以是磺胺类药物。例如,叶酸合成抑制剂可以是抑制真菌合成叶酸的药剂或竞争性抑制剂。磺胺类药物或叶酸合成抑制剂可以是甲氨蝶呤或磺胺甲噁唑。在一些情况下,抗真菌剂可以是核酸交联剂。交联剂可以抑制真菌中的dna或rna过程。例如,交联剂可以是5
‑
氟胞嘧啶,其可以是胞嘧啶的氟化类似物。5
‑
氟胞嘧啶可通过胞质内转化为5
‑
氟尿嘧啶来抑制dna和rna的合成。其他抗真菌剂可以是灰黄霉素。灰黄霉素是一种由灰黄青霉菌产生的抗真菌抗生素。灰黄霉素抑制真菌的有丝分裂,可被视为一种交联剂。另外的交联剂可以是烯丙胺(萘替芬和特比萘芬)在角鲨烯环氧化酶水平上抑制麦角固醇合成;一种形态烯衍生物(阿莫洛芬)抑制在麦角固醇途径的后续步骤。
[0149]
在一些实施方案中,抗真菌剂可以来自多烯、唑、丙烯胺或棘球白素。在一些实施方案中,多烯抗真菌剂是两性霉素b、杀念珠菌素、菲律宾菌素(filipin)、哈霉素、那他霉素、制霉菌素或裂霉素。在一些情况下,抗真菌剂可来自唑类。唑类抗真菌剂可抑制羊毛甾醇14α
‑
脱甲基酶。唑类抗真菌剂可以是咪唑类,诸如联苯苄唑、布康唑、克霉唑、益康唑、芬替康唑、异康唑、酮康唑、卢立康唑、咪康唑、莫康唑、奥唑康唑、舍他康唑、舒康唑或噻康唑。唑类抗真菌剂可以是三唑类,诸如阿巴康唑、艾氟康唑、氟康唑、艾沙康唑(isavuvonazole)、伊曲康唑、泊沙康唑、丙环唑、雷夫康唑、特康唑或伏立康唑。在一些情况下,唑类可以是噻唑类,诸如阿巴芬净。抗真菌剂可以是烯丙胺,诸如阿莫罗芬(amorolfin)、布替萘芬、萘替芬或特比萘芬。抗真菌剂也可以是棘白菌素,诸如阿尼芬净、卡泊芬净或米卡芬净。可以作为抗真菌剂的另外的药剂可以是橙酮、苯甲酸、环吡酮、氟胞嘧啶、灰黄霉素、卤普罗近、托萘酯、十一碳烯酸、龙胆紫或秘鲁香脂。本领域技术人员可以根据感染个体的真菌适当地确定使用哪种已知的抗真菌药物。在一些情况下,受试者将接受与工程化细胞组合的氟康唑。可以预防性地施用抗真菌疗法。
[0150]
在一些方面,可以在施用通过本文提供的方法产生的组合物后监测治疗的受试者。在一些实施方案中,可以在施用工程化细胞后从受试者获得外周血。在一些实施方案中,可以在施用工程化细胞后从受试者的外周血中分离血清。在一些实施方案中,可以在施用工程化细胞后从受试者收集脊椎穿刺样品。在一些实施方案中,可以从样品中定量来自经治疗受试者的样品的工程化免疫细胞。在一些方面,来自已经历工程化细胞施用的受试者的样品可以是外周血。在一些实施方案中,可以通过定量pcr(qpcr)监测工程化细胞。过继移植细胞的qpcr测定可以指示施用后受试者中存在的工程化细胞水平。在一些情况下,
可以使用流式细胞术监测过继转移的细胞。例如,流式细胞术测定可以确定4
‑
1bb对tcr的水平。在一些情况下,可以进行单细胞tcr pcr。可以在输注后第7天确定过继转移细胞的水平。过继转移细胞(诸如修饰细胞)的水平可以在输注后的以下任何一天确定:第5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195天或至多第200天。
[0151]
在一些实施方案中,对已施用工程化细胞的受试者的生长因子水平进行定量。确定受试者体内生长因子的水平可以表明受试者对施用的工程化细胞的反应。在一些方面,定量生长因子的水平以监测受试者对过继转移的细胞的耐受性。在一些方面,定量生长因子的水平可以表明干预对于预防、稳定或最高毒性是必要的。在一些方面,毒性可以是细胞因子释放综合征。在一些实施方案中,可以从受试者的样品中定量和/或监测的生长因子选自il
‑
10、il
‑
6、肿瘤坏死因子α(tnf
‑
α)、il
‑
1β、il
‑
2、il
‑
4、il
‑
8、il
‑
12和/或ifn
‑
γ。
[0152]
在一些方面,重复施用包含工程化细胞的细胞群体。在一些方面,受试者可经历包含工程化细胞的细胞群体的约1、2、3、4、5、6、7、8、9或至多10次输注。在一些方面,工程化细胞对于接受施用的受试者是同种异体的。在一些方面,工程化细胞对于接受施用的受试者是自体的。
[0153]
在一些实施方案中,本文提供的方法可用于治疗疾病。在一些方面,本文提供的方法可用于通过用工程化免疫细胞群体靶向癌症来治疗癌症。在一些实施方案中,施用受试者工程化细胞的受试者患有癌症。在一些方面,癌症是靶标并且是血液学的。在一些实施方案中,血液学癌症包括白血病、骨髓瘤、淋巴瘤和/或其组合。在一些方面,白血病可以是慢性淋巴细胞白血病(cll)、t细胞急性淋巴细胞白血病(t
‑
all)、急性髓性白血病(aml)、b细胞急性淋巴细胞白血病(b
‑
all)和/或急性淋巴细胞白血病(all)。在一些实施方案中,淋巴瘤可以是套细胞淋巴瘤(mcl)、t细胞淋巴瘤、霍奇金淋巴瘤和/或非霍奇金淋巴瘤。在一些方面,癌症是靶标并且是固体。在一些实施方案中,实体癌靶标或液体癌靶标选自:肾母细胞瘤、尤因氏肉瘤、神经内分泌瘤、胶质母细胞瘤、神经母细胞瘤、黑色素瘤、皮肤癌、乳腺癌、结肠癌、直肠癌、前列腺癌、肝癌、肾癌、胰腺癌、肺癌、胆道癌、宫颈癌、子宫内膜癌、食道癌、胃癌、头颈癌、甲状腺髓样癌、卵巢癌、神经胶质瘤或膀胱癌。癌症的非限制性实例包括癌症的细胞,癌症包括棘皮瘤、腺泡细胞癌、听神经瘤、肢端黑色素瘤、尖螺旋体瘤、急性嗜酸性粒细胞白血病、急性淋巴细胞白血病、急性巨核细胞白血病、急性单核细胞白血病、急性髓母细胞白血病伴成熟、急性髓性树突状细胞白血病、急性髓细胞白血病、急性早幼粒细胞白血病、金刚瘤、腺癌、腺样囊性癌、腺瘤、牙源性腺瘤、肾上腺皮质癌、成人t细胞白血病、侵袭性nk细胞白血病、艾滋病相关癌症、艾滋病相关淋巴瘤、肺泡软部肉瘤、成釉细胞纤维瘤、肛门癌、间变性大细胞淋巴瘤、甲状腺未分化癌、血管免疫母细胞t细胞淋巴瘤、血管平滑肌脂肪瘤、血管肉瘤、阑尾癌、星形细胞瘤、非典型畸胎样横纹肌瘤、基底细胞癌、基底样癌、b细胞白血病、b细胞淋巴瘤、贝里尼管癌、胆道癌、膀胱癌、胚细胞瘤、骨癌、骨肿瘤、脑干胶质瘤、脑肿瘤、乳腺癌、brenner肿瘤、支气管肿瘤、细支气管肺泡癌、棕色肿瘤、伯基特淋巴瘤、未知原发部位的癌症、类癌瘤、癌、原位癌、阴茎癌、未知原发部位癌、癌肉瘤、castleman病、中枢神经系统胚胎肿瘤、小脑星形细胞瘤、脑星形细胞瘤、宫颈癌、胆管癌、软骨瘤、软骨肉瘤、脊索瘤、绒毛膜癌、脉络丛乳头状瘤、慢性淋巴细胞白血病、慢性单核细胞白血病、慢性粒细胞白血病、慢性骨髓增生性疾病、慢性嗜中性粒细胞白血病、透明细胞瘤、
结肠癌、结直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、德戈斯病、隆突性皮肤纤维肉瘤、皮样囊肿、促结缔组织增生性小圆细胞瘤、弥漫性大b细胞淋巴瘤、胚胎发育不良神经上皮瘤、胚胎癌、内胚窦瘤、子宫内膜癌、子宫内膜子宫癌、子宫内膜样肿瘤、肠病相关t细胞淋巴瘤、室管膜母细胞瘤、室管膜瘤、上皮样肉瘤、红白血病、食管癌、成感觉神经细胞瘤、尤文氏肉瘤家族、尤文氏家族肉瘤、尤文氏肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、肝外胆管癌、乳房外佩吉特病、输卵管癌、胎中胎、纤维瘤、纤维肉瘤、滤泡性淋巴瘤、滤泡性甲状腺癌、胆囊癌、胆囊癌、神经节神经胶质瘤、神经节细胞瘤、胃癌、胃淋巴瘤、胃肠道癌、胃肠道类癌瘤、胃肠道间质瘤、胃肠道间质瘤、胚细胞瘤、生殖细胞瘤、妊娠绒毛膜癌、妊娠滋养细胞肿瘤、骨巨细胞瘤、多形性成胶质细胞瘤、神经胶质瘤、大脑神经胶质瘤病、血管球瘤、胰高血糖素瘤、性腺母细胞瘤、颗粒细胞瘤、多毛细胞白血病、多毛细胞白血病、头颈癌、头颈癌、心脏癌、血管母细胞瘤、血管外皮细胞瘤、血管肉瘤、血液系统恶性肿瘤、肝细胞癌、肝脾t细胞淋巴瘤、遗传性乳腺癌
‑
卵巢癌综合征、霍奇金淋巴瘤、霍奇金淋巴瘤、下咽癌、下丘脑胶质瘤、炎性乳腺癌、眼内黑色素瘤、胰岛细胞癌、胰岛细胞肿瘤、幼年型粒单核细胞白血病、卡波西肉瘤、卡波西肉瘤、肾癌、klatskin瘤、krukenberg瘤、喉癌、喉癌、恶性黑色素瘤、白血病、白血病、唇和口腔癌、脂肪肉瘤、肺癌、黄体瘤、淋巴管瘤、淋巴管肉瘤、淋巴上皮瘤、淋巴样白血病、淋巴瘤、巨球蛋白血症、恶性纤维组织细胞瘤、恶性纤维组织细胞瘤、恶性骨纤维组织细胞瘤、恶性胶质瘤、恶性间皮瘤、恶性外周神经鞘瘤、恶性横纹肌瘤、恶性蝾螈瘤、malt淋巴瘤、套细胞淋巴瘤、肥大细胞白血病、纵隔生殖细胞瘤、纵隔肿瘤、甲状腺髓样癌、髓母细胞瘤、髓母细胞瘤、髓上皮瘤、黑色素瘤、黑色素瘤、脑膜瘤、默克尔细胞癌、间皮瘤、间皮瘤、转移性鳞状颈癌伴隐匿性原发性、转移性尿路上皮癌、混合苗勒管瘤、单核细胞白血病、口腔癌、黏液性肿瘤、多发性内分泌瘤综合征、多发性骨髓瘤、多发性骨髓瘤、蕈样肉芽肿、蕈样肉芽肿、骨髓增生异常疾病、骨髓增生异常综合征、髓系白血病、髓系肉瘤、骨髓增生性疾病、粘液瘤、鼻腔癌、鼻咽肿瘤、鼻咽癌、新(赘)生物、神经鞘瘤、神经母细胞瘤、神经母细胞瘤、神经纤维瘤、神经瘤、结节性黑色素瘤、非霍奇金淋巴瘤、非霍奇金淋巴瘤、非黑色素瘤皮肤癌、非小细胞肺癌、眼肿瘤学、少突星形细胞瘤、少突胶质细胞瘤、嗜酸细胞瘤、视神经鞘脑膜瘤、口腔癌、口腔癌、口咽癌、骨肉瘤、骨肉瘤、卵巢癌、卵巢癌、卵巢上皮癌、卵巢生殖细胞瘤、卵巢低恶性潜能肿瘤、乳腺paget病、潘科斯特瘤、胰腺癌、胰腺癌、甲状腺乳头状癌、乳头状瘤病、副神经节瘤、鼻窦癌、甲状旁腺癌、阴茎癌、血管周上皮样细胞瘤、咽癌、嗜铬细胞瘤、中间分化松果体实质瘤、松果体母细胞瘤、垂体细胞瘤、垂体腺瘤、垂体瘤、浆细胞瘤、胸膜肺母细胞瘤、多胚细胞瘤、前体t淋巴母细胞淋巴瘤、原发性中枢神经系统淋巴瘤、原发性渗出性淋巴瘤、原发性肝细胞癌、原发性肝癌、原发性腹膜癌、原发性神经外胚层肿瘤、前列腺癌、腹膜假粘液瘤、直肠癌、肾细胞癌、涉及15号染色体上nut基因的呼吸道癌、视网膜母细胞瘤、横纹肌瘤、横纹肌肉瘤、richter’s转化、骶尾部畸胎瘤、唾液腺癌、肉瘤、神经鞘瘤病、皮脂腺癌、继发性肿瘤、精原细胞瘤、浆液性肿瘤、男性细胞瘤、性索间质细胞瘤、塞扎里综合征、印戒细胞癌、皮肤癌、小蓝圆形细胞瘤、小细胞癌、小细胞肺癌、小细胞淋巴瘤、小肠癌、软组织肉瘤、生长抑素瘤、煤烟疣、脊髓肿瘤、脊柱肿瘤、脾边缘区淋巴瘤、鳞状细胞癌、胃癌、浅表扩散性黑色素瘤、幕上原始神经外胚叶肿瘤、表面上皮
‑
间质肿瘤、滑膜肉瘤、t细胞急性淋巴细胞白血病、t细胞大颗粒淋巴细胞白血病、t细胞白血病、t细胞淋巴瘤、t细胞幼淋巴细胞白血病、畸胎瘤、终末期淋巴癌、睾丸癌、泡膜细胞瘤、喉癌、
胸腺癌、胸腺瘤、甲状腺癌、肾盂输尿管移行细胞癌、移行细胞癌、脐尿管癌、尿道癌、泌尿生殖系统肿瘤、子宫肉瘤、葡萄膜黑色素瘤、阴道癌、verner morrison综合征、疣状癌、视觉通路胶质瘤、外阴癌、waldenstrom巨球蛋白血症、warthin瘤、wilms瘤及其组合。在一些实施方案中,靶向癌细胞代表癌细胞群体内的亚群,诸如癌干细胞。在一些实施方案中,癌症属于造血谱系,诸如淋巴瘤。抗原可以是肿瘤相关抗原。在一些方面,受试者在治疗或施用后可患有微小残留病变(mrd)。mrd可以包括任何上述癌症或癌细胞。在一些实施方案中,mrd是急性淋巴细胞白血病。一方面,本文提供的癌症可表达趋化因子诸如sdf
‑
1。一方面,本文提供的癌症的肿瘤微环境的细胞表达趋化因子。趋化因子可以吸引免疫细胞,诸如本文提供的工程化免疫细胞。一方面,工程化免疫细胞,诸如f
‑
cart,可以迁移到趋化因子(诸如sdf
‑
1)高表达的癌症或肿瘤微环境。一方面,可以用本文提供的工程化免疫细胞治疗表达趋化因子诸如sdf
‑
1的癌症。
[0154]
在一些实施方案中,受试者具有bcr
‑
abl突变。在一些实施方案中,bcr
‑
abl突变在bcr
‑
abl激酶结构域或其一部分中。在一些实施方案中,受试者在bcr
‑
abl激酶结构域或其部分中具有t315i和/或v299l突变。在一些情况下,受试者显示对酪氨酸激酶抑制剂的抗性。
[0155]
在一些实施方案中,受试者已接受先前治疗。例如,受试者可已经接受了针对诸如癌症的疾病的第一线治疗。在一些方面,受试者可对第一线治疗具有抗性和/或在第一线治疗诸如化疗后易患肿瘤。在一些方面,受试者在施用受试者工程化细胞之前用化疗预处理。
[0156]
本文可以提供用于向患有诸如癌症的病症的受试者施用治疗方案的方法。在一些情况下,可以以单位剂型提供细胞组合物(例如,包含含有工程化免疫细胞的药物组合物)。细胞组合物可以重悬在溶液中并以输注施用。本文还可以提供包括免疫刺激剂、免疫抑制剂、抗生素、抗真菌剂、止吐剂、化疗剂、放疗及其任何组合的治疗方案。可以将包括上述任一项的治疗方案冻干并在水溶液(例如盐水溶液)中重构。在一些情况下,治疗通过选自皮下注射、肌内注射、皮内注射、经皮施用、静脉内(“i.v.”)施用、鼻内施用、淋巴管内注射和口服施用的途径施用。在一些情况下,通过淋巴管内微导管向受试者输注包含工程化细胞的细胞组合物。
[0157]
与本公开内容的细胞疗法结合使用的药物可以作为液体、胶囊、片剂或咀嚼片口服施用。因为口服途径最方便,通常也是最安全和最便宜的,所以它是最常用的一种途径。然而,由于药物通常通过消化道的方式,所以它具有局限性。对于口服施用的药物,吸收可在口腔和胃中开始。然而,大多数药物通常从小肠吸收。药物穿过肠壁并进入肝脏,然后通过血流输送到其靶标部位。肠壁和肝脏化学改变(代谢)许多药物,减少到达血液的药物量。因此,当静脉注射时,这些药物通常以较小的剂量施用以产生相同的效果。
[0158]
对于与本公开内容的细胞疗法结合使用的药物的皮下施用,将针插入皮肤正下方的脂肪组织中。注射药物后,它会进入小血管(毛细血管)并被血流带走。或者,药物通过淋巴管到达血流。当需要较大体积的药物产品时,肌内途径优于皮下途径。因为肌肉位于皮肤和脂肪组织下方,所以使用更长的针头。药物通常注射到上臂、大腿或臀部的肌肉中。药物被吸收到血流中的速度部分取决于肌肉的血液供应:血液供应越少,药物被吸收所需的时间就越长。对于静脉途径,将针直接插入静脉。含有药物的溶液可以单剂量施用或连续输注。对于输注,溶液通过重力(从可折叠的塑料袋)或更常见地通过输液泵通过细软管移动
到插入静脉(通常在前臂中)的管(导管)中。在一些情况下,细胞或治疗方案以输注施用。输注可在一段时间内进行。例如,输注可以是在约5分钟至约5小时的时间内施用细胞或治疗方案。输注可在约5min、10min、20min、30min、40min、50min、1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时、4.5小时或至多约5小时的时间段内进行。
[0159]
在一些实施方案中,静脉内施用用于在全身快速且以良好控制的方式递送精确剂量。它还用于刺激性溶液,如果通过皮下或肌内注射施用,会引起疼痛和损伤组织。静脉注射比皮下或肌内注射更难施用,因为将针头或导管插入静脉可能很困难,特别是如果该人肥胖。静脉施用时,药物会立即输送到血流中,并且比通过任何其他途径施用时起效更快。因此,医疗保健从业者密切监测接受静脉注射的人是否有药物起作用或引起不良副作用的迹象。此外,通过这种途径施用的药物效果往往持续更短的时间。因此,某些药物必须通过连续输注施用以保持其作用恒定。对于鞘内途径,针插入下脊柱中的两个椎骨之间并进入脊髓周围的空间。然后将药物注射到椎管中。通常使用少量局部麻醉剂来麻醉注射部位。当需要药物对大脑、脊髓或覆盖它们的组织层(脑膜)产生快速或局部作用时——例如,治疗这些结构的感染,使用这种途径。
[0160]
与本公开内容的细胞疗法结合使用的可吸入药物可以通过口腔施用,因为其被雾化成比通过鼻途径施用的那些更小的液滴。这样药物就可通过气管(导管)进入肺部。较小的液滴可会深入喉咙,从而增加吸收的药物量。在肺内,它们被吸收到血流中。应用于皮肤的药物通常用于其局部作用,因此最常用于治疗浅表性皮肤病,诸如牛皮癣、湿疹、皮肤感染(病毒、细菌和真菌)、瘙痒和皮肤干燥。该药物与非活性物质混合。根据非活性物质的稠度,制剂可以是软膏、乳膏、洗剂、溶液、粉末或凝胶。
[0161]
在一些情况下,治疗方案可以根据受试者的体重给药。对于确定为肥胖(bmi>35)的受试者,可需要使用实际体重。bmi计算为:bmi=体重(kg)/[身高(m)]2。男性的理想体重可以计算为50kg
2.3*(超过60英寸的英寸数)或女性的理想体重可以计算为45.5kg
2.3(超过60英寸的英寸数)。对于超过其理想体重的20%的受试者,可以计算调整后的体重。调整后的体重可以是理想体重 (0.4x(实际体重
‑
理想体重))的总和。在一些情况下,可以利用体表面积来计算剂量。体表面积(bsa)可以通过以下方式计算:bsa(m2)=√身高(cm)*体重(kg)/3600。
[0162]
在一些情况下,包含细胞疗法的药物组合物可以通过任何途径单独或与药学上可接受的载体或赋形剂一起施用,并且这种施用可以以单剂量和多剂量进行。更具体地,药物组合物可以与各种药学上可接受的惰性载体结合,形式为片剂、胶囊剂、锭剂、糖锭、糖果剂、粉剂、喷雾剂、水悬浮剂、注射剂、酏剂、糖浆剂等。此类载体包括固体稀释剂或填充剂、无菌水性介质和各种无毒有机溶剂等。此外,此类口服药物制剂可通过通常用于此类目的的各种类型的试剂适当地增甜和/或调味。
[0163]
在一些情况下,治疗方案可以与载体或赋形剂一起施用。示例性载体和赋形剂可包括右旋糖、氯化钠、蔗糖、乳糖、纤维素、木糖醇、山梨糖醇、麦芽糖醇、明胶、peg、pvp及其任何组合。在一些情况下,赋形剂诸如右旋糖或氯化钠的百分比可为约0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、10%、10.5%、11%、11.5%、12%、12.5%、13%、13.5%、14%、14.5%或至多约15%。
[0164]
本文描述了一种治疗接受者的疾病(例如,癌症)的方法,包括向接受者移植一种或多种包含工程化免疫细胞的细胞(包括器官和/或组织)。通过提供的方法制备的细胞可用于治疗癌症。在一些情况下,可以依次或同时与治疗方案或细胞施用确定疾病水平。靶标病变的疾病水平可以测量为完全反应(cr):所有靶标病变消失,部分反应(pr):以基线总和ld为参考,靶标病变的最长直径(ld)总和至少减少30%,进展(pd):以自治疗开始或出现一个或多个新病变以来记录的最小总ld为参考,靶标病变的ld总和至少增加20%,稳定疾病(sd):以最小的总和ld为参考,既不足以收缩来获得pr,也不足以增加来获得pd。在其他情况下,可以测量非靶标病变。非靶标病变的疾病水平可以是完全反应(cr):所有非靶标病变消失和肿瘤标志物水平正常化,非完全反应:一个或多个非靶标病变的持续存在,进展(pd):出现一个或多个新病变。现有非靶标病变的明确进展。在一些情况下,可以评估经历治疗方案和细胞施用的受试者的最佳总体反应。最佳总体反应可以是从治疗开始到疾病进展/复发记录的最佳反应(将自治疗开始以来记录的最小测量值作为进展性疾病的参考)。受试者的最佳响应分配可取决于测量和确认标准的实现。进展时间可以从随机化日期开始计算。一方面,响应可以指监测受试者的癌症负担或肿瘤负荷。一方面,与在施用经历离体扩增2周或更多周的可比群体(诸如c
‑
cart)的可比受试者中观察到的癌症负担相比,当所述受试者施用包含工程化免疫细胞的群体(诸如f
‑
cart)时,在受试者中观察到癌症负担降低。一方面,与施用经历离体扩增2周或更多周的可比群体(诸如c
‑
cart)的可比受试者相比,癌症负担在用包含工程化免疫细胞的群体(诸如f
‑
cart)治疗的受试者中降低至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。一方面,本文所述的受试者可以是哺乳动物。哺乳动物可以是人、狗、马、猪、小鼠、大鼠或猴。
[0165]
要获得pr或cr状态,必须通过重复研究确认肿瘤测量值的变化,这些研究应在首次满足响应标准后至少约4周进行。在sd的情况下,在进入研究后最少间隔6
‑
8周,随访测量必须至少满足一次sd标准。在一些情况下,从满足cr/pr测量标准的时间(以最先记录者为准)到客观记录复发性或进展疾病的第一个日期(将治疗开始以来记录的最小测量值作为进展疾病的参考),可以测量总体反应的持续时间。总体完全反应的持续时间可以从首次满足cr的测量标准的时间测量,直到客观记录复发疾病的第一个日期。可以从治疗开始到满足进展标准为止,可以测量稳定疾病,并以治疗开始以来记录的最小测量值作为参考。在一些情况下,可以使用尺子或卡尺以公制符号获取并记录可测量的疾病。所有基线评估都可以在尽可能接近治疗开始时进行。当病变是浅表的(例如,皮肤结节和可触及的淋巴结)并且使用卡尺直径超过至少约10mm时,可以认为病变是可测量的。在一些情况下,可以进行彩色摄影。
[0166]
在其他情况下,可以进行计算机断层扫描(ct)或磁共振成像(mri)。ct可以在厚度5mm或更薄的切片上进行。如果ct扫描的切片厚度大于5mm,则可测量病变的最小尺寸应为切片厚度的两倍。在一些情况下,可以使用fdg
‑
pet扫描。fdg
‑
pet可用于评估新病变。基线时fdg
‑
pet阴性,随访时fdg
‑
pet阳性是基于新病变的疾病进展(pd)的迹象。基线时无fdg
‑
pet且随访时fdg
‑
pet阳性:如果随访时fdg
‑
pet阳性对应于ct确认的新疾病部位,则为pd。如果随访时pdg
‑
pet阳性对应于ct上预先存在的疾病部位,根据解剖学图像可能没有进展,则这可能不是pd。在一些情况下,fdg
‑
pet可用于以类似于活检的方式增强对cr的反应,在这种情况下,残余放射学异常被认为代表纤维化或瘢痕形成。阳性fdg
‑
pet扫描病变是指
fdg avid的病变,在衰减校正图像上其摄取量大于周围组织的两倍。
[0167]
在一些情况下,可以对病变进行评估。完全反应(cr)可以是所有靶标病变的消失。任何病理淋巴结(靶标或非靶标)的短轴都可能减少到小于10mm。部分响应(pr)可以是靶标病变的直径总和至少减少30%,将基线直径总和作为参考。进行性疾病(pd)可以是靶标病变直径总和至少增加20%,以最小总和作为参考。除了20%的相对增加外,总和还必须证明绝对增加至少5mm。以直径的最小总和为参考,稳定的疾病(sd)既不能充分缩小pr的质量,也不能充分提高pd的质量。
[0168]
在一些情况下,可以评估非靶标病变。非靶标病变的完全反应可以是肿瘤标志物水平的消失和正常化。所有淋巴结的大小必须是非病理性的(短轴小于10mm)。如果肿瘤标志物最初高于正常上限,则它们必须正常化才能将患者视为完全临床反应。非cr/非pd是一种或多种非靶标病变的持续存在和/或肿瘤标志物水平维持在正常限度以上。进展性疾病可以是一个或多个新病变的出现和/或现有非靶标病变的明确进展。明确的进展通常不应超过靶标病变状态。在一些情况下,最佳总体反应可以是从治疗开始到疾病进展/复发记录的最佳反应。
[0169]
在一些情况下,用本文所述的治疗方案或细胞产品治疗的受试者可能经历与该方案或细胞产品相关的不良事件。不良事件可以是在与人类使用药物相关的治疗过程中发生的任何反应、副作用或不良事件,无论该事件是否被认为与治疗相关或具有临床意义。在一些情况下,不良事件可包括受试者报告的事件,以及体格检查或实验室评估的临床显著异常发现。新的疾病、症状、体征或临床上显著的实验室异常或先前存在的病症或异常的恶化可被视为不良事件。所有不良事件,包括实验室评估中的临床显著异常发现,无论严重程度如何,都将被跟踪,直到消退至2级或更低,但淋巴细胞减少和脱发除外。如果预期不良事件不会解决为2级或更低,则受试者可停止治疗。在一些情况下,治疗方案可以与毒性降低剂一起施用。毒性降低剂可以是发烧或呕吐减少剂。例如,可以施用美司钠(mesna)以减少毒性,诸如恶心、呕吐和腹泻。
[0170]
一方面,细胞群体可以在施用之前或与施用同时进行输注前测试。可以进行输注前或施用前测试,以确保工程化细胞产品具有功能性、无菌性,并且能够在输注后发挥作用。输注前测试可包括确定表型、细胞毒性、记忆/干性、耗竭、骨髓迁移、elisa及其任何组合。一方面,施用前测试可包括进行体外或体内测定。一方面,可以确定工程化细胞群体中的细胞毒性水平。例如,可以通过fac评估细胞群体中以下任一项的表达:cd3、cd4、cd8、cd45ro、ccr7、cd45ra、cd62l(l
‑
选择素)、cd27、cd28和il
‑
7rα、cd95、il
‑
2rβ、cxcr3和lfa
‑
1。一方面,功能测试还可包括共培养测定、细胞毒性测定、elisa(例如,定量白细胞介素
‑
2(il
‑
2)和/或ifn
‑
γ部分)或elispot测定。一方面,本文提供的群体的进一步特征在于,与经历离体扩增超过2周的可比群体或如下的可比群体的增殖、细胞毒性和/或骨髓迁移相比,在群体中观察到更大的增殖、细胞毒性和/或骨髓迁移:(a)没有用激活部分同时激活细胞群体和(b)引入编码car的多核苷酸。一方面,本文提供的群体的特征还在于,与经历离体扩增超过2周的可比群体或为(a)没有用激活部分同时激活细胞群体和(b)引入编码car的多核苷酸的可比群体相比,其包含更大的记忆和/或干性。一方面,增殖、记忆/干性、细胞毒性(杀伤能力)和/或bm迁移的水平可以比经历离体扩增超过2周的可比群体或为(a)没有用激活部分同时激活细胞群体和(b)引入编码car的多核苷酸的可比群体大10%、20%、30%、
gaggagcagg ctcctgcaca gtgactacat gaacatgact ccccgccgcc ccgggcccac ccgcaagcat taccagccct atgccccacc acgcgacttc gcagcctatc gctccagagt gaagttcagc aggagcgcag acgcccccgc gtaccagcag ggccagaacc agctctataa cgagctcaat ctaggacgaa gagaggagta cgatgttttg gacaagagac gtggccggga ccctgagatg gggggaaagc cgagaaggaa gaaccctcag gaaggcctgt acaatgaact gcagaaagat aagatggcgg aggcctacag tgagattggg atgaaaggcg agcgccggag gggcaagggg cacgatggcc tttaccaggg tctcagtaca gccaccaagg acacctacga cgcccttcac atgcaggccc tgccccctcg ctaa
[0185]
将编码car的核酸序列克隆到慢病毒载体fugw中,质粒命名为gcp042.293。用质粒gcp042和其他包装质粒(辅助质粒)同时转染t细胞。简而言之,将2
×
106个293t细胞以1.3
×
104个细胞/cm2的密度接种在150cm2的培养皿中的10%fbs的dmem培养基中。然后在转染前将细胞在37℃,5%co2和饱和湿度下培养3天。
[0186]
将18μg辅助质粒和24μg gcp042加入含有3ml dmem培养基的离心管中,然后向管中加入126mg pei得到混合物。将混合物在室温下静置30分钟,然后补充12ml含有2%feb的dmem以获得转染培养基。对于转染,去除培养基后,将293t细胞与转染培养基一起温育4小时,然后将转染培养基替换为含有2%fbs的20ml dmem培养基。72小时后,收集培养基并在3000g、4℃下离心10min。然后用0.45μm过滤器过滤上清液以进一步纯化。滤液进一步在27000g、4℃下离心2小时。收集沉淀物并用100μl预冷的pbs重悬以获得gcl042慢病毒悬浮液,并在4℃下保持过夜。第二天,将病毒悬浮液等分以供进一步使用。
[0187]
实施例2:f
‑
cart细胞的制备
[0188]
为了制备f
‑
cart细胞,从健康供体中收集了100ml外周血。通过以500
‑
600g密度梯度离心20
‑
30分钟来分离pbmc。结合cd28抗体和cd3抗体(cd3/cd28 dynabeads,购自thermofisher)的磁珠用于分选和富集t细胞。然后用如实施例1中制备的gcl042在x
‑
vivo15培养基中在37℃下以0.1
×
106个细胞/ml至10
×
106个细胞/ml之间的细胞密度转染t细胞。转染后,无需进一步扩增,即可获得本发明的car
‑
t细胞(本文也称为f
‑
cart或f
‑
car
‑
t细胞)。在该过程中,细胞在转染前没有被激活,这些细胞在本公开内容中也被称为f
‑
cart
‑
fv1细胞。
[0189]
类似地,从健康供体采集约100ml外周血,通过密度梯度离心机以500
‑
600g离心20
‑
30分钟分离pbmc。结合cd28抗体和cd3抗体(cd3/cd28 dynabeads,购自thermofisher)的磁珠用于分选和富集t细胞。进一步将t细胞与cd3/cd28 dynabeads以0.1:1至5:1(cd3/cd28 dynabeads:t细胞)的比例以及300iu/ml il2一起温育以激活细胞。同时或随后,在37℃下以0.1
‑
10
×
106个细胞/ml的细胞密度用gcl042转染t细胞4小时,然后用盐水缓冲液洗涤。无需进一步扩增,即可获得本公开内容的f
‑
cart细胞。在该过程中,细胞被激活,这些细胞在本公开内容中也被称为f
‑
cart
‑
fv2细胞。
[0190]
表1总结了f
‑
cart
‑
fv1细胞对f
‑
cart
‑
fv2细胞的制备过程
[0191]
表1f
‑
cart
‑
fv1和f
‑
cart
‑
fv2细胞的制备过程
[0192]
实施例3:慢病毒的moi和car阳性细胞的比例
[0193]
随后比较了采用fv1制备工艺和fv2制备工艺的car阳性细胞比例。简而言之,从健康供体采集约100ml外周血,通过密度梯度离心机以500
‑
600g离心20
‑
30分钟分离pbmc。然后使用cd3/cd28dynabeads以分选和富集t细胞。
[0194]
将1
×
107个分选的t细胞分成两组,分别如实施例2所述制备f
‑
cart
‑
fv1和f
‑
cart
‑
fv2细胞。gcl042用于转染t细胞,细胞密度为2
×
106个细胞/ml,moi在3到4之间。特别地,所用病毒的量计算为:病毒数=细胞数xmoi/病毒滴度。然后将计算出的病毒与t细胞温育16
‑
24小时以感染t细胞。转染后,通过离心去除病毒,然后收集细胞并再培养3
‑
5天。收集每组0.5
×
106‑
1.0
×
106个细胞并进行流式细胞术以进行car阳性率分析。结果如表2所示。
[0195]
表2不同制备工艺的car阳性率制剂moi阳性率(%)f
‑
cart
‑
fv13.26.2%f
‑
cart
‑
fv23.033.1%
[0196]
从表2可以看出,f
‑
cart
‑
fv2制剂的car阳性率高于f
‑
cart
‑
fv1制剂。随后,利用f
‑
cart
‑
fv2细胞研究moi与car阳性率的对应性,结果如图1所示。从图1可以看出,使用0.8和1.6的moi时,car阳性率分别为31.0%和39.8%,表明在此阶段阳性率还受到除moi以外的其他因素的影响;使用1.6、3.2的moi时,car阳性率分别为39.8%和57.2%,表明随着病毒量的增加,阳性率呈现近1.5倍的变化,且阳性率与该阶段病毒用量基本相关;使用3.2、6.4、12.8的moi时,car阳性率分别为57.2%、64.6%和69.3%,说明阳性率并未随病毒量的增加而显著增加,病毒感染已在此阶段进入平台。该结果表明制备本公开内容的f
‑
cart,尤其是f
‑
cart
‑
fv2的优选moi在1.6
‑
6.4之间,这样可以更有效、稳定地控制f
‑
cart的阳性率。
[0197]
实施例4:c
‑
cart细胞的制备
[0198]
对照细胞(也称为第二参考细胞、c
‑
cart或c
‑
car
‑
t细胞)根据kochenderfer、j.n等人,(2013),“donor
‑
derived cd19
‑
targeted tcells cause regression of malignancy persisting after allogeneic hematopoietic stem cell transplantation”blood 122(25):4129
‑
4139描述的方法制备。
[0199]
简而言之,从健康供体采集约100ml外周血,通过密度梯度离心机以500
‑
600g离心20
‑
30分钟分离pbmc。使用cd3/cd28 dynabeads以分选和富集t细胞。然后进一步将t细胞与cd3/cd28 dynabeads以0.1:1至5:1的比例(cd3/cd28 dynabeads:t细胞)以及300iu/ml il2一起温育以激活细胞。同时或随后,在37℃下以0.1
‑
10
×
106个细胞/ml的细胞密度用gcl042转染t细胞4小时,然后用盐水缓冲液洗涤。激活和转染后,将修饰细胞培养8天进行扩增,得到对照细胞(也称为第二参考细胞,c
‑
cart或c
‑
car
‑
t细胞)。
[0200]
实施例5:f
‑
cart细胞对c
‑
cart细胞的阳性率
[0201]
比较了在存在和不存在cd19
肿瘤细胞刺激的情况下,从冷冻保存中恢复后,在f
‑
cart(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞中进行体外培养期间car阳性细胞(car
)比率的变化。结果如图2所示。从图2可以看出,对于恢复的f
‑
cart细胞,car 比例随着培养时间的延长而下降,加入肿瘤抗原后,car 比例再次上升(图2中实线代表未加入肿瘤抗原组,虚线代表肿瘤抗原组),表明car 细胞可以通过肿瘤抗原刺激富集,编码car的多核苷酸稳定整合到t细胞基因组中。图2还显示,在肿瘤抗原刺激之前,在起始点,f
‑
cart细胞中的car 比例远高于c
‑
cart细胞,并且从第16天开始,c
‑
cart细胞中的car 比例显著下降,但f
‑
cart中的car 比例仍呈现小幅上升。在肿瘤抗原刺激后,f
‑
cart和c
‑
cart细胞均显示出显著增加的car 比率。
[0202]
实施例6:淋巴细胞亚群分析
[0203]
通过常规流式细胞术分析起始材料(没有病毒转染的相应t细胞)和f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)中的淋巴细胞亚群(参见garcia rl等人,analysis of proliferative grade using anti
‑
pcna/cyclin monoclonal antibodies in fixed,embedded tissues.comparison with flow cytometric analysis.the american journal of pathology,1989,134(4):733)。
[0204]
通过流式细胞术分别使用2
‑3×
106个起始t细胞和f
‑
cart细胞分析包括cd3、cd4、cd8、cd45ro和cd62l的标志物的表达。结果如表3和图3所示。
[0205]
表3淋巴细胞亚群 cd3
cd4
/cd8
‑
cd8
/cd4
‑
temtcmt
n
起始材料74.5%38.1%45.2%23.0%21.5%32.7%f
‑
cart99.9%43.2%45.4%45.9%23.5%15.3%
[0206]
在表3中,tem代表具有cd45ro
/cd62l
‑
的效应t细胞;tcm代表具有cd45ro
/cd62l
的中央记忆t细胞;t
n
代表具有cd45ro
‑
/cd62l
的初始(或幼稚的)t细胞,具有很大的分化潜力,能够分化为细胞亚群,诸如tem和tcm。
[0207]
结果表明,f
‑
cart中cd3
t细胞的比例远高于起始材料,表明有效的t细胞的分选和富集。f
‑
cart中cd4
t和cd8
t细胞的比例与起始材料的比例基本相同。与起始材料相比,f
‑
cart中淋巴细胞亚群的比例发生了变化,其中f
‑
cart中tcm和tem的比例增加,而t
n
的比例降低。这可能是由于t细胞激活后原始t
n
群体的分化。这些结果表明,本技术的f
‑
cart制备工艺可用于制备具有分化潜能的激活t细胞。
[0208]
实施例7:car
‑
t细胞的体外扩增
[0209]
f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞在第0、2、5、8、11、13天检测细胞活力和活细胞数,以比较f
‑
cart(诸如f
‑
cart
‑
fv2)和c
‑
cart制剂的体外增殖。
[0210]
简而言之,将含有300iu/ml il
‑
2的x
‑
vivo15培养基在37℃水浴中预热。f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞在37℃水浴中解冻2
‑
3分钟,然后转移到预热的培养基中,混合均匀,测量细胞悬浮液的总体积。用nc
‑
200计数器计算300μl的f
‑
cart和c
‑
cart细胞悬浮液中的细胞活力和细胞密度,然后根据体积计算细胞数。然后将两组细胞以250
‑
300g离心8
‑
10min。除去上清液,用适量培养基重悬细胞至0.5
×
106个细胞/ml至1.0
×
106个细胞/ml的密度,接种于板,37℃,5%co2下培养。在第0、2、5、8、11和13天计算细胞活力
和活细胞数,以比较f
‑
cart细胞对c
‑
cart细胞的增殖。在此过程中,细胞密度保持在0.5
×
106个细胞/ml和1.0
×
106个细胞/ml之间。
[0211]
进一步比较两组在肿瘤抗原刺激下的增殖情况。简而言之,表达cd19的初级肿瘤细胞(来自b
‑
all肿瘤患者)从第0天起与f
‑
cart细胞和c
‑
cart细胞共培养。在第2、5、8、11和13天计算细胞活力和活细胞数,在此过程中,细胞密度保持在0.5
×
106个细胞/ml和1.0
×
106个细胞/ml之间。结果如表4、图4a和图4b所示。
[0212]
表4 car
‑
t细胞增殖倍数
[0213]
结果表明,无论有无肿瘤细胞刺激,f
‑
cart细胞的增殖能力均显著强于c
‑
cart细胞,表明f
‑
cart细胞具有优越的扩增能力。
[0214]
实施例8:car
‑
t的体外肿瘤杀伤功效
[0215]
为了比较f
‑
cart(诸如f
‑
cart
‑
fv2)和c
‑
cart制剂的体外肿瘤杀伤功效,将f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞解冻并培养在含10%(v/v)ab血清和300iu/ml il
‑
2的x
‑
vivo15培养基中,第2天检测肿瘤杀伤效果。
[0216]
简而言之,将含有10%(v/v)ab血清和300iu/ml il
‑
2的x
‑
vivo15培养基在37℃水浴中预热。制备的f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞在37℃水浴中解冻2
‑
3分钟,然后转移到预热的培养基中,混合均匀,测量细胞悬浮液的总体积。用nc
‑
200计数器计算300μl的f
‑
cart和c
‑
cart细胞悬浮液中的细胞活力和细胞密度,然后根据体积计算细胞数。然后将两组细胞以250
‑
300g离心8
‑
10min。除去上清液,用适量含10%(v/v)ab血清和300iu/ml il
‑
2的x
‑
vivo15培养基重悬细胞至0.5
×
106个细胞/ml
‑
1.0
×
106个细胞/ml的密度,接种于板,37℃,5%co2下培养。
[0217]
第2天,每组0.5
×
106‑
1.0
×
106个细胞进行car 比率分析。作为靶细胞,p2
‑
p10下的hela
‑
cd19、hela和hek293t细胞用10ml dpbs洗涤,用5
‑
10ml 0.25%胰蛋白酶在37℃消化1
‑
3min,然后用5
‑
10ml完全培养基(含10%fbs)中和并反复移液以形成单细胞悬浮液。随后,将三组靶细胞以300g离心5min。去除上清液,并用含有10%fbs的rpmi 1640完全培养基重悬细胞。计数细胞数,三组细胞活力均≥85%。然后将细胞密度调整为1
×
105个细胞/ml。
[0218]
检测程序按照xcellligence的说明建立。特别地,将每组靶细胞加入e
‑
plate view 96孔板中,在培养箱中静置30min,然后检查细胞的附着情况。当xcellligence检测到
的hela
‑
cd19细胞的细胞指数(cell
‑
index)≥2时,根据以上分析的car 比率,收集所需数量的car 细胞,以300g离心5min。去除上清液,将细胞重悬在rpmi 1640完全培养基中至合适的密度。从xcelligence检测中去除e
‑
plate view 96板并弃去上清液。根据car
‑
t细胞与靶细胞所需的比例,将car
‑
t细胞添加到板的每个孔中。然后对e
‑
plate view 96板进行细胞杀伤检测24
‑
48小时。
[0219]
收集并绘制数据,如表5和图5所示,其中靶细胞的半数杀伤时间计算为具有最大细胞指数(cimax)的时间点减去具有最大细胞指数一半(cimax/2)的时间点。
[0220]
图5中,1为hela
‑
cd19,2为nt hela
‑
cd19(5:1),3为c
‑
cart hela
‑
cd19(1:1),4为f
‑
cart hela
‑
cd19(1:1)、5为c
‑
cart hela
‑
cd19(5:1),6为f
‑
cart hela
‑
cd19(5:1)。a为起点,时间为7.90小时,细胞指数为1.02;b为f
‑
cart hela
‑
cd19(5:1),时间为8.91小时,细胞指数为0.51;c为c
‑
cart hela
‑
cd19(5:1),时间为15.23小时,细胞指数为0.51;d为f
‑
cart hela
‑
cd19(1:1),时间为16.77小时,细胞指数为0.51;e为c
‑
cart hela
‑
cd19(1:1),时间为51.23小时,细胞指数为0.52。
[0221]
表5半数杀伤时间概览半数杀伤时间(h)cart hela
‑
cd19(1:1)cart hela
‑
cd19(5:1)f
‑
cart8.87h1.01hc
‑
cart43.33h7.33h
[0222]
结果表明,在效应细胞:靶细胞为5:1和1:1的两个模型中,f
‑
cart的半数杀伤时间比c
‑
cart短,说明f
‑
cart对于肿瘤细胞的杀伤效果显著强于c
‑
cart。使用hela细胞和hek293t细胞也观察到类似的结果。
[0223]
实施例9:car
‑
t对肿瘤抗原刺激的反应
[0224]
比较f
‑
cart(诸如f
‑
cart
‑
fv2)和c
‑
cart制剂释放的细胞因子以评估对肿瘤抗原刺激的反应,其中f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞在第2天经历细胞因子检测,使用实施例2中所述的未转染的t细胞(起始材料)作为对照。
[0225]
简而言之,培养基在37℃水浴中预热。f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞在37℃水浴中解冻2
‑
3分钟,然后转移到预热的培养基中,混合均匀,测量细胞悬浮液的总体积。用nc
‑
200计数器计算300μl的f
‑
cart和c
‑
cart细胞悬浮液中的细胞活力和细胞密度,并根据体积计算细胞数。然后将细胞以250
‑
300g离心8
‑
10min。除去上清液,用适量培养基重悬细胞至0.5
×
106个细胞/ml至1.0
×
106个细胞/ml的密度,接种于板,并在37℃,5%co2下培养。第2天,吸取细胞并充分混合,然后每组0.3
×
106‑
1.0
×
106个细胞进行car
比率分析。根据car
比率,收集适量细胞,以300g离心5min,然后去除上清液,用rpmi 1640完全培养基重悬细胞至1
×
106个细胞/ml的密度。
[0226]
molt4细胞(无肿瘤抗原刺激)和raji细胞(有肿瘤抗原刺激)分别用作阴性靶标和阳性靶标。首先对0.3
‑
0.5ml靶细胞悬浮液进行细胞数和活力计算。然后将两组靶细胞以300g进一步离心5min。去除上清液,用rpmi 1640完全培养基重悬细胞至1
×
106个细胞/ml的密度。
[0227]
随后,将100μl的效应细胞(对照t细胞、f
‑
cart细胞和c
‑
cart细胞)和靶细胞(molt 4细胞或raji细胞)以1:1的比例加入96孔板的每个孔中,在37℃,5%co2下共同温育18
‑
24小时。温育后,将细胞以300g离心5min。收集100
‑
150μl上清液并转移到新的96孔板中,通过
elisa检测细胞因子(包括gm
‑
csf、il
‑
2、tnf
‑
α和ifn
‑
γ)的释放,如图6所示。
[0228]
从图6可以看出,f
‑
cart和c
‑
cart之间释放的gm
‑
csf水平没有显著差异。il
‑
2是激活的t细胞释放的因子,f
‑
cart释放的il
‑
2水平显著高于c
‑
cart,说明f
‑
cart在肿瘤抗原刺激下具有强激活作用。tnf
‑
α和ifn
‑
γ水平均表明t细胞对靶细胞的直接杀伤作用,并且这两个因子在f
‑
cart中的水平显著高于在c
‑
cart中的水平,表明f
‑
cart的杀伤活性优于c
‑
cart。
[0229]
实施例10:体内肿瘤杀伤功效
[0230]
采用cd19
raji b恶性细胞系建立免疫缺陷小鼠(ndg小鼠)cdx模型(同种异体移植瘤模型)。简而言之,将raji
‑
luc细胞悬浮在pbs中至5
×
105个细胞/0.2ml的密度,并通过尾静脉将0.2ml细胞注射到每只b
‑
ndg(b
‑
nsg)小鼠中。从注射的第0天起,对小鼠进行成像以观察肿瘤的生长。当小鼠图像的平均信号达到5
×
106p/s时,选取信号中等的小鼠,随机分成不同的组,每组3只小鼠。同日,小鼠尾静脉注射f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)、c
‑
cart细胞、未转染t细胞(起始材料)及仅用细胞冷冻保存溶液的空白。注射后,通过成像每周两次观察每只动物的肿瘤生长,结果如图7a和7b所示。从结果可以看出,f
‑
cart对小鼠的肿瘤显示出显著更强的抑制作用,最终消除了肿瘤。如图7b所示,使用5
×
105(5e5)剂量时,c
‑
cart表现出一定的肿瘤抑制作用,但不能消除肿瘤,同时f
‑
cart完全消除了肿瘤,提供了较强的抗肿瘤功效。
[0231]
实施例11:体内毒性
[0232]
以2
×
106(2e6)的剂量施用实施例10的f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)、c
‑
cart细胞、未转染t细胞(起始材料)和空白之前和之后,测量小鼠的体重。比较施用前后动物体重的变化,如图8所示。从图8中可以看出,体重变化(%)代表施用后体重占原体重的百分比,计算为体重变化(%)=施用后体重/原体重
×
100%。
[0233]
结果表明,与空白组和起始材料组相比,f
‑
cart组和c
‑
cart组动物的体重没有出现显著变化,而f
‑
cart组动物的体重似乎更稳定,表明该制剂的非明显毒性。
[0234]
实施例12:体内剂量依赖性肿瘤抑制
[0235]
将高(2
×
106个细胞/0.2ml)、中等(5
×
105个细胞/0.2ml)和低(5
×
104个细胞/0.2ml)剂量的f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和空白如实施例10中所建立的方法施用于小鼠以观察肿瘤大小的变化。结果如图9所示。从图9中可以看出,f
‑
cart细胞对肿瘤的抑制是剂量依赖性的,肿瘤的大小随着施用剂量的增加而减小。
[0236]
实施例13:car
‑
t细胞的体内增殖
[0237]
将高(2
×
106个细胞/0.2ml)、中等(5
×
105个细胞/0.2ml)和低(5
×
104个细胞/0.2ml)剂量的f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和空白如实施例10中建立的方法施用于小鼠,然后收集小鼠的外周血以通过流式细胞术分析car
‑
t细胞的扩增(参见garcia r l等人,analysis of proliferative grade using anti
‑
pcna/cyclin monoclonal antibodies in fixed,embedded tissues.comparison with flow cytometric analysis.the american journal of pathology,1989,134(4):733)。结果如图10所示。
[0238]
从图10可以看出,f
‑
cart细胞在施用后28天,尤其是在14至21天之间显示出快速扩增。f
‑
cart细胞的扩增能力是剂量依赖性的,并随着施用剂量的增加而增加。
[0239]
实施例14:f
‑
cart细胞对c
‑
cart细胞的亚群
[0240]
对t细胞状态以及耗竭进行了评估,以比较f
‑
cart(诸如f
‑
cart
‑
fv2)和c
‑
cart制剂的亚群。通过流式细胞术分析f
‑
cart细胞(诸如f
‑
cart
‑
fv2细胞)和c
‑
cart细胞的亚群(参见garcia rl等人,analysis of proliferative grade using anti
‑
pcna/cyclin monoclonal antibodies in fixed,embedded tissues.comparison with flow cytometric analysis.the american journal of pathology,1989,134(4):733)。
[0241]
简而言之,从三个健康供体收集细胞,并如实施例2和4中所述制备f
‑
cart细胞和c
‑
cart细胞。然后将每组制备的1
×
106个细胞与辐射的k562
‑
cd19细胞以1:1的比例分别共培养10天。在培养过程中,每3天补充一次辐射的k562
‑
cd19细胞,以保持1:1的比例。在第6天和第10天,通过流式细胞术分析f
‑
cart和c
‑
cart细胞表面上pd1和lag3的表达。结果如图11a和图11b所示。从图11a和图11b可以看出,f
‑
cart组中pd1
lag3
细胞的比例在第6天和第10天均显著低于c
‑
cart,说明f
‑
cart组受抑制或耗竭的细胞较少。
[0242]
类似的,从三个健康供体收集细胞,并如实施例2和4中所述制备f
‑
cart细胞和c
‑
cart细胞。然后将每组制备的1
×
106个细胞与辐射的k562
‑
cd19细胞以1:1的比例分别共培养10天。在培养过程中,每3天补充一次辐射的k562
‑
cd19细胞,以保持1:1的比例。然后通过流式细胞术分析f
‑
cart和c
‑
cart细胞表面上cd62l和cd45ro的表达,以评估细胞的分化状态。结果如表6和图12所示。
[0243]
表6 f
‑
cart对c
‑
cart的亚群 f
‑
cart(平均值
±
sd)c
‑
cart(平均值
±
sd)tscm6.42
±
3.64*0.39
±
0.13tcm73.47
±
2.85*58.03
±
8.34tem18.8
±
1.77**41.06
±
8.47teff1.28
±
0.26*0.48
±
0.16
[0244]
*p<0.05,**p<0.01
[0245]
从结果可以看出,f
‑
cart组tscm和tcm细胞的比例高于c
‑
cart组,tem细胞比例低于c
‑
cart组,表明f
‑
cart细胞分化程度较低,状态较年轻,以及增殖和分化潜能较强。
[0246]
实施例15:f
‑
cart细胞制剂的安全性和临床疗效
[0247]
将f
‑
cart细胞施用于人类患者xf001,以研究该制剂的安全性和有效性。患者xf001,女,39岁,身高150cm,体重70kg,确诊慢性粒细胞白血病(cml)15年。在f
‑
cart治疗前4个月,发现并诊断出患者患有b细胞急性淋巴细胞白血病(b
‑
all)和中枢神经系统白血病。该患者在bcr
‑
abl中还具有耐药性突变t315i/v299l。各种化疗治疗效果不佳,患者也对酪氨酸激酶抑制剂产生耐药性,对常规化疗无反应。
[0248]
从患者采集白细胞,按照实施例2的方法制备来自患者的含有cd19
‑
car的f
‑
cart细胞。从单采血液成分法到细胞输注间隔仅10天,f
‑
cart细胞的制备过程仅24小时。患者先进行为期3天的fc化疗预处理(第1
‑
3天,每日施用氟达拉滨50mg和环磷酰胺300mg),然后以4.2x106个细胞数(约6x104个细胞/kg体重)向患者输注f
‑
cart制剂。
[0249]
如图13b所示,第8天患者体温正常,输注f
‑
cart细胞后第10天至第13天出现诸如发热、感染等症状,判断症状为一级细胞因子释放综合征(一级crs)。然后对患者进行退热治疗,并用美罗培南治疗感染。第16天,患者体温恢复正常(如图13b所示)。
[0250]
如图13a所示,输注f
‑
cart后1
‑
7天,流式细胞术结果显示外周血中出现极少cd19
b细胞,且pcr未检测到编码car的核酸分子拷贝数(car拷贝数)。输注f
‑
cart后8
‑
28天,外周血中未检测到cd19
b细胞。f
‑
cart输注后第13天,car拷贝数达到峰值(4670.2个拷贝数/μg dna),第28天,拷贝数回落至15.4个拷贝数/μg dna。在第56天,拷贝数减少到0。流式细胞术分析car
‑
t的结果(car
细胞数量的变化)与car拷贝数的结果一致。
[0251]
输注f
‑
cart后第18天,骨穿刺获得的样品分析显示原生动物淋巴细胞占0.5%,形态正常;粒细胞增殖活跃;最小残留病变(mrd)被评估为cml,表明患者的b
‑
all mrd被清除。因此,该患者被诊断为慢性期cml(cp
‑
cml)。患者在输注f
‑
cart 40天后接受了其子的hla7/12半相容造血干细胞移植(hsct),并显示白细胞重建,移植20天后出院。患者免疫反应相关因素(诸如il
‑
6和c反应蛋白crp)的变化如图13c和图13d所示。
[0252]
从以上结果可以发现,给患者施用低剂量的f
‑
cart细胞后,b
‑
all的mrd被成功消除,没有引起严重的crs和神经毒性。
[0253]
基于快速制备,本技术的f
‑
cart的输注比常规的cd19 car
‑
t(c
‑
cart)至少加快了7
‑
10天,表明f
‑
cart在治疗时间上的优势。此外,与常规cd19 car
‑
t(c
‑
cart)相比,使用f
‑
cart制剂时,患者内的car
比率和car拷贝数峰值出现在较晚的时间点。
[0254]
实施例16:f
‑
cart细胞制剂的安全性和临床疗效
[0255]
将f
‑
cart细胞施用于人类患者f01,以研究该制剂的安全性和有效性。入组后,从患者中分离pbmc,并根据实施例2中描述的方法制备来自患者的含有cd19
‑
car的f
‑
cart细胞。患者先接受3天的化疗预处理(氟达拉滨50mg
×
3天 环磷酰胺0.4g
×
3天 阿糖胞苷0.5g
×
4天),然后将制备好的f
‑
cart细胞以约1.07x105个细胞/kg体重的剂量输注给患者。
[0256]
如图14a所示,输注f
‑
cart后第10天,患者出现发热,且体温高达39.4℃。治疗后发热有所缓解。未发现缺氧或低血压症状、crs表现或神经毒性。患者未接受托珠单抗或任何其他激素药物治疗。crs被评为一级。此外,还测定了患者外周血中包括crp、il
‑
6、il
‑
10、inf
‑
γ和scd25的细胞因子的变化,如图14c所示。与基线相比,在输注f
‑
cart后第21天,il
‑
6的分泌增加。其他细胞因子没有显示出显著变化。
[0257]
如图14b所示,在输注后第7天至第14天,在外周血(pb)中观察到f
‑
cart细胞的显著增殖。输注后第7天,外周血中car拷贝数(qpcr)和f
‑
cart细胞数(facs)分别为195,297拷贝/μg dna和27.5个细胞/μl;输注后第10天,外周血中car拷贝数(qpcr)和f
‑
cart细胞数(facs)分别为106822拷贝数/μg dna和20个细胞/μl;输注后第14天,外周血中car拷贝数(qpcr)和f
‑
cart细胞数(facs)分别为162464拷贝数/μg dna和26.5个细胞/μl。第21天增殖显著减少,输注后第28天仍可检测到f
‑
cart细胞。输注后第14天和第28天,检测到骨髓(bm)car拷贝数分别为26429拷贝数/μg dna和68135.6拷贝数/μg dna,qpcr未检测到car扩增。此外,在输注f
‑
cart细胞后第14天和第28天,患者外周血中未检出异常b细胞,流式细胞术骨髓样品未见异常细胞或肿瘤。
[0258]
可见,给患者施用小剂量的f
‑
cart细胞是安全的,在体内杀灭肿瘤细胞是有效的。
[0259]
实施例17:f
‑
cart细胞制剂的临床疗效
[0260]
将f
‑
cart细胞制剂施用于人类患者df06、gf001、xf002、tf003、tf002、df04、df01、xf001和tf001,这些患者分别被诊断为复发或难治性b
‑
all患者。
[0261]
从患者收集白细胞,并根据实施例2中描述的方法制备来自每个患者的含有cd19
‑
car的f
‑
cart细胞。从单采血液成分法到细胞输注间隔仅10天,f
‑
cart细胞的制备过程仅24
小时。在治疗过程中,将制备的f
‑
cart细胞以约104至107(约103个细胞/kg体重至约106个细胞/kg体重)的剂量输注给每个患者。结果如图15所示。
[0262]
治疗中,患者tf002在输注f
‑
cart后第10天退出研究。5名患者(tf001、xf001、df01、df04和xf002)达到完全缓解(cr),其中4名(xf001、df01、df04和xf002)达到微小残留病变(mrd
‑
)。这些结果证明了f
‑
cart细胞制剂在肿瘤治疗中的有效性。
[0263]
此外,9名患者中有8名发展crs(细胞因子释放综合征)(tf002患者除外),只有2名患者(tf001和xf002)发展3级或更高级别的crs,以及1级神经毒性(nt)。8名患者的crs发生在输注后第3天和第10天之间。这些结果表明f
‑
cart细胞制剂是相对安全的。
[0264]
实施例18:f
‑
cart对c
‑
cart的表型分析
[0265]
通过常规流式细胞术分析c
‑
cart和f
‑
cart细胞的淋巴细胞亚群。分别使用2
‑3×
106个起始c
‑
cart细胞和f
‑
cart细胞通过流式细胞术分析标志物cd3、cd4、cd8、cd45ro和cd62l的表达。结果如表7和图16a、图16b和图16c所示。
[0266]
表7 c
‑
cart对f
‑
cart
[0267]
在表7中,tem代表具有cd45ro
/cd62l
‑
的效应t细胞;tcm代表具有cd45ro
/cd62l
的中央记忆t细胞;t
n
代表具有cd45ro
‑
/cd62l
的初始(或幼稚的)t细胞,具有很大的分化潜力,能够分化为细胞亚群,诸如tem和tcm。
[0268]
结果表明,tscm和tcm的比例在fast car
‑
t群体中更为丰富。在fast car
‑
t细胞中观察到的cd45ro /cd62l (tcm)比cd45ro /cd62l
‑
(tem)多(增加4倍)。此外,观察到f
‑
cart中的cd45ro
‑
/cd62l (tscm)比在c
‑
cart中多(增加31倍)。这些结果表明,本技术的f
‑
cart制备工艺可用于制备具有分化潜能和具有非耗竭表型的“年轻”表型的激活t细胞。
[0269]
实施例19:f
‑
car
‑
t对c
‑
car
‑
t细胞的体外扩增、表型和细胞毒性
[0270]
在第8、12和18天定量f
‑
cart细胞和c
‑
cart细胞中的倍数扩增,以比较两种方法的体外增殖。
[0271]
还通过常规流式细胞术分析c
‑
cart和f
‑
cart细胞的亚群。分别使用2
‑3×
106个起始c
‑
cart细胞和f
‑
cart细胞通过流式细胞术分析标志物cd3、cd4、cd8、pd
‑
1和lag3的表达。
[0272]
使用实时细胞分析仪(rtca)测定比较f
‑
cart和c
‑
cart的细胞毒性。rtca是一种使用实时细胞监测来检测细胞在直接和间接共培养过程中的迁移、细胞毒性和粘附/增殖的技术。简而言之,建立了用cd19
肿瘤细胞培养的c
‑
cart、用cd19
肿瘤细胞培养的f
‑
cart、用cd19
肿瘤细胞培养的非转导细胞和仅肿瘤细胞(hela
‑
cd19)的共培养。通过将50μl相同培养基添加到e
‑
16板中,从孔中进行背景测量。随后,rtca软件包1.2用于校准板。将细胞以20,000个/孔的密度平板接种在新鲜培养基中至最终体积为200μl。在启动软件进度之前,
将细胞在rtca支架中在37℃和5%co2下温育4min。前25次扫描(2h)每5min记录一次阻抗信号,实验结束前(40小时)每10min记录一次阻抗信号。在阻抗读数20h后,从每个孔中取出140μl培养基并替换为适当体积的条件培养基(cm)。
[0273]
使用来自rtca测定的培养基评估il
‑
2和ifnγ的细胞因子分泌。简而言之,从共培养测定中收集100ul培养基并通过elisa进行评估。
[0274]
结果如图17a、图17b、图17c、图17d和图18所示。结果表明,与常规制造的car
‑
t相比,pd1 lag3 car
‑
t细胞的百分比显著降低。结果还表明,与c
‑
cart相比,f
‑
cart表现出cd19特异性杀伤、肿瘤特异性细胞因子分泌和相似的杀伤能力。
[0275]
实施例21:f
‑
cart对c
‑
cart受试者样品的体外分析
[0276]
使用f
‑
cart方法和表8中用于受试者的常规方法制备cart细胞。
[0277]
表8:患者样品概要
[0278]
细胞扩增
[0279]
从患者中收集白细胞,并根据实施例2中描述的方法制备来自表达cd19
‑
car的每个受试者的f
‑
cart和c
‑
cart细胞。从单采血液成分法到细胞输注间隔仅10天,f
‑
cart细胞的制备过程仅24小时。
[0280]
比较f
‑
cart和c
‑
cart在肿瘤抗原刺激下的扩增。简而言之,表达cd19的初级肿瘤细胞(来自b
‑
all肿瘤患者)从第0天起与f
‑
cart细胞和c
‑
cart细胞共培养。在第9、13和17天计算细胞活力和活细胞数。在此过程中,细胞密度保持在0.5
×
106个细胞/ml和1.0
×
106个细胞/ml之间。结果如图19a所示。结果表明,与常规制造的car
‑
t(c
‑
cart)相比,fast car
‑
t(f
‑
cart)的增殖能力显著更好。
[0281]
表型
[0282]
通过常规流式细胞术分析来自受试者gc007f的c
‑
cart和f
‑
cart细胞的淋巴细胞亚群。分别使用2
‑3×
106个起始c
‑
cart细胞和f
‑
cart细胞通过流式细胞术分析标志物cd3、cd4、cd8、cd45ro和cd62l的表达。结果如图19b、图19c、图19d和表9所示。结果表明,与c
‑
cart相比,tcm在fast car
‑
t群体中更丰富。
[0283]
表9:gc007f的细胞表型
[0284]
此外,还使用流式细胞术测定细胞耗竭。通过常规流式细胞术分析来自受试者gc007f的c
‑
cart和f
‑
cart细胞的淋巴细胞亚群。通过流式细胞术在car阳性细胞中分析标志物cd3、cd8、pd
‑
1和lag3的表达。结果如图19e所示。结果表明,与常规制造的car
‑
t相比,pd1 lag3 car
‑
t细胞的百分比显著更低。
[0285]
细胞毒性rtca和elisa
[0286]
使用先前描述在实施例17中的实时细胞分析仪(rtca)测定法,使用1:1的效应子与靶标比,比较受试者的gc007f f
‑
cart和c
‑
cart的细胞毒性。结果如图20a所示。
[0287]
使用来自rtca测定的培养基评估il
‑
2和ifnγ的细胞因子分泌。简而言之,从共培养测定中收集100ul培养基并通过elisa进行评估。结果如图20b所示。结果还表明,与c
‑
cart相比,f
‑
cart表现出cd19特异性杀伤、肿瘤特异性细胞因子分泌和相似的杀伤能力。
[0288]
细胞毒性荧光素酶测定
[0289]
将表达荧光素酶的nalm
‑
6或raji肿瘤细胞以3
×
105个细胞/ml的浓度一式三份置于96孔圆底板中,施用d
‑
萤火虫荧光素钾盐(75μg/ml;caliper hopkinton,ma),并用光度计测量。这样做是为了在发生任何细胞死亡之前建立bli基线读数,并确保靶标细胞在孔中均匀分布。随后,将效应f
‑
cart或c
‑
cart细胞以5:1、1:1和0.2:1的效应子比靶标(e:t)的比例加入,并在37℃下温育2或4小时。然后用光度计(packard fusion通用微孔板分析仪,型号a153600)测量bli10秒作为相对光单位(rlu)。用1%nonidet p
‑
40(np40)或水处理细胞作为最大杀伤力的量度。在没有效应细胞的情况下温育的靶细胞用于测量自发性死亡rlu。细胞在2小时或4小时时成像。对一式三份孔取平均值,并使用以下等式从数据计算裂解百分比:%特异性裂解=100
×
(自发性死亡rlu
‑
测试rlu)/(自发性死亡rlu
‑
最大杀伤rlu)。
[0290]
结果显示在图20c中并显示f
‑
cart和c
‑
cart之间的体外细胞毒性相当,因此同时转导和激活的制造方法不会显著影响工程化细胞的细胞毒性,同时减少制造时间。下面的表10示出了f
‑
cart和c
‑
cart之间比较研究的各种体外和体内发现的总结。
[0291]
表10:f
‑
cart对c
‑
cart的总结性能特征f
‑
cartc
‑
cart增殖 记忆/干性 耗竭 杀伤能力(体外) 杀伤能力(体内) bm迁移
[0292]
实施例22:f
‑
cart对c
‑
cart在小鼠白血病模型中的体内分析
[0293]
用raji
‑
luc细胞移植nog小鼠(nod.cg
‑
prkdcscid il2rgtm1sug/jictac)。简而言之,将raji
‑
luc细胞悬浮在pbs中至5
×
105个细胞/0.2ml的密度,并通过尾静脉将0.2ml细胞注射到每只小鼠中。从注射的第0天起,对小鼠进行成像以观察肿瘤的生长。当小鼠图像的平均信号达到5
×
106p/s时,选取信号中等的小鼠,随机分成不同的组,每组3只小鼠。同日,对小鼠尾静脉注射f
‑
cart细胞、c
‑
cart细胞、未转染t细胞,以及仅具有细胞冷冻保存溶液的空白。注射后,每周两次通过生物发光成像观察每只动物的肿瘤生长。
[0294]
结果如图21a所示。从结果可以看出,f
‑
cart显示出显著更强的肿瘤减小的作用,最终消除了肿瘤。
[0295]
实施例23:f
‑
cart对c
‑
cart在鼠白血病模型中的浸润和趋化性的体内分析
[0296]
用nalm
‑6‑
luc细胞移植nog小鼠(nod.cg
‑
prkdcscid il2rgtm1sug/jictac)。简而言之,将nalm
‑
6细胞悬浮在pbs中至5
×
105个细胞/0.2ml的密度,并通过尾静脉注射将0.2ml细胞注射到每只小鼠中。肿瘤细胞注射后7天,对小鼠进行尾静脉注射f
‑
cart细胞、c
‑
cart细胞、未转染t细胞,以及仅具有细胞冷冻保存溶液的空白。治疗后,在第10天通过从小鼠股骨中分离骨髓并评估样品中是否存在car阳性细胞来评估细胞向骨髓的浸润情况。处理示意图描绘于图22a中。结果显示在图22b和图22c中。结果表明,在car
‑
t输注后10天,与c
‑
cart治疗的小鼠相比,骨髓中存在显著更多的f
‑
cart浸润。
[0297]
还使用流式细胞术分析c
‑
cart和f
‑
cart细胞的亚群。通过流式细胞术分析标记物cd3、cd4、cd8和cxcr4的表达。结果显示在图22d、图22e和图22f中。结果显示在f
‑
cart治疗的小鼠中cxcr4的表达更高。
[0298]
使用5μm孔径的transwell板(costar,cambridge,ma)研究趋化性。5
×
105细胞分配在上室,趋化因子或培养基单独添加到下室。以0ng/ml、10ng/ml、25ng/ml和100ng/ml的浓度测试小鼠sdf
‑
1α和人sdf
‑
1α。将板在37℃下温育2小时。使用cfse收集并计数迁移的细胞,并计算迁移指数如下:(n
°
迁移细胞/n
°
分配细胞)x100。从每个值中减去单独用培养基获得的迁移指数。结果显示在图22g和图22h中。结果表明,与c
‑
cart相比,在鼠sdf
‑
1a或人sdf
‑
1a存在下,更多的cfse标记的f
‑
cart迁移到底部孔中。
[0299]
实施例24:分析表达工程化t细胞受体的t细胞(tcrt细胞)
[0300]
慢病毒载体的构建及tcrt细胞的制备
[0301]
编码ny
‑
eso
‑
1的基因(也称为ctag1)的表达仅限于生殖细胞,并且这种表达在正常体细胞组织中最少。然而,ny
‑
eso
‑
1基因在癌症中经常表达,因此可作为癌
‑
睾丸(ct)抗原进行靶向。ny
‑
eso
‑
1基因的表达可以在多种癌症类型中发现,包括但不限于滑膜肉瘤、结肠癌、肺癌、乳腺癌、多发性骨髓瘤等。
[0302]
mhc
‑
i抗原是在体细胞表面以不同水平表达的完整膜糖蛋白。不希望受理论的束缚,mhc
‑
i分子可以通过结合来自降解多肽的一种或多种肽,诸如内源性蛋白质(即加工抗原),并将加工抗原呈递至对特定mhc
‑
i抗原/肽复合物特异的t细胞受体(tcr)而发挥作用。人类白细胞抗原(hla)是人类主要组织相容性复合体(mhc)的i类分子。hla
‑
a*02是hla
‑
a血清型组中的人类白细胞抗原血清型。在一些情况下,hla
‑
a*02可能是最常见的等位基因。在一些情况下,hla
‑
a*02可以将nt
‑
eso
‑
1蛋白的片段呈递给t细胞的tcr。
[0303]
因此,可以将细胞(例如,t细胞)工程化为表达包含对nt
‑
eso
‑
1蛋白片段特异的配
体的工程化tcr,该片段可以由癌症或肿瘤细胞的hla
‑
a*02呈递。编码工程化的ny
‑
eso
‑
1tcr(如seq id no:11所示,以及seq id no:13中的多肽产物)的核苷酸序列包含通过自切割接头p2a连接的tcrα(tcra)和tcrβ(tcrb)。工程化的nt
‑
eso
‑
1tcr设计为结合ny
‑
eso
‑
1肽157
‑
165(sllmwitqc)(如seq id no:15所示)。
[0304]
seq id no:11(tcra
p2a
tcrb):
[0305]
atggagaccctgctgggcctgctgatcctgtggctgcagctccagtgggtgtccagcaagcaggaggtgacccagatccctgccgccctgagcgtgcccgagggcgagaacctggtgctgaactgcagcttcaccgactccgccatctacaacctgcagtggttccggcaggaccccggcaagggcctgaccagcctgctgctgatccagagcagccagcgggagcagaccagcggacggctgaacgccagcctggacaagagcagcggccggagcaccctgtacatcgccgccagccagcccggcgacagcgccacctacctgtgcgctgtgcggcctaccagcggcggcagctacatccccaccttcggcagaggcaccagcctgatcgtgcacccctacatccagaaccccgaccccgccgtgtaccagctgcgggacagcaagagcagcgacaagtctgtgtgcctgttcaccgacttcgacagccagaccaatgtgagccagagcaaggacagcgacgtgtacatcaccgacaagaccgtgctggacatgcggagcatggacttcaagagcaacagcgccgtggcctggagcaacaagagcgacttcgcctgcgccaacgccttcaacaacagcattatccccgaggacaccttcttccccagccccgagagcagctgcgacgtgaaactggtggagaagagcttcgagaccgacaccaacctgaacttccagaacctgagcgtgatcggcttcagaatcctgctgctgaaggtggccggattcaacctgctgatgaccctgcggctgtggagcagccttggaagcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctatgagcatcggcctgctgtgctgcgccgccctgagcctgctgtgggcaggacccgtgaacgccggagtgacccagacccccaagttccaggtgctgaaaaccggccagagcatgaccctgcagtgcgcccaggacatgaaccacgagtacatgagctggtatcggcaggaccccggcatgggcctgcggctgatccactactctgtgggagccggaatcaccgaccagggcgaggtgcccaacggctacaatgtgagccggagcaccaccgaggacttccccctgcggctgctgagcgctgcccccagccagaccagcgtgtacttctgcgccagcagctatgtgggcaacaccggcgagctgttcttcggcgagggctccaggctgaccgtgctggaggacctgaagaacgtgttcccccccgaggtggccgtgttcgagcccagcgaggccgagatcagccacacccagaaggccacactggtgtgtctggccaccggcttctaccccgaccacgtggagctgtcctggtgggtgaacggcaaggaggtgcacagcggcgtgtctaccgacccccagcccctgaaggagcagcccgccctgaacgacagccggtactgcctgtcctccagactgagagtgagcgccaccttctggcagaacccccggaaccacttccggtgccaggtgcagttctacggcctgagcgagaacgacgagtggacccaggaccgggccaagcccgtgacccagattgtgagcgccgaggcctggggcagggccgactgcggcttcaccagcgagagctaccagcagggcgtgctgagcgccaccatcctgtacgagatcctgctgggcaaggccaccctgtacgccgtgctggtgtctgccctggtgctgatggctatggtgaagcggaaggacagccggggctaa。
[0306]
seq id no:13:
[0307]
metllgllilwlqlqwvsskqevtqipaalsvpegenlvlncsftdsaiynlqwfrqdpgkgltsllliqssqreqtsgrlnasldkssgrstlyiaasqpgdsatylcavrptsggsyiptfgrgtslivhpyiqnpdpavyqlrdskssdksvclftdfdsqtnvsqskdsdvyitdktvldmrsmdfksnsavawsnksdfacanafnnsiipedtffpspesscdvklveksfetdtnlnfqnlsvigfrilllkvagfnllmtlrlwsslgsgegrgslltcgdveenpgpmsigllccaalsllwagpvnagvtqtpkfqvlktgqsmtlqcaqdmnheymswyrqdpgmglrlihysvgagitdqgevpngynvsrsttedfplrllsaapsqtsvyfcassyvgntgelffgegsrltvledlknvfppevavfepseaeishtqkatlvclatgfypdhvelswwvngkevhsgvstdpqplkeqpalndsryclssrlrvsatfwqnprnhfrcqvqfyglsendewtqdrakpvtqivsaeawgradcgftsesyqqgvlsatilyeillgkatlyavlvsalvlmamv
krkdsrg。
[0308]
将编码工程化的ny
‑
eso
‑
1tcr(例如,ny
‑
eso
‑
1tcrt cdna)的核苷酸序列插入到pccl
‑
cppt慢病毒质粒中。随后,用pccl
‑
cppt和其他包装质粒(辅助质粒)转染hek293细胞。随后,例如,转染后3天,收获慢病毒(lv)颗粒并通过离心浓缩。包含ny
‑
eso
‑
1tcrt基因的t细胞按照与用于f
‑
cart细胞的程序类似的程序制备,如本公开内容的实施例2和3中所提供。在这样的程序中,t细胞用ny
‑
eso01tcr lv颗粒转染1天。转染后,无需进一步扩增,即可获得本公开内容的car
‑
t细胞(本文也称为ftcrt、f
‑
tcrt或f
‑
tcr
‑
t细胞)。在该程序中,工程化的t细胞在转染前没有被激活。(i)经修饰以表达工程化的ny
‑
eso
‑
1tcr的t细胞与(ii)通过hla
‑
a*02表达ny
‑
eso
‑
1肽的癌细胞之间的相互作用示意性地图示在图23a中。
[0309]
包含ny
‑
eso
‑
1tcrt基因的对照细胞通过使用常规方法,例如本公开内容的实施例4中公开的制备c
‑
cart细胞的方法,用ny
‑
eso
‑
1tcr lv颗粒转染t细胞来制备。激活和转染后(例如,在1天的过程中),将修饰t细胞培养8天进行扩增,得到对照细胞(也称为第二参考细胞、ctcrt、c
‑
tcrt或c
‑
car
‑
t细胞)。
[0310]
tcrt增殖分析
[0311]
分析了ftcrt细胞和ctcrt细胞的增殖能力(例如,体外增殖),结果如图23b所示。简而言之,在解冻冷冻的tcrt细胞(例如ftcrt细胞和ctrct细胞)两天后,每周用照射的u266刺激工程化t细胞两次,并通过流式细胞术定量ny
‑
eso
‑
1tcrt细胞的数量。如图23b所示,ftcrt细胞表现出比ctcrt细胞对照更高的增殖能力。第5天ftcrt细胞数量的倍数变化比ctcrt细胞数量的倍数变化至少高约5倍。第8天ftcrt细胞数量的倍数变化比ctcrt细胞数量的倍数变化至少高约3倍。第12天ftcrt细胞数量的倍数变化比ctcrt细胞数量的倍数变化至少高约6到7倍。
[0312]
淋巴细胞亚群分析
[0313]
使用如本公开内容的实施例6中所示的方法在刺激的ftcrt细胞和ctcrt细胞中分析淋巴细胞亚群。简而言之,将解冻的tcrt细胞用辐射的u266刺激3天,并通过常规流式细胞术分析ftcrt细胞和ctcrt细胞中tcrt细胞的表型。结果如图23c所示,其中具有巨大分化潜力的幼稚t细胞可以通过cd45ro
‑
/cd62l
(顶部图)或cd45ra
/ccr7
(底部图)来表示。结果表明,ftcrt细胞表现出比ctcrt细胞“更年轻”的表型,这由更高百分比的幼稚t细胞表明。ftcrt细胞中cd45ro
‑
/cd62l
幼稚t细胞的比例(69.2%)大约是ctcrt细胞(34.6%)的两倍。ftcrt细胞中cd45ra
/ccr7
幼稚t细胞的比例(29.3%)比ctcrt细胞中的比例(7.87%)高约3.7倍。
[0314]
单独地,使用如本公开内容的实施例14中所示的方法在刺激的ftcrt细胞和ctcrt细胞中分析t细胞耗竭。简而言之,将解冻的tcrt细胞用辐射的u266刺激3天,并通过常规流式细胞术分析ftcrt细胞和ctcrt细胞中tcrt细胞的表型。结果如图23d所示,其中通过pd1
/lag3
(顶部图)或pd1
/tim3
(底部图)表示耗竭t细胞。结果表明,ftcrt细胞表现出比ctcrt细胞更少的耗竭,这由较低百分比的耗竭的tcrt细胞表明。ftcrt细胞中检测不到pd1
/lag3
t细胞的比例(0%),而ctcrt细胞中的比例显著更高(4.65%)。ftcrt细胞中pd1
/tim3
t细胞的比例(0.19%)比ctcrt细胞中的比例(33.7%)低约177倍。
[0315]
tcrt细胞的体外肿瘤杀伤功效
[0316]
使用先前描述在本公开内容的实施例17中的实时细胞分析仪(rtca)测定法,使用
5:1或1:1的效应子与靶标比(即e/t比率),比较ftcrt细胞对靶细胞(例如,呈递至少ny
‑
eso
‑
1蛋白片段的mcf
‑
7乳腺癌细胞)的细胞毒性和ctcrt细胞对靶细胞的细胞毒性。简而言之,解冻的tcrt细胞用2轮辐射u266刺激。随后,tcrt细胞与2x104靶细胞以5:1或1:1的e/t比率共培养。对照包括经历ftcrt制备程序(如本文中的f
‑
nt所示)或常规ctcrt制备程序(如本文中的c
‑
nt所示)的正常t细胞(没有针对ny
‑
eso
‑
1片段的修饰的tcr)。用rtca监测靶细胞生长,结果如图23e所示。结果表明,与ctcrt细胞(如60小时后约1.7的mcf
‑
7的归一化细胞指数所示)相比,ftcrt细胞在1:1的e/t比率(如60小时后约1.1的mcf
‑
7的归一化细胞指数所示)下对mcf
‑
7细胞表现出增强的细胞毒性。此外,结果表明,与ctcrt细胞(如60小时后约0.7的mcf
‑
7的归一化细胞指数所示)相比,ftcrt细胞在5:1的e/t比率(如60小时后约0.5的mcf
‑
7的归一化细胞指数所示)下对mcf
‑
7细胞表现出增强的细胞毒性。
[0317]
tcrt细胞的细胞毒性荧光素酶测定
[0318]
使用先前描述在本公开内容的实施例21中的荧光素酶测定法,使用5:1或1:1的效应子与靶标比(即e/t比率),比较ftcrt细胞对靶细胞(例如,呈递ny
‑
eso
‑
1蛋白至少一个片段的mcf
‑
7乳腺癌细胞)的细胞毒性和ctcrt细胞对靶细胞的细胞毒性。简而言之,解冻的tcrt细胞用2轮辐射u266人b淋巴细胞或刺激的rpmi 8226人b淋巴细胞刺激。随后,tcrt细胞与2x104靶细胞以5:1或1:1的e/t比率共培养。共培养20小时后,在共培养体系中加入荧光素酶物质,根据荧光素酶活性对残留靶细胞进行定量。结果如图23f所示。当用u266刺激时,ftcrt细胞和ctcrt细胞在e/t比率为5:1(顶部图)或1:1(底部图)时对靶细胞表现出相当的细胞毒性。当用rpmi 8226刺激时,与ctcrt细胞(小于约10%,底部图)相比,ftcrt细胞在e/t比率为5:1(约50%,顶部图)时表现出增强的靶细胞裂解。此外,当用rpmi 8226刺激时,与ctcrt细胞(小于约10%,底部图)相比,ftcrt细胞在e/t比率为1:1(约20%,顶部图)时表现出增强的靶细胞裂解。
[0319]
总体而言,配置为表达针对ny
‑
eso
‑
1蛋白片段的工程化tcr的ftcrt细胞表现出(i)增殖能力增强,(ii)具有更强记忆和/或干性的幼稚t细胞比例更高,(iii)细胞耗竭更少,和(iv)与配置为表达相同工程化tcr的ctcrt细胞相比,对某些靶细胞的细胞毒性增强。下面的表11示出了ftcrt细胞和ctcrt细胞之间比较研究的各种体外发现的总结。
[0320]
表11:ftcrt对ctcrt的总结1:ftcrt对ctcrt的总结
[0321]
实施例25:f
‑
cart对c
‑
cart受试者样品的体外和体内分析
[0322]
使用f
‑
cart方法和在本公开内容的先前实施例,例如实施例24中提供的常规方法制备表达双重抗
‑
cd19和抗
‑
cd22 car的cart细胞。使来自gc022患者样品(例如,如本公开
内容的表8中公开的)的t细胞经历f
‑
cart生产过程的方法或其产品在本文中表示为gc022f。使来自gc022患者样品的t细胞经历常规c
‑
cart生产过程的方法或其产品在本文中表示为gc022。与用于生产gc022 c
‑
cart细胞的常规生产工艺(例如c
‑
cart)需要8
‑
14天(例如9天)的培养不同,gc022f可在一天内生产和制备car
‑
t细胞,其可更快地提供给患者,也可以降低生产成本。为了验证gc022f产品的安全性和有效性,进行了体外和体内实验,如下所述。
[0323]
gc022f(f
‑
cart)和gc022(c
‑
cart)细胞的生产
[0324]
来自b
‑
all gc022受试者的t细胞被解冻并相应地处理(例如,转导)以产生gc022f cart细胞和常规的gc022 cart细胞。培养2天后,流式细胞术分析显示,超过50%的gc022f cart细胞(53.6%)和常规gc022 cart细胞(67.5%)表达了感兴趣的car。nt是未用gc022逆转录病毒转导的t细胞对照。结果如图24a所示。
[0325]
细胞毒性荧光素酶测定
[0326]
受试者的gc022f cart和常规gc022 cart的细胞毒性如先前描述评估,例如在实施例21中使用1:1或5:1的效应子与靶标比(即e/t比率)。结果如图24b所示。将gc022f cart细胞和常规gc022cart细胞与作为靶细胞的raji
‑
luc细胞混合,共温育20小时。加入底物以测定细胞培养液中荧光素酶的释放量,计算比杀伤率。图24b中的结果显示gc022f cart细胞和常规gc022 cart细胞在1:1和5:1的e/t比率下对靶细胞表现出相当的细胞毒性。对照nt细胞在相同条件下不表现出细胞毒素活性。
[0327]
细胞扩增
[0328]
将gc022f cart细胞和常规gc022 cart细胞的冷冻样品解冻并培养2天。随后,将每一个通过辐射灭活的k562、k562
‑
cd19或k562
‑
cd22细胞加入到每个cart细胞培养系统中。添加的k562、k562
‑
cd19或k562
‑
cd22细胞的数量是g022f cart细胞或常规g022cart细胞数量的两倍。对照(幼稚)cart细胞未与k562、k562
‑
cd19或k562
‑
cd22细胞中的任何一种共培养。在第5天,对细胞进行计数,并在相同的刺激下传代。在第8天,对细胞计数。如图24c所示,对照cart细胞和与不表达cd19和cd22的k562细胞共培养/刺激的cart细胞缓慢扩增(或增殖)。当用表达cd19或cd22的k562细胞刺激时,gc022f cart细胞和常规gc022 cart细胞均大量扩增(或增殖),并且gc022f cart细胞表现出比常规gc022 cart细胞更大的扩增能力。常规gc022 cart细胞和gc022f cart细胞在k562
‑
cd19刺激下分别表现出约26.4倍和约118.5倍的扩增,因此在cd19刺激下gc022f cart细胞的扩增是常规gc022 cart细胞的扩增的约4.5倍。常规gc022 cart细胞和gc022f cart细胞在k562
‑
cd22刺激下分别表现出约26.7倍和约63.4倍的扩增,因此在cd22刺激下gc022fcart细胞的扩增是常规gc022 cart细胞的扩增的约2.3倍。总体而言,与常规的gc022 cart细胞相比,gc022f cart细胞在抗原特异性刺激下表现出增强的扩增/增殖能力。
[0329]
抗原刺激细胞扩增后的细胞毒性测定
[0330]
为了测试car
‑
t细胞在通过抗原(例如cd19或cd22)刺激和扩增后能否维持对靶细胞的细胞毒性(例如肿瘤杀伤功能),对gc022fcart细胞和常规gc022 cart细胞进行抗原刺激并扩增(如图24c所示),然后与raji
‑
luc细胞以1:1的e/t比率共培养20小时。然后,如先前所述,例如在实施例21中使用基于荧光素酶的测定法评估cart细胞的细胞毒性。如图24d所示,gc022f cart细胞和常规gc022cart细胞在抗原刺激和扩增的体外培养后均表现出对
raji靶细胞的细胞毒性。在一些情况下,cd19或cd22抗原特异性刺激增强了gc022fcart细胞和常规gc022 cart细胞对raji靶细胞的细胞毒性。
[0331]
表型和耗竭
[0332]
通过常规流式细胞术分析gc022f cart细胞和常规gc022 cart细胞的淋巴细胞亚群。通过流式细胞术分析标记物(例如,ccr7、cd45ra、cd45ro、cd62l、pd
‑
1和lag3)的表达。在抗原特异性刺激之后,如上所述(例如,抗原特异性刺激的3天)和进一步的细胞培养(例如,额外的细胞培养的5天),对cart细胞进行facs分析。如图24e所示,对于gc022f cart细胞和常规gc022 cart细胞,在cd19或cd22刺激后tcm细胞(ccr7
/cd45ra
‑
)的比例增加。此外,在cd19或cd22刺激后,gc022f cart细胞中tcm细胞的比例比常规gc022 cart细胞中的比例高约两倍。
[0333]
如图24f所示,评估了cart细胞表现出的t细胞耗竭标志物,诸如pd
‑
1和lag3。gc022 cart细胞中pd
‑1
/lag3
细胞(表示耗竭t细胞)的比例在被抗原cd19或cd22刺激后增加。然而,cd19抗原刺激的gc022f cart细胞中pd
‑1
/lag3
细胞的比例(约5%)约为cd19抗原刺激的常规gc022 cart细胞的比例(约10%)的约50%。此外,cd22抗原刺激的gc022f cart细胞中pd
‑1
/lag3
细胞的比例(约2
‑
3%)约为cd22抗原刺激的常规gc022 cart细胞的比例(约10%)的约20
‑
30%。与常规的cart细胞生产方法相比,本公开内容的方法导致在cart细胞的生产过程中减少了t细胞的耗竭。
[0334]
肿瘤细胞毒性的体内分析
[0335]
用nalm
‑6‑
lucg细胞移植nog小鼠(nod.cg
‑
prkdcscid il2rgtm1sug/jictac)。简而言之,每只小鼠通过尾静脉注射5
×
105个nalm
‑
6细胞,模型肿瘤细胞生长1天后测定荧光值。根据肿瘤生长分组小鼠,并分别用pbs、对照t细胞、gc022f cart细胞和常规gc022 cart细胞处理小鼠。t细胞以1x106个细胞的剂量施用。gc022f cart细胞以5x105个细胞的高剂量(gc022fhd)或1.5x105个细胞的低剂量(gc022fld)施用。常规的gc022 cart细胞以5x105个细胞的高剂量(gc022hd)或1.5x105个细胞的低剂量(gc022ld)施用。在各自的cart细胞治疗后每周进行两次荧光素酶测量(例如,在第0天、第5天、第8天、第12天、第15天和第19天)以评估它们的效果,如图24g所示。结果显示,从第8天起,gc022f cart细胞比常规的gc022cart细胞表现出增强的肿瘤抑制和/或去除。而常规的gc022 cart细胞在第8天诱导肿瘤细胞减少,直到第19天肿瘤细胞的存在增加,gc022f cart细胞在第8天诱导去除肿瘤细胞并维持肿瘤抑制直至第19天。图24g中的生物发光成像的图解概要显示在图24h中。
[0336]
图24i示出了在上述体内分析过程中小鼠体重的变化。结果表明,直到第19天都没有可检测到的副作用,诸如体重减轻,表明gc022fcart细胞疗法可能安全有效地治疗或减少受试者的肿瘤,并且本公开内容的gc022f cart细胞疗法可能比任何常规的gc022 cart细胞治疗法在治疗上更有效和更具成本效益。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。