1.本发明属于药学制剂技术领域,具体涉及一种蜂胶磷脂复合物的亚微乳剂及其制备方法。
背景技术:
2.全球约有2.46亿人患有2型糖尿病,且患者病程呈日益加重趋势。临床上2型糖尿病的治疗主要以口服降糖化学药及胰岛素针剂为主。尽管传统药物治疗有显著的降糖效果,但长期使用会导致患者出现耐受、低血糖、胃肠不适、心血管风险或者因针剂的不便、疼痛导致患者依从性降低。
3.蜂胶是采集工蜂从树木等植物新生芽或树皮上采集的树胶,并混入蜜蜂上颚腺分泌物和蜂蜡等加工形成的具有芳香粘性的固体胶状物质。其主要成份是黄酮类、萜烯类、醛酮类、酯类和有机酸类化合物。国内外大量的临床前研究已经证实,蜂胶有众多生物活性:抗氧化、抗炎、抑菌、免疫调节、保肝护肝、抗癌、心血管保护、调控血脂血糖。尤其在调控糖尿病和高血脂的研究中取得较为显著的效果。蜂胶可通过抗氧化修复胰岛细胞、促进胰岛素分泌、抑制胰岛素体抗、α
‑
葡萄糖苷酶、提高胰岛素靶组织对葡萄糖的利用率等多途径多靶点发挥降血糖降血脂效果,且对正常血糖无影响,提示蜂胶可能不会产生低血糖副作用。
4.目前,市售的蜂胶产品为软胶囊、片剂,由于有效成分口服生物利用度低,抗糖尿病效果不明显,无法应用于临床,仅作为保健品。大量文献表明,制约蜂胶有效成分口服生物利用度的原因可能有:蜂胶自身粘性大,溶出及溶解度差,有效成分易氧化、肝肠首过代谢严重、肠道外排等。cn200710003085.9提供一种蜂胶软胶囊的制备方法,用食用植物油溶解蜂胶,利用蜂胶的基本组成物质,与食用植物油成份相互作用,形成蜂胶油溶物,达到医疗保健功效显著。cn201010181753.9涉及一种蜂胶纳米乳液的制备方法,将蜂胶乙醇提纯液、醋酸乙酯和吐温按质量比=1∶1~3∶2~6的比例混合均匀作为分散相;再使用性能良好的膜材料,选择合适的膜孔径大小,控制跨膜压力、分散相通量和连续相流速等参数,双蒸水为连续相,通过膜乳化器对上述分散相进行乳化,制得稳定的蜂胶纳米乳液,以提高其水溶性和生物利用度。
5.基于此,有必要提供一种具有良好储存稳定性、口服生物利用度高并可应用于糖尿病临床治疗的蜂胶磷脂复合物的亚微乳剂及其制备方法。
技术实现要素:
6.基于现有蜂胶制剂在口服给药中存在的难题,本发明提供一种蜂胶磷脂复合物的亚微乳剂及其制备方法,以亚微乳作为蜂胶磷脂复合物的递药载体,以实现能够提高生物利用度,提高稳定性,延长储存期,抗糖尿病效果显著。
7.本发明通过以下技术方案进行实现:
8.一方面,本发明提供一种蜂胶磷脂复合物的亚微乳剂,包括
9.活性成分:蜂胶磷脂复合物;
10.载体:油相、乳化剂、增溶剂、稳定剂和水。
11.进一步地,所述蜂胶磷脂复合物的制备过程如下:将蜂胶提取物和磷脂溶于有机溶剂,加热反应,去除有机溶剂得到。
12.进一步地,所述有机溶剂为醇;进一步优选的,所述醇为一元醇或二元醇;更优选的,所述醇为一元醇,例如乙醇、丙醇(包括正丙醇或异丙醇)、丁醇(包括正丁醇或异丁醇)等。
13.进一步地,所述蜂胶提取物和磷脂的质量比为(0.5
‑
1):(1
‑
5),进一步地,优选质量比为1:1,1:2等。蜂胶、磷脂的质量比能有效控制亚微乳剂尺寸维持在160
‑
200nm,且特别有助于亚微乳剂灭菌前后磷脂复合物不破灭,提高亚微乳剂的稳定性。进一步地,所述磷脂选自:蛋黄卵磷脂、大豆磷脂,例如大豆卵磷脂、二油酰基卵磷脂、二月桂酰基卵磷脂、二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、脑磷脂、肌醇磷脂、溶血磷脂、磷脂酸等。
14.进一步地,所述加热反应的温度控制在30
‑
70℃,优选为35℃、40℃、45℃、50℃、60℃。进一步地,所述加热反应的时间控制在0.5
‑
12小时,优选为2
‑
3小时。进一步地,所述磷脂与有机溶剂的质量体积比为1:1
‑
500(g/ml),优选为1:500。进一步地,所述去除有机溶剂的过程为:用旋蒸的方法除去有机溶剂,然后冷冻干燥。
15.进一步地,所述油相包括植物油和其它油相,所述植物油选自玉米油、葵花油、芝麻油、花生油、大豆油、红花油、橄榄油、棕榈油、棉籽油、薏仁油、蓖麻油或氢化蓖麻油中的一种或多种;所述其它油相选自链长在c8
‑
c10之间的中等链长脂肪酸甘油酯或c6
‑
c12直链油等,优选为聚乙二醇月桂酸甘油酯、单油酸甘油酯、单亚油酸甘油酯、中链甘油三酯、聚乙二醇油酸甘油酯、聚乙二醇亚油酸甘油酯、聚乙二醇辛酸癸酸甘油酯、辛酸癸酸甘油酯、聚氧乙烯油酸甘油酯、聚氧乙烯亚油酸甘油酯、山茶酸甘油酯、杏仁油油酸peg
‑
6甘油酯、玉米油亚油酸peg
‑
6甘油酯、油酸甘油酯、磷脂酰甘油、硬脂酰/棕榈酰/油酰磷脂酰胆碱、硬脂酰/棕榈酰/油酰磷脂酰乙醇胺、磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰甘油和磷脂酰肌醇、二硬脂酰磷脂酰乙醇胺、油酰磷脂酰胆碱、己酸、辛酸、油酸、维生素e、硬脂酸、月桂酸异丙酯、棕榈酸异丙酯、肉豆蔻酸异丙酯、丙二醇单月桂酸酯、丙二醇单辛酸酯、油酸山梨醇酯、月硅酸乙酯、肉豆蔻酸乙酯、油酸乙酯、亚油酸乙酯中的一种或至少两种。
16.进一步地,所述油相为大豆油和中链甘油三酯的组合,进一步地,二者的质量比为(1
‑
3):(3
‑
1)。
17.进一步地,所述乳化剂选自:蛋黄卵磷脂、大豆磷脂,例如大豆卵磷脂、二油酰基卵磷脂、二月桂酰基卵磷脂、二肉豆蔻酰基卵磷脂、二棕榈酰基卵磷脂、二硬脂酰基卵磷脂、脑磷脂、肌醇磷脂、溶血磷脂、磷脂酸、二肉豆蔻酰基磷脂酰乙醇胺、二棕榈酰基磷脂酰乙醇胺、、二硬脂酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰丝氨酸、乙酰化单甘油酯、脱水山梨糖醇脂肪酸酯、杏仁油酸聚乙二醇甘油酯、椰子油c8/c10聚乙二醇甘油酯、聚氧乙烯十二羟硬脂酸酯、聚乙二醇100维生素e琥珀酸酯、聚氧乙烯
‑
聚氧丙烯共聚物、聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油、聚氧乙烯聚氧丙烯共聚物、聚氧乙烯山梨醇酐三油酸脂、聚氧乙烯甘油三油酸脂、聚氧乙烯脱水山梨糖醇脂肪酸酯、琥珀辛酯钠、琥珀辛酯钙、琥珀辛酯钾、十二烷基硫酸钠、月桂基硫酸钠、二棕榈酰磷脂酸、乙氧基化蓖麻油、甘露醇油酸脂聚氧乙烯醚、聚乙
二醇甘油酯类、聚乙二醇脂肪酸酯、聚乙二醇脂肪酸酯、聚乙二醇
‑
15羟基硬脂酸酯、聚乙二醇
‑8‑
甘油辛酸/癸酸酯、月桂酸聚乙二醇
‑
32甘油酯、月桂酰聚乙二醇
‑
32甘油酯、辛癸酸聚乙二醇甘油酯、山梨醇酐倍半油酸脂、聚山梨酯、司盘80、吐温80、聚乙烯己内酰胺
‑
聚乙酸乙烯酯
‑
聚乙二醇接枝共聚物、辛酸、辛酸钠、胆汁酸及其盐、熊果脱氧胆酸、胆酸钠、脱氧胆酸钠、牛磺胆酸钠、甘胆酸钠、n
‑
十六烷基
‑
n,n
‑
二甲基
‑3‑
氨
‑1‑
丙烷磺酸盐、棕榈酰溶血磷脂酰
‑
l
‑
丝氨酸、溶血磷脂、n
‑
烷基
‑
n,n
‑
二甲基氨
‑1‑
丙烷磺酸盐、3
‑
胆酰胺
‑1‑
丙基二甲基氨
‑1‑
丙烷磺酸盐、十二烷基磷酸胆碱、肉豆蔻酰溶血磷脂酰胆碱、鸡蛋溶血卵磷脂、丙二醇单月桂酸酯、十六烷基
‑
三甲基铵溴化物、十六烷基吡啶氯化物、聚环氧乙烷/聚环氧丙烷嵌段共聚物、牛磺二氢梭链孢酸钠、油酸、酰基肉毒碱、赖氨酸、精氨酸、组氨酸、赖氨酸中的一种或至少两种。
18.进一步地,所述增溶剂选自:吐温、泊洛沙姆、脂肪酸山梨坦、聚山梨酯、聚维酮、聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油、硬脂酸聚氧乙烯酯、聚乙二醇15羟基硬脂酸酯和卵磷脂中的一种或至少两种。
19.进一步地,所述稳定剂选自油酸、油酸盐、泊诺沙姆188、十二烷基硫酸钠、羟丙基纤维素、羟丙甲纤维素、聚乙烯吡咯烷酮、多库酯钠、维生素c、柠檬酸、谷胱甘肽、乙酰水杨酸、焦亚硫酸钠、亚硫酸氢钠、亚硫酸钠、硫代硫酸钠、硫脲、维生素e、半胱氨酸、枸橼酸、酒石酸中的一种或至少两种。进一步地,所述油酸盐为油酸钠、油酸钾、油酸镁、油酸钙或油酸锂。
20.进一步地,所述亚微乳剂中,蜂胶磷脂复合物、油相、乳化剂、增溶剂、稳定剂的质量比为0.5~3:10~20:0.5~5:1~3:0.03~1.5,加水至体积为100ml。
21.进一步地,所述亚微乳剂中,按100ml计,包括以下组分:
[0022][0023]
进一步地,所述亚微乳剂中,按100ml计,包括以下组分:
[0024]
蜂胶磷脂复合物3.0g;大豆油7.5g;中链甘油三酯7.5g;大豆卵磷脂1.2g;吐温80 1.0g;泊洛沙姆188 1.0g;油酸钠0.03g;水加至100ml。
[0025]
另一方面,本发明提供一种蜂胶磷脂复合物的亚微乳剂的制备方法,包括以下步骤:
[0026]
步骤一制备油相混合物:将蜂胶磷脂复合物、油相加热溶解,制得油相混合物;
[0027]
步骤二制备水相混合物:将乳化剂、增溶剂、稳定剂和水搅拌混合后,加热溶解,制得水相混合物;
[0028]
步骤三制备亚微乳剂:将油相混合物加入至水相混合物中,分散,定容至100ml,进一步均质、灭菌,制得亚微乳剂。
[0029]
进一步地,所述加热溶解的温度均控制在65~80℃。
[0030]
进一步地,所述分散是指采用分散机对油相混合物和水相混合物进行剪切分散。进一步地,所述剪切分散的速度为8000~15000转/分钟,剪切的时间为5~20分钟。进一步地,所述剪切分散的速度为8000转/分钟,剪切的时间为15分钟。本发明通过高速的剪切作用有利于改善亚微乳剂的稳定性。
[0031]
进一步地,所述均质是指采用均质机进行,均质过程中的压力为40~100mpa,均质次数为4~9次。进一步地,所述均质过程中的压力为80mpa,均质次数为8次。通过均质进一步进行分散。
[0032]
进一步地,所述灭菌是指将均质后的产物灌装熔封后在121℃下高压灭菌15分钟。
[0033]
另一方面,本发明提供一种药物,其包括本发明制备的蜂胶磷脂复合物亚微乳剂。
[0034]
一方面,本发明提供一种蜂胶磷脂复合物亚微乳剂和药物在制备治疗心血管类疾病或代谢类疾病的药物中的用途,其中所述心血管类疾病包括高血脂类疾病,例如动脉粥样硬化、心绞痛、心肌埂死、脑梗塞等疾病;所述代谢类疾病包括高血糖类疾病,例如糖尿病等。
[0035]
本发明通过选择油相及其种类改善各组分的溶解情况,提高活性成分的载药情况;乳化剂是微乳的关键组分,通过选择合适的乳化剂及乳化剂用量,采用均质技术实现亚微乳的形成;增溶剂的加入有利于减小和控制乳滴粒径,利于各组分的混溶;稳定剂的添加能够有效维持油水界面的稳定性,使得制备的亚微乳外观更加均匀,性质更加稳定。经考察,本发明制备的蜂胶磷脂复合物亚微乳剂粒径在200nm以下,形态圆整,大小均一。通过在4℃避光和室温避光放置12个月没有出现聚集、絮凝、合并、分层等不稳定现象,颗粒没有明显变化,物理性质稳定。
[0036]
本发明所述蜂胶磷脂复合物是指磷脂和蜂胶提取物在非质子传递体系溶剂中,蜂胶提取物和磷脂以一定投料比,通过反应形成蜂胶磷脂复合物。蜂胶提取物粘性极强,室温下呈粘性固体状,其水溶性、油溶性均较差,其主要药理活性成分黄酮易氧化失效;通过将蜂胶与磷脂形成蜂胶磷脂复合物之后,其理化性质和生物学特性和原药物相比发生了很大改变,如增加蜂胶提取物油溶性、水溶性等;其溶解性能的改善可能与磷脂的两亲性有关,以及在水中磷脂形成胶团的增溶作用有关,一方面是由于其无定型的状态,另一方面则是复合物中药物的极性端与磷脂相互作用而受到一定的掩蔽。
[0037]
将蜂胶与磷脂混合搅拌制备成蜂胶磷脂复合物,增加其油溶性,然后将蜂胶磷脂复合物溶解于大豆油与中链甘油三酯混合油相中,通过高压均质方式,制备成亚微乳剂。将蜂胶制备成亚微乳剂有诸多优点,例如1)将蜂胶提取物包裹于纳米级别内相,可避免有效成分氧化失活,显著提高蜂胶提取物稳定性,且提高药物溶出及溶解度;2)制备的亚微乳制剂具有明显的可经淋巴转运途径吸收,可避免有效成分首过代谢;其富含的表面活性剂还可抑制肠道外排蛋白,故可以显著提高蜂胶的口服生物利用度,则有望克服现有的蜂胶制剂存在的一系列问题以及有望用于临床治疗。
[0038]
本发明制得的亚微乳剂降血糖、降血脂效果好,可用于治疗糖尿病。
[0039]
相对于现有技术,本发明提供的技术方案具备有益效果如下:
[0040]
基于亚微乳本身是一种热力学不稳定体系,在贮存过程中容易发生聚集、絮凝、合并,导致两相分层,本发明的蜂胶磷脂复合物的亚微乳剂通过改进配方中油相种类、油相用
量、乳化剂、乳化剂用量、增溶剂、增溶剂用量以及稳定剂及其用量,以及工艺参数的变化,提高亚微乳剂的稳定性。
[0041]
本发明利用蜂胶提取物和磷脂形成蜂胶磷脂复合物之后,再制备成亚微乳剂,口服后,血中白杨素、高良姜素(蜂胶提取物特征性黄酮成分)的浓度迅速升高,生物利用度显著提高,抗糖尿病效果与阳性药物相似,可用于临床。
[0042]
本发明制得的亚微乳剂,利用蜂胶和磷脂形成蜂胶磷脂复合物,不仅提高了蜂胶提取物的稳定性,也提高了亚微乳剂整体的稳定性。
附图说明
[0043]
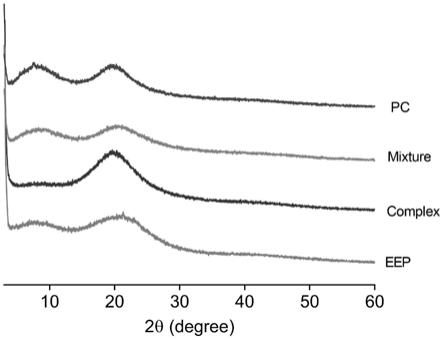
图1为本发明实施例1制得的蜂胶磷脂复合物的xrd(x射线衍射)图谱;图中,蜂胶提取物(eep)、大豆卵磷脂(pc)、蜂胶磷脂复合物(eep
‑
pc complex)、蜂胶提取物与大豆卵磷脂物理混合物(eep pc mixture)。
[0044]
图2为本发明实施例1制得的蜂胶磷脂复合物的dsc(差示扫描量热法)曲线;图中,蜂胶提取物(eep)、大豆卵磷脂(pc)、蜂胶磷脂复合物(eep
‑
pc complex)、蜂胶提取物与大豆卵磷脂物理混合物(eep pc mixture)。
[0045]
图3为本发明实施例2制得的亚微乳剂的扫面电镜图。
[0046]
图4a、4b为本发明实施例2制得的亚微乳剂在血液中的白杨素、高良姜素浓度随时间变化图。图中,chrysin concentration白杨素浓度;galangin concentration高良姜素浓度;图中曲线group1表示实施例2制得的亚微乳剂在血液中浓度与时间的关系,曲线group2表示对比例1制得的蜂胶口服液在血液中浓度与时间的关系,曲线group3表示乳糜微粒阻滞后,口服乳组在血液中浓度与时间的关系。
[0047]
图5为在治疗效果研究中空腹血糖测定结果图。图中,model模型组,emulsion口服乳组,eep/liquid口服液组,pioglitazone阳性药物组吡格列酮,control对照组
[0048]
图6为在治疗效果研究中空腹胰岛素测定结果图。
[0049]
图7为在治疗效果研究中血脂四项测定结果图。
具体实施方式
[0050]
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。以下实施例旨在说明本发明内容,而不是对本发明保护范围的进一步限定。
[0051]
实施例1:蜂胶磷脂复合物的制备
[0052]
蜂胶磷脂复合物通过以下方法制得:将蜂胶提取物、大豆卵磷脂按质量比为1g∶1g溶于500ml乙醇中,在40℃下反应2小时,用旋蒸的方法除去乙醇,然后冷冻干燥,制得。
[0053]
实施例2:亚微乳剂的制备
[0054]
一种蜂胶磷脂复合物亚微乳剂,按100ml计,包括以下组分:蜂胶磷脂复合物3.0g;大豆油7.5g;中链甘油三酯7.5g;大豆卵磷脂1.2g;吐温80 1.0g;泊洛沙姆188 1.0g;油酸钠0.03g;水加至100ml。
[0055]
一种亚微乳剂的制备方法,包括以下步骤:
[0056]
步骤一制备油相混合物:按配方量称取上述各组分,将蜂胶磷脂复合物、大豆油、
中链甘油三酯加热至70℃溶解,制得油相混合物;
[0057]
步骤二制备水相混合物:将吐温80、泊洛沙姆188、油酸钠和水搅拌混合,加热至70℃溶解,制得水相混合物;
[0058]
步骤三制备亚微乳剂:将油相混合物加入至水相混合物中,采用分散机对油相混合物和水相混合物进行剪切分散,剪切分散的速度为8000转/分钟,剪切的时间为15分钟,加水定容至100ml,进一步采用均质机进行均质,均质过程中的压力为80mpa,均质次数为8次,将均质后的产物灌装熔封后在121℃下高压灭菌15分钟,制得亚微乳剂。
[0059]
图3为本发明实施例2制得的亚微乳剂的tem图(透射电镜图),由图3可以看出制备的亚微乳剂形态圆整,大小均一,粒径为170
‑
180nm。
[0060]
实施例3:亚微乳剂的制备
[0061]
一种蜂胶磷脂复合物亚微乳剂,按100ml计,包括以下组分:蜂胶磷脂复合物0.5g;大豆油5g;中链甘油三酯5g;蛋黄卵磷脂1g;吐温80 0.5g;泊洛沙姆188 0.5g;油酸1.5g;水加至100ml。
[0062]
一种亚微乳剂的制备方法,包括以下步骤:
[0063]
步骤一制备油相混合物:按配方量称取上述各组分,将蜂胶磷脂复合物、大豆油、中链甘油三酯加热至80℃溶解,制得油相混合物;
[0064]
步骤二制备水相混合物:将蛋黄卵磷脂、吐温80、泊洛沙姆188、油酸和水搅拌混合,加热至80℃溶解,制得水相混合物;
[0065]
步骤三制备亚微乳剂:将油相混合物加入至水相混合物中,采用分散机对油相混合物和水相混合物进行剪切分散,剪切分散的速度为15000转/分钟,剪切的时间为10分钟,加水定容至100ml,进一步采用均质机进行均质,均质过程中的压力为50mpa,均质次数为5次,将均质后的产物灌装熔封后在121℃下高压灭菌15分钟,制得亚微乳剂。
[0066]
实施例4:亚微乳剂的制备
[0067]
一种蜂胶磷脂复合物亚微乳剂,按100ml计,包括以下组分:蜂胶磷脂复合物1.5g;大豆油10g;中链甘油三酯5g;大豆卵磷脂5g;吐温80 1g;泊洛沙姆188 1g;油酸钠1g;水加至100ml。
[0068]
一种亚微乳剂的制备方法,包括以下步骤:
[0069]
步骤一制备油相混合物:按配方量称取上述各组分,将蜂胶磷脂复合物、大豆油、中链甘油三酯加热至80℃溶解,制得油相混合物;
[0070]
步骤二制备水相混合物:将大豆卵磷脂、吐温80、泊洛沙姆188、油酸钠和水搅拌混合,加热至80℃溶解,制得水相混合物;
[0071]
步骤三制备亚微乳剂:将油相混合物加入至水相混合物中,采用分散机对油相混合物和水相混合物进行剪切分散,剪切分散的速度为10000转/分钟,剪切的时间为15分钟,加水定容至100ml,进一步采用均质机进行均质,均质过程中的压力为70mpa,均质次数为7次,将均质后的产物灌装熔封后在121℃下高压灭菌15分钟,制得亚微乳剂。
[0072]
对比例1
[0073]
称取蜂胶提取物原料药1.5g,加入7.5g的75%乙醇,超声30min,加水至100ml制得蜂胶口服液。
[0074]
对比例2
[0075]
蜂胶 大豆卵磷脂(物理混合物,1.5g 1.5g);大豆油7.5g;中链甘油三酯7.5g;大豆卵磷脂1.2g;吐温80 1.0g;泊洛沙姆188 1.0g;油酸钠0.03g;水加至100ml。按实施例2所述方法制备蜂胶亚微乳剂进行对比考察。
[0076]
效果实施例1产品效果测试
[0077]
1.测试蜂胶提取物(eep)、大豆卵磷脂(pc)、蜂胶磷脂复合物(eep
‑
pc)、蜂胶提取物与大豆卵磷脂物理混合物(eep pc)的xrd图谱。
[0078]
取eep、pc、实施例1制备的eep
‑
pc、eep pc在相同条件下测试xrd图谱,结果如图1所示。
[0079]
图1为本发明实施例1制得的蜂胶磷脂复合物的xrd(x射线衍射)图谱;从图1中可以看出,eep、pc均有两个较宽的衍射峰,表明eep、pc为无定形态。clp pc为两者图谱的叠加。而蜂胶磷脂复合物图谱中,仅有一个较宽的衍射峰。从图1中可以得知,实施例1制得的eep
‑
pc中eep与pc进行了复合。
[0080]
2.测试蜂胶提取物(eep)、大豆卵磷脂(pc)、蜂胶磷脂复合物(eep
‑
pc)、蜂胶提取物与大豆卵磷脂物理混合物(eep pc)的dsc(差示扫描量热法)曲线。
[0081]
dsc(差示扫描量热法)是筛选药物与辅料相容性的可靠方法,可提供有关药物与辅料之间相互作用的信息。
[0082]
取eep、pc、实施例1制备的eep
‑
pc、eep pc在相同条件下测试dsc(差示扫描量热法)曲线,结果如图2所示。
[0083]
图2为本发明实施例2制得的蜂胶磷脂复合物的dsc(差示扫描量热法)曲线;从图2中可以看出,eep在129.1、85.1、100.1℃有吸热峰,pc在149.5
‑
282.6℃呈现出较宽的吸热区域,eep pc基本上是eep与pc两者图谱叠加,在126.9、173.8、285.7℃有吸热峰,而蜂胶磷脂复合物图谱中,蜂胶提取物特征吸热峰消失,仅显示大豆卵磷脂部分吸热峰。从图2中可以得知,实施例1制得的蜂胶磷脂复合物中eep与pc进行了复合。
[0084]
效果实施例2长期稳定性测试
[0085]
取实施例2制得的亚微乳剂充氮封装于安瓿瓶中,在4℃避光和室温避光放置12个月,分别于第1个月、第3个月、第6个月、第12个月取样,考察亚微乳剂的含量(以蜂胶黄酮计,采用铝离子显色法测定)、平均粒径、ph值和包封率(以蜂胶黄酮计)、zeta电位、离心稳定性的变化情况。将考察结果和刚制备的亚微乳比较,考察亚微乳剂储存的稳定性,结果如表1和表2所示。
[0086]
表1:4℃避光稳定性测试
[0087]
时间(月)粒径(nm)phzeta电位(mv)含量(mg/ml)包封率(%)0172.65.66
‑
37.12.2690.21173.25.61
‑
37.52.3289.63172.45.55
‑
36.22.2188.86173.25.47
‑
35.92.2589.412174.85.40
‑
34.82.2787.5
[0088]
从表1可以看出,在4℃避光条件下,实施例2制得的亚微乳剂在4℃储存12个月,各指标无明显变化,表明稳定性良好。
[0089]
表2:室温避光稳定性测试
[0090]
时间(月)粒径(nm)phzeta电位(mv)含量(mg/ml)包封率(%)0173.85.67
‑
37.52.2889.91175.25.59
‑
35.82.2589.83174.35.43
‑
35.42.1890.36173.85.38
‑
34.22.2088.612175.75.34
‑
33.12.2187.1
[0091]
从表2可以看出,在室温避光条件下,实施例2制得的亚微乳剂在室温储存12个月,各指标无明显变化,表明稳定性良好。
[0092]
效果实施例3处方工艺对比测试
[0093]
将实施例2制备蜂胶亚微乳(1号样品)与对比例2制备蜂胶亚微乳(2号样品)对比考察。结果表明,1号样品外观均一,无悬浮物或沉淀,稳定性良好,蜂胶黄酮含量高于2mg/ml,包封率高于85%,可耐受热压灭菌且灭菌前后制剂外观保持一致。2号样品制备中,蜂胶提取物混悬于油相,亚微乳中肉眼可见沉淀生成,随着放置时间延长,沉淀量增大,经检测,蜂胶黄酮含量低于0.02mg/ml,包封率为13.1%,热压灭菌后乳剂破乳油水分层且无法复原。
[0094]
效果实施例4药效相关测试
[0095]
雄性大鼠随机分为3组(口服乳组(实施例2制得的亚微乳剂)、口服液组和淋巴阻断组组),所有的大鼠在给药前都禁食12个小时,自由饮水。每只雄性大鼠按照3ml/100g灌胃给药。对于淋巴阻断组,于灌胃给药1小时前腹腔注射3mg/kg环己酰亚胺溶液(可阻断药物经淋巴转运途径吸收,用以探讨口服乳经淋巴转运效率)。对对比例1口服液组和口服乳剂组(实施例2制得亚微乳剂),直接大鼠灌胃给药。在不同的设置时间点(5、10、15、20、30、45、60、80、100、120、180、240min),取出2ml的血液,3000r/min离心分离5分钟,吸取上层血浆,并进行测定白杨素、高良姜素(蜂胶主要药理活性成分)浓度,结果如图4所示。
[0096]
图4为本发明实施例2制得的亚微乳剂在血液中的白杨素、高良姜素浓度随时间变化图(图4中横坐标表示时间,单位:分钟,纵坐标表示白杨素、高良姜素的浓度,单位:mg/ml),图中曲线group1表示实施例2制得的亚微乳剂在血液中浓度与时间的关系,曲线group2表示对比例1制得的蜂胶口服液在血液中浓度与时间的关系,曲线group3表示乳糜微粒阻滞后,口服乳组在血液中浓度与时间的关系。
[0097]
从图4中可以看出,本发明实施例2制得的亚微乳剂在血液中的药效浓度明显高于对比例1制得的口服液组和淋巴阻断组的浓度,表明亚微乳剂型可显著提高蜂胶口服生物利用度,且可经淋巴转运途径吸收。
[0098]
效果实施例5本发明制得的亚微乳剂治疗效果研究。
[0099]
采用高糖高脂饮食结合链脲佐菌素对sd大鼠进行2型糖尿病大鼠造模,另设空白对照组大鼠,给予正常基础饲料喂养。
[0100]
造模成功的大鼠,按照fbg值随机分为4组分别给药,灌胃剂量为1ml/100g,每日两次。口服乳组灌胃给予本发明实施例2制备的亚微乳,口服液组给予本发明对比例1制得的蜂胶口服液。阳性药物组给予1mg/100g吡格列酮。对照组及模型组则给予等剂量羧甲基纤维素钠溶液,连续给药10周,期间治疗组及模型组给予高脂高糖饲料,对照组给予基础饲料。每两周测定空腹14小时血糖、于治疗第0、4、6、8取血测定血脂四项(总胆固醇ch、甘油三
酯tg、高密度脂蛋白hdl、低密度脂蛋白ldl)。于治疗第0、4、8周取血测定空腹胰岛素。
[0101]
空腹血糖测定结果如图5所示,备注:与模型组相比,*表示p<0.05,**表示p<0.01,***表示p<0.001。与口服液组相比,#表示p<0.05。从图5可以看出,本发明实施例2制得的亚微乳剂在降血糖效果上与阳性药物无明显差异,且在第4周与口服液存在显著性差异。
[0102]
空腹胰岛素测定结果如图6所示,备注:与口服乳组相比,*表示p<0.05,**表示p<0.01。与模型组相比,#表示p<0.05,##表示p<0.01,###表示p<0.001。从图6可以看出,本发明实施例2制得的亚微乳剂在第4周有较明显的降低空腹胰岛素作用,且与阳性药物组、口服液组存在显著性差异,表明口服乳相较于两者有更优越的降低胰岛素作用。
[0103]
血脂四项测定结果如图7a、b、c、d所示,备注:*表示p<0.05,**表示p<0.01,***表示p<0.001。
[0104]
从图7a可以看出,本发明实施例2制得的亚微乳剂、阳性药物在第6周起有较明显的降低tg作用,而口服液组仅在第10周表现出明显降低tg作用,表明口服乳组降低tg水平与阳性药物无明显差异。
[0105]
从图7b可以看出,本发明实施例2制得的亚微乳剂在第8周起有较显著的降ch效果,阳性药物在第6周起有较明显的降低ch作用;而口服液组仅在第10周表现出明显降低ch作用,表明相较于阳性药物组和口服乳组,口服液组降低ch水平较慢;阳性药物组和口服乳组两者效果无显著差异。
[0106]
从图7c可以看出,本发明实施例2制得的亚微乳剂及阳性药物组、口服液组在第8周起有较显著的降ldl效果,且口服乳组降低ldl水平显著高于口服液组,与阳性药物组无显著性差异。
[0107]
从图7d可以看出,阳性药物组在第8周起有显著升高hdl效果。结果表明,口服乳组在降低tg、ch、ldl水平与阳性药物无显著性差异。
[0108]
图中model表示模型组,pioglitazone表示阳性药物组,emulsion表示亚微乳剂组,eep或liquid表示口服液组,control表示对照组
[0109]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。