1.本技术实施例涉及生物技术领域,尤其涉及一种脱氧核糖寡核苷酸测序方法和试剂盒。
背景技术:
2.寡核苷酸是一类短链核苷酸的总称,寡核苷酸包括脱氧核糖核酸(deoxyribonucleic acid,dna)短链和核糖核酸(ribonucleic acid,rna)短链,长度一般在12-100核苷酸(nucleotide,nt)范围。其中,单链dna(single standard dna,ssdna)是分子生物学领域乃至整个生命科学领域的一个重要的研究对象。
3.在分子生物学研究中,dna的序列分析是进一步研究和改造目的基因的基础。目前主要的测序方法主要有桑格(sanger)-毛细管电泳法、焦磷酸测序法、边合成边测序法、连接测序和单分子测序法、纳米孔测序法等。但是,现有的测序方法的读长范围是有限的。
4.以上的测序方法还无法测定长度为150nt以内的脱氧核糖寡核苷酸或者长度为150碱基对(base pair,bp)以内的短片段dna序列。因此迫切需要一种通用的手段实现对脱氧核糖寡核苷酸进行测序。
技术实现要素:
5.本技术提供一种脱氧核糖寡核苷酸测序方法和试剂盒,可以对待测脱氧核糖寡核苷酸进行延长,使处理后的待测脱氧核糖寡核苷酸适用于现有的测序方法。
6.第一方面,提供了一种脱氧核糖寡核苷酸dna序列测序方法,该方法包括:通过t4连接酶,在第一dna序列的3’端连接通用标签接头序列,以获得预处理后的dna序列,其中,通用标签接头序列含有引物结合的序列,第一dna序列是长度小于150核苷酸nt的dna序列;对预处理后的dna序列进行测序。
7.在上述技术方案中,通过在第一dna序列的3’端连接带有引物结合序列的通用标签接头序列,使第一dna序列得到了延长,其长度符合现有的测序技术的要求,提高了脱氧核糖寡核苷酸测序的效率与准确性。
8.在一种可能的实现方式中,通过t4连接酶,在待测脱氧核糖寡核苷酸的3’端连接通用标签接头序列的第一反应体系包括:连接酶反应缓冲液0.8微升ul、通用标签接头序列0.8ul、t4连接酶0.2ul、水6.2ul,其中,该通用标签接头序列的含量是1-100微摩um。
9.可选地,通用标签接头序列的含量是10um。
10.在另一种可能的实现方式中,通用标签序列的3’端包括多个碱基组成的粘性末端,该通用标签接头序列的5’端的部分序列与该粘性末端内侧的部分序列互补。
11.在另一种可能的实现方式中,第一dna序列是通过末端转移tdt酶,在第二dna序列的3’端聚合多个重复碱基获得的序列,该多个重复碱基与通用标签接头序列的粘性末端互补,该第二dna序列是长度小于150nt的dna序列。
12.可选地,多个重复碱基的数量为3-5个重复碱基
13.聚合在第二dna序列3’端的多个重复碱基可以与通用标签接头序列的粘性末端互补,使得通用标签接头序列可以结合到第一dna序列上,有利于通用标签接头序列的连接。
14.在另一种可能的实现方式中,通过末端转移tdt酶,在第二dna序列的3’端聚合多个重复碱基的第二反应体系包括:反应缓冲液5ul、tdt酶0.5ul、碱基0.5ul、水19ul,其中,碱基的含量是10-500um,tdt酶的浓度是0.1-5毫克每毫升mg/ml。
15.可选地,碱基的含量是100um,tdt酶是鼠源重组tdt酶,tdt酶的浓度是1mg/ml。
16.在另一种可能的实现方式中,对预处理后的dna序列进行测序包括:
17.对预处理后的dna序列进行聚合酶链式反应pcr扩增;对pcr扩增的产物进行测序。
18.通用标签接头序列中含有引物结合序列,连接了通用标签接头序列的第一dna序列可以进行pcr扩增,并使用基于pcr扩增原理的测序方法进行测序,提高了测序的效率和准确性,降低了脱氧核糖寡核苷酸测序的成本。
19.第二方面,提供了一种试剂盒,包括:通用标签接头序列、t4连接酶、t4连接酶反应缓冲液以及水;其中,通用标签接头序列含有引物结合的序列;所述t4连接酶用于在第一反应体系中将第一dna序列的3’端连接所述通用标签接头序列,其中,所述第一dna序列是长度小于150核苷酸nt的dna序列,所述第一反应体系包括所述通用标签接头序列、所述t4连接酶、所述t4连接酶反应缓冲液和所述水。
20.通过在第一dna序列的3’端连接带有引物结合序列的通用标签接头序列,使第一dna序列得到了延长,其长度符合现有的测序技术的要求,提高了脱氧核糖寡核苷酸测序的效率与准确性。
21.在另一种可能的实现方式中,所述通用标签接头序列为40ul,所述t4连接酶为10ul,所述t4连接酶反应缓冲液40ul以及所述水2ml。
22.在一种可能的实现方式中,通用标签序列的含量为10um,t4连接酶的浓度为20单位每微升u/ul。
23.在另一种可能的实现方式中,通用标签接头序列的3’端包括多个碱基组成的粘性末端,通用标签接头序列的5’端的部分序列与粘性末端内侧的部分序列互补。
24.在另一种可能的实现方式中,该试剂盒还包括:tdt酶25ul、tdt酶反应缓冲液250ul以及碱基25ul;其中,tdt酶用于在第二dna序列的3’端聚合多个重复碱基,以获得第一dna序列,所述多个重复碱基与所述通用标签接头序列的粘性末端互补,第二dna序列是长度小于150nt的dna序列;tdt酶反应缓冲液用于维持第二反应体系的酸碱度的稳定,该第二反应体系用于在第一dna序列的3’端聚合多个重复碱基的反应的进行,该第二反应体系包括:tdt酶、tdt酶反应缓冲液、碱基和水;碱基用于聚合在第一dna序列的3’端以获得第二dna序列;水还用于配置第二反应体系。
25.聚合在第二dna序列3’端的多个重复碱基可以与通用标签接头序列的粘性末端互补,使得通用标签接头序列可以结合到第一dna序列上,有利于通用标签接头序列的连接。
26.可选地,tdt酶的浓度为1mg/ml,碱基的含量为100um。
附图说明
27.图1是本技术一实施例的脱氧核糖寡核苷酸测序方法的流程示意图。
28.图2是本技术一实施例的脱氧核糖寡核苷酸预处理方法的流程示意图。
29.图3是本技术一实施例的待测脱氧核糖寡核苷酸3’端添加碱基的示意图。
30.图4是本技术一实施例的通用标签接头序列的示意图。
31.图5是本技术一实施例的脱氧核糖寡核苷酸与通用标签接头序列连接的示意图。
32.图6是本技术一实施例的单引物pcr扩增的示意图。
33.图7是本技术一实施例的双引物pcr扩增的示意图。
34.图8是本技术一实施例的脱氧核糖寡核苷酸测序结果。
35.图9是本技术另一实施例的脱氧核糖寡核苷酸测序结果。
36.图10是本技术另一实施例的脱氧核糖寡核苷酸测序结果。
37.图11是本技术另一实施例的脱氧核糖寡核苷酸测序结果。
具体实施方式
38.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本技术的一部分实施例,而不是全部实施例。
39.由于本技术实施例涉及分子生物学技术的的应用,为了便于理解,下面先对本技术实施例可能涉及的分子生物学的相关术语和概念进行介绍。
40.(1)寡核苷酸
41.寡核苷酸(oligonucleotide),是一类只有50个以下碱基的短链核苷酸的总称,寡核苷酸包括脱氧核糖核酸(deoxyribonucleic acid,dna)短链和核糖核酸(ribonucleic acid,rna)短链。寡核苷酸可以很容易地和它们的互补链对接,所以常用来作为探针确定dna或rna的结构,经常用于基因芯片、电泳、荧光原位杂交等过程中。
42.本技术实施例的寡核苷酸是指合成的或天然的分子,其包含在100个以内的核苷酸范围内的共价连接的核苷酸序列,所述核苷酸通过在一个核苷酸的戊糖的3’位置与相邻核苷酸的戊糖的5’位置之间的磷酸二酯键接合。
43.(2)脱氧核糖核酸
44.脱氧核糖核酸(deoxyribonucleic acid,dna)是生物细胞内含有的四种生物大分子之一核酸的一种。dna携带有合成rna和蛋白质所必需的遗传信息,是生物体发育和正常运作必不可少的生物大分子。dna由脱氧核苷酸组成的大分子聚合物。脱氧核苷酸由碱基、脱氧核糖和磷酸构成。其中碱基有4种:腺嘌呤(a)、鸟嘌呤(g)、胸腺嘧啶(t)和胞嘧啶(c)。dna分子结构中,两条多脱氧核苷酸链围绕一个共同的中心轴盘绕,构成双螺旋结构。脱氧核糖-磷酸链在螺旋结构的外面,碱基朝向里面。两条多脱氧核苷酸链反向互补,通过碱基间的氢键形成的碱基配对相连,形成相当稳定的组合。
45.(3)核糖核酸
46.核糖核酸(ribonucleic acid,rna)是存在于生物细胞以及部分病毒、类病毒中的遗传信息载体。rna由核糖核苷酸经磷酸二酯键缩合而成长链状分子。一个核糖核苷酸分子由磷酸,核糖和碱基构成。rna的碱基主要有4种:腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、尿嘧啶(u),其中,尿嘧啶(u)取代了dna中的胸腺嘧啶(t)。
47.(4)碱基对
48.碱基对(base pair,bp)是形成dna、rna单体以及编码遗传信息的化学结构。组成碱基对的碱基包括a、g、t、c、u。严格地说,碱基对是一对相互匹配的碱基(即a-t,g-c,a-u相
互作用)被氢键连接起来。然而,它常被用来衡量dna和rna的长度(尽管rna是单链)。它还与核苷酸互换使用,尽管后者是由一个五碳糖、磷酸和一个碱基组成。
49.(5)核苷酸
50.核苷酸(nucleotide,nt)是一类由嘌呤碱或嘧啶碱基、核糖或脱氧核糖以及磷酸三种物质组成的化合物,又称核甙酸。五碳糖与有机碱合成核苷,核苷与磷酸合成核苷酸,4种核苷酸组成核酸。核苷酸主要参与构成核酸,许多单核苷酸也具有多种重要的生物学功能,如与能量代谢有关的三磷酸腺苷(adenosine triphosphate,atp)、脱氢辅酶等。某些核苷酸的类似物能干扰核苷酸代谢,可作为抗癌药物。根据糖的不同,核苷酸有核糖核苷酸及脱氧核苷酸两类。根据碱基的不同,又有腺嘌呤核苷酸(adenosine monophosphate,amp)、鸟嘌呤核苷酸(guanosine monophosphate,gmp)、胞嘧啶核苷酸(cytidine monophosphate,cmp)、尿嘧啶核苷酸(urid ylic acid,ump)、胸腺嘧啶核苷酸(thymidine,tmp)及次黄嘌呤核苷酸(inosinemonphosphate,imp)等。核苷酸中的磷酸又有一分子、两分子及三分子几种形式。此外,核苷酸分子内部还可脱水缩合成为环核苷酸。
51.(6)单链dna
52.大部分dna以双螺旋结构存在,但一经热或碱处理就会变为单链状态。单链dna(single standard dna,ssdna)就是指以这种状态存在的dna。单链dna在分子流体力学性质、吸收光谱、碱基反应性质等方面都和双链dna不同。某些噬菌体粒子内含有单链环状的dna,这样的噬菌体dna在细胞内增殖时则形成双链dna。
53.(7)t4 dna连接酶(以下简称“t4连接酶”)
54.t4连接酶(t4 dna ligase)可以催化粘端或平端双链dna或rna的5’磷酸(5
’-
p)末端(以下简称“5’端”)和3’羟基(3
’-
oh)末端(以下简称“3’端”)之间以磷酸二酯键结合,该催化反应需atp作为辅助因子。同时t4 dna连接酶可以修补双链dna、双链rna或dna/rna杂合物上的单链缺口。
55.(8)多聚物序列
56.多聚物(poly)序列指同一个碱基的重复序列,例如polya序列指多个碱基a的重复序列;polyt序列指多个碱基t的重复序列;polyc序列指多个碱基c的重复序列;polyg序列指多个碱基g的重复序列。
57.(9)脱氧核糖核苷三磷酸
58.每个脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dntp)由磷酸基团(p),脱氧核糖和含氮碱基(n)组成,根据含氮碱基的不同,dntp包括datp、dgtp、dctp和dttp。在生物dna合成中,以及各种pcr中起原料作用。
59.(10)末端转移酶
60.末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyi transferase,tdt),简称末端转移酶),是从动物(通常是牛)胸腺和骨髓中分离提取的。
61.末端转移酶催化脱氧核苷酸添加到dna分子的3’端,催化作用不需要模板,但需co2 的存在。末端转移酶可给一群dna分子的3’端接上碱基a,或者碱基c,或者碱基g,或者碱基t。
62.(11)聚合酶链式反应
63.聚合酶链式反应(polymerase chain reaction,pcr)是一种用于放大扩增特定的
dna片段的分子生物学技术,它可看作是生物体外的特殊dna复制,pcr的最大特点是能将微量的dna大幅增加。pcr是利用dna在体外摄氏95
°
高温时变性会变成单链,低温(经常是60℃左右)时引物与单链按碱基互补配对的原则结合,再调温度至dna聚合酶最适反应温度(72℃左右),dna聚合酶沿着磷酸到五碳糖(5'-3')的方向合成互补链。
64.(12)taq dna聚合酶
65.taq dna聚合酶(以下简称“taq酶”)是一种具有热稳定性的dna聚合酶。可以以dna为模板,以结合在特定dna模板上的引物为出发点,将四种脱氧核苷酸以watson—crick配对的方式按5'端到3'端方向沿模板顺序合成新的dna链。此酶能耐高温,在70℃反应2小时后其残留活性大于原来的90%,在93℃下反应2小时后其残留活性是原来的60%,在95℃下反应2小时后其残留活性是原来的40%;在分子克隆中taq酶可用于dna序列测定并可利用pcr对dna的特定片段进行体外扩增。在pcr过程中,由于taq dna聚合酶在变性步骤中(约94℃)不失活,可直接进入第二轮循环,因此不必每轮循环时重新加入新酶,这使得taq酶成为pcr反应中的独特用酶。
66.目前主要的dna测序方法有桑格(sanger)-毛细管电泳法、焦磷酸测序法、边合成边测序法、连接测序和单分子测序法、纳米孔测序法等。现有的测序方法的测序原理是基于单引物扩增的pcr,需要引物与聚合酶的帮助。这些测序方法的读长范围是有限的。
67.例如,桑格-毛细管电泳法主要用于长度在600-1000nt的dna测序;焦磷酸测序法主要用于长度在230-400nt的dna测序;边合成边测序法主要用于长度为150nt左右的dna测序;连接测序和单分子测序法主要用于长度为1000-3000nt的dna测序;纳米孔测序法主要用于长度大于500nt的dna分子的测序。
68.由于目前测序技术的局限性,紧靠测序引物一侧的30-50bp通常无法100%被识别。寡核苷酸链长度较短,引物序列占了待测寡核苷酸链较大的一部分,因此现有的测序技术无法对寡核苷酸链进行准确的测序。因此以上的基于pcr扩增原理的测序技术无法对长度为150nt以内的脱氧核糖寡核苷酸进行准确高效的测序。
69.为了实现对寡核苷酸的测序,通常采用基于分子量的技术推测碱基序列。例如,基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,maldi-tof-ms)法对待测样品使用外切酶进行处理,从待测样品上切除一个碱基,通过对比原始样品和经过外切酶处理后的样品的分子量,确定本次切除的是哪种碱基,从而依次推测寡核苷酸的序列。使用maldi-tof-ms测序时,样品样品需要酶切前期处理且质谱检测前需要脱盐,样品消耗量大(灵敏度低),操作麻烦,通量低,价格昂贵。
70.再如,可以使用化学降解法进行寡核苷酸测序。化学降解法利用几个具有碱基专一性的化学切断反应将单个末端被磷32(32p)标记的寡核苷酸分子进行部分切断,产生几组从标记末端到寡核苷酸分子中与碱基专一性反应相应的碱基的各个位点的长短不同的片段。这几组片段在凝胶电泳中从同样的起点按链长被分开,对凝胶进行放射自显影后就可以得到代表每个碱基位置的带谱,从这个带谱可以直接读出从标记末端向另一个末端方向的碱基序列。然而化学降解法的操作繁琐且费时,尤其是对寡核苷酸分子的末端进行核素标记效率较低,造成后续的放射自显影需要较长的曝光时间。
71.为了提高寡核苷酸分子测序的效率和准确性,本技术提供一种脱氧核糖寡核苷酸
的测序方法,对待测脱氧核糖寡核苷酸进行延长,使得处理后的脱氧核糖寡核苷酸满足现有的基于pcr扩增原理的测序技术的要求。
72.本技术实施例中,待测脱氧核糖寡核苷酸可以是ssdna,例如:基因拼接的片段、同源重组供体片段、规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,crispr)系统供体片段、体外转录片段、血液中的循环肿瘤dna(circulating tumor dna,ctdna)等。
73.下面结合图1至图11详细介绍本技术实施例的脱氧核糖寡核苷酸测序方法。
74.图1是本技术一实施例的脱氧核糖寡核苷酸(例如,下文所述的ssdna)的测序方法的流程示意图。应理解,图1示出了脱氧核糖寡核苷酸测序方法的步骤或操作,但这些步骤或操作仅是示例,本技术实施例还可以执行其他操作或者图1中的各个操作的变形。
75.在执行步骤s110的对脱氧核糖寡核苷酸的预处理操作之前,为了对本技术实施例的脱氧核糖寡核苷酸测序方法进行验证,可以在待测ssdna的3’端末尾添加不同的碱基,合成不同的脱氧核糖寡核苷酸分子作为测序的样本。
76.寡核苷酸分子的合成可以包括以下步骤:
77.(1)寡核苷酸分子连接链霉亲和素磁珠
78.a、取100微升(ul)磁珠(invitrogen,dynabeads myone streptavidin t1,10毫克每毫升(mg/ml))于1.5ml微型离心(eppendorf,ep)管中,放置磁力架上,磁性分离,弃去上清液,用缓冲液(10mm ph7.5 tris-hcl,1mm edta,1m nacl,0.1%tween-20)洗涤3次,磁性分离,移去上清液。
79.b、往磁珠中加入180ul待测序序列,待测序列的含量为10微摩(um)。再加入1000ul缓冲液,充分振荡重悬磁珠。将ep管至于旋转混合仪中,室温旋转3小时。
80.其中,待测ssdna的5’端经过了生物素(biotin)修饰,磁珠上的链霉亲和素可以与待测序列5’端的生物素相结合,将待测序列连接到磁珠上。
81.c、磁性分离,用缓冲液洗涤3次,用500ul缓冲液重悬,分装20管,其中每管0.05毫克(mg)磁珠,置于4℃备用。
82.在上述步骤中,将待测序列连接在了磁珠上,在后续的处理中,收集磁珠即可得到连接在磁珠上的待测序列,便于收集反应产物。
83.(2)待测寡核苷酸分子3’端添加碱基,合成不同序列的寡核苷酸分子。
84.在待测寡核苷酸分子3’端添加的碱基包括:添加修饰碱基和正常碱基。
85.i、添加修饰碱基(3
’-
o-n3-dgtp)
86.a、构建修饰碱基反应体系10ul,各试剂的剂量以及处理时间如下:
87.表1
88.试剂剂量反应缓冲液(reaction buffer)*52ul鼠源重组表达tdt(mouse tdt wt)0.1ul3
’-
o-n3-dgtp1ul水(h2o)6.9ul
89.将上述反应体系在25℃条件下持续反应1小时。
90.其中,“反应缓冲液*5”表示反应缓冲液是5倍的母液,在反应体系中稀释成1倍使
用。
91.在一些实施例中,鼠源重组表达tdt的浓度可以是0.1-5mg/ml。可选地,鼠源重组表达tdt的浓度可以为1mg/ml。
92.在一些实施例中,3
’-
o-n3-dgtp的含量可以是2-100毫摩(mm)。可选地,3
’-
o-n3-dgtp的含量可以为20mm。
93.应理解,在一些实施例中,修饰碱基也可以是3
’-
o-n3-datp,或者3
’-
o-n3-dctp,或者3
’-
o-n3-dttp,或者上述四种修饰碱基中任意至少两种修饰碱基的混合物,本技术实施例对此不作限定。
94.在这个步骤中,当修饰碱基结合到已有的待测序列后,其他碱基无法再结合到修饰碱基之后,反应将停止,有利于控制反应进程。
95.b、水洗磁珠三次。
96.c、三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)处理1-2小时。
97.在一些实施例中,tcep的含量可以是5-200mm。可选地,tcep的含量可以是50mm。
98.tcep是一种还原剂,经过tcep处理后,待测序列末尾的修饰碱基将变成正常碱基,其后可以继续结合正常碱基。
99.d、水洗磁珠3次。
100.e、按照添加碱基的需求,重复步骤a-d。
101.通过修饰碱基的结合以及对修饰碱基进行还原处理,可以根据需要控制反应的进行,避免了合成寡核苷酸分子的过程失控。
102.ii、添加正常碱基
103.a、构建正常碱基反应体系50ul,各试剂的剂量以及处理时间如下:
104.表2
105.试剂剂量反应缓冲液(reaction buffer)*510ul鼠源重组表达tdt(mouse tdt wt)4ul三磷酸腺苷双磷酸酶(apyrase)5mu脱氧核糖核苷三磷酸(dntp)4ul水(h2o)32ul
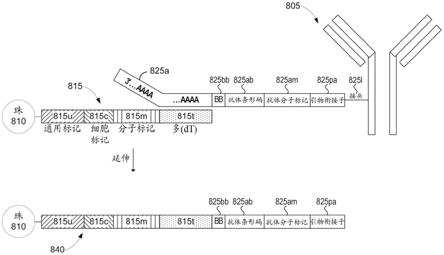
106.将上述反应体系在25℃条件下持续反应1分钟。
107.其中,“反应缓冲液*5”表示反应缓冲液是5倍的母液,在反应体系中稀释成1倍使用。
108.其中,脱氧核糖核苷三磷酸(dntp)是datp、dgtp、dctp以及dttp中的至少一种。例如,在一些实施例中,dntp可以datp;在另一些实施例中,dntp是dgtp和dctp的混合物;在另一些实施例中,dntp是dgtp、dctp以及dttp的混合物,本技术实施例对此不作限定。
109.在一些实施例中,鼠源重组表达tdt的浓度可以是0.1-5mg/ml。可选地,鼠源重组表达tdt的浓度可以为1mg/ml。
110.在一些实施例中,dntp的含量可以是10-500mm。可选地,dntp的含量可以为100mm。
111.b、水洗磁珠3次。
112.c、按照添加碱基的需求,重复步骤a-b。
113.以上是本技术实施例的脱氧核糖寡核苷酸的测序方法中合成寡核苷酸分子的步骤。应理解,上述步骤中合成不同的寡核苷酸分子是为了对本技术实施例提供的脱氧核糖寡核苷酸链测序方法进行验证,在实际的应用中,可以不执行上述步骤,直接对待测的脱氧核糖寡核苷酸进行以下步骤的预处理以及测序工作。
114.在本技术实施例中,待测脱氧核糖寡核苷酸序列或待测ssdna也可以称为第二dna序列。
115.s110,对脱氧核糖寡核苷酸分子进行预处理。
116.图2是脱氧核糖寡核苷酸分子的预处理流程示意图。应理解,图2示出了脱氧核糖寡核苷酸测序预处理方法的步骤或操作,但这些步骤或操作仅是示例,本技术实施例还可以执行其他操作或者图2中的各个操作的变形。
117.s210,待测脱氧核糖寡核苷酸分子3’端聚合多个重复碱基。
118.本技术实施例对3’端聚合的多个碱基的种类不作限定。
119.例如,在一些实施例中,在待测脱氧核糖寡核苷酸分子(例如,第二dna序列)的3’端聚合多个碱基c;在一些实施例中,在待测脱氧核糖寡核苷酸分子的3’端聚合多个碱基a;在一些实施例中,在待测脱氧核糖寡核苷酸分子的3’端聚合多个碱基g;在一些实施例中,在待测脱氧核糖寡核苷酸分子的3’端聚合多个碱基t。
120.在一些实施例中,可以在待测脱氧核糖寡核苷酸分子的3’端聚合的3-5个重复碱基。
121.在待测脱氧核糖寡核苷酸的3’端聚合多个重复碱基便于操作,也便于通用标签接头序列的设计。在待测脱氧核糖寡核苷酸3’端聚合的多个重复碱基可以与通用标签接头序列的粘性末端互补,使得通用标签接头序列结合到待测脱氧核糖寡核苷酸上,便于通用标签接头序列的连接。
122.示例性地,以在3’端聚合多个碱基c为例,介绍本技术实施例的脱氧核糖寡核苷酸分子的预处理流程。
123.在本技术实施例中,用于在第二dna序列的3’端聚合多个重复碱基的反应体系也可以称为第二反应体系。
124.首先构建反应体系(第二反应体系)25ul,各试剂的剂量以及处理时间如下:
125.表3
126.试剂剂量反应缓冲液(reaction buffer)*55ul鼠源重组表达tdt(mouse tdt wt)0.5uldctp0.5ul水(h2o)19ul
127.其中,“反应缓冲液*5”表示反应缓冲液是5倍的母液,在反应体系中稀释成1倍使用。
128.将0.05mg磁珠加入上述反应体系中,在25℃环境下反应30秒,立即用磁力架收集磁珠。
129.在一些实施例中,dctp含量可以是10-500微摩(um)。可选地,dctp的含量可以为100um。
130.在一些实施例中,鼠源重组表达tdt的浓度可以是0.1-5mg/ml。可选地,鼠源重组表达tdt的浓度可以为1mg/ml。
131.图3是本技术一实施例的待测脱氧核糖寡核苷酸分子的3’端聚合多个碱基c示意图,如图所示,待测脱氧核糖寡核苷酸分子是一个ssdna,该ssdna的3’端聚合了3个碱基c。
132.在本技术实施例中,3’端聚合了多个重复碱基后的第二dna序列也可以称为第一dna序列。
133.s220,连接通用标签接头序列。
134.本技术实施例的通用标签接头序列是一段含有引物结合序列的标签序列。
135.在3’端聚合了多个重复碱基的待测脱氧核糖寡核苷酸(例如,第一dna序列)的3’端连接通用标签接头序列可以得到预处理后的序列。
136.该通用标签接头序列的3’端为粘性末端。
137.在一些实施例中,该粘性末端可以与在步骤s210中ssdna的3’端结合的多个碱基互补。例如,该通用标签接头序列的粘性末端为多个碱基g,那么步骤s210中,在ssdna的3’端结合多个碱基c。再如,该通用标签接头序列的粘性末端为多个碱基t,那么在步骤s210中ssdna的3’端结合多个碱基a。
138.粘性末端可以与待测ssdna的3’端添加多个重复碱基的序列互补形成双链,便于通用标签接头序列与待测ssdna进行连接。
139.在一些实施例中,通用标签接头序列的5’端的部分序列与粘性末端内侧的部分序列互补。
140.示例性地,当步骤s210中在ssdna的3’端添加了3个碱基c时,相应的,一个通用标签接头序列从5’端到3’端的序列可以是:
141.(5’)agatcggaagagcacacgtctgaactccagtcacttccgatctggg(3’)
142.其中,3’端的序列“ggg”为该标序列的粘性末端,可以与ssdna的3’端添加的“ccc”互补。该标签序列5’端的序列“agatcggaa”可以与粘性末端内侧的序列“ttccgatct”互补。
143.图4是本技术一实施例的通用标签接头序列的示意图。
144.如图4所示,该通用标签的5’端的部分序列与粘性末端内侧的部分序列互补,形成部分双链的结构,并将粘性末端暴露出来。两端互补的序列之间的序列不能互补,形成环状的结构。
145.下面介绍第一dna序列与通用标签接头序列的连接方法。
146.在本技术实施例中,用于将第一dna序列与通用标签序列连接的反应体系也可以称为第一反应体系。
147.首先构建反应体系(第一反应体系)8ul,各试剂的剂量以及处理时间如下:
148.表4
149.试剂剂量连接酶反应缓冲液(ligase buffer)*100.8ul通用标签接头序列0.8ult4连接酶0.2ul水(h2o)6.2ul
150.其中,“连接酶反应缓冲液*10”表示连接酶反应缓冲液是10倍的母液,在反应体系
中稀释成1倍使用。
151.将磁珠加入上述反应体系中,在16℃的环境下反应至少30分钟。
152.在一些实施例中,通用标签接头序列的含量可以是1-100um。可选地,通用标签接头序列的含量可以是10um。
153.图5是本技术一实施例的第一dna序列与通用标签接头序列连接的示意图。
154.如图5所示,在一些实施例中,在待测ssdna(第二dna序列)的3’端连接了重复碱基“ccc”。通用标签接头序列具有可以和重复序列“ccc”互补的粘性末端“ggg”,并且通用标签接头序列的5’端的部分序列与粘性末端内侧的部分序列可以互补。
155.在连接的过程中,通用标签接头序列的粘性末端“ggg”与待测ssdna的3’端添加的“ccc”互补配对,形成一段双链。t4连接酶连接了通用标签接头序列5’端与重复碱基“ccc”3’端的的缺口。在t4连接酶的作用下,通用标签接头序列与第一dna序列相连接。
156.经过步骤s110的预处理,待测脱氧核糖寡核苷酸分子得到了延长,并且延长的一端序列中有引物序列可以结合的序列,使得延长后的寡核苷酸分子可以用现有的基于pcr扩增原理的测序技术进行测序,提高了测序的效率与准确性。
157.s120,对预处理后的dna序列进行测序。
158.经过步骤s110的预处理,待测脱氧核核糖寡核苷酸分子得到了延长,并且在延长部分的通用标签接头序列中,有引物可以结合的序列,因此可以使用现有的测序技术进行测序。例如,可以使用sanger测序法对经过预处理的待测脱氧核糖寡核苷酸链进行测序。
159.sanger测序法是基于pcr扩增原理的测序技术。首先对预处理后的序列进行pcr扩增。
160.在一些实施例中,可以使用单引物扩增技术实现对待测序列的扩增。
161.在使用单引物扩增的情况下,构建pcr反应体系,各试剂的剂量如下:
162.表5
163.试剂剂量taq酶反应缓冲液(reaction buffer)*101uldntp0.2ultaq酶0.2ul引物-r0.2ul水(h2o)8.2ul
164.其中,“taq酶反应缓冲液*10”表示taq酶反应缓冲液是10倍的母液,在反应体系中稀释成1倍使用。
165.pcr程序如下:
[0166][0167]
图6是本技术一实施例的单引物pcr扩增过程示意图。
[0168]
示例性地,通用标签接头序列从5’端到3’端的序列为:
[0169]
(5’)agatcggaagagcacacgtctgaactccagtcacttccgatctggg(3’)
[0170]
引物-r可以与通用标签接头序列上的部分序列互补形成双链,因此在一些实施例中,引物-r的序列从5’端到3’端可以设计为:
[0171]
(5’)gtgactggagttcagacgtg(3’)
[0172]
如图6所示,在pcr扩增的过程中,高温下,通用标签接头序列互补形成双链的部分将解开。引物-r可以与通用标签接头序列的部分序列互补形成双链,在tap酶的作用下,将在引物-r的基础上,以经过预处理延长的ssdna作为复制模板,得到与经过延长预处理的ssdna互补的新的ssdna。
[0173]
如图6所示的复制过程,经过多个循环,可以得到大量与经过延长预处理的ssdna互补的新的ssdna。在后续的步骤中,对与预处理后的ssdna互补的ssdna进行测序,再依据碱基互补原则,可以得到待测ssdna的序列。
[0174]
在一些实施例中,可以使用双引物扩增技术实现对待测序列的扩增。
[0175]
在使用双引物扩增的情况下,构建pcr反应体系,各试剂的剂量如下:
[0176]
表6
[0177]
试剂剂量taq酶反应缓冲液(reaction buffer)*101uldntp0.2ultaq酶0.2ul引物-r0.2ul引物-f0.2ul水(h2o)8.2ul
[0178]
其中,“taq酶反应缓冲液*10”表示taq酶反应缓冲液是10倍的母液,在反应体系中稀释成1倍使用。
[0179]
其中,引物-r的序列与通用标签接头序列的部分序列互补;引物-f的序列与待测ssdna的部分序列相同。
[0180]
pcr程序如下:
[0181][0182]
图7是本技术一实施例的双引物pcr扩增过程示意图。
[0183]
示例性地,通用标签接头序列从5’端到3’端的序列为:
[0184]
(5’)agatcggaagagcacacgtctgaactccagtcacttccgatctggg(3’)
[0185]
引物-r可以与通用标签接头序列上的部分序列互补形成双链,因此在一些实施例中,引物-r的序列从5’端到3’端可以设计为:
[0186]
(5’)gtgactggagttcagacgtg(3’)
[0187]
示例性地,待测ssdna有部分已知序列,从5’端到3’的已知序列为:
[0188]
(5’)ctacactctttccctacacgac(3’)
[0189]
因此,引物-f的序列从5’端到3’端可以设计为:
[0190]
(5’)ctacactctttccctacacgac(3’)
[0191]
如图7所示,在pcr扩增的过程中,高温下,通用标签接头序列互补形成双链的部分将解开。在第一次扩增中,引物-r可以与通用标签接头序列的部分序列互补形成双链,在tap酶的作用下,将在引物-r的基础上,以经过预处理延长的ssdna作为复制模板,得到与经过延长预处理的ssdna互补的新的ssdna。
[0192]
在之后的扩增中,在第一次扩增中得到的复制链可以作为后续复制的模板,由于复制链的部分序列与ssdna互补,并且引物f的序列与ssdna部分的部分序列相同,因此引物-f的序列与复制链的部分序列互补,可以形成双链。在引物-f的基础上,以第一次扩增得到的复制链为模板,形成新的复制链。
[0193]
在之后的扩增中,第一次扩增中的模板链仍然可以作为模板链。引物-r与通用标签接头序列的部分序列互补形成双链,在引物-r的基础上,以模板链作为复制的模板,形成新的复制链。
[0194]
如图7所示的复制过程,经过多个循环,可以得到大量与经过延长预处理的ssdna互补的新的ssdna和与经过延长处理的ssdna相同的ssdna。在后续的步骤中,对与预处理后的ssdna互补的ssdna进行测序,再依据碱基互补原则,可以得到待测ssdna的序列。也可以直接对经过延长预处理的待测ssdna进行测序,得到待测ssdna的序列。
[0195]
经过上述pcr扩增过程,得到了大量与经过预处理的待测ssdna相同或互补的ssdna,可以回收pcr反应的产物,交给测序公司进行测序。
[0196]
在一些实施例中,可以将pcr反应产物连接克隆载体(cloning vector),并将连接载体后的产物转入大肠杆菌,再送测序公司测序。
[0197]
具体步骤如下:
[0198]
a、连接载体。
[0199]
示例性地,连接的克隆载体可以是peasy-t1克隆载体。连接体系如下:
[0200]
表7
[0201]
试剂剂量pcr产物3ul克隆载体(peasy-t1)1ul
[0202]
将上述连接体系在25℃环境下处理10分钟,得到反应产物。
[0203]
b、将反应产物导入大肠杆菌top10感受态细胞。
[0204]
c、筛选阳性克隆送测序公司测序。
[0205]
在上述步骤中,以sanger测序为例介绍了本技术实施例的脱氧核糖寡核苷酸的预处理与测序方法。应理解,待测脱氧核糖寡核苷酸经过本技术实施例的预处理方法进行预处理后,还可以使用其他基于pcr扩增原理的测序方法进行测序,本技术实施例对此不做限定。
[0206]
以上,结合图1至图7详细介绍了本技术实施例的脱氧核糖寡核苷酸预处理方法和测序方法。图8至图11是脱氧核糖寡核苷酸测序结果。
[0207]
图8是待测ssdna序列的3’端添加碱基“ccc”后的测序结果。如图8所示,图中波形的每个最高峰的位置代表每个碱基的位置,四种不同的颜色代表四种碱基。从图8中可以读
出待测ssdna的序列为:
[0208]“tttccctacacgacgctcttccgatctacgtactgag”,并且待测ssdna的末尾添加的碱基“ccc”也可以被测出。
[0209]
应理解,为了更清楚地展示测序结果,图8仅给出了待测ssdna和在待测ssdna尾部添加的碱基的测序结果,在上述预处理以及测序步骤中连接的克隆载体以及通用标签接头序列的测序结果没有进行展示。
[0210]
图9是待测ssdna序列的3’端添加碱基“gcccc”后的测序结果。如图9所示,图中波形的每个最高峰的位置代表每个碱基的位置,四种不同的颜色代表四种碱基。从图9中可以读出待测ssdna的序列为:
[0211]“tttccctacacgacgctcttccgatctacgtactgag”,并且待测ssdna的末尾添加的碱基“gcccc”也可以被测出。
[0212]
应理解,为了更清楚地展示测序结果,图9仅给出了待测ssdna和在待测ssdna尾部添加的碱基的测序结果,在上述预处理以及测序步骤中连接的克隆载体以及通用标签接头序列的测序结果没有进行展示。
[0213]
图10是待测ssdna序列的3’端添加碱基“ggcccc”后的测序结果。如图10所示,图中波形的每个最高峰的位置代表每个碱基的位置,四种不同的颜色代表四种碱基。从图10中可以读出待测ssdna的序列为:
[0214]“tttccctacacgacgctcttccgatctacgtactgag”,并且待测ssdna的末尾添加的碱基“ggcccc”也可以被测出。
[0215]
应理解,为了更清楚地展示测序结果,图10仅给出了待测ssdna和在待测ssdna尾部添加的碱基的测序结果,在上述预处理以及测序步骤中连接的克隆载体以及通用标签接头序列的测序结果没有进行展示。
[0216]
图11是待测ssdna序列的3’端添加碱基“a-t-g-c”序列后的测序结果。如图11所示,图中波形的每个最高峰的位置代表每个碱基的位置,四种不同的颜色代表四种碱基。从图11中可以读出待测ssdna的序列为:
[0217]“tttccctacacgacgctcttccgatctacgtactgag”,并且待测ssdna的末尾添加的碱基“ttaaaaaaaaggcccccccccc”也可以被测出。
[0218]
应理解,为了更清楚地展示测序结果,图11仅给出了待测ssdna和在待测ssdna尾部添加的碱基的测序结果,在上述预处理以及测序步骤中连接的克隆载体以及通用标签接头序列的测序结果没有进行展示。
[0219]
本技术实施例的脱氧核糖寡核苷酸测序方法通过给待测脱氧核糖寡核苷酸连接一个含有引物结合序列的通用标签接头序列,将待测脱氧核糖寡核苷酸序列进行延长,使得预处理后的脱氧核糖寡核苷酸适用于现有的基于pcr扩增原理的测序方法,提高了测序的效率和测序结果的准确性。
[0220]
本技术实施还提供一种试剂盒,可以对待测ssdna(例如,第二dna序列)进行预处理,实现待测ssdna的延长,使处理后的ssdna符合测序的要求。
[0221]
试剂盒的组成如下:
[0222]
表8
[0223]
产品组成含量
通用标签接头序列10um,40ult4连接酶20u/ul,10ult4连接酶反应缓冲液10x,40ultdt酶1mg/ml,25ultdt酶反应缓冲液5x,250uldntps(datp,dttp,dgtp,dctp)100um,25ul水(h2o)2ml
[0224]
其中,“t4连接酶反应缓冲液10x”表示试剂盒中的t4连接酶反应缓冲液是由10倍的母液稀释成的1倍的反应缓冲液;
[0225]“tdt酶反应缓冲液5x”表示试剂盒中的tdt酶反应缓冲液是由5倍的母液稀释成的1倍的反应缓冲液。
[0226]
上述试剂盒中个产品的含量是使用50次的产品的含量。
[0227]
使用本技术实施例的试剂盒对待测脱氧核糖寡核苷酸进行预处理的方法如下:
[0228]
a、第二dna序列的3’端聚合多个重复碱基(a、t、g或c):
[0229]
使用试剂盒中的试剂配置反应体系(第二反应体系)25ul,反应体系的配置如下:
[0230]
表9
[0231]
试剂剂量tdt酶0.5ultdt酶反应缓冲液5uldntps(datp,dttp,dgtp,dctp)0.5ul水(h2o)19ul
[0232]
应理解,在待测脱氧核糖寡核苷酸分子3’端聚合的多个重复碱基的类型与通用标签接头序列有关,在待测脱氧核糖寡核苷酸分子3’端聚合的多个重复碱基可以与通用标签接头序列的粘性末端互补形成双链。
[0233]
例如,通用标签接头序列的粘性末端为“ggg”,那么,在待测脱氧核糖寡核苷酸分子3’端聚合的最后三个碱基为“ccc”。
[0234]
再如,通用标签接头序列的粘性末端为“aaaa”,那么,在待测脱氧核糖寡核苷酸分子3’端聚合的最后四个碱基为“tttt”。
[0235]
b、在25℃环境下反应30秒,用乙醇沉淀,回收3’端添加了多个重复碱基的待测脱氧核糖寡核苷酸分子。
[0236]
c、通用标签接头序列与第一dna序列连接
[0237]
使用试剂盒中的试剂配置连接体系(第一反应体系)8ul,连接体系的配置如下:
[0238]
表10
[0239]
试剂剂量通用标签接头序列0.8ult4连接酶0.2ult4连接酶反应缓冲液0.8ul水(h2o)6ul3’端添加碱基的待测寡核苷酸分子0.2ul
[0240]
d、在16℃环境反应30分钟。
[0241]
e、送样测序。
[0242]
通过上述的试剂盒,使用者可以方便地配置出预处理所需的反应体系对待测脱氧核糖寡核苷酸分析进行预处理,使得经过预处理得到延长的脱氧核糖寡核苷酸分子符合现有测序技术的要求,提高了脱氧核糖寡核苷酸分子测序的效率与准确性,降低了测序的成本。
[0243]
本技术中,“至少两种”或“多种”是指两种或两种以上。术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况,其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
[0244]
应理解,说明书通篇中提到的“一个实施例”或“一些实施例”意味着与实施例有关的特定特征、结构或特性包括在本技术的至少一个实施例中。因此,在整个说明书各处出现的“在一个实施例中”或“在一些实施例中”未必一定指相同的实施例。此外,这些特定的特征、结构或特性可以任意适合的方式结合在一个或多个实施例中。应理解,在本技术的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本技术实施例的实施过程构成任何限定。
[0245]
以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。