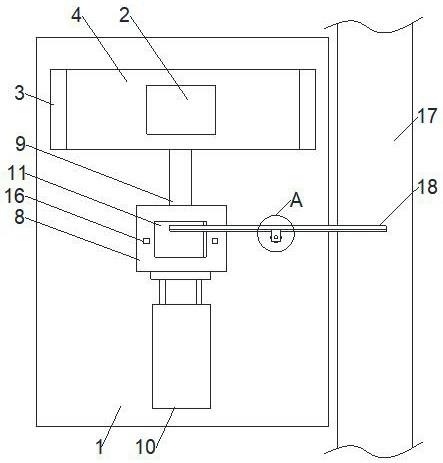
一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器
技术领域
1.本发明属于传感器技术领域,涉及一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器。
背景技术:
2.赭曲霉毒素 a(ochratoxin a, ota)是曲霉属和青霉属等有毒真菌产生的一类次级代谢产物, 是常见污染食品的五大真菌毒素之一, 具有较强的肾毒性、肝毒性、神经毒性和免疫毒性, 以及致畸、致癌和致突变作用。ota 广泛存在于各种谷物及其制品、葡萄与葡萄酒、咖啡等多种食品原料及其成品中, 严重威胁人体健康。
3.针对食品中 ota 的检测, 目前已有许多方法,如薄层色谱法、高效液相色谱法、液相
‑
质谱联用法以及酶联免疫吸附法等。这些方法往往存在仪器昂贵、分析周期长、样品预处理复杂、检测费用昂贵等问题,已经难以适应ota检测的方便、快捷、灵敏度等方面的要求。目前急需建立一种快速,准确,灵敏且高特异性的检测方法来检测ota的残留。
技术实现要素:
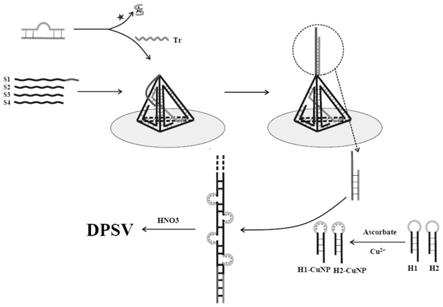
4.为了实现更加灵敏、特异性的检测ota,本技术提出了一种目标与适配体特异性结合释放触发链tr,经链置换触发电极表面dna四面体封闭链释放,进而引发hcr反应使cunp被电极捕获,最终通过hno3溶解cunp导致电位变化构建检测ota的电化学生物传感器。
5.本发明的技术方案如下:一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器,包括赭曲霉毒素a的适配体apt、触发链tr、发夹探针h1、cuso4、mops 缓冲液 、tm缓冲液、发夹探针h2以及形成四面体的dna链s1、s2、s3、s4和封闭链b;所述赭曲霉毒素a的适配体apt的序列为seq id no:1;所述触发链tr的序列为seq id no:2;所述发夹探针h1的序列为seq id no:3;所述发夹探针h2的序列为seq id no:4;所述s1的序列为seq id no:5;所述s2的序列为seq id no:6;所述s3的序列为seq id no:7;所述s4的序列为seq id no:8;所述封闭链b的序列为seq id no:9;所述赭曲霉毒素a的适配体apt的序列为: 5
’‑ꢀ
gatc gggtgtgggtggcgtaaagggagcatcggaca
ꢀ‑3’
;所述触发链tr的序列为: 5
’‑ꢀ
tgtccgatgcggc tttttttttt cacccgatc
ꢀ‑3’
;所述发夹探针h1的序列为: 5
’‑ꢀ
gggcgcccgcgcg tttttttttt ttttttttttcgcgcggggg
ꢀ‑3’
;
所述发夹探针h2的序列为:5
’‑ꢀ
gccccccccgcgcgcg tttttttttt tttttttttt cgcg
ꢀ‑3’
;所述s1的序列为:5
’‑ꢀ
ggcgcccgccgcatcggacaacggagaacaaac aacctttgcctggagatacatgcacattacggctttccctattagaaggtctcaggtgcgcgtttcggtaagtagacg
ꢀ‑3’
;所述s2的序列为:5
’‑ꢀ
sh(ch3)6‑ꢀ
cgc gca cct gag acc ttc taa tag gg ttt c ttgctgacagcgaactag aat gcc c ttt gg gct gtt ccg ggt gtg gctcgt cgg
ꢀ‑3’
;所述s3的序列为:5
’‑ꢀ
sh(ch3)6‑ꢀ
ggc cga gga ctc ctg ctc cgc tgc gg ttt g gag aactgg tcc cgt cta ctt acc g ttt cc gac gag cca cac ccggaa cag ccc
ꢀ‑3’
;所述s4的序列为:5
’‑ꢀ
sh(ch3)6‑ꢀ
gcc gta atg tgc atg tat ctc cag gc ttt c cgc agcgga gca gga gtc ctc ggc c ttt gg gca ttc tagtt
ꢀ‑3’
;所述封闭链b的序列为:5
’‑ꢀ
cgctgtcagcaaggaagaaaca ttt atgcggcggg tttggaccagttctcc
ꢀ‑3’
;所述的s2、s3、s4链的5
’ꢀ
端修饰有巯基
‑
sh。
6.优选地,赭曲霉毒素a与赭曲霉毒素a的适配体apt特异性结合,释放触发链tr,在电极上依次进行链置换暴露封闭链b、杂交链式反应捕获大量cunp及其溶解导致电位变化产生电化学信号。
7.上述检测赭曲霉毒素a的生物传感器的制备方法,包括以下步骤:(1)铜纳米颗粒cunp的制备:h1、cuso4在 mops 缓冲液中混合,再加入还原剂抗坏血酸钠,合成铜纳米颗粒h1
‑
cunp;h2、cuso4在 mops 缓冲液中混合,再加入还原剂抗坏血酸钠,合成铜纳米颗粒h2
‑
cunp;(2)对电极进行预处理;(3)dna四面体制备及其修饰到步骤(2)处理的电极表面:将s1、s2、s3、s4和封闭链b在tm缓冲液中混合,得到dna四面体;将制备好的dna四面体与三(2
‑
羧乙基)膦注入电极,在室温下反应;(4)均相反应产生触发链tr:赭曲霉毒素a的适配体apt和触发链tr,振荡,形成拱形探针ap;灭菌水,5
×
pbs缓冲液,拱形探针ap,赭曲霉毒素a孵育;(5)电极上的链置换、杂交链式反应、cunp的捕获及其溶解反应:将步骤(4)得到的触发链tr、h1
‑
cunp和h2
‑
cunp,滴加到步骤(3)的电极上,反应,清洗。
8.优选地,所述步骤(2)预处理过程为:电极在氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗。
9.优选地,所述步骤(3)dna四面体的制备方法为:将等摩尔量的dna四面体五条链混合在tm缓冲液中,在95℃反应,再逐渐冷却到4℃。
10.优选地,所述步骤(3)将dna四面体修饰到电极表面的过程为:将制备好的dna四面体与三(2
‑
羧乙基)膦(tcep)注入电极,在室温下反应过夜。
11.优选地,所述步骤(2)的电极为金电极。
12.上述制备方法制备的检测赭曲霉毒素a的生物传感器在检测食品、环境中赭曲霉毒素a上的应用。
13.上述的应用,以ag/agcl为参比电极,以pt电极为对电极,电位设置为
‑
0.2到0.6v,电位增加0.004 v,振幅为50 mv,脉冲宽度0.05 s,脉冲周期为0.5 s,沉积电位
‑
0.5 v,沉
积时间6min;采用差分脉冲溶出伏安法读取cunp电信号的变化,检测待测目标物。
14.上述过程中用到的溶液的制备方法:a. 5
×
pbs缓冲液是由以下方法配制:na2hpo4(10 mm)、nah2po4(10 mm)、nacl(140 mm)、kcl(1 mm)、mgcl2(1 mm),最终溶液的ph值为7.4和7.0。保存于
‑
20℃冰箱,备用。
15.b. 5
×
mops缓冲液是由以下方法配制:mops(50 mm)、nacl(750 mm),最终溶液的ph值为7.6。保存于
‑
20℃冰箱,备用。
16.c. tm缓冲液是由以下方法配制:tris(20 mm)、mgcl2(50 mm),最终溶液的ph值为8.0。保存于
‑
20℃冰箱,备用。
17.c.配置的pbs缓冲液、mops缓冲液、tm缓冲液与超纯水均需进行高温灭菌处理。具体方法是,将pbs和超纯水分别放置在不同的锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120 ℃的温度下灭菌20 min。保存于
‑
20℃冰箱,备用。
18.d.电解液的配置:取4 ml 5
×
pbs于16 ml灭菌水中,并加入200 μl,100 mm的h2o2溶液,充分混匀待用。电解液需现用现配。
19.该发明的检测方式是电化学检测,利用传统的三电极体系。ag/agcl为参比电极,铂丝为对电极,修饰的金电极为工作电极。在检测之前,先进行铜纳米颗粒、dna四面体的制备以及均相反应溶液的准备。然后将dna四面体通过au
‑
s键固定在电极表面。再将均相反应产物、h1
‑
cunp和h2
‑
cunp滴加到电极上,依次进行sda、hcr和铜纳米颗粒的捕获。最后向反应电极上滴加过hno3,继续孵育,用三电极工作体系检测信号峰变化。电位设置为
‑
0.2到0.6v,电位增加0.004 v,振幅为50 mv,脉冲宽度0.05 s,脉冲周期为0.5 s,沉积电位
‑
0.5 v,沉积时间6 min。采用差分脉冲溶出伏安法读取cunp电信号的变化,检测待测目标物。
20.本发明基于ota及其适配体的特异性识别、sda反应、hcr反应以及dna四面体的特殊性质构建了电化学生物传感器。该传感器具有检测速度快,检测限低,特异性高等优点,可以弥补ota现有检测方法的缺陷与不足,实现对其快速、准确的定量检测。
附图说明
21.图1为该发明原理示意图;图2为实施例1 拱形探针ap浓度优化检测结果图;图3为实施例2 h1
‑
cunp浓度优化检测结果图;图4为实施例3 传感器检测ota的工作曲线。
22.本发明的有益效果:1、利用了适配体的特异性识别,具有特异性高的优势;2、过铜纳米颗粒的形成和溶解这个变化过程,导致电位发生变化,从而得以检测,反应条件简单可控,反应时间短,灵敏度高;3、反应的主要过程在电极上进行,操作方便简单,性能稳定;4、制备过程价格低廉,监测速度快,适用于食品和环境中ota检测的产业化实际应用。
具体实施方式
23.下面结合具体实施例对本发明进行进一步说明:
实施例1(1)铜纳米颗粒的制备:首先将h1和h2在95℃下加热2 min,再逐渐冷却到室温。取5μl h1(10μm)与75μl 1
×
mops缓冲液(ph=7.6)混合均匀,向混合液中加入10μl 抗坏血酸钠(20 mm ),振荡1 min,加10μl cuso
4 (1 mm),振荡1 min,在室温下进行暗反应10min,得到以h1为模板的铜纳米颗粒h1
‑
cunp。用相同的方法,以h2为模板制备铜纳米颗粒h2
‑
cunp。
24.(2)dna四面体的制备:将5 μl s1、s2、s3、s4和b(终浓度都为100 μm)混合在tm缓冲液中,在95℃反应5 min,放入4℃ 冰箱逐渐冷备用却,使用前需稀释100倍。
25.(3)拱形探针arch probe(ap)的制备:将5 μl apt(10 μm)和5 μl tr(10 μm)加入灭菌的离心管中,振荡30 s,放入95℃的水浴锅中保持5 min形成拱形探针ap后,冷却至室温;如图1所示,目标物ota与适配体特异性结合释放触发链tr,tr经sda反应将dna四面体的封闭区域释放。加入h1
‑
cunp和h2
‑
cunp后进行杂交链式反应,反应后将铜纳米颗粒捕获到电极表面,在加入hno3溶解捕获的cunp,从而产生电化学信号变化。
26.实施例2一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器的制备方法,包括以下步骤:a.电极预处理:金电极首先在0.3和0.05 μm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;b.将10 μl 1μm 的dna四面体溶液(含3mm tcep)滴加到电极表面,在室温下孵育过夜,以备下一步反应使用。
27.c.均相反应:取30 μl灭菌水,10 μl 5
×
pbs缓冲液,5 μl拱形探针(0 μm、0.01 μm、0.05 μm、0.1 μm、0.2 μm、0.3 μm、0.4 μm、0.5 μm),5 μl浓度为500 μm的赭曲霉毒素a于灭菌的离心管中,振荡30 s,放入37℃的水浴锅中孵育2 h,得到触发链tr;d.电极反应:取c步中的tr溶液5 μl,2.5 μl h1
‑
cunp(4 μm)和2.5 μl h2
‑
cunp(4 μm)滴加到电极表面,孵育1.5 h进行hcr反应。反应完成后,加入100 μl的hno3(5 m)反应10 min。
28.e.将修饰好的电极用pbs缓冲液和超纯水清洗三遍,在氮气流下干燥;f.制备好的电极以ag/agcl为参比电极,以pt电极为对电极,电位设置为
‑
0.2到0.6v,电位增加0.004 v,振幅为50 mv,脉冲宽度0.05 s,脉冲周期为0.5 s,沉积电位
‑
0.5 v,沉积时间6min。采用差分脉冲溶出伏安法读取cunp电信号的变化,检测待测目标物。
29.结果见图2,从图中可以看出,检测到的电流信号随着拱形探针的浓度在0
‑
0.1 μm区间内增大而增大,当浓度超过0.1 μm后,电流趋于稳定,所以ap的最佳浓度为0.1 μm。
30.实施例3一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器的制备方法,包括以下步骤:a.电极预处理:金电极首先在0.3和0.05 μm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;b.将10 μl 1μm 的dna四面体溶液(含3mm tcep)滴加到电极表面,在室温下孵育过夜,以备下一步反应使用。
31.c.均相反应:取30 μl灭菌水,10 μl 5
×
pbs缓冲液,5 μl拱形探针(0.1 μm),5 μl浓度为500 μm的赭曲霉毒素a于灭菌的离心管中,振荡30 s,放入37℃的水浴锅中孵育2 h,得到触发链tr;d.电极反应:取c步中的tr溶液5 μl,2.5 μl h1
‑
cunp(0 μm、0.5 μm、1 μm、2 μm、3 μm、4 μm、5 μm、6 μm)和2.5 μl h2
‑
cunp(4 μm)滴加到电极表面,孵育1.5 h进行hcr反应。反应完成后,加入100 μl的hno3(5 m)反应10 min。
32.e.将修饰好的电极用pbs缓冲液和超纯水清洗三遍,在氮气流下干燥;f.制备好的电极以ag/agcl为参比电极,以pt电极为对电极,电位设置为
‑
0.2到0.6v,电位增加0.004 v,振幅为50 mv,脉冲宽度0.05 s,脉冲周期为0.5 s,沉积电位
‑
0.5 v,沉积时间6min。采用差分脉冲溶出伏安法读取cunp电信号的变化,检测待测目标物。
33.结果见图3,从图中可以看出,检测到的电流信号随着h1
‑
cunp的浓度在0
‑
6 μm区间内增大而增大,当浓度超过100 nm后,电流趋于稳定,所以环状模板ct的最佳浓度为4 μm。
34.实施例4一种基于铜纳米颗粒的检测赭曲霉毒素a的生物传感器的制备方法,包括以下步骤:a.电极预处理:金电极首先在0.3和0.05 μm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;b.将10 μl 1μm 的dna四面体溶液(含3mm tcep)滴加到电极表面,在室温下孵育过夜,以备下一步反应使用。
35.c.均相反应:取30 μl灭菌水,10 μl 5
×
pbs缓冲液,5 μl拱形探针(0.1 μm),5 μl浓度为(0 ng
·
l
‑1、1 ng
·
l
‑1、10 ng
·
l
‑1、50 ng
·
l
‑1、100 ng
·
l
‑1、500 ng
·
l
‑1)的赭曲霉毒素a于灭菌的离心管中,振荡30 s,放入37℃的水浴锅中孵育2 h,得到触发链tr;d.电极反应:取c步中的tr溶液5 μl,2.5 μl h1
‑
cunp(4 μm)和2.5 μl h2
‑
cunp(4 μm)滴加到电极表面,孵育1.5 h进行hcr反应。反应完成后,加入100 μl的hno3(5 m)反应10 min。
36.e.将修饰好的电极用pbs缓冲液和超纯水清洗三遍,在氮气流下干燥;f.制备好的电极以ag/agcl为参比电极,以pt电极为对电极,电位设置为
‑
0.2到0.6v,电位增加0.004 v,振幅为50 mv,脉冲宽度0.05 s,脉冲周期为0.5 s,沉积电位
‑
0.5 v,沉积时间6min。采用差分脉冲溶出伏安法读取cunp电信号的变化,检测待测目标物。
37.结果见图4。从图4a中可以看出,检测到的电流信号随着目标物浓度在1 ng
·
l
‑1ꢀ‑
500 ng
·
l
‑1区间内增大而增大,图4b显示ota浓度的对数与电流峰值大小呈正比关系,拟合曲线:i= 8.616 0.720 lgc(相关系数是0.983,其中c代表了ota的浓度),由此计算优化后的生物传感器的检测限为2 pg
·
l
‑1。
38.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。