1.本发明涉及医药技术领域,特别是涉及一种核酸构建体。
背景技术:
2.地中海贫血、镰刀型细胞贫血症等遗传性贫血症是一类罕见的遗传性血液疾病,最常见于地中海、中东、印度和南亚后裔。在中国主要多发于长江以南省份,如广东、广西、海南、四川、云南、台湾等省份。地中海贫血源自globin血红蛋白四聚体单链间的不平衡,红细胞(rbc)α-珠蛋白与β-珠蛋白比例失衡后会产生如下临床症状:1)患者缺乏足够的红细胞和血红蛋白,不能将氧气有效地输送至全身;2)红细胞溶血率升高,导致慢性血管系统的损伤死亡率上升。目前对于该病的治疗方法有输血疗法与铁螯合剂治疗、脾切除术或脾动脉栓塞术。异体造血干细胞移植(异体骨髓移植、外周血造血干细胞移植、脐血移植)是目前根治β-地中海贫血的方法。而移植供者的缺乏和移植相关风险限制了异体造血细胞移植在β-地中海贫血患者中的广泛使用。
3.由于遗传性贫血症是单基因表达缺失导致的遗传疾病,利用慢病毒载体具有的宿主基因组整合的特点,以慢病毒载体将表达正常β珠蛋白肽链(β-globin)的基因在体外植入到从患者体内取出的造血干细胞中,再将这些细胞输回患者体内的自体造血干细胞移植基因治疗新药成为国内外公认的治疗重型遗传性贫血症最具潜力的创新疗法。它不受限于供体,也没有移植细胞被排异和移植物抗宿主病的风险。可以达到一次治疗,完全根治的疗效。
4.正常β珠蛋白肽链(β-globin)的基因由启动子区、3个外显子和2个内含子、下游增强子区以及内源性上游基因表达控制区序列dnase i hypersensitive sites(hss)组成,全长超过6万碱基对(bp),难以应用到任何一种基因治疗载体中。数十年来科学家致力于开发一种相对小的β-globin基因表达框架,以便于能够运用到基因治疗载体中。美国蓝鸟生物公司开发的基于这种自体造血干细胞移植的基因治疗药物——zynteglo于2019年6月获得欧洲药品管理局(ema)批准正式上市销售,治疗输血依赖型β地中海贫血。该基因治疗药物是一种通过慢病毒载体(基于hiv的复制缺陷型的自我失活型,以vsvg为膜蛋白的第三代假包膜慢病毒载体)介导βa87thr:gln基因[第87位突变(βa87thr:gln)的人β-globin基因]转导的自体cd34 造血干细胞移植基因治疗新药。
[0005]
虽然相对于内源性β珠蛋白肽链(β-globin)基因来说,蓝鸟生物的β-globin基因已经减小了尺寸,但是一方面,该慢病毒载体基因序列构建体的商业化生产过程仍然是非常的困难,难以获得较高的病毒载体生产效率,极大地提高了该慢病毒载体的生产成本。慢病毒载体的生产成本占这种基因治疗药物生产成本的相当大的部分,使得这种基因治疗药物的价格非常昂贵(单次治疗费用接近180万美元),难以使广大发展中国家患者受益。
[0006]
另一方面,蓝鸟生物的β-globin慢病毒载体基因序列构建体的基因表达效率并不高,欧洲药品管理局(ema)仅批准zynteglo应用于非β0/β0输血依赖型β地中海贫血症显示出zynteglo对极重症β0/β0地中海贫血症疗效不佳。同时临床试验数据显示部分非β0/β0输
血依赖型β地中海贫血症使用zynteglo后仍然不能完全摆脱输血治疗。
技术实现要素:
[0007]
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种核酸构建体,用于解决现有技术中的问题。
[0008]
为实现上述目的及其他相关目的,本发明提供一种核酸构建体,所述核酸构建体包括β珠蛋白基因,所述β珠蛋白基因包括外显子、内含子和顺式作用元件,所述顺式作用元件包括wpre、sv40多腺苷酸化信号或sv40 ori中的一种或几种元件以及截短的位点控制区。
[0009]
所述外显子为β-globin基因的野生型外显子或优化外显子。
[0010]
优选的,所述优化外显子选自以下优化方式:野生型外显子突变和/或密码子优化。
[0011]
所述截短的位点控制区序列为seq id no22
[0012]
所述内含子可以为β-globin基因的野生型内含子或优化内含子。
[0013]
优选的,所述优化内含子选自以下优化方式:截短的野生型2号内含子(seq id no:21)、野生型2号内含子t87q突变。
[0014]
优选的,所述核酸构建体的表达框架和顺式作用元件是反向插入核酸构建体中的。
[0015]
所述核酸构建体为非病毒载体或病毒载体。
[0016]
优选的,所述病毒载体为慢病毒载体或腺相关病毒载体。
[0017]
优选的,所述慢病毒载体骨架为pkl-kan,所述慢病毒载体骨架的核苷酸序列如seq id no:1。
[0018]
本发明第二方面提供一种慢病毒,所述慢病毒由所述核酸构建体经病毒包装而成。
[0019]
本发明第三方面提供一种慢病毒载体系统,所述慢病毒载体系统包括所述的核酸构建体以及辅助质粒。
[0020]
优选的,所述慢病毒载体系统还包括宿主细胞。
[0021]
本发明第四方面提供一种用于预防或治疗遗传性贫血症的组合物,其有效物质含有:所述核酸构建体;和/或所述慢病毒。
[0022]
本发明第五方面提供一种细胞系,所述细胞系为经所述慢病毒感染的细胞系。
[0023]
本发明第六方面提供所述核酸构建体、慢病毒、细胞系在制备预防、治疗遗传性贫血症的药物中的用途。
[0024]
进一步的,所述遗传性贫血症指地中海贫血症、镰刀型细胞贫血症中的一种或几种。
[0025]
如上所述,本发明的核酸构建体,具有以下有益效果:
[0026]
1)病毒包装效率显著增强。
[0027]
2)慢病毒载体的整合能力更强,单位生物滴度的慢病毒载体能够更高效率整合到靶细胞基因组中。在临床应用中可以以更低的滴度剂量获得相同或更好的临床疗效。并且降低慢病毒载体制剂的免疫原性。
[0028]
3)重组慢病毒基因治疗载体生产效率高、生产成本低。
[0029]
4)应用范围广,可用于生产制备各种形式的遗传性贫血症基因治疗慢病毒载体。
附图说明
[0030]
图1显示为本发明的核酸构建体设计示意图。
[0031]
图2显示为本发明的慢病毒载体骨架质粒图谱。
[0032]
图3显示为β-globin基因不同慢病毒载体包装得到的慢病毒滴度。
[0033]
图4显示为本发明的核酸构建体进一步设计示意图。
具体实施方式
[0034]
除非下文另外定义,本发明所提及的所有技术和科学用语具有本发明所属领域的技术人员通常理解的意义。
[0035]
术语―核酸构建体”是指可以被引入靶细胞或组织中的人工构建的核酸区段,所述核酸构建体可以为慢病毒载体,慢病毒载体包括载体骨架即空载体与表达框架。
[0036]
术语―载体”是指用于将一个或多个核酸或一个或多个多核苷酸引入或转移到靶细胞或组织中的核酸片段或多核苷酸片段。典型地,载体用于将外源dna引入另一个细胞或组织中。载体可以包含用于在细菌中生长的细菌抗性基因和用于在生物体中表达目的蛋白质的启动子。dna可以通过pcr或任何其他本领域技术人员已知的一种或多种合适的技术在体外产生。
[0037]
术语―表达框架”是指具有编码蛋白质潜能的序列。
[0038]
术语“顺式作用元件”是指同一dna分子中具有转录调节功能的特异dna序列。按照功能特性,真核基因顺式作用元件分为启动子、增强子及沉默子。在β珠蛋白基因中,顺式作用元件还包括远距离的顺式作用元件:位点控制区,亦即,基因座控制区或基因表达控制区(locus control regions,lcr),β珠蛋白基因的内源性位点控制区包括7个dnase i超敏感位点,位于珠蛋白基因上游6~25kb。
[0039]
术语―遗传性贫血症”是单基因表达缺失导致的遗传性血液疾病。
[0040]
本发明发明人通过深入研究,第一方面提供一种核酸构建体,所述核酸构建体包括β珠蛋白基因,所述β珠蛋白基因包括外显子、内含子和顺式作用元件,所述顺式作用元件包括wpre、sv40多腺苷酸化信号或sv40 ori中的一种或几种元件以及截短的位点控制区。
[0041]
所述β珠蛋白基因为哺乳动物β珠蛋白基因。例如为人β珠蛋白基因,或者称为人β-globin基因,基因序列号为ensg00000244734。
[0042]
所述外显子为β-globin基因的野生型外显子或优化外显子。
[0043]
所述优化外显子选自以下优化方式中的一种或几种:野生型外显子突变或密码子优化。
[0044]
密码子优化可以使用现有的用于目的基因密码子优化的软件如:dnaworks、upgene、benchling等。
[0045]
密码子优化是基因表达优化的关键步骤,所述密码子优化参数包括以下参数中的一种或几种:密码子使用偏爱性、mrna二级结构、不同的gc含量(避免过高的gc含量)、避免转录和翻译过程中涉及的各种顺式元件、避免罕见密码子的出现、剪切位点等。
ori(此结构命名为p006)
[0064]
截短的位点控制区-优化外显子-优化内含子-wpre-sv40多腺苷酸化信号-sv40 ori
[0065]
截短的位点控制区-优化外显子-野生内含子-wpre-sv40多腺苷酸化信号-sv40 ori(此结构命名为p019)
[0066]
截短的位点控制区-优化外显子-优化内含子-sv40多腺苷酸化信号-sv40 ori(此结构命名为p021)
[0067]
进一步的,所述核酸构建体为非病毒载体或病毒载体。
[0068]
所述非病毒载体为利用非病毒的载体材料的物化性质来介导基因的转移。
[0069]
更进一步的,所述病毒载体为慢病毒载体或腺相关病毒载体。
[0070]
所述慢病毒载体中载体骨架可以现有技术中的载体骨架。
[0071]
进一步的,所述载体骨架为pkl-kan,所述慢病毒载体骨架的核苷酸序列如seq id no:1。
[0072]
较佳的,所述核酸构建体的表达框架以及顺式作用元件是以反向插入慢病毒载体骨架中的,即表达框架的转录方向与慢病毒的转录方向相反。上述方式可以阻止β珠蛋白基因中的内含子在慢病毒包装过程中及反转录前被剪切掉。
[0073]
本发明第二方面提供一种慢病毒,所述慢病毒由所述核酸构建体经病毒包装而成。
[0074]
本发明第三方面提供一种慢病毒载体系统,所述慢病毒载体系统包括所述的核酸构建体以及辅助质粒。
[0075]
更进一步的,所述辅助质粒编码gag和pol蛋白的一个或者多个核苷酸序列以及其它必需的病毒包装组件核苷酸序列,所述辅助质粒可以包括包装质粒和包膜质粒。
[0076]
进一步的,所述慢病毒载体系统还包括宿主细胞,所述宿主细胞可以选自本领域各种可适用的宿主细胞,只要不对本发明的发明目的产生限制即可。具体的可适用的细胞可以为生产慢病毒的细胞,例如可以为293t细胞。
[0077]
本发明第四方面提供一种用于预防或治疗遗传性贫血症的组合物,其有效物质含有:所述核酸构建体;和/或所述慢病毒。
[0078]
所述组合物可以为药物组合物。
[0079]
所述组合物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
[0080]
当所述组合物用于预防或治疗遗传性贫血症时,需要将有效剂量的所述的组合物施用于对象中。采用该方法,所述对象能够正常表达β珠蛋白肽链。
[0081]
本发明第五方面提供一种细胞系,所述细胞系为经所述慢病毒感染的细胞系。
[0082]
该细胞系可以作为生物制剂用于制备预防或治疗神经退行性疾病的产品。
[0083]
本发明第六方面提供所述核酸构建体、慢病毒、细胞系在制备预防、治疗遗传性贫血症的药物中的用途。
[0084]
进一步的,所述遗传性贫血症指地中海贫血症、镰刀型细胞贫血症中的一种或几种。
[0085]
进一步的,所述地中海贫血症为β地中海贫血症。
[0086]
所述用途可以为用于遗传性贫血症药物的开发、筛选、药理毒理学评价中的用途。
[0087]
进一步的,所述用途可以为用于β地中海贫血症的开发、筛选、药理毒理学评价中的用途。
[0088]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0089]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式―一个”、―一”和―这个”包括复数形式。
[0090]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0091]
实施例1β-globin基因慢病毒载体的设计
[0092]
根据文献(therapeutic haemoglobin synthesis inβ-thalassaemic mice expressing lentivirus-encoded humanβ-globin.chad may,stefano rivella,john callegari,glenn heller,karen m.l.gaensler,lucio luzzatto&michel sadelain.nature volume 406,pages82
–
86(2000))设计了与美国蓝鸟生物公司的基因治疗药物-zynteglo相似的β-globin基因表达框架作为对照,将该结构命名为p001。
[0093]
如图1所示,我们分别设计了p002、p005、p006另外3个结构,分别加入了土拨鼠乙肝病毒转录后调控元件(wpre)、sv40病毒的多腺苷酸化信号(sv40 pa signal)、sv40病毒的复制起始位点(sv40 ori),图1和图4中的人工上游基因表达控制区即为截短的位点控制区。
[0094]
实施例2:β-globin基因慢病毒载体的构建:
[0095]
将实施例1设计的结构克隆至慢病毒载体骨架中,慢病毒载体骨架来源于康霖生物科技(杭州)有限公司自备第3代慢病毒载体骨架——pkl-kan(核苷酸序列seq id no:01)(如图2所示)
[0096]
实施例1设计的β-globin基因表达框架p001(核苷酸序列seq id no:2),经南京金斯瑞生物技术有限公司合成后,通过本领域熟知的以同源重组的方法克隆至慢病毒载体骨架pkl-kan上的多克隆位点xhoi/kpni之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p001(核苷酸序列seq id no:3)。
[0097]
将加入土拨鼠乙肝病毒转录后调控元件(wpre)(核苷酸序列seq id no:4)的结构p002,经南京金斯瑞生物技术有限公司合成后,通过本领域熟知的以同源重组的方法wpre克隆至慢病毒载体pkl-kan-th-p001上的lcr与3’ltr之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p002(核苷酸序列seq id no:5)。
[0098]
将加入sv40病毒的多腺苷酸化信号(sv40 pa signal)合并sv40病毒的复制起始位点(sv40 ori)序列(核苷酸序列seq id no:6)的结构p005,经南京金斯瑞生物技术有限公司合成后,通过本领域熟知的以同源重组的方法克隆至慢病毒载体pkl-kan-th-p001上3’ltr与kan ori之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p005(核苷酸序列seq id no:7)。
[0099]
将土拨鼠乙肝病毒转录后调控元件(wpre)以本领域熟知的pcr扩增的方法,以pkl-kan-th-p002为扩增模板扩增,再通过本领域熟知的以同源重组的方法克隆至慢病毒载体pkl-kan-th-p005上的lcr与sv40 pa signal之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p006(核苷酸序列seq id no:8)。
[0100]
实施例3:β-globin基因慢病毒包装
[0101]
将实施2中构建的β-globin基因慢病毒载体(pkl-kan-th-p001、pkl-kan-th-p002、pkl-kan-th-p005、pkl-kan-th-p006)、包膜质粒(pkl-kan-vsvg,其核苷酸序列如seq id no:9所示)和包装质粒(pkl-kan-rev,其核苷酸序列如seq id no:10所示;pkl-kan-gagpol,其核苷酸序列如seq id no:11所示)混合后同时共转染293t细胞(购自美国模式菌种收集中心(atcc),atcc保藏号为crl-3216),在该293t细胞系中进行β-globin基因治疗慢病毒的包装。转染方法为pei阳离子聚合物介导的真核细胞瞬时转染,pei阳离子聚合物为购自polysciences的pei-max转染试剂(购自polysciences,货号:24765-1),转染操作参照生产商推荐标准化操作进行,转染规模为10cm2细胞培养皿。
[0102]
转染完成48小时后,收获慢病毒(转染细胞培养上清),分装于-80℃保存。将不同体积的慢病毒在96孔细胞培养板中接种于预铺于板中的人cd4 t细胞系——mt4细胞系(购自上海素尔生物科技有限公司)。以报告基因慢病毒载体egfp(以pccl-sin-ef1α-wpre-egfp按照上述方法包装的慢病毒载体)感染细胞培养上清为阳性对照,通过本领域熟知的方法,以定量pcr以及基于gfp信号的流式细胞仪数据计算出慢病毒初始收获液感染滴度。定量pcr使用的引物探针序列为:
[0103]
v forward primer 5
’-
agtaagaccaccgcacagca-3’(seq id no:26)
[0104]
lv reverse primer 5
’-
ccttggtgggtgctactcct-3’(seq id no:27)
[0105]
lv probe 5
’-
cctccaggtctgaagatcagcggccgc-3’(seq id no:28)
[0106]
hk forward primer 5
’-
gctgtcatctcttgtgggctgt-3’(seq id no:29)
[0107]
hk probe 5
’-
cctgtcatgcccacacaaatctctcc-3’(seq id no:30)
[0108]
hk reverse primer 5
’-
actcatgggagctgctggttc-3’(seq id no:31)
[0109]
其中lv probe中5’端带有6fam荧光基团,3’带有tamra荧光基团;
[0110]
hk probe中5’端带有cy5荧光基团,3’带有bhq2荧光基团。
[0111]
定量pcr运行程序为:94℃5min;95℃10s,60℃30s,40cyclers。
[0112]
4种不同的β-globin基因慢病毒载体(pkl-kan-th-p001、pkl-kan-th-p002、pkl-kan-th-p005、pkl-kan-th-p006)产生的慢病毒载体初始收获液感染滴度如图3所示。数据显示慢病毒表达载体中顺式作用元件土拨鼠乙肝病毒转录后调控元件(wpre)、以及sv40病毒的多腺苷酸化信号(sv40 pa signal)合并sv40病毒的复制起始位点(sv40 ori)序列,对初始收获液感染滴度均有显著的增强作用,并且两种不同的增强作用可以相互叠加。实施例4β-globin基因慢病毒的表达效率检测
[0113]
以实施3中相同的方法,以β-globin基因慢病毒表达载体(pkl-kan-th-p005、pkl-kan-th-p006)在293t细胞系中进行β-globin基因治疗慢病毒的包装。转染规模为2x15cm2细胞培养皿。转染完成48小时后,收获慢病毒(转染细胞培养上清),首先在台式吊桶式机上,室温4000rpm离心5分钟去除细胞碎片,再4度10000g离心4小时获得病毒颗粒沉淀,去除离心上清后,以1ml rpmi完全培养基加入病毒颗粒沉淀中,以微量进样器重悬病毒颗粒,并将制备好的病毒重悬液分装冻存于-80度备用。
[0114]
将不同体积的慢病毒重悬液,按照实施3中描述的方法接种于mt4细胞系,并以定量pcr以及基于gfp信号的流式细胞仪数据计算出慢病毒载体重悬液感染滴度。
[0115]
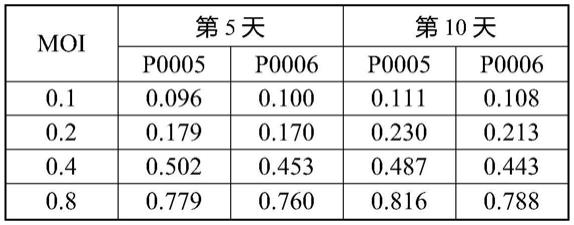
随后我们在细胞系中验证β-globin基因慢病毒的细胞内表达。k562细胞株是从慢性粒细胞白血病(急变期)患者建立的红白血病细胞株。本身可有少量的胚胎期血红蛋白产生并具有一定的红系分化能力。k562细胞株(购自美国模式菌种收集中心(atcc),保藏号为ccl-243)。根据上述步骤计算出的慢病毒载体重悬液感染滴度,以表1所示的感染复数(multiple of infection,moi)将慢病毒接种于预铺于96孔细胞培养板中的k562细胞系中,分别于感染后第5,10,13天收取部分细胞用于以下实验:
[0116]
1.收集感染慢病毒的k562细胞,用pbs清洗细胞后4200rpm,5min,离心收集细胞,重悬以50μl快速抽提溶液(quickextract
tm
dna extraction solutionr)(购自lucigen,货号qe09050)并用pcr仪运行以下程序以裂解细胞和抽提总dna。
[0117]
表1 pcr程序
[0118]
温度时间65℃15min68℃15min95℃10min
[0119]
通过本领域熟知的方法,以定量pcr以及基于gfp信号的流式细胞仪数据计算出k562细胞感染慢病毒拷贝数(vector copy number,vcn)。数据显示,当以相同的感染复数感染k562细胞时,两种慢病毒载体p005、p006获得了非常近似的慢病毒拷贝数。
[0120]
表2 k562细胞感染慢病毒拷贝数
[0121][0122]
2.收集感染慢病毒的k562细胞,以4%多聚甲醛(溶于pbs)固定和triton-x100(溶于pbs,0.1%)破膜,并以鼠抗人β-globin单克隆抗体-fitc染色,通过本领域熟知的基于fitc信号的流式细胞方法检测表达人β-globin蛋白的k562细胞的百分比,以及人β-globin蛋白表达信号的强弱。
[0123]
数据如表2所示,当以相同的感染复数感染k562细胞,并且获得了非常近似的慢病毒拷贝数时,慢病毒载体p005获得了明显优于慢病毒载体p006的β-globin蛋白表达信号。
[0124]
表3 k562细胞β-globin蛋白表达信号
[0125][0126]
实施例5β-globin基因表达慢病毒载体的进一步设计
[0127]
除了对β-globin基因表达慢病毒载体包含的顺式作用元件做了上述优化之外,本发明也对β-globin的基因表达框架进行了针对性优化,其中包括基因内含子序列、基因编码序列等方面。
[0128]
从p006的基础上,我们设计了p009、p011、p012、p015、p019、p021另外5个结构(如图4),分别为完全野生型人β-globin基因序列(p009)、编码序列经方法三优化后的p006β-globin基因序列(p011)、编码序列经方法四优化后的p006β-globin基因序列(p012)、编码序列经方法四优化后的全长2号内含子t87q突变人β-globin基因序列(p015)、编码序列经方法二优化后的全长2号内含子无突变人β-globin基因序列(p019)、以及基于编码序列经方法四优化后的全长2号内含子t87q突变人β-globin基因序列的去掉wpre版本(p021)。
[0129]
实施例6β-globin基因慢病毒载体的构建:
[0130]
以本领域熟知的pcr扩增的方法,以来自人源细胞系293t(购自美国模式菌种收集中心(atcc),保藏号为crl-3216)基因组dna为模板扩增完全野生型人β-globin基因序列(核苷酸序列seq id no:12),再通过本领域熟知的同源重组的方法克隆至慢病毒载体pkl-kan-th-p006上的cppt/cts与lcr之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p009(核苷酸序列seq id no:13)。
[0131]
实施例5设计的编码序列经方法三优化后的p006β-globin基因序列(核苷酸序列seq id no:14),经南京金斯瑞生物技术有限公司合成后,通过同源重组的方法克隆至慢病毒载体pkl-kan-th-p006上的β-globin-enhancer与β-globin-promoter之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p011(核苷酸序列seq id no:15)。
[0132]
实施例5设计的编码序列经方法四优化后的p006β-globin基因序列(核苷酸序列seq id no:16),经南京金斯瑞生物技术有限公司合成后,通过同源重组的方法克隆至慢病毒载体pkl-kan-th-p006上的β-globin-enhancer与β-globin-promoter之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p012(核苷酸序列seq id no:17)。
[0133]
以本领域熟知的pcr扩增的方法,以构建好的pkl-kan-th-p009质粒dna为模板扩增全长2号内含子序列,再通过同源重组的方法克隆至慢病毒载体pkl-kan-th-p012上的exon2与exon3之间,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p015(核苷酸序列seq id no:18)。
[0134]
通过位点突变试剂盒(购自诺维赞生物科技有限公司,货号c214),以本领域熟知的pcr扩增的方法将慢病毒载体pkl-kan-th-p015上的t87q突变回t,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p019(核苷酸序列seq id no:19)。
[0135]
以pkl-kan-th-p015为模板,通过本领域熟知的同源重组的方法,将pkl-kan-th-p015质粒上的wpre序列去掉后分两个片段扩增重组转化,克隆完成后以测序确认序列信息,命名为pkl-kan-th-p021(核苷酸序列seq id no:20)。
[0136]
实施例7β-globin基因慢病毒的表达效率检测
[0137]
以实施例4中描述的方法检测实施例6中构建的β-globin基因表达慢病毒载体的基因表达效率。
[0138]
首先在293t细胞系中进行用实施例6中构建的β-globin基因治疗载体pkl-kan-th-p006、pkl-kan-th-p011、pkl-kan-th-p012、包装慢病毒,制备好的病毒重悬液分装冻存于-80度备用。
[0139]
随后我们在细胞系中验证β-globin基因慢病毒表达载体的细胞内表达。根据上述步骤计算出的慢病毒载体重悬液感染滴度,以下表(表3)所示的感染复数(multiple of infection,moi)将慢病毒载体接种于在96孔细胞培养板中预铺于板中的k562细胞系中,分别于感染后第5,10天收取部分细胞用于以下实验:
[0140]
1.收集慢病毒载体感染k562细胞,裂解细胞和抽提总dna。
[0141]
以定量pcr以及基于gfp信号的流式细胞仪数据计算出k562细胞感染慢病毒拷贝数(vector copy number,vcn)。
[0142]
表4 k562细胞感染慢病毒拷贝数
[0143][0144]
2.收集慢病毒载体感染k562细胞,通过基于pe信号的流式细胞方法检测表达人β
[0145]-globin蛋白的k562细胞的百分比,以及人β-globin蛋白表达信号的强弱。
[0146]
表5,k562细胞β-globin蛋白表达信号
[0147][0148]
数据显示,当以相同的感染复数感染k562细胞,并且获得了非常近似的慢病毒拷贝数时。慢病毒载体p011、p012获得了优于慢病毒载体p006的β-globin蛋白表达信号。其中p012优势更加明显。
[0149]
实施例8β-globin基因慢病毒的表达效率检测
[0150]
以实施例4中描述的方法检测实施例6中构建的β-globin基因慢病毒载体的基因表达效率。
[0151]
首先在293t细胞系中进行用实施例6中构建的β-globin基因治疗载体pkl-kan-th-p006、pkl-kan-th-p009、pkl-kan-th-p012、pkl-kan-th-p015、pkl-kan-th-p019包装慢病毒,制备好的病毒重悬液分装冻存于-80度备用。
[0152]
随后我们在细胞系中验证β-globin基因慢病毒载体的细胞内表达。根据上述步骤计算出的慢病毒载体重悬液感染滴度,以表5所示的感染复数(multiple of infection,moi)将慢病毒载体接种于预铺于96孔细胞培养板中的k562细胞系中,分别于感染后第5,10天收取部分细胞用于以下实验:
[0153]
1.收集慢病毒载体感染k562细胞,裂解细胞和抽提总dna。
[0154]
以定量pcr以及基于gfp信号的流式细胞仪数据计算出k562细胞感染慢病毒拷贝数(vector copy number,vcn)。
[0155]
表6 k562细胞感染慢病毒拷贝数
[0156][0157]
2.收集慢病毒载体感染k562细胞,通过基于pe信号的流式细胞方法检测表达人β-globin蛋白的k562细胞的百分比,以及人β-globin蛋白表达信号的强弱。
[0158]
结果如表6所示,当以相同的感染复数感染k562细胞,并且获得了非常近似的慢病毒拷贝数时。慢病毒载体p012、p015获得了明显优于其它慢病毒载体的β-globin蛋白表达信号。
[0159]
表7 k562细胞β-globin蛋白表达信号
[0160][0161]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。