本发明涉及一种用金属制氢的电池。
背景技术:
当前我国能源供应日趋紧张,提高能源利用效率、节约能源等任务十分紧迫。除了要提高能源的利用效率,寻找可持续应用的能源来代替传统的化石燃料能源的任务更是迫在眉睫。氢气是一种公认的可再生清洁能源,具有热值高、对环境友好等优势,可以降低对日益枯竭的化石能源的依赖。但过高的制氢成本和能耗以及制氢过程中对环境的污染,成为限制氢能得到大规模发展的不利因素。因此,开展经济环保、操作简单的氢生产技术是制氢领域的首要任务。
利用活泼金属与水结合的电化学制氢技术是一种高效、清洁、可控的制氢方式。利用活泼金属,如锂、镁、铝、锌等金属与高活性析氢电极组成一次金属—水系储氢电池,可以制取高纯度的氢气,在析氢的同时电池还可以对外进行供电。这种电池装置只需要消耗金属和水,不需要接入外电源,只需控制外部电流的大小间接地控制氢气产量。
然而,像锂、镁、铝三种金属单质过于活泼,在绝大多数电解液中都极易发生自溶解析氢,避开了电化学制氢的步骤,导致金属所蕴含的部分能量得不到利用,制氢过程中氢气产量得不到精确的控制。而专利cn101748419a公开了一种金属锂电化学制备氢气的方法,为了避免金属锂和水溶液电解液之间的副反应,该专利所述锂金属表面带有一层耐水的锂离子导电膜,这样做虽然可以使析氢过程得到控制,但使得锂金属电极的反应变得相对困难,增加了一定的能耗。
以金属锌为例。锌是一种活泼金属,锌的矿藏储量也十分的丰富,并且锌十分适合当做电池的阳极电极来使用,金属锌也是牺牲阳极进行阴极保护的常用电极材料。金属锌和水之间的反应在环境温度下是不可持续的,即锌在中性或弱酸、弱碱溶液中不易被溶解,难以与水反应置换出氢气。当溶液为强酸或强碱溶液时,锌才容易与水反应置换出氢气,且当溶液ph大于14时,锌越容易溶解和置换氢气。因此,利用电化学的方法使金属锌在强碱溶液进行反应从而置换氢气是一种有效可控的制氢方法。
然而,仅在一种电解液下工作的锌-水制氢电池具有较低的工作电压,从而导致较低的能量密度。如在强碱性电解液中,锌电极释放氢气时电极表面发生氧化反应的反应式为:zn 4oh-→zn(oh)42- 2e-,析氢电极上发生还原反应的反应式为:2h2o 2e-→h2 2oh-,锌电极的标准电位e0=-1.216v,析氢电极的标准电位e0=-0.828v,这种情况下,外电路得到的电池理论电压为-0.828v-(-1.216v)=0.388v,随着外电路放电电流的提高以及析氢过电位等因素作用,电池工作电压还会相应地降低。所以整个电池体系除了得到氢气之外,仅有少量的能量可以加以利用。除此之外,仅在碱性电解液下工作的锌—水制氢电池在制氢放电过程中,由于锌溶解的产物会附着在析氢电极表面,不仅影响了氢气的析出,而且会导致恒流放电的电压出现不稳定的现象。
现有技术中,在电化学合成工业中,同时利用阴、阳两极电极反应进行电合成的成对电解技术出现,但仅限于少数特定的反应。因此,电能的消耗和浪费已成为电合成工业进一步发展的瓶颈,如何降低用电大户之一的电合成工业的电力消耗、提高电能利用率,不仅是我国节能减排的重大科技任务,也是电合成行业自身降低成本,提高竞争力的关键。前述金属制氢也存在类似问题,制氢后的电解液需要恢复,简单的充电将导致正极析氧、能耗大、能量效率差。
技术实现要素:
本发明的目的是提供一种用金属制氢的电池,不仅能够提高制氢电池的放电电压,同时还能在金属制氢电池恢复中电合成获得新的目标产品,达到储能、节电和增益的效果。
为达到上述目的,本发明采用的技术方案是:
一种用金属制氢的电池,包括第一电解液槽、依次排列的设于所述第一电解液槽中的第一阳离子交换膜和第一阴离子交换膜,所述第一阳离子交换膜和所述第一阴离子交换膜用于将所述第一电解液槽沿排列方向隔出第一碱性槽、第一中性槽和第一酸性槽;
所述电池还包括分别设于所述第一碱性槽、第一中性槽和第一酸性槽中的碱性电解液、中性电解液和酸性电解液;
所述电池还包括可相互替换的设于所述第一碱性槽中的金属阳极或氧阴极、可相互替换的设于所述第一酸性槽中的析氢阴极或惰性阳极;
所述碱性电解液包括氢氧化钾、氢氧化锂、氢氧化钠、碳酸钠、碳酸钾中的至少一种;
所述中性电解液包括硫酸盐、甲基磺酸盐、氟磺酸盐、氨基磺酸盐、氟甲基磺酸盐、苯磺酸盐、氯酸盐、高氯酸盐中的至少一种;
所述酸性电解液包括硫酸、甲基磺酸、氟磺酸、氨基磺酸、氟甲基磺酸、苯磺酸、氯酸、高氯酸中的至少一种;
所述电池具有放电状态和充电状态:
所述电池处于所述放电状态时,所述金属阳极和所述析氢阴极分别设于所述第一碱性槽和所述第一酸性槽中,所述金属阳极和所述析氢阴极通过外电路电连接;
所述电池处于所述充电状态时,所述氧阴极和所述惰性阳极分别设于所述第一碱性槽和所述第一酸性槽中,以所述惰性阳极作为正极、所述氧阴极作为负极进行充电。
优选地,所述金属阳极为金属锌、金属铝、金属镁中的至少一种。
优选地,所述析氢阴极为金、铂、钯、镍铜合金、铁酸镧掺杂镍铜合金中的至少一种。
优选地,所述惰性阳极为碳、金、铂、不锈钢、钛、钛锰合金、二氧化铅、二氧化锰中的至少一种。
优选地,所述酸性电解液包括二价锰盐;或所述酸性电解液包括甲基吡啶、糠醛、乙炔甲醇中的至少一种。
优选地,所述酸性电解液中氢离子的浓度为0.1-10.0mol/l。
更优选地,所述酸性电解液中氢离子的浓度为0.5-3.0mol/l。
优选地,所述碱性电解液中氢氧根离子的浓度为0.1-15.0mol/l。
更优选地,所述碱性电解液中氢氧根离子的浓度为3.0-8.0mol/l。
更进一步优选地,所述碱性电解液中氢氧根离子的浓度为5.5-7.5mol/l。
优选地,所述中性电解液中盐的阴离子与所述酸性电解液中的阴离子相同。
优选地,所述中性电解液中盐的阳离子与所述碱性电解液中的阳离子相同。
优选地,所述氧阴极由pt/c复合催化剂构成,或由mno2催化剂构成,或由mno2/c复合催化剂构成。
一种用金属制氢的电池,包括第一电解液槽、依次排列的设于所述第一电解液槽中的第一阳离子交换膜和第一阴离子交换膜,所述第一阳离子交换膜和所述第一阴离子交换膜用于将所述第一电解液槽沿排列方向隔出第一碱性槽、第一中性槽和第一酸性槽;
所述电池还包括第二电解液槽、依次排列的设于所述第二电解液槽中的第二阳离子交换膜和第二阴离子交换膜,所述第二阳离子交换膜和所述第二阴离子交换膜用于将所述第二电解液槽沿排列方向隔出第二碱性槽、第二中性槽和第二酸性槽;
所述电池还包括分别与所述第一碱性槽和所述第二碱性槽连通的第一泵、分别与所述第一中性槽和所述第二中性槽连通的第二泵、分别与所述第一酸性槽和所述第二酸性槽连通的第三泵;
所述电池还包括分别设于所述第一碱性槽、第一中性槽和第一酸性槽中的碱性电解液、中性电解液和酸性电解液;
所述电池还包括分别设于所述第一碱性槽、第一酸性槽、第二碱性槽和第二酸性槽中的金属阳极、析氢阴极、氧阴极和惰性阳极;
所述碱性电解液包括氢氧化钾、氢氧化锂、氢氧化钠、碳酸钠、碳酸钾中的至少一种;
所述中性电解液包括硫酸盐、甲基磺酸盐、氟磺酸盐、氨基磺酸盐、氟甲基磺酸盐、苯磺酸盐、氯酸盐、高氯酸盐中的至少一种;
所述酸性电解液包括硫酸、甲基磺酸、氟磺酸、氨基磺酸、氟甲基磺酸、苯磺酸、氯酸、高氯酸中的至少一种;
所述电池具有放电状态和充电状态:
所述电池处于所述放电状态时,所述金属阳极和所述析氢阴极通过外电路电连接;
所述电池处于所述充电状态时,所述第一泵、第二泵和第三泵分别用于将所述碱性电解液、中性电解液和酸性电解液泵入所述第二碱性槽、第二中性槽和第二酸性槽中,以所述惰性阳极作为正极、所述氧阴极作为负极进行充电;
所述电池能够同时处于所述放电状态和所述充电状态。
优选地,所述金属阳极为金属锌、金属铝、金属镁中的至少一种。
优选地,所述析氢阴极为金、铂、钯、镍铜合金、铁酸镧掺杂镍铜合金中的至少一种。
优选地,所述惰性阳极为碳、金、铂、不锈钢、钛、钛锰合金、二氧化铅、二氧化锰中的至少一种。
优选地,所述酸性电解液包括二价锰盐;或所述酸性电解液包括甲基吡啶、糠醛、乙炔甲醇中的至少一种。
优选地,所述酸性电解液中氢离子的浓度为0.1-10.0mol/l。
更优选地,所述酸性电解液中氢离子的浓度为0.5-3.0mol/l。
优选地,所述碱性电解液中氢氧根离子的浓度为0.1-15.0mol/l。
更优选地,所述碱性电解液中氢氧根离子的浓度为3.0-8.0mol/l。
更进一步优选地,所述碱性电解液中氢氧根离子的浓度为5.5-7.5mol/l。
优选地,所述中性电解液中盐的阴离子与所述酸性电解液中的阴离子相同。
优选地,所述中性电解液中盐的阳离子与所述碱性电解液中的阳离子相同。
优选地,所述氧阴极由pt/c复合催化剂构成,或由mno2催化剂构成,或由mno2/c复合催化剂构成。
由于上述技术方案的运用,本发明与现有技术相比具有下列优点:本发明一种用金属制氢的电池,可扩大放电电压和恢复电解液,实质是制氢时利用酸性电解液中的氢离子还原电位高于碱性电解液中的氢离子还原电位,使得电池的整体放电电压大幅度提高。恢复性充电时,通过补水等调整体系耗水,并将由离子交换膜分隔的酸性电解液、中性电解液和碱性电解液中的离子浓度基本回复到初始状态从而恢复整个电池;同时利用碱性电解液中氧阴极电位高于阴极析氢电位,使恢复用充电电池的理论充电电压处于较低的预期,比单纯类似电渗析或电解水恢复酸性电解液、中性电解液和碱性电解液中的离子浓度时的理论充电电压低很多(碱性电解液中氧阴极电位为0.401v,碱性电解液中阴极析氢电位-0.828v)。
本发明与现有技术相比,还具有如下优点:
1、本发明以牺牲金属阳极得到氢气,其中氢气从酸性电解液中产生,容易去杂质。这是由于碱性电解液中产生的氢气夹杂碱雾,在分离提纯中会在管道等分离设施中结晶成碱或盐固体,造成后续处理难题;而酸性电解液产生的氢气夹杂酸雾,不会在管道等分离设施中结晶出固体。
、本发明提供的制氢电池更好的利用了牺牲金属阳极自身蕴含能量,在控制相同放电电流的条件下本发明提供的制氢电池的放电电压响应更高且更稳定。
、本发明提供的制氢电池的电解液可以通过充电的方式恢复,该过程仅耗费水,而且充电过程消耗的电能较小。
、本发明提供的制氢电池在恢复中利用氧气电解液中的目标物进行有目的的电合成,或者电解液中的目标物在正极上沉积,则用于金属制氢电池恢复的电量得到有效利用,同时获得了新的目标产品。达到储能、节电和增益的效果,具有较强的实用性。
附图说明
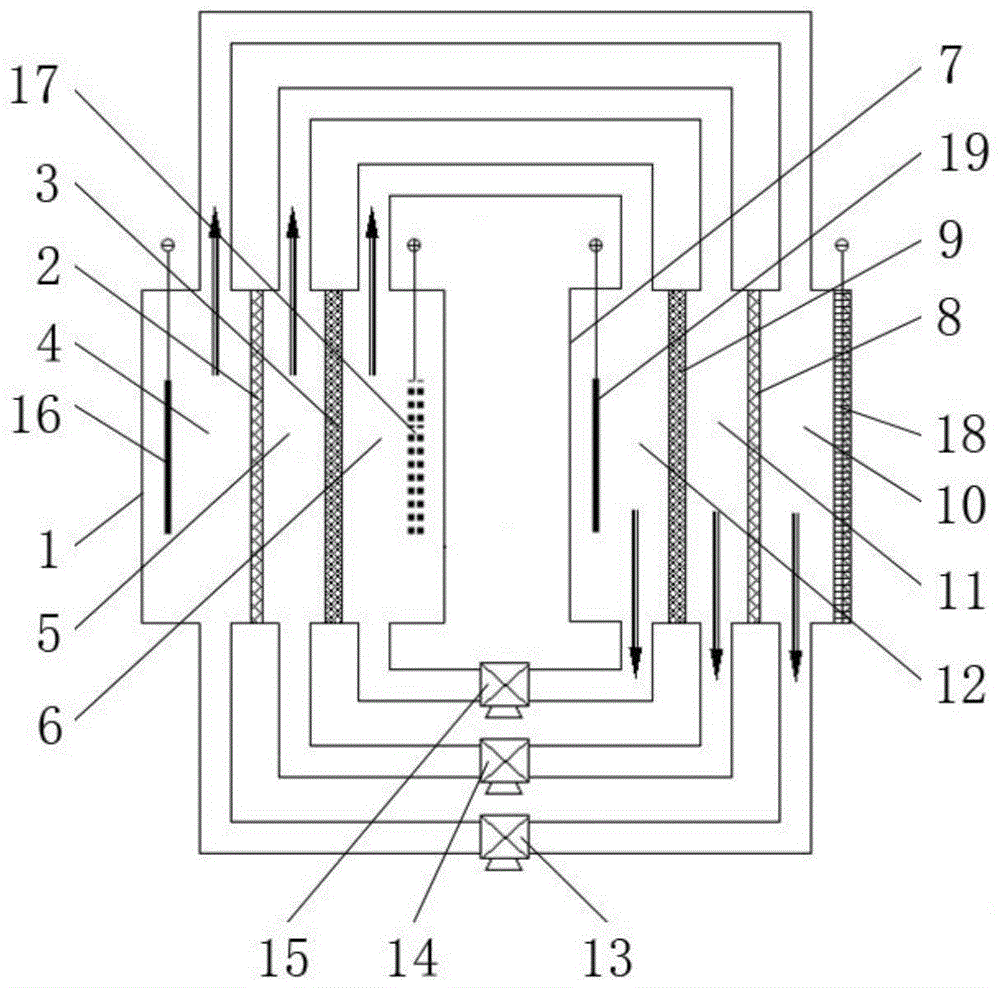
附图1为根据本发明具体实施例2的金属制氢的电池的结构示意图;
附图2为实施例3中本发明电池结构中金属锌制氢电池的放电电压示意图;
附图3为实施例3中对比例中金属锌制氢电池的放电电压示意图。
其中:1、第一电解液槽;2、第一阳离子交换膜;3、第一阴离子交换膜;4、第一碱性槽;5、第一中性槽;6、第一酸性槽;7、第二电解液槽;8、第二阳离子交换膜;9、第二阴离子交换膜;10、第二碱性槽;11、第二中性槽;12、第二酸性槽;13、第一泵;14、第二泵;15、第三泵;16、金属阳极;17、析氢阴极;18、氧阴极;19、惰性阳极。
具体实施方式
下面结合具体实施例和附图来对本发明的技术方案作进一步的阐述。但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件。本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。如无特别说明,本发明的实施例中的原料和试剂均通过商业途径购买。
实施例1
一种用金属制氢的电池,包括第一电解液槽1、依次排列的设于第一电解液槽1中的第一阳离子交换膜2和第一阴离子交换膜3,第一阳离子交换膜2和第一阴离子交换膜3用于将第一电解液槽1沿排列方向隔出第一碱性槽4、第一中性槽5和第一酸性槽6。具体结构可参考图1中左半部分。
电池还包括分别设于第一碱性槽4、第一中性槽5和第一酸性槽6中的碱性电解液、中性电解液和酸性电解液。
电池还包括可相互替换的设于第一碱性槽4中的金属阳极16或氧阴极18、可相互替换的设于第一酸性槽6中的析氢阴极17或惰性阳极19。
碱性电解液包括氢氧化钾、氢氧化锂、氢氧化钠、碳酸钠、碳酸钾中的至少一种;中性电解液包括硫酸盐、甲基磺酸盐、氟磺酸盐、氨基磺酸盐、氟甲基磺酸盐、苯磺酸盐、氯酸盐、高氯酸盐中的至少一种;酸性电解液包括硫酸、甲基磺酸、氟磺酸、氨基磺酸、氟甲基磺酸、苯磺酸、氯酸、高氯酸中的至少一种。
电池具有放电状态和充电状态:
电池处于放电状态时,金属阳极16和析氢阴极17分别设于第一碱性槽4和第一酸性槽6中,金属阳极16和析氢阴极17通过外电路电连接;
电池处于充电状态时,氧阴极18和惰性阳极19分别设于第一碱性槽4和第一酸性槽6中,以惰性阳极19作为正极、氧阴极18作为负极进行充电。
金属阳极16为金属锌、金属铝、金属镁中的至少一种。析氢阴极17为金、铂、钯、镍铜合金、铁酸镧掺杂镍铜合金中的至少一种。惰性阳极19为碳、金、铂、不锈钢、钛、钛锰合金、二氧化铅、二氧化锰中的至少一种。酸性电解液包括二价锰盐;或酸性电解液包括甲基吡啶、糠醛、乙炔甲醇中的至少一种。
上述用金属制氢的电池为单槽结构,电解液不需要更换或流动,可以通过搅拌或振动电极以降低极化。
电池处于放电状态时,金属阳极16氧化并通过外电路将电子传给析氢阴极17,从而将酸性电解液中的氢离子还原成氢气;同时阴离子从酸性电解液经第一阴离子交换膜3进入中性电解液中,阳离子从碱性电解液经第一阳离子交换膜2进入中性电解液中,从而达到电量平衡。以金属锌作为金属阳极16为例,该电池的理论电压为1.216v,远高于现有碱性电解液中的锌-水制氢电池理论电压0.388v。
电池处于充电状态时,用惰性阳极19替换析氢阴极17、用氧阴极18替换金属阳极16,并以惰性阳极19为正极进行充电;正极产生氢离子,负极产生氢氧根离子,同时阴离子从中性电解液经第一阴离子交换膜3进入酸性电解液中,阳离子从中性电解液经第一阳离子交换膜2进入碱性电解液中,从而将电池恢复到初始状态。此时正极惰性阳极19的理论电位为1.229v,负极氧阴极18的理论电位为0.401v(氧阴极18上发生的反应过程为氧气还原为氢氧根离子,即反应式为o2 2h2o 4e-→4oh-,标准电位e0=0.401v),恢复用充电电池的理论充电电压为0.828v。因此,恢复用充电电池的理论充电电压低于制氢电池的输出理论电压,充电消耗氧,放电制氢。当然,恢复时需要适当向体系中加入水,并以适当方式取出金属制氢后的产物(本例中为氧化锌)。
实施例2
参见图1所示,一种用金属制氢的电池,包括第一电解液槽1、依次排列的设于第一电解液槽1中的第一阳离子交换膜2和第一阴离子交换膜3,第一阳离子交换膜2和第一阴离子交换膜3用于将第一电解液槽1沿排列方向隔出第一碱性槽4、第一中性槽5和第一酸性槽6。
电池还包括第二电解液槽7、依次排列的设于第二电解液槽7中的第二阳离子交换膜8和第二阴离子交换膜9,第二阳离子交换膜8和第二阴离子交换膜9用于将第二电解液槽7沿排列方向隔出第二碱性槽10、第二中性槽11和第二酸性槽12。
电池还包括分别与第一碱性槽4和第二碱性槽10连通的第一泵13、分别与第一中性槽5和第二中性槽11连通的第二泵14、分别与第一酸性槽6和第二酸性槽12连通的第三泵15。
电池还包括分别设于第一碱性槽4、第一中性槽5和第一酸性槽6中的碱性电解液、中性电解液和酸性电解液。
电池还包括分别设于第一碱性槽4、第一酸性槽6、第二碱性槽10和第二酸性槽12中的金属阳极16、析氢阴极17、氧阴极18和惰性阳极19。
碱性电解液包括氢氧化钾、氢氧化锂、氢氧化钠、碳酸钠、碳酸钾中的至少一种;中性电解液包括硫酸盐、甲基磺酸盐、氟磺酸盐、氨基磺酸盐、氟甲基磺酸盐、苯磺酸盐、氯酸盐、高氯酸盐中的至少一种;酸性电解液包括硫酸、甲基磺酸、氟磺酸、氨基磺酸、氟甲基磺酸、苯磺酸、氯酸、高氯酸中的至少一种。
电池具有放电状态和充电状态:
电池处于放电状态时,金属阳极16和析氢阴极17通过外电路电连接;
电池处于充电状态时,第一泵13、第二泵14和第三泵15分别用于将碱性电解液、中性电解液和酸性电解液泵入第二碱性槽10、第二中性槽11和第二酸性槽12中,以惰性阳极19作为正极、氧阴极18作为负极进行充电。
电池能够同时处于放电状态和充电状态,此时:第一泵13用于将碱性电解液连续性或间断性的在第一碱性槽4和第二碱性槽10之间循环输送;第二泵14用于将中性电解液连续性或间断性的在第一中性槽5和第二中性槽11之间循环输送;第三泵15用于将酸性电解液连续性或间断性的在第一酸性槽6和第二酸性槽12之间循环输送。
显然,电池能够仅处于放电状态,也能够仅处于充电状态。
金属阳极16为金属锌、金属铝、金属镁中的至少一种。析氢阴极17为金、铂、钯、镍铜合金、铁酸镧掺杂镍铜合金中的至少一种。惰性阳极19为碳、金、铂、不锈钢、钛、钛锰合金、二氧化铅、二氧化锰中的至少一种。酸性电解液包括二价锰盐;或酸性电解液包括甲基吡啶、糠醛、乙炔甲醇中的至少一种。
上述用金属制氢的电池为双槽结构:
放电完成后,第一泵13用于将第一碱性槽4中的碱性电解液泵入第二碱性槽10中,第二泵14用于将第一中性槽5中的中性电解液泵入第二中性槽11中,第三泵15用于将第一酸性槽6中的酸性电解液泵入第二酸性槽12中;
充电完成后,第一泵13用于将第二碱性槽10中的碱性电解液泵入第一碱性槽4中,第二泵14用于将第二中性槽11中的中性电解液泵入第一中性槽5中,第三泵15用于将第二酸性槽12中的酸性电解液泵入第一酸性槽6中。
电池处于放电状态时,金属阳极16氧化并通过外电路将电子传给析氢阴极17,从而将酸性电解液中的氢离子还原成氢气;同时阴离子从酸性电解液经第一阴离子交换膜3进入中性电解液中,阳离子从碱性电解液经第一阳离子交换膜2进入中性电解液中,从而达到电量平衡。
电池处于充电状态时,以惰性阳极19为正极进行充电,正极产生氢离子,负极产生氢氧根离子,同时阴离子从中性电解液经第二阴离子交换膜9进入酸性电解液中,阳离子从中性电解液经第二阳离子交换膜8进入碱性电解液中,从而将电池电解液恢复到初始状态。
以金属锌作为金属阳极16为例,该制氢电池的理论电压为1.216v,远高于现有碱性电解液中的锌-水制氢电池理论电压0.388v。恢复用充电电池,以含二价锰盐的酸性电解液为例,充电时惰性阳极19上产生二氧化锰沉积(即以获得二氧化锰材料作为电合成的目标产品),此时正极惰性阳极19的理论电位为1.208v,负极氧阴极18的理论电位为0.401v;恢复用充电电池的理论充电电压为0.807v。因此,恢复用充电电池的理论充电电压低于制氢电池的输出理论电压,充电消耗氧,放电制氢。当然,恢复时需要适当向体系中加入水和二价锰盐,并以适当方式取出金属制氢后的产物(本例中为氧化锌)。
在酸性电解液中,所选的析氢阴极17在保证较好的催化活性与较低的析氢过电位外,耐酸腐蚀性能要好,这关系到整个制氢过程的稳定性。当以纯金属作为析氢电极时,优选pt族贵金属,如pt、pd等;此外贵金属的氧化物或合金的催化效果也很好,如ruo2、iro2等。ni金属有着良好的析氢性能,但在酸性溶液中析氢过程不稳定,可以通过掺入其它元素与ni元素形成ni基合金,如ni-cu、ni-p、ni-s等二元合金,以及ni-co-p、ni-w-p等三元合金;除了ni基合金外,mo基化合物或合金在酸性溶液中也有较好的催化性能及稳定性,如mos2等。
实施例3
本例采用实施例1中的电池结构。
以铁酸镧掺杂镍铜合金为析氢阴极17,制备方法如下。称取la(no3)3•6h2o和fe(no3)3•9h2o各0.02mol分别溶解于40ml的去离子水中,等到完全溶解后再混合搅拌均匀,将0.06mol的柠檬酸加入到混合溶液中,将混合溶液搅拌均匀后再加入适量氨水调节ph至中性。将溶液超声处理30min,然后置于80℃的恒温水浴磁力搅拌器中直至生成凝胶。将湿凝胶在110℃干燥箱中干燥后研磨后放入马弗炉中,以5℃/min的升温速率加热,并在800℃处保持2h,最终得到黄色lafeo3样品。电沉积ni-cu-lafo3的溶液组成及工艺方法:niso4•6h2o(0.5mol/l)、cuso4•5h2o(0.05mol/l)、h3bo3(30g/l)、c6h5na3o7•2h2o(70g/l)、nacl(8g/l)、lafeo3(15g/l);电流密度50ma/cm2,温度为40℃,电沉积时间为10min,溶液搅拌转速为200r/min。电沉积之前,先将电沉积溶液超声处理30min使lafeo3颗粒均匀分散,然后进行24h的持续磁力搅拌。采用两电极方法进行复合电沉积;电沉积前,先将不锈钢片或镍铜合金片工作电极置于丙酮中超声处理30min,用去离子水冲洗干净后备用,对电极采用铂片,电沉积后所得工作电极为ni-cu-lafeo3复合电极(铁酸镧掺杂镍铜合金析氢阴极17)。
以金属锌片为金属阳极16,金属锌片为市售纯锌箔。
以pt/c复合催化剂为氧阴极18,为市售成品电极。
以钛锰合金为惰性阳极19,该钛锰合金为工业电解二氧化锰用阳极。
酸性电解液选用0.5mol/l的h2so4 0.5mol/l的mnso4水溶液;碱性电解液则选用6mol/l的koh水溶液;中性电解液选用0.5mol/l的k2so4水溶液。
制氢电池及其放电测试:
以铁酸镧掺杂镍铜合金作为析氢阴极17(正极)、电极有效面积为2.0*2.0cm2,裁取金属锌片作为金属阳极16(负极),两电极通过外电路连接在land充放电仪上(武汉蓝电公司产),与电解液共同形成回路。其中析氢阴极17在酸性电解液中,酸性电解液与中性电解液用第一阴离子交换膜3(huamotech公司)分隔;金属阳极16在碱性电解液中,碱性电解液与中性电解液用第一阳离子交换膜2(杜邦公司nafion117)分隔。
采用land充放电仪测试,设置放电电流密度为10ma/cm2,放电1h的放电曲线参见附图2。由图可知,本实施例提供的金属锌制氢电池的放电电压能够维持在1.05v左右(较理论值1.216v约降低200mv,主要是各种极化造成的),1h放电电压基本没有衰减。
作为比较,附图3可见,以相同的两电极置于单一的6mol/l的koh溶液中进行放电制氢时,放电电压初期约0.28v(较理论值0.388v约降低100mv,主要是各种极化造成的),但随着时间的增加放电电压呈持续衰减趋势(对比电池的析氢阴极17为市售雷尼镍电极)。可见,本发明提供的金属锌制氢电池具有约1.0v的输出电压,远高于金属锌直接在6mol/l的koh溶液中放电制氢的输出电压(放电电压初期仅约0.28v);铁酸镧掺杂镍铜合金作为析氢阴极17也比市售雷尼镍电极稳定性好。
上述金属锌制氢电池放电制氢时,阴离子硫酸根离子从酸性电解液经第一阴离子交换膜3进入中性电解液中,阳离子钾离子从碱性电解液经第一阳离子交换膜2进入中性电解液中,从而达到电量平衡。
为恢复上述制氢电池放电后的电解液变化,以惰性阳极19(有效面积2.0*2.0cm2)替换析氢阴极17、用氧阴极18(有效面积2.0*2.0cm2)替换金属阳极16,并以惰性阳极19为正极进行充电。充电过程中正极产生二氧化锰沉积(同时产生氢离子),负极产生氢氧根离子,同时阴离子硫酸根离子从中性电解液经第二阴离子交换膜9进入酸性电解液中,阳离子钾离子从中性电解液经第二阳离子交换膜8进入碱性电解液中,从而将电池恢复到初始状态。采用land充放电仪进行充电测试,设置充电电流密度为10ma/cm2、充电1h,电池恢复到初始状态。
根据测试数据,充电电压基本稳定在0.80v左右(因酸性电解液、碱性电解液浓度均较标准值高,理论电压低于0.807v;本实验充电电流密度较低从而能极化较低);正极惰性阳极19表面可见明显的二氧化锰沉积层,二氧化锰沉积的电流效率约为70%。
实施例4
本例采用实施例1中的电池结构。
以镍铜合金为析氢阴极17,其中镍铜合金为市售蒙耐尔合金(铜含量约28%)。
以金属锌片为金属阳极16,金属锌片为市售纯锌箔。
以mno2/c复合催化剂为氧阴极18,为市售成品电极。
以表面沉积有二氧化铅的钛阳极为惰性阳极19,为工业电解水用钛阳极。
酸性电解液选用3.0mol/l的h2so4水溶液;碱性电解液则选用6mol/l的koh水溶液;中性电解液选用0.1mol/l的k2so4水溶液。
采用land充放电仪测试,设置放电电流密度为10ma/cm2进行放电测试:以析氢阴极17(正极)、金属阳极16(负极)通过外电路连接在land充放电仪上(武汉蓝电公司产),与电解液共同形成回路。其中析氢阴极17在酸性电解液中,酸性电解液与中性电解液用第一阴离子交换膜3(huamotech公司)分隔;金属阳极16在碱性电解液中,碱性电解液与中性电解液用第一阳离子交换膜2(杜邦公司nafion117)分隔。测试表明,该金属锌制氢电池的放电电压能够维持在1.0v左右(较理论值1.216v约降低200mv,主要是各种极化造成的),1h放电电压基本没有衰减。
为恢复上述制氢电池放电后的电解液变化,以惰性阳极19(有效面积2.0*2.0cm2)替换析氢阴极17、用氧阴极18(有效面积2.0*2.0cm2)替换金属阳极16,并以惰性阳极19为正极进行充电,其余设置与实例3中相同。充电时,正极钛阳极上产生氧气,电池充电电压约1.4v(钛阳极上氧气析出极化较大)。
实施例5
本例采用实施例2中的电池结构。
以铁酸镧掺杂镍铜合金为析氢阴极17,制备方法与实施例3中相同。
以金属锌片为金属阳极16,金属锌片为市售纯锌箔。
以pt/c复合催化剂为氧阴极18,为市售成品电极。
以钛锰合金为惰性阳极19,该钛锰合金为工业电解二氧化锰用阳极。
酸性电解液选用0.5mol/l的h2so4 0.5mol/l的mnso4水溶液;碱性电解液则选用6mol/l的koh水溶液;中性电解液选用0.5mol/l的k2so4水溶液。
上述电极有效面积3.5*2.0cm2,第一电解液槽1中以铁酸镧掺杂镍铜合金作为析氢阴极17(正极)、金属锌片作为金属阳极16(负极),两电极通过外电路连接在land充放电仪上(武汉蓝电公司产),与电解液共同形成回路。其中析氢阴极17在酸性电解液中,酸性电解液与中性电解液用第一阴离子交换膜3(huamotech公司)分隔;金属阳极16在碱性电解液中,碱性电解液与中性电解液用第一阳离子交换膜2(杜邦公司nafion117)分隔。
恢复充电用的第二电解液槽7中设有惰性阳极19(正极)和氧阴极18(负极),两电极通过外电路连接在land充放电仪上(武汉蓝电公司产),与电解液共同形成回路。其中惰性阳极19在酸性电解液中,酸性电解液与中性电解液用第二阴离子交换膜9(huamotech公司)分隔;氧阴极18在碱性电解液中,碱性电解液与中性电解液用第二阳离子交换膜8(杜邦公司nafion117)分隔。
参见图1所示,用三个泵将第一电解液槽1和第二电解液槽7的对应电解液连接起来成闭合溶液回路,从而构成双槽式金属锌制氢电池体系。其中,第一碱性槽4上端和第二碱性槽10上端直接连通,第一碱性槽4下端和第二碱性槽10下端通过第一泵13连通;第一中性槽5上端和第二中性槽11上端直接连通,第二中性槽11下端和第二中性槽11下端通过第二泵14连通;第一酸性槽6上端和第二酸性槽12上端直接连通,第一酸性槽6下端和第二酸性槽12下端通过第三泵15连通。
采用land充放电仪设置制氢电池的放电电流密度为10ma/cm2、恢复用充电电池充电电流密度为10ma/cm2,放电/充电持续1h,也可得到附图2中所示的放电曲线。其他测试结果,可参考实施例3和实施例4。
在本实施例中,双槽式金属锌制氢电池结构可以不间断获得氢气和二氧化锰(需定期向体系中补充水和锰盐,并需定期从体系中分离氧化锌沉淀;泵需间歇性或连续性运行以使制氢电池和恢复用充电电池的对应电解液保持相对稳定),不仅能够持续获得两种目标产品,同时还能得到较高的电池电压输出(电合成二氧化锰的电压相对较低)。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围内。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。