本发明涉及光敏剂复合材料制备领域,尤其涉及一种牛血清蛋白自组装三苯胺类光敏剂及制备方法与应用。
背景技术:
癌症已经成为这个社会最致命的疾病之一,全世界每年花费数十亿美元用于研究,以治愈或提高癌症治疗水平。
传统的癌症治疗方法包括手术、放疗和化疗,这三种方法容易导致正常器官功能丧失,产生严重的副作用。而光动力疗法,作为一种新型癌症治疗方法,具有微创性、靶向性、精准性和新颖性,其能在保留正常组织的同时,选择性地杀伤癌细胞。光动力疗法的作用原理为:利用光动力效应,使特定波长照射肿瘤部位,并使选择性聚集在肿瘤组织的光敏剂活化,引发光化学反应破坏肿瘤。其中,光敏剂在“光动力疗法”中发挥了极其重要的作用,其将能量传递给周围的氧,生成活性很强的单态氧,产生细胞毒性,从而杀伤肿瘤细胞。
血清白蛋白(sa)是血浆中最丰富的循环蛋白,参与各种新陈代谢过程,如测定血浆致癌压力、调节流体分布、对抗毒素活性、控制血浆抗氧化性能等。值得注意的是,sa具有出色的内源性负载能力和外源性化合物运输能力。
牛血清白蛋白(bsa)作为sa的同源蛋白,具有sa的优势,且价格低廉,是目前最受欢迎的药物载体之一。bsa的一条多肽链中含有约583个氨基酸残基,不同表面电荷密度的三个结构域影响着bsa表面的吸附能力;其表面有带正电荷和负电荷残基的存在,可分别通过静电作用与带负电荷或正电荷分子相互结合。bsa是循环系统中主要的可溶性蛋白成分,具有多种生理功能,可用于制备蛋白质纳米颗粒。
因此,若将有机小分子光敏剂结合bsa来制备成相应的蛋白质纳米颗粒,并应用于癌细胞光动力学治疗领域,将能有效提升光敏剂在细胞体内的生物相容性增强癌细胞光动力治疗效果。
技术实现要素:
本发明所要解决的技术问题在于提供一种牛血清蛋白自组装三苯胺类光敏剂及制备方法与应用,所合成的有机小分子光敏剂为含双吡啶盐类三苯胺类衍生物,其通过与bsa自组装形成相应纳米颗粒,该纳米光敏剂具有高效ros释放性能,不仅能够大量被宫颈癌细胞摄取,还可在白光照射下快速杀死癌细胞,达到光动力治疗效果。
本发明采用以下技术方案解决上述技术问题:
一种牛血清蛋白自组装三苯胺类光敏剂,由有机小分子光敏剂l与bsa自组装形成;其中,所述有机小分子光敏剂l为含双吡啶盐类三苯胺类衍生物,其通过与bsa自组装形成bsa@l纳米颗粒。
作为本发明的优选方式之一,所述含双吡啶盐类三苯胺类衍生物具体为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶硝酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶-4-甲基苯磺酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶六氟磷酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶三氟乙酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶四苯基硼酸盐中的一种。
一种上述牛血清蛋白自组装三苯胺类光敏剂的制备方法,将所述含双吡啶盐类三苯胺类衍生物分散在甲醇中,缓慢滴加bsa和三乙胺混合水溶液,再超声30min,并搅拌过夜;接着,使用透析袋进行透析;透析后,将所得溶液冷冻干燥24h,即得bsa@l橙色固体;其中,含双吡啶盐类三苯胺类衍生物、bsa和三乙胺之间的质量用量比为1:40:1.0015。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)]-2-吡啶碘盐时,有机小分子光敏剂l表示为l1,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶硝酸盐时,有机小分子光敏剂l表示为l2,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2;
(3)l2的制备
将硝酸银溶解在乙腈溶液中,再加入l1于反应体系中,60~80℃回流反应6h;反应结束,过滤除去沉淀,并浓缩滤液,得红色产物l2,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶硝酸盐;其中,硝酸银与l1之间的摩尔用量比为2:1。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为44-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶-4-甲基苯磺酸盐时,有机小分子光敏剂l表示为l3,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2;
(3)l3的制备
将对甲苯磺酸银溶解在乙腈溶液中,再加入l1于反应体系中,60~80℃温度下回流反应4h;反应结束,过滤除去沉淀,并浓缩滤液,得红色产物l3,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶-4-甲基苯磺酸盐;其中,甲苯磺酸银与l1之间的摩尔用量比为2:1。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶六氟磷酸盐时,有机小分子光敏剂l表示为l4,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2;
(3)l4的制备
将六氟磷酸银溶解在无水乙腈溶液中,再加入l1于反应体系中,60~80℃温度下回流反应2h;反应结束,过滤除去沉淀,并浓缩滤液,得红色产物l4,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶六氟磷酸盐;其中,六氟磷酸银与l1之间的摩尔用量比为2:1。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶三氟乙酸盐时,有机小分子光敏剂l表示为l5,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2;
(3)l5的制备
将三氟乙酸银溶解在无水乙腈溶液中,再加入l1于反应体系中,60~80℃温度下回流反应3h;反应结束,过滤除去沉淀,并浓缩滤液,得红色产物l5,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶三氟乙酸盐;其中,三氟乙酸银与l1之间的摩尔用量比为2:1。
作为本发明的优选方式之一,当所述双吡啶盐类三苯胺类衍生物为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶四苯基硼酸盐时,有机小分子光敏剂l表示为l6,其制备方法如下:
(1)中间体m1的制备
向容器中加入1,2–二(2’-碘乙氧基)-乙烷、4-甲基吡啶和乙醇,60~80℃温度下回流反应24h;反应结束,柱层析分离得白色中间体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,1,2–二(2’-碘乙氧基)-乙烷与4-甲基吡啶之间的摩尔用量比为1:3;
(2)l1的制备
将中间体m1、4-二苯胺基苯甲醛溶于乙醇中,60~80℃温度下回流反应24h;反应结束,并冷却至室温后,先析出红色沉淀,经水洗、抽滤、干燥,得红色固体l1,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐;其中,m1与4-二苯胺基苯甲醛之间的摩尔用量比为1:2;
(3)l6的制备
将四苯基硼钠和l1溶解于无水乙腈中,60~80℃温度下回流反应6h;反应结束,过滤得到红色产物,用乙醇洗涤2~3次得l6,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶四苯基硼酸盐;其中,四苯基硼钠与l1之间的摩尔用量比为2:1。
一种上述牛血清蛋白自组装三苯胺类光敏剂在癌细胞光动力学疗法中的应用。
本发明相比现有技术的优点在于:
(1)本发明以螺旋桨型三苯胺为给电子基团(d),c=c为π桥,带有两个正电荷的醚氧链连接的吡啶盐基团作为吸电子基团(a),通过亲核取代反应、缩合反应以及阴离子交换法等,合成一系列具有双边d-π-a型光敏剂分子l1~l6;将l1~l6分别与牛血清蛋白(bsa)自组装制备出具有良好生物相容性的光敏剂纳米材料bsa@l1~bsa@l6;
经研究发现,bsa@l1~bsa@l6可在体外释放大量ros(1o2);有趣的是,通过细胞摄取实验,可以发现bsa@l1~bsa@l6可以通过胞吞作用被宫颈癌细胞摄取;同时,在白光照射下,bsa@l1~bsa@l6释放ros(1o2),氧化癌细胞,使癌细胞发生凋亡,达到癌细胞光动力治疗效果;因此,本发明探针对于有机光敏剂的合成、蛋白组装纳米颗粒的制备以及癌症光动力学治疗的研究具有重大意义;
(2)本发明制备的以三苯胺类为母体、牛血清蛋白自组装的纳米光敏剂是一类具有高活性氧物种释放的光学材料,暗毒性低,生物相容性好,易被癌细胞摄取,能应用于癌细胞光动力学治疗,具有明显的应用价值;
(3)本发明制备方法原料易得,成本低,合成步骤简单,易于操作。
附图说明
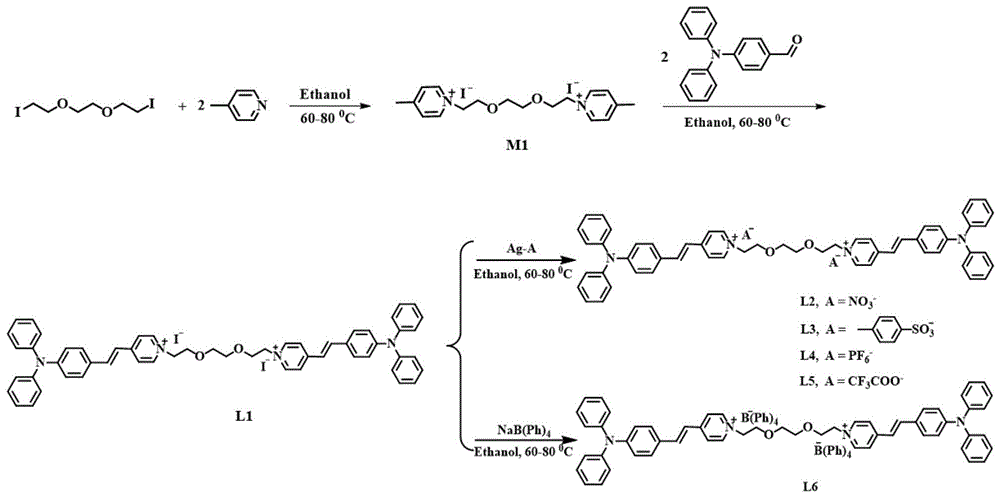
图1是实施例1中有机小分子光敏剂l1~l6的制备方法路线图;
图2是实施例8中不同阴离子双吡啶盐三苯胺类光敏剂l1~l6在pbs中1o2和ros产生对比图(图2中,a图为利用1o2指示剂abda对l1~l6释放1o2/ros的比较图,b图为利用ros指示剂h2dcf-da对l1~l6释放1o2/ros的比较图);
图3是实施例9中阴离子为六氟磷酸根的双吡啶盐三苯胺类光敏剂l4与bsa作用的荧光光谱以及圆二色光谱图(图3中,a图为荧光光谱图,b图为圆二色光谱图);
图4是实施例9中阴离子为l4和bsa作用的核磁共振氢谱图;
图5是实施例10中bsa@l4和l4的共聚焦显微成像图;
图6是实施例10中bsa@l4和l4对宫颈癌细胞黑暗条件、光照条件下细胞毒性测试结果图(图6中,a图为黑暗条件下细胞毒性测试结果图,b图为光照条件下细胞毒性测试结果图)。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例的一种牛血清蛋白自组装三苯胺类光敏剂,由有机小分子光敏剂l与bsa自组装形成;所述有机小分子光敏剂l为含双吡啶盐类三苯胺类衍生物,其通过与bsa自组装形成bsa@l纳米颗粒。
本实施例中,含双吡啶盐类三苯胺类衍生物具体为4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶硝酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶-4-甲基苯磺酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶六氟磷酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶三氟乙酸盐、4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶四苯基硼酸盐中的一种。
为了方便后续描述,现对上述六种含双吡啶盐类三苯胺类衍生物进行简要命名,且分别命名为有机小分子光敏剂l1、有机小分子光敏剂l2、有机小分子光敏剂l3、有机小分子光敏剂l4、有机小分子光敏剂l5、有机小分子光敏剂l6。
l1~l6的结构通式如式(1)所示,制备方法路线参见图1。
实施例2
本实施例的一种上述实施例1中bsa@l1纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
称取1,2–二(2’-碘乙氧基)-乙烷(1.01g,2.7mmol)和4-甲基吡啶(0.76g,8.1mmol),溶于20.0ml无水乙醇中,60~80℃回流,薄层层析法(tlc)示踪反应;反应24h后,反应结束,柱层析分离,得到白色固体m1,即4-二甲基-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐。
产率:64.7%。1hnmr(400mhz,dmso-d6),δ(ppm):8.88-8.86(d,j=8.00hz,4h),8.02-8.01(d,j=4.00hz,4h),4.73-4.70(t,j=6.00hz,4h),3.85-3.83(t,j=4.00hz,4h),3.49(s,4h),2.64(s,6h);13cnmr(100mhz,dmso-d6),δ(ppm):159.12,144.06,128.03,69.42,68.62,59.45,21.47;ms(esi):calcdfor:c18h26n2o22 [m/2],151.10;found,151.0982。
(2)l1的制备
称取中间体m1(1.00g,1.80mmol)、4-二苯胺基苯甲醛(1.23g,4.50mmol)溶于30ml的无水乙醇中,加入0.2ml的哌啶,60~80℃回流反应,tlc示踪反应;反应24h后,反应结束,冷却到室温后,先析出红色沉淀,然后减压抽滤得粗产物,将粗产物用15ml无水乙醇重结晶后得1.20g红色固体粉末l1,即,4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶碘盐。
产率:62.5%。1hnmr(400mhz,dmso-d6),δ(ppm):8.78-8.77(d,j=4.00hz,4h),8.15-8.13(d,j=8.00hz,4h),7.95-7.91(d,j=16.00hz,2h),7.61-7.59(d,j=8.00hz,4h),7.37-7.35(d,j=8.00hz,8h),7.29-7.25(d,j=16.00hz,2h),7.18-7.15(d,j=6.00hz,4h),7.10-7.08(d,j=8.00hz,8h),6.93-6.91(d,j=8.00hz,4h),4.64(s,4h),3.86(s,4h),3.54(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):153.35,149.50,146.09,144.26,140.87,130.02,129.83,129.73,127.78,126.42,125.39,124.47,122.79,120.52,120.42,69.39,68.65,58.88.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2042;calcdfor:i-,126.91;found,126.86。
(3)bsa@l1纳米光敏剂的制备
称取5mg的l1分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l1橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l1溶液。
细胞实验中,将bsa@l1溶液用0.22μm过滤器过滤消毒后使用。
实施例3
本实施例的一种上述实施例1中bsa@l2纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
同实施例2的步骤(1)。
(2)l1的制备
同实施例2的步骤(2)。
(3)l2的制备
将硝酸银(0.064g,0.38mmol)溶解在20ml无水乙腈溶液中,再加入l1(0.20g,0.19mmol)于反应体系中,60~80℃回流4h;反应结束,过滤除去沉淀,浓缩滤液,得0.12g红色产物l2,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶硝酸盐。
产率:66.7%。1hnmr(400mhz,dmso-d6),δ(ppm):8.72-8.71(d,j=4.00hz,4h),8.08-8.07(d,j=4.00hz,4h),7.87-7.83(d,j=16.00hz,2h),7.55-7.53(d,j=8.00hz,4h),7.34-7.31(t,j=8.00hz,8h),7.22-7.18(d,j=16.00hz,2h),7.14-7.10(t,j=8.00hz,4h),7.06-7.04(d,j=8.00hz,8h),6.89-6.87(d,j=8.00hz,4h),4.58(s,4h),3.81(s,4h),3.49(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):153.92,150.07,146.65,144.85,141.44,130.38,130.24,128.35,125.09,123.39,121.05,120.83,69.95,69.19,59.46.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2041;calcdfor:no3-,61.99;found,61.77。
(4)bsa@l2纳米光敏剂的制备
称取5mg的l2分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l2橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l2溶液。
细胞实验中,将bsa@l2溶液用0.22μm过滤器过滤消毒后使用。
实施例4
本实施例的一种上述实施例1中bsa@l3纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
同实施例2的步骤(1)。
(2)l1的制备
同实施例2的步骤(2)。
(3)l3的制备
将对甲苯磺酸银(0.10g,0.38mmol)溶解在乙腈溶液中,再加入l1(0.20g,0.19mmol)于反应体系中,60~80℃温度下回流反应4h;反应结束,过滤除去沉淀,并浓缩滤液,得0.10g红色产物l3,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶-4-甲基苯磺酸盐。
产率:45.5%。1hnmr(400mhz,dmso-d6),δ(ppm):8.72-8.70(d,j=8.00hz,4h),8.08-8.06(d,j=8.00hz,4h),7.87-7.83(d,j=16.00hz,2h),7.54-7.52(d,j=8.00hz,4h),7.46-7.44(t,j=8.00hz,4h),7.34-7.30(t,j=8.00hz,8h),7.23-7.19(t,j=16.00hz,2h),7.13-7.10(t,j=12.00hz,4h),7.07-7.03(t,j=8.00hz,14h),6.87-6.85(d,j=8.00,4h),4.59-4.57(t,j=4.00,4h),3.81-3.79(t,j=4.00,4h),3.48(s,4h),2.23(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):153.88,150.02,146.65,146.18,144.82,141.39,138.17,130.36,130.27,128.36,126.02,125.93,125.06,123.35,121.09,120.85,69.98,69.26,59.46,21.33.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2041;calcdfor:c7h7o3s-,171.01;found,170.93。
(4)bsa@l3纳米光敏剂的制备
称取5mg的l3分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l3橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l3溶液。
细胞实验中,将bsa@l3溶液用0.22μm过滤器过滤消毒后使用。
实施例5
本实施例的一种上述实施例1中bsa@l4纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
同实施例2的步骤(1)。
(2)l1的制备
同实施例2的步骤(2)。
(3)l4的制备
将六氟磷酸银(0.096g,0.38mmol)溶解在无水乙腈溶液中,再加入l1(0.20g,0.19mmol)于反应体系中,60~80℃温度下回流反应2h;反应结束,过滤除去沉淀,并浓缩滤液,得0.12g红色产物l4,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶六氟磷酸盐。
产率:57.1%。1hnmr(400mhz,dmso-d6),δ(ppm):8.71-8.69(d,j=8.00hz,4h),8.07-8.06(d,j=4.00hz,4h),7.87-7.83(d,j=16.00hz,2h),7.55-7.52(d,j=12.00hz,4h),7.34-7.31(t,j=6.00hz,8h),7.22-7.18(t,j=16.00hz,2h),7.14-7.11(t,j=12.00hz,4h),7.06-7.04(t,j=8.00hz,8h),6.89-6.87(d,j=8.00,4h),4.58-4.56(t,j=4.00,4h),3.82-3.79(t,j=6.00,4h),3.49(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):153.93,150.10,144.82,141.45,130.39,130.27,128.30,125.97,125.11,123.34,121.08,120.79,69.93,69.21,59.46.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2042;calcdfor:f6p-,144.96;found,144.83。
(4)bsa@l4纳米光敏剂的制备
称取5mg的l4分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l4橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l4溶液。
细胞实验中,将bsa@l4溶液用0.22μm过滤器过滤消毒后使用。
实施例6
本实施例的一种上述实施例1中bsa@l5纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
同实施例2的步骤(1)。
(2)l1的制备
同实施例2的步骤(2)。
(3)l5的制备
将三氟乙酸银(0.084g,0.38mmol)溶解在无水乙腈溶液中,再加入l1(0.20g,0.19mmol)于反应体系中,60~80℃温度下回流反应3h;反应结束,过滤除去沉淀,并浓缩滤液,得0.09g红色产物l5,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶三氟乙酸盐。
产率:45.0%。1hnmr(400mhz,dmso-d6),δ(ppm):8.73-8.71(d,j=8.00hz,4h),8.09-8.07(d,j=8.00hz,4h),7.88-7.84(d,j=16.00hz,2h),7.55-7.53(d,j=8.00hz,4h),7.35-7.31(t,j=8.00hz,8h),7.23-7.19(t,j=16.00hz,2h),7.14-7.10(t,j=8.00hz,4h),7.06-7.04(d,j=8.00hz,8h),6.89-6.87(d,j=8.00,4h),4.59-4.57(t,j=4.00,4h),3.82-3.80(t,j=4.00,4h),3.49(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):153.92,150.08,146.66,144.85,141.44,130.38,130.27,128.33,125.96,125.09,123.35,121.10,120.82,69.94,69.23,59.45.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2041;calcdfor:c2f3o2-,112.99;found,112.88。
(4)bsa@l5纳米光敏剂的制备
称取5mg的l5分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l5橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l5溶液。
细胞实验中,将bsa@l5溶液用0.22μm过滤器过滤消毒后使用。
实施例7
本实施例的一种上述实施例1中bsa@l6纳米光敏剂的制备方法,包括如下步骤:
(1)中间体m1的制备
同实施例2的步骤(1)。
(2)l1的制备
同实施例2的步骤(2)。
(3)l6的制备
将四苯基硼钠(0.13g,0.38mmol)和l1(0.20g,0.19mmol)溶解于20ml无水乙腈中,60~80℃温度下回流反应6h;反应结束,过滤得到0.15g红色产物,用15ml乙醇洗涤3次得l6,即4-二[(n,n-二苯基胺)苯乙烯基]-n-[1,2-二(乙氧基)乙基]-4-二吡啶四苯基硼酸盐。
产率:54.5%。1hnmr(400mhz,dmso-d6),δ(ppm):8.69-8.67(d,j=8.00hz,4h),8.06-8.04(d,j=8.00hz,4h),7.86-7.82(d,j=16.00hz,2h),7.54-7.52(d,j=8.00hz,4h),7.34-7.30(t,j=6.00hz,8h),7.21-7.17(t,j=16.00hz,2h),7.12-7.10(m,20h),7.06-7.04(d,j=8.00hz,8h),6.89-6.86(t,j=6.00,20h),6.67-6.72(t,j=8.00,8h),4.56-4.54(t,j=4.00,4h),3.80-3.78(t,j=4.00,4h),3.48(s,4h);13cnmr(100mhz,dmso-d6),δ(ppm):164.60,164.11,163.62,163.13,153.89,150.09,146.63,144.78,141.44,136.04,130.37,130.26,128.26,125.96,125.85,125.82,125.80,125.78,125.11,123.32,122.03,121.18,120.78,69.94,69.23,59.47.ms(esi):calcdfor:c56h52n4o22 [m/2],406.20;found,406.2044;calcdfor:c24h20b-,319.17;found,319.19。
(4)bsa@l6纳米光敏剂的制备
称取5mg的l6分散在10ml甲醇中,称取200mg的bsa和10μl三乙胺混合在10ml的二次蒸馏水中超声30min。然后,缓慢滴加到上述溶液中,剧烈搅拌过夜;再使用透析袋(mwco10kda)进行24h的透析后,将所得溶液冷冻干燥24h,得到bsa@l6橙色固体;再将产物分散在去离子水(ph=7.4)中,得bsa@l6溶液。
细胞实验中,将bsa@l6溶液用0.22μm过滤器过滤消毒后使用。
实施例8
本实施例的一种上述实施例中有机小分子光敏剂l1~l6的1o2/ros释放测试。
如图2所示,利用1o2指示剂“9,10-蒽基-双(亚甲基)二丙二酸(abda)”和ros指示剂“2,7-二氯二乙酸荧光素(h2dcf-da)”对l1~l6释放1o2/ros的强弱进行比较。
首先,在黑暗条件下,分别取l1~l6溶液,加入abda母液;然后,用led灯每照射3s测出紫外-可见吸收光谱数据,测出吸光度值a。结果如图2a所示,abda与参比rosebengal在光照12s后a/a0值基本保持不变,而l1~l6均表现出明显的降低;其中,l4下降趋势较为明显,由此说明其1o2释放量较多。
随后,在黑暗条件下,取h2dcf-da(dmso母液)、并用naoh(h2o母液)对其进行活化30min,再分别加入l1~l6溶液,用1w的led灯每照射10s测出荧光强度值i。结果如图2b所示,只加ros指示剂的h2dcf-da在光照条件下i值没有明显的升高,而l1~l6均表现出明显的升高;其中,l1和l4升高均有50倍,表明l1~l6均可以释放大量的ros,且l4释放较多。
实施例9
本实施例的一种上述实施例中有机小分子光敏剂l4与bsa作用光学性质以及作用机制研究。
在自组装前,首先评估l4在体外对bsa的响应情况。如图3a所示,随着bsa(10mg/ml)的加入,荧光强度达到近10倍的增强,表明l4可以对bsa有明显的光学响应。
与此同时,通过圆二色光谱(cd谱)监测bsa构象的变化。实验结果如图3b所示,无论是否加入l4,cd光谱均表现出相似的谱图,两个远紫外波段分别集中在208和222nm处,表明bsa的α-螺旋结构与l4结合后仍保持固有构象。因此,我们推测bsa使l4荧光增强可能是由于形成分子间弱相互作用,限制分子内运动,降低非辐射跃迁几率,使荧光效率增强。
为了探究l4与bsa间的相互作用机制,我们进行了核磁共振氢谱(1h-nmr)滴定实验,如图4所示。随着bsa的加入,l4中吡啶环上氢原子(c和d)以及双键上氢原子(a和b)的化学位移值明显地向高场移动,并且其他氢原子的化学位移值也有略微像高场区移动,说明l4的氢原子与bsa之间氨基酸残基可能存在一定的氢键相互作用。
实施例10
本实施例的一种细胞毒性实验。
考虑到细胞存活率是评价光敏剂效果的关键性指标,通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(mtt)法对bsa@l4和l4在宫颈癌(hela)细胞中光、暗毒性进行研究。
如图6所示,在没有光照的情况下,hela细胞存活率均在80%左右,毒性较小,可忽略不计。当led灯照射10min后,bsa@l4和l4在浓度为1.0μg/ml就能导致hela细胞20%左右的死亡率,其中,bsa@l4在不同浓度梯度时的细胞存活率都较l4低。
为进一步探究细胞存活率差异的原因,利用相同浓度(10μg/ml)bsa@l4和l4培养hela细胞,如图5所示,l4主要附着在细胞膜上,不易被细胞摄取,而bsa@l4培养的细胞中细胞质荧光较强。
结果表明:在led灯照射下,bsa@l4可以进入hela细胞中,在光照条件下,释放大量1o2,对癌细胞产生光毒性;与l4相比,bsa@l4提高了细胞摄取程度,为促进癌细胞凋亡提供前提基础。这种利用蛋白质进行自组装的纳米复合光敏剂对于提高生物相容性、增强细胞摄取能力、加速癌细胞凋亡有着重要的意义。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。