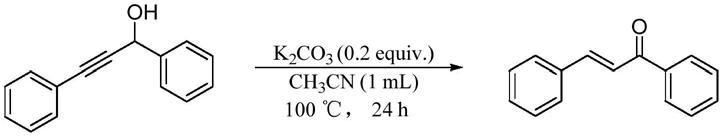
1.本发明涉及化学合成技术领域,具体涉及一种高选择合成查尔酮类化合物的绿色方法。
背景技术:
2.查尔酮化学名称为1,3
‑
二苯基丙烯酮。查尔酮及其衍生物广泛存在于豆科、菊科、甘草、红花等多种天然植物中,在植物花中的含量尤为突出,是花色素的主要成分,也是植物合成黄酮的前体。由于查尔酮及其衍生物分子具有极大的柔性,能与不同的生物受体结合,表现出广泛的生物活性,其中主要有抗蛲虫、抗过敏、抗肿瘤作用、抗炎活性、抗真菌、抗病毒作用、抑制或者清除氧自由基等作用。合成应用方面,查尔酮及其衍生物可用于香料和药物的合成。因此,查尔酮及其衍生物的高选择合成一直是有机化学家们研究的热点。
3.查尔酮及其衍生物传统的合成方法是羟醛(aldol)缩合反应,即利用强碱如naoh、koh等将甲基酮转化亚甲基负离子然后与醛发生加成消除的缩合反应。该方法强碱的用量比较大,废弃物多、污染较大;由于醛比较活泼,使用前需重蒸纯化,强碱条件下还容易发生cannizzaro等副反应产生副产物,也导致反应效率降低,原子经济性较低;强碱条件还导致反应选择性不高,得到的是顺反异构体的混合物、分离困难;由于顺反产物活性的不同,顺反产物的低选择性进一步限制了其在医药中间体合成中的应用。此外,还有不少使用过渡金属催化剂和配体的方法,但成本高、产物中有过渡金属残留,不适用于对金属残留要求高的医药中间体的合成方法。由于上述已知合成方法存在不少问题,特别是具有产物选择性低的缺点,开发一种催化进行、选择性高、污染小甚至无污染、不需要过渡金属参与的新方法非常有价值,在有机合成、生化和医药等领域都是非常有意义的工作。
技术实现要素:
4.针对现有技术存在的不足,本发明的目的在于提供一种高选择合成查尔酮类化合物的绿色方法,该方法采用取代炔丙醇为原料,在无过渡金属参与、碱催化条件下,发明了取代炔丙醇类化合物的氢转移反应新方法,将其应用于制备高反式选择性的查尔酮类化合物,无任何副产物,原子经济性100%,高效、无污染。
5.为实现上述目的,本发明提供了如下技术方案:一种高选择合成查尔酮类化合物的绿色方法,在空气条件下,利用水溶性无机弱碱为催化剂催化炔丙醇类化合物的氢转移反应,实现高反式选择性查尔酮类化合物的绿色合成;反应温度为80~120℃,反应时间12
‑
48小时,反应式为:
[0006][0007]
其中,ar1、ar2均是苯基、甲基、甲氧基、卤原子、取代基取代在2
‑
,3
‑
,4
‑
位或多位置取代的苯基;或ar1、ar2均是芳基、取代芳基、杂芳基、取代杂芳基、直链烷基、直链烷基或环
烷基。
[0008]
作为优选的,合成过程中不使用任何过渡金属催化剂和配体、无需惰性气体保护。
[0009]
作为优选的,水溶性无机弱碱为cs2co3、k2co3、na2co3、li2co3、khco3、nahco3、ch3cook、k3po4、lioh、naoh、koh、csoh、t
‑
buoli、t
‑
buona或t
‑
buok。
[0010]
作为优选的,水溶性无机弱碱的用量为0.1~1.0当量。
[0011]
作为优选的,反应时采用有机溶剂,有机溶剂为乙腈、甲苯、二甲苯或1,4
‑
二氧六环。
[0012]
作为优选的,反应在微量空气下进行,空气对反应有促进作用。
[0013]
作为优选的,当反应温度为100℃时,反应时间为24小时。
[0014]
本发明的优点是:本发明不使用任何过渡金属催化剂和配体,反应无需惰性气体保护,可在空气下直接进行,无其他副产物产生,原子经济性100%,绿色环保无污染,且产物为高选择性的(e)
‑
型产物
[0015]
因此,本发明对反应条件的要求较低、易于操作,优化后的碱催化剂k2co3碱性弱,官能团兼容性好、底物适用范围广,与已知现有技术相比优势明显,具有潜在广泛的应用前景。
[0016]
下面结合具体实施例对本发明作进一步说明。
具体实施方式
[0017]
本发明公开的一种高选择合成查尔酮类化合物的绿色方法,在空气条件下,利用水溶性无机弱碱为催化剂催化炔丙醇类化合物的氢转移反应,实现高反式选择性查尔酮类化合物的绿色合成;反应温度为80~120℃,反应时间12
‑
48小时,反应式为:
[0018][0019]
其中,ar1、ar2均是苯基、甲基、甲氧基、卤原子、取代基取代在2
‑
,3
‑
,4
‑
位或多位置取代的苯基;或ar1、ar2均是芳基、取代芳基、杂芳基、取代杂芳基、直链烷基、直链烷基或环烷基等。
[0020]
作为优选的,合成过程中不使用任何过渡金属催化剂和配体、无需惰性气体保护。
[0021]
作为优选的,水溶性无机弱碱为cs2co3、k2co3、na2co3、li2co3、khco3、nahco3、ch3cook、k3po4、lioh、naoh、koh、csoh、t
‑
buoli、t
‑
buona或t
‑
buok。其中,水溶性无机弱碱为k2co3较佳。
[0022]
作为优选的,水溶性无机弱碱的用量为0.1~1.0当量。其中,水溶性无机弱碱的用量为0.2当量较佳。
[0023]
作为优选的,反应时采用有机溶剂,有机溶剂为乙腈、甲苯、二甲苯或1,4
‑
二氧六环。其中,有机溶剂为乙腈较佳。
[0024]
作为优选的,反应在微量空气下进行,空气对反应有促进作用。
[0025]
作为优选的,当反应温度为100℃时,反应时间为24小时。
[0026]
通过下述实施例将有助于理解本发明,但并不限制于本发明的内容。
[0027]
实施例1
[0028]
1,3
‑
二苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑
查尔酮
[0029][0030]
10ml反应管中依次加入1,3
‑
二苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(0.2当量),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑
查尔酮,分离收率80%。(e)
‑
chalcone(2a).colourless solid.1h nmr(500mhz,cdcl3):δ8.07
–
7.97(m,2h),7.82(d,j=15.7hz,1h),7.65(dd,j=6.6,2.9hz,2h),7.60(t,j=7.4hz,1h),7.55
–
7.48(m,3h),7.43(dd,j=4.9,1.7hz,3h).
13
c nmr(125.4mhz,cdcl3):δ190.6,144.9,138.2,134.9,132.8,130.6,129.0,128.6,128.5,128.5,122.1。
[0031]
实施例2
[0032]1‑
(4
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0033][0034]
10ml反应管中依次加入1
‑
(4
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(0.2当量),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率73%。(e)
‑3‑
phenyl
‑1‑
(p
‑
tolyl)prop
‑2‑
en
‑1‑
one(2b).colourless solid.1h nmr(500mhz,cdcl3):δ7.93(d,j=8.2hz,2h),7.80(d,j=15.7hz,1h),7.62(dd,j=6.5,2.9hz,2h),7.53(d,j=15.7hz,1h),7.40(dd,j=5.1,1.8hz,3h),7.28(d,j=8.0hz,2h),2.41(s,3h).
13
c nmr(125.4mhz,cdcl3):δ190.0,144.4,143.6,135.7,135.0,130.4,129.3,128.9,128.7,128.4,122.1,21.7。
[0035]
实施例3
[0036]1‑
(2
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0037][0038]
10ml反应管中依次加入1
‑
(2
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
甲基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率53%。(e)
‑3‑
phenyl
‑1‑
(o
‑
tolyl)prop
‑2‑
en
‑1‑
one(2c).yellow oil.1h nmr(500mhz,cdcl3):δ7.54(dd,j=6.3,2.6hz,2h),7.50
–
7.43(m,2h),
7.40
–
7.34(m,4h),7.26(dd,j=12.9,5.9hz,2h),7.13(d,j=16.1hz,1h),2.44(s,3h).
13
c nmr(125.4mhz,cdcl3):δ196.6,145.9,139.1,137.0,134.6,131.3,130.7,130.5,129.0,128.4,128.1,126.8,125.5,20.2。
[0039]
实施例4
[0040]1‑
(4
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0041][0042]
10ml反应管中依次加入1
‑
(4
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯,分离收率60%。(e)
‑1‑
(4
‑
methoxyphenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2d).colourless solid.1h nmr(500mhz,cdcl3):δ8.03(d,j=8.8hz,2h),7.79(d,j=15.7hz,1h),7.62(dd,j=7.3,2.1hz,2h),7.53(d,j=15.6hz,1h),7.43
–
7.34(m,3h),6.96(d,j=8.8hz,2h),3.85(s,3h).
13
c nmr(125.4mhz,cdcl3):δ188.6,163.4,143.9,135.1,131.1,130.8,130.3,128.9,128.4,121.9,113.9,55.5。
[0043]
实施例5
[0044]1‑
(3
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(3
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0045][0046]
10ml反应管中依次加入1
‑
(3
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(3
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯,分离收率73%。(e)
‑1‑
(3
‑
methoxyphenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2e).yellow pasty solid.1h nmr(500mhz,cdcl3):δ7.81(d,j=15.7hz,1h),7.63(dd,j=6.4,2.6hz,2h),7.60(d,j=7.6hz,1h),7.55(s,1h),7.51(d,j=15.7hz,1h),7.41
–
7.38(m,4h),7.12(dd,j=8.2,2.3hz,1h),3.86(s,3h).
13
c nmr(125.4mhz,cdcl3):δ190.0,159.9,144.8,139.6,134.9,130.6,129.6,129.0,128.5,122.2,121.1,119.3,112.9,55.5。
[0047]
实施例6
[0048]1‑
(2
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0049][0050]
10ml反应管中依次加入1
‑
(2
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
甲氧基苯基)
‑3‑
苯基丙
‑2‑
烯,分离收率52%。(e)
‑1‑
(2
‑
methoxyphenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2f).yellow oil.1h nmr(500mhz,cdcl3):δ7.80(d,j=15.7hz,1h),7.65
–
7.58(m,3h),7.56
–
7.54(m,1h),7.50(d,j=15.7hz,1h),7.44
–
7.35(m,4h),7.12(dd,j=8.2,2.2hz,1h),3.86(s,3h).
13
c nmr(125.4mhz,cdcl3):δ193.0,158.1,143.3,135.1,132.9,130.4,130.3,129.3,128.9,128.4,127.1,120.8,111.7,55.8。
[0051]
实施例7
[0052]1‑
(4
‑
叔丁基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
叔丁基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0053][0054]
10ml反应管中依次加入1
‑
(4
‑
叔丁基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
叔丁基苯基)
‑3‑
苯基丙
‑2‑
烯,分离收率72%。(e)
‑1‑
(4
‑
(tert
‑
butyl)phenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2g).white solid.1h nmr(500mhz,cdcl3):δ7.98(d,j=8.3hz,2h),7.80(d,j=15.7hz,1h),7.63(d,j=5.0hz,1h),7.58
–
7.48(m,3h),7.42
–
7.37(m,3h),1.35(s,9h).
13
c nmr(125.4mhz,cdcl3):δ190.1,156.6,144.4,135.6,135.0,130.4,129.0,128.5,128.4,125.6,122.2,35.1,31.1。
[0055]
实施例8
[0056]1‑
(4
‑
氟苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
氟苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0057][0058]
10ml反应管中依次加入1
‑
(4
‑
氟苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
氟苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率72%。(e)
‑1‑
(4
‑
fluorophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2h).yellow solid.1h nmr(500mhz,cdcl3):δ8.11
–
7.99(m,2h),7.82(d,j=15.7hz,1h),
7.65(dd,j=6.6,3.0hz,2h),7.51(d,j=15.7hz,1h),7.47
–
7.39(m,3h),7.18(t,j=8.6hz,2h).
13
c nmr(125.4mhz,cdcl3):δ188.8,166.6,164.6,145.0,134.8,131.1(d,j=9.2hz),130.6,129.0,128.4,121.7,115.7(d,j=21.8hz)。
[0059]
实施例9
[0060]1‑
(4
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0061][0062]
10ml反应管中依次加入1
‑
(4
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率72%。(e)
‑1‑
(4
‑
chlorophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2i).colourless solid.1h nmr(500mhz,cdcl3):δ7.95(d,j=8.5hz,2h),7.80(d,j=15.7hz,1h),7.63(dd,j=6.4,3.0hz,2h),7.51
–
7.43(m,3h),7.43
–
7.38(m,3h).
13
c nmr(125.4mhz,cdcl3):δ189.1,145.3,139.2,136.5,134.7,130.7,129.9,129.0,128.9,128.5,121.5.
[0063]
实施例10
[0064]1‑
(3
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(3
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0065][0066]
10ml反应管中依次加入1
‑
(3
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(3
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率60%。(e)
‑1‑
(3
‑
chlorophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2j).white solid.1h nmr(500mhz,cdcl3):δ7.97(t,j=1.7hz,1h),7.88(d,j=7.7hz,1h),7.81(d,j=15.7hz,1h),7.63(dd,j=6.5,2.8hz,2h),7.54(d,j=8.9hz,1h),7.48
–
7.39(m,5h).
13
c nmr(125.4mhz,cdcl3):δ189.1,145.7,139.8,134.9,134.6,132.3,130.8,130.0,129.0,128.6,126.6,121.5。
[0067]
实施例11
[0068]1‑
(2
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0069][0070]
10ml反应管中依次加入1
‑
(2
‑
氯苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
氯苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率68%。(e)
‑1‑
(2
‑
chlorophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2k).yellow oil.1h nmr(500mhz,cdcl3):δ7.56
–
7.54(m,2h),7.49
–
7.43(m,3h),7.43
–
7.35(m,5h),7.13(d,j=16.1hz,1h).
13
c nmr(125.4mhz,cdcl3):δ193.8,146.3,139.1,134.4,131.4,131.3,130.9,130.3,129.4,129.0,128.6,126.9,126.3。
[0071]
实施例12
[0072]1‑
(4
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0073][0074]
10ml反应管中依次加入1
‑
(4
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率76%。(e)
‑1‑
(4
‑
bromophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2l).yellow solid.1h nmr(500mhz,cdcl3):δ7.89(d,j=8.5hz,2h),7.82(d,j=15.7hz,1h),7.70
–
7.60(m,4h),7.48(d,j=15.7hz,1h),7.44
–
7.40(m,3h).
13
c nmr(125.4mhz,cdcl3):δ189.4,145.4,137.0,134.7,131.9,130.7,130.0,129.0,128.5,127.9,121.6。
[0075]
实施例13
[0076]1‑
(3
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(3
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0077][0078]
10ml反应管中依次加入1
‑
(3
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(3
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率65%。(e)
‑1‑
(3
‑
bromophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2m).yellow soild.1h nmr(500mhz,cdcl3):δ8.11(s,1h),7.90(d,j=7.8hz,1h),7.79(d,j=15.7hz,1h),7.66(d,j=7.9hz,1h),7.61(dd,j=5.6,2.4hz,2h),7.46
–
7.37(m,4h),7.33(t,j=7.8hz,1h).
13
c nmr(125.4mhz,cdcl3):δ188.9,145.7,140.0,135.6,134.6,
131.5,130.9,130.2,129.0,128.6,127.0,123.0,121.4。
[0079]
实施例14
[0080]1‑
(2
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0081][0082]
10ml反应管中依次加入1
‑
(2
‑
溴苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
溴苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率69%。(e)
‑1‑
(2
‑
bromophenyl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2n).colorless solid.1h nmr(500mhz,cdcl3):δ7.63(d,j=8.0hz,1h),7.57
–
7.52(m,2h),7.45
–
7.29(m,7h),7.09(d,j=16.1hz,1h).
13
c nmr(125.4mhz,cdcl3):δ194.7,146.6,141.2,134.4,133.5,131.4,130.9,129.2,129.0,128.6,127.4,126.2,119.5。
[0083]
实施例15
[0084]1‑
(4
‑
氰基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(4
‑
氰基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0085][0086]
10ml反应管中依次加入1
‑
(4
‑
氰基苯基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(4
‑
氰基苯基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率60%。4
‑
cinnamoylbenzonitrile(2o).white solid.1h nmr(500mhz,cdcl3):δ8.08(d,j=8.4hz,2h),7.89
–
7.76(m,3h),7.65(dd,j=7.2,2.3hz,2h),7.52
–
7.41(m,4h).
13
c nmr(125.4mhz,cdcl3):δ189.1,146.0,141.5,134.4,132.2,131.1,129.1,128.9,128.7,121.2,118.0,115.9。
[0087]
实施例16
[0088]1‑
(2
‑
萘基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
萘基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0089][0090]
10ml反应管中依次加入1
‑
(2
‑
萘基)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
萘基)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率70%。(e)
‑1‑
(naphthalen
‑2‑
yl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one
(2p).white solid.1h nmr(500mhz,cdcl3):δ8.52(s,1h),8.09(dd,j=8.6,1.6hz,1h),7.97(d,j=8.0hz,1h),7.91(d,j=8.6hz,1h),7.89
–
7.84(m,2h),7.72
–
7.64(m,3h),7.62
–
7.50(m,2h),7.42(dd,j=5.1,1.8hz,3h).
13
c nmr(125.4mhz,cdcl3):δ190.3,144.8,135.6,135.5,135.0,132.6,130.6,130.0,129.6,129.0,128.6,128.5,128.4,127.8,126.8,124.5,122.1。
[0091]
实施例17
[0092]1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮
[0093][0094]
10ml反应管中依次加入1
‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮,分离收率58%。(e)
‑1‑
phenyl
‑3‑
(m
‑
tolyl)prop
‑2‑
en
‑1‑
one(2q).white solid.1h nmr(500mhz,cdcl3):δ8.01(d,j=8.5hz,2h),7.78(d,j=15.7hz,1h),7.56(t,j=7.3hz,1h),7.53
–
7.46(m,3h),7.43(d,j=6.3hz,2h),7.29(t,j=7.9hz,1h),7.21(d,j=7.5hz,1h),2.38(s,3h).
13
c nmr(125.4mhz,cdcl3):δ190.6,145.1,138.6,138.3,134.8,132.8,131.5,129.1,128.9,128.6,128.5,125.8,121.9,21.4。
[0095]
实施例18
[0096]1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮
[0097][0098]
10ml反应管中依次加入1
‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
苯基
‑3‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮,分离收率60%。(e)
‑3‑
(4
‑
ethylphenyl)
‑1‑
phenylprop
‑2‑
en
‑1‑
one(2r).brown oil.1h nmr(500mhz,cdcl3):δ8.01(d,j=7.4hz,2h),7.80(d,j=15.7hz,1h),7.55(d,j=8.1hz,3h),7.52
–
7.44(m,3h),7.23(d,j=8.0hz,2h),2.66(q,j=7.6hz,2h),1.24(t,j=7.6hz,3h).
13
c nmr(125.4mhz,cdcl3):δ190.7,147.4,145.0,138.4,132.7,132.4,128.6,128.6 128.6,128.5,121.1,28.9,15.4。
[0099]
实施例19
[0100]1‑
苯基
‑3‑
(4
‑
氟苯基)丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
苯基
‑3‑
(4
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0101][0102]
10ml反应管中依次加入1
‑
苯基
‑3‑
(4
‑
氟苯基)丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=99/1。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
苯基
‑3‑
(4
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮,分离收率63%。(e)
‑3‑
(4
‑
fluorophenyl)
‑1‑
phenylprop
‑2‑
en
‑1‑
one(2s).yellow solid.1h nmr(500mhz,cdcl3):δ8.00(d,j=7.6hz,2h),7.75(d,j=15.7hz,1h),7.64
–
7.52(m,3h),7.52
–
7.41(m,3h),7.07(t,j=8.6hz,2h).
13
c nmr(125.4mhz,cdcl3):δ190.2,165.0,163.0,143.4,138.1,132.9,131.1(d,j=3.3hz),130.4(d,j=8.5hz),128.6(d,j=21.1hz),121.7,116.1(d,j=21.9hz)。
[0103]
实施例20
[0104]1‑
(2
‑
噻吩)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
噻吩)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0105][0106]
10ml反应管中依次加入1
‑
(2
‑
噻吩)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
噻吩)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率71%。(e)
‑3‑
phenyl
‑1‑
(thiophen
‑2‑
yl)prop
‑2‑
en
‑1‑
one(2t).grey solid.1h nmr(500mhz,cdcl3):δ7.84(d,j=16.9hz,2h),7.76
–
7.57(m,3h),7.41(d,j=15.0hz,4h),7.16(s,1h).
13
c nmr(125.4mhz,cdcl3):δ182.1,145.5,144.1,134.7,133.9,131.9,130.6,129.0,128.5,128.3,121.7。
[0107]
实施例21
[0108]1‑
(2
‑
呋喃)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇制备(e)
‑1‑
(2
‑
呋喃)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮
[0109][0110]
10ml反应管中依次加入1
‑
(2
‑
呋喃)
‑3‑
苯基丙
‑2‑
炔
‑1‑
醇(2mmol),k2co3(20mol%),乙腈(1ml),反应混合物直接在空气下密封、加热到100℃反应24h。通过gc
‑
ms检测产物的e/z=98/2。反应混合物蒸除溶剂后柱色谱分离提纯,得到(e)
‑1‑
(2
‑
呋喃)
‑3‑
苯基丙
‑2‑
烯
‑1‑
酮,分离收率44%。(e)
‑1‑
(furan
‑2‑
yl)
‑3‑
phenylprop
‑2‑
en
‑1‑
one(2u).yellow oil.1h nmr(500mhz,cdcl3):δ7.87(d,j=15.8hz,1h),7.63(d,j=7.3hz,3h),7.44(d,j=15.8hz,1h),7.42
–
7.37(m,3h),7.33(d,j=3.5hz,1h),6.57(dd,j=3.4,1.5hz,1h).
13
c nmr(125.4mhz,cdcl3):δ178.0,153.7,146.6,144.0,134.7,130.6,128.9,128.5,121.1,117.6,112.6。
[0111]
本发明不使用任何过渡金属催化剂和配体,反应无需惰性气体保护,可在空气下直接进行,无其他副产物产生,原子经济性100%,绿色环保无污染,且产物为高选择性的(e)
‑
型产物
[0112]
因此,本发明对反应条件的要求较低、易于操作,优化后的碱催化剂k2co3碱性弱,官能团兼容性好、底物适用范围广,与已知现有技术相比优势明显,具有潜在广泛的应用前景。
[0113]
上述实施例对本发明的具体描述,只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限定,本领域的技术工程师根据上述发明的内容对本发明作出一些非本质的改进和调整均落入本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

