1.本发明涉及化学合成技术领域,具体涉及一种熊去氧胆酸的合成方法。
背景技术:
2.熊去氧胆酸(3α,7β
‑
二羟基
‑
5β
‑
胆甾烷
‑
24
‑
酸;udca),无臭,在乙醇中易溶,在三氯甲烷中不溶,在冰醋酸中易溶,在氢氧化钠试液中溶解,其结构式如式(vii)所示:
[0003][0004]
熊去氧胆酸作为传统名贵药材熊胆的主要有效成分,具有极强的促进脂肪和脂肪酸水解等作用,在临床上主要用于治疗各种肝胆疾病和消化道疾病。随着分子生物学以及熊去氧胆酸基础和临床研究的不断进步,人们发现熊去氧胆酸在促进免疫调节、治疗冠心病等方面也有积极作用。因此,随着研究的深入,熊去氧胆酸的利用价值越来越受到人们的重视,对熊去氧胆酸的需求量也在逐年升高。
[0005]
目前现有技术中有关熊去氧胆酸的制备方法制备方法主要包括以下几种:
[0006]
1、从熊身上活取熊胆后提取分离得到;
[0007]
2、以动物胆酸类(包括:胆酸、鹅去氧胆酸、猪胆酸、猪去氧胆酸等)为原料的合成方法;
[0008]
3、以雄甾烯二酮为原料的合成方法;
[0009]
4、全合成的方法。
[0010]
在以上几种方法中,由于保护野生动物的要求,第1种方法已基本不可能应用,第3、4种方法的成本很高,至今没有工业生产价值,因而以第2种方法应用最为普遍。
[0011]
目前已报道的第2种合成方法均存在产生一定量的副产物的问题,尽管经精制后可以将这些副产物除去,但最终产品收率仍然较低;而且合成路线均以动物胆酸、脱氧胆酸为起始原料。由于动物来源原料的安全性会受到动物疫病的影响,研发一种基于植物源原料,高效合成udca的方法具有重要意义和工业化价值。
技术实现要素:
[0012]
本发明的目的是提供一种熊去氧胆酸的合成方法,该方法以7β,21
‑
二羟基
‑
20
‑
甲
基孕甾
‑4‑
烯
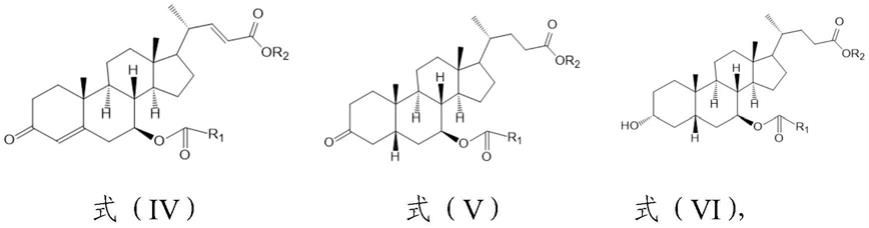
‑3‑
酮(7β
‑
oh
‑4‑
hbc)为原料合成熊去氧胆酸。
[0013]
本发明提供的熊去氧胆酸的合成方法,以7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮为原料,经过酯化保护、氧化反应、wittig反应、氢化还原反应、羰基还原反应和水解反应最终合成熊去氧胆酸udca。7β
‑
oh
‑4‑
hbc可由植物甾醇经生物转化得到(例如:cn201811563245.x公开了以21
‑
羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮(4
‑
hbc)为原料,利用微生物合成7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮的方法),是一种植物源的绿色原料,目前年产量达千吨级,价格低廉,能够很好避免现有技术中动物源原料可能存在致病菌和病毒的感染问题,同时,本发明的熊去氧胆酸合成方法还具有副反应少、收率高、原料廉价易得、环境友好的优势,适用于工业化生产,解决了现有技术中合成成本高、收率低、不适合大规模工业化生产的问题。
[0014]
具体地,本发明提供以下技术方案:
[0015]
本发明提供一种熊去氧胆酸的合成方法,以7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮为原料,包括先将7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮先进行7
‑
位酯化反应再进行氧化反应的步骤。
[0016]
7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮的结构式如式(i)所示。
[0017][0018]
本发明发现,以7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮为原料时,将该原料的7
‑
oh进行酯化保护后再进行氧化反应,可有效减少氧化过程的副产物产生,进而提高产物的收率。
[0019]
对于酯化反应,优选采用如下方法:将7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮在第一溶剂中与酸酐和有机碱反应,得到式(ii)所示的7
‑
位酯化物,
[0020][0021]
其中,r1为烷基;优选地为c1~c10的烷基;进一步优选地,为c1、c2、c3的烷基。
[0022]
作为本发明的优选实施方案,式(ii)所示的化合物为:21
‑
羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮
‑
7β
‑
酯。
[0023]
在上述合成方法的基础上,本发明对酯化反应的溶剂体系和原料进行特异的选择,进一步提高了酯化反应的效率和产物的收率。
[0024]
具体地,其中,所述第一溶剂包括呋喃、四氢呋喃、2
‑
甲基呋喃、丙酮、丁酮中的一种或至少两种的混合物的混合物。优选的第一溶剂为丙酮、四氢呋喃或呋喃。更优选为丙酮。
[0025]
所述酸酐包括乙酸酐、丙酸酐、丁酸酐、苯酐、顺丁烯二酸酐、丁二酸酐、戊二酸酐中的一种或至少两种的混合物。优选的酸酐为顺丁烯二酸酐、丁二酸酐或戊二酸酐。更优选为顺丁烯二酸酐。
[0026]
所述有机碱包括甲胺、二甲胺、三甲胺、乙胺、二乙胺、三乙胺、丙胺、吡啶、2,6
‑
二甲基吡啶、2
‑
甲基吡啶、3
‑
甲基吡啶、4
‑
甲基吡啶中的一种或至少两种的混合物。优选的有机碱为二甲胺和2,6
‑
二甲基吡啶的混合物,或者为二乙胺,或为乙胺和吡啶的混合物。更优选为二甲胺和2,6
‑
二甲基吡啶的混合物。所述二甲胺和2,6
‑
二甲基吡啶的混合物中,二甲胺和2,6
‑
二甲基吡啶的摩尔比为(1
‑
100):1,优选为(45
‑
55):1。所述乙胺和吡啶的混合物中,乙胺和吡啶的摩尔比(1
‑
100):1,优选为(35
‑
45):1。
[0027]
对于上述酯化反应的反应体系中,所述7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮、所述酸酐与所述有机碱的摩尔比优选为1:(1
‑
4):(1
‑
5)。
[0028]
反应体系中,7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮与第一溶剂的质量体积比优选为1:(3
‑
10)。
[0029]
所述酯化反应的反应温度为10
‑
70℃,反应时间为3
‑
18h。更优选的反应条件为:反应温度为30
‑
40℃,反应时间为3
‑
8h。
[0030]
在酯化反应后,将得到的7
‑
位酯化物进行氧化反应:将式(ii)所示的7
‑
位酯化物在第二溶剂中与氧化剂进行氧化反应,得到式(iii)所示的7
‑
酯基
‑
21
‑
氧代化合物,
[0031][0032]
其中,r1为烷基;优选为c1~c10的烷基;进一步优选为c1、c2、c3的烷基。
[0033]
作为本发明的优选实施方案,式(iii)所示的化合物为:20
‑
甲基孕甾
‑4‑
烯
‑
3,21
‑
二酮
‑
7β
‑
酯。
[0034]
优选地,将7
‑
位酯化物先用第二溶剂溶解后,再加入氧化剂进行氧化反应。
[0035]
针对上述酯化反应的产物,本发明对氧化反应的溶剂体系和原料进行优化,进一步提高了氧化反应的产物收率。
[0036]
具体地,所述第二溶剂包括呋喃、四氢呋喃、2
‑
甲基呋喃、3
‑
甲基呋喃、2
‑
甲基四氢呋喃、二氯甲烷、氯仿、正己烷、丙酮、水中的一种或至少两种的混合物。优选的第二溶剂为四氢呋喃或丙酮。
[0037]
所述氧化剂包括n
‑
氯代琥珀酰亚胺ncs、n
‑
溴代琥珀酰亚胺nbs、2
‑
碘酰基苯甲酸
ibx、铬酸钾、铬酸钠、双氧水、过氧乙酸中的一种或至少两种的混合物。优选的氧化剂为n
‑
溴代琥珀酰亚胺nbs或2
‑
碘酰基苯甲酸ibx。
[0038]
在氧化反应的反应体系中,式(ii)所示的7
‑
位酯化物与氧化剂的摩尔比优选为1:(0.3
‑
3)。
[0039]
所述反应体系中,式(ii)所示的7
‑
位酯化物与第二溶剂的质量体积比优选为1:(3
‑
10)。
[0040]
氧化反应的反应条件如下:温度0
‑
50℃;时间2
‑
8h。优选的反应条件为:温度10
‑
20℃;时间3
‑
5h。
[0041]
本发明所述的udca的合成方法还包括:将氧化反应的产物进行21
‑
位witting反应,得到式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物,将式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物的4
‑
位及21
‑
位进行氢化还原反应得到式(v)所示的化合物,将式(v)所示的化合物的3
‑
位进行羰基还原反应,得到式(vi)所示的化合物,再将式(vi)所示的化合物进行碱水解反应,得到熊去氧胆酸的步骤,
[0042][0043]
其中,r1为烷基;优选为c1~c10的烷基;进一步优选为c1、c2、c3的烷基;r2为烷基;优选为c1~c10的烷基;进一步优选为c1、c2的烷基。
[0044]
作为本发明的优选方案,式(iv)所示的化合物为:20
‑
甲基孕甾
‑
4,21
‑
二烯
‑3‑
酮
‑
7β,23
‑
二酯。
[0045]
式(v)所示的化合物为:5β
‑
胆甾烷
‑3‑
酮
‑
7β,24
‑
二酯。
[0046]
式(vi)所示的化合物为:3α
‑
羟基
‑
5β
‑
胆甾烷
‑
7β,24
‑
二酯。
[0047]
其中,所述witting反应包括:将式(iii)所示的7
‑
酯基
‑
21
‑
氧代化合物在第三溶剂中与wittig试剂发生wittig反应。
[0048]
优选地,将7
‑
酯化
‑
21
‑
氧代化物用第三溶剂溶解后,再与卤代烃、wittig试剂发生wittig反应。
[0049]
其中,所述第三溶剂包括苯、甲苯、乙酸乙酯、四氢呋喃、己烷中的一种或至少两种的混合物。优选的第三溶剂为四氢呋喃或甲苯。
[0050]
所述wittig试剂选自氢化钠、膦酰基乙酸三乙酯、乙氧甲酰基亚甲基三苯基膦中的一种或至少两种的混合物。优选的witting试剂为膦酰基乙酸三乙酯或乙氧甲酰基亚甲基三苯基膦。
[0051]
在witting反应的反应体系中,式(iii)所示的7
‑
酯基
‑
21
‑
氧代化合物与wittig试剂的摩尔比优选为1:(1
‑
3)。
[0052]
在witting反应的反应体系中,式(iii)所示的7
‑
酯基
‑
21
‑
氧代化合物与第三溶剂的质量体积比为1:(10
‑
100)。
[0053]
wittig反应的反应条件如下:温度为0
‑
30℃;时间为2
‑
8h。优选的反应条件为:温
度为0
‑
10℃;时间为3
‑
4h。
[0054]
在wittig反应后,将得到的产物进行氢化还原反应:将式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物在第四溶剂中与pd/c和碱发生氢化还原反应。
[0055]
具体地,将式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物与pd/c、碱用第四溶剂溶解后,h2置换,发生氢化还原反应。
[0056]
其中,所述第四溶剂包括甲醇、乙醇、丙醇、乙酸乙酯、丙酮、二氯甲烷、四氢呋喃中的一种或至少两种的混合物。优选的第四溶剂为乙醇和二氯甲烷的混合物。混合物中乙醇和二氯甲烷的体积比为1:(1
‑
3)。优选的第四溶剂还可为乙酸乙酯。
[0057]
所述pd/c为5%pd/c、10%pd/c中的一种或两种。优选使用10%pd/c。
[0058]
所述碱包括碳酸钠、碳酸氢钠、氨水、4
‑
甲氧基吡啶、吡啶、4
‑
二甲氨基吡啶中的一种或多种。优选的碱为4
‑
甲氧基吡啶。
[0059]
在氢化还原反应的反应体系中,所述式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物、pd/c与碱的摩尔比优选为100:(1
‑
5):(10
‑
50)。
[0060]
式(iv)所示的7
‑
酯基
‑
21
‑
烯键化合物与第四溶剂的质量体积比为1:(10
‑
100)。
[0061]
氢化还原反应的条件为:压强为0.1
‑
4mpa,温度为0
‑
40℃,时间为12
‑
36h。优选的反应条件为:压强为0.2
‑
0.3mpa,温度为20
‑
30℃。
[0062]
在氢化还原反应后,将式(v)所示的化合物进行羰基还原反应:将式(v)所示的化合物、三氯化铈在第五溶剂中与还原剂发生羰基还原反应。
[0063]
优选地,将式(v)所示的化合物、七水合三氯化铈在第五溶剂中溶解,加入还原剂,进行羰基还原反应。
[0064]
其中,所述第五溶剂包括甲醇、乙酸乙酯、二氯甲烷、四氢呋喃中的一种或多种。优选的第五溶剂为四氢呋喃和甲醇的混合溶剂。混合溶剂中,四氢呋喃和甲醇的体积比为1:(1
‑
10)。优选的第五溶剂还可为乙酸乙酯或四氢呋喃。
[0065]
所述还原剂包括硼氢化钠、硼氢化钾中的一种或两种。
[0066]
在羰基还原反应的反应体系中,式(v)所示的化合物、三氯化铈与还原剂的摩尔比优选为1:(1
‑
5):(1
‑
8)。
[0067]
式(v)所示的化合物与第五溶剂的质量体积比为1:(5
‑
15)。
[0068]
羰基还原反应的条件为:温度为
‑
40
‑
30℃,时间为1
‑
8h。优选的反应条件为
‑
30~
‑
10℃,时间为3
‑
4h。
[0069]
在羰基还原还原后,将式(vi)所示的化合物在第六溶剂中与强碱发生水解反应,除去溶剂,结晶析出熊去氧胆酸。
[0070]
优选地,将式(vi)所示的化合物在第六溶剂中完全溶解后,加入强碱溶液,使7
‑
位及23
‑
位基团水解。
[0071]
其中,所述第六溶剂包括甲醇、乙醇、丙醇、四氢呋喃、水、碱性水溶液中的一种或多种。优选的第六溶剂为四氢呋喃和甲醇的混合溶剂。混合溶剂中,四氢呋喃和甲醇的体积比为1:(1
‑
3)。优选的第六溶剂还可为乙酸乙酯。
[0072]
所述强碱包括氢氧化锂、氢氧化钠、氢氧化钾、甲醇钠中的一种或多种。优选的强碱为氢氧化锂或氢氧化钠。
[0073]
在水解反应的反应体系中,所述式(vi)所示的化合物与所述强碱的摩尔比为1:
(0.2
‑
2)。
[0074]
式(vi)所示的化合物与第六溶剂的质量体积比为1:(5
‑
50)。
[0075]
水解反应的条件为:温度为10
‑
40℃,时间为12
‑
48h。优选的反应条件为:温度为20
‑
30℃,时间为18
‑
24h。
[0076]
本发明提供的以7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮(7β
‑
oh
‑4‑
hbc)为原料合成熊去氧胆酸的方法具体包括如下步骤,其合成路线如图1所示:
[0077]
a、7β
‑
oh
‑4‑
hbc(1)的7
‑
位酯化,得到7
‑
酯化保护的酯化物(2);
[0078]
b、将上述化合物(2)进行21
‑
位氧化反应,得到7
‑
酯基
‑
21
‑
氧代化合物(3);
[0079]
c、将上述化合物(3)进行21
‑
位wittig反应,得到7
‑
酯基
‑
21
‑
烯键化合物(4);
[0080]
d、将上述化合物(4)的4
‑
位及21
‑
位进行氢化还原反应,得到化合物(5);
[0081]
e、将上述化合物(5)的3
‑
位进行羰基还原反应,得到化合物(6);
[0082]
f、将上述化合物(6)进行水解反应,得到熊去氧胆酸(7)。
[0083]
本发明的有益效果在于:
[0084]
本发明的合成方法所用的原料7β
‑
oh
‑4‑
hbc为植物源原料,避免了动物源原料可能存在致病菌和病毒的感染问题,原料廉价易得。
[0085]
本发明的合成方法步骤操作简便、副反应少、制备的熊去氧胆酸的纯度高,产物的收率高,对环境友好,方便实现工业化和产业化生产,解决了现有技术中合成成本高、收率低、不适合大规模工业化生产的问题。
附图说明
[0086]
图1为本发明以7β,21
‑
二羟基
‑
20
‑
甲基孕甾
‑4‑
烯
‑3‑
酮(7β
‑
oh
‑4‑
hbc)为原料合成熊去氧胆酸的合成路线。
具体实施方式
[0087]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0088]
实施例1式(ii)所示化合物的制备
[0089]
本实施例提供式(ii)所示化合物的制备方法,具体为以下1
‑
3中的任一种:
[0090]
1、在一个500毫升反应瓶中,加入7β
‑
oh
‑4‑
hbc(10克,28.86mmol),顺丁烯二酸酐(6克,61.19mmol),丙酮40毫升,二甲胺(4.2克,93.17mmol),2,6
‑
二甲基吡啶(0.2克,1.87mmol)。升温至38
‑
40℃,并于此温度下维持搅拌5小时。tlc法检测反应完全程度后,减压浓缩除去丙酮,加水30毫升,降温至20℃。滴加10%盐酸,调节ph至3.5
‑
4.0,出现混浊。流加甲醇30毫升,出现结晶。过滤,水洗两遍,干燥得到白色至类白色固体粉末(10.81克,27.61mmol),即为式(ii)所示的化合物,经计算式(ii)所示的化合物的质量收率为108.1%,摩尔收率95.67%。
[0091]
2、在一个500毫升反应瓶中,加入7β
‑
oh
‑4‑
hbc(10克,28.86mmol),顺丁烯二酸酐(3克,30.59mmol),丙酮40毫升,二甲胺(4.2克,93.17mmol),2,6
‑
二甲基吡啶(0.2克,1.87mmol)。升温至38
‑
40℃,并于此温度下维持搅拌5小时。tlc法检测反应完全程度后,减压浓缩除去丙酮,加水30毫升,降温至20℃。滴加10%盐酸,调节ph至3.5
‑
4.0,出现混浊。流加甲醇30毫升,出现结晶。过滤,水洗两遍,干燥得到白色至类白色固体粉末10.2克,
26.05mmol),即为式(ii)所示的化合物,经计算式(ii)所示的化合物的质量收率为102%,摩尔收率90.26%。
[0092]
3、在一个500毫升反应瓶中,加入7β
‑
oh
‑4‑
hbc(10克,28.86mmol),顺丁烯二酸酐(9克,91.78mmol),丙酮40毫升,二甲胺4.2克,93.17mmol),2,6
‑
二甲基吡啶(0.2克,1.87mmol)。升温至38
‑
40℃,并于此温度下维持搅拌5小时。tlc法检测反应完全程度后,减压浓缩除去丙酮,加水30毫升,降温至20℃。滴加10%盐酸,调节ph至3.5
‑
4.0,出现混浊。流加甲醇30毫升,出现结晶。过滤,水洗两遍,干燥得到白色至类白色固体粉末(9.72克,24.83mmol),即为式(ii)所示的化合物,经计算式(ii)所示的化合物的质量收率为97.2%,摩尔收率86.04%。
[0093]
4、在一个500毫升反应瓶中,加入7β
‑
oh
‑4‑
hbc(10克,28.86mmol),戊二酸酐(6.2克,54.34mmol),四氢呋喃40毫升,二乙胺(4.5克,61.53mmol),2
‑
甲基吡啶(0.2克,2.15mmol)。升温至28
‑
30℃,并于此温度下维持搅拌5小时。tlc法检测反应完全程度后,减压浓缩除去四氢呋喃,加水30毫升,降温至10
‑
15℃。滴加10%盐酸,调节ph至3.5
‑
4.0,出现混浊。流加甲醇30毫升,出现结晶。过滤,水洗两遍,干燥得到白色至类白色固体粉末(9.2克,23.5mmol),即为式(ii)所示的化合物,经计算式(ii)所示的化合物的质量收率为92%,摩尔收率81.43%。
[0094]
5、在一个500毫升反应瓶中,加入7β
‑
oh
‑4‑
hbc(10克,28.86mmol),丁二酸酐(5.2克,51.96mmol),呋喃40毫升,乙胺(4.5克,99.82mmol),吡啶(0.2克,2.53mmol)。升温至28
‑
30℃,并于此温度下维持搅拌6小时。tlc法检测反应完全程度后,减压浓缩除去呋喃,加水30毫升,降温至20℃。滴加10%盐酸,调节ph至3.5
‑
4.0,出现混浊。流加甲醇30毫升,出现结晶。过滤,水洗两遍,干燥得到白色至类白色固体粉末(7.1克,18.13mmol),即为式(ii)所示的化合物,经计算式(ii)所示的化合物的质量收率为71%,摩尔收率62.82%。
[0095]
实施例2式(iii)所示的化合物的制备
[0096]
本实施例提供式(iii)所示化合物的制备方法,具体为以下1
‑
3中的任一种:
[0097]
1、在一个500毫升反应瓶中,加入式(ii)所示的化合物(10克,24.84mmol),四氢呋喃50毫升,25
‑
30℃搅拌30分钟,至式(ii)所示的化合物完全溶解。加入n
‑
溴代琥珀酰亚胺nbs(5.2克,29.22mmol),10℃继续搅拌4小时,得类白色混悬物。如tlc法检测反应完全,减压浓缩除去四氢呋喃。加水,抽滤,二氯甲烷萃取三遍,水洗两遍,减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iii)所示的化合物(9.2g,22.91mmol),经计算,式(iii)所示的化合物的质量收率为92%,摩尔收率92.23%。
[0098]
2、在一个500毫升反应瓶中,加入式(ii)所示的化合物(10克,24.84mmol),四氢呋喃50毫升,25
‑
30℃搅拌30分钟,至式(ii)所示的化合物完全溶解。加入n
‑
溴代琥珀酰亚胺nbs(9.2克,51.7mmol),10℃继续搅拌4小时,得类白色混悬物。如tlc法检测反应完全,减压浓缩除去四氢呋喃。加水,抽滤,二氯甲烷萃取三遍,水洗两遍,减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iii)所示的化合物(8.85g,22.04mmol),经计算,式(iii)所示的化合物的质量收率为88.5%,摩尔收率88.73%。
[0099]
3、在一个500毫升反应瓶中,加入式(ii)所示的化合物(10克,24.84mmol),丙酮50毫升,25
‑
30℃搅拌30分钟,至式(ii)所示的化合物完全溶解。加入2
‑
碘酰基苯甲酸ibx(4.2克,15.00mmol),20℃继续搅拌5小时,得类白色混悬物。如tlc法检测反应完全,减压浓缩除
去丙酮。加水,抽滤,二氯甲烷萃取三遍,水洗两遍,减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iii)所示的化合物(6.7g,16.69mmol),经计算式(iii)所示的化合物的质量收率为67%,摩尔收率67.19%。
[0100]
4、在一个500毫升反应瓶中,加入式(ii)所示的化合物(10克,24.84mmol),氯仿水溶液50毫升,25
‑
30℃搅拌30分钟,至式(ii)所示的化合物完全溶解。加入2
‑
碘酰基苯甲酸ibx(10克,24.84mmol),20℃继续搅拌5小时,得类白色混悬物。如tlc法检测反应完全,减压浓缩除去氯仿。加水,抽滤,二氯甲烷萃取三遍,水洗两遍,减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iii)所示的化合物(4.3g,10.71mmol),经计算式(iii)所示的化合物的质量收率为43%,摩尔收率43.12%。
[0101]
实施例3式(iv)所示的化合物的制备
[0102]
本实施例提供式(iv)所示化合物的制备方法,具体为以下1
‑
3中的任一种:
[0103]
1、在一个500毫升反应瓶中,加入式(iii)所示的化合物(2克,4.98mmol),乙氧甲酰基亚甲基三苯基膦(4.12g,11.83mmol),四氢呋喃30ml,0
‑
4℃回流反应4h。tlc检测反应完全后减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iv)所示的化合物(2.2g,4.68mmol),经计算式(iv)所示的化合物的质量收率为110%,摩尔收率93.97%。
[0104]
2、在一个500毫升反应瓶中,加入式(iii)所示的化合物(2克,4.98mmol),乙氧甲酰基亚甲基三苯基膦(2.12g,6.09mmol),四氢呋喃30ml,0
‑
4℃回流反应4h。tlc检测反应完全后减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iv)所示的化合物(2.05g,4.36mmol),经计算式(iv)所示的化合物的质量收率为102.5%,摩尔收率87.55%。
[0105]
3、在一个500毫升反应瓶中,加入式(iii)所示的化合物(2克,4.98mmol),膦酰基乙酸三乙酯(2.4g,10.71mmol),四氢呋喃30ml,5
‑
10℃回流反应4h。tlc检测反应完全后减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iv)所示的化合物(1.94g,4.12mmol),经计算式(iv)所示的化合物的质量收率为97%,摩尔收率82.73%。
[0106]
4、在一个500毫升反应瓶中,加入式(iii)所示的化合物(2克,4.98mmol),乙氧甲酰基亚甲基三苯基膦(4.12g,11.83mmol),甲苯30ml,0
‑
4℃回流反应4h。tlc检测反应完全后减压浓缩,硅胶柱层析(pe/ea=3/1,v/v)纯化,得到式(iv)所示的化合物(1.86g,3.95mmol),经计算式(iv)所示的化合物的质量收率为93%,摩尔收率79.31%。
[0107]
实施例4式(v)所示的化合物的制备
[0108]
本实施例提供式(v)所示化合物的制备方法,具体为以下1
‑
3中的任一种:
[0109]
1、在一个500毫升反应瓶中,加入式(iv)所示的化合物(10克,21.25mmol)、二氯甲烷和乙醇(v:v=7:3)的混合溶剂250ml,加入4
‑
甲氧基吡啶(0.5g,4.58mmol),10%pd/c(500mg,0.47mmol),置换氢气三次,0.3mpa,20℃反应。tlc监测反应完全完毕后,抽滤pd/c,将滤液旋干,得到淡黄色固体。将上述淡黄色固体加入石油醚45ml,25℃打浆12h,抽滤,得到式(v)所示的化合物(9.2g,19.39mmol),经计算式(v)所示的化合物的质量收率为92%,摩尔收率91.25%。
[0110]
2、在一个500毫升反应瓶中,加入式(iv)所示的化合物(10克,21.25mmol)、二氯甲烷和乙醇(v:v=7:3)的混合溶剂250ml,加入4
‑
甲氧基吡啶(1g,9.16mmol),10%pd/c(500mg,0.47mmol),置换氢气三次,0.3mpa,20℃反应。tlc监测反应完全完毕后,抽滤pd/c,将滤液旋干,得到淡黄色固体。将上述淡黄色固体加入石油醚45ml,25℃打浆12h,抽滤,得
到式(v)所示的化合物(8.8g,18.55mmol),经计算式(v)所示的化合物的质量收率为88%,摩尔收率87.29%。
[0111]
3、在一个500毫升反应瓶中,加入式(iv)所示的化合物(10克,21.25mmol)、乙酸乙酯250ml,加入4
‑
甲氧基吡啶(0.5g,4.58mmol),5%pd/c(500mg,0.235mmol),置换氢气三次,0.3mpa,20℃反应。tlc监测反应完全完毕后,抽滤pd/c,将滤液旋干,得到淡黄色固体。将上述淡黄色固体加入石油醚45ml,25℃打浆12h,抽滤,得到式(v)所示的化合物(7.8g,16.44mmol),经计算式(v)所示的化合物的质量收率为78%,摩尔收率77.36%。
[0112]
4、在一个500毫升反应瓶中,加入式(iv)所示的化合物(10克,21.25mmol)、二氯甲烷和乙醇(v:v=1:1)的混合溶剂250ml,加入4
‑
二甲氨基吡啶(0.5g,4.09mmol),10%pd/c(500mg,0.47mmol),置换氢气三次,0.3mpa,10℃反应。tlc监测反应完全完毕后,抽滤pd/c,将滤液旋干,得到淡黄色固体。将上述淡黄色固体加入石油醚45ml,25℃打浆12h,抽滤,得到式(v)所示的化合物(6.8g,14.33mmol),式(v)所示的化合物的质量收率为68%,摩尔收率67.44%。
[0113]
实施例5式(vi)所示化合物及式(vii)所示化合物的制备
[0114]
本实施例提供式(vi)所示化合物及式(vii)所示化合物的制备方法,具体为以下1
‑
3中的任一种,其中,制备得到的式(vi)所示化合物的粗品不用进行精制,可直接用于下一步水解得到式(vii)所示化合物。
[0115]
1、在一个500毫升反应瓶中,加入式(v)所示的化合物(10克,21.07mmol)、cecl3·
7h2o(10g,26.84mmol),四氢呋喃和甲醇混合溶剂(v:v=1:2)80ml,
‑
30℃加入kbh4(2.1g,38.93mmol),
‑
30℃反应。tlc监测反应完全完毕后,加入丙酮(2ml)淬灭反应。将溶剂旋干,加入ea溶液,再加入10%的乙酸水溶液至溶液澄清,分液,有机相用水洗,饱和nacl的水溶液干燥,无水硫酸钠干燥,减压浓缩,得到式(vi)所示的化合物粗品,直接用于下一步合成。
[0116]
将上述式(vi)所示的化合物粗品,加入60ml四氢呋喃与甲醇的混合溶剂(v:v=1:2)中,搅拌至溶清,0℃缓慢加氢氧化锂1.25g,室温反应过夜。tlc监测反应完全完毕后,将反应液的溶剂减压浓缩,加入水溶解,稀盐酸调节ph值至4左右,有大量白色固体析出,抽滤,得到式(vii)所示的化合物的粗品。将粗品加入30ml乙酸乙酯中打浆过夜,抽滤,得到熊去氧胆酸(7.4g,18.9mmol),质量收率为74%,摩尔收率89.7%。
[0117]
2、在一个500毫升反应瓶中,加入式(v)所示的化合物(10克,21.07mmol)、cecl3·
7h2o(20g,53.68mmol),四氢呋喃和甲醇混合溶剂(v:v=1:2)80ml,
‑
30℃加入kbh4(2.1g,38.93mmol),
‑
30℃反应。tlc监测反应完全完毕后,加入丙酮(2ml)淬灭反应。将溶剂旋干,加入ea溶液,再加入10%的乙酸水溶液至溶液澄清,分液,有机相用水洗,饱和nacl的水溶液干燥,无水硫酸钠干燥,减压浓缩,得到式(vi)所示的化合物粗品,直接用于下一步合成。
[0118]
将上述式(vi)所示的化合物粗品,加入60ml四氢呋喃与甲醇的混合溶剂(v:v=1:2)中,搅拌至溶清,0℃缓慢加氢氧化锂1.25g,室温反应过夜。tlc监测反应完全完毕后,将反应液的溶剂减压浓缩,加入水溶解,稀盐酸调节ph值至4左右,有大量白色固体析出,抽滤,得到式(vii)所示的化合物的粗品。将粗品加入30ml乙酸乙酯中打浆过夜,抽滤,得到熊去氧胆酸(7.1g,18.13mmol),质量收率为71%,摩尔收率86.04%。
[0119]
3、在一个500毫升反应瓶中,加入式(v)所示的化合物(10克,21.07mmol)、cecl3·
7h2o(10g,26.84mmol),四氢呋喃和甲醇混合溶剂(v:v=1:2)80ml,
‑
30℃加入kbh4(4.1g,
76.01mmol),
‑
30℃反应。tlc监测反应完全完毕后,加入丙酮(2ml)淬灭反应。将溶剂旋干,加入ea溶液,再加入10%的乙酸水溶液至溶液澄清,分液,有机相用水洗,饱和nacl的水溶液干燥,无水硫酸钠干燥,减压浓缩,得到式(vi)所示的化合物粗品,直接用于下一步合成。
[0120]
将上述式(vi)所示的化合物粗品,加入60ml四氢呋喃与甲醇的混合溶剂(v:v=1:2)中,搅拌至溶清,0℃缓慢加氢氧化锂1.25g,室温反应过夜。tlc监测反应完全完毕后,将反应液的溶剂减压浓缩,加入水溶解,稀盐酸调节ph值至4左右,有大量白色固体析出,抽滤,得到式(vii)所示的化合物的粗品。将粗品加入30ml乙酸乙酯中打浆过夜,抽滤,得到熊去氧胆酸(7.1g,18.13mmol),质量收率为71%,摩尔收率86.04%。
[0121]
4、在一个500毫升反应瓶中,加入式(v)所示的化合物(10克,21.07mmol)、cecl3·
7h2o(10g,26.84mmol),乙酸乙酯80ml,
‑
40℃分批加入nabh4(1.5g,39.65mmol),
‑
30℃反应。tlc监测反应完全完毕后,加入丙酮(2ml)淬灭反应。将溶剂旋干,加入ea溶液,再加入10%的乙酸水溶液至溶液澄清,分液,有机相用水洗,饱和nacl的水溶液干燥,无水硫酸钠干燥,减压浓缩,得到式(vi)所示的化合物粗品,直接用于下一步合成。
[0122]
将上述化合物式(vi)所示的化合物粗品,加入60ml乙酸乙酯中,搅拌至溶清,0℃缓慢加氢氧化锂1.25g,室温反应过夜。tlc监测反应完全完毕后,将反应液的溶剂减压浓缩,加入水溶解,稀盐酸调节ph值至4左右,有大量白色固体析出,抽滤,得到式(vii)所示的化合物的粗品。将粗品加入30ml乙酸乙酯中打浆过夜,抽滤,得到熊去氧胆酸(6.9g,17.62mmol),质量收率为69%,摩尔收率83.62%。
[0123]
5、在一个500毫升反应瓶中,加入式(v)所示的化合物(10克,21.07mmol)、cecl3·
7h2o(10g,26.84mmol),四氢呋喃80ml,
‑
40℃分批加入kbh4(2.1g,38.93mmol),
‑
40℃反应。tlc监测反应完全完毕后,加入丙酮(2ml)淬灭反应。将溶剂旋干,加入ea溶液,再加入10%的乙酸水溶液至溶液澄清,分液,有机相用水洗,饱和nacl的水溶液干燥,无水硫酸钠干燥,减压浓缩,得到式(vi)所示的化合物粗品,直接用于下一步合成。
[0124]
将上述式(vi)所示的化合物粗品,加入60ml四氢呋喃与甲醇的混合溶剂(v:v=1:2)中,搅拌至溶清,0℃缓慢加氢氧化钠1.5g,室温反应过夜。tlc监测反应完全完毕后,将反应液的溶剂减压浓缩,加入水溶解,稀盐酸调节ph值至4左右,有大量白色固体析出,抽滤,得到式(vii)所示的化合物的粗品。将粗品加入30ml乙酸乙酯中打浆过夜,抽滤,得到熊去氧胆酸(6.5g,16.6mmol),质量收率为65%,摩尔收率78.78%。
[0125]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

