1.本发明涉及植物组织和细胞培养技术领域技术领域,具体涉及甘蔗幼叶不同发育时期原生质体分离及提取方法。
背景技术:
2.植物体细胞融合是指2种来自不同种或属的异源原生质体,通过细胞膜的流动性使得2种原生质体发生融合(核融合、胞质融合),形成杂合体细胞的过程。体细胞杂交育种可以突破物种生殖隔离,且不受种属的限制,可创造远缘杂交。迄今为止,已有很多禾本科植物通过原生质体融合技术获得了杂合体植株。甘蔗是重要的糖类和纤维作物,此前对甘蔗原生质体的培养和融合有广泛研究,但至今只有4例关于其原生质体再生植株的报道。aftab等(optimization of conditions for electrofusion in sugarcane protoplasys[j].pakistan journal of botany,2002,34(3);297
‑
301)用甘蔗叶片叶肉细胞和细胞悬浮系分离得到的原生质体进行电融合,最终杂合体细胞分裂形成了小愈伤,但并未分化长成杂合体植株。宋亚妮(甘蔗原生质体的融合及杂核细胞再生条件的优化[d].南宁:广西大学,2018)以甘蔗桂糖28号和新台糖22号为材料,优化了peg融合和电融合的条件、以及融合后杂合体细胞再生的培养条件,获得了杂合体细胞的愈伤组织,但没有进一步分化形成植株。目前甘蔗幼叶提取原生质体融合再生植株,还存在试验重复性差,实验激素组合和浓度差异大、培养过程中褐化死亡导致甘蔗原生质体再生频率低的问题。
[0003]
甘蔗茎尖顶端未展开的幼叶组织细胞处于一边分裂一边分化的状态,细胞类型的组成比较复杂,有部分细胞是刚启动分化的细胞,部分细胞是分生细胞,部分细胞已经是成熟细胞。不同细胞类型体内代谢物成分不一样,内源激素的组分也不一样,分化初期的细胞,既具有分裂能力又具有分化能力,体内的激素可以维持其往分裂的方向发展,也可以引导其往分化的方向发展,利用外源激素稍微打破激素平衡即可以改变其分裂或分化的方向。分生细胞维持细胞持续分裂,体内的激素就足以支撑其继续保持分裂能力,分离出的原生质体,不需额外添加外源激素仍可启动分裂。成熟的细胞要维持细胞分裂必须要进行脱分化,这种类型的原生质体培养必须添加脱分化的激素组合才能重新启动分裂。原生质体培养实验的重复性差往往是因为细胞发育状态不一致,所需的培养条件和激素类型有所差别,而当用统一的培养方式和培养激素时,对有些细胞有利,有些细胞不利,导致部分细胞很快死亡,最终引起全部细胞死亡。在酶解过程中获得相同细胞发育状态的原生质体,然后再根据细胞发育特征辅以相应的激素和培养方式,有利于原生质体的再生。
[0004]
为了解决原生质体启动分裂及再生愈伤组织困难的问题,本发明拟以新台糖22号为材料,切取尾梢内层的淡黄色幼叶,经过酶解分离纯化出分化初期细胞、分生细胞和成熟细胞,为今后原生质体的培养提供同质性材料,同时为体细胞融合育种提供技术支撑。
技术实现要素:
[0005]
本发明的发明目的在于:针对上述存在的问题,提供甘蔗幼叶不同发育时期原生
质体分离及提取方法,通过本发明的方法可以分离纯化出分生细胞、分化初期细胞和成熟细胞,为今后原生质体的培养提供同质性材料,同时为体细胞融合育种提供技术支撑。
[0006]
为了实现上述目的,本发明采用的技术方案如下:
[0007]
甘蔗幼叶不同发育时期原生质体分离及提取方法,包括以下步骤:
[0008]
(1)预处理
[0009]
从大田采回新台糖22号8
‑
10叶龄的甘蔗植株尾梢,除去叶片,进行表面消毒,待表面干后,喷无菌水至湿润,用防水膜和不透光材料包扎好放置在温度为14
‑
16℃控温装置内,每隔一天降温2
‑
3℃,降至8
‑
10℃,在控温装置内放置的时间一共为4天;
[0010]
(2)酶解
[0011]
①
取预处理后的材料,剥去外面4
‑
5层叶鞘后,进行消毒,再用无菌水洗涤;于无菌环境中切除外层叶鞘,取最里面3
‑
4层距生长点4
‑
6cm甘蔗尾鞘的淡黄色幼叶作为酶解材料;
[0012]
②
将幼叶切成薄片,收集在培养皿中,铺满培养皿;在培养皿中加入含13w/v%甘露醇的cpw溶液,使幼叶质壁分离0.4
‑
0.6h;
[0013]
③
弃掉cpw溶液,加入酶解液在室温、黑暗条件下酶解;酶解液的组成为1%纤维素酶 0.5%果胶酶 0.1%离析酶 0.3%半纤维素酶,含9w/v%甘露醇,ph 5.8;
[0014]
(3)分离纯化
[0015]
所述分离纯化包括分化初期细胞的分离纯化,具体为:在经过所述步骤(2)酶解后,将酶解产物通过300目筛网过滤至离心管,450
‑
550r
·
min
‑1低速离心5
‑
9min;离心结束后迅速将上部酶解液倒出,上部酶解液收集待用,底部沉淀用mr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有含19%w/v蔗糖的mp溶液,采用450
‑
550r
·
min
‑1低速离心4
‑
7min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分化初期细胞。
[0016]
进一步地,本发明所述的分离纯化还包括分生细胞的分离纯化,具体为,在所述步骤(3)中,取完环形原生质体带后,将离心管中的底部沉淀用mr溶液洗涤一遍,然后用mr溶液悬浮,将悬浮液转入离心管中,离心管内预先加有含21%w/v蔗糖的mp,采用450
‑
550r
·
min
‑1低速离心5min;离心结束后,吸取悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分生细胞。
[0017]
进一步地,本发明所述的分离纯化还包括成熟细胞的分离纯化,具体为,收集步骤(3)中过筛后筛网上的幼叶残渣,继续用步骤(3)中回收的上部酶液酶解至糜烂状态,然后继续按照步骤(3)中酶解后的相同方法完成过筛、洗涤、悬浮、制备环形原生质体带的操作,获得纯化后的成熟细胞。
[0018]
优选地,上述操作中所述消毒均采用75%乙醇。
[0019]
优选地,上述操作中所述悬浮所用的mr溶液均为2ml,离心管中加有的mp溶液的体积均为5ml。
[0020]
优选地,所述防水膜为保鲜膜,所述不透光材料为黑布。
[0021]
优选地,步骤(2)中所述酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为1.8
‑
2.2h。
[0022]
综上所述,由于采用了上述技术方案,本发明的有益效果是:
[0023]
本发明的分离纯化方法包括预处理、酶解和分离纯化的步骤,其中酶解分两次进行,第一次酶解后过筛,对沉淀进行洗涤、悬浮得到纯化后的分化初期细胞,第一次悬浮取完环形原生质体带后,将离心管中的沉淀再次洗涤、悬浮得到纯化后的分生细胞,第一次酶解后的上部酶解液对筛网上的幼叶残渣进行第二次酶解,过筛后对沉淀进行洗涤、悬浮得到纯化后的成熟期细胞。本发明可以获取不同类型细胞的原生质体,各种类型的细胞之间差异较大,而同种类型的细胞之间的同质性良好,可用于进一步探索不同类型细胞相应的培养条件,避免了各类细胞统一培养存在的弊端。
附图说明
[0024]
图1为分生细胞的原生质体;
[0025]
图2为分化初期细胞的原生质体;
[0026]
图3是成熟细胞的原生质体;
[0027]
图4是对比例分离得到的多种细胞类型混杂的原生质体。
具体实施方式
[0028]
为了更清楚地表达本发明,以下通过具体实施例对本发明作进一步说明。
[0029]
本发明中所用的含13w/v%甘露醇的cpw溶液配方为:27.2mg/l磷酸二氢钾,101.0mg/l硝酸钾,1480.0mg/l氯化钙,246mg/l七水合硫酸镁,0.16mg/l碘化钾,0.025mg/l五水合硫酸铜,13%w/v甘露醇,ph 5.8。
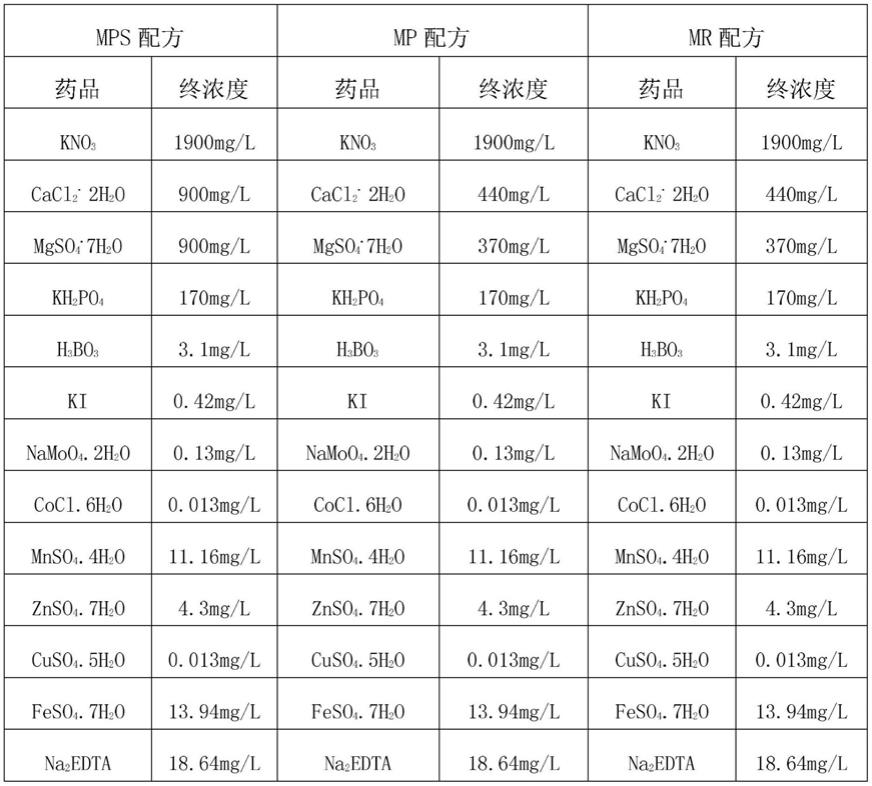
[0030]
含蔗糖的mp溶液、mr溶液和mps溶液的的配方见下表1。
[0031]
表1部分溶液配方表
[0032]
[0033][0034]
实施例1
[0035]
甘蔗幼叶分化初期细胞的分离纯化方法,包括以下步骤:
[0036]
(1)预处理
[0037]
从大田采回新台糖22号8
‑
10叶龄的甘蔗植株尾梢,除去叶片,采用75%乙醇进行表面消毒,待表面乙醇蒸发干后,喷无菌水至湿润,用保鲜膜和黑布包扎好放置在温度为14℃控温装置内,每隔一天降温3℃,降至8℃,在控温装置内放置的时间一共为4天;
[0038]
(2)酶解
[0039]
①
取预处理后的材料,剥去外面4层叶鞘后,采用75%乙醇进行消毒,再用无菌水洗涤3次;于无菌环境中切除外层叶鞘,取最里面3层距生长点4cm甘蔗尾鞘的淡黄色幼叶作为酶解材料;
[0040]
②
将幼叶切成长约1cm,宽约0.5cm的薄片,收集在直径为9cm的培养皿中,铺满培养皿;在培养皿中加入含13w/v%甘露醇的cpw溶液,使幼叶质壁分离0.4h;
[0041]
③
弃掉cpw溶液,加入酶解液在室温、黑暗条件下酶解;酶解液的组成为1%纤维素酶 0.5%果胶酶 0.1%离析酶 0.3%半纤维素酶,含9w/v%甘露醇,ph 5.8,酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为1.8h;
[0042]
(3)分化初期细胞的分离纯化,具体为:在经过所述步骤(2)酶解后,将酶解产物通过300目尼龙筛网过滤至离心管,450r
·
min
‑1低速离心9min;离心结束后迅速将上部酶解液倒出,上部酶解液收集待用,底部沉淀用2mlmr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有5ml含19%w/v蔗糖的mp溶液,采用450r
·
min
‑1低速离心7min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到
纯化后的分化初期细胞。
[0043]
实施例2
[0044]
甘蔗幼叶分化初期细胞和分生细胞的分离纯化方法,包括以下步骤:
[0045]
(1)预处理
[0046]
从大田采回新台糖22号8
‑
10叶龄的甘蔗植株尾梢,除去叶片,采用75%乙醇进行表面消毒,待表面乙醇蒸发干后,喷无菌水至湿润,用保鲜膜和黑布包扎好放置在温度为16℃控温装置内,每隔一天降温3℃,降至10℃,在控温装置内放置的时间一共为4天;
[0047]
(2)酶解
[0048]
①
取预处理后的材料,剥去外面5层叶鞘后,采用75%乙醇进行消毒,再用无菌水洗涤3次;于无菌环境中切除外层叶鞘,取最里面4层距生长点6cm甘蔗尾鞘的淡黄色幼叶作为酶解材料;
[0049]
②
将幼叶切成长约1cm,宽约0.5cm的薄片,收集在直径为9cm的培养皿中,铺满培养皿;在培养皿中加入含13w/v%甘露醇的cpw溶液,使幼叶质壁分离0.5h;
[0050]
③
弃掉cpw溶液,加入酶解液在室温、黑暗条件下酶解;酶解液的组成为1%纤维素酶 0.5%果胶酶 0.1%离析酶 0.3%半纤维素酶,含9w/v%甘露醇,ph 5.8,酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为2.2h;
[0051]
(3)分离纯化
[0052]
分化初期细胞的分离纯化,具体为:在经过所述步骤(2)酶解后,将酶解产物通过300目尼龙筛网过滤至离心管,550r
·
min
‑1低速离心5min;离心结束后迅速将上部酶解液倒出,上部酶解液收集待用,底部沉淀用2mlmr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有5ml含19%w/v蔗糖的mp溶液,采用550r
·
min
‑1低速离心4min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分化初期细胞。
[0053]
分生细胞的分离纯化,具体为,在所述步骤(3)中,取完环形原生质体带后,将离心管中的底部沉淀用mr溶液洗涤一遍,然后用2mlmr溶液悬浮,将悬浮液转入离心管中,离心管内预先加有含5ml、21%w/v蔗糖的mp,采用450r
·
min
‑1低速离心5min;离心结束后,吸取悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分生细胞。
[0054]
实施例3
[0055]
甘蔗幼叶不同发育时期原生质体分离及提取方法,包括以下步骤:
[0056]
(1)预处理
[0057]
从大田采回新台糖22号8
‑
10叶龄的甘蔗植株尾梢,除去叶片,采用75%乙醇进行表面消毒,待表面乙醇蒸发干后,喷无菌水至湿润,用保鲜膜和黑布包扎好放置在温度为15℃控温装置内,每隔一天降温3℃,降至9℃,在控温装置内放置的时间一共为4天;
[0058]
(2)酶解
[0059]
①
取预处理后的材料,剥去外面4层叶鞘后,采用75%乙醇进行消毒,再用无菌水洗涤3次;于无菌环境中切除外层叶鞘,取最里面3层距生长点5cm甘蔗尾鞘的淡黄色幼叶作为酶解材料;
[0060]
②
将幼叶切成长约1cm,宽约0.5cm的薄片,收集在直径为9cm的培养皿中,铺满培
养皿;在培养皿中加入含13w/v%甘露醇的cpw溶液,使幼叶质壁分离0.6h;
[0061]
③
弃掉cpw溶液,加入酶解液在室温、黑暗条件下酶解;酶解液的组成为1%纤维素酶 0.5%果胶酶 0.1%离析酶 0.3%半纤维素酶,含9w/v%甘露醇,ph 5.8,酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为2.0h;
[0062]
(3)分离纯化
[0063]
分化初期细胞的分离纯化,具体为:在经过所述步骤(2)酶解后,将酶解产物通过300目尼龙筛网过滤至离心管,筛网上的幼叶残渣收集备用,滤液在500r
·
min
‑1低速离心6min;离心结束后迅速将上部酶解液倒出,上部酶解液收集待用,底部沉淀用2mlmr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有5ml含19%w/v蔗糖的mp溶液,采用500r
·
min
‑1低速离心5min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分化初期细胞。
[0064]
分生细胞的分离纯化,具体为,在所述步骤(3)中,取完环形原生质体带后,将离心管中的底部沉淀用mr溶液洗涤一遍,然后用2mlmr溶液悬浮,将悬浮液转入离心管中,离心管内预先加有含5ml、21%w/v蔗糖的mp,采用500r
·
min
‑1低速离心5min;离心结束后,吸取悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的分生细胞。
[0065]
成熟细胞的分离纯化:收集步骤(3)中过筛后筛网上的幼叶残渣,继续用步骤(3)中回收的上部酶液酶解至糜烂状态,酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为1.8
‑
2.2h,然后继续按照步骤(3)中酶解后的相同方法完成过筛、洗涤、悬浮、制备环形原生质体带的操作,即,将酶解产物通过300目筛网过滤至离心管,滤液用500r
·
min
‑1低速离心6min;离心结束后迅速将上部酶解液倒出,底部沉淀用mr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有含19%w/v蔗糖的mp溶液,采用500r
·
min
‑1低速离心5min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到纯化后的成熟细胞。
[0066]
对比例
[0067]
甘蔗幼叶的原生质体分离及提取方法,包括以下步骤:
[0068]
(1)预处理
[0069]
从大田采回新台糖22号8
‑
10叶龄的甘蔗植株尾梢,除去叶片,采用75%乙醇进行表面消毒,待表面乙醇蒸发干后,喷无菌水至湿润,用保鲜膜和黑布包扎好放置在温度为15℃控温装置内,每隔一天降温3℃,降至9℃,在控温装置内放置的时间一共为4天;
[0070]
(2)酶解
[0071]
①
取预处理后的材料,剥去外面5层叶鞘后,采用75%乙醇进行消毒,再用无菌水洗涤3次;于无菌环境中切除外层叶鞘,取最里面3层距生长点5cm甘蔗尾鞘的淡黄色幼叶作为酶解材料;
[0072]
②
将幼叶切成长约1cm,宽约0.5cm的薄片,收集在直径为9cm的培养皿中,铺满培养皿;在培养皿中加入含13w/v%甘露醇的cpw溶液,使幼叶质壁分离0.5h;
[0073]
③
弃掉cpw溶液,加入酶解液在室温、黑暗条件下酶解;酶解液的组成为1%纤维素酶 0.5%果胶酶 0.1%离析酶 0.3%半纤维素酶,含9w/v%甘露醇,ph 5.8,酶解的条件为,在摇床上以50r
·
min
‑1的低速振动,酶解时间为3.5h;
[0074]
(3)分离纯化
[0075]
原生质体的分离纯化,具体为:在经过所述步骤(2)酶解后,将酶解产物通过300目尼龙筛网过滤至离心管,用mr溶液将两个离心管配平,500r
·
min
‑1低速离心7min;离心结束后迅速将上部酶解液倒出,底部沉淀用2mlmr溶液悬浮,并将悬浮液转入离心管中,离心管内预先加有5ml含21%w/v蔗糖的mp溶液,采用500r
·
min
‑1低速离心5min;离心结束后,取出离心管,收集悬浮于mr溶液和mp溶液之间的环形原生质体带,用mps溶液洗涤一遍,即得到甘蔗幼叶的原生质体。
[0076]
参见图1
‑
4,图1为实施例3酶解出来的分生细胞的原生质体,可以看出其细胞体积小,细胞质浓,细胞核大,无明显液泡;图2为分化初期细胞的原生质体,可以看出细胞质浓,细胞核处于细胞中心,有多个小液泡;图3为成熟细胞的原生质体,可以看出其细胞较大,细胞质较稀,有明显大液泡,细胞核处于细胞边缘。图4为对比例酶解出来的原生质体,可以看出其是多种细胞类型混杂的原生质体,可以看出其细胞大小不一,细胞核位置各不相同。因此,本发明通过分两个时段酶解,然后用了两种mp浓度作界面分离,成功得到三种类型的细胞,同种类型的细胞之间的同质性良好,可用于进一步探索不同类型细胞相应的培养条件,避免了各类细胞统一培养存在的弊端。
[0077]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

