1.本发明属于牙周缺损再生修复材料领域,特别涉及一种仿牙周有序双层结构支架材料的制备方法及其在牙周缺损再生修复中的应用。
背景技术:
2.天然牙周组织是由软、硬组织共同构成的一个功能系统,软组织包括牙周膜和牙龈,硬组织包括牙槽骨和牙骨质,该系统将牙齿牢固地附着于牙槽骨,承受咬合力。牙周膜主要是由有序排列的i型胶原纤维组成,主要起到缓冲作用,可抵抗牙齿受到各种机械外力导致的创伤;牙槽骨主要是由有序排列的矿化胶原纤维组成,主要为牙齿提供机械支撑作用。我国牙周炎的患病率高达90%以上,严重的牙周炎症常常导致牙周支持组织的缺损,甚至导致牙齿松动脱落。天然牙周组织具有复杂的矿化与非矿化多层结构,使牙周组织的再生修复具有挑战性。目前临床最常用的牙周组织再生治疗方法包括引导性组织再生术和植骨术,很少能达到完全的组织再生,一般仅为1
‑
2mm,难以满足临床的需求。
3.近年来,组织工程通过支架材料搭载生长因子,构建仿生微环境,诱导干细胞增殖和分化,从而促进牙周组织再生修复,为牙周缺损的治疗提供新的策略。人工支架材料的研究由来已久,从最开始模拟细胞外基质的单相材料,如胶原、壳聚糖、磷酸钙类材料等,到后来模拟牙周软硬组织结构的多相材料,如聚丙交酯
‑
共
‑
乙交酯酸/磷酸钙双层支架、聚己内酯/聚乙醇酸双层支架、水凝胶三层支架,但这些材料都有其局限性,不能真正模拟天然牙周组织的微纳拓扑结构,导致牙周再生效果不理想。理想的牙周组织替代材料应能模拟天然牙周软硬组织的微纳结构和机械性能,具有良好的生物相容性和生物可降解性,提供良好的生长因子微环境,募集宿主干细胞并诱导细胞多向分化。
技术实现要素:
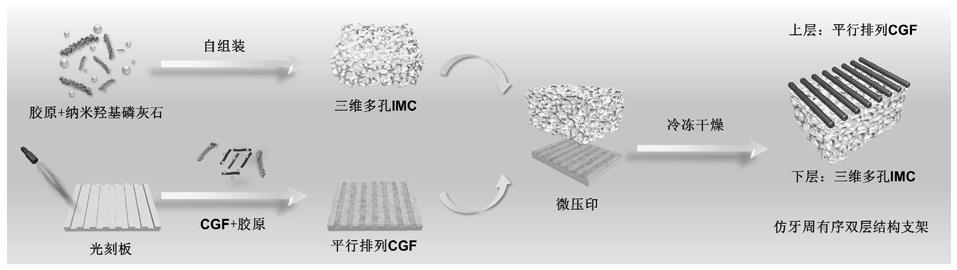
4.发明目的:为了解决上述问题,本发明基于天然牙周组织有序结构,利用仿生自组装技术合成天然牙槽骨样的三维多孔纤维内矿化胶原支架,利用平行光刻板合成天然牙周膜样的平行排列浓缩生长因子支架,最后利用微压印技术形成仿牙周组织有序双层结构支架材料,还提供了该仿生支架材料在牙周缺损再生修复中的应用。
5.技术方案:为达到上述发明目的,本发明采用如下技术方案:
6.一种仿牙周有序双层结构支架材料,所述有序双层结构支架材料包括上层的平行排列浓缩生长因子纤维(模拟天然牙周膜)和下层的三维多孔纤维内矿化胶原支架(模拟天然牙槽骨)。其中,所述浓缩生长因子纤维的宽度为50
‑
100μm,相邻纤维间的间距为50
‑
100μm;所述三维多孔纤维内矿化胶原支架的孔隙率为88
‑
92%,平均孔尺度为80
‑
200μm。
7.所述仿牙周有序双层结构支架材料的制备方法,包括以下步骤:
8.(1)将平行排列的浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,速冻后冻干,即得到双层支架中间体;
9.(2)将双层支架中间体置于溶液中交联,结束后冲洗,冻干,即得到三维仿牙周有
序双层结构的支架材料(cgf/imc)。
10.作为具体实施方案或者优选方案:
11.步骤(1)中,所述压印的时间为5
‑
10min;速冻时间为2
‑
3min;冻干条件为
‑
90~
‑
105℃,0.12
‑
0.45mbar,冻干时间为2
‑
4h;
12.步骤(2)中,在含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3
‑
5h,edc占整个溶液的质量百分比为0.75
‑
1.25%,乙醇水溶液的体积比浓度为75
‑
85%;所述冲洗是使用甘氨酸溶液与双蒸水交替冲洗,所述甘氨酸溶液的质量百分浓度为0.5
‑
1.5%。
13.所述平行排列cgf纤维的制备方法,包括以下步骤:
14.(1)提取cgf:抽取新鲜血液到采血管,即刻离心。弃掉上层部分液体后,收集剩余上层清亮液体和下层上方液体,即得到cgf;
15.(2)微压印技术法制备平行排列的cgf纤维:在得到的cgf中加入i型胶原溶液,混匀后注入到光刻板平行模具中,室温静置0.5
‑
1h,即得到平行排列的cgf纤维。
16.优选的:
17.步骤(1)中,所述新鲜血液来源于大鼠心脏动脉血,所述采血管为白色无菌真空离心管,为提取浓缩生长因子专用离心管,不含抗凝剂,采血后需即刻离心;所述离心采用浓缩生长因子专用离心机(medifuge,salfident,意大利),使用可变转速离心来分离全血,其速度为:30s加速,2min 408
×
g,4min 323
×
g,4min 408
×
g,3min 3000
×
g,36s减速,离心后分为两层,上层为清亮液体,下层为红细胞层;
18.步骤(2)中,所述胶原溶液选自i型鼠尾胶原溶液,浓度为0.5
‑
1mg/ml;所述浓缩生长因子与i型鼠尾胶原溶液混合体积比为2:1
‑
3:1;光刻板平行模具的平行槽沟宽度为50
‑
100μm,间隔为50
‑
100μm,深度为50
‑
150μm。
19.所述三维多孔imc支架的制备方法,包括以下步骤:
20.(1)胶原自组装:浓缩胶原溶液,采用热动力学控制的自下而上自组装模式,制备自组装胶原;
21.(2)三维多孔胶原支架的合成:将步骤(1)得到的自组装胶原离心、搅拌均匀得到悬浮液,注入模具中,冷冻干燥,得到三维海绵状的胶原支架;然后在溶液中交联,结束后冲洗,冻干,即得到三维多孔胶原支架;
22.(3)三维多孔胶原支架的矿化:将得到的三维多孔支架浸入到矿化液中进行矿化处理,含钙磷离子的矿化液中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔imc支架。
23.优选的:
24.步骤(1)中,所述胶原溶液选自i型鼠尾胶原溶液,利用聚乙二醇(peg)对i型鼠尾胶原溶液进行浓缩,使其浓度达4.0
‑
5.0mg/ml;所述聚乙二醇的分子量为8000
‑
12000;在透析袋中进行自组装,所述透析袋的分子量为3000
‑
4000,透析时间20
‑
24h;透析液为含10
‑
50mm na2hpo4、5
‑
20mm kh2po4、100
‑
300mm kcl的溶液;
25.步骤(2)中,所述冷冻干燥的条件为
‑
90~
‑
105℃,0.12
‑
0.45mbar,冻干时间为10
‑
12h;在含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3
‑
5h,edc占整个溶液的质量百分比为0.75
‑
1.25%,乙醇水溶液的体积比浓度为75
‑
85%;所述冲
洗是使用甘氨酸溶液与双蒸水交替冲洗,所述甘氨酸溶液的质量百分浓度为0.5
‑
1.5%;
26.步骤(3)中,所述矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:130
‑
140mm nacl、2
‑
3mm的kcl、7
‑
9mm的na2hpo4、1
‑
2mm的k2hpo4·
3h2o、2.5
‑
3.5mm的na3n、溶剂为水(ph为7.0
‑
8.0),硅酸盐在矿化液中含量为0.001
‑
10g;三维多孔支架与矿化液的用量比为0.01
‑
1g:1
‑
100ml;所述聚丙烯酸分子量为1500
‑
2500,同时所述聚丙烯酸在矿化液中浓度为0.2
‑
1mm,矿化时间为5
‑
7天。
27.本发明最后提供了所述的仿牙周有序双层结构支架材料在制备牙周缺损再生修复材料中的应用。
28.有益效果:本发明中采用热动力学控制的自下而上自组装模式,纳米羟基磷灰石与胶原分子共组装,并在胶原纤维内部有序排列,形成三维多孔的imc支架材料;采用光刻技术制作平行光刻板模具,浓缩生长因子与胶原混合液在平行光刻板模具中平行间隔排列,形成平行排列cgf纤维支架材料;采用微压印技术,最终使平行排列cgf支架与多孔imc支架机械结合,形成仿牙周有序双层结构支架材料cgf/imc。仿牙周有序双层结构支架材料成功模拟了天然牙周软硬组织的微纳结构、机械性能和生长因子微环境,具有良好的生物相容性,有利于募集自体干细胞并引导干细胞向成骨向和成纤维向双向特异性分化,实现牙周软硬组织协同再生修复。
29.组织工程学要求生物材料需要具备的首要条件是有良好的生物相容性,而对于牙周组织工程来说,支架材料的微观结构、机械性能和生长因子微环境影响牙周干细胞的多向分化命运。本发明中仿牙周有序双层结构支架材料不管在体外还是体内都具有良好的生物相容性,并且其上层特征性的未矿化平行排列浓缩生长因子支架引导牙周膜干细胞相对平行有序在支架中伸展,体内体外都可以最终分化为成纤维细胞,并特异性表达胶原纤维相关基因和蛋白;其下层特征性的多孔纤维内矿化胶原支架引导牙周膜干细胞交错有序在支架中伸展,体内体外都可以最终分化为成骨细胞,并特异性表达骨组织相关基因和蛋白。
30.材料与牙周宿主之间良好的相互作用促进新生牙周组织的再生,在大鼠牙周开窗缺损模型当中,本发明的仿牙周有序双层结构支架材料可在无外源性干细胞存在下诱导结构特异性新生牙周软硬组织产生,其再生效果可媲美天然牙周组织。
31.该支架制备过程简便易行,有利于实现工业化大规模生产。
附图说明
32.图1:本发明仿牙周有序双层结构支架材料的制备流程图。
33.图2:(a)为本发明仿牙周有序双层结构支架材料的上面观、下面观和侧面观的扫描电镜图;(b)为仿牙周有序双层结构支架材料的上面观、下面观和侧面观的共聚焦显微镜图;(c)为仿牙周有序双层结构支架材料上层和下层的透射电镜图;(d)为仿牙周有序双层结构支架材料上层和下层的原子力显微镜图和杨氏模量统计图。
34.图3:(a)为本发明仿牙周有序双层结构支架材料中生长因子tgf
‑
β1和vegf的免疫荧光图;(b)为仿牙周有序双层结构支架材料在培养基中浸泡1天、3天、5天、7天、9天和14天时生长因子tgf
‑
β1和vegf的累计释放量。
35.图4:本发明中牙周膜干细胞在仿牙周有序双层结构支架材料培养1天、3天和5天时细胞增殖变化图。
36.图5:(a)为本发明中牙周膜干细胞在仿牙周有序双层结构支架材料上层培养1天后的细胞骨架蛋白f
‑
actin的免疫荧光图;(b)为本发明中牙周膜干细胞在仿牙周有序双层结构支架材料下层培养1天后的细胞骨架蛋白f
‑
actin的免疫荧光图;(c)为本发明中牙周膜干细胞在平行排列浓缩生长因子(p
‑
cgf)支架与非平行排列浓缩生长因子(r
‑
cgf)支架中成纤维诱导7天后胶原纤维相关基因和蛋白的表达情况;(d)为本发明中牙周膜干细胞在多孔纤维内矿化胶原(imc)支架和空白孔板(control)中成骨诱导14天后骨组织相关基因表达情况和成骨诱导7天后骨组织相关蛋白表达情况。
37.图6:(a)为本发明仿牙周有序双层结构支架材料移植修复大鼠牙周开窗缺损的手术示意图;(b)为本发明中不同植入材料修复大鼠牙周开窗缺损8周后牙周缺损区域ct图、he染色图和masson染色图;(c)为本发明中不同植入材料修复大鼠牙周开窗缺损8周后牙周缺损区域骨组织相关标志物bmp2、ocn,胶原纤维相关标志物col
‑
1和成血管相关标志物vegfr
‑
1的免疫组化染色图,以及其统计图。
38.图7:(a)为本发明仿牙周有序双层结构支架材料移植入裸鼠皮下8周后的masson染色图和扫描电镜图;(b)为本发明仿牙周有序双层结构支架材料移植入裸鼠皮下8周后干细胞相关标志物cd146、stro
‑
1,骨组织相关标志物bmp2,胶原纤维相关标志物col
‑
1以及成血管相关标志物vegfr
‑
1的免疫组化染色图。
具体实施方式
39.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.本发明中,使用的原料及采购来源如下:鼠尾i型原胶原溶液(bd bio
‑
sciences)、透析袋(invitrogen,paisly,uk)、甘氨酸(sigma
‑
aldrich,usa)、1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(sigma
‑
aldrich,usa)、聚乙二醇(sigma
‑
aldrich,usa)、na2hpo4(sigma
‑
aldrich,usa)、kh2po4(sigma
‑
aldrich,usa)、kcl(sigma
‑
aldrich,usa)、paa(sigma
‑
aldrich,usa)、白色无菌真空离心管(greiner bio
‑
one,austria)、浓缩生长因子专用离心机(medifuge,salfident,italy)。其中图1为仿牙周有序双层结构支架材料的大致制备流程图,以下实施例进行说明本发明。
41.实施例1
42.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
43.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为10min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干2h。
44.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为1%,乙醇溶液的体积比浓度为80%;所述甘氨酸溶液的质量百分浓度为1%。
45.其中,平行排列cgf纤维的制备方法,具体步骤如下:
46.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
47.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入0.5mg/ml的i型胶原溶液,混匀后注入到50μm光刻板平行模具中,室温静置1h,即得到平行排列的cgf纤维。cgf与i型胶原溶液混合体积比为2:1;光刻板模具平行槽沟宽/间隔参数为50μm/50μm,深度为50μm。
48.其中,三维多孔imc支架的制备方法,具体步骤如下:
49.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇8000对i型鼠尾胶原原溶液进行浓缩,使其浓度达4.5mg/ml;透析袋(3500分子量)将置于中性透析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析20h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
50.(2)三维多孔imc支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为1%,乙醇溶液的体积比浓度为80%;所述甘氨酸溶液的质量百分浓度为1%。
51.(3)三维多孔imc支架的矿化:将得到的三维多孔支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑
1mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
52.实施例2
53.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
54.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为5min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干3h。
55.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为1%,乙醇溶液的体积比浓度为80%;所述甘氨酸溶液的质量百分浓度为1%。
56.其中,平行排列cgf纤维的制备方法,具体步骤如下:
57.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
58.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入1mg/ml的i型胶原溶液,混匀后注入到100μm光刻板平行模具中,室温静置45min,即得到平行排列的
cgf纤维。cgf与i型胶原溶液混合体积比为3:1;光刻板模具平行槽沟宽/间隔参数为100μm/100μm,深度为100μm。
59.其中,三维多孔imc支架的制备方法,具体步骤如下:
60.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇8000对i型鼠尾胶原原溶液进行浓缩,使其浓度达4.5mg/ml;透析袋(3500分子量)将置于中性透析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析20h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
61.(2)三维多孔胶原支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为1%,乙醇溶液的体积比浓度为80%;所述甘氨酸溶液的质量百分浓度为1%。
62.(3)三维多孔胶原支架的矿化:将得到的三维多孔胶原支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑
1mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
63.实施例3
64.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
65.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为10min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干2h。
66.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为0.75%,乙醇溶液的体积比浓度为75%;所述甘氨酸溶液的质量百分浓度为1.5%。
67.其中,平行排列cgf纤维的制备方法,具体步骤如下:
68.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
69.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入0.5mg/ml的i型胶原溶液,混匀后注入到50μm光刻板平行模具中,室温静置1h,即得到平行排列的cgf纤维。cgf与i型胶原溶液混合体积比为2:1;光刻板模具平行槽沟宽/间隔参数为50μm/50μm,深度为50μm。
70.其中,三维多孔imc支架的制备方法,具体步骤如下:
71.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇10000对i型鼠尾胶原原溶液进行浓缩,使其浓度达5.0mg/ml;透析袋(3000分子量)将置于中性透
析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析22h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
72.(2)三维多孔imc支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为0.75%,乙醇溶液的体积比浓度为75%;所述甘氨酸溶液的质量百分浓度为1.5%。
73.(3)三维多孔imc支架的矿化:将得到的三维多孔支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑
1mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
74.实施例4
75.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
76.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为5min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干3h。
77.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为0.75%,乙醇溶液的体积比浓度为75%;所述甘氨酸溶液的质量百分浓度为1.5%。
78.其中,平行排列cgf纤维的制备方法,具体步骤如下:
79.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
80.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入1mg/ml的i型胶原溶液,混匀后注入到100μm光刻板平行模具中,室温静置45min,即得到平行排列的cgf纤维。cgf与i型胶原溶液混合体积比为3:1;光刻板模具平行槽沟宽/间隔参数为100μm/100μm,深度为100μm。
81.其中,三维多孔imc支架的制备方法,具体步骤如下:
82.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇10000对i型鼠尾胶原原溶液进行浓缩,使其浓度达5.0mg/ml;透析袋(3000分子量)将置于中性透析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析22h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
83.(2)三维多孔胶原支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲
洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为0.75%,乙醇溶液的体积比浓度为75%;所述甘氨酸溶液的质量百分浓度为1.5%。
84.(3)三维多孔胶原支架的矿化:将得到的三维多孔胶原支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑
1mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
85.实施例5
86.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
87.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为10min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干2h。
88.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为1.25%,乙醇溶液的体积比浓度为85%;所述甘氨酸溶液的质量百分浓度为0.5%。
89.其中,平行排列cgf纤维的制备方法,具体步骤如下:
90.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
91.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入0.5mg/ml的i型胶原溶液,混匀后注入到50μm光刻板平行模具中,室温静置1h,即得到平行排列的cgf纤维。cgf与i型胶原溶液混合体积比为2:1;光刻板模具平行槽沟宽/间隔参数为50μm/50μm,深度为50μm。
92.其中,三维多孔imc支架的制备方法,具体步骤如下:
93.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇12000对i型鼠尾胶原原溶液进行浓缩,使其浓度达4.0mg/ml;透析袋(4000分子量)将置于中性透析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析24h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
94.(2)三维多孔imc支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为1.25%,乙醇溶液的体积比浓度为85%;所述甘氨酸溶液的质量百分浓度为0.5%。
95.(3)三维多孔imc支架的矿化:将得到的三维多孔支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷
酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25
96.mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑197.mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
98.实施例6
99.制备仿牙周有序双层结构支架材料的方法,具体步骤如下:
100.(1)将平行排列浓缩生长因子(cgf)纤维压印到三维多孔纤维内矿化胶原(imc)支架表面,液氮速冻后冻干,即得到双层支架中间体。平行排列cgf支架压印到三维多孔imc支架表面时间为5min;液氮速冻时间为3min;于
‑
100℃,0.12
‑
0.45mbar条件下冻干3h。
101.(2)将双层支架中间体置于含有1
‑
乙基(3
‑
二甲基氨丙基)碳化二亚胺盐酸盐(edc)的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维仿牙周有序双层结构支架材料(cgf/imc)。edc占整个溶液的质量百分比为1.25%,乙醇溶液的体积比浓度为85%;所述甘氨酸溶液的质量百分浓度为0.5%。
102.其中,平行排列cgf纤维的制备方法,具体步骤如下:
103.(1)cgf的提取:抽取8ml大鼠心脏动脉血到白色无菌真空离心管后,立刻用浓缩生长因子专用离心机离心。离心后,上层为清亮液体,下层为红细胞层。弃掉上层约2ml液体后,剩余上层清亮液体和下层上方3mm液体,即得到cgf。
104.(2)微压印技术法制备平行排列的cgf纤维:将得到的cgf混匀后,加入1mg/ml的i型胶原溶液,混匀后注入到100μm光刻板平行模具中,室温静置45min,即得到平行排列的cgf纤维。cgf与i型胶原溶液混合体积比为3:1;光刻板模具平行槽沟宽/间隔参数为100μm/100μm,深度为100μm。
105.其中,三维多孔imc支架的制备方法,具体步骤如下:
106.(1)胶原自组装:采用热动力学控制的自下而上自组装模式,利用聚乙二醇12000对i型鼠尾胶原原溶液进行浓缩,使其浓度达4.0mg/ml;透析袋(4000分子量)将置于中性透析液中,浓缩后的胶原溶液倒入透析袋中,将载有透析袋的容器置入37℃摇床中,透析24h后,即得到自组装胶原,透析液为30mm na2hpo4、10mm kh2po4、200mm kcl水溶液,其ph为7。
107.(2)三维多孔胶原支架的合成:将步骤(1)得到的自组装胶原离心、混匀得到悬浮液,注入模具中,
‑
20~
‑
40℃冷冻24h,于
‑
100℃,0.12
‑
0.45mbar冻干机真空干燥,得到三维海绵状的胶原支架;再在含有edc的乙醇水溶液中交联3h,再用甘氨酸溶液与双蒸水交替冲洗,冻干,即得到三维多孔支架。edc占整个溶液的质量百分比为1.25%,乙醇溶液的体积比浓度为85%;所述甘氨酸溶液的质量百分浓度为0.5%。
108.(3)三维多孔胶原支架的矿化:将得到的三维多孔胶原支架浸入到矿化液中矿化处理,含钙磷离子的矿化材料中加入聚丙烯酸形成纳米羟基磷灰石,在热动力学控制条件下逐渐进入胶原内部,并实现在纤维内部的有序排列,即得到三维多孔的imc支架。矿化液包含磷酸盐和i型白色硅酸盐水门汀,其中磷酸盐包括:136.9mm nacl、2.7mm的kcl、8.3mm的na2hpo4、1.25mm的k2hpo4·
3h2o、3.08mm的na3n、溶剂为水(ph为7.4),硅酸盐水门汀在矿化液中含量为0.001
‑
10g,聚丙烯酸在矿化液中浓度为0.2mm
‑
1mm,矿化液的体积为1
‑
100ml,矿化时间为5
‑
7天。
109.实施例7
110.为了验证本发明中仿牙周有序双层结构支架材料的微观结构和机械性能成功模拟了天然牙周软硬组织,通过扫描电镜、共聚焦显微镜、透射电镜和原子力显微镜实验来观察实施例1制备得到的仿牙周有序双层结构支架材料中上层平行排列浓缩生长因子(cgf)纤维与下层三维多孔纤维内矿化胶原(imc)支架。
111.进行以下处理:
112.1.扫描电镜观察仿牙周有序双层结构支架材料的微观形貌:将支架材料经梯度酒精脱水(50%-100%),冻干,喷金后,在15kv电压下使用扫描电镜观察支架材料的上层、下层和侧面的微观形貌。
113.结果显示:仿牙周有序双层结构支架材料的上层cgf具有与天然牙周膜结构类似的平行有序排列的纤维结构,纤维宽度约为50μm,纤维间隔约为50μm;下层imc具有与天然牙槽骨结构类似的均匀多孔结构,孔径为80
‑
200μm;上层平行排列cgf与下层三维多孔imc间机械牢固结合,见图2a。
114.2.共聚焦显微镜观察仿牙周有序双层结构支架材料的微观形貌:在上层平行排列cgf制备过程中加入量子点,在微压印前下层三维多孔imc进行col
‑
1免疫荧光染色,在共聚焦显微镜下观察支架材料的上下层和侧面的微观形貌。
115.结果显示:仿牙周有序双层结构支架材料的上层cgf呈现平行有序排列结构,纤维宽度约为50μm,纤维间隔约为50μm;下层imc呈现均匀多孔结构;上层平行排列cgf与下层三维多孔imc间机械牢固结合,结合界面厚约150μm,见图2b。
116.3.透射电镜观察仿牙周有序双层结构支架材料的纳米结构:将支架材料的上层和下层经梯度酒精脱水(50%-100%),树脂渗透,包埋聚合后,使用超薄切片的方法切厚为50
‑
70nm厚度的薄片,置于醋酸双氧铀和枸橼酸铅染液中染色,1%naoh溶液洗一次,水洗三次后,干燥后使用透射电镜观察上层和下层胶原纤维的排列和分布情况。
117.结果显示:仿牙周有序双层结构支架材料的上层cgf的纤维平行排列,纤维直径约60.6
‑
99.3nm;下层imc中纳米羟基磷灰石在纤维内形成约67nm的骨样周期性横纹结构,纤维直径约96.4
‑
144.0nm,见图2c。
118.4.原子力显微镜观察仿牙周有序双层结构支架材料的纳米结构和杨氏模量:将支架材料分层制备到玻璃片上,使用原子力显微镜观察上层和下层的纳米结构和杨氏模量。
119.结果显示;仿牙周有序双层结构支架材料上层平行排列cgf的纤维平行排列,其杨氏模量为38.04
‑
47.20mpa,接近天然牙周膜(约68.9mpa);下层三维多孔imc的纤维成束状排列,其杨氏模量为1248.17
‑
1569.83mpa,接近天然牙槽骨(约2000mpa),见图2d。
120.实施例8
121.为了检测本发明中仿牙周有序双层结构支架材料的生长因子微环境,采用免疫荧光染色和酶联免疫吸附实验来检测实施例1制备得到的仿牙周有序双层结构支架材料中生长因子tgf
‑
β1和vegf的表达和缓释情况。
122.进行以下处理:
123.1.免疫荧光染色观察仿牙周有序双层结构支架材料中生长因子的表达情况:将支架材料固定于4%多聚甲醛0.5h后,pbs溶液洗3次,5%牛血清白蛋白封闭1h,进行tgf
‑
β1和vegf免疫荧光染色。
124.结果显示:仿牙周有序双层结构支架材料的上层平行排列浓缩生长因子(cgf)和界面处高表达生长因子tgf
‑
β1和vegf,下层三维多孔纤维内矿化胶原(imc)几乎不表达生长因子tgf
‑
β1和vegf,见图3a。
125.2.酶联免疫吸附实验观察仿牙周有序双层结构支架材料中生长因子的缓释情况:将支架材料浸泡在2ml培养基中,置于37℃摇床,在1天、3天、5天、7天、9天和14天时收集上清液存于
‑
80℃,并更换等量新鲜培养基,收集的上清液采用酶联免疫吸附实验进行定量分析。
126.结果显示:仿牙周有序双层结构支架材料中生长因子tgf
‑
β1和vegf在体外可持续缓慢释放至14天,释放量累计增高,见图3b。
127.实施例9
128.为了验证实施例1制备得到的仿牙周有序双层结构支架材料的生物相容性。
129.进行以下处理:
130.预先将支架材料紫外线消毒2h,置于48孔板中,加入无血清培养基,置于37℃孵箱中,放置2h后,加入1
×
104个牙周膜干细胞于材料上,更换10%胎牛血清的α
‑
mem培养基,分别于1天、3天和5天时,去除孔板内培养基,用pbs清洗3次,将cck
‑
8检测试剂与α
‑
mem培养基1:10混合后加入到孔板内,37℃孵育1h后,将液体移至96孔板,用酶标仪在450nm处读出吸光度值。
131.结果显示:培养到第5天时,仿牙周有序双层结构支架材料促进牙周膜干细胞增殖超过3倍,具有良好的生物相容性,见图4。
132.实施例10
133.为了验证实施例1制备得到的仿牙周有序双层结构支架材料的微观结构、机械性能和生长因子微环境影响牙周膜干细胞的细胞形态以及多向分化能力。
134.进行以下处理:
135.为了观察仿牙周有序双层结构支架材料的上层平行排列浓缩生长因子(cgf)和下层三维多孔纤维内矿化胶原(imc)对干细胞的生物效应,首先将实施例1制备得到的仿牙周有序双层结构支架材料的上层cgf和下层mc分开为单层支架,紫外线消毒2h后,置于孔板中,加入无血清培养基,置于37℃孵箱中,放置2h后,加入牙周膜干细胞于材料上,更换10%胎牛血清的α
‑
mem培养基。
136.1.培养1天后弃去培养基,无菌pbs轻柔清洗2次后,加入4%多聚甲醛溶液固定0.5h,进行f
‑
acin免疫荧光细胞染色;
137.结果显示:牙周膜干细胞在上层cgf中平行排列伸展,见图5a;牙周膜干细胞在下层imc中均匀交错排列伸展,见图5b。
138.2.牙周膜干细胞在上层cgf中成纤维诱导培养7天后,采用realtime pcr检测成纤维相关基因(postn和elastin)的表达情况,采用western blotting检测成纤维相关蛋白(postn)的表达情况;牙周膜干细胞在下层imc中成骨诱导培养14天后,采用realtime pcr检测成骨相关基因(runx2和opn)的表达情况,成骨诱导培养7天后,采用western blotting检测成骨相关蛋白(sp7和alp)的表达情况;
139.结果显示:牙周膜干细胞在上层cgf中成纤维相关基因(postn和elastin)和蛋白(postn)表达均明显上调,见图5c;牙周膜干细胞在下层imc中成骨相关基因(runx2和opn)
和蛋白(sp7和alp)表达均明显上调,见图5d。
140.实施例11
141.为了验证实施例1制备得到的仿牙周有序双层结构支架材料可以再生修复缺损牙周组织的结构和功能。
142.进行以下处理:
143.构建大鼠牙周开窗缺损模型,去除大鼠下颌右侧第一磨牙颊侧牙槽骨、牙周膜和根面牙骨质,缺损大小约为5mm长、4mm高、1mm深,分为空白对照组(blank组):不植入任何支架材料;单纯cgf组(cgf组):植入浓缩生长因子(cgf组);阳性对照组(cgf
‑
dbbm组):植入cgf与脱蛋白牛骨矿物质(dbbm)直接混合支架材料;实验组(cgf/imc组):植入实施例1制备得到仿牙周有序双层结构支架材料cgf/imc,各组均在缺损周围覆盖bio
‑
gide膜,主要流程见图6a。
144.在手术第8周后,取右侧下颌骨,使用10%中性福尔马林固定,micro
‑
ct扫描,之后脱水、包埋、切片,分别进行苏木精
‑
伊红染色(he)、马松染色(masson)和免疫组化染色。
145.结果显示:手术第8周后,blank组未见任何新生牙周组织;cgf组可见少量新生牙周膜和牙槽骨样结构,但大部分为无序纤维结构;cgf
‑
dbbm组可见少量新生牙周膜和牙槽骨样结构,但新生牙周组织结构不连续,缺损区域多为未降解的支架材料;cgf/imc组新生牙槽骨密度与天然牙槽骨密度一致,可见连续完整的新生牙周膜、牙槽骨和牙骨质,新生牙周膜胶原纤维较成熟,并有丰富的新生血管,其再生修复效果可与天然牙周组织相媲美,见图6b;手术第8周后,cgf/imc组再生区域的成骨相关标志物bmp2和ocn高表达、成纤维相关标志物col
‑
1高表达、成血管相关标志物vegfr
‑
1高表达,见图6c。
146.实施例12
147.为了验证实施例1制备得到的仿牙周有序双层结构支架材料在体内具有良好的生物相容性,具备异位形成牙周软硬组织样结构的能力。
148.进行以下处理:
149.预先将支架材料紫外线消毒2h后,置于孔板中,加入无血清培养基,将支架材料移植入裸鼠背部皮下,经过8周后,取出移植的支架材料,使用无菌pbs冲洗干净后,使用10%中性福尔马林固定,之后脱水、包埋、切片。
150.1.对8周后的组织切片进行masson染色和扫描电镜观察;
151.结果显示:8周后,仿牙周有序双层结构支架材料改建形成骨岛样骨组织结构和牙周膜样胶原纤维结构,见图7a。
152.2.对8周后的组织切片进行免疫组化染色;
153.结果显示:8周后,仿牙周有序双层结构支架材料中干细胞相关标志物cd146和stro
‑
1高表达,成骨相关标志物bmp2高表达,成纤维相关标志物col
‑
1高表达,成血管相关标志物vegfr
‑
1高表达,表明本发明中仿牙周有序双层结构支架材料可募集自体干细胞,并成功诱导自体干细胞多向分化,见图7b。
154.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。