1.本发明属于生物医学检测技术领域,具体涉及百日咳杆菌的实时荧光核酸恒温扩增检测试剂盒及其专用引物和探针,特别涉及特异性靶标捕获技术和实时荧光核酸恒温扩增检测技术(simultaneous amplification and test,sat)结合的百日咳杆菌(bordetella pertussis,bp)的实时荧光核酸恒温扩增检测中使用的引物、探针及相关试剂盒。
背景技术:
2.百日咳主要是由百日咳杆菌引起的一种严重急性呼吸道传染病,百日咳杆菌的检测不仅对识别病原体有意义,还对可能由病原体污染的环境,例如河水、污水、物体表面附着物等,以及饮用水、食品等样本中致病菌的检测有意义。
3.目前百日咳杆菌主要依靠鼻咽拭子的pcr检测以及血清百日咳毒素igg检测,其中pcr检测的产物为dna,不易降解,容易污染环境,且人工检测重复性欠佳,也增加了接触感染的风险。
4.实时荧光核酸恒温扩增检测技术(simultaneous amplification and testing,简称sat)是一种直接快速检测rna的方法,与检测dna的实时荧光pcr相比,不同之处在于:前者检测体系多了一个逆转录反应的步骤,核酸扩增在一个温度下进行(42℃),因此无需热循环。然而,sat技术在不同种类病原体的检测中应用所面临的问题各不相同,需要具体分析病原体的特性进行专门设计。
5.申请人之前专利文献cn111378724a涉及一种rna放大检测方法,实施例中公开了该方法在检测百日咳杆菌的应用,其公开的方法需要在其检测体系中引入用于识别待测ran的探针a(其3’端为与待测rna特异性结合的序列,5’端为第一引物序列),并在第一引物序列中引入一段与待测rna非同源的序列作为共同引物,检测灵敏度可以达到100copies/反应,但仍不能满足更高检测灵敏度的要求。
技术实现要素:
6.针对现有技术中存在的问题的一个或多个,本发明提供一种百日咳杆菌的实时荧光核酸恒温扩增检测试剂盒,其包括:
7.(1)核酸提取液:其包含含有特异性捕获探针的固相支持物和第一引物,其中所述捕获探针用于捕获检测序列,所述第一引物用于与靶标序列特异性结合;
8.(2)检测液a:其包含第二引物,所述第二引物与所述第一引物配合,用于扩增靶标序列;
9.(3)检测液b:其包含第一引物和靶标检测探针,其中所述靶标检测探针与所述靶标的扩增产物rna拷贝特异性结合;
10.(4)sat酶液:其包含至少一种rna聚合酶和m-mlv反转录酶;
11.其中所述第一引物的核苷酸序列如seq id no:3所示,所述第二引物的核苷酸序列如seq id no:4所示,所述靶标检测探针的核苷酸序列如seq id no:5所示。
12.上述特异性捕获探针的核苷酸序列如seq id no:2所示。
13.上述试剂盒还包括:
14.(5)洗涤液:其含有nacl和sds;和/或
15.(6)矿物油;和/或
16.(7)阳性对照:含有百日咳杆菌核酸的体系;和/或
17.(8)阴性对照:不含有百日咳杆菌核酸的体系。
18.上述试剂盒中,所述核酸提取液的组分为:250~800mm hepes,4~10%十二烷基硫酸锂,1~50μμ所述的特异性捕获探针,50~500mg/l磁珠,25~150pmol/ml所述的第一引物;所述检测液a的组分为:10-50mm tris,5-40mm kcl,10-40mm mgcl2,1-20mm ntp,0.1-10mm dntps,1-10%pvp40,250~750pmol/ml所述的第二引物;所述检测液b的组分为:10-50mm tris,5-40mm kcl,10-40mm mgcl2,1-20mm ntp,0.1-10mm dntps,1-10%pvp40,143~857pmol/ml所述的第一引物,143~857pmol/ml所述的靶标检测探针;所述sat酶液的组分为:16000~160000u/ml的m-mlv反转录酶、8000~80000u/ml的rna聚合酶、2~10mm hepes ph7.5、10~100mm n-acetyl-l-cysteine、0.04~0.4mm zinc acetate、10~100mm trehalose、40~200mm tris-hcl ph 8.0、40~200mm kcl、0.01~0.5mm edta、0.1~1%(v/v)triton x-100和20~50%(v/v)glycerol。
19.上述试剂盒中,所述洗涤液的组分为:5~50mm hepes、50~500mm nacl、0.5~1.5%sds、1-10mm edta;所述阳性对照为体外转录百日咳杆菌ptxa基因的稀释物。
20.本发明另一方面提供一种百日咳杆菌实时荧光核酸恒温扩增检测的引物和探针组合,用于上述的试剂盒中,其包括:
21.核苷酸序列如seq id no:3所示的第一引物、核苷酸序列如seq id no:4所示的第二引物和核苷酸序列如seq id no:5所示的靶标检测探针。
22.上述引物和探针组合还包括核苷酸序列如seq id no:2所示的特异性捕获探针。
23.本发明再一方面还提供一种检测百日咳杆菌核酸的非疾病诊断方法,其包括以下步骤:
24.1)向试样中加入核酸提取液进行核酸提取,获得分析检测样品;
25.2)向所述分析检测样品中加入检测液a进行第一步反应,获得第一步反应液;
26.3)向所述第一步反应液中加入sat酶液进行第二步反应,获得第二步反应液;
27.4)向所述第二步反应液中加入检测液b进行第三步反应,同时进行实时荧光检测,获得实时荧光检测的dt值;
28.5)根据步骤4)获得的实时荧光检测的dt值进行结果判定;
29.若dt≤35,则试样中含有百日咳杆菌核酸;若dt>35,则试样中不含有百日咳杆菌核酸。
30.上述方法中,步骤2)中所述第一步反应的条件为40℃~45℃保温3~15min;步骤3)中所述sat酶液使用前事先预热,预热温度为41~43℃;步骤3)中所述第二步反应的条件为41℃~43℃反应3-15min;步骤4)中所述第三步反应的条件为41℃~43℃反应30-50min。
31.上述试样来源包括河水、污水、物体表面附着物、饮用水、食品、气溶胶。
32.基于以上技术方案提供的百日咳杆菌的实时荧光核酸恒温扩增检测试剂盒中包括核酸提取液、检测液a、检测液b和sat酶液等,其中在核酸提取液中可包含用于结合检测序列的特异性捕获探针和用于与靶标序列特异性结合的第一引物,在检测液a中可含有第二引物,在检测液b中可含有第一引物、靶标检测探针等,sat酶液则含有反应过程中所需要的rna聚合酶和反转录酶等。本发明根据百日咳杆菌ptxa基因优化设计获得更适合于百日咳杆菌核酸检测的引物和探针,并在使用过程中通过分步添加上述反应液分步反应,可以避免不同引物、探针之间的相互干扰,体系反应较为简单,可以实现对百日咳杆菌的高灵敏度、高特异性检测。本发明除用于医学领域的百日咳杆菌检测,还可以用于对非医学诊断用样本,例如河水、污水、物体表面附着物等环境样本、以及饮用水、食品等样本中百日咳杆菌的检测,适合大范围推广使用。
33.与现有的检测方法相比,本发明具有以下优点:
34.(1)本发明试剂盒中引物和探针组根据百日咳杆菌ptxa基因进行优化设计获得,其不同于申请人之前专利文献cn111378724a需要在引物中引入和待检测样品rna非同源的共同引物序列,而是直接根据百日咳杆菌ptxa基因优化设计获得更加适合于百日咳杆菌核酸检测的引物探针组,在检测过程中通过分步添加不同的组分进而实现更高的灵敏度检测。实施例结果表明,本发明提供的试剂盒和方法对百日咳杆菌检测的灵敏度可达10copies/反应,高于申请人之前专利文献cn111378724a中检测百日咳杆菌(100copies/反应)的一个数量级,因此本发明提供的试剂盒和方法能够满足更高灵敏度的要求。
35.(2)本发明采用实时荧光核酸恒温扩增检测技术(simultaneous amplification and testing,简称sat)对百日咳杆菌进行检测,避免了现有技术(例如rt-pcr)中提取rna的加热、离心等操作,简化实验步骤和反应体系,易于实现自动化,对检测灵敏度有了较大提高,且减少了操作人员感染的风险。
36.(3)本发明将核酸的扩增与检测在同一封闭体系中同步进行,整个过程没有温度的升降及循环,因而所需时间大大缩短,同时降低了对所用pcr仪的设计和生产成本。
37.(4)本发明扩增产物为rna,rna在自然界中极易降解,相对pcr扩增dna而言,污染易控,交叉影响小,不会引起样本交叉污染和环境污染。
附图说明
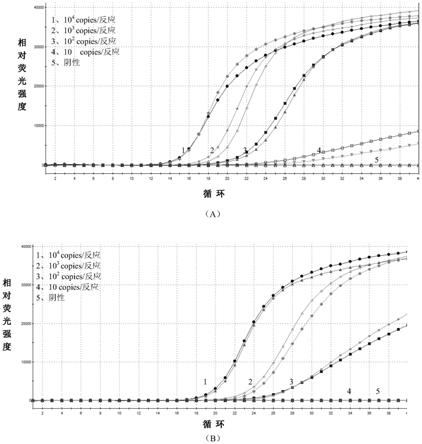
38.图1为实施例1中组1(a幅)和组2(b幅)引物和探针对系列浓度的百日咳杆菌阳性标准品的扩增曲线;
39.图2为对百日咳临床样本进行检测的扩增曲线。
具体实施方式
40.针对现有技术中存在的百日咳杆菌检测方法的缺陷,本发明利用核酸恒温同步放大检测的方法检测百日咳杆菌,并提供了用于百日咳杆菌检测的核酸恒温同步放大检测试剂盒及其专用引物和探针以及检测方法。
41.以下结合具体实施例和附图详细说明本发明的内容。
42.在下文中,仅简单地描述了某些示例性实施例。正如本领域技术人员可认识到的那样,在不脱离本发明的精神或范围的情况下,可通过各种不同方式修改所描述的实施例。
因此,附图和描述被认为本质上是示例性的而非限制性的。
43.下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecular cloning:a laboratory manual》sambrook,j.,russell,david w.,molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
44.实施例中描述到的各种生物材料的取得途径仅是提供一种试验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
45.本发明提及的所有引物、荧光探针和体外转录rna产物用已有技术合成。
46.实施例1:用于实时荧光核酸恒温扩增检测百日咳杆菌的ptxa基因的专用引物和探针的设计
47.本发明人根据genbank数据库已公开的百日咳杆菌核酸序列,选择确定百日咳杆菌ptxa基因上其中一段高度保守且与其他相似病原体有较大差异的序列作为检测序列(对应dna的核苷酸序列如seq id no:1所示),按照引物和探针设计原则进行引物和探针设计,以对百日咳杆菌进行实时荧光核酸恒温扩增检测。
48.该实施例共设计了多组引物和探针,其中选择以下两组引物和探针(组1和组2)对百日咳杆菌阳性对照(以下详述)和阴性对照(不含有百日咳杆菌核酸的体系,例如去离子水)进行检测验证,从而筛选出特异性、灵敏度和重复性均较好的引物和探针组,用于检测百日咳杆菌。
49.组1:
50.特异性捕获探针:
51.ggtgatgccgttgtgatagacccgcgtttaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa(seq id no:2);
52.第一引物:
53.aatttaatacgactcactatagggagagacgatcgacgctacggaccttcgcg(seq id no:3);
54.第二引物:tcgctacgtcagccagcagactcg(seq id no:4);
55.靶标检测探针:cgaccuaucccaaccccuacacacggaggucg(seq id no:5),5’端用fam荧光标记,3’端用dabcyl荧光标记;
56.其中在ptxa基因检测序列中第一引物和第二引物的扩增区域作为ptxa基因靶标序列,靶标检测探针与该靶标序列的扩增产物rna拷贝特异性结合;
57.组2:
58.特异性捕获探针-1,同组1中特异性捕获探针(seq id no:2);
59.第一引物-1:aatttaatacgactcactatagggagagctatgcgcaccaatgtgcc(seq id no:6);
60.第二引物-1:acgaccacggagtattccaacgct(seq id no:7);
61.靶标检测探针-1:ccaggccagcagacucgcgccugg(seq id no:8),其5’端用fam荧光标记,3’端用dabcyl荧光标记。
62.该实施例中阳性对照的制备方式包括以下步骤:
63.(1)用化学合成法合成一段百日咳杆菌ptxa基因的保守性片段(seq id no:1),构建到含有t7启动子序列的常用质粒载体上;
64.(2)用商品化t7启动子体外转录试剂盒(sigma)转录出rna片段,纯化后,通过紫外计算rna拷贝数,作为阳性对照。
65.利用上述两组引物和探针(组1和组2)分别对通过阴性对照系列稀释阳性对照获得的阳性标准品(浓度分别为104copies/反应、103copies/反应、102copies/反应、10copies/反应)和阴性对照进行实时荧光核酸恒温扩增检测(具体检测方法如以下实施例3所述)。结果如图1所示,其中a幅为组1的引物和探针的实时荧光核酸恒温扩增检测曲线,b幅为组2的引物和探针的实时荧光核酸恒温扩增检测曲线,可见组1的引物和探针的检测灵敏度可达10copies/反应,而组2的引物和探针的检测灵敏度只达到102copies/反应,因此组1的引物和探针的检测灵敏度显著高于组2的引物和探针的检测灵敏度,选择组1所示的引物和探针用于以下实施例中对百日咳杆菌进行实时荧光核酸恒温扩增检测。
66.实施例2:百日咳杆菌ptxa基因的实时荧光核酸恒温扩增检测试剂盒
67.该实施例提供的用于百日咳杆菌核酸检测的试剂盒是基于rna核酸恒温同步放大检测原理检测百日咳杆菌ptxa基因的试剂盒,具体包括以下组分:
68.(1)病毒核酸提取液:用于提取和纯化样本中的百日咳杆菌核酸,其包含250~800mm hepes、4~10%十二烷基硫酸锂(lls)、1~50μμ的特异性捕获探针(seq id no:2)、50~500mg/l磁珠、25~150pmol/ml的第一引物(seq id no:3);
69.(2)检测液a:其包含10-50mm tris、5-40mm kcl、10-40mm mgcl2、1-20mm ntp、0.1-10mm dntps、1-10%pvp40、250~750pmol/ml的第二引物(seq id no:4);
70.(3)检测液b:其包含10-50mm tris、5-40mm kcl、10-40mm mgcl2、1-20mm ntp、0.1-10mm dntps、1-10%pvp40、143~857pmol/ml的第一引物(seq id no:3)、143~857pmol/ml的靶标检测探针(seq id no:5);
71.(4)sat酶液:其主要含16000~160000u/ml的m-mlv反转录酶和8000~80000u/ml的rna聚合酶(例如t7 rna聚合酶),具体含16000~160000u/ml的m-mlv反转录酶、8000~80000u/ml的rna聚合酶、2~10mm hepes ph7.5、10~100mm n-acetyl-l-cysteine(n-乙酰基-l-半胱氨酸)、0.04~0.4mm zinc acetate(乙酸锌)、10~100mm trehalose(海藻糖)、40~200mm tris-hcl ph 8.0、40~200mm kcl、0.01~0.5mm edta、0.1~1%(v/v)triton x-100和20~50%(v/v)glycerol(甘油)。
72.为了方便检测,该实施例提供的试剂盒还包含以下组分:
73.(5)洗涤液:用于磁珠水相清洗,其配方为hepes 5~50mm、nacl 50~500mm、1%sds、edta 1-10mm;
74.(6)矿物油:用于磁珠有机相清洗的矿物油;
75.(7)阳性对照;可以为体外转录百日咳杆菌ptxa基因(1
×
106copies/ml)的稀释物(实施例1中制备);
76.(8)阴性对照:不含百日咳杆菌核酸的体系,例如去离子水或样本保存液(其含有高浓度去垢剂和生理盐水)。
77.实施例3:实时荧光核酸恒温扩增检测百日咳杆菌ptxa基因的方法
78.该实施例方法基于rna恒温同步放大检测原理检测百日咳杆菌的ptxa基因,其利
用上述实施例2提供的试剂盒对从受试者获取的口咽拭子/痰液样本中是否含有百日咳杆菌核酸进行检测,具体操作步骤为:
79.3.1、样品准备
80.分别取250μl百日咳杆菌阳性对照(实施例1所述)、250μl阴性对照和250μl待测样本(口咽拭子样本/痰液样本)分别置于样品处理管中备用;
81.3.2、核酸提取
82.(1)在各样品处理管中加入100μl~800μl病毒核酸提取液(hepes 500mm、lls 8%、特异性捕获探针(seq id no:2)15μμ、磁珠150mg/l、第一引物(seq id no:3)浓度为100pmol/ml),混匀,60℃保温10分钟,室温放置5~10分钟;
83.(2)将样品处理管置于磁珠分离装置上,静置2~5分钟。待磁珠吸附于管壁后,保持样品处理管于磁珠分离装置上,吸弃液体,保留磁珠。加入1ml洗涤液(hepes 25mm、nacl150mm、1%sds、edta2.5mm)振荡均匀后静置2~5分钟,弃液体,保留磁珠,然后加入800μl洗涤液和150μl矿物油,振荡均匀后静置2~5分钟,弃液体,保留磁珠;
84.(3)将样品处理管移离磁珠分离装置,管中为磁珠-核酸复合物,备用。
85.3.3、sat扩增检测
86.(1)向样品处理管中各加入40μl检测液a(tris 15mm、mgcl
2 15mm、dntp 2.5mm、ntp 3mm、pvp40 1%、kcl 10mm、第二引物(seq id no:4)浓度为500pmol/ml)振荡重悬磁珠;
87.(2)取振荡混匀的上述40μl反应检测液a加至洁净微量反应管,向每个反应管中加入50μl矿物油,42℃5-10min。向微量反应管中加入25μlsat酶液(事先42℃条件下预热,含有m-mlv反转录酶60000u/ml、t7 rna聚合酶40000u/ml、10mm hepes ph7.5、15mm n-acetyl-l-cysteine(n-乙酰-l-半胱氨酸)、0.15mm zinc acetate(乙酸锌)、20mm trehalose(海藻糖)、100mm tris-hcl ph 8.0、80mm kcl、0.25mm edta、0.5%(v/v)triton x-100和30%(v/v)glycerol(丙三醇)),42℃5-10min;
88.(3)向微量反应管中加入35μl的检测液b(tris15mm、mgcl
2 15mm、dntp 2.5mm、ntp 3mm、pvp40 1%、kcl 10mm、第一引物(seq id no:3)浓度为429pmol/ml,靶标检测探针(seq id no:5)浓度为429pmol/ml),将反应管快速转至恒温荧光检测仪器,42℃反应40分钟,设定每1分钟检测一次荧光,共检测40次;荧光素通道选择fam通道。
89.3.4、结果判定
90.根据sat扩增结果得到的曲线,设定阀值线,读取dt值,判定结果。
91.阈值设定:以阈值线刚好超过正常阴性对照扩增曲线的最高点。dt表示样本曲线与阈值线交点对应的横坐标读数。结果判定标准为:
92.fam通道dt≤35,则样本为阳性,即样本中含有百日咳杆菌核酸;
93.fam通道dt>35,则样本为阴性,即样本中不含有百日咳杆菌核酸。
94.利用上述方法分别对10份百日咳口咽拭子样本(生理盐水基质)和10份百日咳痰液样本进行实时荧光核酸恒温扩增检测。结果如图2和下表1所示,可见20例临床样本检测结果均为阳性。
95.表1:10份百日咳口咽拭子样本和10份百日咳痰液样本的实时荧光核酸恒温扩增检测结果
[0096] ct值 ct值拭子样本124.4痰液样本124.3拭子样本217.2痰液样本218.6拭子样本324.9痰液样本321.5拭子样本421痰液样本421.7拭子样本524.3痰液样本521.7拭子样本623.9痰液样本629.1拭子样本725.8痰液样本719拭子样本822.6痰液样本827.4拭子样本923.3痰液样本928.4拭子样本1021.6痰液样本1029
[0097]
参照本实施例,同样可以对其他临床诊断样本(如鼻拭子、肺泡关系液、血液、粪便等)进行检测,还可以对非临床诊断样本,例如河水、污水、物体表面附着物、气溶胶等环境样本,以及饮用水、食品等样本中百日咳杆菌进行检测,均表现出较高的检测灵敏度。
[0098]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

