治疗人免疫缺陷病毒的治疗组合物
1.本技术为国际申请pct/us2016/060989进入中国国家阶段的中国专利申请(申请号为201680065167.3,申请日为2016年11月8日,发明名称为“治疗人免疫缺陷病毒的治疗组合物”)的分案申请。
技术领域
2.提供了适用于治疗病毒感染例如hiv的药物制剂,特别是包含式i化合物、恩曲他滨和替诺福韦艾拉酚胺的固体口服剂型。
背景技术:
3.人免疫缺陷病毒1型(hiv
‑
1)感染是具有重大公共卫生意义的威胁生命和严重的疾病,全世界约有3500万人受到感染(联合国艾滋病规划署(unaids))。全球报告:联合国艾滋病规划署2013年全球艾滋病流行报告)。治疗hiv
‑
1感染的护理标准使用联合抗逆转录病毒疗法(art)将病毒复制抑制到低于可检测的限度,增加cd4细胞计数并停止疾病进展。
4.还需要药物来服务治疗选择有限的人群(例如儿童、妇女和老年人)。在某些情况下,这些人群可能难以维持治疗,因为一旦将它们配制成多药物组合物后的药丸负担(每天服用的药丸数量,以及药丸的不同组合)或药丸本身尺寸。例如,目前没有针对非常年幼的儿童(例如,年龄小于12岁)每天一次施用(即qd)的固定剂量组合。
5.抗逆转录病毒疗法的目标是在hiv感染患者中实现病毒抑制。美国卫生与公众服务部公布的治疗指南规定,实现病毒抑制需要使用联合疗法,即至少两种或更多种药物类别的几种药物。另外,当患者需要其他医疗病症的治疗(例如二甲双胍,利福平,hcv抗病毒剂,激素避孕药等)时,关于治疗hiv感染患者的决定是复杂的。由于护理标准要求使用多种不同的药物来抑制hiv,以及治疗患者可能正在经历的其他病症,所以药物相互作用的可能性是选择药物治疗方案的标准。因此,需要使药物
‑
药物相互作用(例如,影响转运蛋白(例如oct
‑
2)或激活受体(例如pxr)的那些)的可能性降低的抗逆转录病毒疗法。
技术实现要素:
6.本文中的所有组合物和口服剂型包含式i化合物,(2r,5s,13ar)
‑8‑
羟基
‑
7,9
‑
二氧代
‑
n
‑
(2,4,6
‑
三氟苄基)
‑
2,3,4,5,7,9,13,13a
‑
八氢
‑
2,5
‑
亚甲基吡啶并[1',2':4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑
10
‑
甲酰胺,具有以下结构:
[0007][0008]
或其药学上可接受的盐。
[0009]
在某些实施方案中,式i化合物的药学上可接受的盐是式ii化合物,(2r,5s,
13ar)
‑
7,9
‑
二氧代
‑
10
‑
((2,4,6
‑
三氟苄基)氨基甲酰基)
‑
2,3,4,5,7,9,13,13a
‑
八氢
‑
2,5
‑
亚甲基吡啶并[1',2':4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑8‑
钠盐,其具有以下结构:
[0010][0011]
发明人成功地配制了含有式i化合物、替诺福韦艾拉酚胺和恩曲他滨的口服剂型。该口服剂型适用于医药,特别是用于治疗病毒感染如hiv。
[0012]
在一个方面,提供了包含式i化合物或其药学上可接受的盐、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的固体口服剂型。在某些实施方案中,剂型包含50mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨。例如,在某些实施方案中,剂型包含50mg作为其药学上可接受的盐的式i化合物、25mg作为其药学上可接受的盐的替诺福韦艾拉酚胺和200mg恩曲他滨。在某些实施方案中,剂型包含52mg式ii化合物、28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨。
[0013]
另一方面,提供了包含75mg作为其药学上可接受的盐的式i化合物、25mg作为其药学上可接受的盐的替诺福韦艾拉酚胺和200mg恩曲他滨的固体口服剂型。在某些实施方案中,提供了包含75mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨的固体口服剂型。在某些实施方案中,提供了包含78mg式ii化合物、28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨的固体口服剂型。
[0014]
发明人已经发现,可以配制药学上可接受的(即药理学有效的和物理上可接受的)固体口服剂型,同时减少获得可接受的药代动力学特征所必需的赋形剂的总量。因此,在一个方面,提供了固体口服剂型,其包含50mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨或其药学上可接受的盐,其中剂型具有小于850mg(例如小于800mg或小于730mg或小于700mg)的总重量。
[0015]
另一方面,提供了固体口服剂型,其包含75mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨或其药学上可接受的盐,其中所述剂型具有小于850mg(例如小于800mg或小于700mg)的总重量。
[0016]
另一方面,提供了包含50mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨或其药学上可接受的盐的包衣片剂。
[0017]
另一方面,提供了包含75mg式i化合物或其药学上可接受的盐、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨或其药学上可接受的盐的包衣片剂。
[0018]
另一方面,提供了包含52mg式ii化合物、28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨的片剂。
[0019]
另一方面,提供了包含78mg式ii化合物、28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨的片剂。
[0020]
另一方面,提供了片剂,其包含(a)50mg式i化合物或其药学上可接受的盐、(b)25mg替诺福韦艾拉酚胺或其药学上可接受的盐和(c)200mg恩曲他滨或其药学上可接受的
盐,其中(a)和(b)是分离的,并且其中片剂具有小于约1.5g(例如小于约1g)的总重量。通常,(a)和(b)存在于多层片剂中的不同层中。
[0021]
另一方面,提供了片剂,其包含(a)75mg式i化合物或其药学上可接受的盐、(b)25mg替诺福韦艾拉酚胺或其药学上可接受的盐和(c)200mg恩曲他滨或其药学上可接受的盐,其中(a)和(b)是分离的,并且其中片剂具有小于约1.5g(例如,小于约1g)的总重量。通常,(a)和(b)存在于多层片剂中的不同层中。
[0022]
另一方面,提供了片剂,其包含6.5
‑
11.0%w/w的式i化合物或其药学上可接受的盐、3.0
‑
4.5%w/w替诺福韦艾拉酚胺或其药学上可接受的盐和25
‑
30%w/w恩曲他滨或其药学上可接受的盐,其中重量百分数表示整个片剂的比例。在一些实施方案中,(a)式i化合物作为式ii化合物存在和/或(b)替诺福韦艾拉酚胺作为替诺福韦艾拉酚胺半富马酸盐存在。
[0023]
另一方面,提供了片剂,其包含9.5
‑
11.5%w/w的式i化合物或其药学上可接受的盐、2.5
‑
4.5%w/w的替诺福韦艾拉酚胺或其药学上可接受的盐和26
‑
33%w/w恩曲他滨或其药学上可接受的盐,其中重量百分数表示整个片剂的比例。在一些实施方案中,(a)式i化合物作为式ii化合物存在和/或(b)替诺福韦艾拉酚胺作为替诺福韦艾拉酚胺半富马酸盐存在。
[0024]
发明人已经发现使用固定剂量组合可以有助于实现适当的药代动力学参数和/或足够的片剂稳定性。另外,使用多层片剂作为特定类型的固定剂量组合还可以提供药代动力学和/或稳定性益处。因此,另一方面,提供了固定剂量组合片剂,其包含(a)式i化合物或其药学上可接受的盐,(b)替诺福韦艾拉酚胺或其药学上可接受的盐,和(c)恩曲他滨或其药学上可接受的盐。另外,提供了包含(a)式i化合物或其药学上可接受的盐、(b)替诺福韦艾拉酚胺或其药学上可接受的盐和(c)恩曲他滨或其药学上可接受的盐的多层片剂。
[0025]
另一方面,提供了试剂盒,其包含(a)包含式i化合物或其药学上可接受的盐、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的片剂,和(b)干燥剂(例如硅胶)。
[0026]
还提供了生产固体口服剂型如片剂的方法,如下面更详细讨论的。
[0027]
另外,提供了用于治疗患者的方法,其也在下面更详细地讨论。
附图说明
[0028]
图1显示使用禁食模拟肠液作为溶出介质对制剂f1、f2和f3进行研究以评估78mg式ii化合物作为单一药剂与双层相比的溶出结果。
[0029]
图2显示使用进食模拟肠液作为溶出介质对制剂f1和f2进行研究以评估78mg式ii化合物作为单一药剂与双层相比的溶出的结果。
[0030]
图3显示对制剂f1、f2、f4、f5和f6进行研究以评估78mg式ii化合物在含有各种赋形剂的片剂中的溶出的结果。
[0031]
图4显示使用禁食模拟肠液作为溶出介质对制剂f7和f8进行研究以评估52mg式ii化合物作为单一药剂与双层相比的溶出的结果。
[0032]
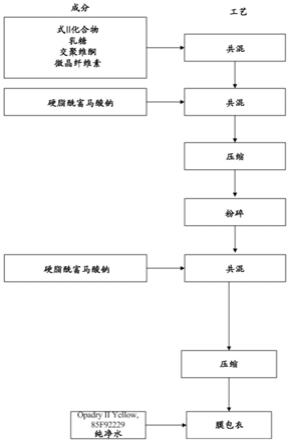
图5是说明制备含有式ii化合物的片剂制剂的流程图。
[0033]
图6是说明制备含有式ii化合物、恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的片剂制剂的流程图。
具体实施方式
[0034]
典型地,本文公开的口服剂型包含三种活性药物成分:式i化合物(或其药学上可接受的盐)、替诺福韦艾拉酚胺(或其药学上可接受的盐)和恩曲他滨(或其药学上可接受的盐)。
[0035]
(2r,5s,13ar)
‑8‑
羟基
‑
7,9
‑
二氧代
‑
n
‑
(2,4,6
‑
三氟苄基)
‑
2,3,4,5,7,9,13,13a
‑
八氢
‑
2,5
‑
亚甲基吡啶并[1
′
,2
′
:4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑
10
‑
甲酰胺
[0036]
(2r,5s,13ar)
‑8‑
羟基
‑
7,9
‑
二氧代
‑
n
‑
(2,4,6
‑
三氟苄基)
‑
2,3,4,5,7,9,13,13a
‑
八氢
‑
2,5
‑
亚甲基吡啶并[1
′
,2
′
:4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑
10
‑
甲酰胺(式i)是有效的hiv整合酶抑制剂,具有针对野生型hiv
‑
1的体外活性。它具有下式(参见wo2014/100323):
[0037][0038]
其iupac名称是(2r,5s,13ar)
‑8‑
羟基
‑
7,9
‑
二氧代
‑
n
‑
(2,4,6
‑
三氟苄基)
‑
2,3,4,5,7,9,13,13a
‑
八氢
‑
2,5
‑
亚甲基吡啶并[1
′
,2
′
:4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑
10
‑
甲酰胺。其cas名是2,5
‑
亚甲基吡啶并[1
′
,2
′
:4,5]吡嗪并[2,1
‑
b][1,3]氧氮杂环庚烷
‑
10
‑
甲酰胺,2,3,4,5,7,9,13,13a
‑
八氢
‑8‑
羟基
‑
7,9
‑
二氧代
‑
n
‑
[(2,4,6
‑
三氟苯基)甲基]
‑
(2r,5s,13ar)。式i化合物是pka为8.6的弱酸。式i化合物游离酸的水溶性是ph依赖性的,随着ph增加溶解度增加,最大值在ph 10.5。式i化合物的化学稳定性也是ph依赖性的,在ph 4时具有最大的稳定性。式i化合物被认为是具有低溶解度和高渗透性的bcs 2类化合物。
[0039]
本文公开的固体口服剂型包含式i化合物,通常为药学上可接受的盐形式。式i化合物可以以溶剂化或非溶剂化形式存在于口服剂型中,并且对“式i”的提及包含这两种形式。典型地,式i化合物为具有下式的式ii化合物的形式:
[0040][0041]
在某些具体实施方案中,提供了含有50mg式i化合物(例如,作为约52mg的式ii化合物)的固体口服剂型。
[0042]
在某些具体实施方案中,提供了含有75mg式i化合物(例如,作为约78mg式ii化合物)的固体口服剂型。
[0043]
如本文所用,并且在没有特别提及式i化合物(例如,式ii)的特定药学上可接受的盐和/或溶剂化物的情况下,任何剂量,无论以例如mg或以重量%表达,应视为是指式i化合物游离酸的量,即式i的量:
[0044][0045]
因此,例如,提及“50mg式i化合物或其药学上可接受的盐和/或溶剂化物”是指提供了与50mg式i化合物游离酸相同量的式i化合物的式i化合物或其药学上可接受的盐和/或溶剂化物的量。
[0046]
因此,例如,提及“75mg式i化合物或其药学上可接受的盐和/或溶剂化物”是指提供了与75mg式i化合物游离酸相同量的式i化合物的式i化合物或其药学上可接受的盐和/或溶剂化物的量。
[0047]
替诺福韦艾拉酚胺
[0048]
替诺福韦艾拉酚胺(taf)是具有下式的核苷酸逆转录酶抑制剂(参见wo02/08241a2):
[0049][0050]
其iupac名称是(s)
‑2‑
(((s)
‑
(((r)
‑1‑
(6
‑
氨基
‑
9h
‑
嘌呤
‑9‑
基)丙
‑2‑
基)氧基)(苯氧基)磷酰基)氨基)丙酸异丙酯。它也被称为{9
‑
[(r)
‑2‑
[[(s)
‑
[[(s)
‑1‑
(异丙氧基羰基)乙基]氨基]苯氧基氧膦基]甲氧基]丙基]腺嘌呤}。替诺福韦艾拉酚胺是弱碱,pka为3.9。其溶解度随着ph降低而增加,在约ph 3时具有最大溶解度。替诺福韦艾拉酚胺被认为是bcs 3类化合物,具有高平衡溶解度和较低的表观渗透性。
[0051]
本文公开的固体口服剂型包含替诺福韦艾拉酚胺,通常为药学上可接受的盐形式。替诺福韦艾拉酚胺可以以溶剂化或非溶剂化形式的口服剂型存在,并且提及“替诺福韦艾拉酚胺”包含这两种形式。具体而言,替诺福韦艾拉酚胺可以与富马酸盐结合,如单富马酸盐或半富马酸盐。典型地,替诺福韦艾拉酚胺是具有下式的替诺福韦艾拉酚胺半富马酸盐的形式(参见wo2013/025788a1):
[0052][0053]
如本文所用,并且在没有具体提及替诺福韦艾拉酚胺的特定药学上可接受的盐
和/或溶剂化物的情况下,任何剂量,无论以mg或以重量百分比表达,应视为是指替诺福韦艾拉酚胺的量,即下式的量:
[0054][0055]
因此,例如,提及“25mg替诺福韦艾拉酚胺或其药学上可接受的盐和/或溶剂化物”是指提供与25mg替诺福韦艾拉酚酰胺游离碱相同量的替诺福韦艾拉酚胺的替诺福韦艾拉酚胺或其药学上可接受的盐和/或溶剂合物的量。
[0056]
本文提供的固体口服剂型中的替诺福韦艾拉酚胺的量通常为10mg至30mg,例如20mg至30mg,更通常24mg至28mg。在某些具体实施方案中,提供了含有25mg替诺福韦艾拉酚胺(例如作为约28mg替诺福韦艾拉酚胺半富马酸盐)的固体口服剂型。
[0057]
恩曲他滨
[0058]
恩曲他滨(ftc)是具有下式的核苷逆转录酶抑制剂:
[0059][0060]
其iupac名称是4
‑
氨基
‑5‑
氟
‑1‑
[(2r,5s)
‑2‑
(羟甲基)
‑
1,3
‑
氧硫杂环戊烷
‑5‑
基]
‑
1,2
‑
二氢嘧啶
‑2‑
酮。它也被称为5
‑
氟
‑1‑
[(2r,5s)
‑2‑
(羟甲基)
‑
1,3
‑
氧硫杂环戊烷
‑5‑
基]胞嘧啶。目前它被批准为以下的部分:(恩曲他滨200mg),(恩曲他滨200mg,替诺福韦酯富马酸盐300mg),(恩曲他滨200mg,依法韦仑600mg,替诺福韦酯富马酸盐300mg)和(恩曲他滨200mg,可比司他150mg,替诺福韦酯富马酸盐300mg,埃替拉韦150mg)和(利匹韦林25mg,恩曲他滨200mg,替诺福韦酯富马酸盐300mg)。
[0061]
恩曲他滨是一种游离碱,表现出2.65的pka。酸性条件下溶解度增强。它被认为是bcs 1类化合物,具有高溶解度和高渗透性。
[0062]
本文公开的固体口服剂型包含恩曲他滨,任选地作为药学上可接受的盐的形式。恩曲他滨可以以溶剂化或非溶剂化形式存在于口服剂型中,并且对“恩曲他滨”的提及包含这两种形式。通常,恩曲他滨以游离碱的形式存在。
[0063]
如本文所用,并且在没有特别提及恩曲他滨的特定药学上可接受的盐和/或溶剂化物的情况下,无论以何种剂量表达,例如,mg或以重量%,应视为是指恩曲他滨的量,即下式的量:
[0064][0065]
因此,例如,提及“200mg恩曲他滨或其药学上可接受的盐和/或溶剂合物”是指提供与200mg恩曲他滨游离碱相同量的恩曲他滨的恩曲他滨或其药学上可接受的盐和/或溶剂化物的量。
[0066]
本文提供的固体口服剂型中恩曲他滨的量通常在180mg和220mg之间,例如190mg和210mg之间,更通常在195mg和205mg之间。在某些具体实施方案中,提供了含有200mg恩曲他滨的固体口服剂型。
[0067]
固体口服剂型
[0068]
发明人成功地将式i化合物、恩曲他滨和替诺福韦艾拉酚胺制成药物学上有效且物理上可接受的单一稳定剂型。本文公开的固体口服剂型旨在用于人类个体的药物用途。因此,除了治疗有效性之外,它们必须具有适合于口服人类施用的尺寸和重量(例如它们应该具有小于约1.5g例如小于约1.0g的总重量)。
[0069]
在某些实施方案中,提供了三种活性成分制成总重量小于约1.0g的固体口服剂型,例如小于约800mg,或甚至小于约750mg,或甚至小于700mg。考虑到(相当于600mg阿巴卡韦的硫酸阿巴卡韦,相当于50mg多洛格韦的多洛格韦钠和300mg拉米夫定)的总重量大于约1000mg,基于每片中活性成分的重量(由于制备药学上可接受的片剂所需的赋形剂的量),这是有利的。提供了相对小的剂型(特别是片剂)代表了临床优势,因为与对于患者而言吞咽更加难以忍受的更大剂量形式相比,可以预期会增加患者便利性并因此提高依从性。在具体实施方案中,本文公开的固体口服剂型具有700
‑
750mg的总重量。在某些实施方案中,本文公开的固体口服剂型具有700
‑
725mg或约700mg的总重量。在具体实施方案中,本文公开的固体口服剂型具有约50mg至约750mg、约100mg至约750mg,约200mg至约750mg或约250mg至约750mg的总重量。目前公开的剂型可以包含小于600mg的赋形剂,例如小于500mg的赋形剂或小于450mg的赋形剂。例如,本文公开的固体口服剂型可包含300mg至600mg的赋形剂,或350mg至500mg的赋形剂,或400mg至500mg的赋形剂。最典型地,本文公开的固体口服剂型包含425mg至450mg的赋形剂。在这样的实施方案中,剂型包含作为活性成分的(a)50mg式i化合物或其药学上可接受的盐,(b)25mg替诺福韦艾拉酚胺或其药学上可接受的盐,和(c)200mg恩曲他滨或其药学上可接受的盐。在某些实施方案中,剂型包含作为活性成分的(a)52mg式ii化合物,(b)28mg替诺福韦艾拉酚胺半富马酸盐和(c)200mg恩曲他滨。在一些实施方案中,剂型包含作为活性成分的(a)75mg式i化合物或其药学上可接受的盐,(b)25mg替诺福韦艾拉酚胺或其药学上可接受的盐,和(c)200mg恩曲他滨或其药学上可接受的盐。在某些实施方案中,剂型包含作为活性成分的(a)78mg式ii化合物,(b)28mg替诺福韦艾拉酚胺半富马酸盐和(c)200mg恩曲他滨。
[0070]
本文公开的固体口服剂型通常将呈固定剂量组合片剂的形式。这是因为发明人发现使用固定剂量组合片剂可有助于优化活性成分的药代动力学性质,特别是式i化合物或其药学上可接受的盐的总暴露量,如由曲线下的面积(auc)和c
max
所测量的。在具体实施方
案中,本文公开的固体口服剂型呈多层片剂的形式。在某些实施方案中,固定剂量组合(例如多层片剂)的使用可影响剂型内的一种或多种活性成分的溶出曲线,因此可能影响剂型的体内药代动力学。具体而言,已经观察到式i(例如,如式ii)化合物的溶出依赖于片剂是否与替诺福韦艾拉酚胺和恩曲他滨处于固定剂量组合制剂中和/或片剂是否是单层或多层片剂而变化。还观察到,多层片剂制剂中存在某些赋形剂(或不存在其他赋形剂)会影响剂型中一种或多种活性成分的溶出曲线。提供了具有特定药代动力学参数的片剂,例如药代动力学参数是本公开提供的特定优点。
[0071]
在一个实施方案中,提供了包含(a)式i化合物或其药学上可接受的盐、(b)替诺福韦艾拉酚胺或其药学上可接受的盐和(c)恩曲他滨或其药学上可接受的盐的多层片剂。通常,每个层包含(a)、(b)和(c)中的至少一个。例如,在某些实施方案中,片剂包含第一层,其包含(a)式i化合物或其药学上可接受的盐,和第二层,其包含(b)替诺福韦艾拉酚胺或其药学上可接受的盐,并且还包含c)恩曲他滨或其药学上可接受的盐。在这样的实施方案中,通常第一层基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐,和/或第二层基本上不含式i化合物或其药学上可接受的盐。在一个实施方案中,第一层基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐(例如第一层含有小于1重量%的替诺福韦艾拉酚胺或其药学上可接受的盐),并且第二层基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐)。
[0072]
一个具体的实施方案提供了片剂,其中第一层包含式i化合物或其药学上可接受的盐(例如式ii)并且基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐(例如,第一层含有少于1重量%的替诺福韦艾拉酚胺或其药学上可接受的盐),并且第二层包含替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐,并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐)。在一个具体的实施方案中,提供了片剂,其中第一层包含52mg的式ii化合物并且基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐(例如,第一层含有小于1重量%的替诺福韦艾拉酚胺或其药学上可接受的盐),并且第二层包含28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨并且基本上不含式i化合物或其药学上可接受的盐(例如,第二层含有小于1重量%的式i化合物或其药学上可接受的盐),其中第一层的总重量小于约400mg,如约325mg,第二层的总重量小于约450mg,如约380mg。在一个实施方案中,含有替诺福韦艾拉酚胺或其药学上可接受的盐的层不含乳糖和/或淀粉。在一个实施方案中,含有式i化合物或其药学上可接受的盐的层不含乳糖、交聚维酮和/或硬脂酰富马酸钠。
[0073]
一个具体的实施方案提供了片剂,其中第一层包含式i化合物或其药学上可接受的盐(例如式ii)并且基本上不含恩曲他滨或其药学上可接受的盐(例如,第一层含有少于1重量%的恩曲他滨或其药学上可接受的盐),(b)第二层包含替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐,并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐)。在一个具体的实施方案中,提供了片剂,其中(a)第一层包含52mg的式ii化合物并且基本上不含恩曲他滨或其药学上可接受的盐(例如,第一层含有小于1重量%的恩曲他滨或其药学上可接受的盐),和(b)第二层包含28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨并且基本上不含式i化合物或其药学上可接受的盐(例如,第二层含有小于1重量%的式i化合物或其药学
上可接受的盐),其中第一层的总重量小于约400mg,如约325mg,第二层的总重量为小于约450mg,如约380mg。在一个实施方案中,含有恩曲他滨或其药学上可接受的盐的层不含乳糖和/或淀粉。在一个实施方案中,含有式i化合物或其药学上可接受的盐的层不含乳糖、交聚维酮和/或硬脂酰富马酸钠。
[0074]
一个具体实施方案提供了片剂,其中第一层包含式i化合物或其药学上可接受的盐(例如式ii)并且基本上不含替诺福韦艾拉酚胺和恩曲他滨或其药学上可接受的盐(例如第一层含有少于1重量%的替诺福韦艾拉酚胺和恩曲他滨或其药学上可接受的盐),和(b)第二层包含替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐,并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐)。在一个具体实施方案中,提供了片剂,其中(a)第一层包含52mg式ii化合物并且基本上不含替诺福韦艾拉酚胺和恩曲他滨或其药学上可接受的盐(例如,第一层含有少于1重量%的替诺福韦艾拉酚胺和恩曲他滨或其药学上可接受的盐),和(b)第二层包含28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐),其中第一层的总重量小于约400mg,例如约325mg,并且第二层的总重量小于约450mg,例如约380mg。在一个实施方案中,含有替诺福韦艾拉酚胺和恩曲他滨或其药学上可接受的盐的层不含乳糖和/或淀粉。在一个实施方案中,含有式i化合物或其药学上可接受的盐的层不含乳糖、交聚维酮和/或硬脂酰富马酸钠。
[0075]
在一个具体实施方案中,提供了片剂,其中(a)第一层包含78mg式ii化合物且基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐(例如第一层含有小于1重量%的替诺福韦艾拉酚胺或其药学上可接受的盐),(b)第二层包含28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨,并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有小于1重量%的式i化合物或其药学上可接受的盐),其中第一层的总重量小于约400mg,例如约355mg,第二层的总重量为小于约450mg,例如约380mg。在一个实施方案中,含有替诺福韦艾拉酚胺或其药学上可接受的盐的层不含乳糖和/或淀粉。
[0076]
除非另外指明,否则术语“第一层”、“第二层”、“第三层”等不指定本文公开的多层片剂的特定顺序或取向。相反,这些术语用于区分组合物的各个部分并指定每个部分或隔室的特征或组分。例如,在一个实施方案中,提供了片剂,其中第一层包含52mg式ii化合物且基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐(例如,第一层含有小于1重量%的替诺福韦艾拉酚胺或其药学上可接受的盐),(b)第二层包含28mg替诺福韦艾拉酚胺半富马酸盐和200mg恩曲他滨,并且基本上不含式i化合物或其药学上可接受的盐(例如第二层含有少于1重量%的式i化合物或其药学上可接受的盐),其中第一层具有小于约400mg的总重量,例如约325mg,并且第二层具有小于约450mg的总重量,例如约380mg。第一层可以首先合成或者可以其次合成。第一层可以在底部或可以在顶部或可以在一侧。术语“第一层”不限于顺序和取向。
[0077]
本文公开的片剂通常是即释片剂。在一个实施方案中,提供了片剂,使用usp装置ii在333ml的禁食状态模拟肠液(ph 6.5)中在37℃和100rpm的桨速下测量,其在约20分钟内释放至少50%的式i化合物或其药学上可接受的盐。在某些实施方案中,使用usp装置ii在333ml的50mm禁食状态模拟肠液中在37℃和100rpm的桨速下测量,本文公开的片剂在20
分钟内释放至少60%的式i化合物或其药学上可接受的盐。在一些实施方案中,提供了使用usp装置ii在333ml的50mm禁食状态模拟肠液中在37℃和100rpm的桨速下测量在60分钟内释放至少70%的式i化合物的片剂。
[0078]
本文公开的片剂通常具有在14
‑
20kp范围内的硬度,并且在某些具体的实施方案中,具有17kp的硬度。根据usp<1217>(使用例如tbh 220,erweka gmbh,heusenstamm德国硬度测试仪)操作,通过驱动砧座(anvil)以恒定加载速率压缩片剂直至其断裂,可以方便地评估硬度。
[0079]
本文公开的片剂通常具有<1重量%的易碎性。易碎性可根据usp<1216>进行评估。
[0080]
本文提供的片剂的芯可以具有14
‑
20kp之间的硬度和<1重量%的易碎性。
[0081]
片剂通常将包含一种或多种赋形剂。赋形剂应该与制剂的其他成分相容并且对其接受者在生理上无害。合适的赋形剂的实例对于片剂制剂领域的技术人员是公知的,并且可以在例如handbook of pharmaceutical excipients(eds.rowe,sheskey&quinn),2009年第6版中找到。如本文所用,术语“赋形剂”旨在尤其是指碱化剂、增溶剂、助流剂、填充剂、粘合剂、润滑剂、稀释剂、防腐剂、表面活性剂、分散剂等。该术语还包含诸如甜味剂、调味剂、着色剂、防腐剂和包衣剂的试剂。这些组分通常以片剂内混合物的形式存在。
[0082]
增溶剂的实例包含但不限于离子型表面活性剂(包含离子型和非离子型表面活性剂),如十二烷基硫酸钠、十六烷基三甲基溴化铵、聚山梨醇酯(如聚山梨醇酯20或80)、泊洛沙姆(如泊洛沙姆188或207)和聚乙二醇。在一个具体的实施方案中,包含式i化合物或其药学上可接受的盐的片剂包含聚山梨醇酯,特别是聚山梨醇酯20。在某些具体的实施方案中,本文公开的片剂中的聚山梨醇酯20的量小于约5mg,例如小于约1mg或约0.5mg。
[0083]
润滑剂、助流剂和流动助剂的实例包含但不限于硬脂酸镁、硬脂酸钙、硬脂酸、氢化植物油、棕榈酸硬脂酸甘油酯、山嵛酸甘油酯、硬脂酰富马酸钠、胶体二氧化硅和滑石。片剂中润滑剂的量通常在约0.5
‑
5重量%之间。在某些实施方案中,片剂中润滑剂的量为约1.5重量%。在某些具体的实施方案中,本文公开的片剂包含硬脂酸镁。在某些其他的实施方案中,本文公开的片剂不包含硬脂酰富马酸钠。在某些实施方案中,片剂包含少于约10mg的硬脂酸镁或少于约7.5mg的硬脂酸镁。在某些实施方案中,片剂包含少于约9mg硬脂酸镁或少于约8.75mg硬脂酸镁。在某些实施方案中,片剂包含约5mg至约10mg硬脂酸镁或约6mg至约9mg硬脂酸镁或约7mg至约9mg硬脂酸镁或约8mg至约9mg硬脂酸镁,或约8.1mg、约8.2mg、约8.3mg、约8.4mg、约8.5mg、约8.6mg、约8.7mg、约8.8mg或约8.9mg硬脂酸镁。
[0084]
崩解剂的实例包含但不限于淀粉、纤维素、交联pvp(交聚维酮)、羟基乙酸淀粉钠、交联羧甲基纤维素钠等。在某些实施方案中,本文公开的片剂包含交联羧甲基纤维素钠。在某些其他的实施方案中,本文公开的片剂不包含交聚维酮。在某些实施方案中,片剂包含小于约50mg交联羧甲基纤维素钠或小于约25mg交联羧甲基纤维素钠。在某些实施方案中,片剂包含约30mg至约60mg交联羧甲基纤维素钠或约40mg至约60mg交联羧甲基纤维素钠或约45mg至约55mg交联羧甲基纤维素钠或约45mg、约46mg、约47mg、约48mg、约49mg、约50mg、约51mg、约52mg或约53mg或约54mg或约55mg交联羧甲基纤维素钠。
[0085]
填充剂(也称为填充剂或稀释剂)的实例包含但不限于淀粉、麦芽糖糊精、多元醇(例如乳糖)和纤维素。在某些实施方案中,本文提供的片剂可以是微晶纤维素。在某些其他的实施方案中,本文提供的片剂不含乳糖。在某些实施方案中,本文提供的片剂包含小于约
300mg的微晶纤维素,特别是小于约250mg的微晶纤维素和/或小于约225mg的微晶纤维素。在某些实施方案中,本文提供的片剂包含小于约500mg的微晶纤维素,或小于约450mg的微晶纤维素,或小于约400mg的微晶纤维素,或小于约375mg的微晶纤维素。在某些实施方案中,本文提供的片剂包含约250mg至约500mg微晶纤维素,或约300mg至约450mg微晶纤维素,或约300mg至约400mg微晶纤维素,或约325mg至约375mg微晶纤维素,或约350mg至约370mg微晶纤维素。在某些实施方案中,本文提供的片剂包含约300mg或约310mg或约320mg或约330mg或约340mg或约350mg或约360mg或约370mg或约380mg或约390mg或约400mg微晶纤维素。
[0086]
粘合剂的实例包含但不限于交联pvp、hpmc、蔗糖、淀粉等。
[0087]
在某些实施方案中,本文提供的片剂是未包衣的。在某些其他的实施方案中,本文提供的片剂是包衣的(在这种情况下它们包含包衣)。尽管可以使用未包衣的片剂,但临床环境中更常提供包衣片剂,在这种情况下可以使用常规的非肠溶包衣。膜包衣在本领域中是已知的并且可以由亲水性聚合物材料组成,但不限于多糖材料如羟丙基甲基纤维素(hpmc),甲基纤维素,羟乙基纤维素(hec),羟丙基纤维素(hpc),聚(乙烯醇
‑
共
‑
乙二醇)和其他水溶性聚合物。虽然在某些实施方案中,本文公开的实施方案的膜包衣中包含的水溶性材料包含单一聚合物材料,但在某些其他的实施方案中,其使用多于一种聚合物的混合物形成。在某些实施方案中,包衣是黄色或棕色的。合适的包衣包含但不限于聚合物膜包衣,例如包含聚乙烯醇例如ii(其包含部分水解的pva,二氧化钛,聚乙二醇3350(peg)和滑石的那些,具有任选的着色剂如氧化铁(例如氧化铁红或氧化铁黑)或靛蓝胭脂红或氧化铁黄或fd&c黄#6)。包衣的量通常在芯重量的约2
‑
4%之间,在某些具体实施方案中,约为3%。除非特别说明,否则在剂型被包衣的情况下,应理解的是,提及片剂的重量%是指总片剂的重量%,即包括包衣。
[0088]
药代动力学
[0089]
在某些实施方案中,本文公开的药物组合物导致式i化合物或其药学上可接受的盐的全身暴露(auc
inf
,c
max
)增加。在具体的实施方案中,与式i化合物或其药学上可接受的盐的单一药剂片剂制剂相比,本文公开的多层片剂制剂导致式i化合物或其药学上可接受的盐的全身暴露增加。在某些实施方案中,与式i化合物的单一药剂片剂制剂或其药学上可接受的盐相比,多层片剂制剂导致式i化合物或其药学上可接受的盐的全身暴露至少约20%的增加。在一些实施方案中,全身暴露的增加至少约25%或至少约30%。在一些实施方案中,全身暴露的增加约30%。
[0090]
c
max
[0091]
c
max
是观察到的最大药物血浆/血清浓度。
[0092]
在具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在禁食患者中的血浆c
max
为约5300ng/ml至约8900ng/ml,例如约7100ng/ml。
[0093]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在禁食患者中的血浆c
max
为约1700ng/ml至约2800ng/
ml,例如约2300ng/ml。
[0094]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在禁食患者中的血浆c
max
为约190ng/ml至约320ng/ml,例如约250ng/ml。
[0095]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物的血浆c
max
为约4200ng/ml至约8000ng/ml,不论个体是否进食或禁食。
[0096]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在禁食患者中的血浆c
max
为约4200ng/ml至约6500ng/ml,或约4700ng/ml至约5300ng/ml,或约4700ng/ml至约5800ng/ml,或约5000ng/ml至约5500ng/ml。
[0097]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物进食患者中的血浆c
max
为约4500ng/ml至约8000ng/ml,或约4800ng/ml至约7900ng/ml,或约5300ng/ml至约6900ng/ml,或约5600ng/ml至约6600ng/ml。
[0098]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨的血浆c
max
为约1770ng/ml至约2800ng/ml,无论个体是否进食或禁食。
[0099]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在禁食患者中的血浆c
max
为约1770ng/ml至约2800ng/ml,或约2000ng/ml至约2600ng/ml,或约2000ng/ml至约2500ng/ml,或约2100ng/ml至约2400ng/ml。
[0100]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在进食患者中的血浆c
max
为约1000ng/ml至约3000ng/ml,或约1500ng/ml至约2000ng/ml,约1700ng/ml至约2200ng/ml,约1800ng/ml至约2100ng/ml。
[0101]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺的血浆c
max
为约185ng/ml至约315ng/ml,不论个体是否进食或禁食。
[0102]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在禁食患者中的血浆c
max
为约185ng/ml至约315ng/ml,或约200ng/ml至约300ng/ml,或约210ng/ml至约290ng/ml,或约220ng/ml至约275ng/ml,或约230ng/ml至约265ng/ml,或约240ng/ml至约260ng/ml。
[0103]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在进食患者中的血浆c
max
为约150ng/ml至约350ng/ml,或约185ng/ml至约300ng/m,或约210ng/ml至约280ng/ml,或约250ng/ml至约265ng/ml。
[0104]
auc
inf
[0105]
auc是指血浆/血清浓度
‑
时间曲线下的面积(外推至无限时间),以auc0‑
最终
(c
最终
/λ
z
)计算。
[0106]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在进食患者中的血浆auc
inf
为约117000h
·
ng/ml至约196000h
·
ng/ml,例如约157000h
·
ng/ml。
[0107]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在进食患者中的血浆auc
inf
为约8700h
·
ng/ml至约14500h
·
ng/ml,例如约2300h
·
ng/ml。
[0108]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在进食患者中的血浆auc
inf
为约150h
·
ng/ml至260h
·
ng/ml,例如约210h
·
ng/ml。
[0109]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物的血浆auc
inf
为约84450h
·
ng/ml至约141000h
·
ng/ml,不论个体是否进食或禁食。
[0110]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在禁食患者中的血浆auc
inf
为约84450h
·
ng/ml至约141000h
·
ng/ml,或约90000h
·
ng/ml至约135000h
·
ng/ml,或约95000h
·
ng/ml至约130000h
·
ng/ml,或约100000h
·
ng/ml至约125000h
·
ng/ml,或约110000h
·
ng/ml至约120000h
·
ng/ml。
[0111]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在进食患者中的血浆auc
inf
为约100000h
·
ng/ml至约200000ng/ml,或约112000h
·
ng/ml至约175000ng/ml,或约126000h
·
ng/ml至约155000h
·
ng/ml,或约133000h
·
ng/ml至约147000h
·
ng/ml。
[0112]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨的血浆auc
inf
为约8100h
·
ng/ml至约13600h
·
ng/ml,无论个体是否进食或禁食。
[0113]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、
200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在禁食患者中的血浆auc
inf
为约8100h
·
ng/ml至约13600h
·
ng/ml,或约8700h
·
ng/ml至约13000h
·
ng/ml,或约92000h
·
ng/ml至约12500h
·
ng/ml,或约9700h
·
ng/ml至约12000h
·
ng/ml,或约10000h
·
ng/ml至约11400h
·
ng/ml。
[0114]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在进食患者中的血浆auc
inf
为约7500h
·
ng/ml至约15000h
·
ng/ml,或约8300h
·
ng/ml至约14000h
·
ng/ml,或约9500h
·
ng/ml至约12000h
·
ng/ml,或约9900h
·
ng/ml至约11600h
·
ng/ml。
[0115]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺的血浆auc
inf
为约200h
·
ng/ml至约500h
·
ng/ml,无论个体是否进食或禁食。
[0116]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在禁食患者中的血浆auc
inf
为约200h
·
ng/ml至约265h
·
ng/ml,或约200h
·
ng/ml至约300h
·
ng/ml,或约210h
·
ng/ml至约290h
·
ng/ml,或约220h
·
ng/ml至约270h
·
ng/ml,或约230hng/ml至约265h
·
ng/ml。
[0117]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在进食患者中的血浆auc
inf
为约200h
·
ng/ml至约500h
·
ng/ml,或约230h
·
ng/ml至约400h
·
ng/ml,或约260h
·
ng/ml至约350h
·
ng/ml,或约275h
·
ng/ml至约370h
·
ng/ml。
[0118]
auc
最终
[0119]
auc
最终
是从零至最终可定量浓度的时间的血浆/血清浓度
‑
时间曲线下的面积。
[0120]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在进食患者中的血浆auc
最终
为约114000h
·
ng/ml至约190000h
·
ng/ml,例如约152000h
·
ng/ml。
[0121]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在进食患者中的血浆auc
最终
为约8600h
·
ng/ml至约14000h
·
ng/ml,例如约11000h
·
ng/ml。
[0122]
在某些具体的实施方案中,包含含有75mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在进食患者中的血浆auc
最终
为约150h
·
ng/ml至260h
·
ng/ml,例如约210h
·
ng/ml。
[0123]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的
片剂的药物组合物提供的式i化合物的血浆auc
最终
为约81700h
·
ng/ml至约140000h
·
ng/ml,无论个体是否进食或禁食。
[0124]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在禁食患者中的血浆auc
最终
为约81700h
·
ng/ml至约140000h
·
ng/ml,约87000h
·
ng/ml至约131000h
·
ng/ml,约92000h
·
ng/ml至约130000h
·
ng/ml,约98100h
·
ng/ml至约120000h
·
ng/ml,约104000h
·
ng/ml至约115000h
·
ng/ml。
[0125]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的式i化合物在进食患者中的血浆auc
最终
为约100000h
·
ng/ml至约200000ng/ml,或约108000h
·
ng/ml至约170000ng/ml,或约122000h
·
ng/ml至约150000h
·
ng/ml,或约128000h
·
ng/ml至约142000h
·
ng/ml。
[0126]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨的血浆auc
最终
为约7500h
·
ng/ml至约15000h
·
ng/ml,不论个体是否进食或禁食。
[0127]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在禁食患者中的血浆auc
最终
为约8000h
·
ng/ml至约13400h
·
ng/ml,约8500h
·
ng/ml至约12800h
·
ng/ml,约9000h
·
ng/ml至约12300h
·
ng/ml,约9500h
·
ng/ml至约11000h
·
ng/ml,约10000h
·
ng/ml至约11200h
·
ng/ml。
[0128]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的恩曲他滨在进食患者中的血浆auc
最终
为约7500h
·
ng/ml至约15000ng/ml,或约8000h
·
ng/ml至约14000h
·
ng/ml,或约9000h
·
ng/ml至约12000h
·
ng/ml,或约9700h
·
ng/ml至约11300h
·
ng/ml。
[0129]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺的血浆auc
最终
为约165h
·
ng/ml至约400
‑
ng/ml,不论个体是否进食或禁食。
[0130]
在某些具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在禁食患者中的血浆auc
最终
为约165h
·
ng/ml至约390h
·
ng/ml,约186h
·
ng/ml至约227h
·
ng/ml,约196h
·
ng/ml至约217h
·
ng/ml。
[0131]
在具体的实施方案中,包含含有50mg式i化合物或其药学上可接受的盐、200mg恩曲他滨或其药学上可接受的盐和25mg替诺福韦艾拉酚胺或其药学上可接受的盐的片剂的药物组合物提供的替诺福韦艾拉酚胺在进食患者中的血浆auc
最终
为约200h
·
ng/ml至约400h
·
ng/ml,或约230h
·
ng/ml至约390h
·
ng/ml,或约260h
·
ng/ml至约345h
·
ng/ml,或约275h
·
ng/ml至约330h
·
ng/ml。
[0132]
c
最终
[0133]
c
最终
是最后观察到的可定量的药物血浆/血清浓度。
[0134]
c
max
、c
最终
、auc
inf
和auc
最终
是标准药代动力学参数,其可以手动估计或通过使用本领域公知的建模软件如使用非隔室模型的pharsight winnonlin软件包来估计。计算这些量的一般原理是众所周知的(例如参见rowland&tozer(2010)clinical pharmacokinetics and pharmacodynamics:concepts and applications isbn 978
‑
0781750097或jambhekar&breen(2012)basic pharmacokinetics isbn978
‑
0853699804)。通常,参数将被评估为来自一组至少12(通常在24和36之间)个健康成年人的平均值(例如几何或算术平均值)。参数应按照fda、ema、mhlw或who等药品管理机构可接受的标准和做法进行测量。这些值可以基于片剂摄取后的适当间隔进行的测量,例如每小时或以越来越稀疏的取样间隔,如在摄入后1、3、5、7、9、11、13、15、20和24小时。它们可以在单剂量药物或稳态后进行评估,但通常在单剂量后进行评估。
[0135]
利用度和生物等效性领域中众所周知如何确定任何特定的片剂是否满足对等效生物利用度和药代动力学生物等效性的监管要求,例如参见:niazi(2014)生物等效性测试手册,第2版,isbn978
‑
1482226379;guidance for industry bioavailability and bioequivalence studies for orally administered drug products—general considerations fda 2003年3月;和guideline on the investigation of bioequivalence,emea 2010cpmp/ewp/qwp/1401/98rev.1/corr**。为确保统计效能,将在多个个体中进行研究以测量c
max
、auc
最终
和auc
inf
值,例如在一组至少12(通常在24和36)个健康的成年人中。
[0136]
因为确定c
max
、auc
最终
和auc
inf
值必然是破坏性的,所以这些参数将不直接针对所讨论的剂型(特别是片剂)确定,而是针对通过用相同组分相同制备工艺制备的剂型直接确定。因此可以通过特定的方法制备一批剂型(例如片剂),并且在这些片剂的样品上评估c
max
、auc
最终
和auc
inf
的90%置信区间。如果这些值满足上述80
‑
125%的要求,那么通过所讨论的制备方法制成的片剂是本发明的片剂。
[0137]
提供了固定剂量组合片剂,其包含(a)式i化合物或其药学上可接受的盐(例如,式(ii)),(b)替诺福韦艾拉酚胺或其药学上可接受的盐,和(c)恩曲他滨或其药学上可接受的盐。
[0138]
在一个实施方案中,提供了多层片剂,其包含(a)式i化合物或其药学上可接受的盐(例如,式(ii)),(b)替诺福韦艾拉酚胺或其药学上可接受的盐,和(c)恩曲他滨或其药学上可接受的盐。
[0139]
在一个实施方案中,本文公开的多层片剂包含(a)含有式i化合物或其药学上可接受的盐的第一层,(b)含有替诺福韦艾拉酚胺或其药学上可接受的盐的第二层,和(c)还包含恩曲他滨或其药学上可接受的盐。
[0140]
在本文公开的多层片剂的一个实施方案中,(a)第一层基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐,和/或(b)第二层基本上不含式i化合物或其药学上可接受的盐。
[0141]
在本文公开的多层片剂的一个实施方案中,(a)第一层基本上不含恩曲他滨或其药学上可接受的盐,和/或(b)第二层基本上不含式i化合物或药学上可接受的盐。
[0142]
在本文公开的多层片剂的一个实施方案中,(a)第一层基本上不含恩曲他滨或其药学上可接受的盐和替诺福韦艾拉酚胺或其药学上可接受的盐,和/或(b)第二层基本上不含式i化合物或其药学上可接受的盐。
[0143]
在一个实施方案中,本文公开的多层片剂包含(a)含有式i化合物或其药学上可接受的盐的第一层,(b)含有恩曲他滨或其药学上可接受的盐的第二层,和(c)还含有替诺福韦艾拉酚胺或其药学上可接受的盐。
[0144]
在本文公开的多层片剂的一个实施方案中,(a)第一层基本上不含恩曲他滨或其药学上可接受的盐,和/或(b)第二层基本上不含式i化合物或药学上可接受的盐。
[0145]
在本文公开的多层片剂的一个实施方案中,(a)第一层包含式i化合物或其药学上可接受的盐,并且基本上不含替诺福韦艾拉酚胺或其药学上可接受的盐,和(b)第二层包含替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐,并且基本上不含式i化合物或其药学上可接受的盐。
[0146]
在本文公开的多层片剂的一个实施方案中,第一层基本上不含恩曲他滨。
[0147]
在一个实施方案中,本文公开的多层片剂包含50
±
6mg式i化合物。在一个实施方案中,本文公开的多层片剂包含200
±
20mg恩曲他滨。在一个实施方案中,本文公开的多层片剂包含25
±
3mg替诺福韦艾拉酚胺。
[0148]
在一个实施方案中,本文公开的多层片剂包含75
±
6mg式i化合物。在一个实施方案中,本文公开的多层片剂包含200
±
20mg恩曲他滨。在一个实施方案中,本文公开的多层片剂包含25
±
3mg替诺福韦艾拉酚胺。
[0149]
在一个实施方案中,本文公开的多层片剂包含52
±
6mg式ii化合物。在一个实施方案中,本文公开的多层片剂包含200
±
20mg恩曲他滨。在一个实施方案中,本文公开的多层片剂包含28
±
3mg替诺福韦艾拉酚胺半富马酸盐。
[0150]
在一个实施方案中,本文公开的多层片剂包含78
±
6mg式ii化合物。在一个实施方案中,本文公开的多层片剂包含200
±
20mg恩曲他滨。在一个实施方案中,本文公开的多层片剂包含28
±
3mg替诺福韦艾拉酚胺半富马酸盐。
[0151]
在一个实施方案中,本文公开的多层片剂的第一层包含一种或多种赋形剂,例如一种或多种稀释剂、崩解剂、粘合剂或润滑剂。
[0152]
在一个实施方案中,多层片剂的第一层包含交联羧甲基纤维素钠。在一个实施方案中,多层片剂的第一层包含交联羧甲基纤维素钠、微晶纤维素和硬脂酸镁。
[0153]
在一个实施方案中,提供了片剂,其中小于约25重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中小于约20重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中小于约16重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中约5重量至约20重量%,或约10重量至约18重量%,或约14重量至约18重量%的第一层为式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中约16重量%的第一层是式i化合物或其药学上可接受的盐。
[0154]
在一个实施方案中,提供了片剂,其中第一层包含52
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约290mg。
[0155]
在一个实施方案中,提供了片剂,其中第一层包含52
±
2.8mg式ii化合物,并且其
硬脂酸镁5
±
1.5
[0172]
在一个实施方案中,多层片剂的第一层由以下组成:
[0173]
成分质量(mg)式ii化合物52
±
5.6微晶纤维素246
±
10交联羧甲基纤维素钠19
±
2.5硬脂酸镁5
±
0.75
[0174]
在一个实施方案中,多层片剂的第一层由以下组成:
[0175]
成分质量(mg)式ii化合物52
±
2.8微晶纤维素246
±
5交联羧甲基纤维素钠19
±
1.75硬脂酸镁5
±
0.5
[0176]
在一个实施方案中,多层片剂的第一层由以下组成:
[0177]
成分质量(mg)式ii化合物52.5微晶纤维素246.3交联羧甲基纤维素钠19.4硬脂酸镁4.9
[0178]
在一个实施方案中,多层片剂的第一层包含:
[0179][0180]
在一个实施方案中,多层片剂的第一层包含:
[0181][0182][0183]
在一个实施方案中,多层片剂的第一层由以下组成:
[0184][0185]
在一个实施方案中,多层片剂的第一层包含:
[0186][0187]
在一个实施方案中,提供了片剂,其中小于约30重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中小于约25重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中小于约22重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中约15重量%至约27重量%,或约17重量%至约25重量%,或约19重量%至约23重量%的第一层是式i化合物或其药学上可接受的盐。在一个实施方案中,提供了片剂,其中约21重量%的第一层是式i化合物或其药学上可接受的盐。
[0188]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约320mg。
[0189]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约330mg。
[0190]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约340mg。
[0191]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约350mg。
[0192]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约360mg。
[0193]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约370mg。
[0194]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约380mg。
[0195]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约390mg。
[0196]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约320mg并且小于约390mg。
[0197]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其
中第一层的总重量为至少约330mg并且小于约380mg。
[0198]
在一个实施方案中,提供了片剂,其中第一层包含78
±
2.8mg式ii化合物,并且其中第一层的总重量为至少约350mg并且小于约360mg。
[0199]
在一个实施方案中,多层片剂的第一层具有353
±
75mg或353
±
25mg或353
±
10mg或353mg的总重量。
[0200]
在一个实施方案中,多层片剂的第一层包含:
[0201]
成分质量(mg)式i化合物或其盐40
‑
85微晶纤维素200
‑
400交联羧甲基纤维素钠1
‑
40硬脂酸镁1
‑
10
[0202]
在一个实施方案中,多层片剂的第一层包含:
[0203]
成分质量(mg)式ii化合物30
‑
90微晶纤维素200
‑
400交联羧甲基纤维素钠1
‑
40硬脂酸镁2
‑8[0204]
在一个实施方案中,多层片剂的第一层包含:
[0205]
成分质量(mg)式ii化合物80
±
6微晶纤维素250
±
20交联羧甲基纤维素钠20
±
5硬脂酸镁5
±
1.5
[0206]
在一个实施方案中,多层片剂的第一层由以下组成:
[0207]
成分质量(mg)式ii化合物78
±
5.6微晶纤维素250
±
10交联羧甲基纤维素钠20
±
2.5硬脂酸镁5
±
0.75
[0208]
在一个实施方案中,多层片剂的第一层由以下组成:
[0209]
成分质量(mg)式ii化合物78
±
2.8微晶纤维素247
±
5交联羧甲基纤维素钠21
±
1.75硬脂酸镁5
±
0.5
[0210]
在一个实施方案中,多层片剂的第一层由以下组成:
[0211]
成分质量(mg)式ii化合物78.7
微晶纤维素247.8交联羧甲基纤维素钠21.2硬脂酸镁5.3
[0212]
在一个实施方案中,多层片剂的第一层由以下组成:
[0213][0214]
在一个实施方案中,多层片剂的第二层不包含乳糖。在一个实施方案中,多层片剂的第二层不包含淀粉。在一个实施方案中,多层片剂的第二层既不包含乳糖也不包含淀粉。
[0215]
在一个实施方案中,多层片剂的第二层包含一种或多种赋形剂,例如一种或多种稀释剂、崩解剂、粘合剂或润滑剂。
[0216]
在一个实施方案中,多层片剂的第二层包含微晶纤维素和交联羧甲基纤维素钠。
[0217]
在一个实施方案中,多层片剂的第二层包含微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。
[0218]
在一个实施方案中,多层片剂的第二层包含20
‑
40mg交联羧甲基纤维素钠。在一个实施方案中,多层片剂的第二层包含105
‑
125mg微晶纤维素。在一个实施方案中,多层片剂的第二层包含1
‑
8mg硬脂酸镁。
[0219]
在一个实施方案中,多层片剂的第二层不包含乳糖。在一个实施方案中,多层片剂的第二层不包含淀粉。在一个实施方案中,多层片剂的第二层既不包含乳糖也不包含淀粉。
[0220]
在一个实施方案中,多层片剂的第二层具有小于600mg,或小于500mg,或小于400mg,或小于380mg的总重量。在一个实施方案中,多层片剂的第二层具有377mg
±
50mg或377mg
±
25mg或377mg
±
5mg或377mg的总重量。
[0221]
在一个实施方案中,多层片剂的第二层的超过50重量%是恩曲他滨或其盐和替诺福韦艾拉酚胺或其盐。在一个实施方案中,多层片剂的第二层的超过55重量%是恩曲他滨或其盐和替诺福韦艾拉酚胺或其盐。在一个实施方案中,多层片剂的第二层的超过60重量%是恩曲他滨或其盐和替诺福韦艾拉酚胺或其盐。在一个实施方案中,多层片剂的第二层的约55重量%至约65重量%是恩曲他滨或其盐和替诺福韦艾拉酚胺或其盐。在一个实施方案中,多层片剂的第二层的超过60重量%是恩曲他滨和替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的约55重量%至约65重量%是恩曲他滨和替诺福韦
艾拉酚胺半富马酸盐。
[0222]
在一个实施方案中,多层片剂的第二层含有小于250mg的赋形剂,例如小于200mg或小于150mg。
[0223]
在一个实施方案中,多层片剂的第二层的至少50重量%是恩曲他滨。在一个实施方案中,多层片剂的第二层的至少53重量%是恩曲他滨。在一个实施方案中,多层片剂的第二层的约45重量%至约65重量%是恩曲他滨。在一个实施方案中,多层片剂的第二层的约50重量%至约60重量%是恩曲他滨。在一个实施方案中,多层片剂的第二层的约51重量%至约53重量%是恩曲他滨。
[0224]
在一个实施方案中,多层片剂的第二层的至少4重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的至少6重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的至少7重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的约5重量%至约10重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的约6重量%至约9重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的约7重量%至约8重量%是替诺福韦艾拉酚胺半富马酸盐。在一个实施方案中,多层片剂的第二层的约7重量%是替诺福韦艾拉酚胺半富马酸盐。
[0225]
在一个实施方案中,多层片剂的第二层的小于20重量%是交联羧甲基纤维素钠。在一个实施方案中,多层片剂的第二层的小于10重量%为交联羧甲基纤维素钠。在一个实施方案中,多层片剂的第二层的约5重量%至约10重量%为交联羧甲基纤维素钠。在某些实施方案中,相对于其他崩解剂例如聚乙烯吡咯烷酮(交聚维酮),第二层的约5
‑
7重量%(例如约6重量%)使用交联羧甲基纤维素钠可以提供式i化合物或其药学上可接受的盐的增强的溶出度。在某些实施方案中,相对于其它崩解剂例如聚乙烯吡咯烷酮(交聚维酮),第二层的约5
‑
10重量%使用交联羧甲基纤维素钠可以提供式i化合物或其药学上可接受的盐的增强的溶出度。
[0226]
在一个实施方案中,小于50重量%的多层片剂的第二层是微晶纤维素。在一个实施方案中,小于40重量%的多层片剂的第二层是微晶纤维素。在一个实施方案中,小于31重量%的多层片剂的第二层是微晶纤维素。
[0227]
在一个实施方案中,多层片剂的第二层的小于5重量%是硬脂酸镁。在一个实施方案中,多层片剂的第二层的小于3重量%是硬脂酸镁。在一个实施方案中,多层片剂的第二层的小于2重量%为硬脂酸镁。在一个实施方案中,多层片剂的第二层的约0.5重量%至约1.5重量%为硬脂酸镁。在某些实施方案中,相对于其他润滑剂例如硬脂酰富马酸钠,按重量第二层的约1%至约2%(例如约1.5%)使用硬脂酸镁可以提供式i化合物或其药学上可接受的盐的增强的溶出度。
[0228]
在一个实施方案中,第二层的总重量小于第一层总重量的150%。在一个实施方案中,第二层的总重量小于第一层总重量的125%。在一个实施方案中,第二层的总重量小于第一层总重量的116%。在一个实施方案中,第二层的总重量小于第一层总重量的106%。
[0229]
在一个实施方案中,多层片剂的第二层包含:
[0230]
成分质量(mg)恩曲他滨或其盐150
‑
250
替诺福韦艾拉酚胺或其盐20
‑
35微晶纤维素90
‑
130交联羧甲基纤维素钠20
‑
35硬脂酸镁1
‑7[0231]
在一个实施方案中,多层片剂的第二层包含:
[0232]
成分质量(mg)恩曲他滨170
‑
230替诺福韦艾拉酚胺半富马酸盐22
‑
32微晶纤维素100
‑
120交联羧甲基纤维素钠20
‑
35硬脂酸镁1
‑7[0233]
在一个实施方案中,多层片剂的第二层由以下组成:
[0234]
成分质量(mg)恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素113
±
9交联羧甲基纤维素钠30
±
3硬脂酸镁5.6
±
1.1
[0235]
在一个实施方案中,多层片剂的第二层由以下组成:
[0236]
成分质量(mg)恩曲他滨200
±
10替诺福韦艾拉酚胺半富马酸盐28
±
1.4微晶纤维素113
±
4交联羧甲基纤维素钠30
±
1.4硬脂酸镁5.6
±
0.5
[0237]
在一个实施方案中,多层片剂的第二层由以下组成:
[0238]
成分质量(mg)恩曲他滨200替诺福韦艾拉酚胺半富马酸盐28.1微晶纤维素113.2交联羧甲基纤维素钠30.2硬脂酸镁5.7
[0239]
在一个实施方案中,多层片剂的第二层由以下组成:
[0240]
成分质量(mg)粒间 恩曲他滨200.00替诺福韦艾拉酚胺半富马酸盐28.1微晶纤维素113.2
恩曲他滨200替诺福韦艾拉酚胺半富马酸盐28微晶纤维素115交联羧甲基纤维素钠30.2硬脂酸镁1.9粒外 硬脂酸镁1.9层总重量377
[0252]
在一个实施方案中,多层片剂的第二层包含:
[0253][0254][0255]
在一个实施方案中,多层片剂的第二层包含:
[0256]
成分质量(mg)恩曲他滨200替诺福韦艾拉酚胺半富马酸盐28微晶纤维素115交联羧甲基纤维素钠30.2硬脂酸镁3.8
[0257]
在一个实施方案中,多层片剂的第二层包含:
[0258]
成分质量(mg)粒间 恩曲他滨200替诺福韦艾拉酚胺半富马酸盐28微晶纤维素113.2交联羧甲基纤维素钠30.2硬脂酸镁2.85粒外 硬脂酸镁2.85层总重量377
[0259]
在本文公开的多层片剂制剂的一个实施方案中,第一层与第二层接触。
[0260]
在一个实施方案中,首先制备第一层,随后是第二层。也就是说,在一个实施方案中,制备第一层并将其压缩成第一层,随后制备第二层并将其与第一层一起压缩成多层片
剂。在一个实施方案中,首先制备第二层,随后是第一层。也就是说,在一个实施方案中,制备第二层并将其压缩成第二层,接着制备第一层并将其与第二层一起压缩成多层片剂。
[0261]
如本文所用,当描述本文公开的多层片剂时,术语“第一层”和“第二层”不旨在指示片剂制备的方法,特别是获得层的顺序。
[0262]
在某些实施方案中,多层片剂还包含附加层。在某些实施方案中,附加层位于第一层和第二层之间。在某些实施方案中,附加层位于第一层和/或第二层的任一侧上,使得它们是片剂的外层和/或放置在第一层和/或第二层与包衣之间。在一些实施方案中,附加层包封第一层和第二层。
[0263]
在一个实施方案中,多层片剂进一步包含介于第一层和第二层之间并将第一层和第二层分开的第三层。在一个实施方案中,多层片剂的第三层包含乳糖一水合物或微晶纤维素或其混合物。
[0264]
在一个实施方案中,多层片剂还包含膜包衣。在一个实施方案中,多层片剂还包含约14mg至约28mg的膜包衣。在一个实施方案中,多层片剂还包含约19mg至约23mg的膜包衣。在一个实施方案中,多层片剂还包含约21mg的膜包衣。在一个实施方案中,膜包衣包含聚乙烯醇、聚乙二醇、滑石、二氧化钛和氧化铁黑。在一个实施方案中,膜包衣由21
±
7mg opadry ii brown 85f165072组成。在一个实施方案中,膜包衣由21
±
7mg opadry ii yellow 85f92259组成。
[0265]
在一个实施方案中,多层片剂还包含膜包衣。在一个实施方案中,多层片剂还包含约1.9%w/w至约3.9%w/w的膜包衣。在一个实施方案中,多层片剂还包含约2.5%w/w至约3.5%w/w的膜包衣。在一个实施方案中,多层片剂还包含约3%的膜包衣。在一个实施方案中,膜包衣包含聚乙烯醇、聚乙二醇、滑石、二氧化钛、氧化铁红和氧化铁黑。在一个实施方案中,膜包衣包含36%
‑
40%聚乙烯醇、18%
‑
22%聚乙二醇、13%
‑
16%滑石、20%
‑
24%二氧化钛、2%
‑
3%氧化铁红和0.5%
‑
0.7%氧化铁黑。
[0266]
在一个实施方案中,提供了包含约6.4
‑
8.5%w/w的式ii化合物、约25
‑
32%w/w mg的恩曲他滨、约3.5
‑
4.5%w/w mg的替诺福韦艾拉酚胺半富马酸盐、约46
‑
57%w/w mg的微晶纤维素、约5.9
‑
8.5%w/w mg的交联羧甲基纤维素钠和约1.0
‑
2.0%w/w mg的硬脂酸镁的片剂。
[0267]
在一个实施方案中,提供了包含52
±
6mg式ii化合物、200
±
20mg恩曲他滨、28
±
3mg替诺福韦艾拉酚胺半富马酸盐、360
±
30mg微晶纤维素、50
±
8mg交联羧甲基纤维素钠和10.5
±
3mg硬脂酸镁的片剂,并且其中片剂的总重量为至少约685mg。
[0268]
在一个实施方案中,提供了包含52
±
6mg式ii化合物、200
±
10mg恩曲他滨、28
±
1.5mg替诺福韦艾拉酚胺半富马酸盐、360
±
15mg微晶纤维素、50
±
4mg交联羧甲基纤维素钠和10.5
±
1.5mg硬脂酸镁的片剂,并且其中片剂的总重量为至少约685mg并且小于约715mg。
[0269]
在一个实施方案中,提供了包含52
±
6mg式ii化合物、200
±
20mg恩曲他滨、28
±
3mg替诺福韦艾拉酚胺半富马酸盐、360
±
30mg微晶纤维素、50
±
8mg交联羧甲基纤维素钠和8.6
±
3mg硬脂酸镁的片剂,并且其中片剂的总重量为至少约685mg。
[0270]
在一个实施方案中,提供了包含52
±
6mg式ii化合物、200
±
10mg恩曲他滨、28
±
1.5mg替诺福韦艾拉酚胺半富马酸盐、360
±
15mg微晶纤维素、50
±
4mg交联羧甲基纤维素钠和8.6
±
1.5mg硬脂酸镁的片剂,并且其中片剂的总重量为至少约685mg并且小于约715mg。
[0271]
在一个实施方案中,片剂具有700
±
75mg或700
±
25mg或700
±
10mg或700mg的总重量。在一个实施方案中,片剂未包衣且总重量为约700
±
75mg或约700
±
25mg或约700
±
10mg或约700mg。在一个实施方案中,片剂的总重量为约720
±
75mg或约720
±
25mg或约720
±
10mg或约720mg或约721mg或约722mg或约723mg或约724mg或约725mg或约726mg或约727mg或约728mg或约729mg或约730mg。
[0272]
在一个实施方案中,提供了片剂,其包含80
±
6mg式ii化合物、200
±
20mg恩曲他滨、28
±
3mg替诺福韦艾拉酚胺半富马酸盐、360
±
30mg微晶纤维素、50
±
8mg交联羧甲基纤维素钠和11
±
3mg硬脂酸镁,并且其中片剂的总重量为至少约715mg。
[0273]
在一个实施方案中,提供了片剂,其包含78
±
2.3mg的式ii化合物、200
±
10mg的恩曲他滨、28
±
1.5mg的替诺福韦艾拉酚胺半富马酸盐、361
±
15mg的微晶纤维素、51
±
4mg的交联羧甲基纤维素钠和11
±
1.5mg硬脂酸镁,并且其中片剂的总重量为至少约715mg且小于约745mg。
[0274]
在一个实施方案中,片剂具有730
±
75mg或730
±
25mg或730
±
10mg或730mg的总重量。在一个实施方案中,片剂总重量为约750
±
75mg或约750
±
25mg或约750
±
10mg或约750mg或约751mg或约752mg或约753mg或约754mg或约755mg。
[0275]
在一个实施方案中,提供了一种片剂,其包含:
[0276]
成分质量(mg)式ii化合物52
±
6恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素360
±
30交联羧甲基纤维素钠50
±
8硬脂酸镁10.5
±3[0277]
在一个实施方案中,提供了一种片剂,其包含:
[0278]
成分质量(mg)式ii化合物52.5
±
3恩曲他滨200
±
10替诺福韦艾拉酚胺半富马酸盐28.1
±
1.5微晶纤维素360
±
15交联羧甲基纤维素钠50
±
4硬脂酸镁10.5
±
1.5
[0279]
在一个实施方案中,提供了一种片剂,其包含:
[0280][0281]
在一个实施方案中,提供了一种片剂,其包含:
[0282][0283]
在一个实施方案中,提供了一种片剂,其包含:
[0284]
成分质量(mg)式i化合物或其药学上可接受的盐52
±
6恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素360
±
30交联羧甲基纤维素钠50
±
8硬脂酸镁8.6
±3[0285]
在一个实施方案中,提供了一种片剂,其包含:
[0286]
[0287][0288]
在一个实施方案中,提供了一种片剂,其包含:
[0289]
成分质量(mg)式ii化合物52.5
±
3恩曲他滨200
±
10替诺福韦艾拉酚胺半富马酸盐28.1
±
1.5微晶纤维素360
±
15交联羧甲基纤维素钠50
±
4硬脂酸镁8.6
±
1.5
[0290]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0291]
成分质量(mg)式ii化合物50
±
6微晶纤维素250
±
20交联羧甲基纤维素钠20
±
5硬脂酸镁5
±
1.5
[0292]
和由以下组成的第二层:
[0293]
成分质量(mg)恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素113
±
9交联羧甲基纤维素钠30
±
3硬脂酸镁5.6
±
1.1
[0294]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0295]
成分质量(mg)式i化合物或其药学上可接受的盐50
±
6微晶纤维素250
±
20交联羧甲基纤维素钠20
±
5硬脂酸镁5
±
1.5
[0296]
以及第二层,其包含:
[0297]
交联羧甲基纤维素钠19
±
1.75硬脂酸镁5
±
0.5
[0309]
和由以下组成的第二层:
[0310]
成分质量(mg)恩曲他滨200
±
10替诺福韦艾拉酚胺半富马酸盐28
±
1.4微晶纤维素113
±
4交联羧甲基纤维素钠30
±
1.4硬脂酸镁5.6
±
0.5
[0311]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0312][0313]
和第二层,其包含:
[0314][0315]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0316][0317][0318]
和第二层,其包含:
[0319]
成分质量(mg)恩曲他滨200
±
10
替诺福韦艾拉酚胺半富马酸盐28
±
1.4微晶纤维素113
±
4交联羧甲基纤维素钠30
±
1.4硬脂酸镁4
±
0.5
[0320]
在一个实施方案中,提供了一种片剂,其包含:
[0321]
成分质量(mg)式ii化合物80
±
6恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素360
±
30交联羧甲基纤维素钠50
±
8硬脂酸镁11
±3[0322]
在一个实施方案中,提供了一种片剂,其包含:
[0323]
成分质量(mg)式ii化合物78.6
±
2.3恩曲他滨200
±
10替诺福韦艾拉酚胺半富马酸盐28.1
±
1.5微晶纤维素361
±
15交联羧甲基纤维素钠51
±
4硬脂酸镁11
±
1.5
[0324]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0325]
成分质量(mg)式ii化合物80
±
6微晶纤维素250
±
20交联羧甲基纤维素钠20
±
5硬脂酸镁5
±
1.5
[0326]
和由以下组成的第二层:
[0327]
成分质量(mg)恩曲他滨200
±
20替诺福韦艾拉酚胺半富马酸盐28
±
3微晶纤维素113
±
9交联羧甲基纤维素钠30
±
3硬脂酸镁5.6
±
1.1
[0328]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0329]
成分质量(mg)式ii化合物78
±
2.8微晶纤维素247
±
5交联羧甲基纤维素钠21
±
1.75
微晶纤维素12
‑
20交联羧甲基纤维素钠3
‑
6硬脂酸镁0.3
‑
0.7
[0342]
以及任选的膜包衣。
[0343]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0344][0345][0346]
和第二层,其包含:
[0347][0348]
以及任选的膜包衣。
[0349]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0350] %w/w(片剂中)式ii化合物6
‑
9微晶纤维素30
‑
40交联羧甲基纤维素钠2.4
‑
3.2硬脂酸镁0.6
‑
0.8
[0351]
和第二层,其包含:
[0352] %w/w(片剂中)恩曲他滨24
‑
33替诺福韦艾拉酚胺半富马酸盐3.4
‑
4.6微晶纤维素14
‑
19交联羧甲基纤维素钠3.6
‑
4.9硬脂酸镁0.6
‑
0.8
[0353]
以及任选的膜包衣。
[0354]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0355][0356][0357]
和第二层,其包含:
[0358] %w/w(片剂中)恩曲他滨26
‑
30替诺福韦艾拉酚胺半富马酸盐3.7
‑
4.6微晶纤维素15
‑
17交联羧甲基纤维素钠4.0
‑
4.5硬脂酸镁0.5
‑
0.6
[0359]
以及任选的膜包衣。
[0360]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0361] %w/w(片剂中)式ii化合物7
‑
8微晶纤维素33
‑
36交联羧甲基纤维素钠2.7
‑
2.8硬脂酸镁0.7
‑
0.8
[0362]
和第二层,其包含:
[0363] %w/w(片剂中)恩曲他滨27
‑
29替诺福韦艾拉酚胺半富马酸盐3.8
‑
4.2微晶纤维素16
‑
17交联羧甲基纤维素钠4.1
‑
4.4硬脂酸镁0.5
‑
0.8
[0364]
以及任选的膜包衣。
[0365]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0366][0367]
[0368]
和第二层,其包含:
[0369] %w/w(片剂中)恩曲他滨28.6替诺福韦艾拉酚胺半富马酸盐4.0微晶纤维素16.4交联羧甲基纤维素钠4.3硬脂酸镁0.5
[0370]
以及任选的膜包衣。
[0371]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0372] %w/w(片剂中)式ii化合物7.5微晶纤维素35.2交联羧甲基纤维素钠2.8硬脂酸镁0.7
[0373]
和第二层,其包含:
[0374] %w/w(片剂中)恩曲他滨28.6替诺福韦艾拉酚胺半富马酸盐4.0微晶纤维素16.2交联羧甲基纤维素钠4.3硬脂酸镁0.8
[0375]
以及任选的膜包衣。
[0376]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0377][0378][0379]
和第二层,其包含:
[0380][0381]
以及任选的膜包衣。
[0382]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0383] %w/w(层中)粒间 式ii化合物11
‑
19微晶纤维素51
‑
86交联羧甲基纤维素钠4
‑
7硬脂酸镁0.5
‑
0.9粒外 微晶纤维素7
‑
12硬脂酸镁0.5
‑
0.9
[0384]
和第二层,其包含:
[0385] %w/w(层中)粒间 恩曲他滨39
‑
67替诺福韦艾拉酚胺半富马酸盐5
‑
10微晶纤维素22
‑
38交联羧甲基纤维素钠6
‑
10硬脂酸镁0.3
‑
0.7粒间 硬脂酸镁0.3
‑
0.7
[0386]
以及任选的膜包衣。
[0387]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0388][0389]
和第二层,其包含:
[0390][0391]
以及任选的膜包衣。
[0392]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0393] %w/w(层中)粒间 式ii化合物13
‑
17微晶纤维素58
‑
79交联羧甲基纤维素钠4.6
‑
6.3硬脂酸镁0.6
‑
0.8粒外 微晶纤维素5
‑
11硬脂酸镁0.6
‑
0.8
[0394]
和第二层,其包含:
[0395] %w/w(层中)粒间 恩曲他滨45
‑
61替诺福韦艾拉酚胺半富马酸盐6
‑
9微晶纤维素25
‑
35交联羧甲基纤维素钠6.5
‑
9.2硬脂酸镁0.4
‑
0.5粒间 硬脂酸镁0.4
‑
0.5
[0396]
以及任选的膜包衣。
[0397]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0398][0399]
和第二层,其包含:
[0400][0401]
以及任选的膜包衣。
[0402]
在一个实施方案中,提供了片剂,其包含第一层,所述第一层包含:
[0403] %w/w(层中)粒间 式ii化合物14
‑
16微晶纤维素66
‑
73交联羧甲基纤维素钠5.2
‑
5.8硬脂酸镁0.65
‑
0.75粒外 微晶纤维素8
‑
10硬脂酸镁0.65
‑
0.75
[0404]
和第二层,其包含:
[0405] %w/w(层中)粒间 恩曲他滨50
‑
56替诺福韦艾拉酚胺半富马酸盐7
‑
8微晶纤维素28
‑
32交联羧甲基纤维素钠7.5
‑
8.5硬脂酸镁0.45
‑
0.55粒间 硬脂酸镁0.45
‑
0.55
[0406]
以及任选的膜包衣。
[0407]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层包含:
[0408] %w/w(层中)粒间 式ii化合物15微晶纤维素69交联羧甲基纤维素钠5.5硬脂酸镁0.7粒外 微晶纤维素9硬脂酸镁0.7
[0409]
和第二层,其包含:
[0410] %w/w(层中)粒间 恩曲他滨53替诺福韦艾拉酚胺半富马酸盐7.5微晶纤维素30交联羧甲基纤维素钠8
硬脂酸镁0.5粒间 硬脂酸镁0.5
[0411]
以及任选的膜包衣。
[0412]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0413] %w/w(层中)粒间 式ii化合物15微晶纤维素69交联羧甲基纤维素钠5.5硬脂酸镁0.7粒外 微晶纤维素9硬脂酸镁0.7
[0414]
和第二层,其包含:
[0415] %w/w(层中)粒间 恩曲他滨53替诺福韦艾拉酚胺半富马酸盐7.5微晶纤维素30交联羧甲基纤维素钠8硬脂酸镁0.7粒间 硬脂酸镁0.7
[0416]
以及任选的膜包衣。
[0417]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0418][0419]
和第二层,其包含:
[0420][0421]
以及任选的膜包衣。
[0422]
在一个实施方案中,提供了一种片剂,其包含第一层,所述第一层由以下组成:
[0423][0424]
和由以下组成的第二层:
[0425]
[0426]
以及任选的膜包衣。
[0427]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0428][0429]
和由以下组成的第二层:
[0430][0431]
以及任选的膜包衣。
[0432]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0433][0434]
和由以下组成的第二层:
[0435][0436]
和由21mg opadry ii brown 85f165072(聚乙烯醇、聚乙二醇(peg)、滑石、二氧化钛、氧化铁红和氧化铁黑的组合)组成的膜包衣。
[0437]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0438]
[0439]
和第二层,其包含:
[0440][0441]
以及由21mg opadry ii brown 85f165072(聚乙烯醇,聚乙二醇(peg),滑石,二氧化钛,氧化铁红和氧化铁黑的组合)组成的膜包衣。
[0442]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0443] 质量(mg)%w/w(片剂中)式ii化合物47
‑
586.75
‑
8.25微晶纤维素222
‑
27132
‑
59交联羧甲基纤维素钠17
‑
212.5
‑
3.1硬脂酸镁4.4
‑
5.40.6
‑
0.8
[0444]
和第二层,其包含:
[0445][0446][0447]
以及任选的膜包衣(例如opadry ii brown 85f165072(聚乙烯醇、聚乙二醇(peg)、滑石、二氧化钛、氧化铁红和氧化铁黑的组合)。
[0448]
在一个实施方案中,提供了一种片剂,其包含第一层,其包含:
[0449] 质量(mg)%w/w(片剂中)式ii化合物52.57.5微晶纤维素24635交联羧甲基纤维素钠192.8硬脂酸镁50.7
[0450]
和第二层,其包含:
[0451] 质量(mg)%w/w(片剂中)恩曲他滨20029替诺福韦艾拉酚胺半富马酸盐284微晶纤维素11516交联羧甲基纤维素钠304.3硬脂酸镁40.5
[0452]
以及任选的膜包衣(例如opadry ii brown 85f165072(聚乙烯醇、聚乙二醇(peg)、滑石、二氧化钛、氧化铁红和氧化铁黑的组合)。
[0453]
在一个实施方案中,提供了一种片剂,其包含由以下组成的第一层:
[0454][0455][0456]
和由以下组成的第二层:
[0457][0458]
以及由21.9mg opadry ii yellow 85f92259(聚乙烯醇、聚乙二醇(peg)、滑石、二氧化钛和铁黄的组合)组成的膜包衣。
[0459]
在一个实施方案中,提供了包含约75mg式i化合物或其药学上可接受的盐(例如式ii化合物)、约25mg替诺福韦艾拉酚胺或其药学上可接受的盐和约200mg恩曲他滨或其药学
上可接受的盐的组合物,其中在单一剂量施用于人后每种组分的平均auc
最终
为约81700h
·
ng/ml至约140000h
·
ng/ml的式i化合物,约7500h
·
ng/ml至约15000h
·
ng/ml的恩曲他滨,以及约165h
·
ng/ml至约400h
·
ng/ml的替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。
[0460]
在一个实施方案中,提供了包含50mg式i化合物或其药学上可接受的盐(例如式ii化合物)、25mg替诺福韦艾拉酚胺或其药学上可接受的盐和200mg恩曲他滨或其药学上可接受的盐的组合物,其中单一剂量后每种组分的平均auc
最终
为约87,000h
·
ng/ml
‑
约131,000h
·
ng/ml的式i化合物,约8500h
·
ng/ml至约12,800h
·
ng/ml的恩曲他滨和约186h
·
ng/ml至约227h
·
ng/ml的替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0461]
在一个实施方案中,提供了包含式i化合物或其药学上可接受的盐(例如式ii化合物)、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的组合物,其中在单一剂量施用于人后,每种组分的平均auc
inf
为约84450h
·
ng/ml至约141000h
·
ng/ml的式i化合物,约8100h
·
ng/ml至约136000h
·
ng/ml的恩曲他滨和约200h
·
ng/ml至约500h
·
ng/ml的替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0462]
在一个实施方案中,提供了包含式i化合物(例如式ii化合物)、替诺福韦艾拉酚胺和恩曲他滨的组合物,其中单一剂量后每种组分的平均c
max
为约90,000h
·
ng/ml至约135,000h
·
ng/ml的式i化合物,约8,700h
·
ng/ml至约13,000h
·
ng/ml的恩曲他滨以及约200h
·
ng/ml至约300hng/ml的替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0463]
在一个实施方案中,提供了包含式i化合物或其药学上可接受的盐(例如式ii化合物)、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的组合物,其中在单一剂量给予人后每种组分的平均c
max
为约4200ng/ml至约8000mg/ml式i化合物,约1770ng/ml至约2800ng/ml恩曲他滨和约185ng/ml至约315ng/ml替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0464]
在一个实施方案中,提供了包含式i化合物或其药学上可接受的盐(例如式ii化合物)、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的组合
物,其中单一剂量后每种组分的平均c
max
为约4700ng/ml至约5300ng/ml式i化合物、约2000ng/ml至约2600ng/ml恩曲他滨和约200ng/ml至约300ng/ml替诺福韦艾拉酚胺。在某些实施方案中,组合物施用于禁食状态的人。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0465]
在一个实施方案中,提供了包含式i化合物或其药学上可接受的盐(例如式ii化合物)、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐的组合物,其中在单一剂量施用给进食状态下的人后每种组分的平均auc
最终
、auc
inf
和/或c
max
分别为在单一剂量施用给禁食状态下的人后各组分的平均auc
最终
、auc
inf
和/或c
max
的80
‑
125%、80
‑
120%、85
‑
115%、90
‑
110%或95
‑
105%。在某些实施方案中,组合物是片剂。在某些实施方案中,片剂是双层片剂。在某些实施方案中,片剂是双层片剂,式i化合物在一层中,恩曲他滨和替诺福韦艾拉酚胺在另一层中。在某些实施方案中,个体禁食。在其他实施方案中,个体进食。
[0466]
在某些实施方案中,本文所述组合物的药代动力学曲线在可接受的范围内,不论个体在服用药物之前是否已经吃过。相应地,在某些实施方案中,本文所述的组合物可以不考虑个体的食物摄入而服用。在某些实施方案中,食物摄取是低脂肪、中等脂肪或高脂肪膳食。
[0467]
在一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
最终
为给予禁食患者后单一剂量的平均auc
最终
的约100%至约160%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中在给予进食患者后单一剂量的平均auc
最终
为在给禁食患者后单一剂量的平均auc
最终
的约100%至约145%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中施用给进食患者后的单一剂量的平均auc
最终
为在给禁食患者施用后单一剂量的平均auc
最终
的约100%至约135%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中施用于进食患者后单一剂量的平均auc
最终
为施用于禁食患者后单一剂量的auc
最终
的约100%至约125%。
[0468]
在某些实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
最终
为给予禁食患者后单一剂量平均auc
最终
的60%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中在给予进食患者后单一剂量的平均auc
最终
为给予禁食患者后单一剂量的auc
最终
的约45%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中在给予进食患者后单一剂量的平均auc
最终
为给予禁食患者后单一剂量的auc
最终
的35%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中在给予进食患者后单一剂量的平均auc
最终
为给予禁食患者后单一剂量的auc
最终
的25%以内。
[0469]
在一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂
量的平均auc
inf
的约100%至约160%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的约100%至约150%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的约100%至约135%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的约100%至约125%。
[0470]
在某些实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的60%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的50%以内。在其他实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的35%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均auc
inf
为给予禁食患者后单一剂量的平均auc
inf
的25%以内。
[0471]
在一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的约100%至约160%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的约100%至约130%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的约100%至约120%。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的约100%至约115%。
[0472]
在某些实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的60%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的30%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的20%以内。在另一个实施方案中,提供了包含50mg式i化合物、25mg替诺福韦艾拉酚胺和200mg恩曲他滨的组合物,其中给予进食患者后单一剂量的平均c
max
为给予禁食患者后单一剂量的平均c
max
的15%以内。
[0473]
制备方法
[0474]
还提供了用于生产本文公开的组合物和剂型(特别是片剂)的方法。在一些实施方案中,所述方法包含(a)压缩式i化合物或其药学上可接受的盐作为第一层,和(b)压缩替诺
福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐作为第二层。例如,在一些实施方案中,所述方法包含(a)压缩式i化合物或其药学上可接受的盐作为第一层,随后(b)压缩替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐作为第二层。在其它实施方案中,该方法包含(a)压缩替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐,随后(b)压缩式i化合物或其药学上可接受的盐可接受的盐作为另一层。在其他实施方案中,所述方法包含(a)将式i化合物或其药学上可接受的盐压缩作为一层,然后(b)压缩替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐作为另一层。第一层和第二层可以分开压缩并随后组合。然而,更典型地,通过压缩形成第一层,随后将第二层压缩到第一层上。在某些实施方案中,多层片剂压片中层顺序的选择可能影响片剂的性质(例如片剂内各层的粘附)。
[0475]
在一些实施方案中,提供了片剂,其中第一层可通过以下方法获得:(a)压缩式i化合物或其药学上可接受的盐作为第一层,和(b)压缩替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐作为第二层。在其它实施方案中,提供了片剂,其中第二层可通过以下方法获得:(a)压缩式i化合物或其药学上可接受的盐作为第一层,和(b)压缩替诺福韦艾拉酚胺或药学上可接受的其盐和恩曲他滨或其药学上可接受的盐作为第一层。
[0476]
在某些实施方案中,所述方法将包括在压缩后包衣片芯的步骤,例如,用如上所述的膜包衣。
[0477]
一般而言,制片方法在制药领域是众所周知的。技术和制剂通常可以在remington's pharmaceutical sciences(mack publishing co.,easton,pa)中找到,其全部内容通过引用并入到本文中。
[0478]
片剂可以通过压缩或模制,任选地与一种或多种赋形剂一起制备。压缩片剂可通过在合适的机器中压缩自由流动形式的活性成分如粉末或颗粒,任选与赋形剂混合来制备。
[0479]
治疗方法
[0480]
本文公开的固体口服剂型(特别是片剂)用于治疗hiv感染(例如hiv
‑
1感染)。在某些实施方案中,本文公开的固体口服剂型(特别是片剂)用于预暴露预防(prep)以降低性获得性hiv
‑
1的风险。
[0481]
因此,提供了用于治疗感染hiv的个体的方法,其包括向个体施用本文公开的固体口服剂型(特别是片剂)。类似地,提供了用于这种治疗方法的固体口服剂型(特别是片剂)。还提供了式i化合物或其药学上可接受的盐、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐在制备用于治疗hiv感染的本文公开的口服剂型(特别是片剂)的用途。在一些实施方案中,本发明提供了替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐在制备用于治疗hiv感染的本文公开的口服剂型(特别是片剂)的用途。
[0482]
在某些实施方案中,本文公开的固体口服剂型(特别是片剂)用于预暴露预防(prep)以降低性获得性hiv
‑
1的风险。因此,提供了用于预防处于感染hiv风险的个体感染的方法,包括将本文公开的固体口服剂型(特别是片剂)给予个体。类似地,提供本文公开的固体口服剂型(特别是片剂)用于这样的治疗方法。本发明还提供了式i化合物或其药学上
可接受的盐、替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐在制备用于预防处于感染hiv风险的个体感染的本文公开的口服剂型(特别是片剂)中的用途。在一些实施方案中,本发明提供了替诺福韦艾拉酚胺或其药学上可接受的盐和恩曲他滨或其药学上可接受的盐在制备用于预防hiv感染的本文公开的口服剂型(特别是片剂)中的用途。
[0483]
在某些实施方案中,提供了用本文公开的组合物治疗患有hiv的个体的方法,其中所述方法不增加患者中药物
‑
药物相互作用的风险。在某些实施方案中,提供了用本文公开的组合物治疗患有hiv的个体的方法,其中所述方法降低患者中药物
‑
药物相互作用的风险。示例性药物
‑
药物相互作用包括式i化合物、替诺福韦艾拉酚胺或恩曲他滨与利福平、二甲双胍、一种或多种激素类避孕药或hcv抗病毒剂(例如索非布韦、雷迪帕韦、维帕他韦、voxilaprevir、依巴司韦、波普瑞韦、elbasvir、dasabuvir、ombitasvir、帕利瑞韦、abt
‑
530和abt
‑
493的一种或多种)之间的相互作用。在某些实施方案中,提供了治疗患有hiv的个体的方法,其中所述个体被施用一种或多种本文公开的组合物,其中所述个体还正在用利福平、二甲双胍或hcv抗病毒剂(例如索非布韦、雷迪帕韦、维帕他韦、voxilaprevir、依巴司韦、波普瑞韦、elbasvir、dasabuvir、ombitasvir、帕利瑞韦、abt
‑
530和abt
‑
493的一种或多种)治疗。
[0484]
所述方法包括向个体(通常为人)施用本文公开的口服剂型(特别是片剂),并且通常涉及重复施用,通常每天一次。治疗可以是预防性或治疗性治疗。
[0485]
一般
[0486]
与给予人类个体固体口服剂型相关的术语“进食”是指在进食条件下(中等脂肪膳食)口服施用该剂型,例如在人消耗大约300至600卡路里和约10至约15克脂肪的的标准化膳食的约30分钟内施用。在一些实施方案中,“进食”是指在人消耗高脂肪膳食的约30分钟内施用。
[0487]
与在例如组合物内给定组分存在有关的术语“基本上不含”是指该组合物的少于5重量%(例如少于组合物的1重量%)是该给定组分。“基本上”这个词并不排除“完全”,例如组合物“基本上不含”y可以是完全不含y。必要时,本发明的定义中可以省略“基本上”这个词。
[0488]
与片剂内的某些组分(例如a和b)有关的使用的术语“分离的”意指这些组分在物理上是离散的,使得一种组分(例如a)的存在基本上不影响与它分离的其它组分(例如b)的储存稳定性。通常,当组分在片剂中分离时,它们将在多层片剂的不同层中存在。例如,组分a和b可以在多层片剂的不同层中存在,其中(a)含有组分a的层基本上不含组分b,和(b)含有组分b的层基本上不含组分a。分开的层可以彼此接触或可以分开,例如,通过一个或多个附加层。
[0489]
术语“包含”及其变型例如“含有”和“包括”应被解释为“包括但不限于”的开放包含含义。
[0490]
关于两个值的术语“之间”包含那些两个值,例如“在”10mg和20mg之间的范围涵盖例如10、11、12、13、14、15、16、17、18、19和20mg。
[0491]
与量相关使用的术语“约”包含所述值并且具有由上下文所指示的含义(例如,包含与特定量的测量相关的误差程度)。例如,在某些非限制性实例中,与数值x有关的术语
“
约”是指x
±
10%、x
±
5%或x
±
1%。
[0492]“%w/w”是指组分的重量占例如其中存在组分的层或剂型总重量的百分比。例如,包含“5%w/w x”的组合物是指其中组分x的重量为组合物总重量的5%的组合物。
[0493]
本说明书全篇对“一个实施方案”或“实施方案”的引用意味着结合该实施方案描述的特定特征、结构或特性被包含在本文提供的至少一个实施方案中。因此,本说明书全篇各处出现的短语“在一个实施方案中”或“在实施方案中”不一定都指同一实施方案。此外,特定特征、结构或特性可以以任何合适的方式在一个或多个实施方案中组合。
[0494]
关于物质的术语“药学上可接受的”是指通常认为安全且适合使用的物质,没有与合理的利益/风险比相称的不适当的毒性、刺激性、过敏反应等。关于赋形剂的“药学上可接受的”包括但不限于已被美国食品和药品管理局批准为可接受用于人类或家畜的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。
[0495]“药学上可接受的盐”是指药学上可接受的并且具有(或可以转化为一种形式,其具有)母体化合物的所需药理学活性的化合物的盐。这些盐包含与无机酸如盐酸,氢溴酸,硫酸,硝酸,磷酸等形成的酸加成盐;或与有机酸如乙酸,苯磺酸,苯甲酸,樟脑磺酸,柠檬酸,乙磺酸,富马酸,葡庚糖酸,葡糖酸,乳酸,马来酸,丙二酸,扁桃酸,甲磺酸,2
‑
萘磺酸,油酸,棕榈酸,丙酸,硬脂酸,琥珀酸,酒石酸,对甲苯磺酸,三甲基乙酸等形成的酸加成盐;以及当母体化合物中存在的酸性质子被金属离子例如碱金属离子、碱土离子或铝离子取代的酸性质子形成的盐;或与有机碱如二乙醇胺、三乙醇胺、n
‑
甲基葡糖胺等配合物。该定义还包含铵和取代或季胺化的铵盐。代表性的药学上可接受的盐的非限制性列表可参见s.m.berge et al.,j.pharma sci.,66(1),1
‑
19(1977),and remington:the science and practice of pharmacy,r.hendrickson,ed.,21st edition,lippincott,williams&wilkins,philadelphia,pa,(2005),第732页,表38
‑
5,这两个专利通过引用并入本文。
[0496]
如本文所用,术语“盐”包含共晶。术语“共晶”是指包含两种或更多种分子组分的结晶化合物,例如,其中分子组分之间的质子转移是部分或不完全的。
[0497]
术语“溶剂化物”是指包含化合物和一种或多种药学上可接受的溶剂分子的分子复合物。溶剂分子的实例包含水和c1‑6醇,例如乙醇。当溶剂化物是水时,可以使用术语“水合物”。
[0498]
疾病的“治疗”包括以下内容:
[0499]
(1)预防或降低发生疾病的风险,即导致疾病的临床症状在可能暴露于或倾向于疾病但尚未经历或表现出疾病症状的个体中发展,
[0500]
(2)抑制疾病,即阻止或减少疾病或其临床症状的发展,以及
[0501]
(3)缓解疾病,即引起疾病或其临床症状的消退。
[0502]
术语“有效量”是指可有效引起所需生物或医学反应的量,包含当向个体施用以治疗疾病时足以实现疾病的这种治疗的化合物的量。有效量取决于化合物、待治疗的个体的疾病及其严重程度以及年龄、体重等而变化。有效量可以包含一定范围的量。
[0503]
实施例
[0504]
提供了以下实施方案是为了说明而非限制的目的。
[0505]
实施例1
‑
式ii化合物单剂片剂
[0506]
式ii化合物的制剂(片剂f1)通过干法制粒来制备。图5是说明该制剂的制备的流程图。单剂制剂的组成如下表所示:
[0507][0508]
*相当于75mg式i化合物
[0509]
**粒间:2.25mg(0.75%);粒外:2.25mg(0.75%)
[0510]
在实施例3的药代动力学研究中,制剂f1的片剂用12mg opadry ii yellow 85f92259膜包衣。膜包衣片剂的总重量为312mg。
[0511]
将式ii化合物与粒间赋形剂(乳糖、微晶纤维素和交聚维酮)混合,进一步与硬脂酰富马酸钠的粒间部分共混),碾压,研磨,并与硬脂酰富马酸钠最终共混以产生用于压缩的最终粉末混合物。最终粉末混合物的平均粒径为347μm,压缩指数为21%。将最终粉末混合物压缩成片芯,如上所述对其进行膜包衣,达到4%的目标增重。
[0512]
实施例2
‑
式ii化合物/恩曲他滨/替诺福韦艾拉酚胺双层片剂
[0513]
使用实施例8中描述的方法制备式ii化合物、恩曲他滨和替诺福韦艾拉菲酰胺半富马酸盐的双层制剂(片剂f2)。图6是说明制备双层片剂的流程图。该制剂的组成总结在下表中:
[0514]
[0515][0516]
*相当于75mg式i化合物
[0517]
**相当于25mg替诺福韦艾拉酚胺
[0518]
***粒间:212.5mg(29.1%);粒外:2.65mg(0.4%)
[0519]
粒间:2.65mg(0.4%);粒外:2.65mg(0.4%)
[0520]
粒间:2.83mg(0.4%);粒外:2.83mg(0.4%)
[0521]
在实施例3的药代动力学研究中,用21.9mg opadry ii yellow 85f92259(代表3%增重)对制剂f2的片剂进行膜包衣。膜包衣片剂的总重量为752mg。
[0522]
通过碾压工艺使用干法制粒来制备片剂。恩曲他滨/替诺福韦艾拉酚胺最终粉末混合物通过恩曲他滨和替诺福韦艾拉酚胺与赋形剂(微晶纤维素、交联羧甲基纤维素钠、粒间硬脂酸镁)干法制粒,随后与粒外润滑剂(粒外硬脂酸镁)混合而制备。式i化合物的最终粉末共混物通过活性组分与赋形剂(微晶纤维素、交联羧甲基纤维素钠、粒间硬脂酸镁)的干法制粒然后与粒外填充剂和润滑剂(微晶纤维素和粒外硬脂酸镁)共混来制备。在该研究中,将恩曲他滨/替诺福韦艾拉酚胺的最终粉末混合物压缩成层1,并将式i化合物的最终粉末混合物压缩成层2,得到最终的双层片芯。如上所述将芯膜包衣。
[0523]
实施例2a恩曲他滨/替诺福韦艾拉酚胺片剂
[0524]
下表显示了随后研究中使用的恩曲他滨/替诺福韦艾拉酚胺(f/taf)固定剂量组合片剂的组成:
[0525][0526][0527]
恩曲他滨和替诺福韦艾拉酚胺半富马酸盐与微晶纤维素和交联羧甲基纤维素钠
共混,随后用硬脂酸镁润滑。然后将碾压预混物用碾压机碾压并研磨。所得颗粒用硬脂酸镁润滑并压成350mg片芯,随后将其进行膜包衣。
[0528]
实施例3
‑
药物动力学研究
[0529]
进行研究以评估实施例1、2和2a的制剂f1、f2和f3的药代动力学曲线。进行随机的、开放式、多周期、固定序列、交叉研究以评估双层片剂制剂f2相对于同时与含有恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂(片剂制剂f3)共同施用的单剂片剂制剂f1的相对生物利用度。在健康个体中评估生物利用度。
[0530]
研究设计和治疗持续时间
[0531]
在最多21天的总研究持续时间期间口服给予三个单剂量的以下片剂制剂:
[0532]
(a)在禁食条件下同时施用包含恩曲他滨和替诺福韦艾拉酚胺(200/25mg
‑
片剂f3)的固定剂量组合片剂和含有式i化合物的单剂片剂(75mg
‑
片剂f1)(第1天给药;第2
‑
8天清除);
[0533]
(b)在禁食条件下施用包含式i化合物、恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂(75/200/25mg
‑
片剂f2)(在第9天施用;第10
‑
16天清除);和
[0534]
(c)在高脂肪膳食的进食条件下施用含有式i化合物、恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂(75/200/25mg
‑
片剂f2)(在第17天给药;第21天出院)。
[0535]
评估标准
[0536]
计算以下血浆药代动力学参数:c
max
、auc
最终
和auc
inf
。
[0537]
统计方法
[0538]
药代动力学:使用描述性统计学由分析物和治疗组列出和总结血浆浓度和pk参数。此外,使用适用于交叉设计的混合效应模型的参数方差分析适用于pk参数(auc
inf
,auc
最终
和c
max
)的自然对数转换。针对式i化合物、恩曲他滨和替诺福韦艾拉酚胺的各pk参数的几何最小二乘均值(glsm)的比率构建了双侧90%置信区间(ci)。
[0539]
结果
[0540]
个体配置和人口统计
[0541]
总共28名个体被随机分组并接受至少1个剂量的研究药物。
[0542]
下表总结了第一批临床研究的结果。该表呈现在禁食条件下与恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合共同施用双层片剂制剂f2或单剂片剂制剂f1后,各活性成分的血浆pk参数auc
最终
、auc
inf
和c
max
的平均(%cv)值、几何最小二乘平均(glsm)比率和90%ci值。
[0543][0544]
在禁食条件下,式i化合物以含有两种另外的治疗剂(taf和ftc)的双层片剂制剂f2施用时的总暴露量比与含有taf和ftc(f3)的固定剂量组合片剂共施用的单剂片剂制剂f1高约30%。在禁食条件下,在施用双层片剂f2后,式i化合物的auc
inf
和c
max
分别比施用单剂片剂f1和f/taf固定剂量组合(f3,200/25mg)高27%和31%。恩曲他滨和替诺福韦艾拉酚胺暴露在施用双层片剂制剂f2或单剂片剂制剂f1与f/taffdc(f3,200/25mg)后相似。
[0545]
基于来自该研究的数据,开发了式i化合物、恩曲他滨和替诺福韦艾拉酚胺的新的固定剂量制剂。
[0546]
还在非随机化、开放式、交叉、2周期、固定序列和由8个独特个体组成的单剂量组群中检查了食物对式i化合物的药代动力学的影响。在该研究中,单剂量的式i化合物分别在禁食和进食条件下以固定序列在两个周期内施用。在禁食和进食序列之间需要至少5个半衰期的清除。
[0547]
根据实施例1的片剂制剂的重量百分比,等同于100mg式i化合物的剂量和相应地调整的赋形剂的量制备式i化合物以达到指定的重量百分比(100mg/片)。在第1天过夜禁食后(没有食物或饮料,除了水以外,至少10小时),将含有式i化合物(100mg/片)的单一片剂与约240ml水一起施用。个体继续禁食直至给药后4小时或直到收集给药4小时后的血液样品。在第9天,在禁食过夜(没有食物或饮料,除了水之外,至少10小时)后和个体完成标准的高脂肪早餐(大约800卡路里,50%的卡路里来自脂肪)约5分钟内,将含有式i化合物(100mg/片)的单一片剂与约240ml水一起施用。
[0548]
通过比较在进食和禁食条件下在第1天和第9天的auc
inf
、auc0‑
最终
和c
max
来获得食物对式i化合物的作用的评估。自然对数转换的pk参数(即,auc
inf
、auc0‑
最终
和c
max
)使用混合效
应模型进行评估,其中食物作为固定效应并且个体作为随机效应。构建了禁食与进食的几何最小二乘均数(glsm)比率的90%ci。在进食和禁食状态下单剂量施用该片剂后,式1化合物的药代动力学参数的统计比较在下表中给出。
[0549][0550]
上表给出了对于式i化合物的初级血浆pk参数的测试(进食)与参考(禁食)治疗的glsm比率和相关的90%置信区间(ci)。单剂量施用式i化合物100mg与食物(高热量/高脂肪早餐)使c
max
和auc
inf
的glsm值增加101%(glsm比率的90%ci为165.93%至242.74%)和84%(glsm比率的90%ci为152.05%至222.59%)。施用食物后清除率和t
1/2
没有明显变化,表明食物通过改善其溶解度和/或吸收来提高式i化合物的生物利用度。
[0551]
在上述临床研究中评价式i化合物、恩曲他滨和替诺福韦艾拉酚胺作为片剂制剂f2片剂施用时食物对其pk的影响(随机化的、开放式、多周期、固定序列、交叉研究涉及28名个体,比较了双层片剂制剂f2与与同时含有恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂(片剂制剂f3)共同施用的单剂片剂制剂f1)。
[0552]
在禁食条件下或与高脂肪膳食一起施用片剂制剂f1后,式i化合物、恩曲他滨和替诺福韦艾拉酚胺的pk参数auc
最终
、auc
inf
和c
max
的血浆的平均(%cv)值、glsm比率和90%ci值列于下表中。
[0553][0554]
与在禁食条件下施用相比,高脂肪膳食与片剂制剂f2一起施用导致式i化合物的auc
inf
高46%和c
max
高27%。食物对恩曲他滨和替诺福韦艾拉酚胺暴露的影响是类似于之前观察到的。
[0555]
上述两个表中呈现的数据还证实,相对于单剂片剂制剂f1,双层片剂制剂f2中食物对式i化合物总暴露的影响降低。式i化合物在单剂片剂制剂f1中的auc
inf
的几何平均比率为1.84,而双层片剂制剂f2中式i化合物的auc
inf
的几何平均比率为1.46。相比之下,各制剂中恩曲他滨的auc
inf
的几何平均比率分别为0.91和1.00以及替诺福韦艾拉酚胺的auc
inf
的几何平均比率分别为1.75和1.58(比较片剂制剂f2的恩曲他滨和替诺福韦艾拉酚酰胺暴露与和片剂制剂f3共剂量的片剂制剂f1的那些)。单剂片剂制剂f1的c
max
的几何平均比率为2.01,而双层片剂制剂f2的c
max
的几何平均比率为1.27。相比之下,恩曲他滨和替诺福韦艾拉酚胺在片剂制剂f1和f2中的c
max
几何平均比率分别为0.85和0.83。这些数据表明,式i化合物、恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂可以不考虑食物服用。
[0556]
实施例4
‑
溶出度研究
[0557]
进行研究以评估片剂f1、f2和f3
‑
a的溶出曲线。在37℃和桨叶速度为100rpm下,使用usp装置ii在250ml ph 6.5禁食状态模拟肠液(fassif)中测量式ii化合物的溶出度。fassif通过将模拟肠液(sif)粉末(biorelevant.com)以约4.48g/l添加至ph 6.5磷酸盐缓冲液中来制备。一旦粉末溶解,所得溶液的体积加倍。在单剂片剂制剂f1的情况下,在存在含有恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的实施例2a的固定剂量组合片剂制剂f3的情况下测量式ii化合物的溶出度。结果显示在图1中。这些数据显示,与单剂制剂(与f3共给
药的片剂f1)相比,双层制剂(片剂f2)表现出式ii化合物的溶出度增强。根据下面的表格根据实施例1中描述的方法制备片剂制剂f3
‑
a作为单剂制剂。
[0558][0559]
*相当于75mg式i化合物
[0560]
***粒间:212.5mg(29.1%);粒外:2.65mg(0.4%)
[0561]
粒间:2.65mg(0.4%);粒外:2.65mg(0.4%)
[0562]
如上所示,片剂f3
‑
a使用实施例2的式ii化合物层(f2)的组合物(赋形剂选择和量)。图1进一步表明,与片剂制剂f1和f3
‑
a相比,片剂制剂f2表现出式ii化合物的溶解度提高。从制剂f1和f3
‑
a溶解的式ii化合物的总百分比在约60%时是相当的。从制剂f2溶解的式ii化合物的总量大约高10%。
[0563]
在第二项研究中,使用进食状态模拟肠液(fessif)作为溶出介质测量式ii化合物的溶出。通过将模拟肠液(sif)粉末(biorelevant.com)以约22.405g/l添加到ph 5.0磷酸盐缓冲液中制备fessif。一旦粉末溶解,所得溶液的体积增加一倍。在该研究中,式ii化合物的溶出度使用usp装置ii在250ml ph5.5的模拟肠液中在37℃和桨叶速度100rpm下测量。如在先前使用禁食模拟肠液的研究中那样,在含有恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的第二片剂制剂(片剂f3)存在下测试单剂片剂制剂f1。结果显示在图2中。这些数据还显示与单剂制剂(片剂f1)相比,双层制剂(片剂f2)表现出式ii化合物的溶出度增强。
[0564]
实施例5
‑
赋形剂研究
[0565]
为了进一步评估特定赋形剂对式i化合物溶出度的影响,制备了三种另外的双层片剂制剂f4、f5和f6。片剂制剂f4类似于片剂制剂f2,其中交联羧甲基纤维素钠被交聚维酮代替。同样,片剂制剂f5类似于片剂制剂f2,硬脂酸镁用硬脂酰富马酸钠代替。最后,片剂制剂f6类似于片剂制剂f2,交联羧甲基纤维素钠和硬脂酸镁分别被交聚维酮和硬脂酰富马酸钠代替。使用实施例8中描述的方法制备片剂f4、f5和f6。
[0566][0567]
图3显示了在片剂制剂f4、f5和f6以及片剂制剂f1和f2上进行的溶出度研究的结果。这些数据表明,每种赋形剂的替代增强了式i化合物的溶出。
[0568]
实施例6
‑
式i化合物/恩曲他滨/替诺福韦艾拉酚胺双层片剂
‑
50mg剂量
[0569]
由于在药代动力学研究中观察到的式i化合物体内暴露量更高,因此制备的式ii化合物、恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的双层制剂(片剂f7)掺入了低剂量的式i化合物。如前所述,即使用实施例8中所述的方法制备片剂制剂f7。制剂的组成总结于下表中:
[0570][0571]
*相当于50mg式i化合物
[0572]
**相当于25mg替诺福韦艾拉酚胺
[0573]
实施例7
‑
式i化合物的单剂片剂(50mg)
[0574]
将50mg剂量双层片剂f7与50mg单剂片剂进行比较,进行溶出度研究。
[0575]
以与实施例1的片剂制剂f1类似的方式制备式ii化合物的50mg制剂(片剂f8)。单剂制剂的组成在下表中示出:
[0576][0577]
图4显示50mg双层片剂制剂(固定剂量组合)f7和50mg单剂片剂制剂f8的溶出度。式ii化合物的溶出度使用usp装置ii在333ml ph 6.5的fassif中在37℃和100rpm桨速下测量。f7和f8每种片剂制剂测试两片。如实施例3中那样,在单剂片剂f8的情况下,在包含恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的实施例2a的固定剂量组合片剂制剂的存在下测量式ii化合物的溶出度。这些数据显示与单剂制剂(片剂f8)相比,50mg双层制剂(片剂f7)表
现出式ii化合物的增强的溶出度。
[0578]
实施例8
‑
制备过程
[0579]
式ii化合物/恩曲他滨/替诺福韦艾拉酚胺半富马酸盐片剂的制备/包装程序分为五个单元过程:
[0580]
1.将式ii化合物药物与粒间赋形剂混合,碾压或压缩,碾磨,并与粒外赋形剂混合,得到式ii化合物的最终粉末混合物;
[0581]
2.将恩曲他滨和替诺福韦艾拉酚胺半富马酸盐药物与粒间赋形剂混合,干法制粒,研磨并与粒外赋形剂混合以产生恩曲他滨/替诺福韦艾拉酚胺半富马酸盐的最终粉末混合物;
[0582]
3.片剂压缩以产生双层片芯;
[0583]
4.片剂膜包衣以产生膜包衣的片剂;和
[0584]
5.包装。
[0585]
下面详细描述制备最终药物产品的制备过程步骤。
[0586]
式ii化合物的最终粉末混合物(分配,混合,干法制粒,研磨,最终混合)
[0587]
1.称量式ii化合物和赋形剂(微晶纤维素和交联羧甲基纤维素钠)。基于药物含量因子(dcf)校正式ii化合物的重量,同时伴随微晶纤维素重量的减少。
[0588]
2.将硬脂酸镁的粒间部分共混到滚筒混合机中并混合。
[0589]
3.使用碾压机干法造粒所得的混合物或将所得的混合物压块并研磨。
[0590]
4.加入粒外微晶纤维素和硬脂酸镁并混合。
[0591]
恩曲他滨/替诺福韦艾拉酚胺半富马酸盐的最终粉末混合物(分配,混合,干法制粒,研磨,最终混合)
[0592]
5.称量恩曲他滨和替诺福韦艾拉酚胺半富马酸盐药物和赋形剂(微晶纤维素和交联羧甲基纤维素钠)。根据相应的dcf调整恩曲他滨和替诺福韦艾拉酚胺半富马酸盐药物的重量,同时调整微晶纤维素的重量。
[0593]
6.将恩曲他滨和替诺福韦艾拉酚胺半富马酸盐药物、微晶纤维素和交联羧甲基纤维素钠混合到滚筒搅拌器中并混合。
[0594]
7.将硬脂酸镁的粒间部分混合到滚筒搅拌器中并混合。
[0595]
8.使用碾压机干法造粒所得的混合物或将所得混合物塞住并研磨。
[0596]
9.混合硬脂酸镁的粒外部分。
[0597]
压片
[0598]
10.将作为第一层的式ii化合物的最终粉末共混物和作为第二层的恩曲他滨/替诺福韦艾拉酚胺半富马酸盐的最终粉末共混物压缩,用适当的主压缩力以实现17kp的目标硬度(范围:14
‑
20kp)。对于含有50mg式ii化合物的片剂制剂,使用目标总片剂重量700mg将最终的粉末混合物压缩成323mg的目标层重量。对于含有75mg式ii化合物的片剂制剂,使用目标总片剂重量730mg将最终的粉末混合物压缩成353mg的目标层重量。
[0599]
膜包衣
[0600]
11.制备opadry ii brown 85f165072(用于含有50mg式i化合物的片剂)或opadry ii yellow 85f92259(用于含有75mg式i化合物的片剂)的混悬液。膜包衣片芯以达到3%(范围2
‑
4%)的目标片剂重量增加。冷却和排出前干燥膜包衣片剂。
[0601]
实施例9
‑
药代动力学研究
‑
组群2
[0602]
用第二治疗组(组群)来继续实施例3的药代动力学研究,以评估实施例7的制剂f7的药代动力学曲线,与制剂f2相比较。
[0603]
研究设计和治疗持续时间
[0604]
在36天的总研究持续时间期间,每日一次口服施用四个单一剂量的以下片剂制剂:
[0605]
(a)在禁食条件下将含有恩曲他滨和替诺福韦艾拉酚胺(200/25mg
‑
片剂f3)的固定剂量组合片剂与含有式i化合物(75mg
‑
片剂f1)的单剂片剂同时施用(治疗a)(在第1天施用;第2
‑
8天清除);
[0606]
(b)在禁食条件下施用含有式i化合物、恩曲他滨和替诺福韦艾拉酚胺(50/200/25mg
‑
片剂f2)的固定剂量组合片剂(治疗d)(第9天施用;第10
‑
16天清除);和
[0607]
(b)在进食条件下施用含有式i化合物、恩曲他滨和替诺福韦艾拉酚胺(50/200/25mg
‑
片剂f2)的固定剂量组合片剂和高脂肪膳食(治疗e)(在第17天施用;在第18
‑
24天清除);
[0608]
(c)在进食条件下施用含有式i化合物、恩曲他滨和替诺福韦艾拉酚胺(50/200/25mg
‑
片剂f2)的固定剂量组合片剂和中等脂肪膳食(治疗f)(在第25天施用;在第29天出院)。
[0609]
评估标准
[0610]
计算以下血浆药代动力学参数:auc
最终
、auc
inf
、%auc
exp
、c
max
、c
最终
、t
max
、t
最终
、cl/f、v
z
/f和t
1/2
。
[0611]
统计方法
[0612]
药代动力学:使用描述性统计通过治疗组(群组)和治疗列出和总结每种分析物(式1化合物、ftc和taf)的个体浓度数据和个体pk参数。汇总统计通过时间点、群组、和治疗确定个体浓度数据和通过群组和治疗确定个体pk参数。此外,对于个体pk参数数据,给出几何平均值、95%置信区间(ci)以及自然对数转换值的平均值和标准偏差(sd)。每个时间点的样本量基于该时间点具有非缺失浓度数据的个体的数量。在每个时间点呈现浓度低于定量水平(blq)的个体的数目。
[0613]
进行每种分析物的自然对数转换的pk参数和感兴趣的治疗对比的统计学比较。统计学建模基于针对待评估分析物的pk分析集。对于每种分析物,所有具有可用于评估pk参数的数据的个体都包含在建模中。使用治疗a作为参考的统计学比较仅使用来自该群组的数据,而不使用来自实施例3的早期群组(即,未合并治疗a)的数据。
[0614]
对于每种分析物和每个pk参数,将参数(正常理论)混合效应anova模型拟合成待评估的pk参数的自然对数转换值。统计学模型包含作为固定效应的治疗和作为随机效应的个体。
[0615]
总共27名个体完成研究的第二治疗组。
[0616]
结果
[0617]
下面给出了每种分析物的血浆药代动力学参数。该表呈现在禁食条件下施用双层片剂f7和与f/taf制剂f3共同施用的单层片剂f1后,每种活性成分的血浆pk参数auc
最终
、auc
inf
和c
max
的平均(%cv)值、几何最小二乘平均(glsm)比率和90%ci值。
[0618][0619]
具体而言,这些数据证实在制剂f7中的式i化合物的暴露量成比例地低于制剂f2中观察到的那些,并且与修正剂量的预测暴露量一致。这些数据与早期临床数据的建模一致,证实这些暴露提供了抗hiv抗病毒效力。制剂f7和制剂f2与f3共同施用的ftc和taf暴露相似;制剂f7的taf c
max
略低于(约16%)f2和f3的共同施用。
[0620]
当以制剂f7施用时,食物对式i化合物、恩曲他滨和替诺福韦艾拉酚胺的药代动力学的影响也在上述临床研究的进一步治疗组中进行检查。
[0621]
下表列出了在禁食条件下或在施用高脂肪膳食和中等脂肪膳食下施用片剂制剂f7后,式i化合物、恩曲他滨和替诺福韦艾拉酚胺的pk参数auc
最终
、auc
inf
和c
max
的血浆的平均(%cv)值、glsm比率和90%ci值。
[0622][0623][0624]
与禁食条件下的施用相比,与高脂肪膳食一起施用片剂f7导致式i化合物的auc
inf
高24%和c
max
高13%。施用中等脂肪膳食导致式i化合物的auc
inf
高24%和c
max
高20%。
[0625]
食物对恩曲他滨和替诺福韦艾拉酚胺暴露的影响类似于先前观察到的。
[0626]
这些数据证实了式i化合物、恩曲他滨和替诺福韦艾拉酚胺的固定剂量组合片剂制剂可以不考虑食物。
[0627]
实施例10
‑
压缩研究
[0628]
为了进一步研究组合物的性质,以下研究探索混合物的可压缩性和层粘附性。
[0629]
首先,制备各种最终共混组合物(包含式i化合物(作为钠盐,即式ii化合物)),其具有不同水平的粒间或粒外乳糖,如下表所示。
[0630]
式ii化合物:含乳糖的最终粉末共混物
[0631][0632]
接下来,如下表所示制备式ii化合物与0.75%至0.5%不同量的硬脂酸镁的最终共混组合物:
[0633]
式i化合物:具有不同水平的硬脂酸镁的最终粉末混合物
[0634][0635]
最后,含有恩曲他滨和替诺福韦艾拉酚胺的最终共混组合物与不同量的范围为0.75%至0.5%的硬脂酸镁制备,如下表所示:
[0636]
f/taf最终粉末混合物的定量组合物
[0637][0638]
研究了改变硬脂酸镁含量以评估其对式i化合物和恩曲他滨/替诺福韦艾拉酚胺混合物可压缩性和层粘附性的影响。还监测制剂的冲孔成膜和粘着。
[0639]
如下表所概述的,制备上表中所述的最终粉末共混物的十四种组合。所有十四种组合都确定了临界夯实力。
[0640]
压缩研究关键层1夯实力结果
[0641][0642]
*f/taf作为层1并且式i化合物作为层2
[0643]
ig:粒间
[0644]
eg:粒外
[0645]
mgst硬脂酸镁
[0646]
组合a代表用于比较其他组合物的基线的层顺序和组成。每层的片剂制剂对应于
片剂制剂f7的相应层。一个目的是调查是否有可能改善组合a观察到的1.0kn的临界夯实力。
[0647]
组合b
‑
g代表其中将乳糖包含在包含式i化合物的层中以研究评估层粘附性的研究。组合g粒间部分包含20%的乳糖,粒外部分没有。在组合c、d和e中,乳糖与微晶纤维素的比例分别为1:1、3:1、1:3。组合g在粒间部分包含20mg乳糖。对于组合b
‑
g,在1.5kn处观察到分层。结果,较低的夯实力未被进一步研究。当层顺序颠倒时(组合h),在1.0kn时没有发生分层,但是在1.5kn下使用组合a的层组合物观察到分层。
[0648]
在组合i
‑
n中,研究改变各层中硬脂酸镁的量以确定对压缩性和层粘附性的影响。在组合i、j和k的式i化合物层中,粒间硬脂酸镁分别为0.75%、0.70%和0.60%。组合i、j和k的每一种的f/taf层中的总硬脂酸镁含量分别为1.0%、1.4%和1.2%。在组合l和m的式i化合物层中,粒间硬脂酸镁分别为0.6%和0.5%(各自具有0.75%的粒外硬脂酸镁)。组合n在两层中的硬脂酸镁总含量最低(每层为1.0%)。
[0649]
发现在每个粒间和粒外部分中,硬脂酸镁从0.75%减少至0.5%,恩曲他滨/替诺福韦艾拉酚胺层将临界夯实力增加至2.0kn(组合i)。当含有式i化合物的层中硬脂酸镁减少到0.5%粒外和/或粒间部分(组合m和n)时,临界夯实力可进一步提高到2.5kn。然而,尽管获得了临界夯实力的增加,但在含有式1化合物的粉末混合物的每种组分中,硬脂酸镁降低至0.5%对粘着有负面影响。与组合i相比,硬脂酸镁(组合j
‑
l)的中间变化没有进一步改善。结果,仅恩曲他滨/替诺福韦艾拉酚胺层(制剂组合i)中硬脂酸镁水平降低。最终确定临界层1夯实力为1377n。下表总结了制剂i的组成。
[0650]
因此,向含有式i化合物的层添加粒间或粒外乳糖对层粘附几乎没有影响。从每种最终的粉末混合物中减少硬脂酸镁提高了可压缩性。
[0651]
组合制剂i的定量组成
[0652][0653]
a根据每批式ii化合物的纯度调整所用的量,同时调整微晶纤维素的量。
[0654]
b相当于50mg式i化合物游离酸。
[0655]
c根据每批恩曲他滨和替诺福韦艾拉酚胺半富马酸盐的纯度调整所用的量,同时
调整微晶纤维素的量。
[0656]
d相当于25mg替诺福韦艾拉酚胺游离碱。
[0657]
e opadry ii brown 85f165072含有聚乙烯醇,usp(40.0%w/w);二氧化钛,usp(22.0%w/w);聚乙二醇,nf(20.2%w/w);滑石,usp(14.8%w/w);氧化铁红,nf(2.4%w/w);氧化铁黑,nf(0.6%w/w)。
[0658]
f表示理论重量增加3%w/w(范围2%至4%w/w)到片芯重量上。
[0659]
g充足的纯净水用于膜包衣,并在此过程中被除去
[0660]
所有出版物、专利和专利申请通过引用整体并入,如同单独通过引用并入。已经参考各种特定且优选的实施方案和技术描述了本发明。然而,应理解,可以在保持在本发明的精神和范围内的同时进行许多变化和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。