本发明涉及金属材料制备技术领域,具体涉及一种还原性熔盐介质及其制备方法。
背景技术:
从矿物中提取有价金属的基本方法包括:(1)通过选矿法从矿物中提取出金属氧化物或硫化物含量高的精矿;(2)采用冶炼法将精矿转化成粗金属,然后精炼粗金属获得高纯的金属;或者(3)先将精矿转化成金属化合物(金属氧化物、金属卤化物、金属硫化物等),然后从这些金属化合物中制备出金属。传统从金属化合物中制备金属依赖于:(1)湿法冶金制备法,(2)高温化学制备法,和(3)电化学方法制备法。
活泼金属m1热还原另一金属的化合物m2x属高温化学制备法之一,其总反应表达如下:
m2x m1=m2 m1x(1)
其中m1是活泼金属(例如,碱金属、碱土金属、al、si),用作还原剂;m2x是金属化合物,其中m2是所要制备的金属,而x是非金属元素,可以是氧、氯、氟、硫、碳、氮等等。与m2相比,m1对x具有更强的亲和力,也就是说,m1x的热力学稳定性比m2x高。这样,反应(1)的标准反应自由能变化(δg°)总是负值。此外,反应(1)总是放热反应,因此称之为“金属热还原”。金属热还原法已经在工业上应用于生产某些高纯度金属,例如,镁分别热还原ticl4或zrcl4生产金属海绵钛或者锆(trans.electrochem.soc.,1940,78,35-47;“zirconium”crchandbookofchem.phys.4,2007-2008,newyork,crcpress,42),k2taf7钠还原生产金属钽粉(美国专利3012877,1961年12月12日),铝热还原氧化铁和氧化钒铝混合物生产钒铁合金(mineralseng.,2003,16,793-805)。
金属热还原法需要消耗过量的活泼金属还原剂m1以便使反应(1)进行彻底,所有活泼金属它们本身的价格高,从而提高了热还原法的生产成本。从经济效益角度来看,金属热还原法仅适合于生产比金属还原剂价格更高的金属。此外,金属热还原过程中伴随着释放大量反应热,使反应金属产物相互就地烧结易形成海绵状形态多孔颗粒,无法制备超细金属粉末。
在金属热还原方法中,碱金属(ma)与碱土金属(me)已在金属热还原方法中广泛地被用作还原剂制备各种金属,其主要不足是:(1)碱金属、碱土金属本身价格高,造成还原过程成本高;(2)由于碱金属、碱土金属的化学活性,直接使用这些金属还原剂造成操作危险、安全管理要求高、难度大;(3)热还原过程释放大量反应热,容易引起反应产物的局部烧结,(4)由于碱金属、碱土金属在高温下挥发性强,易发生对炉衬材料的化学侵蚀;(5)生产工艺复杂;6)生产周期长、成本高;(7)过程能耗大;(8)过程是批量生产过程,难以实现连续化或半连续化。
碱金属与碱土金属相比,其熔点远远低于碱土金属,但其沸点只是略微低于碱土金属。因此,碱金属更适合于还原温度较低的热还原过程,例如低于700℃,而碱土金属更适合较高还原温度的热还原,例如高于750℃。低温金属热还原的最大优点是它能大大降低过程的热能损失,同时有效地降低了产物局部烧结程度,使产物结构性能更具一致性。
熔盐在碱或碱土金属热还原中广泛地用作反应介质。例如,美国专利(专利号4992096,1991年2月12日)公开了一种在cacl2熔盐介质中的钙热还原稀土金属氯化物制备稀土金属及其合金。在cacl2-nacl熔盐介质中的钙热还原稀土金属氧化物制备稀土金属及合金(us4578242,1986年3月25日),在cacl2熔盐介质中的钙热还原稀土金属氟化物制备稀土金属及其合金(美国专利5314526,1994年5月24日),mgcl2-ndcl3熔盐介质中的镁热还原uo2和其它锕系金属氧化物回收金属价(us590337,1994年3月1日),在cacl2-caf2熔盐介质中的钙热还原tio2或zro2制备金属钛或锆(us6117208,2000年9月12日),碱与碱土金属氯化物中钠热还原ta2o5和nb2o5制备金属钽和铌(cn1410209a,2003年4月16日)。熔盐介质的主要优点是:
(i)熔盐介质传热性好,易于保持介质温度的均匀性,可以有效地降低还原产物的局部烧结,有利于保证产物性能的一致性;
(ii)碱、碱土金属在其熔融的卤化物中有一定的熔解度,某些热还原反应副产品(碱土金属氧化物meo)在其熔融的卤化物盐中有相当量的熔解度,这些性能有利于碱金属还原剂与氧化物mo的直接接触,加快反应速度。
然而,上述金属热还原过程直接采用金属形式的钙或钠作为还原剂。因此,
尽管采用了熔盐介质,上述碱金属、碱土金属热还原法的缺点(1),(2),(5),(6),(7)和(8)仍然无法克服。
专利cn105274576b公开了一种熔盐介质中连续还原制备金属的方法,针对现有熔盐介质中碱金属热还原氧化物mo存在的不足,以解决或克服以下存在的缺点:
(i)采用特选的碱土金属氧化物meo/碱金属卤化物may混合物取代金属形态的碱金属还原剂:克服现有直接加入的碱金属还原剂方法带来的操作复杂、危险的缺点;解决了处理和操作碱金属安全管理要求高、难度大的问题;
(ii)辅助电解含碱土金属氧化物meo熔盐介质,就地生成与再生成碱金属还原剂:解决了现有碱金属热还原过量使用碱金属还原剂的问题;克服现有金属热还原的批量生产过程,难以实现连续化的缺点。
然而,在实际生产过程中,专利cn105274576b方法存在生产效率低以及能耗增高的问题。
技术实现要素:
本发明目的在于至少在一定程度上解决背景技术中指出的其中之一的技术问题。
本发明所要解决的技术问题,通过以下技术方案予以实现:
本发明提供一种还原性熔盐介质的制备方法,其以混合盐maoh-ma2co3-macl为原料,以混合物may-mey2为熔盐介质熔剂;将maoh-ma2co3-macl熔融形成maoh-ma2co3-macl熔盐,放入熔融的may-mey2熔盐介质熔剂中,进行电解反应即得所述的还原性熔盐介质;
所述的还原性熔盐介质为may-mey2-ma;
其中,ma代表碱金属;me代表碱土金属;y代表卤素元素。
专利cn105274576b是发明人前期的发明,在实际生产中发明人进一步发现,采用专利cn105274576b的方法在制备金属材料的过程中存在生产效率低的技术问题;而为了解决生产效率低的技术问题,发明人经大量的试验研究寻找生产效率低的原因,最终发现:采用专利cn105274576b的方法是以meo/may混合物为原料制备还原性熔盐介质,而采用该还原性熔盐介质在反应产物附近meo熔解于熔盐介质的速度过慢,未熔解的meo使周围的熔盐粘度升高;而熔盐粘度升高导致还原速度降低,进而导致生产效率低。基于该原因的发现,发明人,将专利cn105274576b中的原料meo/may替换成了原料maoh-ma2co3-macl用于制备还原性熔盐介质,由于该原料中不含meo,其能有效降低了熔盐介质中meo的含量,促进了反应生成的meo的熔解,有效降低了熔盐介质中meo的含量,解决了meo熔解于熔盐介质的速度过慢的问题;进而成功地克服了专利cn105274576b的方法在反应产物附近meo熔解于熔盐介质的速度过慢,导致还原速度降低,进而导致生产效率低的问题。
发明人进一步研究发现,在反应产物附近meo熔解于熔盐介质的速度过慢,未熔解的meo使周围的熔盐粘度升高;而熔盐粘度升高会降低熔融盐性能的均匀性,尤其使熔盐介质传热性下降,容易造成金属产物的局部或过分烧结引起产物结构一致性变差;基于该原因的发现,本发明发明人将专利cn105274576b中的原料meo/may替换成了原料maoh-ma2co3-macl用于制备还原性熔盐介质,由于该原料中不含meo,其能有效降低了熔盐介质中meo的含量,促进了反应生成的meo的熔解,解决了meo熔解于熔盐介质的速度过慢的问题;进而成功地克服了专利cn105274576b方法存在产物结构一致性差的问题。
发明人进一步研究发现,在反应产物附近meo熔解于熔盐介质的速度过慢,会引起能耗及生产成本上升。基于该原因的发现,本发明发明人将专利cn105274576b中的原料meo/may替换成了原料maoh-ma2co3-macl用于制备还原性熔盐介质,由于该原料中不含meo,其能有效降低了熔盐介质中meo的含量,促进了反应生成的meo的熔解,解决了meo熔解于熔盐介质的速度过慢的问题;进而成功地克服了专利cn105274576b方法存在的能耗高的问题。
所述的还原性熔盐介质的制备方法,其具体步骤如下:
将maoh-ma2co3-macl熔盐放入具有ma 离子传导作用的容器中;再将具有ma 离子传导作用的容器放入熔融的may-mey2熔盐介质熔剂中,具有ma 离子传导作用的容器外部直接与may-mey2熔盐介质熔剂相接触,使得maoh-ma2co3-macl熔盐与熔融的may-mey2熔盐介质熔剂完全隔离;
在maoh-ma2co3-macl熔盐中插入电子导体棒作为惰性阳极;在may-mey2熔盐介质熔剂中插入电子导体棒作为惰性阴极;构成“惰性阳极,maoh-ma2co3-macl(阳极电解质)|ma 离子固体导体|may-mey2(阴极电解质),惰性阴极”电解池;
对电解池进行电解反应,即得所述的还原性熔盐介质may-mey2-(ma)。
发明人在采用原料maoh-ma2co3-macl用于制备还原性熔盐介质中,进一步研究发现,采用中国发明专利cn105274576b方法产出的ma溶入熔盐介质会引起介质电子导电比例的显著增加和电解电流效率的下降,进而导致制备ma还原剂的效率低,最终导致生产过程的生产效率低,能耗增高及生产成本上升。
基于上述原因的发现,发明人在电解过程中,将maoh-ma2co3-macl熔盐放入具有ma 离子传导作用的容器中;再将具有ma 离子传导作用的容器放入熔融的may-mey2熔盐介质熔剂中,具有ma 离子传导作用的容器外部直接与may-mey2熔盐介质熔剂相接触,使得maoh-ma2co3-macl熔盐与熔融的may-mey2熔盐介质熔剂完全隔离;构成“惰性阳极,maoh-ma2co3-macl(阳极电解质)|ma 离子固体导体|may-mey2(阴极电解质),惰性阴极”电解池。基于该电解池进行电解,克服了中国发明专利cn105274576b中电解后形成may-mey2-(ma)熔盐介质具有离子/电子混合传导的缺点,极大地提高了电解的电流效率从而能实现高效制备ma还原剂,最终促进生产过程的生产效率的提高以及能耗的降低。
此外,采用“惰性阳极,maoh-ma2co3-macl(阳极电解质)|ma 离子固体导体|may-mey2(阴极电解质),惰性阴极”电解池进行电解,可以使得阳极产物氧气、水蒸汽与阴极产物碱金属ma完全隔开,避免了氧气及水蒸汽与活泼金属ma的逆反应。通过放置惰性阴极在may-mey2熔盐介质熔剂不同位置,能使ma在熔盐介质熔剂内部任何需要的位置在阴极析出ma并就地熔入熔盐介质熔剂向其四周扩散,强化(ma)在介质中均匀化和热还原mo过程。
采用“惰性阳极,maoh-ma2co3-macl(阳极电解质)|ma 离子固体导体|may-mey2(阴极电解质),惰性阴极”电解池进行电解,可以将原料maoh-ma2co3-macl与may-mey2隔离开来,使得熔盐介质熔剂may-mey2中没有外界添加的meo,促进了生成的meo的熔解,解决了meo熔解于熔盐介质的速度过慢导致生产效率低的问题。
另外,所述的maoh-ma2co3-macl为具有低熔点的熔盐,优选为低共熔混合盐maoh-ma2co3-macl熔盐。
另外,所述的碱金属为li,na或k;所述的碱土金属为ca,sr或ba;所述的卤素元素为cl或f。
另外,所述的具有ma 离子传导作用的容器的中的活性材料为固体离子导体ma β-al2o3。
另外,所述的具有ma 离子传导作用的容器通过如下方法制备得到:将由na2o和al2o3为原料制备得到的na β-al2o3容器浸没在含有ma 离子的熔融盐中,进行离子交换即得所述的具有ma 离子传导作用的容器;
或者,所述的具有ma 离子传导作用的容器是以ma氧化物或碳酸盐和al2o3为原料制备得到。
另外,所述的含有ma 离子的熔融盐为may-mey2混合熔融盐;或者为含有ma 离子的卤化物或硝酸盐。
另外,惰性阴极和惰性阳极电子导体棒的材料相同或不同。
进一步地,作为惰性阳极的电子导体棒的材料选自:金属,合金,电子陶瓷,金属陶瓷,或石墨;作为惰性阴极的电子导体棒的材料,在氯化物熔盐体系中是不锈钢,fe,ni,mo,w,或者与所制备金属相同的材料;在氟化物熔盐体系中是mo,w或者与所制备金属相同的材料。
另外,所述电解反应中的电解电压控制在高于maoh的实际分解电压且低于ma2co3的实际分解电压,或者高于ma2co3的实际分解电压且低于macl的实际分解电压,或者高于macl的实际分解电压。
另外,所述电解反应中的电解电压控制在2.4-2.6v。在实际生产过程中,2.4-2.6v的电解电压,既保证了电解的电流效率,提高了生产效率,又保证了在阳极释放唯一的气体副产物氧气,使过程具有绿色、环保的优点。
本发明中各成分之间“-”代表组成,如混合盐maoh-ma2co3-macl表示由maoh、ma2co3以及macl组成的混合盐。
本发明还提供了一种由上述制备方法制备得到的还原性熔盐介质。
有益效果:与现有技术相比,在本发明所述的还原性熔盐介质中制备金属材料具有如下优点:(1)使用maoh-ma2co3-macl作为碱金属ma的原材料,便于使用普通金属或合金取代价值昂贵的贵金属作为氧气惰性阳极材料,低的maoh理论分解电压有助于降低制备ma的电能消耗;(2)阳极产物氧气、水蒸汽与阴极产物碱金属ma完全隔开,避免了氧气及水蒸汽与活泼金属ma的逆反应;(3)使用“惰性阳极,maoh-na2co3-nacl(阳极电解质)|ma 离子固体导体|may-mey2(阴极电极质),惰性阴极”电解池克服了中国发明专利cn105274576b中电解后形成may-mey2-(ma)熔盐介质具有离子/电子混合传导的缺点,极大地提高了辅助电解的电流效率从而能实现高效制备ma还原剂;(4)阴极析出的ma具有极高的纯度;(5)与传统直接从熔盐介质表面加入ma然后朝下扩散进入熔盐介质主体的方法相比,阴极析出的ma容易直接熔解进入熔盐介质主体,减少了ma在熔盐介质表面的挥发、氧化损失;(6)通过放置惰性阴极在may-mey2熔盐介质熔剂中的不同位置,能使ma在熔盐介质熔剂内部任何需要的位置在阴极析出ma并就地熔入熔盐介质向其四周扩散,强化(ma)在介质中均匀化和热还原mo过程;(7)添加ma具有更精确的可控性,避免cn105274576b中ma缓慢熔解于熔盐介质和(ma)缓慢均匀化分布的缺点;(8)克服了传统外加ma过程中形成浮渣、烟气粉尘的缺点;(9)阳极释放的氧气和水蒸汽在常温下即自然分离,有价值氧气便成为唯一气体副产物,使过程具有绿色、环保的优点。
附图说明
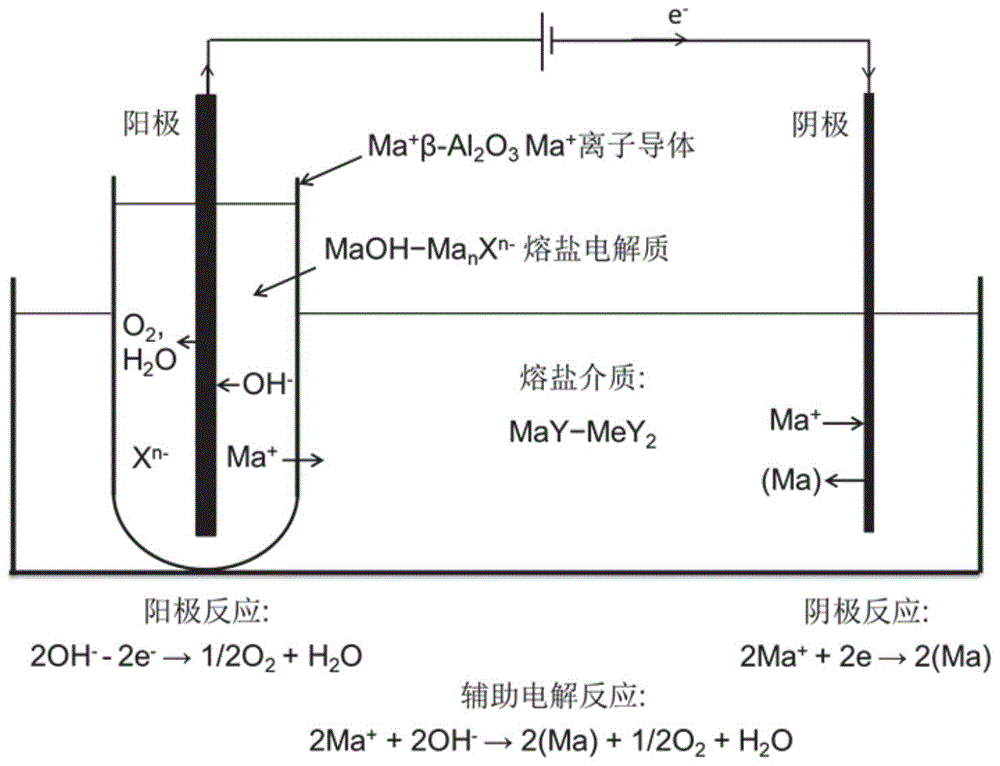
图1为本发明实施例所述的还原性熔盐介质的制备过程示意图。
具体实施方式
以下结合具体实施例来进一步解释本发明,但实施例对本发明不做任何形式的限定。
本发明采用一种电化学方法就地制备碱金属ma还原剂,该方法通过熔盐电解分解低共熔混合盐maoh-ma2co3-macl体系中maoh,ma2co3和macl。电解总反应分别由以下反应表示:
4(maoh)=4(ma) o2(g) 2h2o(2a)
2(ma2co3)=4ma o2(g) 2co2(g)(2b)
2(macl)=2ma cl2(g)(2c)
熔融的maoh中添加ma2co3和macl目的是为了能适当降低maoh在混合熔盐中的活度及熔盐的熔点。
还原性熔盐介质中碱金属ma热还原mo制备金属m由反应3表示:
mo 2(ma) mey2=m 2may (meo)(3)
其中,反应(3)中,(meo)是反应(3)的反应副产物,随后熔解于还原性may-mey2-(ma)熔盐介质中形成may-mey2-(ma)-(meo)介质。mey2也参与ma热还原mo反应,熔盐介质存在mey2使得反应3的
ma热还原mo过程中形成的熔盐介质may-mey2-(ma)-(mao)的氧位由(me)/(meo)热力学平衡控制,可用下列反应表达:
(me) 1/2o2(g)=(meo)(4)
may-mey2-(ma)-(mao)熔盐介质的平衡氧位由如下公式表示:
其中,
表1给出分别以maoh,ma2co3和mcl为原料制备ma在550℃下的热力学数据。
表1.以maoh,ma2co3和mcl为原料制备碱金属ma还原剂的热力学数据
从表1数据可知,反应(2)的标准自由能变化
(i)控制电解池电压在2.4-2.6v将发生反应2a,naoh被分解:阴极析出na,阳极释放o2(g)和h2o(g),
(ii)在约2.4-3.4v范围,反应2a和b同时发生,naoh和na2co3同时被分解:阴极析出na,阳极释放o2(g),h2o(g)和co2(g),
(iii)大于约3.5v时,反应2a、b和c将同时发生,naoh,na2co3和nacl同时被分解:阴极析出na,阳极释放o2(g),h2o(g),co2(g)和cl2(g)。
在以上些条件下进行熔盐电解时,可以连续加入相应损失量的盐以保持熔融的低熔点混合熔盐maoh-ma2co3-macl的成分基本不变。
表1中的热力学分析结果为本发明的碱金属ma还原剂的制备及ma热还原mo制备金属m提供了必要的理论依据。
本发明具体采用固体离子传导隔膜在电解支持下产出碱金属ma,ma然后就地熔解于熔盐介质熔剂may-mey2中形成还原性熔盐介质may-mey2-(ma)。采用的一种固体离子导体由阳离子传导。目前,工业上广泛应用的固体离子导体是na β-al2o3(na2o.11al2o3:约350-1200℃,na 传导)离子导体(j.inorg.nucl.chem.,1967,29,2453-2475),其主要应用在高温na-s电池和电化学传传感器(thesodiumsulphurbattery,chapmanandhall,london,1985;phil.trans.,1996,354,1595-1612)。文献已报逍:当na β-al2o3导体沉浸在熔融的其它碱金属氯化物、硝酸盐或者其混合盐中,na β-al2o3中的na 离子将与熔盐中的ma 离子进行离子交换,经过多次沉浸在新的熔盐中能制备出ma β-al2o3导体(j.inorg.nucl.chem.,1967,29,2453-2475;solidstateionics,1982,7,267-281)。
本发明采用该方法用容器形式的na β-al2o3导体就地制备ma β-al2o3导体。任何其它现有制备方法获得的ma β-al2o3导体同样能用在本发明中使用。
实施例1还原性熔盐介质的制备
本实施例以混合盐naoh-na2co3-nacl为原料,以混合物nacl-cacl2为熔盐介质熔剂;其中混合盐naoh-na2co3-nacl中naoh、na2co3以及nacl的质量比为2∶1∶1。混合物nacl-cacl2中nacl和cacl2的质量比为1∶2。
如图1所示,(1)将装有naoh-na2co3-nacl原料的na β-al2o3容器放入nacl-cacl2熔盐介质中,使na β-al2o3容器外部直接与nacl-cacl2熔盐介质相接触,并使得naoh-na2co3-nacl熔盐与熔融的nacl-cacl2熔盐介质熔剂完全隔离;(2)当na β-al2o3容器中的原料完成熔化形成熔融的naoh-na2co3-nacl熔盐后,在此熔盐中插入电子导体铁棒作为惰性阳极;在nacl-cacl2熔盐介质熔剂中插入不锈钢材质的电子导体棒作为惰性阴极;构成“惰性阳极,naoh-na2co3-nacl(阳极电解质)|na β-al2o3|nacl-cacl2(阴极电解质),惰性阴极”电解池;(3)在600℃下控制电解池电压在2.3-2.5v范围内,对电解池进行电解反应,即得所述的还原性熔盐介质。
该实施例以低共熔naoh-na2co3-nacl阳极电解质为金属钠还原剂的原料,在600℃时控制电解池电压在2.3-2.5v范围内,对图1所示的电解池惰性阳极和惰性阴极之间进行辅助电解,电化学分解naoh,而在2.3-2.5v条件下naoh-na2co3-nacl阳极电解质中的na2co3-nacl将不参与电极反应,起着电解质熔剂的作用。在阳极释放出氧气并产出水蒸汽,来自naoh的na 离子从na β-al2o3容器内壁穿过na β-al2o3容器隔膜进入容器外部的nacl-cacl2阴极电解质,并在惰性阴极上析出高纯液体na,na随之熔入阴极电解质中,形成强还原性的nacl-cacl2-(na)熔盐介质。
实施例2还原性熔盐介质的制备
本实施例以混合盐koh-k2co3-kcl为原料,以混合物kcl-cacl2为熔盐介质熔剂;其中混合盐koh-k2co3-kcl中koh、k2co3以及kcl的质量比为3∶1∶1。混合物kcl-cacl2中kcl和cacl2的质量比为2∶1。
如图1所示,(1)将koh-k2co3-kcl熔融形成koh-k2co3-kcl熔盐,放入k β-al2o3容器中;k β-al2o3容器外部直接与kcl-cacl2熔盐介质熔剂相接触,使得koh-k2co3-kcl熔盐与熔融的kcl-kcl2熔盐介质熔剂完全隔离;(2)在koh-k2co3-kcl熔盐中插入电子ni导体棒作为惰性阳极;在kcl-kcl2熔盐介质熔剂中插入不锈钢材质的电子导体棒作为惰性阴极;构成“惰性阳极,koh-k2co3-kcl(阳极电解质)|k β-al2o3|kcl-cacl2(阴极电解质),惰性阴极”电解池;(3)在650℃下控制电解池电压在2.3-2.5v范围内,对电解池进行电解反应,即得kcl-cacl2-(k)还原性熔盐介质。
实施例3还原性熔盐介质的制备
本实施例以混合盐lioh-li2co3-licl为原料,以混合物licl-cacl2为熔盐介质熔剂;其中混合盐lioh-li2co3-licl中lioh、li2co3以及licl的质量比为3∶1∶2。混合物licl-cacl2中licl和cacl2的质量比为1∶1.75。
如图1所示,(1)将lioh-li2co3-licl熔融形成lioh-li2co3-licl熔盐,放入li β-al2o3容器中;li β-al2o3容器外部直接与licl-cacl2熔盐介质熔剂相接触,使得lioh-li2c03-licl熔盐与熔融的licl-licl2熔盐介质熔剂完全隔离;(2)在lioh-li2co3-licl熔盐中插入电子导体铁棒作为惰性阳极;在licl-licl2熔盐介质熔剂中插入不锈钢材质的电子导体棒作为惰性阴极;构成“惰性阳极,lioh-li2co3-licl(阳极电解质)|li β-al2o3|licl-cacl2(阴极电解质),惰性阴极”电解池;(3)在550℃下控制电解池电压在2.9-3.0v范围内,对电解池进行电解反应,即得licl-cacl2-(li)还原性熔盐介质。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。