1.本发明涉及一种利用光催化和电催化的协同作用,由三取代硅氢生成相应硅基自由基的新方法,该方法目前尚未有文献报道。利用上述生成的硅基自由基,在光电协同作用下,通过串联反应一步构建硅基取代的苯并咪唑并异喹啉酮类化合物,该类化合物结构新颖,目前尚未有文献报道。因此,本发明利用光电化学的协同作用,首次合成了硅基取代的苯并咪唑并异喹啉酮类化合物,属于光化学合成和电化学合成领域。
背景技术:
2.苯并咪唑并异喹啉酮类化合物广泛存在于许多合成中间体、药物和有机材料中(okubo t.,yoshikawa r.and chaki s.,et al.design,synthesis,and structure
‑
activity relationships of novel tetracyclic compounds as peripheral benzodiazepine receptor ligands[j].bioorganic&medicinal chemistry,2004,12(13):3569
‑
3580)。不同空间位阻和取代基的有机硅化物在药物分子的设计、稳定性、溶解性和药代动力学方面具有独特的特性(ramesh r.and reddy d.s.quest for novel chemical entities through incorporation of silicon in drug scaffolds[j].journal of medicinal chemistry,2018,61(9):3779
‑
3798)。因此,将硅原子引入到药物分子中为药物的开发开创了一种新型的途径。考虑到苯并咪唑并异喹啉酮和有机硅化合物在药物开发中的重要作用,将二者进行有机的结合将会为药物化学的研究起到一定的促进作用。但是,将硅原子引入到苯并咪唑并异喹啉酮骨架中的方法目前还未有文献报道。因此,发展一种新型的合成方法,并用于硅基取代的苯并咪唑并异喹啉酮类化合物的高效合成,将为药物的发现和研发提供一种新的思路。
[0003]
传统的有机硅基团的引入依靠昂贵的过渡金属催化剂(如ir、ru等)和化学当量的氧化剂,诱导硅自由基前体化合物生成硅自由基,进而发生自由基反应制备硅基取代的化合物。目前,硅基取代的苯并咪唑并异喹啉酮类化合物的制备方法尚未见国内外文献报道。
技术实现要素:
[0004]
本发明的目的是提供一种铈盐催化,醇类化合物作为氢转移试剂,硅烷作为硅自由基的前体,光电协同催化合成硅基取代的苯并咪唑并异喹啉酮类化合物的方法,本发明操作简单,以清洁的电子代替化学氧化还原试剂,具有经济、绿色的显著优势。
[0005]
本发明提供的一种光电协同催化合成硅基取代的苯并咪唑并异喹啉酮类化合物的新方法,包括如下步骤:
[0006]
在单室电解池中分别加入2
‑
苯基苯并咪唑类化合物(ii)、硅烷(iii)、铈盐催化剂、支持电解质、h原子转移催化剂、溶剂,在铈盐催化剂、支持电解质、h原子转移催化剂存在条件下,进行恒流通电和光照共存下反应4
‑
12h即得到如式i所示的硅基取代的苯并咪唑并异喹啉酮类化合物。
[0007][0008]
其中,r1表示
‑
h、卤素,烷基;r2表示
‑
h、卤素、烷基、酯基、氰基、砜基或烷氧基;r3表示
‑
烷基或芳基;r4表示
‑
烷基或
‑
芳基;r5表示
‑
烷基或
‑
芳基;r6表示
‑
烷基或
‑
芳基。
[0009]
上述的方法中,所述光照和恒电流电解反应在溶剂存在时进行;
[0010]
所述铈盐催化剂选自卤化铈、硫酸铈、硝酸铈、三氟甲磺酸铈和草酸铈中的任一种;铈盐催化剂的用量优选为2
‑
苯基苯并咪唑类化合物(ii):铈盐催化剂的摩尔比为1:(0.02
‑
1);
[0011]
所述支持电解质选自四丁基氯化铵、四乙基氯化铵、四甲基氯化铵、六氟膦酸铵和四丁基四氟硼酸铵中的任一种;支持电解质的用量优选为2
‑
苯基苯并咪唑类化合物(ii):支持电解质的摩尔比为1:(0.5
‑
5);
[0012]
所述的h原子转移催化剂为醇,选自甲醇、乙醇、三氟乙醇、六氟异丙醇、三氯乙醇中的任一种;所述的醇优选为甲醇;优选h原子转移催化剂的用量:溶剂的体积比为1:(10
‑
100);
[0013]
所述的溶剂为乙腈、甲醇、n,n
‑
二甲基乙酰胺、二甲基亚砜、氯苯、乙腈和氯苯中的一种或几种,或乙腈和溴苯的的任意体积混合溶剂,或乙腈和二氯苯的任意体积混合溶剂,或乙腈和三氟甲基苯的任意体积混合溶剂,优选乙腈和氯苯的任意体积混合溶剂。优选硅烷:溶剂的体积比为1:(1
‑
100)。
[0014]
优选2
‑
苯基苯并咪唑类化合物(ii)在电解池混合溶液中的浓度为0.01
‑
0.1mol/l。
[0015]
所述的电解用的阳极为石墨片电极、石墨毡电极、铂网电极、铂片电极、铂碳电极,优选石墨毡电极;
[0016]
所述的电解用阴极为石墨片电极、石墨毡电极、铂网电极、铂片电极、镍片电极,泡沫镍电极、铁片电极、铜片电极或锌片电极,优选泡沫镍电极;
[0017]
反应的温度为20
‑
80℃,光照的波长为300nm
‑
460nm;电流密度为0
‑
10ma/cm2且不为0。
[0018]
本发明中,所述光电协同催化反应的后处理采用本领域公知的常用方法。
[0019]
本发明具有以下优点:
[0020]
(1)本发明方法采用利用光电协同催化,首次合成了硅基取代的苯并咪唑并异喹啉酮类化合物。
[0021]
(2)本发明方法利用地壳中含量第二丰富的铈盐作为电催化剂,诱导硅自由基的生成,以前未有文献报道。
[0022]
(3)本发明方法所使用的工作电极是便宜的石墨片,石墨毡等,使得合成成本大大降低。
[0023]
(4)本发明方法使用清洁的电子作为氧化剂,代替有毒有害的化学氧化剂,反应过后“三废”排放低,是清洁生产的一个典型案例。
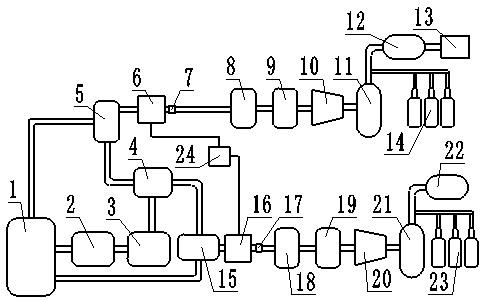
附图说明
[0024]
图1为本发明光电协同铈盐催化合成硅基取代的苯并咪唑并异喹啉酮类化合物的反应流程图。
具体实施方式
[0025]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0026]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下面结合实施例对本发明作进一步说明,但本发明并不限于以下实施例。
[0027]
实施例1:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0028]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:66%。
[0029][0030]
white solid,66%,m.p.87.2
‑
87.9℃.1h nmr(400mhz,cdcl3)δ8.49(dt,j=7.8,1.1hz,1h),8.44
‑
8.35(m,1h),7.89
‑
7.81(m,1h),7.61
‑
7.54(m,2h),7.48(dddd,j=15.8,6.7,5.2,2.0hz,3h),1.89(d,j=14.8hz,1h),1.81(s,3h),1.51(d,j=14.7hz,1h),0.68(t,j=7.9hz,9h),0.20
‑‑
0.03(m,6h).
13
c nmr(100mhz,cdcl3)δ173.7,149.99,144.0,143.3,131.6,131.4,127.7,126.8,125.9,125.8,125.6,121.8,119.7,115.8,46.8,33.8,27.1,7.0,3.4.hrms(esi)calcd for c
23
h
29
n2osi
:377.2044,found:377.2038.
[0031]
实施例2:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0032]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨片(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除
去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:43%。
[0033]
实施例3:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0034]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为镍片(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:44%。
[0035]
实施例4:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0036]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.2ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:56%。
[0037]
实施例5:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0038]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将440nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:49%。
[0039]
实施例6:5
‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0040]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将白光(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:31%。
[0041]
实施例7:5
‑
((乙基二甲基硅基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0042]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、乙基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:41%。
[0043][0044]
white solid,41%,m.p.103.1
‑
103.4℃.1h nmr(400mhz,cdcl3)δ8.51(d,j=7.8hz,1h),8.47
‑
8.33(m,1h),7.86(d,j=7.3hz,1h),7.63
‑
7.53(m,2h),7.56
‑
7.41(m,3h),1.90(d,j=14.7hz,1h),1.81(s,3h),1.52(d,j=14.7hz,1h),0.71(t,j=7.9hz,3h),0.09(p,j=7.7hz,2h),
‑
0.44(s,3h),
‑
0.51(s,3h).
13
c nmr(100mhz,cdcl3)δ173.4,149.8,144.1,143.1,131.6,131.4,127.7,126.9,125.9,125.6,121.8,119.8,115.8,46.9,33.7,30.2,7.3,7.0,
‑
3.4,
‑
3.5.hrms(apci)calcd for c
21
h
25
n2osi
:349.1731,found:349.1726.
[0045]
实施例8:5
‑
((叔丁基二甲基硅基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0046]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、叔丁基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl
(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:81%。
[0047][0048]
fused solid,81%.1h nmr(400mhz,cdcl3)δ8.61(d,j=7.8hz,1h),8.52
‑
8.35(m,1h),7.91(d,j=7.3hz,1h),7.68
‑
7.57(m,1h),7.57
‑
7.47(m,4h),1.97(d,j=14.7hz,1h),1.82(s,3h),1.52(d,j=14.7hz,1h),0.81(s,9h),
‑
0.53(s,3h),
‑
0.72(s,3h).
13
c nmr(100mhz,cdcl3)δ173.6,149.8,144.0,143.1,131.6,131.4,127.7,127.0,125.9,125.6,121.9,119.7,115.8,46.9,34.7,26.5,26.1,16.4,
‑
5.6,
‑
6.3.hrms(apci)calcd for c
23
h
29
n2osi
:377.2044,found:377.2037.
[0049]
实施例9:5
‑
((苄基二甲基硅基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0050]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、苄基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:59%。
[0051][0052]
fused solid,59%.1h nmr(400mhz,cdcl3)δ8.52(dd,j=7.7,1.6hz,1h),8.45
‑
8.35(m,1h),7.91
‑
7.81(m,1h),7.53(ddd,j=15.8,7.6,1.6hz,2h),7.49
‑
7.45(m,3h),7.16(dd,j=8.1,6.9hz,2h),7.11
‑
7.01(m,1h),6.89
‑
6.78(m,2h),1.96(d,j=14.7hz,1h),1.81(s,3h),1.77(s,2h),1.54(d,j=14.7hz,1h),
‑
0.42(s,3h),
‑
0.56(s,3h).
13
cnmr(100mhz,cdcl3)δ173.7,149.7,144.1,143.0,139.3,131.7,131.4,128.1,128.1,127.8,
126.8,126.0,125.7,124.1,121.8,119.8,115.7,47.0,33.9,29.9,26.0,
‑
3.0,
‑
3.2.hrms(apci)calcd for c
26
h
27
n2osi
:411.1887,found:411.1878.
[0053]
实施例10:5
‑
甲基
‑5‑
((三丙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0054]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三丙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:41%。
[0055][0056]
white solid,66%,m.p.59.7
‑
59.9℃.1h nmr(400mhz,cdcl3)δ8.53
‑
8.46(m,1h),8.45
‑
8.35(m,1h),7.95
‑
7.81(m,1h),7.60
‑
7.53(m,2h),7.50(ddd,j=8.4,6.3,2.1hz,1h),7.47
‑
7.43(m,2h),1.84(d,j=16.2hz,4h),1.48(d,j=14.7hz,1h),1.02(ddtd,j=18.5,13.8,7.1,6.7,5.4hz,6h),0.65(t,j=7.2hz,9h),0.14
‑‑
0.13(m,6h).
13
c nmr(100mhz,cdcl3)δ173.7,149.8,144.1,143.2,131.5,131.4,127.7,126.8,125.8,125.8,125.5,121.9,119.7,115.8,46.8,33.3,28.6,18.3,17.0,15.3.hrms(apci)calcd for c
26
h
35
n2osi
:419.2513,found:419.2501.
[0057]
实施例11:5
‑
甲基
‑5‑
((三丁基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮酮的光电化学合成
[0058]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三丁基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:47%。
[0059][0060]
white solid,47%,m.p.49.5
‑
49.9℃.1h nmr(400mhz,cdcl3)δ8.61
‑
8.46(m,1h),8.46
‑
8.35(m,1h),7.95
‑
7.80(m,1h),7.58
‑
7.54(m,2h),7.49(ddd,j=8.3,5.3,3.0hz,1h),7.47
‑
7.43(m,2h),1.86(d,j=14.7hz,1h),1.83(s,3h),1.49(d,j=14.7hz,1h),1.05
‑
0.80(m,11h),0.69(t,j=6.9hz,9h),0.10
‑‑
0.08(m,6h).
13
c nmr(100mhz,cdcl3)δ173.7,149.8,144.0,143.3,131.6,131.4,127.7,126.9,125.9,125.8,125.5,121.8,119.7,115.8,46.8,33.4,28.7,26.6,26.0,13.5,12.3.hrms(apci)calcd for c
29
h
41
n2osi
:461.2983,found:461.2976.
[0061]
实施例12:5
‑
((二甲基(苯基)硅基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0062]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、二甲基苯基(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:67%。
[0063][0064]
white solid,67%,m.p.65.3
‑
65,9℃.1h nmr(400mhz,cdcl3)δ8.47
‑
8.38(m,1h),8.13(dt,j=7.9,0.9hz,1h),7.77(dt,j=8.0,1.0hz,1h),7.54
‑
7.44(m,3h),7.41(dd,j=7.8,1.3hz,1h),7.35(td,j=7.7,1.2hz,1h),7.07
‑
6.98(m,2h),6.93
‑
6.79(m,3h),2.16(d,j=14.7hz,1h),1.76(s,3h),1.70(d,j=14.8hz,1h),0.01(s,3h),
‑
0.18(s,3h).
13
c nmr(100mhz,cdcl3)δ173.2,149.5,143.8,142.5,136.2,133.1,131.4,131.1,128.5,127.7,127.2,127.0,125.7,125.6,125.1,121.9,119.4,115.8,46.9,33.9,31.0,
‑
2.1,
‑
2.9.hrms(apci)calcd for c
25
h
25
n2osi
:397.1731,found:397.1726.
[0065]
实施例13:5
‑
甲基
‑5‑
((甲基二苯基硅基)甲基)苯并[4,5]咪唑[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0066]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、甲基二苯基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:49%。
[0067][0068]
white solid,49%,m.p.49.2
‑
49.7℃.1h nmr(400mhz,cdcl3)δ8.39(dd,j=7.0,1.9hz,1h),8.07(dt,j=7.9,0.9hz,1h),7.75(dt,j=8.0,0.9hz,1h),7.49(dtd,j=14.0,6.5,6.0,4.3hz,3h),7.41(td,j=7.7,1.3hz,1h),7.38
‑
7.30(m,3h),7.34
‑
7.24(m,1h),7.26
‑
7.17(m,2h),7.10
‑
6.99(m,2h),6.92
‑
6.74(m,3h),2.57(d,j=14.8hz,1h),2.00(d,j=14.8hz,1h),1.80(s,3h),0.06(s,3h).
13
c nmr(100mhz,cdcl3)δ173.1,149.3,142.3,136.2,134.2,134.2,131.5,129.2,128.8,127.8,127.7,127.2,127.1,125.8,125.6,125.1,119.3,115.9,46.9,34.4,28.7,
‑
3.72.hrms(esi)calcd for c
30
h
27
n2osi
:459.1887,found:459.1881.
[0069]
实施例14:5
‑
甲基
‑5‑
((三苯基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0070]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三苯基硅烷(6mmol)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:73%。
[0071][0072]
fused solid,73%.1h nmr(400mhz,cdcl3)δ8.28(dd,j=7.9,1.4hz,1h),8.19
‑
8.11(m,1h),7.81
‑
7.68(m,1h),7.57
‑
7.44(m,1h),7.45
‑
7.28(m,10h),7.26(td,j=7.7,1.5hz,1h),7.22
‑
7.05(m,10h),2.92(d,j=15.2hz,1h),2.48(d,j=15.2hz,1h),1.75(s,3h).
13
c nmr(100mhz,cdcl3)δ173.5,149.5,143.6,142.1,135.7,133.6,131.3,131.2,
129.2,127.6,127.5,127.0,125.7,125.4,125.0,122.5,119.4,115.7,47.8,36.6,24.0.hrms(apci)calcd for c
35
h
29
n2osi
:521.2044,found:521.2037.
[0073]
实施例15:5
‑
((4
‑
(二甲基硅基)苯基)二甲基硅基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0074]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、4
‑
(二甲基硅基)苯基)二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:39%。
[0075][0076]
fused solid,39%.1h nmr(400mhz,cdcl3)δ8.41(dt,j=7.3,1.2hz,1h),8.11(dt,j=7.9,0.9hz,1h),7.77(dt,j=7.9,1.0hz,1h),7.48(dddd,j=11.0,7.3,4.5,1.7hz,3h),7.41(td,j=7.6,1.3hz,1h),7.35(td,j=7.7,1.3hz,1h),7.14
‑
7.03(m,2h),7.03
‑
6.96(m,2h),4.18(p,j=3.8hz,1h),2.17(d,j=14.7hz,1h),1.75(s,3h),1.70(d,j=14.8hz,1h),0.20(dd,j=3.8,2.6hz,6h),0.03(s,3h),
‑
0.17(s,3h).
13
c nmr(100mhz,cdcl3)δ173.3,143.8,142.6,138.1,137.3,132.7,132.6,131.4,131.1,127.7,127.0,125.8,125.3,122.0,119.6,115.7,46.9,34.1,30.7,
‑
2.1,
‑
2.8,
‑
4.0,
‑
4.1.
13
c nmr(100mhz,cdcl3)δ173.3,149.5,143.8,142.6,136.1,17.3,132.7,132.6,131.4,131.1,127.7,127.0,125.8,125.7,125.3,122.0,119.6,115.7,46.9,34.1,30.7,
‑
2.1,
‑
2.8,
‑
4.0,
‑
4.1.hrms(apci)calcd for c
27
h
31
n2osi
2
:455.1969,found:455.1959.
[0077]
实施例16:5
‑
((1,1,1,3,3,3
‑
六甲基
‑2‑
(三甲基硅基)三硅烷
‑2‑
基)甲基)
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0078]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三(三甲基硅基)硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解
后柱层析分离得到目标产物。收率:72%。
[0079][0080]
white solid,72%,m.p.119.2
‑
119.7℃.1h nmr(400mhz,cdcl3)δ8.52(dd,j=7.8,1.4hz,1h),8.44
‑
8.35(m,1h),7.93
‑
7.81(m,1h),7.61(ddd,j=8.4,7.1,1.5hz,1h),7.58
‑
7.49(m,2h),7.52
‑
7.40(m,2h),2.20(d,j=14.6hz,1h),1.84(d,j=14.6hz,1h),1.72(s,3h),0.00(s,27h).
13
c nmr(100mhz,cdcl3)δ173.2,149.7,143.4,132.4,131.2,128.0,126.5,125.9,125.7,122.2,119.6,115.7,49.3,37.3,19.8,1.24.hrms(apci)calcd for c
26
h
41
n2osi
4
:509.2290,found:509.2285.
[0081]
实施例17:5,9,10
‑
三甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0082]
在单室电解池中分别加入原料1
‑
(5,6
‑
二甲基
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(5,6
‑
二甲基
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:52%。
[0083][0084]
fused solid,52%.1h nmr(400mhz,cdcl3)δ8.46(d,j=7.7hz,1h),8.17(s,1h),7.61(s,1h),7.54(d,j=2.8hz,2h),7.48(td,j=5.3,2.5hz,1h),2.45(s,3h),2.44(s,3h),1.89(d,j=14.7hz,1h),1.79(s,3h),1.50(d,j=14.7hz,1h),0.68(t,j=7.9hz,9h),0.20
‑‑
0.04(m,6h).
13
c nmr(100mhz,cdcl3)δ173.6,149.1,13.1,134.9,134.8,131.2,129.7,127.6,126.8,125.7,119.9,116.0,46.7,33.9,26.9,20.6,20.5,7.1,3.4.hrms(apci)calcd for c
25
h
32
n2osi
:405.2357,found:405.2350.
[0085]
实施例18:9,10
‑
二氯
‑5‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0086]
在单室电解池中分别加入原料1
‑
(5,6
‑
二氯
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约
3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(5,6
‑
二氯
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:55%。
[0087][0088]
white solid,55%,m.p.81,3
‑
81.5℃.1h nmr(400mhz,cdcl3)δ8.52(s,1h),8.45(dd,j=7.8,1.4hz,1h),7.92(s,1h),7.66
‑
7.47(m,3h),1.88(d,j=14.8hz,1h),1.81(s,3h),1.52(d,j=14.8hz,1h),0.68(t,j=7.9hz,9h),0.22
‑‑
0.09(m,6h).
13
c nmr(150mhz,cdcl3)δ173.5,151.4,43.5,143.5,132.2,130.4,130.0,129.4,27.9,126.9,126.1,121.1,120.9,117.1,46.9,33.8,27.1,7.0,3.4.hrms(esi)calcd for c
23
h
23
cl2n2osi
:445.1264,found:445.1257.
[0089]
实施例19:9,10
‑
二氟
‑5‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的的光电化学合成
[0090]
在单室电解池中分别加入原料1
‑
(5,6
‑
二氟
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、二甲基叔丁基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(5,6
‑
二氟
‑2‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:69%。
[0091][0092]
white solid,69%,m.p.157.2
‑
157.6℃.1h nmr(400mhz,cdcl3)δ8.44(dd,j=7.8,1.5hz,1h),8.24(dd,j=9.8,7.4hz,1h),7.64
‑
7.58(m,2h),7.56
‑
7.48(m,2h),1.95(d,j=14.7hz,1h),1.81(s,3h),1.51(d,j=14.6hz,1h),0.80(s,9h),
‑
0.55(s,3h),
‑
0.73(s,3h).
13
c nmr(100mhz,cdcl3)δ173.5,151.2(d,j=3.0hz),150.6(dd,j=47.5,3.0hz),148.1(dd,j=43.4,21.2hz),142.9,141.7,139.8(dd,j=10.1,2.0hz),131.9,127.9,127.1,125.8,121.4,107.6(d,j=20.2hz),104.5(d,j=24.2hz),46.9,34.6,26.5,26.1,16.4,
‑
5.6,
‑
6.3.
19
f nmr(376mhz,cdcl3)δ
‑
138.0(d,j=22.6hz),
‑
138.3(d,j=18.8hz)
.hrms(apci)calcd for c
23
h
27
f2n2osi
:413.1855,found:413.1849.
[0093]
实施例20:3,5
‑
二甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0094]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
(对甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
(对甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:64%。
[0095][0096]
fused solid,64%.1h nmr(400mhz,cdcl3)δ8.45
‑
8.32(m,2h),7.99
‑
7.74(m,1h),7.56
‑
7.35(m,2h),7.35
‑
7.30(m,2h),2.49(s,3h),1.96(d,j=14.6hz,0h),1.79(s,3h),1.50(d,j=14.6hz,1h),0.81(s,9h),0.56(s,3h),
‑
0.53(s,1h),
‑
0.70(s,3h).
13
cnmr(150mhz,cdcl3)δ173.9,150.1,143.3,142.2,131.4,128.8,127.3,125.9,125.8,125.3,119.5,115.7,46.8,33.9,26.8,21.9,7.0,3.4.hrms(esi)calcd for c
24
h
31
n2osi
:391.2200,found:391.2200.
[0097]
实施例21:5
‑
((叔丁基二甲基硅基)甲基)
‑
3,5
‑
二甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0098]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
(对甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、叔丁基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
(对甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:61%。
[0099]
[0100]
white solid,61%,m.p.86.8
‑
86.9℃.1h nmr(400mhz,cdcl3)δ8.49
‑
8.34(m,1h),7.84(dd,j=6.9,2.0hz,1h),7.57
‑
7.40(m,2h),7.39
‑
7.30(m,2h),2.49(s,3h),1.88(d,j=14.7hz,1h),1.80(s,3h),1.53(s,1h),0.69(t,j=7.9hz,9h),0.07(ddq,j=38.5,15.0,7.7hz,6h).
13
c nmr(150mhz,cdcl3)δ169.0,145.3,139.4,138.3,137.3,126.7,124.0,122.8,121.1,121.0,120.5,114.8,114.5,111.0,42.2,30.0,21.4,21.4,17.1,11.7,
‑
10.3,
‑
11.0.hrms(apci)calcd for c
24
h
31
n2osi
:391.2200,found:391.2195.
[0101]
实施例22:5
‑
((叔丁基二甲基硅基)甲基)
‑
1,5
‑
二甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0102]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
(邻甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、叔丁基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
(邻甲苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:64%
[0103][0104]
white solid,64%,m.p.87.2
‑
87.4℃.1h nmr(400mhz,cdcl3)δ8.51
‑
8.40(m,1h),8.01
‑
7.84(m,1h),7.48
‑
7.41(m,4h),7.33(dd,j=6.5,2.4hz,1h),3.09(s,3h),1.96(d,j=14.6hz,1h),1.80(s,3h),1.50(d,j=14.7hz,1h),0.81(s,9h),
‑
0.53(s,3h),
‑
0.70(s,3h).
13
c nmr(100mhz,cdcl3)δ173.8,150.1,144.2,144.2,139.6,130.9,130.6,130.3,125.6,125.0,120.6,120.0,115.9,46.8,35.1,26.8,26.2,24.7,16.5,
‑
5.5,
‑
6.3.hrms(apci)calcd for c
24
h
31
n2osi
:391.2200,found:391.2194.
[0105]
实施例23:5
‑
((叔丁基二甲基硅基)甲基)
‑3‑
甲氧基
‑5‑
甲基苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0106]
在单室电解池中分别加入原料1
‑
(2
‑
(4
‑
甲氧基苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、叔丁基二甲基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(2
‑
(4
‑
甲氧基苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用
水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:76%。
[0107][0108]
fused solid,76%.1h nmr(400mhz,cdcl3)δ8.44(d,j=8.7hz,1h),8.39
‑
8.35
[0109]
(m,1h),7.91
‑
7.71(m,1h),7.43(ddd,j=8.6,7.4,1.5hz,2h),7.06(dd,j=8.7,2.4hz,1h),7.00(d,j=2.4hz,1h),3.94(s,3h),1.96(d,j=14.7hz,1h),1.79(s,3h),1.46(d,j=14.6hz,1h),0.82(s,9h),
‑
0.50(s,3h),
‑
0.64(s,3h).
13
c nmr(100mhz,cdcl3)δ173.7,162.4,150.0,145.2,131.3,127.9,125.8,125.1,119.3,115.6,113.6,112.5,55.6,47.1,34.9,26.3,26.2,16.5,
‑
5.4,
‑
6.2.hrms(apci)calcd for c
24
h
31
n2o2si
:407.2149,found:407.2148.
[0110]
实施例24:3
‑
(烯丙基氧基)
‑5‑
甲基
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0111]
在单室电解池中分别加入原料1
‑
(2
‑
(4
‑
(烯丙基氧基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(2
‑
(4
‑
(烯丙基氧基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:67%。
[0112][0113]
fused solid,67%.1h nmr(400mhz,cdcl3)δ8.42(dd,j=8.9,5.2hz,1h),8.36(dd,j=7.4,1.7hz,1h),7.80(dd,j=7.3,1.6hz,1h),7.49
‑
7.36(m,2h),7.11
‑
7.01(m,2h),6.11(ddt,j=17.3,10.5,5.3hz,1h),5.49(dq,j=17.2,1.6hz,1h),5.38(dt,j=10.5,1.5hz,1h),4.68(ddt,j=4.9,3.1,1.5hz,2h),1.88(d,j=14.7hz,1h),1.79(s,3h),1.45(d,j=14.7hz,1h),0.70(t,j=7.9hz,9h),0.10(tq,j=15.0,7.7hz,6h).
13
cnmr(150mhz,cdcl3)δ173.7,161.5,150.0,145.5,144.2,132.6,131.4,127.8,125.7,125.0,119.4,118.2,115.6,114.9,114.3,113.2,69.0,47.0,33.8,27.2,7.0,3.5.hrms(esi)calcd for c
26
h
33
n2o2si
:433.2306,found:433.2300.
[0114]
实施例25:5
‑
甲基
‑5‑
((三乙基硅基)甲基)
‑
2,3
‑
二氢苯并[4,5]咪唑并[2,1
‑
a]呋喃[3,2
‑
g]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0115]
在单室电解池中分别加入原料1
‑
(2
‑
(2,3
‑
二氢苯并呋喃
‑6‑
基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料1
‑
(2
‑
(2,3
‑
二氢苯并呋喃
‑6‑
基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)
‑2‑
甲基丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:61%。
[0116][0117]
fused solid,61%.1h nmr(400mhz,cdcl3)δ8.39
‑
8.29(m,2h),7.78(dd,j=7.4,1.5hz,1h),7.51
‑
7.34(m,2h),6.91(s,1h),4.72(td,j=8.7,2.3hz,2h),3.43
‑
3.30(m,2h),1.86(d,j=14.8hz,1h),1.76(s,3h),1.44(d,j=14.7hz,1h),0.70(t,j=7.9hz,9h),0.24
‑
0.01(m,6h).
13
c nmr(100mhz,cdcl3)δ173.8,163.6,150.4,145.1,131.3,127.8,125.7,124.9,122.6,119.2,115.6,107.2,72.2,47.2,34.0,28.9,27.0,7.1,3.5.hrms(apci)calcd for c
25
h
31
n2o2si
:419.2149,found:419.2142.
[0118]
实施例26:5
‑
甲基
‑3‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧苯甲醛
‑2‑
基)
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0119]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
(4
‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧苯并呋喃
‑2‑
基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
(4
‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧苯并呋喃
‑2‑
基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:59%。
[0120]
[0121]
fused solid,59%.1h nmr(400mhz,cdcl3)δ8.49(s,1h),8.40(dd,j=7.3,2.0hz,1h),8.00(s,1h),7.98
‑
7.91(m,1h),7.92
‑
7.81(m,1h),7.50
‑
7.37(m,2h),1.89(d,j=14.8hz,1h),1.83(s,3h),1.64(d,j=14.8hz,1h),1.41(s,6h),1.39(s,6h),0.68(t,j=7.9hz,9h),0.33
‑
0.04(m,3h),0
‑‑
0.09(m,3h).
13
c nmr(100mhz,cdcl3)δ173.9,149.8,142.3,133.7,133.3,131.5,125.9,125.7,124.9,123.8,119.8,115.8,84.3,47.0,34.0,26.1,25.1,24.6,7.0,3.4.hrms(apci)calcd for c
24
h
40
bn2o3si
:503.2896,found:503.2895.
[0122]
实施例27:5
‑
甲基
‑6‑
氧代
‑5‑
((三乙基硅基)甲基)
‑
5,6
‑
二氢苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑3‑
羧酸甲酯的光电化学合成
[0123]
在单室电解池中分别加入原料4
‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸甲酯(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料4
‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸甲酯消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:65%。
[0124][0125]
white solid,65%,m.p.86.3
‑
86.6℃.1h nmr(400mhz,cdcl3)δ8.56(d,j=8.2hz,1h),8.46
‑
8.37(m,1h),8.25(d,j=1.5hz,1h),8.15(dd,j=8.2,1.6hz,1h),7.96
‑
7.83(m,1h),7.68
‑
7.39(m,2h),4.01(s,3h),1.92(d,j=14.8hz,1h),1.84(s,3h),1.58(d,j=14.8hz,1h),0.67(t,j=7.9hz,9h),0.19
‑‑
0.07(m,6h).
13
c nmr(150mhz,cdcl3)δ173.2,166.1,148.7,144.0,143.4,132.5,131.4,128.6,128.4,126.2,126.1,125.9,120.1,115.8,52.6,47.0,33.7,26.7,7.0,6.9,3.4.hrms(esi)calcd for c
25
h
31
n2o3si
:435.2098,found:435.2090.
[0126]
实施例28:5
‑
甲基
‑3‑
(甲基磺酰基)
‑5‑
((三乙基硅基)甲基)苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑
6(5h)
‑
酮的光电化学合成
[0127]
在单室电解池中分别加入原料2
‑
甲基
‑1‑
(2
‑
(4
‑
(甲磺酰基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
甲基
‑1‑
(2
‑
(4
‑
(甲磺酰基)苯基)
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至
(5h)
‑
酮的光电化学合成
[0135]
在单室电解池中分别加入原料2
‑
苯基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
苯基
‑1‑
(2
‑
苯基
‑
1h
‑
苯并[d]咪唑
‑1‑
基)丙
‑2‑
烯
‑1‑
酮消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:35%。
[0136][0137]
fused solid,35%.1h nmr(400mhz,cdcl3)δ8.55(dd,j=7.7,1.6hz,1h),8.35
‑
8.21(m,1h),8.02
‑
7.77(m,1h),7.58
‑
7.38(m,3h),7.21
‑
7.14(m,1h),2.51(d,j=14.1hz,1h),1.86(d,j=14.1hz,1h),0.72(t,j=7.9hz,9h),0.27
‑‑
0.04(m,6h).
13
c nmr(150mhz,cdcl3)δ171.7,149.9,145.4,144.2,143.2,131.7,131.5,129.3,128.7,128.0,127.5,127.1,125.9,125.7,125.6,122.8,119.8,115.9,54.6,24.0,7.1,3.5.hrms(esi)calcd for c
28
h
31
n2osi
:439.2200,found:439.2195.
[0138]
实施例31:(1r,2s,5s)
‑2‑
异丙基
‑5‑
甲基环己基
‑5‑
甲基
‑6‑
氧代
‑5‑
((三乙基硅基)甲基)
‑
5,6
‑
二氢苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑3‑
羧酸酯的光电化学合成
[0139]
在单室电解池中分别加入原料(1r,2s,5s)
‑2‑
异丙基
‑5‑
甲基环己基
‑4‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料(1r,2s,5s)
‑2‑
异丙基
‑5‑
甲基环己基
‑4‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:64%。
[0140]
[0141]
fused solid,64%.1h nmr(400mhz,cdcl3)δ8.56(d,j=8.2hz,1h),8.46
‑
8.37(m,1h),8.24(dd,j=5.9,1.5hz,1h),8.18
‑
8.09(m,1h),7.97
‑
7.84(m,1h),7.63
‑
7.41(m,3h),5.03(tdd,j=10.9,4.4,1.7hz,1h),2.23
‑
2.12(m,1h),1.92(dd,j=14.9,1.4hz,1h),1.84(d,j=2.8hz,3h),1.81
‑
1.75(m,3h),1.68
‑
1.54(m,3h),1.18(dddd,j=14.3,11.9,7.7,3.5hz,2h),1.04
‑
0.93(m,7h),0.84(dd,j=7.1,4.2hz,4h),0.68(td,j=7.9,2.3hz,9h),0.25
‑‑
0.09(m,6h).
13
c nmr(150mhz,cdcl3)δ173.3,173.3,165.1,148.8,144.1,143.3,133.3,128.5,128.4,128.3,128.2,126.1,126.1,125.9,120.1,115.8,75.6,75.6,47.3,47.3,47.1,47.1,41.0,34.3,33.9,33.8,31.5,31.5,26.9,26.7,26.5,26.4,23.9,23.6,22.0,20.8,20.7,16.8,16.4,7.0,3.5,3.5.hrms(apci)calcd for c
34
h
47
n2o3si
:559.3350,found:559.3344.
[0142]
实施例32:2
‑
((1r,5s)
‑
6,6
‑
二甲基双环[3.1.1]庚
‑2‑
烯
‑2‑
基)乙基5
‑
甲基
‑6‑
氧代
‑5‑
((三乙基硅基)甲基)
‑
5,6
‑
二氢苯并[4,5]咪唑并[2,1
‑
a]异喹啉
‑3‑
羧酸酯的光电化学合成
[0143]
在单室电解池中分别加入原料2
‑
((1r,5s)
‑
6,6
‑
二甲基双环[3.1.1]庚
‑2‑
烯
‑2‑
基)乙基4
‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料2
‑
((1r,5s)
‑
6,6
‑
二甲基双环[3.1.1]庚
‑2‑
烯
‑2‑
基)乙基4
‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:46%。
[0144][0145]
fused solid,46%.1h nmr(400mhz,cdcl3)δ8.56(d,j=8.2hz,1h),8.48
‑
8.39(m,1h),8.25(d,j=1.4hz,1h),8.13(dd,j=8.2,1.5hz,1h),7.94
‑
7.84(m,1h),7.64
‑
7.38(m,2h),5.49
‑
5.35(m,1h),4.62
‑
4.31(m,2h),2.58
‑
2.47(m,2h),2.43(dt,j=8.5,5.6hz,1h),2.33
‑
2.25(m,1h),2.22
‑
2.12(m,2h),1.92(d,j=14.8hz,1h),1.84(s,3h),1.78(dd,j=3.0,1.3hz,1h),1.56(d,j=14.8hz,1h),1.32(s,3h),1.22(d,j=8.5hz,1h),0.89(s,3h),0.67(t,j=7.9hz,9h),0.05(ddt,j=32.3,15.0,7.6hz,6h).
13
c nmr(150mhz,cdcl3)δ173.3,165.5,148.8,144.1,144.1,143.4,132.9,131.5,128.5,128.3,126.1,126.1,125.9,125.5,120.1,119.1,115.8,63.8,63.7,47.0,45.8,45.8,40.8,38.1,36.1,33.6,31.7,31.4,26.9,26.3,21.2,7.0,3.5.hrms(apci)calcd for c
35
h
45
n2o3si
:569.3194,found:569.3189.
[0146]
实施例33:(3ar,5r,6s,6ar)
‑5‑
((r)
‑
2,2
‑
二甲基
‑
1,3
‑
二氧戊环
‑4‑
基)
‑
2,2
‑
二甲基四氢呋喃[2,3
‑
d][1,3]二氧戊环
‑6‑
基5
‑
甲基
‑6‑
氧代
‑5‑
((三乙基硅基)甲基)
‑
5,6
‑
二氢苯并[4,5]咪唑[2,1
‑
a]异喹啉
‑3‑
羧酸酯的光电化学合成
[0147]
在单室电解池中分别加入原料(3ar,5r,6s,6ar)
‑5‑
((r)
‑
2,2
‑
二甲基
‑
1,3
‑
二氧杂环
‑4‑
基)
‑
2,2
‑
二甲基四氢呋喃[2,3
‑
d][1,3]二氧杂环
‑6‑
基
‑4‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯(0.3mmol)、三乙基硅烷(1ml)、cecl3·
7h2o(0.06mmol,20mol%)、n
‑
bu4ncl(0.3mmol)和meoh(0.1ml)。以乙腈:氯苯=1:1(v/v,5.0ml)为溶剂,阳极为石墨毡(1.0
×
1.0cm2)、阴极为泡沫镍(1.0
×
1.0cm2)。将390nm的leds(20w)放置于反应电解池约3cm处。在50℃水浴条件下搅拌通电,电流密度为2ma/cm2,同时光照进行反应,tlc检测反应的进程。当tlc检测原料(3ar,5r,6s,6ar)
‑5‑
((r)
‑
2,2
‑
二甲基
‑
1,3
‑
二氧杂环
‑4‑
基)
‑
2,2
‑
二甲基四氢呋喃[2,3
‑
d][1,3]二氧杂环
‑6‑
基
‑4‑
(1
‑
甲基丙烯酰
‑
1h
‑
苯并[d]咪唑
‑2‑
基)苯甲酸酯消失后停止光照和通电,停止反应。将反应体系和dcm清洗阳极和阴极的液体至50ml茄型瓶中,减压旋蒸除去dcm和反应溶剂中的乙腈,并尽可能的除去高沸点溶剂氯苯。之后先用水泵、后用油泵减压蒸馏除去反应体系中的氯苯和硅烷。减压蒸馏完毕后,茄型瓶中的固体加dcm溶解后柱层析分离得到目标产物。收率:46%。
[0148][0149]
fused solid,46%.1h nmr(400mhz,cdcl3)δ8.57(d,j=8.2hz,1h),8.43
‑
8.38(m,1h),8.24(d,j=1.5 hz,1h),8.09(dt,j=8.2,1.8 hz,1h),7.94
‑
7.79(m,1h),7.60
‑
7.43(m,2h),6.02(dd,j=16.6,3.8 hz,1h),5.59(td,j=5.3,2.7 hz,1h),4.69(dd,j=6.4,3.8 hz,1h),4.54
‑
4.30(m,2h),4.27
‑
4.08(m,2h),1.93(dd,j=14.9,2.2 hz,1h),1.84(d,j=5.0 hz,2h),1.80
‑
1.74(m,1h),1.65
‑
1.51(m,4h),1.45(s,4h),1.36(d,j=3.3 hz,4h),1.30(d,j=5.0 hz,4h),0.68(td,j=7.9,2.7 hz,9h),0.22
‑‑
0.10(m,6h).
13
c nmr(150 mhz,cdcl3)δ173.0,173.0,164.3,164.3,148.5,148.5,144.1,143.6,131.5,128.6,128.5,128.4,126.3,126.1,126.1,126.1,120.2,115.9,112.5,112.5,109.6,109.5,105.2,83.5,83.4,80.1,80.0,72.7,72.6.67.5,67.5,47.1,47.0,33.8,33.6,27.1,26.9,26.8,26.8,26.6,26.3,26.2,25.2,25.2,7.0,7.0,3.5,3.5.hrms(esi)calcd for c
36
h
47
n2o8si
:663.3096,found:663.3076。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。