本发明涉及一种基于萘醌触发基团的nqo1近红外荧光探针、制备方法及应用,属于化学生物学领域。
背景技术:
癌症已成为当今世界危害人类生命健康的最主要因素。其中大部分癌症患者,在确诊时就已经处于疾病晚期,这极大地增加了治愈癌症的困难。而早期的肿瘤诊断能帮助提高肿瘤的治愈率。用小分子荧光探针进行生物成像是肿瘤诊断的重要手段,它由于对肿瘤的高敏感型和能够实时监测的特性而得到了研究人员广泛的关注。用小分子对肿瘤进行荧光成像,最不可缺少的就是肿瘤标志物。还原型辅酶i/ii:醌氧化还原酶1(nqo1)是一种目前研究热门的可用于肿瘤诊断的肿瘤特异性标志物。
nqo1是一种黄素蛋白,可以催化内源性和外源性醌的双电子还原反应。据报道,nqo1广泛存在于各种实体瘤中,其在实体瘤中的表达水平远高于正常细胞,如nqo1在肺癌、胰腺癌、乳腺癌,胃癌等实体瘤中,其浓度较正常细胞可高达200倍。由于这个特性,nqo1的小分子荧光探针逐渐受到了人们重视。目前的nqo1探针大多包含nqo1触发基团和荧光报告基团。这两个部分可以直接连接,也可以通过连接链进行连接。并且,基于近红外荧光基团的荧光探针由于组织深度穿透性更好,组织吸收率较低以及对细胞的光毒性较低的特性而备受关注。
目前报道的nqo1近红外荧光探针均采用三甲基对苯醌作为触发基团,基于苯醌触发基团的nqo1近红外荧光探针,所述探针如式vi;
该触发基团能够平行堆叠在nqo1辅基fad异咯嗪环上方。然而三甲基对苯醌占据nqo1催化口袋后,fad的异咯嗪环上方仍留有较大空腔,这导致苯醌触发基团与nqo1结合能力不强,因此对nqo1的灵敏度低,响应速度慢。
技术实现要素:
发明目的:本发明针对现有技术中近红外荧光探针对nqo1灵敏度低响应速度慢的问题,提供一种对nqo1酶具有高度选择性和敏感性的特异性的近红外荧光探针;还提供了上述近红外荧光探针的制备方法和应用。
技术方案:本发明的所述的基于萘醌触发基团的nqo1近红外荧光探针,所述近红外荧光探针的分子结构(i)为:
其制备方法包括以下步骤:
(1)将中间体ii与中间体iii在催化剂及对应的溶剂体系下进行缩合反应生成酰胺中间体iv;
(2)将中间体iv与中间体v在催化剂及对应的溶剂体系下,与三光气进行取代反应生成化合物i。
优选的,步骤(1)中的催化剂及对应的溶剂体系包括:dcc/dmap/dcm、hatu/dipea/thf、pybop/dipea/dmf;进一步的,优选为dcc/dmap/dcm。
优选的,步骤(2)中的催化剂及对应的溶剂体系包括:dmap/dmf、tea/thf、py/dcm;进一步的,优选为dmap/dmf。
进一步的,步骤(1)中的中间体ii的制备方法为:由原料ii-1经还原得到化合物ii-2,加入甲磺酸与3,3-二甲基丙烯酸甲酯(或3,3-二甲基丙烯酸)进行亲核加成得到中间体ii-4;随后中间体ii-4在n-溴代丁二酰亚胺存在下发生水解反应得到中间体ii。
进一步的,步骤(1)中的中间体iii的制备方法为:用tbscl保护原料iii-1的羟基,得到中间体iii-2,随后进行胺甲基化反应得到中间体iii。
进一步的,步骤(2)中的中间体v的制备方法为:原料v-1在还原剂的催化下发生还原反应,得到中间体v。
本发明还提供了所述的近红外荧光探针的应用,该荧光探针应用于制备nqo1酶的检测试剂及检测试剂盒。
进一步的,所述的检测试剂及检测试剂盒应用于肿瘤的检测。
本发明所制备的基于萘醌触发基团的nqo1近红外荧光探针,其萘醌触发基团能够充分占据fad异咯嗪环的上方的空间,增强醌平面和nqo1催化口袋的结合能力,最终达到提高触发基团的响应速度的目的。本发明涉及的探针使用新设计的萘醌结构作为触发基团,基于荧光强度检测生物体中的nqo1蛋白水平,用于对nqo1高表达的细胞成像,相比于现有技术的触发基团,该探针具有快速响应性和高度选择性,应用于制备nqo1酶的检测试剂及检测试剂盒。
有益效果:与现有技术相比,本发明具有如下显著优点:
(1)本发明所制备的基于萘醌触发基团的近红外荧光探针,对醌氧化还原酶1响应迅速,灵敏度高,对醌氧化还原酶1的检测限低至0.033μg/ml,在10-15min即可完全释放荧光信号,而现有技术中的苯醌触发基团探针20-30min才能完全释放荧光信号,并且本发明的探针在灵敏度方面比基于苯醌触发基团探针高出8倍;
(2)本发明所制备的近红外荧光探针,对醌氧化还原酶1具有很高的选择性和敏感性,本发明所制备的近红外荧光探针i对醌氧化还原酶1的选择性和特异性可达14倍;
(3)本发明所述的近红外荧光探针的制备方法简单,在常温常压下即可完成制备,且转化率高,产物得率高。
附图说明
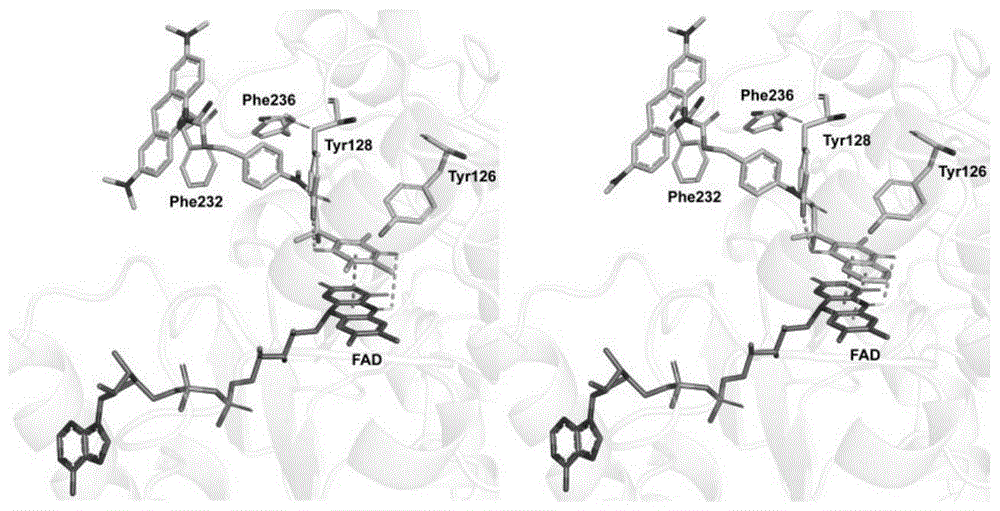
图1为基于萘醌触发基团的探针i和基于苯醌触发基团的探针vi与nqo1催化口袋的对接图;
图2为探针i在nqo1存在或缺失条件下的紫外吸收变化图和荧光发射光谱图;
图3为探针i与nqo1孵育不同时间的荧光强度和时间的变化关系曲线图;
图4为探针i与不同浓度的nqo1酶孵育后的荧光强度与nqo1酶浓度关系变化图;
图5为探针i与不同离子反应后的荧光强度;
图6为探针i在不同细胞中的成像图;
图7为探针i和vi在动物体内荧光信号成像图;
图8为探针i和vi在动物体内荧光强度对比图。
具体实施方式
下面结合附图对本发明的技术方案作进一步说明。
实施例1
将ii-4(1.28g,5mmol)溶于乙腈(10ml)和水(2ml)的混合溶液,随后在室温搅拌下分批加入nbs(934.4mg,5.3mmol)。继续搅拌6h,反应完成后,减压浓缩有机溶剂,并将剩余溶液用dcm(3×30ml)萃取。将有机层合并,随后用无水硫酸钠干燥,减压蒸馏除去溶剂,得到黄色的中间体ii(885.0mg,65%)。m.p.142.6-143.7℃.1hnmr(300mhz,dmso-d6)δ:12.31(s,1h),8.02(q,j=3.7hz,2h),7.86(q,j=3.4hz,2h),2.41(t,j=9.6hz,2h),2.16(s,3h),1.32(s,3h),1.28(s,3h);ei-msm/z:272[m] 。
将对氨基苯甲醇(1.0g,8.1mmol)、tbscl(1.5g,9.7mmol)和咪唑(660.4mg,9.7mmol)溶于dcm(40ml)中。置于室温下搅拌过夜。待反应结束后,将反应混合物用饱和氯化钠溶液稀释,然后用乙酸乙酯(3×150ml)萃取。合并有机相,并用无水硫酸钠干燥并过滤。最后通过减压浓缩除去溶剂得到中间体iii-2(1.7g,90%).1hnmr(300mhz,dmso-d6)δ7.11-6.97(m,3h),6.68-6.61(m,1h),4.55-4.49(m,2h),3.40(s,2h),0.86(s,9h),0.03(s,6h);ei-msm/z:237[m] 。
将中间体iii-2(1.0g,4.2mmol),甲醇钠(1.1g,21.1mmol)和多聚甲醛(1.9g,21.1mmol)溶于ch3oh(50ml),并于66℃下搅拌4h。然后将反应冷却至室温。在0℃下,向反应中分批添加硼氢化钠(797.6mg,21.1mmol)。随后将反应在66℃下再搅拌2h。反应完成后,将反应用冰水(50ml)淬灭。先减压浓缩除去甲醇,然后将混合物用乙酸乙酯(3×100ml)萃取。用水(3×100ml)洗涤有机溶剂,经无水硫酸钠干燥并过滤,随后减压浓缩除去溶剂。最后通过柱层析(洗脱液:石油醚/乙酸乙酯60:1)纯化,得到油状物iii(370.0mg,35%).1hnmr(300mhz,dmso-d6)δ7.02(d,j=10.0hz,2h),6.48(d,j=10.7hz,2h),5.59-5.55(m,1h),4.51(s,2h),2.64(d,j=6.0hz,3h),0.87(s,9h),0.03(s,6h);ei-msm/z:251[m] 。
将中间体ii(1497.7mg,5.5mmol)和中间体iii(1387.4mg,5.0mmol)溶解在dcm(50ml)中,在0℃下向其中加入dmap(61.1mg,0.5mmol)。将混合物从0℃自然升温至室温并继续搅拌0.5h。然后加入dcc(1.2g,6.0mmol),并将反应混合物室温搅拌过夜。待反应完成后,通过减压浓缩除去dcm,然后用乙酸乙酯(3×50ml)萃取,合并有机层并用水(3×50ml)洗涤。并用无水硫酸钠干燥并过滤。使用旋转蒸发仪除去溶剂,并将粗产物溶解在thf(30ml)中。然后加入tbaf(8ml,1m的thf溶液,8.0mmol),并将溶液在室温搅拌1h。待反应完成后,减压蒸馏除去溶剂,残余物用dcm(3×50ml)萃取,合并有机相并用饱和氯化钠溶液(3×50ml)洗涤,经无水硫酸钠干燥,并过滤。减压浓缩除去溶剂,并将粗产物通过柱层析(洗脱液:石油醚/乙酸乙酯1:1)纯化,得到黄色的iv(751.5mg,36%).m.p.155.6-157.3℃.1hnmr(300mhz,dmso-d6)δ:7.99-7.93(m,1h),7.83-7.80(m,3h),7.44(d,j=9.2hz,2h),7.27(d,j=4.8hz,2h),6.57(d,j=15.2hz,1h),6.42-6.33(m,1h),5.09(s,1h),4.33(d,j=3.3hz,2h),3.16(s,3h),2.23-2.16(m,2h),2.03(s,3h),1.25(s,6h);ei-msm/z:391[m] 。
氮气保护下,将v-1(320.0mg,1mmol)、连二亚硫酸钠(261.1mg,1.5mmol)和碳酸氢钠(168mg,2mmol)溶于dcm(10ml)和h2o(10ml)的混合溶剂中,将混合物在室温下搅拌过夜。反应结束后,分离有机层,水层用dcm(3×10ml)萃取。合并有机相,并用无水硫酸钠干燥。减压浓缩溶剂得到中间体v。1hnmr(300mhz,dmso-d6)δ8.21(s,1h),6.97–6.91(m,2h),6.71–6.66(m,4h),2.96(s,12h);ei-msm/z:285[m] 。
在氮气保护下,将中间体iv(1.96g,5.0mmol)和dmap(6.1mg,0.05mmol)溶于dcm(30ml),冷却至0℃。逐滴加入溶于dcm(15ml)中的三光气(1.5g,5.0mmol),将混合物从0℃自发升温至室温并继续搅拌12h。反应完成后,减压浓缩除去溶剂,并将残余物用dcm(3×50ml)萃取,合并有机相,并用饱和氯化钠溶液(3×15ml)洗涤,用无水硫酸钠干燥,并过滤。减压浓缩除去溶剂,并且粗产物无需进一步纯化即可使用。然后将该酰氯产物溶解在dmf(10ml)中。将中间体v(1.4g,5.0mmol)和tea(0.6g,5.5mmol)溶于dmf(20ml),冷却至0℃。向混合物中滴加酰氯溶液,然后从0℃逐渐升至室温并搅拌24h。反应完成后,将溶剂dmf用水(100ml)稀释,然后用dcm(3×50ml)萃取,并用饱和氯化钠溶液洗涤,用无水硫酸钠干燥,并过滤。使用旋转蒸发仪除去溶剂,并将粗产物通过柱层析(洗脱液:石油醚/乙酸乙酯1:1)纯化。得到呈黄色固体的目标产物i(738.0mg,21%).m.p.162.1-162.6℃.1hnmr(300mhz,dmso-d6)δ:7.96-7.90(m,2h),7.82-7.78(m,2h),7.49(d,j=8.8hz,2h),7.28(q,j=9.2hz,4h),6.59-6.45(m,4h),4.67(s,2h),3.13(s,3h),2.73(s,12h),2.16-2.08(m,2h),1.99(s,3h),1.74(s,6h);ei-msm/z:702[m] 。
实施例2
基于萘醌和苯醌触发基团的探针i和vi与nqo1催化口袋的对接图,如图1所示,其中探针i为本发明所述的基于萘醌触发基团的nqo1近红外荧光探针,探针vi为现有技术中的基于苯醌触发基团的nqo1近红外荧光探针;
所用软件为discoverystudio2020,从结果可以看出,三甲基对苯醌触发基团能够平行堆叠在fad异咯嗪环上方,占据部分空间并形成π-π相互作用,而萘醌触发基团则能够充分占据fad异咯嗪环上分空间,从而与fad形成更强的π-π相互作用,从而提高触发基团对nqo1的响应速度。
实施例3
下面是本发明所述探针的光学性质、荧光滴定、选择性、细胞及动物水平成像研究实验及结果:
1.探针的紫外吸收和荧光发射光谱
将化合物i溶于含有1%dmso,ph=7.4的pbs缓冲液中。测试浓度为:探针浓度为10μm,nadph浓度为100μm,nqo1浓度为40μg/ml。图2为探针i的紫外吸收和荧光发射光谱曲线。实验结果显示,在没有nqo1存在的条件下,探针紫外吸收很弱且不能释放荧光信号,但是在nqo1存在的条件下,682nm处出现一个显著的紫外吸收峰且695nm处出现显著的荧光信号。这说明探针与nqo1确实能够发生反应,并且释放出荧光信号。
2.探针的响应时间实验
将化合物i溶于含有1%dmso,ph=7.4的pbs缓冲液中。测试浓度为:探针浓度为10μm,nadph浓度为100μm,nqo1浓度为40μg/ml。所得溶液在37℃下孵育不同时间(0、5、10、15、20、25、30min),测定所述混合溶液的荧光强度(ex=695nm)随时间的变化的曲线图。图3为探针i与nqo1酶孵育不同时间的荧光强度曲线变化图。从结果可以看出,10min后,荧光强度基本达到饱和,说明探针对nqo1响应迅速,仅为10min。
2.探针的荧光滴定实验
将化合物i溶于含有1%dmso,ph=7.4的pbs缓冲液中。加入nadph。然后加入不同的离子或者nqo1酶的pbs溶液,使得整个体系测试浓度为:探针浓度为10μm,nadph浓度为100μm。在37℃下孵化10min后,测定所述混合溶液的荧光强度(ex=695nm)随nqo1酶浓度变化的曲线图。图4为探针i与nqo1荧光滴定曲线图。从结果可以看出,在nqo1存在的条件下,探针释放的荧光强度随nqo1浓度的增加而不断增强而不断增强,并且在nqo1浓度在0-1μg/ml时,荧光强度与浓度呈线性关系,所述线性关系曲线具体为y=57.09x 37.20(r2=0.995)。本发明涉及的探针i对nqo1的检测限为0.033μg/ml。
3.探针的选择性实验
将化合物i溶于含有1%dmso,ph=7.4的pbs缓冲液中。加入nadph。然后加入不同浓度的nqo1酶的pbs溶液,使得整个体系测试浓度为:探针浓度为10μm,nadph浓度为100μm,40μg/ml离子或者nqo1酶。图5为探针i与不同的离子或nqo1酶反应的荧光光谱图。从结果可以看出,探针i不与生物体中的其他离子发生反应,其对nqo1酶的选择性高达14倍。因此对nqo1有很高的选择性。
6.探针的细胞成像研究
将对数生长期的a549、h596细胞用0.25%的胰酶消化液处理,调整细胞悬液浓度为5×105个细胞,向共聚焦皿中加入100μl,然后置于37℃、5%co2的培养箱中过夜,当细胞贴壁后,加入探针(10μm),继续孵育20min,然后加入hoechst33342染色剂,继续孵育5min。之后用pbs洗涤三次,最后通过激光共聚焦显微镜(olympusfluoviewfv1000,japan)进行拍照。图6为探针在细胞中的成像结果。从结果来看,探针能够在a549(nqo1 )细胞中释放显著的荧光信号,而在h596(nqo1-)细胞中不能释放显著的荧光信号。表明该探针能够特异性的识别细胞中的nqo1,并在nqo1的作用下释放荧光信号。
7.探针在动物体内的成像研究
取对数生长期的a549细胞,接种于balb/c裸鼠腋下(4–5周),待瘤块长至100mm3时,通过尾静脉注射探针(5mg/kg)50μl,并用小鼠成像系统在0、5、10、15、30、45、60min对小鼠进行拍照。取现有技术的基于苯醌触发基团的探针vi作为对照组。
图7为探针i和vi在小鼠体内的成像结果,探针能够在a549(nqo1 )接种的肿瘤部位释放显著的荧光信号,并且由图8可以看出,基于萘醌触发基团的探针i在15min时能达到最大荧光信号,而基于苯醌触发基团的探针vi需要20-30min才能达到最大荧光强度。并且基于萘醌触发基团的探针i相对于基于苯醌触发基团的探针vi敏感性最高可达8倍。因此,相比于现有技术的苯醌触发基团,本发明涉及的基于萘醌触发基团的探针i在体内具有很好的灵敏度。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。