1.本发明涉及干细胞技术领域,具体涉及一种促进人胚胎干细胞均一分化为限定性内胚层细胞的方法。
背景技术:
2.人胚胎干细胞(embryonic stem cells,escs)是来源于源于着床前囊胚内细胞团(inner cell mass,icm)的一类具有自我更新和多项分化多潜能干细胞,广泛应用于个体发育研究和干细胞治疗,如糖尿病和神经退行性疾病等。探明干细胞分化效率的限制因子,在很大程度上可以促进其临床应用。
3.近年来研究发现,人escs在向中内胚层分化过程中采用了不均等分裂,同时产生近似起始干性状态的未分化细胞和分化的中内胚层细胞;然而,该过程主要与细胞内部信号分子的极性分布有关,难以适用于细胞亚群之间的干预调控。通过大规模基因缺失研究可以筛选提高干细胞分化效率的关键信号分子;然而,目前基于基因转染进行干预的方法存在转染效率低或者引入外源基因的风险。小分子化合物具有高效、无基因组污染的优点,正逐渐成为诱导干细胞分化的主要工具。
4.限定性内胚层(definitive endoderm,de)是胚胎发育过程中的一个重要的阶段,de细胞是可以进一步分化为肝脏、胰腺、肺脏、肠管等组织的细胞。sox17不仅是de细胞的标记分子,而且是调控de定向分化的关键转录因子。sox17强阳性的de细胞较sox17弱阳性的de细胞,具有更强的定向分化能力和应用价值。
5.因而,探明人escs向限定性内胚层细胞异质性分化的关键因子,筛选出合适的小分子化合物,提高分化而成的限定性内胚层细胞中sox17强阳性细胞比例,促进干细胞均一分化,是目前干细胞研究领域的关键问题。
技术实现要素:
6.本发明的目的旨在针对人escs向限定性内胚层细胞异质性分化的问题,提供一种促进人胚胎干细胞均一分化为限定性内胚层细胞的方法。在本发明中,“均一”具体含义为“提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例”。
7.第一方面,本发明要求保护一种促进人胚胎干细胞分化为限定性内胚层细胞的方法。
8.本发明所提供的促进人胚胎干细胞分化为限定性内胚层细胞的方法,可包括如下步骤:在促进人胚胎干细胞向限定性内胚层细胞分化的过程中,在分化培养基中加入g1期抑制剂,实现促进人胚胎干细胞分化为限定性内胚层细胞。
9.该方法与不加入g1期抑制剂的常规方法(常规方法与本发明方法相比差别仅在于不加入g1期抑制剂)相比,能够提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例。
10.在本发明中,所述sox17强阳性细胞是指:由人胚胎干细胞分化而成的限定性内胚
层细胞群体,经流式细胞检测,会先后出现两个sox17阳性细胞峰,第一个出现的sox17阳性细胞峰所对应的细胞定义为sox17弱阳性细胞;第二个出现的sox17阳性细胞峰所对应的细胞定义为sox17强阳性细胞。下同。
11.进一步地,所述方法可包括如下步骤:
12.(a1)将人胚胎干细胞在额外添加有g1期抑制剂的第一阶段诱导培养液中诱导培养,使人胚胎干细胞分化为中内胚层细胞;
13.(a2)将步骤(a1)所得中内胚层细胞在额外添加有g1期抑制剂的第二阶段诱导培养液中诱导培养,使中内胚层细胞分化为限制性内胚层细胞。
14.在本发明的具体实施方式中,所述g1期抑制剂具体为帕博西尼(palbociclib)。
15.其中,所述第一阶段诱导培养液中含有如下因子:its-supplement、activin a和wnt3a。所述第二阶段诱导液中含有如下因子:its-supplement和activin a。
16.进一步地,所述第一阶段诱导培养液中还含有bsa,所述第二阶段诱导液中也含有bsa。
17.在所述第一阶段诱导培养液中额外添加的帕博西尼的终浓度可为1-3μm(如2μm)。在所述第二阶段诱导培养液中额外添加的帕博西尼的终浓度可为1-3μm(如2μm)。
18.在所述第一阶段诱导培养液中,所述its-supplement体积含量为0.2
‰
,所述activin a的终浓度为100ng/ml,所述wnt3a的终浓度为50ng/ml。
19.在所述第二阶段诱导培养液中,所述its-supplement体积含量为0.5
‰
,所述activin a的终浓度为100ng/ml。
20.所述第一阶段诱导培养液为将所述its-supplement、所述activin a的储存溶液和所述wnt3a的储存溶液加入到仅含有浓度为0.05g/100ml的bsa的限定性内胚层分化基础培养基中,并使各物质达到其终浓度后所得。
21.所述第二阶段诱导培养液为将所述its-supplement和所述activin a的储存溶液加入到仅含有浓度为0.2g/100ml的bsa的限定性内胚层分化基础培养基中并使各物质达到其终浓度后所得。
22.进一步地,所述限定性内胚层分化基础培养基为rpmi 1640。
23.进一步地,所述activin a的储存溶液中activin a的浓度为0.5mg/ml,余量为0.1%(即0.1g/100ml)bsa溶液(溶剂为水)。所述wnt3a的储存溶液中wnt3a的浓度为0.2mg/ml,余量为0.1%(即0.1g/100ml)bsa溶液(溶剂为pbs)。
24.在步骤(a1)中,所述诱导培养的时间可为1天。
25.在步骤(a2)中,所述诱导培养的时间可为2天。
26.第二方面,本发明要求保护第一方面所述方法制备得到的限制性内胚层细胞(sox17强阳性细胞比例提高)。
27.第三方面,本发明要求保护一种用于提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例的成套产品。
28.本发明所要求保护的成套产品由g1期抑制剂、前文第一方面中所述的第一阶段诱导培养液和前文第一方面中所述的第二阶段诱导培养液组成。
29.在本发明的具体实施方式中,所述g1期抑制剂为帕博西尼(palbociclib)。
30.第四方面,本发明要求保护如下任一应用:
31.p1、前文第一方面所述方法在提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例中的应用。
32.p2、g1期抑制剂在促进人胚胎干细胞分化为限定性内胚层细胞中的应用。
33.p3、g1期抑制剂在提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例中的应用。
34.进一步地,所述g1期抑制剂为帕博西尼(palbociclib)。
35.p4、前文第三方面中所述成套产品在促进人胚胎干细胞分化为限定性内胚层细胞中的应用。
36.p5、前文第三方面中所述成套产品在提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例中的应用。
37.在上述各方面中,所述人胚胎干细胞具体可为人胚胎干细胞h9。
38.在本发明中,所述提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例具体体现为与不加入g1期抑制剂的常规方法(常规方法与本发明方法相比差别仅在于不加入g1期抑制剂)相比由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例增加。
39.本发明采用针对g1期的小分子抑制剂,在不引入外源基因条件下,显著提高人escs向限定性内胚层细胞分化的均一化水平,提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例。
40.本发明的优势在于:采用g1期小分子抑制剂palbociclib进行干预,没有引入外源基因的风险;本发明通过添加palbociclib可以显著提高分化24小时g1期细胞比例;本发明通过添加palbociclib,显著提高限定性内胚层细胞强阳性sox17细胞亚群比例。本发明对于获得更高比例的强阳性sox17细胞进而提高de细胞均一度,增强其分化能力而言具有重要意义。
附图说明
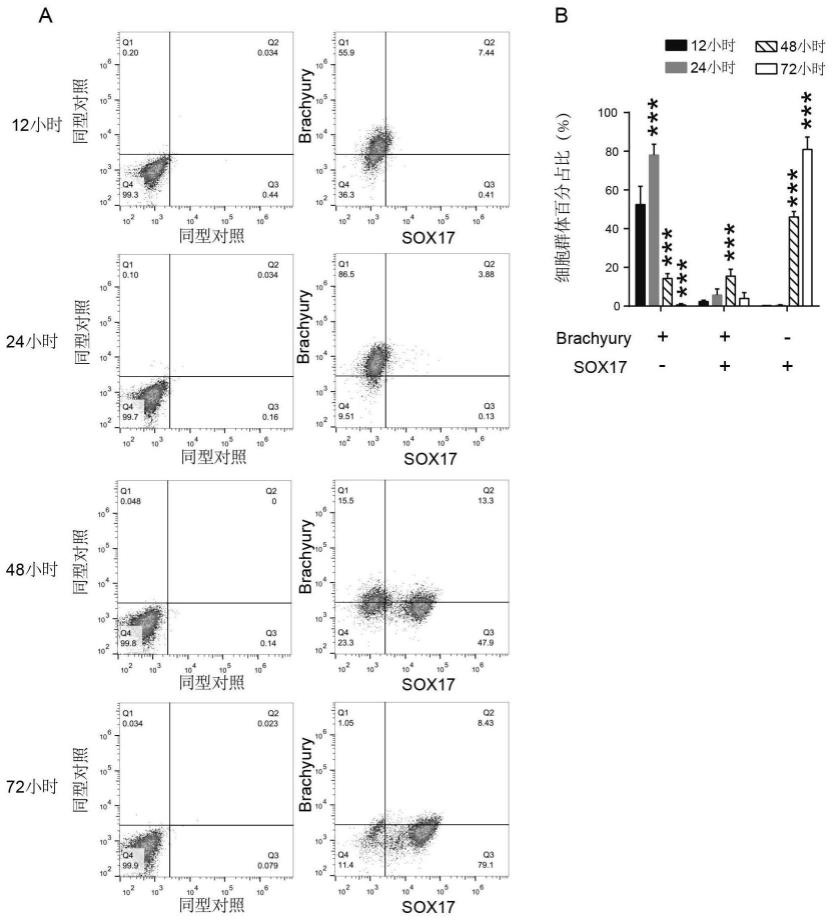
41.图1为流式细胞术检测限定性内胚层细胞分化效率。其中,a为h9诱导分化12、24、48和72小时中内胚层标记分子brachyury和限定性内胚层标记分子sox17阳性细胞比例分布,b为统计分析图。
42.图2为单细胞测序检测不同时间点细胞亚群分布特征。其中,a为h9诱导分化0、12、24、36、48和72小时不同亚群分布特征,b为不同亚群细胞周期相关基因表达分布结果。
43.图3为流式细胞术检测不同时间点细胞周期特征。其中,a为h9诱导分化0、24、48和72小时g1、s和g2起dna分布特征,b为统计分析图。
44.图4为流式细胞术检测不同浓度palbociclib对分化24小时细胞周期的影响。其中,a为0、1和2μm palbociclib处理24小时g1、s和g2起dna分布特征,b为统计分析图。
45.图5为流式细胞术检测不同浓度palbociclib对分化72小时细胞周期的影响。其中,a为0、1和2μm palbociclib处理72小时g1、s和g2起dna分布特征,b为统计分析图。
46.图6为流式细胞术评价palbociclib添加对限定性内胚层分化效率的影响。其中,a为0、1和2μm palbociclib处理72小时后限定性内胚层标记分子sox17弱阳性(weak)、弱阳性(strong)以及所有阳性(positive)群体的分布特征,b为统计分析图。
t-test)进行数据分析,数据用平均值
±
标准差(mean
±
sd)表示。
70.实施例1、促进人胚胎干细胞均一分化为限定性内胚层细胞的方法
71.本发明所在团队研究发现人escs在向限定性内胚层干细胞分化过程中呈现明显的异质性分化的趋势,不同异质性亚群的表型分布与细胞周期相关,具体表现为:具有较强分化表型的细胞大多处于细胞周期的g1期;而具有较弱分化表型的细胞大多处于细胞周期的非g1期。基于此,本发明采用针对g1期的小分子抑制剂,在不引入外源基因条件下,显著提高由人胚胎干细胞分化而成的限定性内胚层细胞中sox17强阳性细胞比例,进而提高限定性内胚层细胞的均一性。
72.具体如下:
73.一、人escs体外培养
74.主要试剂的配制如下:
75.(1)人escs无饲养层基质胶matrigel配制:冰上溶解matrigel。根据每批次matrigel的批号,在corning网站上查询相应批次的稀释比例。用冰上预冷的dme/f-12按照相应比例稀释。
76.(2)人escs完全培养基配制:将mtesr的5x添加物至于4℃冰箱溶解,然后加入mtesr的基础培养基中,混合均匀后分装使用。
77.取人escs无饲养层matrigel,以1ml/孔转移至6孔板,在室温反应45分钟后更换人escs完全培养基。选取50代以内的人胚胎干细胞h9,以克隆团块种植于6孔板,然后置于5%co2、饱和湿度、37℃培养箱中培养5天。在此期间,每间隔24小时更换新鲜人escs完全培养基。在培养第5天,采用人escs消化液dispase处理h9细胞,使之分散为克隆团块,用mfresr冻存液冻存细胞;或者,采用人escs消化液relesr处理h9细胞,使之分散为稍小克隆团块,然后按1:6比例进行团块传代;或者,采用人escs消化液tryple处理h9细胞,使之分散为单细胞悬液,按照实例2要求进行单细胞传代。
78.二、添加palbociclib将人escs向限定性内胚层细胞分化
79.(一)添加palbociclib将人escs向限定性内胚层细胞分化的方法
80.主要试剂的配制如下:
81.(1)0.1%bsa h2o溶液配制:将0.1g bsa溶解于100ml无菌h2o,然后采用0.22μm pvdf滤膜过滤后于-20℃冻存。
82.(2)0.1%bsa pbs溶液配制:将0.1g bsa溶解于100ml无菌pbs,然后采用0.22μm pvdf滤膜过滤后于-20℃冻存。
83.(3)0.5mg/ml activin a储存溶液配制:将100μg activin a溶解于200μl 0.1%(即0.1g/100ml)bsa h2o溶液,于-80℃冻存。
84.(4)0.2mg/ml wnt3a存储溶液配制:将10μg wnt3a溶解于50ul 0.1%(即0.1g/100ml)bsa pbs溶液,于-80℃冻存。
85.(5)10mm rho/rock抑制剂配制:将5mg y-27632溶解于1.56ml dmso,然后分装冻存于-80℃。
86.(6)5mm palbociclib抑制剂配制:将2mg palbociclib溶解于0.86ml dmso,然后冻存于-80℃。
87.(7)0.05g/100ml bsa限定性内胚层分化基础培养基rpmi 1640配制:将0.05g bsa
溶解于100ml限定性内胚层分化基础培养基rpmi 1640,然后采用0.22μm pvdf滤膜过滤后使用。
88.(8)0.2g/100ml bsa限定性内胚层分化基础培养基rpmi 1640配制:将0.2g bsa溶解于100ml限定性内胚层分化基础培养基rpmi 1640,然后采用0.22μm pvdf滤膜过滤后使用。
89.(9)第一阶段诱导培养液:对于10ml的第一阶段诱导培养液的配制而言,含有2μl的浓度为0.5mg/ml activin a储存溶液(使activin a最终浓度为100ng/ml),2.5μl的浓度为0.2mg/ml wnt3a存储溶液(使wnt3a最终浓度为50ng/ml),2μl的its-supplement(使its-supplement按1:5000稀释,即its-supplement体积含量为0.2
‰
),余量是浓度为0.05g/100ml bsa限定性内胚层分化基础培养基rpmi 1640。
90.(10)第二阶段诱导培养液:对于10ml的第二阶段诱导培养液的配制而言,含有2μl的浓度为0.5mg/ml activin a储存溶液(使activin a最终浓度为100ng/ml),5μl的its-supplement(使its-supplement按1:2000稀释,即its-supplement体积含量为0.5
‰
),余量是浓度为0.2g/100ml bsa限定性内胚层分化基础培养基rpmi1640。
91.1、单细胞传代
92.采用步骤一中的人escs无饲养层基质胶matrigel处理6孔板,取步骤一中h9的单细胞悬液,离心后去除上清,用人escs完全培养基重悬细胞,按照2.6
×
106个/孔的密度和2ml/孔的体积种植于人escs无饲养层基质胶matrigel处理后的6孔板。然后在每孔中加入rho/rock抑制剂,使其最终浓度为10μm。在培养1天后,完成单细胞传代。
93.2、第一阶段诱导分化
94.在6孔板中,用2ml限定性内胚层分化基础培养基rpmi 1640洗涤每孔细胞一次,然后更换为2ml第一阶段诱导培养液。在第一阶段诱导培养液中添加palbociclib抑制剂,使其终浓度为所需要求。在培养1天后,得到第一阶段诱导分化的中内胚层细胞。
95.3、第二阶段诱导分化
96.在6孔板中,用2ml限定性内胚层分化基础培养基rpmi 1640洗涤每孔细胞一次,然后更换为2ml第二阶段诱导培养液。在第二阶段诱导培养液中添加palbociclib抑制剂,使其终浓度为所需要求。每天更换新鲜培养液和添加palbociclib抑制剂。在培养2天后,得到第二阶段诱导分化的限定性内胚层细胞。
97.(二)添加palbociclib诱导的限定性性内胚层细胞的鉴定
98.1、人escs向限定性内胚层细胞分化中单细胞转录组检测
99.取人h9向限定性内胚层分化第0、24、36、48和72小时的细胞,采用tryple消化成单细胞悬液,然后利用10
×
genomics的chromiumtmsingle cell 3
′
library&gel bead kit v2进行单细胞转录组的文库构建,在illumina hiseq x ten仪器上进行配对双端150bp(pe150)测序。实验数据采用10
×
genomics的cell ranger和seurat软件进行数据分析。
100.2、人escs向限定性内胚层细胞分化中细胞周期检测
101.取人h9向限定性内胚层分化不同阶段的细胞,采用tryple消化后用1
×
pbs洗涤一次,然后重悬于1ml的1
×
pbs。将细胞置于震荡仪上,逐滴加入3ml-20℃预冷的100%乙醇,然后在冰上固定细胞30分钟。采用1
×
pbs清洗2次后,将细胞重悬于400μl的1
×
pbs,然后加入pi和rnase a,使其最终浓度分别为40μg/ml和100μg/ml。在37℃反应30分钟以去除内源
rna干扰,采用40μm滤膜过滤后,最后在1小时内使用流式细胞仪进行检测。实验数据使用flowjo进行分析。
102.3、人escs向限定性内胚层细胞分化中表面标记检测
103.取人h9向限定性内胚层分化不同阶段的细胞,采用tryple消化后用1
×
pbs洗涤一次。使用cytofix/cytoperm通透固定液室温处理20分钟,然后用1
×
perm/wash buffer洗涤细胞1次,然后重悬细胞,加入相应流式抗体,室温避光孵育45分钟。随后用1
×
pbs洗涤细胞1次,重悬细胞,使用40μm滤膜过滤。最后在12小时内使用流式细胞仪进行检测。实验数据使用flowjo进行分析。
104.(三)结果与分析
105.图1为流式细胞术检测限定性内胚层细胞分化效率(未添加palbociclib)。其中,a为h9诱导分化12、24、48和72小时中内胚层标记分子brachyury和限定性内胚层标记分子sox17阳性细胞比例分布,b为统计分析图。
106.由图1可知,在未添加palbociclib条件下,在h9在分化第1天,即24小时,中内胚成层brachyury的阳性比例达到峰值;在分化第2天(48小时)和第3天(72小时),限定性内胚层标记分子sox17的阳性比例逐渐增加,在第3天达到峰值,符合常规胚胎干细胞向限定性内胚层细胞分化的标记分子表达模式。这表明我们在未添加palbociclib条件下,建立了常规的人胚胎干细胞h9向限定性内胚层细胞分化的体系。
107.图2为单细胞测序检测不同时间点细胞亚群分布特征(未添加palbociclib)。其中,a为h9诱导分化0、12、24、36、48和72小时不同亚群分布特征,b为不同亚群细胞周期相关基因表达分布结果。
108.由图2可知,在未添加palbociclib条件下,在h9向限定性内胚层细胞分化不同阶段,呈现为明显异质性分化趋势,具体表现为在分化第24、36、48和72小时均分别根据基因表达模式均可划分为两种不同的亚群,其中8和9号亚群g1期细胞比例低于4和5号亚群的比例,提示细胞周期g1可能是影响干细胞异质性分化的潜在因素。
109.图3为流式细胞术检测不同时间点细胞周期特征(未添加palbociclib)。其中,a为h9诱导分化0、24、48和72小时g1、s和g2起dna分布特征,b为统计分析图。
110.由图3可知,在未添加palbociclib条件下,从整体细胞群体水平来看,h9向限定性内胚层细胞分化过程中,g1期细胞群体的比例显著上调,进一步提示延长g1期可能与干细胞分化进程相关。
111.图4为流式细胞术检测不同浓度palbociclib对分化24小时细胞周期的影响。其中,a为0、1和2μm palbociclib处理24小时g1、s和g2起dna分布特征,b为统计分析图。
112.由图4可知,在持续添加不同浓度g1期抑制剂palbociclib条件下,在h9向限定性内胚层细胞分化24小时,1和2μm的浓度显著提高g1期细胞亚群的比例。
113.图5为流式细胞术检测不同浓度palbociclib对分化72小时细胞周期的影响。其中,a为0、1和2μm palbociclib处理72小时g1、s和g2起dna分布特征,b为统计分析图。
114.由图5可知,在持续添加不同浓度g1期抑制剂palbociclib条件下,在h9向限定性内胚层细胞分化72小时,1和2μm palbociclib对g1期细胞亚群比例上调的影响不显著,可能与该分化阶段g1期细胞比例已经大幅增加有关。
115.图6为流式细胞术评价palbociclib添加对限定性内胚层分化效率的影响。其中,a
为0、1和2μm palbociclib处理72小时后限定性内胚层标记分子sox17弱阳性(weak)、弱阳性(strong)以及所有阳性(positive)群体的分布特征,b为统计分析图。
116.由图6可知,在持续添加不同浓度g1期抑制剂palbociclib条件下,在h9向限定性内胚层细胞分化72小时,2μm palbociclib显著提高sox17强阳性细胞亚群的比例,说明延长g1期可以显著提高限定性内胚层细胞均一性。其中,所述sox17强阳性细胞是指:由人胚胎干细胞分化而成的限定性内胚层细胞群体,经流式细胞检测,会先后出现两个sox17阳性细胞峰,第一个出现的sox17阳性细胞峰所对应的细胞定义为sox17弱阳性细胞;第二个出现的sox17阳性细胞峰所对应的细胞定义为sox17强阳性细胞。
117.以上结果表明,人胚胎干细胞h9像限定性内胚层细胞分化过程中表现为明显的异质性,而且不同细胞亚群主要与细胞周期g1期相关,通过添加palbociclib可在分化过程中显著延长g1期细胞亚群比例,其中2μm palbociclib可以显著提到sox17强阳性亚群的比例。
118.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。