1.本发明涉及生物技术领域,具体涉及一种通过借助代理引导编辑器进行水稻多基因精准编辑的方法。
背景技术:
2.基因组编辑技术目前已成为农作物重要基因功能验证和遗传改良的重要工具。crispr/cas9系统由于操作简单、成本低、可进行基因多重编辑等优点,在农作物育种中展现了广阔应用前景。利用crispr/cas9系统进行农作物改良主要分为三种类型:定点敲除、定点修饰及外源基因定点整合。crispr/cas9系统介导的定点敲除通常在基因组上产生随机插入和删除,但在农作物中不同品种的优异等位基因的差异通常是由基因启动子区或编码区特定的一个或多个碱基的插入或差异引起的,因此需要对目的基因进行精准改良。单碱基编辑技术虽然编辑效率较高,但单碱基编辑技术只能在基因组特定位点实现单个碱基的转换,且具有编辑窗口的限制;而crispr/cas9介导的同源重组虽然可以在基因组任意位置实现精准编辑,但在植物中发生效率低,因此亟需在农作物中建立高效的基因精准编辑系统,并用于农作物的精准改良。
3.此前,哈佛大学david r.liu教授研究团队,通过将cas9缺刻酶ncas9(h840a)与逆转录酶突变体(engineered m-mlv-rt)融合,在哺乳动物中开发了一系列新的基因组精准编辑体系-引导编辑系统(prime editors)。在引导编辑系统中,具有引导编辑作用的pegrna(prime editing guide rna),通过在sgrna骨架的3’端引入引物初始结合位点(primer binding site,pbs)序列结合ncas9断裂的非靶标链,以pegrna上携带目标突变的逆转录本(rt)为模板,通过延伸,产生含有目的突变的单链dna。细胞进一步通过dna损伤修复和复制把目的突变引入基因组。此外,在非编辑链上引入能产生缺刻的sgrna,有助于提高引导编辑的效率。该系统能够在不借助dna双链断裂缺口和dna供体修复模板的情况下,即可实现靶向插入、删除和所有类型的单碱基自由转换和颠换,为提高作物精准编辑效率提供了可能。
4.鉴于引导编辑系统在基因组精准修饰方面的巨大应用前景,多家实验室首先探索了其在植物中的可行性和有效性。与人类细胞相比,引导编辑系统在植物细胞中编辑效率普遍较低,且有较大的靶点依赖性,在很大程度上限制了引导编辑系统在农作物中的广泛应用。且到目前为止,引导编辑只能在动、植物中实现单个基因的精准编辑,尚未有引导编辑介导的多个优异等位基因同时精准编辑的报道。
技术实现要素:
5.本发明的目的是提供一种通过借助代理引导编辑器进行水稻多基因精准编辑的方法。
6.第一方面,本发明要求保护一种载体,记为载体甲。
7.所述载体甲能够表达如下(a1)和(a2),并含有如下(a3);
8.(a1)抗生素抗性筛选标记蛋白;
9.(a2)由a1)和a2)融合而成的融合蛋白;
10.a1)cas9缺刻酶或其变体;
11.a2)逆转录酶或其变体;
12.(a3)dna片段甲;所述dna片段甲中含有:
13.b1)启动子;
14.b2)polya和终止序列;
15.b3)位于所述b1)和所述b2)之间的dna序列i;所述dna序列i能够表达靶向osals基因并且将osals基因编码蛋白的第627位丝氨酸突变为异亮氨酸的成套向导rna;
16.b4)位于所述b1)和所述b2)之间的插入位点;所述插入位点用于插入dna序列ii;所述dna序列ii能够表达针对一个或若干个靶标基因的一个或若干个成套向导rna;
17.所述b3)和所述b4)位置不固定,既可以是所述b3)在前也可以是所述b4)在前;
18.所述成套向导rna为自5’端到3’端依次由trna、pegrna、trna、sgrna和trna组成的一条串联排列序列。所述trna在体内能够自我剪切,从而释放由其串联的各pegrna和sgrna。
19.第一方面,本发明要求保护一种载体,记为载体乙。
20.所述载体乙能够表达如下(b1),并含有如下(b2)和(b3);
21.(b1)由a1)和a2)融合而成的融合蛋白;
22.a1)cas9缺刻酶或其变体;
23.a2)逆转录酶或其变体;
24.(b2)含有潮霉素抗性筛选标记基因突变体的表达盒;所述潮霉素抗性筛选标记基因突变体为将野生型潮霉素抗性筛选标记基因中编码第46位酪氨酸的密码子突变为终止密码子后所得;
25.(b3)dna片段乙;所述dna片段乙中含有:
26.c1)启动子;
27.c2)polya和终止序列;
28.c3)位于所述c1)和所述c2)之间的dna序列i;所述dna序列i能够表达靶向osals基因并且将osals基因编码蛋白的第627位丝氨酸突变为异亮氨酸的成套向导rna;
29.c4)位于所述c1)和所述c2)之间的插入位点;所述插入位点用于插入dna序列ii;所述dna序列ii能够表达针对一个或若干个靶标基因的一个或若干个成套向导rna;
30.c5)位于所述c1)和所述c2)之间的dna序列iii;所述dna序列iii能够表达靶向(b2)中所述潮霉素抗性筛选标记基因突变体并且将所述潮霉素抗性筛选标记基因突变体中编码第46位氨基酸的终止密码子回复为异亮氨酸的成套向导rna;
31.所述c3)、所述c4)和所述c5)位置不固定;
32.所述成套向导rna为自5’端到3’端依次由trna、pegrna、trna、sgrna和trna组成的一条串联排列序列。所述trna在体内能够自我剪切,从而释放由其串联的各pegrna和sgrna。
33.在前文第一方面和第二方面中,所述载体甲和所述载体乙均可为环形载体。
34.在前文第一方面和第二方面中,所述载体甲和所述载体乙中如果有若干个所述成套向导rna,相邻的两个所述成套向导rna可以共用连接处的trna。
35.在前文第一方面和第二方面中,所述cas9缺刻酶可为ncas9(h840a);所述逆转录酶可为m-mlv-rt(moloney murine leukemia virus reverse transcriptase)突变体(突变点为:h9y,d200n,t306k,w313f,t330p,l603w)。
36.进一步地,所述融合蛋白两端可分别连接有核定位信号nls。
37.进一步地,在所述融合蛋白中,a1)和a2)之间可由linker连接。
38.在所述载体中,所述融合蛋白由含有所述融合蛋白的编码基因的表达盒表达而来。该表达盒的表达产物自n端到c端依次由核定位信号nls、ncas9(h840a)、连接肽、所述m-mlv-rt突变体和核定位信号nls组成。进一步地,该表达产物的氨基酸序列如seq id no.3所示。其中,第1-7位为核定位信号nls、第16-1382位为ncas9(h840a)、第1383-1415位为连接肽、第1416-2092位为所述m-mlv-rt突变体、第2107-2122位为核定位信号nls。其中,含有所述融合蛋白的编码基因的表达盒自5’端到3’端依次由玉米增强型启动子ubiquitin、核定位信号nls的dna编码序列、ncas9(h840a)的编码基因、连接肽的dna编码序列、所述m-mlv-rt突变体的编码基因、核定位信号nls的dna编码序列、polya、豌豆rubisco小亚基e9终止子组成(ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9)。
39.进一步地,含有所述融合蛋白的编码基因的表达盒的序列(反向互补序列)如seq id no.1的第14-9317位所示(对应seq id no.2的第14-9317位)。
40.在所述dna片段甲和所述dna片段乙中,所述启动子均为水稻组成型actin启动子;所述终止序列均为nos终止序列。
41.在所述dna序列i表达的成套向导rna中,pegrna序列为seq id no.1的第10809-10929位(对应seq id no.2的第11187-11307位);sgrna为seq id no.1的第11007-11102位(对应seq id no.2的第11385-11480位);
42.进一步地,所述dna序列i表达的成套向导rna的序列为seq id no.1的第10732-11179位(对应seq id no.2的第11110-11557位)。
43.在所述dna序列iii表达的成套向导rna中,pegrna序列为seq id no.2的第10809-10936位;sgrna为seq id no.2的第11014-11109位。
44.进一步地,所述dna序列iii表达的成套向导rna的序列为seq id no.2的第10732-11186位。
45.在(a1)中,所述抗生素抗性筛选标记蛋白由含有所述抗生素抗性筛选标记蛋白的编码基因的表达盒表达而来;在含有所述抗生素抗性筛选标记蛋白的编码基因的表达盒中,所述抗生素抗性筛选标记蛋白的编码基因由35s启动子启动表达。
46.进一步地,所述抗生素抗性筛选标记蛋白的编码基因为潮霉素抗性筛选标记基因。所述潮霉素抗性筛选标记基因的序列如seq id no.1的第18260-19285位的反向互补序列所示。
47.更进一步地,含有所述抗生素抗性筛选标记蛋白的编码基因的表达盒的反向互补序列如seq id no.1的第18046-20029位所示。
48.在(b2)中,在所述含有潮霉素抗性筛选标记基因突变体的表达盒中,所述潮霉素抗性筛选标记基因突变体由35s启动子启动表达。
49.进一步地,所述含有潮霉素抗性筛选标记基因突变体的表达盒的序列如seq id no.2的第18424-20407位所示。
50.在本发明的具体实施方式中,所述载体甲的序列如seq id no.1所示。所述载体乙的序列如seq id no.2所示。
51.第三方面,本发明要求保护前文第一方面或前文第二方面中所述的载体在对受体植物进行基因编辑中的应用。
52.第四方面,本发明要求保护一种对受体植物进行基因编辑的方法。
53.本发明要求保护的对受体植物进行基因编辑的方法,可包括如下步骤:将前文第一方面或第二方面中所述dna序列ii插入到前文第一方面或第二方面所述载体的所述插入位点,得到重组载体;将所述重组载体导入受体植物,从而实现对所述受体植物进行基因编辑。
54.在第三方面或第四方面中,所述受体植物可为单子叶植物;
55.进一步地,所述单子叶植物可为禾本科植物;
56.更进一步地,所述禾本科植物可为稻属植物;
57.更加具体地,所述稻属植物可为水稻。
58.在第三方面或第四方面中,所述基因编辑(精准编辑)可为多基因编辑;
59.进一步地,所述多基因编辑为同时对2个或2个以上,如2-4个基因进行编辑。
60.在上述各方面中,所述若干个均可以理解为两个或两个以上,如2-4个。
61.实验证明,本发明开发了两个代理引导编辑编辑系统,分别是基于osals
s627i
的单代理引导编辑系统,以及基于hygromycin
y46*
和osals
s627i
的双代理引导编辑系统,用于水稻内源基因的引导编辑,大大提高了编辑效率。基于osals
s627i
的单代理引导编辑器可以将精准编辑效率提高约14倍,而双代理系统可以将精准编辑效率最高提高约50倍。此外,本发明使用双代理系统同时精准编辑了多个内源性基因。总之,本发明为多基因精准编辑开发的代理引导编辑器将极大地扩展引导编辑在水稻多性状同时改良中的能力,并可能在未来扩展到其他作物。
附图说明
62.图1为本发明所涉及基因的pegrna和sgrna的设计。
63.图2为本发明各载体框架图。
64.图3为组培流程图。
65.图4为osspl14基因的组培流程图。
66.图5为目的基因编辑区域的测序峰图。
具体实施方式
67.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
68.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊
说明,均可从商业途径得到。
69.实施例1、通过借助代理引导编辑器进行水稻多基因精准编辑
70.一、材料和方法
71.(一)实验材料
72.用于水稻转化的水稻材料为中花11,由中国农业科学院作物科学研究所提供。
73.(二)载体构建
74.1、pe3基础载体的构建及其应用
75.(1)pe3基础载体的构建
76.pcxun-ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9载体全序列如seq id no.4所示。第7327-9317位反向互补序列为玉米增强型启动子ubi,第7216-7236位反向互补序列为sv40 nls的dna编码序列,第3091-7191位反向互补序列为ncas9(h840a)编码基因,第2992-3090位反向互补序列为linker(33aa)的dna编码序列,第961-2991位反向互补序列为m-mlv-rt(h9y,d200n,t306k,w313f,t330p,l603w)突变体编码基因,第871-918位反向互补序列为nls的dna编码序列,第649-863位反向互补序列为polya序列,第14-648位反向互补序列为e9终止子。
77.利用apn-fty/apn-rty引物对(具体序列见表1),以人工合成的片段(如seq id no.5所示)为模板进行pcr扩增,获得带有接头的包含actin启动子、polya和nos终止子的表达盒,把表达盒序列通过同源重组酶连入到hindⅲ和pmeⅰ双酶切后的pcxun-ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9载体,经测序验证正确后得到基础载体pcxun-ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9-actin-polya-nos(记为pe3基础载体),表达盒连入载体后原有的hindⅲ和pmeⅰ的酶切位点遭到破坏。
78.(2)利用pe3基础载体构建编辑目的基因的重组载体
79.把针对目的基因的trna-pegrna-trna-sgrna-trna的dna序列(与下文针对hptii基因的trna-pegrna-trna-sgrna-trna片段的dna序列相比差别仅在于其中的pegrna和sgrna序列不同,针对不同目的基因的pegrna和sgrna序列设计详见图1)通过overlap pcr进行扩增(相关引物见表1),利用同源重组酶进行连接插入到hindⅲ酶切后的pcxun-ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9-actin-polya-nos载体,经测序验证正确最终形成pcxun-ubi-nls-ncas9(h840a)-linker(33aa)-m-mlv-rt-nls-polya-e9-actin-trna-pegrna-trna-sgrna-trna-pol ya-nos,载体结构如图2所示(pe3载体-原始载体)。
80.当目的基因有多个或者针对一个目的基因有多个靶点时,可插入串联的多个针对目的基因的trna-pegrna-trna-sgrna-trna的dna序列。在最终载体中,如果两个以上trna-pegrna-trna-sgrna-trna片段直接相连,连接处的trna共用。
81.2、hygromycin
y46*
单代理基础载体的构建及其应用
82.(1)hygromycin
y46*
单代理基础载体的构建
83.首先突变pe3基础载体上的hptii基因,利用hpt-kpn-fty/hpt-mutant-r1和hpt-mutant-f2/hpt-rsr-rty引物对进行pcr扩增,使tyr 46(tat)变成终止密码子tag,利用hpt-kpn-fty/hpt-rsr-rty为引物,以第一轮pcr获得的片段按照摩尔比1:1进行混合后作
trna片段,最后通过overlap pcr,以第一轮pcr获得的sgrna trna片段和第二轮pcr获得的trna-pegrna-trna片段按照摩尔比1:1进行混合后作为模板,以pe3-fty/pe3-rty引物对进行扩增,获得带接头的针对osals基因的trna-pegrna-trna-sgrna-trna片段。相关引物具体序列见表1。
92.把针对水稻内源的osals基因带有接头的trna-pegrna-trna-sgrna-trna的dna序列(seq id no.1的第10707-11201位,对应gtgcggagcttttttgtaggtagac seq id no.2的第11110-11579位)通过overlap pcr方法获得,利用同源重组酶进行连接插入到hindⅲ酶切的pe3基础载体中,经测序验证正确后最终形成osals
s627i
单代理基础载体。
93.osals
s627i
单代理基础载体的全序列如seq id no.1所示。其中,第14-648位为e9终止子的反向互补序列,第649-863位为polya的反向互补序列,第871-918位为nls的反向互补序列,第961-2991位为m-mlv-rt(h9y,d200n,t306k,w313f,t330p,l603w)突变体编码基因的反向互补序列,第2992-3090位为liner(33a)dna编码的反向互补序列,第3091-7191位为ncas9(h840a)编码基因的反向互补序列,第7216-7236位为sv40 nls的反向互补序列,第7327-9317位为玉米增强型启动子ubi的反向互补序列,第9331-10731位为actin启动子,第10732-10808位为trna序列,第10809-10929位为pegrna(osals)序列,第10930-11006位为trna序列,第11007-11102位为sgrna(osals)序列,第11103-11179位为trna序列,第11185-11399位为polya的反向互补序列,第11400-11652位为nos终止子,第18046-18220位为camv polya signal反向互补序列,第18260-19285位为hptii基因反向互补序列,第19352-20029位为35s启动子的反向互补序列。
94.(2)利用osals
s627i
单代理基础载体构建编辑目的基因的重组载体
95.将针对其它目的基因的trna-pegrna-trna-sgrna-trna的dna序列(与针对osals基因的trna-pegrna-trna-sgrna-trna片段的dna序列相比差别仅在于其中的pegrna和sgrna序列不同,针对不同目的基因的pegrna和sgrna序列设计详见图1)通过overlap pcr方法获得(相关引物见表1),利用同源重组酶插入到hindⅲ酶切的osals
s627i
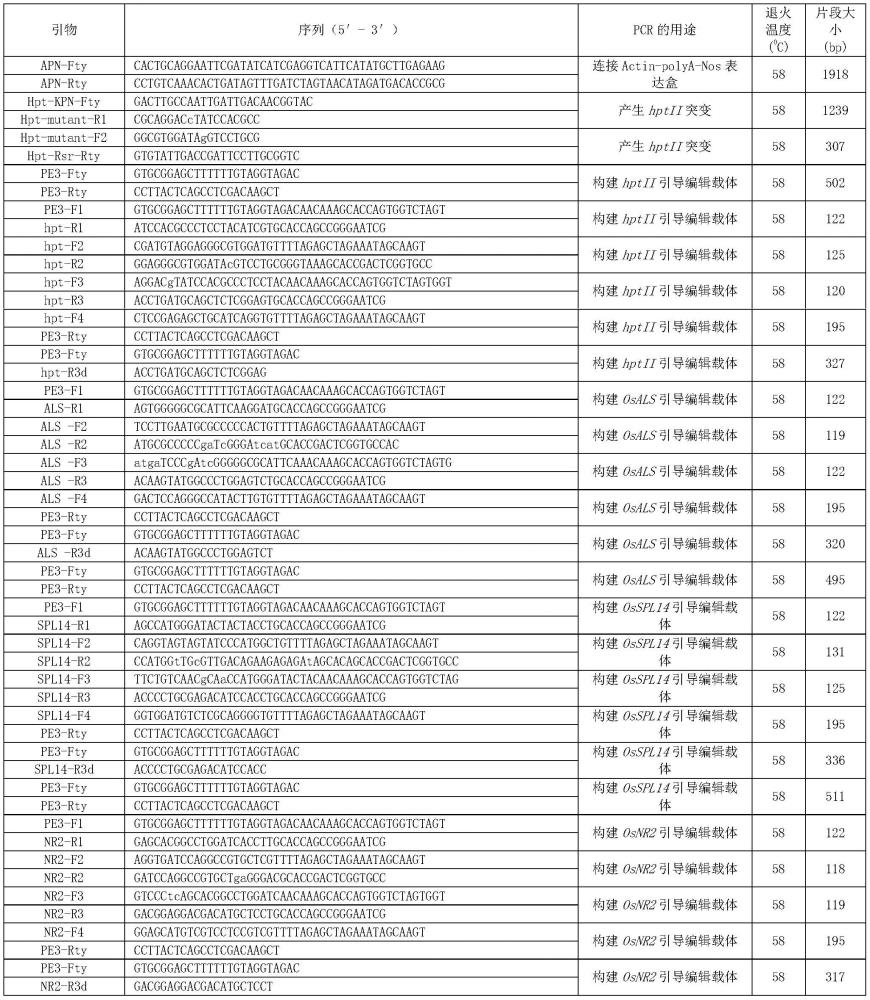
单代理基础载体中,然后进行序列测定。所得载体结构如图2所示(pe3-as载体(osals
s627i
单代理系统))。
96.当目的基因有多个或者针对一个目的基因有多个靶点时,可插入串联的多个针对目的基因的trna-pegrna-trna-sgrna-trna的dna序列。在最终载体中,如果两个以上trna-pegrna-trna-sgrna-trna片段直接相连,连接处的trna共用。
97.4、hygromycin
y46*
和osals
s627i
双代理基础载体的构建及其应用
98.(1)hygromycin
y46*
和osals
s627i
双代理基础载体的构建
99.把针对水稻内源的osals基因带有接头的pegrna-trna-sgrna-trna的dna序列(seq id no.1的第10787-11201位,对应seq id no.2的第11165-11579位)使用als-hs-fty/pe3-rty引物对(相关引物见表1),以osals基因带有接头的trna-pegrna-trna-sgrna-trna的dna序列(seq id no.1的第10707-11201位,对应gtgcggagcttttttgtaggtagac seq id no.2的第11110-11579位)为模板进行pcr扩增,利用同源重组酶插入到hindⅲ酶切的hygromycin
y46*
单代理基础载体中,经测序正确后最终形成hygromycin
y46*
和osals
s627i
双代理基础载体。
100.hygromycin
y46*
和osals
s627i
双代理基础载体的全序列如seq id no.2所示。其中,第14-648位为e9终止子的反向互补序列,第649-863位为polya的反向互补序列,第871-918
位为nls的dna编码序列的反向互补序列,第961-2991位为m-mlv-rt(h9y,d200n,t306k,w313f,t330p,l603w)突变体编码基因的反向互补序列,第2992-3090位为linker(33a)的dna编码序列的反向互补序列,第3091-7191位为ncas9(h840a)编码基因的反向互补序列,第7216-7236位为sv40 nls的反向互补序列,第7327-9317位为玉米增强型启动子ubi的反向互补序列,第9331-10731位为actin启动子,第10732-10808位为trna序列,第10809-10936位为pegrna(hptii)序列,第10937-11013位为trna序列,第11014-11109位为sgrna(hptii)序列,第11110-11186位为trna序列,第11187-11307位为pegrna(osals)序列,第11308-11384位为trna序列,第11385-11480位为sgrna(osals)序列,第11481-11557位为trna序列,第11563-11777位为polya,第11778-12030位为nos终止子,第18424-18598位为camv polya signal反向互补序列,第18638-19663位为mhptii编码基因的反向互补序列(把tyr 46(tat)变成终止密码子tag),第19730-20407位为35s启动子的反向互补序列。
101.(2)利用hygromycin
y46*
和osals
s627i
双代理基础载体构建编辑目的基因的重组载体
102.将针对其它目的基因的trna-pegrna-trna-sgrna-trna片段通过overlap pcr扩增后利用同源重组酶插入到hindⅲ酶切的hygromycin
y46*
和osals
s627i
双代理基础载体中。所得载体结构如图2所示(pe3-ds载体(双代理系统))。
103.当目的基因有多个或者针对一个目的基因有多个靶点时,可插入串联的多个针对目的基因的trna-pegrna-trna-sgrna-trna的dna序列。在最终载体中,如果两个以上trna-pegrna-trna-sgrna-trna片段直接相连,连接处的trna共用。
104.(三)转基因水稻的获得
105.1、选取饱满的中花11水稻种子,剥去种皮,灭菌、消毒并清洗后,均匀地点入在含有浓度为3.5mg/l的2,4-d的灭菌n6固体培养基(phytotech,c167)中,28℃黑暗培养30-40d以诱导愈伤组织的产生。
106.2、将步骤1得到的愈伤组织在含有0.3m甘露醇和0.3m山梨醇的n6培养基中高渗处理4-6h后,将待导入质粒通过基因枪轰击水稻愈伤,采用0.6μm金粉,轰击压力为900psi进行轰击,轰击后在含有0.3m甘露醇和0.3m山梨醇的n6培养基中先放置在32℃培养箱处理6h后,再移至30℃培养10h后转移至n6筛选培养基(含有0.5mg/l的2,4-d和50mg/l的潮霉素的n6固体培养基)中,30℃持续暗培养2周。
107.3、选取生长良好呈嫩黄色的抗性愈伤组织,用无菌镊子移至第二轮筛选培养基上,pe3原始载体组和pe-hs载体组移到含有0.5mg/l的2,4-d和50mg/l的潮霉素的n6固体培养基,pe-as载体组和pe-ds载体组额外添加0.65μmol/l的双草醚(bs),30℃持续暗照培养2-3周。
108.4、完成步骤3后,挑选生长旺盛的愈伤组织转入ms再生培养基(phytotech,m524)(含有0.02mg/l naa、2mg/l kinetin)中,28℃持续光照培养。
109.5、完成步骤4后,待分化出来的幼苗长至2至5cm,转入ms固体培养基(phytotech,m519)中28℃光照培养2到4周,之后移入生根培养基中置于温室生长(温度28-30℃,16h光照/8h黑暗),得到t0代植株。对t0代植株进行基因型分析,获得目标植物移入土中并单株收种(图3)。
110.(四)转基因水稻的基因型鉴定
111.提取待测植株的基因组dna,以基因组dna为模板,对进行pcr扩增,通过sanger测序确定植株的基因型。所用引物参见表1。
112.表1、本发明引物
113.114.[0115][0116]
三、结果与分析
[0117]
本发明提出了一种假设,可通过对代理引导编辑器中hptii或osals精准编辑事件的富集,进一步富集引导编辑活性细胞。通过精准编辑将引导编辑载体中hptii的终止密码子(*)精准校正为tyr46,可恢复水稻愈伤组织对潮霉素的抗性,从而充当基于hygromycin
y46*
的单代理引导编辑系统(pe3-hs)。此外,因hptii突变体(mhptii)是一个外源基因,本发明还添加了一个基于内源性等位基因osals
s627i
的代理系统(pe3-as)(图2),osals既可作为内源基因,也可作为一个代理系统,用于富集其他目标内源基因的精准编辑
事件。osals中627位的丝氨酸突变为异亮氨酸(ser-to-ile)将赋予水稻对双草醚(bs)的除草剂抗性,在愈伤组织诱导和筛选过程中,双草醚可以作为筛选剂。本发明还进一步推断,当基于hygromycin
y46*
和osals
s627i
的代理引导编辑器作为双代理引导编辑器(pe3-ds)使用时,其对于活性细胞的富集作用将高于单一代理引导编辑器,因此双代理引导编辑器可更有效地富集内源基因的精准编辑事件。
[0118]
为了测试上述假设,本发明选择了几个内源基因作为引导编辑的目标基因进行相关实验(图1),内源基因包括osspl14(也称为osipa1),osdhdps,osnr2,以及osepsps基因。每个内源基因的pegrna和sgrna的详细设计如图1所示。为了实现多基因引导编辑,使用trna策略同时产生一组串联的pegrnas和sgrnas。
[0119]
本发明分别测试了这三种代理系统对内源基因osspl14、osdhdps和osnr2进行引导编辑的效率。如图4所示,对于内源基因osspl14的引导编辑,mhptii载体(ck)转化的愈伤组织在单独添加潮霉素或同时潮霉素和bs的诱导培养基上培养4周后,几乎未得到再生植株;而使用代理系统时,转化后的愈伤在潮霉素或潮霉素和bs的诱导培养基上培养4周后获得的抗性愈伤均可分化出再生植株(图4),且植株假阳性率低,此结果表明代理系统可有效地富集内源基因的精准编辑事件。进一步研究发现,pe3-as,pe3-ds的筛选效果优于pe3-hs。
[0120]
对于osspl14基因,本发明通过基因枪介导的遗传转化将pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别转化200个水稻愈伤组织,并将每个愈伤组织再生的所有植株作为单一事件处理。通过水稻遗传转化,pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别获得了101、95、20和73簇独立的再生植株(表2)。使用表1中列出的引物osspl14-f/osspl14-r,以上述再生植株的基因组dna为模板进行pcr扩增,并对pcr产物进行sanger测序,通过对测序进行分析,最终确定每个独立株系的基因型。结果表明,转化pe3原始载体、pe3-hs、pe3-as和pe3-ds载体最终分别获得了1簇、2簇、2簇和9簇精准编辑植株,精准编辑效率分别为1.0%、2.1%、10.0%和12.3%。进一步分析表明,与pe3原始载体相比,代理系统pe3-hs、pe3-as和pe3-ds可将引导编辑效率分别提高约2倍、10倍和12倍,其中双代理系统编辑效率最高(表2)。值得注意的是,在双代理系统转化获得的9簇精准编辑植株中,3簇为杂合编辑植株,6簇为双等位编辑植株(图5):一条链发生精准编辑,另一条链发生部分精准编辑。且上述9簇精准编辑植株中,绝大多数编辑植株的hptii和osals
s627i
基因型为纯合或杂合,仅少量植株存在逃逸现象,这可能与再生培养基不添加筛选有关(数据未显示)。
[0121]
对于osdhdps基因,本发明通过基因枪介导的遗传转化将pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别转化200个水稻愈伤组织,并将每个愈伤组织再生的所有植株作为单一事件处理。通过水稻遗传转化,pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别获得了94、80、35和24簇独立的再生植株(表2)。使用表1中列出的引物osdhdps-f/osdhdps-r,以上述再生植株的基因组dna为模板进行pcr扩增,并对pcr产物进行sanger测序,通过对测序进行分析,最终确定每个独立株系的基因型。结果表明,转化pe3原始载体、pe3-hs、pe3-as和pe3-ds载体最终分别获得了0簇、1簇、5簇和13簇精准编辑植株,精准编辑效率分别为0%、1.3%、14.3%和54.2%(表2)。进一步分析表明,与pe3原始载体相比,代理系统pe3-hs、pe3-as和pe3-ds可以将引导编辑效率分别提高约2倍、约14倍、约50倍。同样,双代理系统编辑效率最高(表2)。
[0122]
对于osnr2,本发明通过基因枪介导的遗传转化将pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别转化200个水稻愈伤组织,并将每个愈伤组织再生的所有植株作为单一事件处理。通过水稻遗传转化,pe3原始载体、pe3-hs、pe3-as和pe3-ds载体分别获得了102、48、41和31簇独立的再生植株(表2)。使用表1中列出的引物osnr2-f/osnr2-r,以上述再生植株的基因组dna为模板进行pcr扩增,并对pcr产物进行sanger测序,通过对测序进行分析,最终确定每个独立株系的基因型。通过对测序进行分析,最终确定每个独立株系的基因型。结果表明,转化pe3原始载体未获得精准编辑的株系,而pe3-hs、pe3-as和pe3-ds载体最终分别获得了1簇、1簇和1簇精准编辑植株,精准编辑效率分别为2.1%、2.4%和3.2%(表2)。osnr2相对较低的编辑效率可能表明,引导编辑效率也取决于目标内源性基因的固有性质。上述结果表明,代理系统可使原始载体不能发生精准编辑的目标基因(如osdhdps,osnr2)中实现了精准编辑。在引导编辑的代理系统中,双代理系统在实现精准编辑方面是最有效、和省时省力的。
[0123]
表2、通过不同的代理引导编辑器编辑不同目的基因的精准编辑效率统计
[0124][0125][0126]
本发明利用双代理系统在水稻中进行了多基因引导编辑,如:osspl14与osals组合、osdhdps与osals组合、osnr2与osals组合,上述组合中两个内源基因同时发生精准编辑的效率分别为9.6%(7/73)、45.8%(11/24)和3.2%(1/31)(表3)。本发明还利用双代理系统对不同内源基因组合进行了同时精准编辑,基因组合如下:osspl14与osdhdps、osdhdps与osspl14、osspl14与osepsps、osspl14与osvq25、osspl14与oscyp71a1、osdhdps与osvq25,在osals发生精准编辑的基础上,上述组合中多基因同时发生精准编辑(精准编辑/基因敲除)的效率分别为4.7%(3/64)、4.8%(3/62)、3.8%(2/52)、1.8%(1/56)、6.7%(1/15)和4.0%(1/25)(表3)。此外,本发明还测试了利用pe3-as系统同时精准编辑两个内源性基因osspl14和osdhdps的能力,多基因精准编辑效率为2.6%(3/115),编辑效率低于双代
理系统。
[0127]
表3、代理编辑系统介导的多基因精准编辑效率统计
[0128][0129][0130]
注:表中ho:纯合,he:杂合,bi:双等位,d12:删除12bp,i44:插入44bp。
[0131]
为了评估水稻中代理引导编辑系统的特异性,使用表1中的相关引物对每个靶点潜在的脱靶位点(crispr-ge,http://skl.scau.edu.cn/)(表4)进行了脱靶分析。结果表明,本发明在预测的脱靶位点未检测到脱靶现象。
[0132]
表4、潜在的脱靶位点分析
[0133][0134][0135]
注:表中“潜在的脱靶位点序列”一列中加粗字体表示错配碱基,下划线处表示pam位点。
[0136]
综上所述,本发明利用osals
s627i
的单代理引导基因编辑器(pe3-as)和基于hygromycin
y46*
和osals
s627i
的双代理引导编辑器(pe3-ds),显著提高了水稻中引导编辑效
率,并在此基础上开发了高效的植物多基因引导编辑系统,在水稻中实现了高效多基因精准编辑,进一步拓展了引导编辑系统在农作物多基因聚合育种中的应用。
[0137]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。