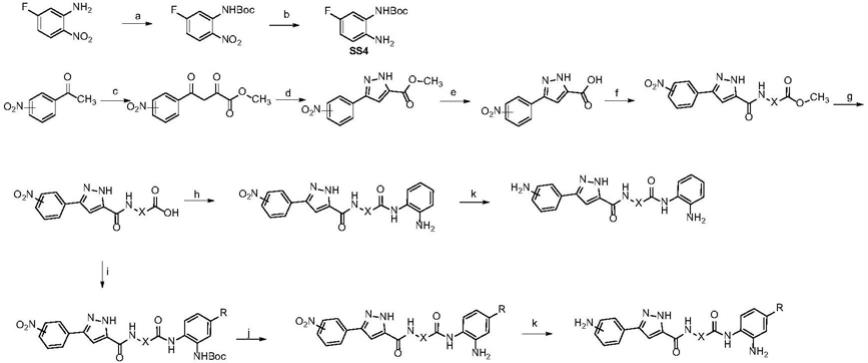
1.本发明属于医药技术领域,涉及一种苯基吡唑类化合物,及其药学上可接受的盐、水合物,和以该化合物为活性成分的药物组合物,以及在制备组蛋白去乙酰化酶抑制剂及用于治疗和/或预防癌症药物中的应用。
背景技术:
2.组蛋白乙酰化修饰是表观遗传修饰的一种重要方式,人类绝大多数肿瘤细胞都存在组蛋白修饰异常,这种异常能引起抑癌基因沉默致使肿瘤形成。组蛋白去乙酰化酶(histone deacetylases,hdac)是一类能够使组蛋白乙酰化的酶,同时能够乙酰化50多种非组蛋白。人体中的组蛋白去乙酰化酶包含18种亚型,可以分为4类。hdac1、2、3和8属于ⅰ类亚型,存在于细胞核中,而hdac3能够存在于细胞质中。ⅱ类亚型又可以分为ⅱa类(hdac4,5,7和9)和ⅱb类(hdac6,10)。hdac11属于第ⅳ类亚型。ⅲ类的sirtuin家族依赖于烟酰胺腺嘌呤核苷酸(nicotinamide adenine dinucleotide,nad
)。第ⅰ、ⅱ、ⅳ类由于结构中都含有锌离子结合域,属于锌离子依赖的经典hdacs。
3.在hdac家族成员中,hdac3能够同时存在于细胞核和细胞质中,并在细胞核和细胞质之间穿梭。hdac3能够催化组蛋白和非组蛋白(核因子κb,信号转导子和转录激活子3,src激酶)的去乙酰化。最近研究表明,抑制hdac3与多种疾病的治疗有明显的联系,如癌症,炎症,代谢疾病和神经退行性疾病。因此hdac3抑制剂不仅可以作为研究hdac3蛋白功能的化学探针,而且可以作为低毒的药物治疗相关疾病。
技术实现要素:
4.本发明目的在于提供一种苯基吡唑类化合物,及其药学上可接受的盐、水合物,和以该化合物为活性成分的药物组合物,以及在制备组蛋白去乙酰化酶抑制剂及用于治疗和/或预防癌症药物中的应用。
5.为实现上述目的,本发明采用技术方案为:
6.一种苯基吡唑类化合物,化合物如通式i所示
[0007][0008]
其中,
[0009]
r1、r3可相同或不同的氢、氧、c1
‑
c4的烷基、c1
‑
c4的酰基、未取代或被至少一个基团取代的c3
‑
c6的环烷基、苯基、苄基或吡啶基;下述基团为卤素、c1
‑
c4的烷基、c1
‑
c4的烷氧基;
[0010]
r2为h或卤素;
[0011]
x为或c
m
h
2m
,m=2
‑
6的整数。
[0012]
优选,所述化合物如通式i所示,式中,
[0013]
r1、r3可相同或不同的氢、氧、c1
‑
c3的烷基、c1
‑
c3的酰基、未取代或被1
‑
3个基团取代的c3
‑
c6的环烷基或苯基;下述基团为卤素、c1
‑
c3的烷基、c1
‑
c3的烷氧基;
[0014]
r2为h、氟或氯;
[0015]
x为或c
m
h
2m
,m=2
‑
6的整数。
[0016]
进一步优选,所述化合物为:
[0017]3‑
(4
‑
氨基苯基)
‑
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0018]3‑
(4
‑
氨基苯基)
‑
n
‑
{5
‑
[(2
‑
氨基苯基)氨基]
‑5‑
氧代戊基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0019]3‑
(4
‑
氨基苯基)
‑
n
‑
{7
‑
[(2
‑
氨基苯基)氨基]
‑7‑
氧代庚基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0020]3‑
(4
‑
氨基苯基)
‑
n
‑
{4
‑
[(2
‑
氨基苯基)氨基甲酰基]苄基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0021]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0022]
n
‑
{5
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑5‑
氧代戊基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0023]
n
‑
{7
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑7‑
氧代庚基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0024]
n
‑
{4
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基甲酰基]苄基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0025]3‑
(3
‑
氨基苯基)
‑
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(3
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0026]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0027]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0028]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(二甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0029]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(二甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0030]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
丙酰胺基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0031]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
丙酰胺基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0032]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0033]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苯基氨基)苯基]
‑
1h
‑
吡
唑
‑5‑
甲酰胺、
[0034]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苄基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0035]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苄基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0036]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0037]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0038]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环丁基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0039]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环丁基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0040]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(环丙基甲基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0041]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(环丙基甲基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0042]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环戊基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0043]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环戊基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0044]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(吡咯烷
‑1‑
基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0045]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(吡咯烷
‑1‑
基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0046]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(4
‑
甲氧基苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0047]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(4
‑
甲氧基苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0048]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(对甲苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0049]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(对甲苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0050]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(2,6
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0051]
n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(2,6
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺、
[0052]
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氯苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺。
[0053]
下面的合成路线描述了本发明的式i化合物的制备,所有的原料都是通过这些路线中描述的方法、通过有机化学领域普通技术人员熟知的方法制备的或者可商购。本发明的全部最终化合物都是通过这些路线中描述的方法或通过与其类似的方法制备的,这些方法是有机化学领域普通技术人员熟知的。这些路线中应用的全部可变因数如下文的定义或权利要求中的定义。
[0054]
按照本发明的式i化合物,当氮原子上无取代时,按照路线一的方法制得实施例。其他各取代基如
技术实现要素:
所定义。
[0055][0056]
试剂和条件:(a)二碳酸二叔丁酯,三乙胺,二氯甲烷,室温;(b)5%钯碳,氢气,甲醇,室温;(c)草酸二甲酯,甲醇钠,乙醚,室温;(d)80%水合肼,冰醋酸,100℃;(e)氢氧化钠,水,60℃;(f)不同的氨基酸甲酯盐酸盐,1
‑
羟基苯并三唑,1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐,三乙胺,n,n
‑
二甲基甲酰胺,室温;(g)氢氧化钠,水,60℃;(h)邻苯二胺,2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯,n,n
‑
二异丙基乙胺,n,n
‑
二甲基甲酰胺,室温;(i)ss4,2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯,n,n
‑
二异丙基乙胺,n,n
‑
二甲基甲酰胺,室温;(j)三氟乙酸,二氯甲烷,室温;(k)锌粉,氯化铵,水,乙醇,80℃。
[0057]
当氮原子上为其它取代基时,按照路线二的方法制得实施例。其他各取代基如发明内容所定义。
[0058][0059]
试剂和条件:(a)二碳酸二叔丁酯,三乙胺,二氯甲烷,室温;(b)5%钯碳,氢气,甲醇,室温;(c)醋酸钯,(
±
)
‑
2,2'
‑
双
‑
(二苯膦基)
‑
1,1'
‑
联萘,不同的胺,碳酸铯,甲苯,80℃或叔丁醇钾,卤代物,二氯甲烷,室温或丙酰氯,三乙胺,二氯甲烷,室温;(d)草酸二甲酯,甲醇钠,乙醚,室温;(e)80%水合肼,冰醋酸,100;℃(f)氢氧化钠,水,60;℃(g)6
‑
氨基酸甲酯盐酸盐,1
‑
羟基苯并三唑,1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐,三乙胺,n,n
‑
二甲基甲酰胺,室温;(h)氢氧化钠,水,60;℃(i)邻苯二胺,2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯,n,n
‑
二异丙基乙胺,n,n
‑
二甲基甲酰胺,室温;(j)ss4,2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯,n,n
‑
二异丙基乙胺,n,n
‑
二甲基甲酰胺,室温;(k)三氟乙酸,二氯甲烷,室温。
[0060]
苯基吡唑类化合物的应用,所述通式i所示化合物在制备与组蛋白去乙酰化酶活性异常表达相关的疾病药物中的应用。
[0061]
所述通式i所示化合物在制备抗肿瘤药物中的应用。
[0062]
所述通式i所示化合物在制备治疗和/或预防前列腺癌、乳腺癌、宫颈癌或白血病药物中的应用。
[0063]
一种药物组合物,包含所述通式i所示化合物。
[0064]
所述权利要求1中所示化合物与药学上可接受的赋型剂。
[0065]
本发明包括药物组合物,该组合物含有上式i的含有苯基吡唑类化合物和药物上可接受的赋型剂。所述药物上可接受的赋型剂是指任何可用于药物领域的稀释剂、辅助剂和/或载体。本发明的化合物可以与其他活性成分组合使用,只要它们不产生其他不利的作用,例如过敏反应等。
[0066]
本发明的药物组合物可配制成若干种剂型,其中含有药物领域中常用的一些赋型剂,例如,口服制剂(如片剂,胶囊剂,溶液或混悬液);可注射的制剂(如可注射的溶液或混悬液,或者是可注射的干燥粉末,在注射前加入注射用水可立即使用);局部制剂(例如软膏或溶液)。
[0067]
用于本发明药物组合物的载体是药物领域中可得到的常见类型,包括:口服制剂
用的粘合剂、润滑剂、崩解剂、助溶剂、稀释剂、稳定剂、悬浮剂、色素、矫味剂等;可注射制剂用的防腐剂、加溶剂、稳定剂等;局部制剂用的基质、稀释剂、润滑剂、防腐剂等。药物制剂可以经口服或胃肠外方式(例如静脉内、皮下、腹膜内或局部)给药,如果某些药物在胃部条件下是不稳定的,可将其配制成肠衣片剂。
[0068]
通过体外酶抑制实验可见,本发明化合物可抑制组蛋白去乙酰化酶,可用于制备与组蛋白去乙酰化酶异常表达相关的疾病中的药物的应用。
[0069]
通过体外活性及体内药效学研究,本发明化合物具有抗肿瘤活性可以用于制备治疗和/或预防各种癌症的药物,如乳腺癌、结直肠癌、前列腺癌、和白血病等。
[0070]
本发明活性化合物可作为唯一的抗癌药物使用,或者与一种或多种其它抗肿瘤药物联合使用。联合治疗通过将各个治疗组分同时、顺序或隔开给药来实现。
[0071]
一种药物组合物的应用,所述组合物在制备与组蛋白去乙酰化酶活性异常表达相关的疾病药物中的应用。
[0072]
本发明所具有的优点:
[0073]
本发明具有抗肿瘤活性的苯基吡唑类化合物;本发明制备方法操作简单、条件温和,所得化合物表现出良好的hdac3抑制作用。体外抗肿瘤活性测试结果表明,对多种肿瘤细胞表现出良好的抗增殖活性,尤其是抗白血病活性。
具体实施方式:
[0074]
下面通过具体的实施例对本发明进行详细说明,但这些实施方式的用途和目的仅用来列举本发明,并非对本发明的实际保护范围构成任何形式的任何限定,更非将本发明的保护范围局限于此。
[0075]
步骤a:(5
‑
氟
‑2‑
硝基苯基)氨基甲酸叔丁酯的制备
[0076][0077]
将5
‑
氟
‑2‑
硝基苯胺1.5g(9.6mmol)溶于二氯甲烷,然后加入三乙胺2.0ml(14.4mmol)和二碳酸二叔丁酯1.4ml(9.6mmol),室温反应2小时。反应结束后,蒸除溶剂,得淡黄色固体2.5g。
[0078]
步骤b:(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯的制备
[0079][0080]
将(5
‑
氟
‑2‑
硝基苯基)氨基甲酸叔丁酯2.5g(9.7mmol)溶于甲醇,加入0.25g钯碳,氢气保护下反应3小时,抽滤除去钯碳,蒸除溶剂,得浅紫色固体2.4g。
[0081]
实施例1:3
‑
(4
‑
氨基苯基)
‑
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑
1h
‑
吡唑
‑5‑
甲酰胺的制备
[0082]
步骤c:4
‑
硝基苯基
‑
2,4
‑
二氧代丁酸甲酯的制备
[0083][0084]
将0.31g(1.85mmol)对硝基苯乙酮和0.33g(2.77mmol)草酸二甲酯溶于20ml干燥的四氢呋喃,在0℃下加入0.15g(3.7mmol)甲醇钠。随后将反应液移至室温搅拌2.5h。将反应液减压浓缩得到黄色固体0.62g,收率:89.6%。
[0085]
步骤d:3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
羧酸甲酯的制备
[0086][0087]
将0.56g(2.25mmol)4
‑
硝基苯基
‑
2,4
‑
二氧代丁酸甲酯溶于20ml乙酸,滴加0.35ml(7.19mmol)水合肼(80%),于80℃搅拌4h。待反应液冷却至室温,将反应液倒入100ml水中,抽滤,水洗,干燥。得到白色固体0.34g,收率:58.9%。
[0088]
步骤e:3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
羧酸的制备
[0089][0090]
将0.34g(1.39mmol)3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
羧酸甲酯溶于15ml四氢呋喃,滴加4ml氢氧化钠溶液(1mol/l),于60℃搅拌2.5h。冷却至室温,减压蒸除有机溶剂,加入10ml水,用盐酸水溶液(2mol/l)调节ph至5左右。抽滤,水洗,得白色固体0.31g,收率:93.5%。
[0091]
步骤f:6
‑
[3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺基]己酸甲酯的制备
[0092][0093]
将0.31g(1.34mmol)3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
羧酸溶于干燥的n,n
‑
二甲基甲酰胺,加入0.34ml(4.02mmol)三乙胺和0.22g(1.61mmol)1
‑
羟基苯并三唑,室温搅拌10min,加入0.29g(1.61mmol)6
‑
氨基己酸甲酯盐酸盐,继续搅拌15min,加入0.31g(1.61mmol)1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐,继续搅拌12h。反应液乙酸乙酯萃取3次(50ml
×
3),饱和碳酸氢钠洗,水洗,饱和氯化钠洗,无水硫酸钠干燥。减压蒸干溶剂,以二氯甲烷∶甲醇(v/v)=50∶1为洗脱剂硅胶柱层析,分离得到白色固体0.24g,收率:52.8%。步骤g:6
‑
[3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺基]己酸的制备
[0094][0095]
将0.24g(0.84mmol)6
‑
[3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺基]己酸甲酯溶于15ml四氢呋喃,滴加3ml氢氧化钠溶液(1mol/l),于60℃搅拌2.5h。冷却至室温,减压蒸除有机溶剂,加入10ml水,用盐酸水溶液(2mol/l)调节ph至5左右。抽滤,水洗,得白色固体
0.20g,收率:81.3%。
[0096]
步骤h:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺的制备
[0097][0098]
将0.20g(0.78mmol)6
‑
[3
‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺基]己酸溶于干燥的n,n
‑
二甲基甲酰胺,加入0.13ml(0.75mmol)n,n
‑
二异丙基乙胺和0.18g(0.47mmol)2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n
′
,n
′‑
四甲基脲六氟磷酸酯,室温搅拌30min,加入0.08g(0.62mmol)邻苯二胺,继续搅拌12h。反应液乙酸乙酯萃取3次(50ml
×
3),饱和碳酸氢钠洗,水洗,饱和氯化钠洗,无水硫酸钠干燥。减压蒸干溶剂,以二氯甲烷∶甲醇(v/v)=30∶1为洗脱剂硅胶柱层析,分离得到白色固体0.18g,收率:58.6%。
[0099]
步骤i:3
‑
(4
‑
氨基苯基)
‑
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧己代基}
‑
1h
‑
吡唑
‑5‑
甲酰胺的制备
[0100][0101]
称取0.15g(2.3mmol)锌粉加入100ml烧瓶中,再加入0.13g(2.3mmol)氯化铵和2ml水,在60℃下活化30min。将0.2g(0.46mmol)n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
硝基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺溶于20ml乙醇中,加入烧瓶后升温至90℃反应1h。反应完成后,抽滤除去锌粉,蒸除乙醇,加入20ml水,乙酸乙酯(50ml
×
3)萃取,无水硫酸钠干燥,减压蒸干溶剂,以二氯甲烷∶甲醇(v/v)=25∶1为洗脱剂硅胶柱层析,分离得到类白色固体0.18g,即得实施例1,收率:58.3%。结构如下:
[0102][0103]
谱图数据如下:esi
‑
ms:m/z,429.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.15(d,j=2.1hz,1h),9.07(s,1h),8.02(t,j=6.0hz,1h),7.43(d,j=8.8hz,2h),7.14(dd,j=7.8,1.5hz,1h),6.80(td,j=7.8,1.5hz,1h),6.71(td,j=7.8,1.5hz,2h),6.61(d,j=8.8hz,2h),6.52(td,j=7.8,1.5hz,1h),5.35(s,2h),4.80(s,2h),3.23(q,j=6.8hz,2h),2.32(t,j=7.4hz,2h),1.63(m,j=7.4hz,2h),1.54(m,j=7.4hz,2h),1.35(m,j=7.4hz,2h);
13
c nmr(100mhz,dmso
‑
d6)δ171.58,162.27,149.60,148.17,144.88,142.34,126.82,126.12(2c),125.76,124.04,116.85,116.62,116.32,114.28(2c),100.65,38.74,36.24,29.69,26.64,25.61.
[0104]
实施例2:3
‑
(4
‑
氨基苯基)
‑
n
‑
{5
‑
[(2
‑
氨基苯基)氨基]
‑5‑
氧代戊基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0105]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为5
‑
氨基戊酸甲酯盐酸盐,分离得到类白色固体0.21g,即得实施例2,收率:48.5%。结构如下:
[0106][0107]
谱图数据如下:esi
‑
ms:m/z,415.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.17(s,1h),9.09(s,1h),8.09(t,j=6.0hz,1h),7.43(d,j=8.5hz,1h),7.16(dd,j=7.8,1.2hz,1h),6.88(td,j=7.8,1.2hz,1h),6.74(d,j=1.8hz,1h),6.71(dd,j=7.8,1.2hz,1h),6.60(d,j=8.5hz,2h),6.53(td,j=7.8,1.2hz,1h),5.36(s,2h),4.82(s,2h),3.26(q,j=6.0hz,2h),2.34(t,j=6.8hz,2h),1.60(m,4h);
13
c nmr(100mhz,dmso
‑
d6)δ171.55,162.33,149.58,148.14,144.90,142.31,126.82,126.13,125.74(2c),124.02,116.86,116.62,116.33,114.30(2c),100.68,38.58,35.96,29.51,23.30.
[0108]
实施例3:3
‑
(4
‑
氨基苯基)
‑
n
‑
{7
‑
[(2
‑
氨基苯基)氨基]
‑7‑
氧代庚基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0109]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为7
‑
氨基庚酸甲酯盐酸盐,分离得到类白色固体0.20g,即得实施例3,收率:54.2%。结构如下:
[0110][0111]
谱图数据如下:esi
‑
ms:m/z,443.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.15(s,1h),9.08(s,1h),8.01(t,j=5.7hz,1h),7.43(d,j=8.4hz,2h),7.15(d,j=7.2hz,1h),6.88(t,j=7.2hz,1h),6.73(d,j=7.2hz,1h),6.70(s,1h),6.61(d,j=8.4hz,2h),6.52(m,1h),5.35(s,2h),4.80(s,2h),3.23(q,j=6.5hz,3h),2.31(t,j=7.3hz,2h),1.65
‑
1.55(m,2h),1.55
‑
1.47(m,2h),1.34(s,4h);
13
c nmr(100mhz,dmso
‑
d6)δ171.60,162.26,149.60,148.18,144.88,142.34,126.81(2c),126.12,125.74,124.06,116.84,116.63,116.34,114.27(2c),100.65,38.79,36.23,29.77,28.95,26.74,25.79.
[0112]
实施例4:3
‑
(4
‑
氨基苯基)
‑
n
‑
{4
‑
[(2
‑
氨基苯基)氨基甲酰基]苄基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0113]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为氨甲基苯甲酸甲酯盐酸盐,分离得到类白色固体0.28g,即得实施例4,收率:65.3%。结构如下:
[0114][0115]
谱图数据如下:esi
‑
ms:m/z,449.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.25(d,j=2.2hz,1h),9.61(s,1h),8.74(t,j=6.3hz,1h),7.93(d,j=8.1hz,2h),7.40(d,j=8.1hz,2h),7.43(m,3h),7.16(dd,j=7.8,1.5hz,1h),6.96(td,j=7.8,1.5hz,1h),6.78(s,1h),6.77(dd,j=7.8,1.5hz,1h),6.61(d,j=8.1hz,2h),5.37(s,2h),4.88(s,2h),4.50(d,j=6.3hz,2h);
13
c nmr(100mhz,dmso
‑
d6)δ165.62,162.53,149.66,147.84,
145.04,144.05,143.57,133.47,128.21(2c),127.42(2c),127.12,126.89,126.85(2c),123.81,116.74,116.70,116.57,114.27(2c),100.82,42.21.
[0116]
实施例5:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0117]
按照实施例1记载的步骤,将步骤h中得邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基,最后通过锌粉、氯化铵还原得类白色固体0.24g,即得实施例5,收率:59.2%。结构如下:
[0118][0119]
谱图数据如下:esi
‑
ms:m/z,447.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.15(s,1h),8.99(s,1h),8.02(t,j=5.7hz,1h),7.43(d,j=8.5hz,2h),7.08(dd,j=8.7,6.4hz,1h),6.73(d,j=2.0hz,1h),6.61(d,j=8.5hz,2h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.35(s,2h),5.11(s,2h),3.23(q,j=6.6hz,2h),2.30(t,j=7.4hz,2h),1.61(qui,j=6.8hz,2h),1.54(qui,j=6.8hz,2h),1.33(qui,j=6.8hz,2h);
13
c nmr(100mhz,dmso
‑
d6)δ171.82,162.27,159.72,149.60,148.17,144.89,144.64,127.60,126.82(2c),120.05,116.84,114.28(2c),102.44,101.66,100.65,38.73,36.12,29.68,26.63,25.52.
[0120]
实施例6:n
‑
{5
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑5‑
氧代戊基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0121]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为5
‑
氨基戊酸甲酯盐酸盐;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基,最后通过锌粉、氯化铵还原得类白色固体0.12g,即得实施例6,收率:56.5%。结构如下:
[0122][0123]
谱图数据如下:esi
‑
ms:m/z,433.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.17(d,j=2.0hz,1h),9.01(s,1h),8.08(t,j=6.0hz,1h),7.42(d,j=8.5hz,2h),7.10(dd,j=8.5,6.4hz,1h),6.74(d,j=2.0hz,1h),6.60(d,j=8.5hz,2h),6.47(dd,j=11.2,2.9hz,1h),6.29(td,j=8.5,2.9hz,1h),5.36(s,2h),5.14(s,2h),3.25(q,j=6.4hz,2h),2.33(t,j=6.9hz,2h),1.66
‑
1.48(m,4h);
13
c nmr(100mhz,dmso
‑
d6)δ171.79,162.31,159.73,149.60,148.14,144.89,144.75,127.59,126.82(2c),120.01,116.83,114.27(2c),102.42,101.64,100.66,38.56,35.84,29.52,23.20.
[0124]
实施例7:n
‑
{7
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑7‑
氧代庚基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0125]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为7
‑
氨基庚酸甲
酯盐酸盐;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基,最后通过锌粉、氯化铵还原得类白色固体0.12g,即得实施例7,收率:70.2%。结构如下:
[0126][0127]
谱图数据如下:esi
‑
ms:m/z,461.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.15(s,1h),9.00(s,1h),8.01(t,j=5.6hz,1h),7.42(d,j=8.4hz,2h),7.09(dd,j=8.5,6.5hz,1h),6.73(d,j=2.0hz 1h),6.61(d,j=8.4hz,2h),6.48(dd,j=11.2,2.8hz,1h),6.29(td,j=8.5,2.8hz,1h),5.35(s,2h),5.11(s,2h),3.22(q,j=6.5hz,2h),2.29(t,j=7.4hz,2h),1.62
‑
1.55(m,2h),1.55
‑
1.47(m,2h),1.38
‑
1.30(m,4h);
13
c nmr(100mhz,dmso
‑
d6)δ171.84,162.26,159.72,149.59,148.18,144.74,144.62,127.56,126.81(2c),120.08,116.84,114.28(2c),102.46,101.68,100.65,38.79,36.12,29.77,28.95,26.73,25.71.
[0128]
实施例8:n
‑
{4
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基甲酰基]苄基}
‑3‑
(4
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0129]
按照实施例1记载的步骤,将步骤f中6
‑
氨基己酸甲酯盐酸盐替换为氨甲基苯甲酸甲酯盐酸盐;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基,最后通过锌粉、氯化铵还原得类白色固体0.17g,即得实施例8,收率:62.1%。结构如下:
[0130][0131]
谱图数据如下:esi
‑
ms:m/z,467.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.25(s,1h),9.54(s,1h),8.73(t,j=6.0hz,1h),7.93(d,j=8.5hz,2h),7.46
‑
7.40(m,4h),7.11(dd,j=8.5,6.5hz,1h),6.79(d,j=1.9hz,1h),6.61(d,j=8.5hz,2h),6.54(dd,j=11.2,2.9hz,1h),6.35(td,j=8.5,2.9hz,1h),5.37(s,2h),5.20(s,2h),4.50(d,j=6.2hz,2h);
13
c nmr(100mhz,dmso
‑
d6)δ165.89,162.53,160.26,149.66,147.84,145.96,145.04,144.07,133.35,129.04,128.22(2c),127.39(2c),126.85(2c),119.74,116.73,114.27(2c),102.58,101.77,100.82,42.22.
[0132]
实施例9:3
‑
(3
‑
氨基苯基)
‑
n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0133]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为间硝基苯乙酮,分离得类白色固体0.17g,即得实施例9,收率:59.1%。结构如下:
[0134][0135]
谱图数据如下:esi
‑
ms:m/z,429.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.41(s,1h),9.06(s,1h),8.09(s,1h),7.15(dd,j=7.8hz,1.2hz,1h),7.09(s,1h),6.91
‑
6.8(m,3h),6.81(s,1h),6.71(dd,j=7.8,1.2hz,1h),6.56(s,1h),6.52(td,j=7.8,1.2hz,1h),5.15(s,2h),4.83(s,2h),3.26(q,j=7.4hz,2h),2.32(t,j=7.4hz,2h),1.67
‑
1.61(m,2h),1.59
‑
1.52(m,2h),1.41
‑
1.32(m,2h);
13
c nmr(150mhz,dmso)δ171.59,162.08,149.59,148.22,144.69,142.35,129.97,129.84,126.15,125.77,124.04,116.64,116.34,114.64,113.43,111.11,102.39,40.53,36.23,29.66,26.64,25.59.
[0136]
实施例10:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(3
‑
氨基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0137]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为间硝基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基,最后通过锌粉、氯化铵还原得类白色固体0.17g,即得实施例10,收率:62.1%。结构如下:
[0138][0139]
谱图数据如下:esi
‑
ms:m/z,447.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.42(s,1h),8.99(s,1h),8.09(t,j=5.3hz,1h),7.13
‑
7.02(m,3h),6.90(d,j=7.2hz,2h),6.81(s,1h),6.60
‑
6.51(m,1h),6.48(dd,j=8.5,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.18(s,2h),5.11(s,2h),3.29
‑
3.20(m,2h),2.30(t,j=7.3hz,2h),1.67
‑
1.59(m,2h),1.58
‑
1.50(m,2h),1.40
‑
1.30(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.12,159.75,149.59,148.24,144.75,144.64,129.97,127.59,127.49,120.09,114.68,113.47,111.17,102.48,101.95,101.70,38.79,36.13,29.66,26.64,25.52.
[0140]
实施例11:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0141]
步骤j:4
‑
甲氨基苯乙酮的合成
[0142][0143]
将1.0g(7.4mmol)对氨基苯乙酮溶于二氯甲烷,加入叔丁醇钾1.6g(14.8mmol),再加入碘甲烷0.9ml(14.8mmol),室温反应4小时。反应结束后,柱层析,得白色固体0.5g
[0144]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
甲氨基苯乙酮,分离得白色固体0.23g,即得实施例11,收率:58.2%。结构如下:
[0145][0146]
谱图数据如下:esi
‑
ms:m/z,443.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.19(s,1h),9.08(s,1h),8.04(s,1h),7.50(d,j=8.5hz,2h),7.14(d,j=7.6hz,1h),6.88(t,j=7.3hz,1h),6.76(s,1h),6.70(d,j=7.8hz,1h),6.58(d,j=8.3hz,2h),6.52(t,j=7.4hz,1h),5.94(s,1h),4.80(s,2h),3.27
‑
3,21(m,2h),2.70(d,j=4.9hz,3h),2.32(t,j=7.4hz,2h),1.62(p,j=7.3hz,2h),1.56(p,j=7.3hz,2h),1.38
‑
1.31(m,2h);
13
c nmr(150mhz,dmso)δ169.32,140.09,124.48,123.87,123.51,121.78,114.36,114.06,109.82,98.46,38.27,36.52,33.97,27.77,24.38,23.33.
[0147]
实施例12:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0148]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
甲氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.17g,即得实施例12,收率:54.3%。结构如下:
[0149][0150]
谱图数据如下:esi
‑
ms:m/z,461.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.18(s,1h),8.99(s,1h),8.02(t,j=5.7hz,1h),7.50(d,j=8.6hz,2h),7.08(dd,j=8.7,6.4hz,1h),6.76(m,1h),6.59(d,j=8.5hz,2h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.92(m,1h),5.11(s,2h),3.23(q,j=6.4hz,2h),2.70(d,j=4.6hz,3h),2.30(t,j=7.4hz,2h),1.61(p,j=7.4hz,2h),1.54(p,j=7.4hz,2h),1.39
‑
1.30(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.29,162.11,159.74,150.53,148.21,144.76,144.65,127.50,126.81,120.07,116.65,112.10,102.24,101.68,100.70,49.07,36.13,30.01,29.69,26.64,25.52.
[0151]
实施例13:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(二甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0152]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
二甲氨基苯乙酮,分离得白色固体0.13g,即得实施例13,收率:61.3%。结构如下:
[0153][0154]
谱图数据如下:esi
‑
ms:m/z,457.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.26(s,1h),9.06(s,1h),8.04(t,j=5.8hz,1h),7.59(d,j=8.8hz,2h),7.14(dd,j=7.8hz,j=1.4hz,1h),6.90
‑
6.85(m,1h),6.81(d,j=1.7hz,1h),6.77(d,j=8.8hz,2h),6.71(dd,j=
8.0,1.4hz,1h),6.52(td,j=7.7,1.4hz,1h),4.80(s,2h),3.24(q,j=6.6hz,2h),2.94(s,6h),2.32(t,j=7.2hz,2h),1.62(p,j=7.2hz,2h),1.55(p,j=7.2hz,2h),1.34(p,j=7.2hz,2h);
13
c nmr(100mhz,dmso)δ171.59,162.26,150.72,148.28,144.54,142.34,126.69,126.13,125.76,124.07,117.07,116.64,116.35,112.71,101.02,40.38,38.76,36.25,29.69,26.64,25.61.
[0155]
实施例14:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(二甲基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0156]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
二甲氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.17g,即得实施例14,收率:72.1%。结构如下:
[0157][0158]
谱图数据如下:esi
‑
ms:m/z,475.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.25(s,1h),8.99(s,1h),8.04(t,j=5.9hz,1h),7.59(d,j=8.8hz,2h),7.08(dd,j=8.6,6.4hz,1h),6.81(d,j=1.7hz,1h),6.77(d,j=8.8hz,2h),6.48(dd,j=11.2,2.9hz,1h),6.28(td,j=8.6,2.9hz,1h),5.11(s,2h),3.24(q,j=6.6hz,2h),2.94(s,6h),2.30(t,j=7.4hz,2h),1.61(p,j=7.4hz,2h),1.54(p,j=7.4hz,2h),1.34(p,j=7.4hz,2h);
13
c nmr(100mhz,dmso)δ162.10,159.74,150.63,144.77,144.65,127.61,127.50,126.59,120.06,112.73,102.45,102.23,101.92,101.67,101.02,40.63,38.80,36.12,29.63,26.64,25.52.
[0159]
实施例15:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
丙酰胺基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0160]
步骤k:n
‑
(4
‑
乙酰苯基)丙酰胺的合成
[0161][0162]
将0.5g(3.7mmol)对氨基苯乙酮溶于二氯甲烷,加入三乙胺0.76(5.55mmol),再加入丙酰氯0.5ml(5.55mmol),室温反应2小时。反应结束后,加水淬灭,反应液二氯甲烷萃取3次(50ml
×
3),饱和碳酸氢钠洗,水洗,饱和氯化钠洗,无水硫酸钠干燥。减压蒸干溶剂,分离得到白色固体0.18g,收率:78.0%。
[0163]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为本实施例步骤k中获得的n
‑
(4
‑
乙酰苯基)丙酰胺,分离得淡黄色固体0.15g,即得实施例15,收率:59.6%。结构如下:
[0164]
[0165]
谱图数据如下:esi
‑
ms:m/z,485.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.47(s,1h),10.00(s,1h),9.08(s,1h),8.12(s,1h),7.69(m,4h),7.14(d,j=7.8hz,1h),6.95(s,1h),6.88(td,j=7.8hz,j=1.2hz,1h),6.7(dd,j=7.8hz,j=1.2hz,1h),6.51(td,j=7.8hz,j=1.2hz,1h),4.80(s,2h),3.25(s,2h),2.33(p,j=7.5hz,4h),1.66
‑
1.58(m,2h),1.59
‑
1.51(m,2h),1.41
‑
1.29(m,2h),1.09(t,j=7.6hz,3h);
13
c nmr(100mhz,dmso)δ172.61,171.59,162.08,148.45,143.75,142.34,139.99,126.27,126.14,125.85,125.77,124.06,119.66,116.64,116.35,102.36,38.79,36.24,30.02,29.66,26.64,25.60,10.06.
[0166]
实施例16:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
(4
‑
丙酰胺基苯基)
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0167]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为n
‑
(4
‑
乙酰苯基)丙酰胺;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得淡黄色固体0.17g,即得实施例16,收率:62.5%。结构如下:
[0168][0169]
谱图数据如下:esi
‑
ms:m/z,503.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.45(s,1h),9.98(s,1h),8.99(s,1h),8.09(t,j=5.9hz,1h),7.68(m,4h),7.08(dd,j=8.5,6.4hz,1h),6.94(d,j=1.9hz,1h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.10(s,2h),3.24(q,j=6.6hz,2h),2.37
‑
2.27(m,4h),1.67
‑
1.58(m,2h),1.58
‑
1.50(m,2h),1.40
‑
1.32(m,2h),1.09(t,j=7.5hz,3h);
13
c nmr(100mhz,dmso)δ172.61,171.84,162.07,148.44,144.76,143.75,139.99,127.49,126.27,125.84,123.91,120.05,119.66,102.45,101.93,101.68,38.78,36.12,30.02,29.67,26.64,25.52,10.06.
[0170]
实施例17:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0171]
步骤l:4
‑
苯基氨基苯乙酮的合成
[0172][0173]
将0.4g(2.01mmol)4
‑
溴苯乙酮,0.37g(4.02mmol)苯胺,0.02g(0.08mmol)醋酸钯,0.08g(0.12mmol)binap和0.98g(3.02mmol)碳酸铯置于100ml三颈瓶中,用25ml甲苯溶解。氮气保护,升温至95℃搅拌5.5h。待反应液冷却至室温,抽滤滤除不溶物。滤液减压浓缩后以石油醚:乙酸乙酯(v/v)=2∶1为洗脱剂硅胶柱层析,分离得到淡黄色固体0.35g,收率:81%。
[0174]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为本实施例步骤l制备获得的4
‑
苯基氨基苯乙酮,分离得白色固体0.21g,即得实施例17,收率:56.6%。结构如下:
[0175][0176]
谱图数据如下:esi
‑
ms:m/z,505.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.36(s,1h),9.08(s,1h),8.39(s,1h),8.09(s,1h),7.63(d,j=8.5hz,2h),7.27(t,j=7.5hz,2h),7.15(dd,j=7.8,1.2hz,1h),7.12(d,j=8.6hz,4h),6.98(td,j=7.8,1.2hz,3h),6.71(dd,j=7.8,1.2hz,1h),6.52(td,j=7.8,1.2hz,1h),4.80(s,2h),3.28
‑
3.22(m,2h),2.32(t,j=7.4hz,2h),1.63(p,j=7.4hz,2h),1.59
‑
1.52(m,2h),1.40
‑
1.32(m,2h);
13
c nmr(150mhz,dmso)δ171.59,162.17,148.34,144.28,144.19,143.08,142.36,129.71,126.90,126.14,125.77,124.04,120.85,120.38,118.02,116.63,116.33,101.54,40.53,36.23,29.68,26.64,25.60.
[0177]
实施例18:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0178]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
苯基氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.19g,即得实施例18,收率:49.2%。结构如下:
[0179][0180]
谱图数据如下:esi
‑
ms:m/z,523.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.35(s,1h),8.99(s,1h),8.38(s,1h),8.07(t,j=5.9hz,1h),7.63(d,j=8.6hz,2h),7.26(q,j=7.6,7.1hz,2h),7.14
‑
7.09(m,5h),7.09
‑
7.05(m,1h),6.86(d,j=1.9hz,1h),6.48(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.11(s,2h),3.24(q,j=6.5hz,2h),2.30(t,j=7.4hz,2h),1.67
‑
1.59(m,2h),1.58
‑
1.50(m,2h),1.34(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.19,159.75,148.35,144.76,144.21,143.09,129.72,127.60,126.91,120.87,120.40,120.05,118.05,117.60,116.62,102.47,101.93,101.68,38.77,36.13,29.68,26.64,25.53.
[0181]
实施例19:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苄基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0182]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
苄基氨基苯乙酮,分离得白色固体0.19g,即得实施例19,收率:64.3%。结构如下:
[0183][0184]
谱图数据如下:esi
‑
ms:m/z,519.3[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.17(s,1h),9.09(s,1h),8.03(s,1h),7.46(d,j=8.6hz,2h),7.36(d,j=7.4hz,2h),7.32(t,j=7.5hz,2h),7.23(t,j=7.2hz,1h),7.14(d,j=7.2hz,1h),6.88(td,j=7.2,1.2hz,1h),
6.75(s,1h),6.71(dd,j=7.2,1.2hz,1h),6.63(d,j=8.6hz,2h),6.56(s,1h),6.53(td,j=7.2,1.2hz,1h),4.92(s,2h),4.31(s,2h),3.23(q,j=6.3hz,2h),2.31(t,j=7.4hz,2h),1.62(p,j=7.4hz,2h),1.54(p,j=7.4hz,2h),1.36
‑
1.31(m,2h);
13
c nmr(150mhz,dmso)δ171.60,162.26,149.31,148.18,144.75,142.26,140.46,128.79,127.64,127.15,126.76,126.14,125.77,124.09,116.70,116.38,112.79,100.80,46.68,40.53,36.23,29.68,26.64,25.59.
[0185]
实施例20:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(苄基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0186]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
苄基氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.26g,即得实施例20,收率:52.3%。结构如下:
[0187][0188]
谱图数据如下:esi
‑
ms:m/z,537.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.16(s,1h),8.99(s,1h),8.01(t,j=5.9hz,1h),7.45(d,j=8.6hz,2h),7.38
‑
7.30(m,4h),7.23(t,j=7.0hz,1h),7.08(dd,j=8.6,6.4hz,1h),6.74(d,j=1.8hz,1h),6.63(d,j=8.6hz,2h),6.56(t,j=6.0hz,1h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.6,2.9hz,1h),5.11(s,2h),4.31(d,j=6.0hz,2h),3.23(q,j=6.6hz,2h),2.29(t,j=7.4hz,2h),1.66
‑
1.58(m,2h),1.57
‑
1.50(m,2h),1.36
‑
1.29(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.28,159.74,149.33,148.20,144.76,144.64,140.43,128.78,127.64,127.49,127.15,126.78,120.05,117.01,112.80,102.24,101.68,100.79,46.68,38.74,36.13,29.68,26.64,25.52.
[0189]
实施例21:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0190]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(3,5
‑
二氟苯基)氨基苯乙酮,分离得白色固体0.18g,即得实施例21,收率:54.3%。结构如下:
[0191][0192]
谱图数据如下:esi
‑
ms:m/z,541.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.45(s,1h),9.07(s,1h),8.84(s,1h),8.10(t,j=5.8hz,1h),7.72(d,j=8.6hz,2h),7.20(t,j=8.0hz,2h),7.15(d,j=6.7hz,1h),6.93(d,j=1.8hz,1h),6.88(td,j=8.0,1.2hz,1h),6.70(td,j=8.0,1.2hz,3h),6.58(tt,j=9.6,2.0hz,1h),6.52(td,j=8.0,1.2hz,1h),4.80(s,2h),3.29
‑
3.22(m,2h),2.32(t,j=7.3hz,2h),1.68
‑
1.59(m,2h),1.58
‑
1.52(m,2h),1.38
‑
1.31(m,2h);
13
c nmr(100mhz,dmso)δ171.59,165.11,162.11,148.43,143.83,142.35,142.14,127.03,126.62,126.13,125.77,124.06,122.58,119.09,116.64,116.34,
102.08,99.10,94.74,38.79,36.25,29.68,26.65,25.61.
[0193]
实施例22:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0194]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(3,5
‑
二氟苯基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.19g,即得实施例22,收率:56.2%。结构如下:
[0195][0196]
谱图数据如下:esi
‑
ms:m/z,559.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.44(s,1h),8.99(s,1h),8.82(s,1h),8.09(s,1h),7.72(d,j=8.5hz,2h),7.21(d,j=8.4hz,2h),7.09(dd,j=8.7,6.4hz,1h),6.94(d,j=10.5hz,1h),6.68(d,j=8.8hz,2h),6.56(s,1h),6.48(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.11(s,2h),3.28
‑
3.22(m,2h),2.31(t,j=7.4hz,2h),1.68
‑
1.59(m,2h),1.59
‑
1.51(m,2h),1.39
‑
1.32(m,2h).
13
c nmr(150mhz,dmso)δ171.84,164.68,164.58,163.08,162.97,161.72,160.14,144.75,144.67,127.60,127.54,126.98,120.04,120.03,119.12,102.43,102.28,101.88,101.72,40.52,36.11,26.64,25.51.
[0197]
实施例23:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环丁基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0198]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(环丁基氨基)苯乙酮,分离得白色固体0.13g,即得实施例23,收率:65.2%。结构如下:
[0199][0200]
谱图数据如下:esi
‑
ms:m/z,483.3[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.16(s,1h),9.07(s,1h),8.04(s,1h),7.47(d,j=8.5hz,2h),7.15(dd,j=7.9,1.2hz,1h),6.88(td,j=7.9,1.2hz,1h),6.78(s,1h),6.71(dd,j=7.9,1.2hz,1h),6.55(d,j=8.5hz,2h),6.51(dd,j=7.9,1.2hz,1h),6.14(s,1h),4.79(s,2h),3.91
‑
3.82(m,1h),3.24(q,j=6.4hz,2h),2.37
‑
2.30(m,4h),1.87
‑
1.78(m,2h),1.77
‑
1.67(m,2h),1.66
‑
1.58(m,2h),1.57
‑
1.52(m,2h),1.38
‑
1.30(m,2h);
13
c nmr(100mhz,dmso)δ171.59,142.34,126.80,126.12,125.76,124.07,116.64,116.34,112.66,100.75,48.24,38.79,36.24,30.73,29.64,26.64,25.59,15.36.
[0201]
实施例24:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环丁基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0202]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(环丁基氨基)苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.21g,即得实施例24,收率:55.4%。结构如下:
[0203][0204]
谱图数据如下:esi
‑
ms:m/z,501.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.18(s,1h),9.00(s,1h),8.04(t,j=5.7hz,1h),7.47(d,j=8.4hz,2h),7.08(dd,j=8.4,6.6hz,1h),6.75(s,1h),6.55(d,j=8.4hz,2h),6.47(dd,j=11.2,2.6hz,1h),6.28(td,j=8.5,2.6hz,1h),6.18(d,j=6.6hz,1h),5.12(s,2h),3.89
‑
3.83(m,1h),3.23(q,j=6.4hz,2h),2.37
‑
2.32(m,2h),2.30(t,j=7.4hz,2h),1.85
‑
1.79(m,2h),1.76
‑
1.68(m,2h),1.63
‑
1.58(m,2h),1.56
‑
1.51(m,2h),1.35
‑
1.31(m,2h);
13
c nmr(150mhz,dmso)δ171.84,162.28,161.71,160.13,148.43,148.20,144.67,127.60,126.85,120.03,116.82,112.65,102.26,101.70,100.73,48.17,40.53,38.73,36.12,30.71,29.69,26.63,25.53,15.36.
[0205]
实施例25:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(环丙基甲基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0206]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(环丙基甲基)氨基苯乙酮,分离得白色固体0.18g,即得实施例25,收率:56.6%。结构如下:
[0207][0208]
谱图数据如下:esi
‑
ms:m/z,483.3[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.17(s,1h),9.07(s,1h),8.02(s,1h),7.48(d,j=8.4hz,2h),7.15(dd,j=7.8,1.2hz,1h),6.88(td,j=7.8,1.2hz,1h),6.75(s,1h),6.71(dd,j=7.8,1.2hz,1h),6.63(d,j=8.4hz,2h),6.52(td,j=7.8,1.2hz,1h),5.96(s,1h),4.79(s,2h),3.28
‑
3.20(m,2h),2.93(t,j=6.0hz,2h),2.32(t,j=7.3hz,2h),1.67
‑
1.60(m,2h),1.58
‑
1.50(m,2h),1.39
‑
1.32(m,2h),1.08
‑
1.01(m,1h),0.51
‑
0.44(m,2h),0.24
‑
0.19(m,2h);
13
c nmr(150mhz,dmso)δ171.59,167.43,162.29,149.71,148.20,144.85,142.35,132.00,129.14,126.78,126.13,125.77,124.04,116.62,116.33,112.42,100.67,47.67,38.74,36.24,30.48,26.64,25.60,11.04,3.98.
[0209]
实施例26:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(环丙基甲基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0210]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(环丙基甲基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.25g,即得实施例26,收率:63.7%。结构如下:
[0211][0212]
谱图数据如下:esi
‑
ms:m/z,501.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.16(s,1h),8.99(s,1h),8.01(s,1h),7.48(d,j=8.6hz,2h),7.08(dd,j=8.6,6.4hz,1h),6.75(s,1h),6.63(d,j=8.6hz,2h),6.48(dd,j=11.2,2.8hz,1h),6.28(td,j=8.6,2.9hz,
1h),5.95(s,1h),5.11(s,2h),3.24(q,j=6.1hz,2h),2.93(t,j=6.0hz,2h),2.30(t,j=7.4hz,2h),1.67
‑
1.58(m,2h),1.57
‑
1.50(m,2h),1.39
‑
1.29(m,2h),1.08
‑
0.99(m,1h),0.51
‑
0.44(m,2h),0.24
‑
0.18(m,2h);
13
c nmr(150mhz,dmso)δ171.84,162.29,161.71,160.13,149.72,148.19,144.75,144.68,127.60,126.78,120.04,116.57,112.42,102.27,101.71,100.67,47.67,38.74,36.12,29.69,26.64,25.52,11.04,3.98.
[0213]
实施例27:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环戊基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0214]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
环戊基氨基苯乙酮,分离得白色固体0.23g,即得实施例27,收率:68.3%。结构如下:
[0215][0216]
谱图数据如下:esi
‑
ms:m/z,497.3[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.16(s,1h),9.07(s,1h),8.03(s,1h),7.47(d,j=8.6hz,2h),7.14(dd,j=8.0,1.2hz,1h),6.88(td,j=8.0,1.2hz,1h),6.75(s,1h),6.71(dd,j=8.0,1.2hz,1h),6.60(d,j=8.6hz,2h),6.52(td,j=8.0,1.2hz,1h),5.88(s,1h),4.81(s,2h),3.75
‑
3.70(m,1h),3.24(q,j=6.2hz,2h),2.32(t,j=7.4hz,2h),1.96
‑
1.90(m,2h),1.69
‑
1.66(m,2h),1.64
‑
1,59(m,2h),1.58
‑
1.51(m,4h),1.48
‑
1.41(m,2h),1.39
‑
1.31(m,2h);
13
c nmr(100mhz,dmso)δ171.59,142.34,126.73,126.13,125.77,124.07,116.64,116.35,112.78,100.66,53.92,38.79,36.25,33.00,29.65,26.65,25.60,24.19.
[0217]
实施例28:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(环戊基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0218]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
环戊基氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.19g,即得实施例28,收率:54.7%。结构如下:
[0219][0220]
谱图数据如下:esi
‑
ms:m/z,515.3[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.16(s,1h),8.99(s,1h),8.01(t,j=5.5hz,1h),7.47(d,j=8.7hz,2h),7.08(dd,j=8.7,6.4hz,1h),6.74(s,1h),6.61(d,j=8.7hz,2h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.7,2.9hz,1h),5.88(d,j=6.3hz,1h),5.11(s,2h),3.76
‑
3.69(m,1h),3.23(q,j=6.2hz,2h),2.30(t,j=7.4hz,2h),1.97
‑
1.89(m,2h),1.71
‑
1.64(m,2h),1.64
‑
1.58(m,2h),1.58
‑
1.51(m,4h),1.48
‑
1.40(m,2h),1.37
‑
1.30(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.11,159.75,149.26,148.20,144.76,144.65,127.60,127.50,126.76,120.07,116.36,112.78,102.46,101.93,100.65,53.91,38.75,36.12,32.99,29.68,26.64,25.52,24.19.
[0221]
实施例29:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(吡咯
‑1‑
基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0222]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(吡咯
‑1‑
基)苯乙酮,分离得白色固体0.22g,即得实施例29,收率:59.2%。结构如下:
[0223][0224]
谱图数据如下:esi
‑
ms:m/z,483.3[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.23(s,1h),9.08(s,1h),8.05(t,j=5.6hz,1h),7.58(d,j=8.6hz,2h),7.14(d,j=7.8hz,1h),6.88(td,j=7.8,1.2hz,1h),6.79(s,1h),6.71(dd,j=7.8,1.2hz,1h),6.59(d,j=8.6hz,2h),6.52(td,j=7.8,1.2hz,1h),4.80(s,2h),3.26(m,6h),2.32(t,j=7.3hz,2h),1.96(t,j=6.4hz,4h),1.66
‑
1.60(m,2h),1.58
‑
1.50(m,2h),1.40
‑
1.29(m,2h);
13
c nmr(100mhz,dmso)δ171.59,162.27,148.05,144.76,142.36,126.78,126.14,125.77,124.04,116.62,116.33,112.17,100.78,47.72,38.75,36.24,29.70,26.64,25.60,25.43.
[0225]
实施例30:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(吡咯
‑1‑
基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0226]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(吡咯
‑1‑
基)苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.16g,即得实施例30,收率:63.2%。结构如下:
[0227][0228]
谱图数据如下:esi
‑
ms:m/z,501.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.23(s,1h),9.01(s,1h),8.06(s,1h),7.58(d,j=8.6hz,2h),7.08(dd,j=8.6,6.4hz,1h),6.80(s,1h),6.59(d,j=8.6hz,2h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.6,2.9hz,1h),5.13(s,2h),3.27
‑
3.23(m,6h),2.30(t,j=7.4hz,2h),1.96(t,j=6.4hz,4h),1.66
‑
1.58(m,2h),1.57
‑
1.51(m,2h),1.39
‑
1.28(m,2h);
13
c nmr(150mhz,dmso)δ171.84,162.28,161.71,160.13,148.04,144.75,127.60,127.53,126.77,120.04,116.22,112.17,102.42,101.88,100.78,47.71,40.53,38.75,36.12,29.69,26.64,25.43.
[0229]
实施例31:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(4
‑
甲氧基苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0230]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(4
‑
甲氧基苯基)氨基苯乙酮,分离得白色固体0.19g,即得实施例31,收率:72.6%。结构如下:
[0231][0232]
谱图数据如下:esi
‑
ms:m/z,535.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.29(s,1h),9.07(s,1h),8.08(s,1h),7.57(d,j=8.7hz,2h),7.15(dd,j=7.8,1.2hz,1h),7.08
(d,j=8.8hz,3h),6.95(d,j=8.8hz,2h),6.92
‑
6.85(m,3h),6.83(s,1h),6.71(dd,j=7.8,1.2hz,1h),6.52(td,j=7.8,1.2hz,1h),4.80(s,2h),3.73(s,3h),3.25(q,j=6.3hz,2h),2.32(t,j=7.4hz,2h),1.66
‑
1.61(m,2h),1.59
‑
1.52(m,2h),1.39
‑
1.32(m,2h);13c nmr(100mhz,dmso)δ171.18,161.77,154.28,147.86,145.56,143.97,141.93,135.36,129.71,126.46,125.72,125.35,123.65,121.22,116.23,115.93,114.66,114.52,100.81,55.30,38.40,35.82,29.22,26.23,25.18.
[0233]
实施例32:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(4
‑
甲氧基苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0234]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(4
‑
甲氧基苯基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.17g,即得实施例32,收率:36.2%。结构如下:
[0235][0236]
谱图数据如下:esi
‑
ms:m/z,553.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.30(s,1h),9.00(s,1h),8.10(s,1h),8.07(s,1h),7.57(d,j=8.6hz,2h),7.08(dd,j=8.6,4.7hz,3h),6.95(d,j=8.6hz,2h),6.90(d,j=8.6hz,2h),6.83(s,1h),6.48(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.12(s,2h),3.73(s,3h),3.28
‑
3.20(m,2h),2.30(t,j=7.4hz,2h),1.66
‑
1.58(m,2h),1.57
‑
1.50(m,2h),1.39
‑
1.29(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.11,159.74,154.74,148.29,146.00,144.78,144.66,144.39,135.73,127.62,127.52,126.92,121.66,120.04,115.06,114.87,102.46,101.67,101.24,55.69,38.76,36.11,29.68,26.64,25.52.
[0237]
实施例33:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(对甲苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0238]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(4
‑
甲基苯基)氨基苯乙酮,分离得白色固体0.15g,即得实施例33,收率:34.3%。结构如下:
[0239][0240]
谱图数据如下:esi
‑
ms:m/z,519.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.32(s,1h),9.07(s,1h),8.24(s,1h),8.06(t,j=5.8hz,1h),7.60(d,j=8.5hz,2h),7.18(dd,j=7.8,1.2hz,1h),7.10
‑
7.02(m,6h),6.88(td,j=7.8,1.2hz,1h),6.85(s,1h),6.71(dd,j=7.8,1.2hz,1h),6.52(td,j=7.8,1.2hz,1h),4.80(s,2h),3.25(q,j=6.1hz,2h),2.32(t,j=7.3hz,2h),2.25(s,3h),1.66
‑
1.61(m,2h),1.59
‑
1.50(m,2h),1.41
‑
1.31(m,2h);13c nmr(100mhz,dmso)δ176.34,166.96,153.08,149.74,149.05,147.10,145.11,134.89,134.80,131.66,130.88,130.52,128.82,124.56,123.63,121.39,121.10,120.63,106.15,
43.53,41.00,34.44,31.40,30.36,25.55.
[0241]
实施例34:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
[4
‑
(对甲苯基氨基)苯基]
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0242]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(4
‑
甲基苯基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.18g,即得实施例34,收率:41.3%。结构如下:
[0243][0244]
谱图数据如下:esi
‑
ms:m/z,537.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.33(s,1h),9.00(s,1h),8.25(s,1h),8.08(t,j=5.5hz,1h),7.60(d,j=8.4hz,2h),7.10
‑
7.07(m,3h),7.05(d,j=8.8hz,2h),7.02(d,j=8.4hz,2h),6.84(s,1h),6.47(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.12(s,2h),3.24(q,j=6.2hz,2h),2.30(t,j=7.3hz,2h),2.24(s,3h),1.63
‑
1.58(m,2h),1.57
‑
1.52(m,2h),1.39
‑
1.30(m,2h);
13
c nmr(150mhz,dmso)δ171.83,162.19,161.71,160.13,148.31,144.96,144.68,144.29,140.33,130.14,127.60,127.53,126.89,120.04,118.85,115.86,102.26,101.70,101.40,40.54,36.12,29.69,26.64,25.52,20.80.
[0245]
实施例35:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(2,6
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0246]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(2,6
‑
二氟苯基)氨基苯乙酮,分离得白色固体0.28g,即得实施例35,收率:65.3%。结构如下:
[0247][0248]
谱图数据如下:esi
‑
ms:m/z,541.2[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.32(s,1h),9.07(s,1h),8.11(s,1h),8.07(s,1h),7.58(d,j=8.6hz,2h),7.22
‑
7.17(m,3h),7.15(dd,j=7.9,1.2hz,1h),6.88(td,j=7.9,1.2hz,1h),6.84(s,1h),6.73(d,j=8.6hz,2h),6.71(dd,j=7.9,1.2hz,1h),6.52(td,j=7.9,1.2hz,1h),4.86(s,2h),3.25((d,j=6.0hz,2h),2.32(t,j=7.4hz,2h),1.66
‑
1.60(m,2h),1.58
‑
1.52(m,2h),1.41
‑
1.30(m,2h);
13
c nmr(100mhz,dmso)δ171.60,158.98,158.92,156.53,156.47,142.27,126.58,126.13,125.77,124.10,116.70,116.38,114.82,112.89,112.83,112.72,112.66,101.45,38.82,36.24,29.59,26.64,25.59.
[0249]
实施例36:n
‑
{6
‑
[(2
‑
氨基
‑4‑
氟苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(2,6
‑
二氟苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0250]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(2,6
‑
二氟苯基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.25g,即得实施例36,收率:68.2%。结构如下:
[0251][0252]
谱图数据如下:esi
‑
ms:m/z,559.2[m na]
;1h nmr(600mhz,dmso
‑
d6)δ13.33(s,1h),9.00(s,1h),8.12(s,1h),8.08(s,1h),7.58(d,j=8.4hz,2h),7.20(d,j=8.2hz,3h),7.08(dd,j=8.6,6.4hz,1h),6.84(s,1h),6.73(d,j=8.2hz,2h),6.47(dd,j=11.2,2.8hz,1h),6.28(td,j=8.4,2.8hz,1h),5.12(s,2h),3.27
‑
3.21(m,2h),2.30(t,j=7.4hz,2h),1.63
‑
1.59(m,2h),1.57
‑
1.52(m,2h),1.36
‑
1.33(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.11,159.74,158.96,158.90,156.51,156.45,144.77,144.66,127.61,127.51,126.67,120.02,114.81,112.90,112.67,102.23,101.67,101.49,38.78,36.11,29.65,26.64,25.51.
[0253]
实施例37:n
‑
{6
‑
[(2
‑
氨基苯基)氨基]
‑6‑
氧代己基}
‑3‑
{4
‑
[(3,5
‑
二氯苯基)氨基]苯基}
‑
1h
‑
吡唑
‑5‑
甲酰胺
[0254]
按照实施例1记载的步骤,将步骤c中的对硝基苯乙酮替换为4
‑
(3,5
‑
二氯苯基)氨基苯乙酮;步骤h中的邻苯二胺替换为(2
‑
氨基
‑5‑
氟苯基)氨基甲酸叔丁酯(ss4),再在三氟乙酸的条件下脱boc保护基得类白色固体0.27g,即得实施例37,收率:54.3%。结构如下:
[0255][0256]
谱图数据如下:esi
‑
ms:m/z,591.1[m na]
;1h nmr(400mhz,dmso
‑
d6)δ13.45(s,1h),8.99(s,1h),8.79(s,1h),8.09(s,1h),7.73(d,j=8.5hz,2h),7.20(d,j=8.2hz,2h),7.15(s,1h),7.08(dd,j=8.5,6.4hz,1h),7.01(s,1h),6.99(s,1h),6.94(d,j=5.9hz,1h),6.48(dd,j=11.2,2.9hz,1h),6.28(td,j=8.5,2.9hz,1h),5.11(s,1h),3.29
‑
3.21(m,2h),2.31(t,j=7.3hz,2h),1.66
‑
1.59(m,2h),1.57
‑
1.52(m,2h),1.41
‑
1.31(m,2h);
13
c nmr(100mhz,dmso)δ171.84,162.11,159.75,148.44,146.50,144.76,143.81,141.94,135.13,127.60,127.10,122.81,120.07,119.32,118.76,114.31,102.47,102.14,101.94,38.79,36.12,29.67,26.64,25.52.
[0257]
实施例38.本发明产物药理作用研究
[0258]
实验设空白对照组(不加药)和阳性对照组(rgfp966)。室温下将5μl上述各实施例制备获得化合物采用缓冲液(a缓冲盐溶液)配置不同浓度(2μm、0.5μm、0.125μm、0.031μm、0.008μm、0.002μm)的溶液和市购的5μl hela核提取物(0.5μg/μl)或重组人源蛋白(0.05μg/μl)孵育15min,加入5μl荧光底物boc
‑
lys(ac)
‑
amc(0.25mm/l)。37℃下培养60min后,加入25μl终止缓冲液(包含2μm saha和0.67mm trypsin的缓冲盐溶液)终止反应。15min后,应用全波长多功能酶标仪在激发和发射波长分别为355nm和460nm时检测荧光强度,计算ic
50
(μm)。同时以rgfp966
b
作为阳性对照,各化合物对hdacs酶抑制活性见表1和表2。
[0259]
表1.实施例1
‑
10和对照化合物rgfp966的hdac酶抑制活性a
[0260][0261][0262]
a
缓冲盐溶液(ph=8.0)包含25mmol
·
l
‑1tris/hcl、137mmol
·
l
‑1氯化钠、2.7mmol
·
l
‑1氯化钾、1mmol
·
l
‑1氯化镁、0.1mg
·
ml
‑1牛血清白蛋白
[0263]
b
阳性对照化合物rgfp966
[0264]
c
n.d.代表未测试
[0265]
通过酶活性测试发现,大多数实施例对hdac3的抑制活性优于对照化合物rgfp966,其中,实施例1对hdac3的抑制活性最好,ic
50
为0.007μm。部分实施例表现出了对hdac3较好的选择性,如实施例1、实施例5、实施例9和实施例10。
[0266]
表2.实施例11
‑
37和对照化合物rgfp966的hdac酶抑制活性a.
[0267][0268]
a
缓冲盐溶液(ph=8.0)包含25mmol
·
l
‑1tris/hcl、137mmol
·
l
‑1氯化钠、2.7mmol
·
l
‑1氯化钾、1mmol
·
l
‑1氯化镁、0.1mg
·
ml
‑1牛血清白蛋白
[0269]
b
阳性对照化合物rgfp966
[0270]
c
n.d.代表未测试
[0271]
酶活性结果表明,所有实施例对hdac1,2和3表现出抑制活性,对hdac6几乎不抑制。除实施例20外,其余实施例对hdac3的抑制活性优于对照化合物rgfp966。其中,实施例18和实施例31的抑制活性最优,ic
50
为0.005μm。实施例22和实施例32对hdac3也表现出较优的抑制活性,ic
50
分别为0.009μm和0.012μm,同时对hdac1、2的抑制活性为10μm,也对hdac3表现出了很好的选择性。
[0272]
体外肿瘤细胞抗增殖实验
[0273]
1.细胞复苏
[0274]
从液氮中小心取出结直肠癌细胞hct116、乳腺癌细胞mcf
‑
7、前列腺癌细胞pc
‑
3和白血病细胞hl
‑
60、molm13(冻存管)在37~40℃水浴中迅速全部融化,使细胞迅速越过极易受损的0~5℃温度范围。在无菌条件下用移液枪吸出细胞放入离心管中,在1300r/min下离
心3min,轻轻弃去上清液后加入培养液,吹打混匀细胞,移入培养瓶中放入二氧化碳培养箱中培养,4h后换液一次。
[0275]
2.细胞传代
[0276]
细胞复苏后需培养传代2
‑
3次待其稳定后方可进行实验,每次传代以细胞贴满培养瓶底部90%为准。
[0277]
3.细胞埋板
[0278]
细胞生长贴满培养瓶底部时用胰蛋白酶溶液(0.25%)使其从培养瓶底部消化下来。轻轻弃去上胰蛋白酶溶液后加入10ml培养液,吹打混匀细胞,吸取10μl细胞混悬液加入细胞计数板中计数,调整细胞浓度为3.5
×
104个/孔。96孔板中除a1孔为空白孔不加细胞外,其余皆加入100μl细胞混悬液。将96孔板放入培养箱中培养24h。
[0279]
4.细胞加药
[0280]
先用50μl dmso溶解上述实施例获得各化合物作为药物。而后加入适量培养液(prim1640培养基添加10%胎牛血清、100units/ml青霉素g和100ng/ml链霉素)使药物溶解成2mmol/ml药液。然后在96孔板中将药物溶解成20,10,5,2.5,0.625μmol/ml。每个浓度加入3孔,其中周围两行两列细胞长势受环境影响较大,只作为空白细胞孔使用。将96孔板放入培养箱中培养24h。
[0281]
mtt试验测定方法
[0282]
将细胞按1.5~3
×
104细胞密度埋96孔板,每孔100ul,细胞贴壁24h加入不同浓度的药物(100ul/孔),药物与细胞孵育96h后加入mtt(四氮唑)溶液,放入培养箱中4h后,弃去mtt(四氮唑)溶液,加入dmso200ul。在磁力振荡器上振荡使存活细胞与mtt反应产物甲臜充分溶解,放入酶标仪中在570nm波长处读出od值。按下式计算抑制率:
[0283][0284]
细胞计数测定方法
[0285]
采用细胞计数法考察化合物对hl
‑
60和molm13的生长抑制作用。将一定密度(1
×
105个/ml)的细胞悬浮液接种于24孔培养板(2ml/孔),然后加入不同浓度药物共同孵育72小时,加入台盼蓝并于显微镜下计数,依以下公式求得细胞生长抑制率,求得半数生长抑制浓度gi
50
(使细胞生长抑制率达50%时的药物浓度)。
[0286]
抑制率(%)=[(n
对照
‑
n
加药
)/n
对照
]
×
100
[0287]
以rgfp966为阳性对照药,对实施例进行抗细胞增殖抑制活性试验。试验结果见表3和表4。
[0288]
表3.实施例11
‑
37和对照化合物rgfp966对前列腺癌细胞pc
‑
3的抗增殖活性
[0289]
实施例gi
50
(μm)实施例gi
50
(μm)113.95251.82124.61263.21131.07271.73143.05282.801529.74290.641612.67301.18
171.05311.25181.7322.26193.31331.80202.57345.87210.69350.87223.09362.89231.1737n.d.
b
24n.d.rgfp96626.70
[0290]
a
阳性对照化合物rgfp966
[0291]
b
.n.d.代表未测试
[0292]
前列腺癌细胞pc
‑
3抗增殖实验结果表明,除实施例15外,其余实施例对pc
‑
3的抗增殖活性优于对照化合物rgfp966。实施例21、实施例29和实施例35表现出了很好的抗增殖活性,gi
50
均小于1μm。
[0293]
表4.部分实施例和对照化合物rgfp966对结直肠癌细胞hct116、乳腺癌细胞mcf
‑
7、前列腺癌细胞pc
‑
3和白血病细胞hl
‑
60、molm13的抗增殖活性
a
.
[0294][0295]
a
阳性对照化合物rgfp966
[0296]
b
.n.d.代表未测试
[0297]
选择部分实施例测试对结直肠癌细胞hct116、乳腺癌细胞mcf
‑
7、前列腺癌细胞pc
‑
3和白血病细胞hl
‑
60、molm13的抗增殖活性测试,结果发现这些实施例的抗增殖活性均优于对照化合物rgfp966。
[0298]
综上结果表明,本发明要保护的通式的化合物对hdac3具有很好的抑制作用,优于对照化合物rgfp966,其中实施例22表现出最好的hdac3选择性。此外,本发明中保护的化合物对多种肿瘤细胞表现出良好的抗增殖活性,如结直肠癌细胞hct116、乳腺癌细胞mcf
‑
7、前列腺癌细胞pc
‑
3和白血病细胞hl
‑
60、molm13,优于对照化合物rgfp966。同时,本发明化合物合成操作简单、条件温和,具有很好的工业应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。