抗猪源氨肽酶n蛋白单克隆抗体及其应用
技术领域
1.本发明涉及生物技术及抗体工程领域,具体涉及抗猪源氨肽酶n蛋白单克隆抗体及其应用。
背景技术:
2.氨肽酶n(apn,aminopeptidase n)是一种zn
2
依赖型的膜结合外肽酶,从属于金属蛋白酶m1家族,分子量约为150kda,广泛存在于多种组织和细胞中,尤其在小肠黏膜上可以高效表达。该蛋白主要以二聚体的形式发挥功能,包括:能够通过近n端的螺旋产生跨膜作用进入细胞,使apn能够固定在细胞上,且有一部分n端肽链的单个氨基能够通过催化作用进入细胞浆,从而发挥该蛋白具有的肽链端解酶或外肽酶(exopeptidase)的功能。单核细胞中,apn蛋白能够参与丝裂原活化蛋白激酶(mitogen
‑
activated protein kinase,mapk)信号通路的调节;apn还能微调生物活性肽,如神经肽、血管活性肽、炎症多肽等的浓度,影响活性肽介导的细胞反应和信号转导,且这一功能与γ干扰素(ifn
‑
γ)、肿瘤生长因子β1(tgf
‑
β
‑
1)等对apn生物学活性的调节作用有关。此外,apn还是乳腺癌、肝癌、结肠癌等多种癌症的肿瘤标志物,不仅能够高水平表达于癌细胞的表面,而且与肿瘤侵袭转移、血管生成以及预后密切相关。
3.猪源apn(apn)已被证实是猪传染性胃肠炎病毒(tgev)等冠状病毒的受体,识别和结合病毒的s纤突蛋白,介导病毒对宿主细胞的感染。前期研究中,我们发现apn也是产肠毒素大肠杆菌etec f4菌毛的受体蛋白,其能够和etec f4菌毛及其主要亚单位蛋白faeg发生直接的蛋白
‑
蛋白相互作用,其中,faeg的功能结合域及关键作用位点已经确定(具体内容可见专利zl 201610877089.9)。
4.有研究表明,etec f4ac是通过网格蛋白介导的细胞吞噬作用内陷入仔猪空肠上皮细胞ipec
‑
j2。而melkebeek等的研究也证实,apn可以促进小肠上皮细胞内吞f4ac菌毛并且能够诱导黏膜免疫的发生;apn与f4ac菌毛的黏附是通过唾液酸结合凝集素和apn的唾液酸残基共同作用完成的。通过口服apn抑制剂来研究apn作用,可知即使在没有佐剂或辅助性物质存在的情况下,apn也可以引起肠道强烈的黏膜免疫反应,并产生数量较多的iga、igg抗体,甚至连初次免疫后产生的igm抗体也可检测到。而即使是远低于可检测水平的apn也可以促进肠上皮细胞的吞噬作用,并能够诱导一定的黏膜免疫应答。这一结果表明apn是疫苗抗原靶向穿越上皮屏障的作用目标。
5.以产肠毒素大肠杆菌(etec)f4为例,其主要感染肠道细胞,引起仔猪黄痢、白痢、水肿病和断奶仔猪腹泻等,并易混合和继发多种疾病感染。而预防和治疗肠道疾病最有效的方法之一,就是激活和诱导黏膜免疫应答,以获得对肠道病原体的抵抗力。为此,药物或是疫苗抗原等必须能够穿越上皮屏障,而且其激活黏膜免疫应答的能力不会受到胃肠道中本身免疫反应的影响,但目前尚无相关研究的报道。由于apn本身具有很好的激活黏膜免疫应答的作用,且受自身免疫反应的干扰较小,因此,以apn单抗(或抗体蛋白)为靶标开发抗体类似药或是新型疫苗是很有前景的,其不仅可以选择性地将抗原输送到特定的肠道细胞
群,而且能够有效诱导对这些抗原的保护性黏膜免疫反应。
技术实现要素:
6.发明目的:本发明首先要解决的技术问题是获得杂交瘤细胞株apn
‑
5b36。在此基础上获得了高效的抗猪源氨肽酶n(apn)蛋白的单克隆抗体,所述单抗由杂交瘤细胞株apn
‑
5b36分泌产生。
7.本发明还进一步获得了体外表达的重组抗猪源apn蛋白的抗体蛋白,解决了单克隆抗体制备周期长、实验重复性差等问题,更有利于后期抗体类药物或疫苗的开发。
8.技术方案:为解决上述技术问题,本发明采用的技术方案如下:一种杂交瘤细胞株,所述的杂交瘤细胞株于2019年8月30日保藏于中国普通微生物菌种保藏管理中心(cgmcc),分类命名为:猪源氨肽酶n蛋白单克隆抗体杂交瘤细胞株,保藏地址为中国北京,保藏编号为cgmcc no.18521。
9.本发明内容还包括由杂交瘤细胞株cgmcc no.18521分泌产生的单克隆抗体。
10.本发明内容还包括抗猪源apn蛋白的单克隆抗体,所述单克隆抗体的氨基酸序列如seq id no.1所示,所述单克隆抗体包括重链和轻链,所述重链可变区和轻链可变区均由三个互补决定区cdr组成。
11.其中,所述单克隆抗体的重链恒定区为igg2b,所述单克隆抗体的轻链恒定区为cλ。本发明中所述单克隆抗体,经生物标记或化学修饰等处理后获得的标记单克隆抗体也属于本专利的保护范围。进一步地,经酶标记的上述单克隆抗体属于本发明的保护范围。所述的酶为辣根过氧化物酶等。
12.本发明内容还包括所述的单克隆抗体的编码基因,所述基因序列如seq id no.2所示。
13.本发明内容还包括一种体外表达的重组抗猪源apn蛋白的抗体蛋白,所述抗体蛋白由哺乳动物表达载体pires2
‑
zsgreen1
‑
apn
‑
5b36表达,所述重组表达载体pires2
‑
zsgreen1
‑
apn
‑
5b36包含编码所述单克隆抗体的编码基因。
14.进一步地,本发明通过基因工程的方法,扩增apn单抗的重链、轻链序列,与原核表达载体pet28a( )连接后,导入bl21大肠杆菌,经iptg诱导表达蛋白;与哺乳动物表达载体pires2
‑
zsgreen1连接后,转染中国仓鼠卵巢细胞(chinese hamster ovary,cho),并经g418筛选获得稳定表达细胞系。由结果可知,重组表达载体pires2
‑
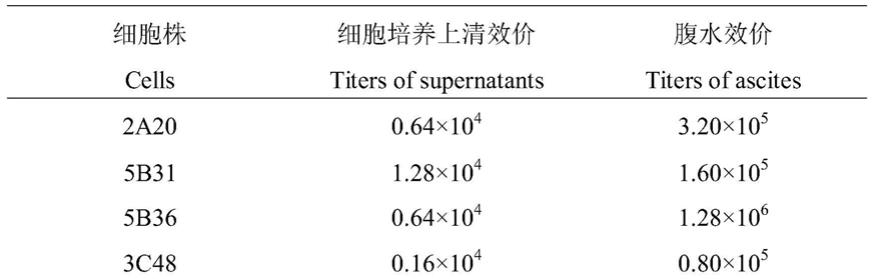
zsgreen1
‑
apn
‑
5b36表达获得具有单抗生物学活性的抗体蛋白,命名为apn
‑
5b36y,同时,以apn抗体为靶标进行后续抗体类药物或疫苗的开发。
15.具体的,所述抗体蛋白apn
‑
5b36y的制备方法,包括以下步骤:
16.1)提取杂交瘤细胞株cgmcc no.18521的总rna并进行反转录得到cdna;
17.2)利用巢氏pcr扩增抗体可变区重链及轻链序列;
18.3)将抗体重链、轻链序列串联后与pires2
‑
zsgreen1载体通过无缝克隆连接,经测序验证正确后,转染cho细胞,经g418筛选和流式细胞仪分选获得阳性细胞,建系后开始梯度降低血清浓度,最终获得由无血清培养基培养的稳定表达细胞系pires2
‑
zsgreen1
‑
apn
‑
5b36
‑
cho;
19.4)将上述表达细胞系pires2
‑
zsgreen1
‑
apn
‑
5b36
‑
cho调至对数期生长后,接种无
血清基础培养基dmem f12培养,待细胞密度达到1.0
‑
2.0
×
106/ml以上,离心获得细胞上清,过滤后纯化获得抗体蛋白。
20.本发明内容还包括所述的抗猪源apn蛋白的单克隆抗体、所述的编码基因、所述的抗体蛋白在制备预防或治疗肠道疾病药物或疫苗中的应用。
21.有益效果:与现有技术相比,本发明具备以下优点:
22.1、本发明首次获得了apn单克隆抗体,以及产生该单抗的杂交瘤细胞株cgmcc no.18521,该单克隆抗体识别的apn蛋白具有很好的黏膜免疫活性,可以靶向运送抗原至特定的细胞,而保留了单抗生物学活性的抗体蛋白,有助于进一步研发重组抗体
‑
抗原复合物,有效激活黏膜免疫应答,通过进一步明确apn的受体功能、开发抗体类药物,以抑制病原对宿主受体的识别和结合,预防和减少疾病发生。
23.2、本发明采用无缝克隆法将apn单克隆抗体重、轻链连接在表达载体上,最终构建的克隆没有任何额外的碱基序列,表达载体选择pires2
‑
zsgreen1,其中zsgreen1荧光表达便于筛选转染后的阳性细胞;而ires2组分可以使zsgreen1及抗体链蛋白在哺乳动物细胞中串联表达。
24.3、本发明的apn
‑
5b36单克隆抗体和抗体蛋白apn
‑
5b36y具有很好的单抗生物学活性,apn
‑
5b36y与传统方法制备的单克隆抗体相比,不需要制备动物腹水,批次间的差异性较小,且更容易进行修饰和优化,更有利于后期抗体类药物或疫苗的开发。
附图说明
25.图1、apn单抗与猪源apn蛋白、人cd13蛋白的玻板凝集实验。
26.图2、重组抗体蛋白原核表达载体pet28a( )
‑
apn
‑
5b36和真核表达载体pires2
‑
zsgreen1
‑
apn
‑
5b36的构建和鉴定;m:trans 2k plus,泳道1:pet28a( )空载体,2和5:b5
‑
36单抗的vh
‑
vl基因,3:pet28a( )
‑
rabs
‑
apn
‑
bl21(de3);4:pires2
‑
zsgreen1空载体,6:pires2
‑
zsgreen1
‑
apn
‑
5b36
‑
dh5α。
27.图3、腹水单抗与重组抗体蛋白sds
‑
page鉴定图;图a:m:蛋白marker,泳道1和2:pet28a( )
‑
rabs
‑
apn
‑
bl21(de3)沉淀和上清,泳道3:纯化腹水单抗apn
‑
5b36(饱和硫酸铵沉淀法);图b:m:蛋白marker,泳道1:纯化腹水单抗apn
‑
5b36(protein a agarose纯化法)。
28.图4、重组抗体蛋白的间接免疫荧光检测;pegfp
‑
c1
‑
apn
‑
ipec
‑
j2细胞孵育不同样品,包括a:pbs,b:pet28a( )
‑
rabs
‑
apn
‑
bl21(de3)纯化上清,c:apn多克隆抗体(1∶500);d:纯化腹水单抗apn
‑
5b36(1∶500);e:纯化pires2
‑
zsgreen1
‑
rabs
‑
apn
‑
cho细胞上清(1∶500),与dylight 549红色荧光二抗(1∶200)共孵育后,检测荧光强度。
29.图5、elisa法测定抗体的相对结合亲和力。
具体实施方式
30.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。以下实施例中未注明具体条件的实验方法,均按照常规步骤进行,所用材料和试剂均为市售商品。
31.实施例1制备抗猪源apn蛋白的单克隆抗体
32.一、猪源apn抗原的制备
33.取实验室保存的pet28a( )
‑
apn菌株在km
lb平板上划线培养,37℃静置过夜;次日挑取单菌落接种km
lb液体培养基,37℃振摇过夜;次日取菌液1∶100接种于新鲜的液体培养基,37℃振摇直至od
600
=0.4
‑
0.6,再添加0.4mm iptg进行蛋白的诱导表达。根据前期实验结果,apn蛋白在37℃诱导条件下以包涵体形式表达,而在16℃诱导条件下为可溶性表达。因此,本实验选择16℃进行蛋白的诱导表达。
34.16℃连续培养18h,离心收集10l细菌培养液中的菌体。称量收集到的菌体重量后,利用macherey
‑
nagel公司的protino ni
‑
ted 2000packed column试剂盒进行蛋白纯化:用5ml/1g lew缓冲液重悬对应湿重的菌体,充分混匀直至无团块,加溶菌酶至终浓度1mg/ml,冰上搅拌30min;压力破碎四次,以完全裂解菌体,4℃ 8000rpm离心40min收集上清,冰上保存。按照试剂盒中可溶性蛋白纯化的方法操作,收集洗脱液(以上操作均在冰上进行)。同时,取透析袋于煮沸的ddh2o中煮10min,冷却后排尽液体备用;将收集到的洗脱液装入透析袋中,放入pbs中4℃透析过夜,透析结束后,可用peg2000对蛋白进行浓缩,小样分装后
‑
20℃保存。
35.取上述蛋白进行常规制样,配制浓度为12.0%的sds
‑
page凝胶进行电泳(110v,1.5h),检测到蛋白条带为110kda,与预期大小一致。利用bca蛋白测量试剂盒测定纯化后的apn蛋白浓度为2.12mg/ml。
36.二、动物的免疫
37.用上述制备的抗原蛋白与佐剂(除第一次使用弗氏完全佐剂外,后面四次均使用弗氏不完全佐剂,均购于sigma aldrich)充分乳化后,免疫6
‑
8周龄雌性balb/c小鼠,颈背部皮下多点注射,50μg/只;每2周免疫一次,五免后7天断尾采血,用间接elisa方法检测小鼠抗体效价,选择抗体效价高的小鼠(血清稀释至1∶25600时od值≥1.213)在融合前3天腹腔注射100μg/只的apn蛋白以加强免疫。
38.三、细胞融合
39.五免结束后,复苏sp2/0细胞,使用含6%胎牛血清(fbs)的dmem进行培养,调整细胞状态(圆形明亮,大小均一),扩大培养多瓶,每日换液,确保细胞融合时sp2/0处于对数生长期,状态良好,活细胞计数高于95%。
40.在小鼠加强免疫的次日,取未免疫的balb/c小鼠摘除眼球采血,并分离血清作为抗体检测时的阴性对照。同时,按照常规操作制备饲养细胞(腹腔巨噬细胞),用适量的hat培养基重悬细胞至2
×
105/ml后,铺布96孔板,100μl/孔,并置于37℃,6%co2的培养箱中培养备用。
41.在加强免疫的第3天,取检测抗体效价高的balb/c小鼠,摘除眼球采血,并分离血清作为抗体检测时的阳性对照。同时,按照常规操作摘取免疫小鼠的脾脏,并制成单细胞悬液,用200目铜网过滤以除去脾细胞悬液中的大团块;1000rpm离心10min后,用dmem基础培养基重悬细胞,同上洗涤、离心两次;再重悬于10ml培养基中,制成细胞悬液,活细胞计数后备用。同时,选用8
‑
10瓶状态良好的sp2/0细胞(细胞密度为80
‑
90%),用不含血清的dmem基础培养基轻轻吹下细胞,收集于离心管中,1000rpm离心10min后弃上清;再用适量培养基重悬细胞,同上洗涤、离心两次;最后用10ml培养基重悬细胞,制成细胞悬液,活细胞计数后备用。
42.取计数后的脾细胞和sp2/0细胞按5∶1
‑
10∶1的比例充分混匀,收集到50ml融合管
中,1000rpm离心10min,弃上清;用掌心轻击融合管底,使细胞团松散;随后,在45s内缓慢滴加1ml 37℃预热的roche peg1500,边滴边用掌心轻轻旋转融合管底部,并在90s内缓慢滴加1ml 37℃预热的dmem基础培养基;补加适量培养基定容至30ml后,放入37℃水浴中静置30min;取出后,1000rpm离心10min,弃上清,用hat培养基重悬细胞,充分混匀后,分装于已接种饲养细胞的96孔细胞培养板中,37℃,6%co2培养箱中培养。5天后每孔补加1
‑
2滴新鲜的hat培养基,10天后用ht培养基替换hat培养基;观察各孔内杂交瘤细胞的生长情况,待细胞培养上清变黄或孔内有明显的细胞集落形成时,吸取细胞培养上清进行间接elisa抗体检测。
43.四、杂交瘤细胞的筛选和建株
44.用0.05mol/l碳酸钠
‑
碳酸氢钠缓冲液(ph 9.6)稀释apn蛋白至终浓度5μg/ml,批量包被96孔酶标板,按常规操作封闭后,
‑
20℃保存备用。检测当天,取出酶标板在室温复温15
‑
20min后,吸取待检孔的细胞上清加入上述酶标板中,同时设立阳性对照、阴性对照和空白对照(pbs),按照elisa检测常规操作,测定孔内的od
450
读值:待检孔的od值/阴性对照孔的od值≥2.1即可判断为阳性,标记相应的孔后备用。
45.采用有限稀释法对连续三次检测为阳性孔的杂交瘤细胞进行亚克隆,克隆前制备饲养细胞;对阳性孔中的杂交瘤细胞进行活细胞计数后,将其用ht培养基进行稀释,100μl/孔,加入已接种饲养细胞的96孔细胞培养板中,使每孔平均有0.5
‑
2个细胞,37℃,6%co2培养箱中培养。待细胞上清变黄时进行检测,连续检测三次均为阳性的孔再进行亚克隆,如此重复3~4次,直到阳性率达到100%且od
450
稳定时进行建株和冻存。
46.选择多株强阳性的杂交瘤细胞进行连续传代,用间接elisa方法来检测细胞上清的效价;同时,按照kohler g等的方法进行上述细胞的冻存和复苏,检测复苏培养的细胞上清的elisa效价。选择连续检测阳性率达到100%且效价高的,即能够稳定分泌抗apn抗体的细胞株进行扩大培养,并分别命名为2a20、5b31、5b36、3c48、5c51、6c56、3fd9、3f10、10f3。
47.五、单抗(腹水)的制备和纯化
48.选择10
‑
12周龄的雌性balb/c小鼠8
‑
10只,腹腔注射液体石蜡,0.3ml/只,7~10天后,腹腔注射对数期生长的杂交瘤细胞2
‑5×
105细胞/只,待小鼠腹部明显膨胀时收集腹水,4000rpm离心10min,收集上清。用饱和(nh4)2so4盐析法或protein a agarose亲和柱法(碧云天)进行腹水的纯化,随后通过sds
‑
page检测单抗的纯化效果,由图3可知,protein a agarose亲和柱法纯化效果优于饱和(nh4)2so4盐析法,抗体更纯且浓度更高。
49.利用bca法测定纯化后2a20、5b31、5b36、3c48、5c51、6c56、3fd9、3f10、10f3单抗的蛋白浓度,分别为3.189mg/ml,2.432mg/ml,3.402mg/ml,3.403mg/ml,1.968mg/ml,2.161mg/ml,2.447mg/ml,1.867mg/ml,2.890mg/ml。
50.实施例2抗猪源apn蛋白单克隆抗体的特性检测
51.一、单抗的稳定性和特异性测试
52.经过三次亚克隆筛选,获得9株杂交瘤细胞,最终命名为apn
‑
2a20、apn
‑
5b31、apn
‑
5b36、apn
‑
3c48、apn
‑
5c51、apn
‑
6c56、apn
‑
3fd9、apn
‑
3f10、apn
‑
10f3。经过液氮冻存、复苏和体外连续传40代次以上,上述细胞透明、圆润,生长良好,抗体效价未见降低,稳定性较好。将上述杂交瘤细胞株的细胞上清和腹水进行倍比稀释,用间接elisa方法检测效价,结果如表1所示。
53.表1.apn单抗的elisa效价
[0054][0055][0056]
将上述单抗分别与纯化的猪源apn蛋白、人cd13蛋白(sigma aldrich)进行western
‑
blot试验和玻板凝集试验,如图1结果(以apn
‑
5b36为例)所示,只有猪源apn能与单抗发生特异性反应,说明上述单抗具有很好的特异性。
[0057]
二、单抗的亚类鉴定
[0058]
根据southernbiotech单抗亚类试剂盒(5300
‑
01,5300
‑
05)说明书,以捕获elisa的方法进行单抗的亚类鉴定,结果如表2所示。
[0059]
表2.apn单抗的亚类鉴定结果
[0060][0061]
三、单抗识别抗原表位的分析
[0062]
取出
‑
20℃保存的包被apn抗原的96孔酶标板,室温复温15
‑
20min后,吸取上述实验制备的单抗和前期制备的apn多克隆抗体1∶1000稀释,每组设三个重复(取平均读值用于
后续计算);同时设立空白和阴性对照,37℃孵育1h后,按照常规elisa步骤进行试验。用av(additivity value)值表示抗体之间相加效应的程度,计算公式为:av=(odmcab(a b))/(odmcaba odmcabb)
×
100%。其中,odmcaba、odmcabb表示不同单克隆抗体单独与抗原作用时的od
450
值;odmcab(a b)表示2种单克隆抗体混合后与抗原作用时的od
450
值(av值<50%时,说明a和b两种单抗识别同一个抗原位点,而av值>50%时,说明a和b两种单抗识别不同的抗原位点)。由结果可知,单克隆抗体2a20、5b36、3f10识别apn抗原表位不完全一致;3c48、5c51、6c56识别的抗原表位类似,同时,3c48能够识别3fd9的抗原表位,6c56也能够识别10f3的抗原表位,如表3所示。
[0063]
表3.抗原的表位鉴定
[0064][0065]
四、重组表达抗体蛋白
[0066]
根据上述结果,与其他单抗相比,apn
‑
5b36抗体的效价和蛋白浓度均较高,且与其他抗体无交叉抗原表位,因此,综合选定apn
‑
5b36进行细胞保藏和序列鉴定。采用trizol法提取上述杂交瘤细胞的总rna,测量rna的纯度和浓度后,按照rt reagent kit with gdna eraser试剂盒提供的方法去除基因组dna,反应条件为42℃ 2min,冷却至4℃后备用。注意整个反应体系的配制均在冰上进行,具体体系如表4:
[0067]
表4反应体系
[0068][0069]
*
10μl反应体系最多可消除1μg的total rna,加入量需要根据实际提取的rna浓度
计算
[0070]
将上述实验产物按照primescript
tm 1st strand cdna synthesis kit说明书进行反转录,反转录后的cdna放置于
‑
20℃保存备用。
[0071]
根据抗体的不同亚类选用特异性的引物,利用巢氏pcr扩增抗体可变区序列(重链vh及轻链vl引物,up:5
’‑
ccgggtgggccggatagacmgatggggctg
‑3’
;lo:5
’‑
ccggccacataggccccacttgacattgatgt
‑3’
),扩增产物用1.5%的琼脂糖凝胶进行电泳,选择清晰明亮的目的条带进行胶回收,回收产物与t载体连接后,16℃连接过夜,次日转化涂布amp
平板,挑单克隆送测序,分析后获得上述杂交瘤细胞的重链、轻链序列,结果如seq id no.1(氨基酸序列)和seq id no.2所示(核苷酸序列),经与小鼠抗体库序列比对后验证正确,重链恒定区为igg2b,轻链恒定区为cλ。
[0072]
seq id no.1(下划线部分为轻链):
[0073][0074]
seq id no.2(下划线部分为轻链):
[0075][0076]
将抗体重链、轻链序列串联后,1)与pet28a( )载体通过无缝克隆连接(引物序列为up:5
’‑
tccaccagtcatgctagccataacaacggtcgtgattcga
‑3’
;lo:5
’‑
ctggtgccgcgcggcagccagtgggatacccgtattaccc
‑3’
)(见图2),经测序验证正确后,导入bl21大肠杆菌。经过条件筛选,以0.4mm iptg于16℃诱导表达10h,纯化后的抗体蛋白经sds
‑
page检测纯化效果,由图3可知,细胞上清和沉淀中均存在疑似目的抗体蛋白,但蛋白大小并不一致;且elisa、间接免疫荧光等试验证明上述两种来源的疑似抗体蛋白均不能有效识别apn或不能达到腹水制备单抗的效果,不具有单抗活性。
[0077]
2)与pires2
‑
zsgreen1载体通过无缝克隆连接(引物序列为up:5
’‑
cgacggtaccgc
gggcccggtaacaacggtcgtgattcga
‑3’
;lo:5
’‑
gggggggagggagaggggcggtgggatacccgtattaccc
‑3’
)(见图2),经测序验证正确后,转染cho细胞,经400μg/ml g418筛选和流式细胞仪分选获得阳性细胞,建系后开始梯度降低血清浓度,最终获得由无血清培养基培养的稳定表达细胞系pires2
‑
zsgreen1
‑
apn
‑
5b36
‑
cho。其中,zsgreen1荧光表达便于筛选转染后的阳性细胞;而ires2组分可以使zsgreen1及抗体链蛋白在哺乳动物细胞中串联表达。
[0078]
经过条件筛选,将上述细胞调至对数期生长后,以0.8
‑
1.0
×
105/ml密度接种无血清基础培养基dmem f12,在37℃,80
‑
110r/m,6%co2条件下培养,每12h收集细胞悬液进行活性检测,待细胞密度达到1.0
‑
2.0
×
106/ml以上,细胞活力下降至80%时,离心获得细胞上清,过滤后经protein a agarose纯化获得抗体蛋白,命名为apn
‑
5b36y。利用上述单抗和抗体蛋白apn
‑
5b36y进行apn蛋白的elisa效价检测和间接免疫荧光实验,由图4可知,apn抗体蛋白apn
‑
5b36y具有与apn腹水单抗相同的生物学活性,能够识别apn蛋白并表现出明显的红色荧光,elisa检测抗体效价为2.56
×
105。为后续开发重组抗体
‑
抗原复合物奠定了基础和平台。
[0079]
五、elisa法测抗体的相对亲和力
[0080]
用0.05mol/l碳酸钠
‑
碳酸氢钠缓冲液(ph 9.6)稀释apn蛋白至终浓度0,0.5,1,5,10μg/ml,充分混匀后加入酶标板条中,100μl/孔,包被液作为空白对照,37℃孵育1h,4℃过夜进行包被。用含有5%脱脂奶的pbst进行封闭,37℃孵育1h;pbst洗涤3次,5min/次,拍干后备用;将不同抗体也倍比稀释后依次加入对应的抗原孔中,100μl/孔,37℃孵育3h;pbst洗涤3次,5min/次;拍干后与hrp标记的羊抗鼠igg二抗(1∶10000)共孵育,100μl/孔,37℃孵育30min;pbst洗涤同前,拍干;加入tmb底物显色液,100μl/孔,37℃避光作用20min后以2mol/l h2so4终止显色,50μl/孔;随后,利用酶标仪在波长450nm处测定apn
‑
5b36单克隆抗体或抗体蛋白apn
‑
5b36y与不同浓度apn蛋白(pet28a( )
‑
apn菌株表达的蛋白)结合时的吸收峰。采用四参数logistic模型(four
‑
parameter logistic model)拟合绘制抗体的相对亲和力曲线,其中,x轴为抗体浓度的对数,y轴为吸光度。由图5可知,apn
‑
5b36单克隆抗体与apn蛋白的结合早于apn
‑
5b36y达到平衡;同时,结合graphpad8.0软件对抗体亲和力常数k
d
进行计算,上述两种单克隆抗体的k
d
值分别为(4.232
±
0.475)
×
10
‑9mol/l和(2.201
±
0.367)
×
10
‑8mol/l,说明apn
‑
5b36单克隆抗体与apn蛋白的亲和力略高于apn
‑
5b36y与apn的亲和力,但两者均属于亲和力较高的单克隆抗体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

