作为阿尔茨海默病的诊断和预后中的标志物的p53肽
发明领域
1.本发明涉及p53肽p1、p2、p3和p5,以及它们在生物样品中作为阿尔茨海默病(ad)的诊断和/或预后中的生物标志物的用途。本发明还提供了一种诊断方法,所述诊断方法基于高度精确的质谱分析,通过特异性地定量患者的人类血浆中的所述p53肽的水平,用于对处于阿尔茨海默病的临床前期和前驱期的该疾病的诊断,以及用于对受试者中的认知衰退的预后。
背景技术:
2.在不同的已发表研究[1
‑
3]中已经展示了将大量的改变构象的p53异形体(isoform)的存在确认为阿尔茨海默病(简称“ad”)的早期风险因素。最初,ad、轻度认知障碍、帕金森病、其他痴呆和健康受试者中的多于400名受试者被登记到不同的独立研究中,并通过用使用商业构象特异性抗p53抗体的不同技术(免疫沉淀实验、facs分析、elisa)对未折叠的p53进行测试[4
‑
7]。2006年uberti等人[8]首次展示了来自散发性阿尔茨海默病(ad)患者的成纤维细胞特异性表达异常且可检测到的p53构象状态,该构象状态将这些细胞与年龄匹配的非ad受试者的成纤维细胞区分开来。在这种构象改变的状态中,p53失去其反式激活其靶基因的能力,并且因此失去了其生物学功能[9
‑
10]。与健康非痴呆受试者或受其他痴呆和pd影响的患者相比,在ad的血液中以及转化为ad的mci中也证实了较高量的未折叠的p53。
[0003]
总之,这些数据表明了未折叠的p53和ad病理之间的直接联系。
[0004]
在ep3201234b1中,已经报道了一种命名为2d3a8的新的构象特异性抗up53抗体的开发,该抗体与表位(aa 282
‑
297)结合,该表位仅在p53失去其野生型构象趋向未折叠的表型时才可及(accessible)。与起初在ad中发现未折叠的p53时使用的商业抗体(pab240,aa214
‑
217)相比,2d3a8抗体在oviedo队列(cohort)中在与健康老年人相比鉴定ad患者中显示出高的灵敏度和特异性。
[0005]
特别地,所述免疫诊断方法能够鉴定生物样品中指示ad的免疫复合物,并确定受轻度认知障碍(mci)影响的受试者发展ad的易感性。
[0006]
现在需要鉴定可用于阿尔茨海默病的诊断和/或预后的新的特异性生物标志物,并且需要开发可用于ad(特别是处于该疾病的临床前期和前驱期)的诊断和/或预后以及用于对ad与其他形式的痴呆的鉴别分析的精确且合理的诊断方法。
[0007]
发明概述
[0008]
通过在生物样品中鉴定具有权利要求书中报告的序列的称为p1(seq id n.1)、p2(seq id n.2)、p3(seq id n.3)和p5(seq id n.5)的四种p53肽,实现了该目的。
[0009]
本发明的另一方面涉及一种诊断方法,所述诊断方法基于所述肽的鉴定和定量,用于在处于不同期的阿尔茨海默病的诊断和/或预后中使用。
[0010]
本发明的特征和优点将从以下的详细描述和为说明性目的提供的工作实施例中变得明显。
id n.5)的p53肽。
[0026]
本发明的另一种实施方案是由(v)p5:gephhelppgstkralpnntssspqpk(seq id n.5)组成的p53肽。
[0027]
另一种实施方案是根据本发明的p53肽p3和/或p5作为用于阿尔茨海默病的诊断的体外生物标志物的用途。
[0028]
本发明的另一种实施方案是用于阿尔茨海默病的诊断和/或预后的体外或离体方法,该方法包括以下步骤:
[0029]
a)确定生物样品中p53肽的存在,和
[0030]
b)通过比较所述肽与给定内部对照来定量所述肽。
[0031]
在优选的实施方案中,步骤a)中的p53肽是p53肽p1或p2。
[0032]
在优选的实施方案中,本发明的方法还包括步骤c)将p53肽的量与处于疾病的不同期的患者中阿尔茨海默病的诊断相关联。
[0033]
优选地,所述生物样品是血液、血浆、血清、唾液、尿液、神经元细胞、血细胞或其他类型的细胞。
[0034]
在优选的实施方案中,在根据本发明的方法中,步骤a)通过用与p53肽结合的单克隆抗体免疫沉淀p53肽来进行。
[0035]
优选地,所述单克隆抗体是抗体2d3a8。
[0036]
在根据本发明的方法的优选的实施方案中,步骤b)通过质谱分析进行,优选地通过hplc
‑
质谱进行。
[0037]
在另一种优选的实施方案中,在步骤b)中,经标记的肽用作内部对照。
[0038]
根据优选的实施方案,本发明的体外或离体方法包括以下步骤:
[0039]
a)通过以下(i)、(ii)、(iii)、(iv)来确定生物样品中p53肽的存在:
[0040]
(i)提供生物样品;
[0041]
(ii)通过与p53肽结合的抗体进行蛋白免疫沉淀;
[0042]
(iii)通过胰蛋白酶进行蛋白片段化;
[0043]
(iv)进行肽的强阳离子交换色谱法;
[0044]
和
[0045]
b)通过以下(v)经由比较所述p53肽与给定内部对照来定量所述p53肽:
[0046]
(v)进行选择性反应监测分析以通过比较p53肽与给定对照来鉴定和定量p53肽。
[0047]
优选地,步骤a)(ii)的抗体是2d3a8。
[0048]
优选地,在进行步骤a)(ii)之前,通过hplc或色谱柱对步骤a)(i)的生物样品进行蛋白血浆消耗(protein plasma depletion)。
[0049]
根据优选的实施方案,本发明的体外或离体方法用于无症状个体和罹患mci的人中的阿尔茨海默病的诊断。
[0050]
优选地,在无症状个体和罹患mci的人中,p53肽的量为0.05fmol/40μl至6.70fmol/40μl。
[0051]
根据另一种优选的实施方案,本发明的体外或离体方法用于无症状个体和罹患mci的人中的阿尔茨海默病的认知衰退的预后。
[0052]
优选地,在具有阿尔茨海默痴呆的认知衰退的预后的无症状和mci受试者中,p53
肽的量为0.203fmol/40μl至6.70fmol/40μl。
[0053]
优选地,在无症状个体中,auc为至少80%。
[0054]
优选地,在罹患mci的人中,auc为至少90%。
[0055]
诊断/预后方法准确性的度量包括灵敏度和特异性。灵敏度是指在具有靶条件的那些中出现阳性测试结果的概率,并且其通过以下式进行测量:灵敏度=真阳性/(真阳性 假阴性)。特异性是没有靶条件的那些中出现阴性测试结果的概率,并且其通过以下式来测量:特异性=真阴性/(真阴性 假阳性)。
[0056]
优选地,在无症状个体中,p53肽的灵敏度为至少70%。
[0057]
优选地,在罹患mci的人中,p53肽的灵敏度为至少90%。
[0058]
优选地,在无症状个体中,p53肽的特异性为至少90%。
[0059]
优选地,在罹患mci的人中,p53肽的特异性为至少90%。
[0060]
在另一种优选的实施方案中,本发明的体外或离体方法用于阿尔茨海默病与其他痴呆的鉴别分析,所述其他痴呆选自额颞叶痴呆(ftd)、路易体、帕金森病和血管性痴呆。
[0061]
优选地,在受阿尔茨海默病影响的患者中,所述p53肽的量为2.21fmol/40μl至6.56fmol/40μl,而在受其他形式的痴呆影响的患者中,所述p53的量低于3.81fmol/40μl。
[0062]
优选地,在受阿尔茨海默病影响的患者中,auc为至少85%。
[0063]
优选地,在受阿尔茨海默病影响的患者中,p53肽的灵敏度为至少75%。
[0064]
优选地,在受阿尔茨海默病影响的患者中,p53肽的特异性为至少80%。
[0065]
本发明的另一种实施方案是如上文描述的检测p53肽的方法,所述方法包括以下步骤:
[0066]
a)确定生物样品中p53肽的存在,和
[0067]
b)通过比较所述肽与给定对照来定量所述肽。
[0068]
在另一种优选的实施方案中,本发明的方法还包括步骤c):将p53肽的量与阿尔茨海默病的诊断和/或预后相关联。
[0069]
根据优选的实施方案,在本发明的方法中,步骤c)将p53肽的量与无症状个体和罹患mci的人中的阿尔茨海默病的诊断相关联。
[0070]
在优选的实施方案中,步骤a)中的p53肽是p53肽p1或p2。
[0071]
根据另一种优选的实施方案,在本发明的方法中,步骤c)中p53肽的量与无症状个体和罹患mci的人中的阿尔茨海默病的认知衰退的预后相关联。
[0072]
更优选地,在本发明的方法中,步骤c)中p53肽的量与阿尔茨海默病与其他痴呆的鉴别分析相关,所述其他痴呆选自额颞叶痴呆(ftd)、路易体、帕金森病和血管性痴呆。
[0073]
还应该理解的是,如上文报告的本发明的肽的优选方面的所有组合,以及其制备方法和其使用方法都应被认为在此公开。
[0074]
本发明的肽的优选方面的所有组合、制备方法和上文所公开的方法应理解为本文描述的。
[0075]
下文是为了说明性目的而提供的本发明的工作实施例。
实施例
[0076]
材料和方法
[0077]
材料
[0078]
基于抗体的血浆/血清消耗igy14 lc10柱购自sigma
‑
aldrich(merck kgaa,darmstadt,germany)。胰蛋白酶(测序级经修饰的猪胰蛋白酶)从promega获得。乙腈购自jt baker,并且甲酸从emd millipore(billerica,ma,usa)获得。用于样品制备的c18盒(c18 cartridges),和用于brplc的色谱柱,以及三重四极质谱仪的在线hplc购自waters(milford,massachusetts)。血浆稀释缓冲液、
‑
血浆洗涤缓冲液和
‑
血浆洗脱缓冲液遵循用于该方法的标准方案制备。除非另有说明,所有其他试剂均购自sigma
‑
aldrich(st.louis,missouri)。
[0079]
血浆样品消耗
[0080]
使用seppro igy14柱消耗血浆中最丰富的蛋白。血浆样品在血浆稀释缓冲液中稀释5x,过滤(0.22μm),然后注入与agilent 1200hplc系统附接的igy lc10柱中。收集未保留的级分(fraction)。用血浆洗脱缓冲液洗脱高丰度蛋白。
[0081]
免疫沉淀(ip)
[0082]
抗体克隆2d3a8用于ip反应。抗体与珠的缀合经优化并使用连接缓冲液进行。单克隆抗体直接添加至蛋白g dynal磁珠(从invitrogen获得),并且抗体与缓冲液中的珠在旋转器上于室温结合2h。然后结合抗体的珠通过在50ml link
‑
a缓冲液中孵育来洗涤,并收集在磁体上。抗体通过与50ml b缓冲液在旋转器上于室温孵育1h而与珠上的蛋白g交联。然后珠用50mlc缓冲液洗涤两次,重悬在50mlc缓冲液中,并在室温旋转15min。将珠重悬在c缓冲液中并在
‑
20℃储存直到应用。将200μl的经消耗或未消耗的血浆样品用于ip反应,将每个样品用ip缓冲液重构至3ml系统中,并将3ml的缀合抗体的珠(1∶1体积比)添加至系统。ip系统在旋转器上以32转/分的速度在4℃孵育18小时。将珠收集在磁体上,并且在4℃用ip
‑
洗涤缓冲液洗涤3次,然后用ip
‑
洗脱缓冲液洗脱抗原。收集流过级分(flow
‑
through fractions)用于蛋白样品制备。
[0083]
蛋白制备
[0084]
蛋白样品按照“过滤器辅助样品制备”(fasp)方法(nat methods.2009,6:359
‑
362)进行处理。简而言之,9m尿素中的蛋白样品用5mm tcep在37℃还原45min,并且还原的半胱氨酸用50mm碘乙酰胺在25℃封闭15min。然后蛋白样品(各自100μg)用9m尿素使用10kda amicon过滤器(ufc501096,millipore)清洗三次,并用缓冲液1清洗两次。然后样品用胰蛋白酶(v5111,promega)在37℃蛋白水解12小时。然后通过添加1%三氟乙酸(tfa)使肽溶液酸化,并在室温孵育15min。通过装载5ml 100%(vol/vol)乙腈激活sep
‑
pak轻c18盒(waters corporation),并通过3.5ml0.1%tfa溶液洗涤两次。
[0085]
酸化的经消化的肽溶液以1,800
×
g离心5min,并将上清液装载到盒中。为了使与盒结合的肽脱盐,依次使用1ml、3ml和4ml的0.1%tfa。为了将肽从盒中洗脱,使用2ml的具有0.1%tfa的40%(vol/vol)乙腈,并且该洗脱再重复两次(总共6ml洗脱液)。重要的是确保在应用每次顺序洗涤和洗脱溶液之前,盒已经停止滴液。将洗脱的肽冻干过夜,并在100μl缓冲液2中重构。
[0086]
强阳离子交换色谱法
[0087]
肽通过强阳离子交换(scx)色谱法进行分级分离(fractionated)。简而言之,将冻干的肽混合物重悬在1ml scx溶剂a(5mm kh2po
4 ph 2.7,30%acn)中重悬,并通过scx色谱
法在agilent 1290infinity ii lc系统上在polysulphoethyl a(5μm,)柱(200
×
9.4mm;polylc inc.,columbia,md)上通过使用scx溶剂b(5mm kh2po
4 ph 2.7,30%acn,350mm kcl)的递增梯度来分级分离。对于每个实验,最初总共收集96个级分,然后将其汇集成24个级分,并使用speedvac(eppendorf)干燥。brplc和scx并列地进行以比较tp53蛋白检测的相容性,并且选择scx是因为在这个项目中重复观察到tp53异形体的相对更高产量。
[0088]
肽srm转变的优化
[0089]
选择来自靶向tp53蛋白的4种肽作为srm定量靶,并使用用于带1 、2 、3 和4 电荷的前体离子的agilent 6495三重四极质谱仪单独地确定了4种肽的1092组转变参数和保留时间。然后选择2种肽(p1和p2)作为与ad病理相关的主要肽。
[0090]
选择性反应监测(srm)分析
[0091]
37ul缓冲液3中重构的肽样品用srm内部对照混合物加标(spiked),所述srm内部对照混合物由1飞摩尔重同位素标记的肽的池组成,覆盖大疏水性窗口和大m/z范围(m/z 200~1300),肽样品通过在线agilent 1290hplc系统洗脱至agilent 6495三重四极质谱仪的射流esi源中。
[0092]
结果
[0093]
在先前的项目中,在血浆中累计检测到p53蛋白的5种肽[p1:teeenlr(seq id n.1);p2:teeenlrk[gg]k(seq id n.2),p3:kkpldgeyftlqir(seq id n.3),p4:epggsrahsshlk(seq id n.4)和p5:gephhelppgstkralpnntssspqpk(seq id n.5)]。确定了4种肽的srm检测方法。肽gephhelppgstkralpnntssspqpk由于其高分子量而不适合用于基于srm的检测。
[0094]
p53序列肽与ad诊断之间的相关性。
[0095]
实施例1.通过深度测序蛋白方法在无症状(认知正常)和mci期对阿尔茨海默病的p53肽标志物的检测。
[0096]
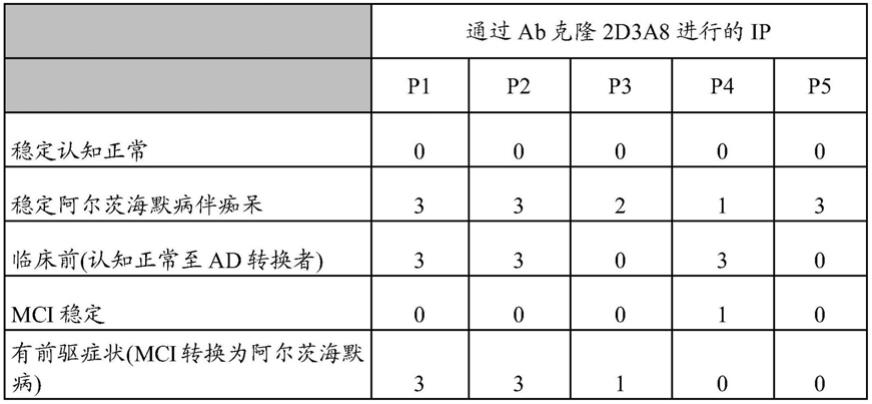
对用构象特异性ab 2d3a8免疫沉淀的人类血浆进行深度序列质谱分析。血浆样品根据上文报告的方法被消耗了丰富的蛋白。然后样品通过2d3a8进行免疫沉淀,并使用orbitrap(深度序列质谱分析)进行分析。选择在ad、mci至ad以及无症状至ad中独特存在并且在无症状和mci稳定样品中不存在的所得肽作为标志物。通过这种方法对肽进行的检测(存在/不存在)与受试者的临床诊断相关。
[0097]
对以下进行了分析:来自pib(pittsburgh化合物b) ve ad(pib ve)患者(ad)的10个样品的池,来自在基线(正常)后至少108个月保持无症状和pib
‑
ve两者的无症状pib阴性个体的10个基线血浆样品的池,来自患有mci的pib ve患者的在其转变为ad症状(前驱的,由于ad的mci)之前18个月的10个基线血浆样品的池,来自没有经历进一步认知衰退至ad症状的患有mci的pib
‑
ve患者(基线后18
‑
72个月随访)(mci稳定)的10个基线血浆样品和来自患有mci的pib ve患者(临床前,正常至ad转换者)的在其转换为ad症状之前18个月的3个基线血浆样品的池。
[0098]
表1.基线特征的纳入标准
[0099] 最小年龄f/m最小%前驱的(mci至ad)700.40临床前(认知正常至ad转换者)700.4
mci稳定700.40认知正常660.5阿尔茨海默病伴痴呆670.5
[0100]
结果
[0101]
表2.p53标志物在无症状和mci期的ad的诊断中的表现的验证:通过深度测序质谱法的结果。
[0102]
转变的n=1可以解释为“可能阴性”,转变的n=2是可能阳性;转变的n=0为“阴性”,转变的n=3为阳性。
[0103][0104]
实施例2.对处于疾病的临床前期和前驱期的阿尔茨海默病有特异性的p53构象人类血浆生物标志物的验证
[0105]
通过直接elisa测量u
‑
p53信号对认知正常受试者和患有轻度认知障碍的人进展为可能的ad的临床进展进行研究的一项为期四年的纵向研究的初步结果显示出非常高的对进展的预测价值。基于这一发现,开发了一种基于鉴定p53肽p1和/或p2的高度精确的质谱方法,用于对处于疾病的临床前期和前驱期的阿尔茨海默病的诊断以及用于认知衰退的预后。在患有mci的受试者和无症状受试者两者中均达到了认知衰退至阿尔茨海默痴呆的最大预后ppv。据信,p53肽p1和/或p2的诊断和预后表现两者在迄今为止已报道的之中是最高的。
[0106]
一种特定的质谱方法,即srm(选择性监测反应)方法(通过三重四极质谱仪)用于定量来自ad、无症状、mci受试者的血浆样品中的p1和/或p2两者。通过本质上充当质量过滤器的三重四极质谱仪,可以通过观察不同的转变峰来对肽进行测序。然后,使用肽1和肽2的重标记(heavy labelled)内部对照,可以通过选择性监测反应(srm)方法以最大精度定量这些肽。
[0107]
预后表现
[0108]
评估了生物标志物在富集以下患者中的预后能力:所述患者是pib 而且在18个月中从mci受试者表现出认知衰退,以及在18
‑
72个月中从就诊时(at presentation)无症状的受试者表现出认知衰退。这是为了评估生物标志物在显著富集认知衰退中的价值,认知衰退作为无症状和患有mci的患者中的疾病改善试验(disease modifying trials)中的终点。使用临床表现的未来转换检查了p1和p2的预后能力。能够描述p1和p2的预后能力的统
计参数报告如下:
[0109]
表3.无症状受试者至ad诊断的预后能力
[0110] 序列肽1序列肽2灵敏度72.2%89%特异性95.5%100%ppv(阳性预测值)70.2%100%npv(阴性预测值)99.7%99.8%auc83%90.7%p值0.00220.0020
[0111]
表4.mci受试者至ad诊断的预后能力
[0112] 序列肽1序列肽2灵敏度95%100%特异性95%100%ppv(阳性预测值)88.2%100%npv(阴性预测值)98%100%auc96.3%100%p值0.00820.4724
[0113]
结论
[0114]
p1和p2能够以非常高的特异性和灵敏度,准确地从无症状或mci临床表现富集将表现出认知衰退的患者,并且从而能够成功招募患者用于靶向该疾病极早期阶段(very early stages)的疾病改善药物。
[0115]
实施例3.
[0116]
阿尔茨海默病与其他形式的痴呆的鉴别诊断
[0117]
还进行了一项分析,以验证先前关于u
‑
p53生物标志物在阿尔茨海默痴呆中的特异性的数据。将淀粉样蛋白阳性且具有阿尔茨海默痴呆的良好表征的阿尔茨海默患者与具有其他痴呆诸如ftd(额颞叶痴呆)、帕金森、路易体和血管性痴呆的临床表现的患者进行比较。
[0118]
在疾病期收集来自od(ftd、血管性痴呆、帕金森、路易体)的血浆样品。无论如何,在鉴别诊断中,都有可能确定,高于某一截止值,两种肽序列表现出对ad(与od相比)的高特异性和灵敏度。
[0119]
此外,已经观察到两种肽的auc都大于90%,这显示了生物标志物浓度和ad诊断之间的高度相关性。
[0120]
在文献中,阿尔茨海默痴呆的鉴别诊断中存在未满足的需求,该鉴别诊断为鉴别:a)晚期ftd和晚期ad;b)晚期lbd和ad,因为这些可以模拟某些病例中的临床表现。任何可以排除ad或其他痴呆的事物都具有临床价值,因此对任一种痴呆的高灵敏度都足以带来价值。
[0121]
表5.p53肽p1和p2在患有痴呆的患者中鉴别阿尔茨海默病症与其他痴呆中的表现度量。
[0122] 序列肽1序列肽2灵敏度100%80%特异性85.7%85.7%ppv(阳性预测值)87.5%84.8%npv(负预测值)100%81.1%auc94.3%90.7%p值0.05100.0171
[0123]
参考文献
[0124]
1.stanga,s.et al.,2010.unfolded p53 in the pathogenesis of alzheimer’s disease:is hipk2 thelink?aging,2(9),pp.545
‑
554.
[0125]
2.lanni,c.et al.,2007unfolded p53:a potential biomarker for alzheimer’s disease.in journal of alzheimer’s disease.pp.93
‑
99.
[0126]
3.uberti,d.et al.,2008.conformationally altered p53:a putative peripheral marker for alzheimer’s disease.neuro
‑
degenerative diseases,5(3
‑
4),pp.209
‑
11.
[0127]
4.lanni,c.et al.,2008.conformationally altered p53:a novel alzheimer’s disease marker?molecular psychiatry,13(6),pp.641
‑
7.
[0128]
5.lanni,c.,racchi,m.,et al.,2010.unfolded p53 in blood as a predictive signature signature of the transition from mild cognitive impairment to alzheimer’s disease.journal ofalzheimer’s disease:jad,20(1),pp.97
‑
104.
[0129]
6.buizza,l.et al.,2012.conformational altered p53 as an early marker of oxidative stress in alzheimer’s disease.plos one,7(1),p.e29789
[0130]
7.arce
‑
varas n,et al.comparison of extracellular and intracellular blood compartments highlights redox alterations in alzheimer’s and mild cognitive impairment patients.current alzheimer research2017;14(1):112
‑
122.
[0131]
8.uberti,d.et al.,2006.identification ofa mutant
‑
like conformation of p53in fibroblasts from sporadic alzheimer’s disease patients.neurobiology of aging,27(9),pp.1193
‑
201.
[0132]
9.lanni,c.,nardinocchi,l.,et al.,2010.homeodomain interacting protein kinase2:a target for alzheimer’s beta amyloid leading to misfolded p53and inappropriate cell survival.plos one,5(4),p.e10171.
[0133]
10.lanni,c.et al.,2008.pharmacogenetics and pharmagenomics,trends in normal and pathological aging studies:focus on p53.current pharmaceutical design,14(26),pp.2665
‑
2671.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。