1.本发明涉及一种针对耐药性细菌或炎症诱导性细菌的抗菌组合物。另外,本发明涉及一种用来治疗、改善或预防耐药性细菌或炎症诱导性细菌所引起的疾病等的药物组合物或方法。
背景技术:
2.消化道或口腔等的黏膜中常存在各式各样的正常细菌,其整体形成菌群。正常菌群对于宿主的生理或健常维持发挥极大的作用。正常菌群的构成异常称为dysbiosis(菌群失调),已逐渐阐明其为各种疾病的成因。若进一步深入了解黏膜正常菌群,则极有可能有助于针对各种疾病的新的疾病对策或治疗开发,但由于其复杂性,其详细机制仍未充分阐明。
3.人每天会分泌、吞入约1.5l的唾液。一般而言,唾液所含的菌(口腔内细菌)仅仅通过肠道,而不会定植。然而,在某些情况下口腔内细菌有时会定植于肠道内。特别是有人报导,在克罗恩病、肝硬化、大肠癌中,自疾病发病的早期可观察到口腔内细菌的肠道定植。而且,已知定植的口腔内细菌会对疾病的病状造成影响(非专利文献1~6)。
4.另外,本发明者们从克罗恩病等的患者的口腔内细菌中,通过使其定植于肠道并诱导th1细胞,而成功分离培养、鉴定出与该疾病的发病有关的菌(专利文献1)。更具体而言,本发明者们对无菌小鼠口服施与取自某克罗恩病患者的唾液的结果发现,于大肠中干扰素
‑
γ(ifn
‑
γ)产生性cd4阳性t细胞(th1细胞)显著增加。而且,成功由可看出此th1细胞的增加的小鼠的肠内,分离培养出可认为属于肺炎克雷伯氏菌(klebsiella pneumoniae)的kp2h7株。进而阐明,通过取自克罗恩病患者的唾液的该菌定植于肠道,来诱导th1细胞的增殖或活化,也与肠炎的发生有关。
5.再者,本发明者们发现,对spf(specific
‑
pathogen
‑
free,无特定病原体)小鼠口服施与kp2h7株时,有别于所述无菌小鼠,没有确认这些细菌株的肠内定植。进而,也阐明通过对spf小鼠施与抗生素,这些细菌株有时能够定植于该小鼠的肠道。而且,基于这样的结果,本发明者们假设,肠道中存在抑制kp2h7株等th1细胞诱导性细菌的肠内定植的肠内细菌,且通过施与所述抗生素而将所述肠内细菌由肠道内排除,由此可使该细菌定植于肠内。
6.因此,尝试了在人肠内细菌中进行抑制th1细胞诱导性细菌的肠内定植的细菌的鉴定。其结果,成功由取自3位健常人(#k、#f及#i)的粪便试样,各自分离培养出68株、37株及42株肠内细菌株,且确定了各菌株的16srdna的序列。进而,阐明通过施与这些细菌株,可抑制th1细胞诱导性细菌的肠内定植(专利文献2)。
7.现有技术文献
8.专利文献
9.专利文献1:国际公开2018/084172
10.专利文献2:国际公开2019/017389
11.非专利文献
12.非专利文献1:y.chenet et al.,scientific reports 6,34055(2016)
13.非专利文献2:d.gevers et al.,cell host&microbe 15,382
‑
392(2014)
14.非专利文献3:c.a.lozupone et al.,cell host&microbe 14,329
‑
339(2013)
15.非专利文献4:i.vujkovic
‑
cvijin et al.,science translational medicine 5,193ra191(2013)
16.非专利文献5:n.qin et al.,nature 513,59
‑
64(2014)
17.非专利文献6:c.l.sears,w.s.garrett,cell host&microbe 15,317
‑
328(2014)
技术实现要素:
18.发明所要解决的课题
19.本发明中,目的在于发现对耐药性细菌或炎症诱导性细菌具有抗菌活性的肠内细菌,提供以该肠内细菌作为有效成分的针对耐药性细菌或炎症诱导性细菌的抗菌组合物,用来治疗、改善或预防耐药性细菌或炎症诱导性细菌所引起的疾病的药物组合物或方法。
20.用于解决课题的手段
21.本发明者们为达成所述目的而致力累积多次研究的结果阐明,抑制所述的th1细胞诱导性细菌的肠内定植的细菌(取自健常人#k的肠内细菌68株、取自健常人#f的肠内细菌37株、取自健常人#i的肠内细菌42株)可抑制多重耐药性细菌(碳青霉烯类耐性肠杆菌科细菌、万古霉素耐性肠球菌、艰难梭菌(clostridium difficile)、空肠弯曲杆菌(campylobacter jejuni))及炎症诱导性细菌(粘附侵袭性大肠杆菌)的肠内定植。
22.再者,关于这样的肠内的细菌定植抑制能力,成功由该37株中筛选出可发挥与取自健常人#f的肠内细菌37株同等程度之能力的18株,从而完成了本发明。
23.即,本发明是提供以下发明。
24.[1]一种针对耐药性细菌或炎症诱导性细菌的抗菌组合物,含有肠内细菌作为有效成分。
[0025]
[2]如[1]所述的抗菌组合物,其中,所述肠内细菌是具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0026]
[3]如[1]所述的抗菌组合物,其中,所述肠内细菌是具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0027]
[4]如[1]所述的抗菌组合物,其中,所述肠内细菌是由保藏号nite bp
‑
03147~03164中的任一者所特别规定的至少1种细菌。
[0028]
[5]如[1]所述的抗菌组合物,其中,所述肠内细菌是具有由序列编号:1~147中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0029]
[6]如[1]所述的抗菌组合物,其中,所述肠内细菌是具有由序列编号:1~68中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0030]
[7]如[1]所述的抗菌组合物,其中,所述肠内细菌是具有由序列编号:106~147中
的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0031]
[8]如[1]~[7]中任一项所述的抗菌组合物,是药物组合物。
[0032]
[9]如[1]~[7]中任一项所述的抗菌组合物,是用来治疗、改善或预防感染症或炎症性疾病的药物组合物。
[0033]
发明的效果
[0034]
根据本发明,通过抑制耐药性细菌或炎症诱导性细菌向肠道的定植等,可抑制这些细菌的增殖或活化,进而可治疗、改善或预防这些细菌所引起的疾病。
附图说明
[0035]
图1是对无菌小鼠施与克雷伯氏菌属2h7株(kp2h7),于其1周后对小鼠施与健常人的粪便样品(fmt)时,以cfu表示便中克雷伯氏菌属的菌量的经时变化的曲线图。使用5种粪便的任一样品中克雷伯氏菌属均明显减少。
[0036]
图2是表示取自健常捐赠者f、i、k的3种粪便的16s元分析(meta
‑
analysis)的结果的直方图。一个个方格表示1种菌株,其大小表示该菌占全体菌量的比例。将3种粪便在厌氧环境下进行培养,以相邻直方图的(彩色显示下)黄色表示在这里培养而能够分离出来的菌株。下方表示能够分离的菌的总数。
[0037]
图3是使kp2h7定植于无菌小鼠后,各自混合施与由粪便分离的菌株时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。源于取自健常捐赠者f的粪便(f便)的37株与粪便样品同等地使克雷伯氏菌属减少。
[0038]
图4是使kp2h7定植于无菌小鼠后,各自混合施与由粪便分离的菌株时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。与源于f便的37株同样,由取自健常捐赠者k的粪便(k便)所分离的68菌株与粪便样品同等地使克雷伯氏菌属减少。
[0039]
图5是对无菌小鼠施与kp2h7后,于1周后施与f37mix(源于f便的37菌株),进而于1个月后饮水施与氨苄青霉素时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。通过施与氨苄青霉素,克雷伯氏菌属虽暂时性增加,但其后再度降低。
[0040]
图6a是表示图5所示实验中的各菌量(f31、f22、f20、f32)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0041]
图6b是表示图5所示实验中的各菌量(f26、f28、f21、f30)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0042]
图6c是表示图5所示实验中的各菌量(f24、f23/f25、f35/f36、f09)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0043]
图6d是表示图5所示实验中的各菌量(f33、f12、f17/f19、f18)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0044]
图6e是表示图5所示实验中的各菌量(f34、f03/f08、f29、f13)在总菌量中的存在
比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0045]
图6f是表示图5所示实验中的各菌量(f04/f08、f37、f01、f02)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0046]
图6g是表示图5所示实验中的各菌量(f05、f07、f14)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0047]
图6h是表示图5所示实验中的各菌量(f10/f15、f16、f11/f27)在总菌量中的存在比率的经时变化的图。图的下方显示各菌的编号、r(与克雷伯氏菌属的斯皮尔曼等级相关系数)及菌名。
[0048]
图7是以kp2h7与各菌的菌量的斯皮尔曼等级相关系数具正相关的顺序排列菌的图。拟杆菌属(bacteroides)中多数呈现与kp2h7无关的行为,成负相关者多为furmicutes属。
[0049]
图8是对无菌小鼠施与kp2h7而使其定植后,各自混合施与图7所示37株(f37mix)、该37株中属于拟杆菌门(bacteroidetes)的8株(f8mix)、或除此之外的29菌株(f29mix)时,以cfu表示便中kp2h7的菌量的经时变化的曲线图。除拟杆菌属(bacteroides)外的29株也可看出与37株几乎同等的克雷伯氏菌属的减少,认为克雷伯氏菌属的排除不需要拟杆菌属(bacteroides)。
[0050]
图9是表示图8所示实验中所使用的f37mix、f8mix及f29mix的细项的系统树。系统树是将分离菌的采用桑格法的16srdna分析结果的dna碱基序列,使用mega x,通过邻接(neighbor
‑
joining)法制成的。关于系统树的制成,在图10及12中也同样。
[0051]
图10是表示源于f便的18菌株(f18mix)的细项的系统树。
[0052]
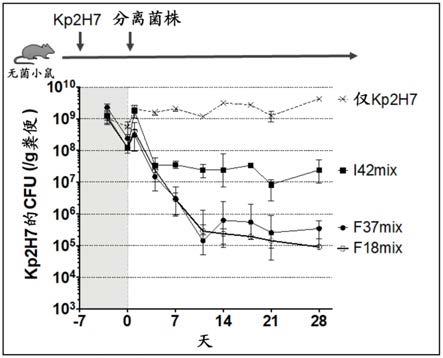
图11是使kp2h7定植于无菌小鼠后,各自混合施与源于f便的37菌株(所述f37mix)、源于f便的18菌株(图10所示f18mix)、或源于取自健常者i的粪便(i便)的42菌株时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。对于f18mix,也能与f37mix同等地排除克雷伯氏菌属。
[0053]
图12是将源于f便的18菌株(f18mix)分成4组,表示它们的细项的系统树。将此4组由18菌株(f18mix)中抽出而调制f15mix(f18mix
‑
other phyla)、f12mix(f18mix
‑
lachnoclostiridum)、f14mix(f18mix
‑
blautia)、f13mix(f18mix
‑
other firmicutes)的菌株组,提供给图11所示的实验。
[0054]
图13是使kp2h7定植于无菌小鼠后,各自混合施与由f37mix重复的株及除去f18mix的组(f31
‑
18mix)、所述f15mix、所述f12mix、所述f14mix、所述f13mix、或所述f18mix时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。此外,图13中合并显示进行了2次的实验数据。由f18mix中除去图12所示的任一组,克雷伯氏菌属排除能力都降低,表明任一组对于克雷伯氏菌属的排除都重要。
[0055]
图14是表示在图13所示实验中,于第28天的时间点各组的便中kp2h7的cfu的曲线图。f18mix施与组比起除f37mix以外的其他施与组,克雷伯氏菌属的菌量均统计学上显著地少。
[0056]
图15是表示对f37mix施与组、f18mix施与组、或kp2h7单独施与组的小鼠大肠黏膜固有层中的免疫细胞,以流式细胞仪进行分析的结果的散点图。图中的各圈选(gate,四边形)中的数值表示cd4 ifnγ 细胞的比例。比起kp2h7单独施与组,在f37mix施与组及f18mix施与组中,cd4 ifnγ 细胞的诱导被抑制。
[0057]
图16是对无菌小鼠施与kp2h7,于1周后施与各菌株mix时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。图中的“f15mix”是表示由f18mix除去e.coli(大肠杆菌)、fusobacterium(梭形杆菌属)及bifidobacterium(双歧杆菌属)的3株而进行施与的小鼠的结果,“f18mix
‑
e.coli”、“f18mix
‑
fusobacterium”及“f18mix
‑
bifidobacterium”则分别表示分别由f18mix除去所述3株当中的各1株而进行施与的小鼠的结果。此3株均如果由f18mix除去则其效果减弱,显示各自与克雷伯氏菌属的排除有关。
[0058]
图17是对无菌的rag2
‑
/
‑
γc
‑
/
‑
小鼠、myd88
‑
/
‑
triff
‑
/
‑
小鼠或野生型小鼠(wt)施与kp2h7,于1周后施与混合的f37mix时,以cfu表示kp2h7的便中菌量的经时变化的曲线图。任何类型的小鼠均能同等地排除克雷伯氏菌属。由此启示,宿主的主要天然免疫、获得性免疫与克雷伯氏菌属的排除无关。
[0059]
图18是对无菌小鼠施与克雷伯氏菌属(kp
‑
cre),于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)时,以cfu表示便中cre菌量的经时变化的曲线图。f37mix、k68mix也能使cre减少。
[0060]
图19是表示对图18所示实验结束时的小鼠的大肠以he染色进行分析的结果的显微镜照片。任何分离菌mix施与小鼠中均未看出炎症迹象。
[0061]
图20是对无菌小鼠施与vre(万古霉素耐性肠球菌),于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)时以cfu表示便中vre菌量的经时变化的曲线图。对于vre,比起f37mix,k68mix较能使菌量降低。
[0062]
图21是表示对图20所示实验结束时的小鼠的大肠以he染色进行分析的结果的显微镜照片。就任何分离菌mix施与小鼠均未看出炎症迹象。
[0063]
图22是对无菌小鼠施与aiec,于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)时,以cfu表示便中aiec菌量的经时变化的曲线图。对于aiec,f37mix是最有效地使菌量减少。
[0064]
图23是对无菌小鼠施与产生esbl的克雷伯氏菌属,于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)时,以cfu表示便中产生esbl的克雷伯氏菌属菌量的经时变化的曲线图。f37mix、k68mix与取自f的粪便同等地能排除产生esbl的克雷伯氏菌属。
[0065]
图24是对无菌小鼠施与空肠弯曲杆菌(campylobacter jejuni),于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)或取自健常人f的粪便试样时,以cfu表示便中弯曲杆菌菌量的经时变化的曲线图。任何分离菌mix施与组中均同等程度地看出空肠弯曲杆菌(campylobacter jejuni)的排除。
[0066]
图25是对无菌小鼠施与空肠弯曲杆菌(campylobacter jejuni),于其1周后对小鼠施与分离菌mix(f37mix、k68mix、i42mix)或取自健常人f的粪便试样时,以除以总菌量而得的相对值表示便中弯曲杆菌的菌量的经时变化的曲线图。任何分离菌mix施与组中均同等程度地看出空肠弯曲杆菌(campylobacter jejuni)的排除。
[0067]
图26是表示对无菌小鼠施与艰难梭菌(clostridium difficile),于其1周后对小
鼠施与分离菌mix(f37mix、k68mix、i42mix、k47mix)或取自健常人f的粪便试样时,以qpcr分析便中艰难梭菌(clostridium difficile)的菌量的经时变化的结果的曲线图。k68mix、k47mix比起取自f的粪便更能排出艰难梭菌(clostridium difficile),但f37mix的排除效果低。
具体实施方式
[0068]
<肠内细菌>
[0069]
本发明中,作为抗菌组合物的有效成分而含有的肠内细菌,在肠道内针对耐药性细菌或炎症诱导性细菌(以下也称“耐药性细菌等”)具有抗菌作用。
[0070]
本发明中所称“抗菌活性”,是指抑制细菌的活动的活性,更具体而言意指抑制细菌的增殖或定植,或者消灭细菌的活性,可举出例如,抑制肠内的细菌的定植的活性、从肠内排除细菌的活性。
[0071]“肠内细菌”是指存在于动物的肠道内的细菌。另外,作为所述细菌所存在的的动物,可举出人、非人动物(小鼠、大鼠、猴、猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、狗、猫、兔子、仓鼠等);这些动物当中,优选为人。
[0072]
本发明中,“肠内细菌”可为1株细菌,也可为由多株细菌所构成的细菌株的混合物。此外,由多株细菌所构成时,期望其中至少1种细菌株具有针对耐药性细菌等的抗菌活性。另外,此时,所述多株细菌可为不具有所述抗菌活性的细菌株,也可包含具有增强具所述抗菌活性的细菌株的该活性的作用的细菌株、具有维持具所述抗菌活性的细菌株的增殖或定植的作用的细菌株、针对抑制所述抗菌活性的细菌具有抑制该抑制活性的作用的细菌株。
[0073]
本发明中,作为“肠内细菌”,可举出例如,具有由序列编号:1~147中的任一者所记载的碱基序列或者相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的至少1种细菌;具有由序列编号:1~68中的任一者所记载的碱基序列或者相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的至少1种细菌;具有由序列编号:69~105中的任一者所记载的碱基序列或者相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的至少1种细菌(例如具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的至少1种细菌);或具有由序列编号:106~147中的任一者所记载的碱基序列或者相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的至少1种细菌。
[0074]
各序列编号所示序列是随附资料中的k68、f37及i43各菌的16srdna的序列。下述表1~4中,显示各菌、与表示各16srdna的序列的序列编号、与由该序列所推定的各菌的对应。此外,k、f及i表示为由3位健常人(日本人)的粪便各自分离出来的肠内细菌(参照专利文献2)。
[0075]
表1
[0076][0077]
表2
[0078][0079]
表3
[0080][0081]
表4
[0082][0083]
表1~4中显示将各序列编号所记载的序列,相对于refseq的16sdna序列数据库实施blast检索而为top hit的种名及refseq的accession(2020年1月8日时间点)。此外,一般而言,如果%同一性>97%就能够鉴定至种(species);如果>94%,就能够鉴定至属(genus)。因此,对于%同一性为>94%的菌株,应理解为是能够以属水平特别规定的菌。
[0084]
所称本发明的肠内细菌中的“至少70%的同一性”,是相对于各碱基序列的同一性优选为80%以上,更优选为85%以上,进一步优选为90%以上(例如91%以上、92%以上、93%以上、94%以上),更优选为94%以上(例如95%以上、96%以上、97%以上、98%以上),
特别优选为99%以上。
[0085]
另外,序列(氨基酸序列或核苷酸(碱基)序列)的同源性或同一性可利用blast(basic local alignment search tool,基本局部序列比对检索工具)的程序(altschul et al.j.mol.biol.,215:403
‑
410,1990)来确定。该程序基于根据karlin及altschul的算法blast(proc.natl.acad.sci.usa,87:2264
‑
2268,1990,proc.natl.acad.sci.usa,90:5873
‑
5877,1993)。通过blast来分析序列间的同源性或同一性时,可利用例如美国国家生物信息中心(ncbi)的blast等(例如,使用默认值、即初始设定的参数)来确定。
[0086]
本发明中,作为具有由序列编号:1~147中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,优选为这些肠内细菌群中的至少15种细菌,更优选为所述肠内细菌群中的至少30种细菌,进一步优选为所述肠内细菌群中的至少75种细菌,更优选为所述肠内细菌群中的至少120种细菌,进一步优选为所述肠内细菌群中的至少135种细菌,更优选为所述肠内细菌群中的至少140种细菌,进一步优选为各自具有由序列编号:1~147中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的147种肠内细菌,特别优选为各自具有由序列编号:1~147中的任一者所记载的碱基序列组成的dna的147种细菌。
[0087]
本发明中,作为具有由序列编号:1~68中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,优选为这些肠内细菌群中的至少7种细菌,更优选为所述肠内细菌群中的至少15种细菌,进一步优选为所述肠内细菌群中的至少35种细菌,更优选为所述肠内细菌群中的至少60种细菌,进一步优选为所述肠内细菌群中的至少65种细菌,更优选为各自具有由序列编号:1~68中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的68种肠内细菌,特别优选为各自具有由序列编号:1~68中的任一者所记载的碱基序列组成的dna的68种细菌。另外,作为具有由序列编号:1~68中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,期望对氨苄青霉素具有耐药性。另外,各自具有由序列编号:1~46中的任一者所记载的碱基序列或者相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的46种细菌也适合在本发明中使用。
[0088]
本发明中,作为具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,优选为这些肠内细菌群中的至少4种细菌,更优选为所述肠内细菌群中的至少8种细菌,进一步优选为所述肠内细菌群中的至少18种细菌,更优选为所述肠内细菌群中的至少29种细菌,进一步优选为所述肠内细菌群中的至少33种细菌,更优选为所述肠内细菌群中的至少35种细菌,进一步优选为各自具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的37种肠内细菌,特别优选为各自具有由序列编号:69~105中的任一者所记载的碱基序列组成的dna的37种细菌。另外,作为具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,期望对氨苄青霉素具有敏感性。
[0089]
本发明中,作为具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,优选为这些肠内细菌群中的至少2种细菌,更优选为所述肠内细菌群中的至少
5种细菌,进一步优选为所述肠内细菌群中的至少10种细菌,更优选为所述肠内细菌群中的至少14种细菌,进一步优选为所述肠内细菌群中的至少15种细菌,更优选为所述肠内细菌群中的至少16种细菌,进一步优选为所述肠内细菌群中的至少17种细菌,更优选为各自具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的18种肠内细菌,特别优选为各自具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列组成的dna的18种细菌(具有由序列编号:69所记载的碱基序列组成的dna的细菌、具有由序列编号:80所记载的碱基序列组成的dna的细菌、具有由序列编号:85所记载的碱基序列组成的dna的细菌、具有由序列编号:86所记载的碱基序列组成的dna的细菌、具有由序列编号:87所记载的碱基序列组成的dna的细菌、具有由序列编号:88所记载的碱基序列组成的dna的细菌、具有由序列编号:89所记载的碱基序列组成的dna的细菌、具有由序列编号:90所记载的碱基序列组成的dna的细菌、具有由序列编号:91所记载的碱基序列组成的dna的细菌、具有由序列编号:92所记载的碱基序列组成的dna的细菌、具有由序列编号:94所记载的碱基序列组成的dna的细菌、具有由序列编号:96所记载的碱基序列组成的dna的细菌、具有由序列编号:98所记载的碱基序列组成的dna的细菌、具有由序列编号:99所记载的碱基序列组成的dna的细菌、具有由序列编号:100所记载的碱基序列组成的dna的细菌、具有由序列编号:101所记载的碱基序列组成的dna的细菌、具有由序列编号:103所记载的碱基序列组成的dna的细菌、及具有由序列编号:105所记载的碱基序列组成的dna的细菌)。
[0090]
此外,各自具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列组成的dna的18种细菌的典型例是下述表5所示的保藏菌株。任一种细菌株均于2020年3月2日委托独立行政法人国家技术评估学会(nite,邮政编码292
‑
0818千叶县木更津市kazusakamatari 2
‑5‑
8 122号室)保藏。
[0091]
表5
[0092][0093]
此外,只要不损及针对耐药性细菌或炎症诱导性细菌的抗菌作用等,则由这些各菌,通过突变处理、基因重组、基因组编辑、自然突变株的选择等所培育的细菌(衍生株、诱导株等)也包含于本发明的肠内细菌。
[0094]
本发明中,作为具有由序列编号:106~147中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,优选为这些肠内细菌群中的至少4种细菌,更优选为所述肠内细菌群中的至少9种细菌,进一步优选为所述肠内细菌群中的至少22种细菌,更优选为所述肠内细菌群中的至少34种细菌,进一步优选为所述肠内细菌群中的至少39种细菌,更优选为所述肠内细菌群中的至少41种细菌,进一步优选为各自具有由序列编号:106~147中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的42种肠内细菌,特别优选为各自具有由序列编号:106~147中的任一者所记载的碱基序列组成的dna的42种细菌。另外,作为具有由序列编号:106~147中的任一者所记载的碱基序列或相对于该碱基序列有至少70%的同一性的碱基序列组成的dna的“肠内细菌”,期望对氨苄青霉素具有敏感性。
[0095]
另外,本发明中,作为“肠内细菌”的一个方案,可举出对选自由壮观霉素所构成的组中的至少一种化合物显示耐药性、及/或对选自由氨苄青霉素、泰乐菌素及氯仿所构成的组中的至少一种化合物显示敏感性的肠内细菌。另外,作为其他方案,可举出对甲硝唑显示耐药性、及/或对选自由万古霉素及泰乐菌素所构成的组中的至少一种化合物显示敏感性的肠内细菌。
[0096]
此外,如后述实施例所示,上述的肠内细菌是由本发明者们所分离出来的,针对耐药性细菌、炎症诱导性细菌等发挥抗菌作用,是有用的。从而,本发明也可提供以下发明。
[0097]
(1)具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0098]
(2)具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0099]
(3)由保藏号nite bp
‑
03147~03164中的任一者所特别规定的至少1种细菌。
[0100]
(4)具有由序列编号:1~147中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0101]
(5)具有由序列编号:69~105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0102]
(6)具有由序列编号:106~147中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0103]
(7)如(1)~(6)中任一项所述的细菌,是在肠道内针对耐药性细菌、炎症诱导性细菌、或诱导th1细胞的增殖或活化的细菌具有抗菌作用的细菌。
[0104]
<抗菌组合物及药物组合物>
[0105]
本发明的组合物只要是包含所述种肠内细菌的即可,该细菌可为活菌,也可以为死菌体。此外,可复合使用组合物,在作为结果联合使用而被摄取或吸收的情况(联合使用组合物的情况)下,所述种肠内细菌也可于2种以上的组合物中分开存在。
[0106]
本发明的组合物可为药物组合物、准药品用组合物、饮食品(包含动物用饲料)、或者用于研究目的(例如体外或体内的实验)的试剂的形态。
[0107]
本发明的组合物由于对耐药性细菌等发挥抗菌活性,因而适用于作为用于该细菌所引起的疾病的治疗、预防或改善的药物组合物、准药品用组合物、饮食品。
[0108]
本发明的组合物可通过公知的制剂学方法制剂化。例如,可制成胶囊剂、锭剂、丸剂、液剂、散剂、颗粒剂、细粒剂、膜衣剂、颗粒剂、片剂、舌下剂、咀嚼剂、口颊剂、糊剂、糖浆剂、悬浮剂、酏剂、乳剂、涂布剂、软膏剂、硬膏剂、贴敷剂、经皮吸收型制剂、洗剂、吸入剂、气雾剂、注射剂、栓剂等,而可以用于经由口服、非口服(例如肠道内、肌肉内、静脉内、气管内、鼻内、经皮、皮内、皮下、眼内、阴道、腹腔内、直肠或者吸入)、或包含这些多种的组合途径的路径的施与。
[0109]
在这些制剂化中,可与药理学上或者作为饮食品可容许的载体适宜组合,所述载体具体而言为灭菌水、生理食盐水、缓冲液、培养基、植物油、溶剂、基剂、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载体(vehicle)、防腐剂、黏合剂、稀释剂、等渗剂、镇痛剂、增量剂、崩解剂、缓冲剂、包衣剂、润滑剂、着色剂、甜味剂、增稠剂、矫味矫臭剂、增溶剂或者其他添加剂等。
[0110]
另外,在这些制剂化中,基于对肠道内的耐药性细菌等更有效率地发挥抗菌活性等观点,尤其是在以口服施与为目的的制剂中,也可与能将本发明的组合物有效地传递至肠道内的组合物组合。对于这样的可传递至肠道内的组合物不特别限制,可适宜采用公知的组合物,可举出例如,ph敏感性组合物、可抑制释放至肠道之组合物(纤维素系聚合物、丙烯酸聚合物及共聚物、乙烯酸聚合物及共聚物等)、可特异性地贴附于肠道黏膜之生物体贴附性组合物(例如美国专利第6.368.586号说明书所记载的聚合物)、含蛋白酶抑制剂之组合物、可通过肠道内酶而特异性地分解之组合物)。
[0111]
另外,将本发明的抗菌组合物作为药物组合物使用时,也可进一步包含用于耐药
性细菌等所引起的疾病的治疗、预防或改善的公知的物质(例如其他抗菌剂、抗炎症剂、免疫抑制剂),且也可与所述物质联合使用。
[0112]
将本发明的组合物作为饮食品使用时,该饮食品可为例如健康食品、功能性食品、特定保健用食品、营养功能食品、功能性标示食品、营养辅助食品、病患用食品或动物用饲料。作为饮食品的具体例,可举出发酵饮料、含油分的制品、汤类、乳饮料、清凉饮料水、茶饮料、酒精饮料、饮剂、胶冻状饮料等液状食品、含碳水化合物食品、畜产加工食品、水产加工食品;蔬菜加工食品、半固态食品、发酵食品、糕点类、预包装制品、微波炉专用食品等。进而,也可举出调制成粉末、颗粒、锭剂、胶囊剂、液状、糊状或胶冻状的健常饮食品。此外,本发明中的饮食品的制造可通过该技术领域所熟知的制造技术来实施。该饮食品中,也可添加有效改善或预防耐药性细菌等所引起的疾病的成分(例如营养素等)。再者,也可通过与可发挥该改善等以外的功能的其他成分或者其他功能性食品组合而制成多功能性的饮食品。
[0113]
本发明的组合物的制品(药物品、准药品、饮食品、试剂)或其说明书可附加针对耐药性细菌等发挥抗菌活性,或用以治疗、改善或者预防耐药性细菌等所引起的疾病之意旨的标示。另外,关于饮食品,为了在形态及使用对象等方面与一般食品区别,可作为保健功能食品(特定保健用食品、营养功能食品、功能性标示食品)将健康功能的标示附加于本发明的组合物的制品等。此处所称“对制品或说明书附加标示”,是指对制品本身、容器、包装等附加标示,或者对揭示制品信息的说明书、附加文件、宣传品、其他印刷物等附加标示。另外,本发明的组合物也可为试剂盒的形态。
[0114]
另外,如上所述,使用本发明的肠内细菌等,通过公知的制剂化技术,可制造药物组合物。从而,本发明也提供一种用于制造用来治疗、改善或预防耐药性细菌等所引起的疾病的药物组合物的本发明的肠内细菌等的使用。
[0115]
<治疗方法等>
[0116]
本发明也提供一种治疗、改善或预防对象中由耐药性细菌等所引起的疾病的方法,其特征在于,使对象摄取上述的抗菌组合物或者药物组合物、或作为它们的有效成分的上述的肠内细菌(以下总称为“本发明的药物组合物等或它们的有效成分等”)。
[0117]
本发明中所称“耐药性细菌”,是指对抗菌剂(抗生素等)具有耐药性,该药剂对其无效或不易发挥效果的细菌。另外,该药剂可为1种药剂,也可为多种药剂。即,本发明的耐药性细菌中也包含多重耐药性细菌。作为所述细菌,不特别限制,可举出例如,碳青霉烯类耐性肠杆菌科细菌(cre,产生kpc
‑
2的肺炎克雷伯氏菌(klebsiella pneumoniae)等)、万古霉素耐性肠球菌(vre,具有万古霉素耐性基因(vana)的细菌等)、艰难梭菌、空肠弯曲杆菌。更具体而言,可举出肺炎克雷伯氏菌(klebsiella pneumoniae)(atcc baa
‑
1705)、屎肠球菌(enterococcus faecium)(orla
‑
jensen)schleifer and kilpper
‑
balz(atcc 700221)、艰难梭菌(clostridioides difficile)(prevot)lawson et al.(atcc 43255,菌株标示:vpi 10463)、艰难梭菌(clostridioides difficile)(prevot)lawson et al.(atcc baa
‑
1382,菌株标示:630)、空肠弯曲杆菌(campylobacter jejuni)81
‑
176(atcc baa2151)。
[0118]
作为“耐药性细菌所引起的疾病”,可举出由耐药性细菌所引起的感染症。另外,也包含由该感染所引起,或与该感染有关的疾病。作为所述疾病,可举出例如,败血症、腹膜炎、脑膜炎、肠胃炎、肺炎等呼吸器官感染症、尿路感染症、手术部位感染症、软组织感染症、
医疗器材相关感染症(医疗器材相关血流感染症等)。
[0119]
本发明中所称“炎症诱导性细菌”,是指在肠道内诱导炎症的细菌,可举出例如,粘附侵袭性大肠杆菌(aiec)。更具体而言,可举出aiec lf82。
[0120]
作为“炎症诱导性细菌所引起的疾病”,可举出由该细菌所诱导的炎症所引起,或与该炎症有关的疾病。作为所述疾病,可举出例如,炎症性肠疾病(克罗恩病、溃疡性大肠炎、炎症性肠疾病等慢性炎症性肠疾病等)。
[0121]
本发明的药物组合物等或它们的有效成分等能以包含人的动物为对象而使用,作为人以外的动物,不特别限制,能以各种家畜、家禽、宠物、实验用动物等为对象。
[0122]
此外,作为本发明的肠内细菌等的摄取对象,可举出无论是否发生耐药性细菌等所引起的疾病,均保有耐药性细菌等的动物。另外,基于预防的观点,也可使未保有或可能未保有该细菌的动物摄取本发明的药物组合物等或它们的有效成分等。
[0123]
作为本发明的药物组合物等或它们的有效成分等的摄取方法,不特别限制,可为口服施与,又也可为非口服施与(例如对肠道内的施与),若为口服施与时,基于进一步提升本发明的药物组合物等或它们的有效成分等的效果的观点,本发明的药物组合物等或它们的有效成分等的摄取对象优选预先通过摄取质子泵抑制剂(ppi)等而使胃酸产生减少。
[0124]
另外,摄取本发明的药物组合物等或它们的有效成分等时,对于本领域技术人员来说,其摄取量可依据对象的年龄、体重、疾病的症状、健康状态、组合物的种类(药物品、饮食品等)、摄取方法等而适宜选择。
[0125]
以上,对于本发明的抗菌组合物及药物组合物,以及治疗方法等的优选实施方式进行了说明,但不限定于上述实施方式。
[0126]
如后述实施例所示,关于属th1细胞诱导性细菌的克雷伯氏菌属2h7株(kp2h7)的肠内定植抑制能力,已成功筛选出可发挥与取自健常人#f的肠内细菌37株同等程度的肠内定植抑制能力的18株。从而,本发明涉及抗菌组合物及药物组合物、以及治疗方法等,也可提供下述方案。
[0127]
<1>一种针对th1细胞诱导性细菌的抗菌组合物,含有肠内细菌作为有效成分,所述所述肠内细菌是具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0128]
<2>如<1>所述的抗菌组合物,是药物组合物。
[0129]
<3>如<1>或<2>所述的抗菌组合物,是用来治疗、改善或预防th1细胞所引起的疾病的药物组合物。
[0130]
<4>一种抑制对象中th1细胞的增殖或者活化的方法、抑制该对象中的免疫的方法、或治疗、改善或预防该对象中由th1细胞所引起的疾病的方法,其特征在于,使对象摄取如<1>~<3>中任一项所的抗菌组合物,或具有由序列编号:69、80、85~92、94、96、98~101、103及105中的任一者所记载的碱基序列或相对于该碱基序列有至少90%的同一性的碱基序列组成的dna的至少1种细菌。
[0131]
本发明的“th1细胞诱导性细菌”是通常存在于人的口腔内,但通过定植于肠道内,而诱导th1细胞的增殖或活化的细菌。优选为属于克雷伯氏菌属(klebsiella),更优选为属于肺炎克雷伯氏菌(klebsiella pneumoniae)或klebsiella aeromobilis,且在肠道内诱
导th1细胞的增殖或活化的细菌。另外,“th1细胞诱导性细菌”优选为容易在通过施与抗菌剂而与健常状态相比多样性发生了变化的肠内环境中定植的细菌。另外,也可为容易在因大肠炎等而与健常状态相比多样性发生了变化的肠内环境中定植的细菌。
[0132]
关于“th1细胞诱导性细菌”的实例,可参照专利文献1,典型上可举出属于克雷伯氏菌属(klebsiella)的kp2h7株、ka11e12株、34e1株、baa
‑
1705株、700603株、40b3株。这些当中,更优选为kp2h7株或ka11e12株,特别优选为kp2h7株。此外,关于这些细菌的细节,兹参照表6。
[0133][0134]
另外,作为本发明的“th1细胞诱导性细菌”,可举出含有由与编码kp2h7株、ka11e12株、34e1株、baa
‑
1705株、700603株或40b3株的16srrna的核苷酸序列具有90%以上(91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上)的同一性的核苷酸序列所构成的dna的细菌;另外,也可举出含有由与kp2h7株、ka11e12株、34e1株、baa
‑
1705株、700603株或40b3株的特异性核苷酸序列具有70%以上(优
选为80%以上,更优选为85%以上,进一步优选为90%以上,更优选为94%以上(例如,95%以上、96%以上、97%以上、98%以上、99%以上))的同源性或同一性的核苷酸序列所构成的dna的细菌。
[0135]
本发明中,“th1细胞”是cd4阳性的辅助性t细胞(th细胞)的亚群,是指使细胞免疫增强的细胞。另外,“th1细胞的活性”是包含通过该细胞的th1细胞因子(ifn
‑
γ等)的产生,通过该细胞因子的巨噬细胞、细胞毒性t细胞(ctl)等细胞的活化,通过该活化的细胞免疫的增强的含义。再者,“th1细胞的增殖或活化的诱导”是也包含达到th1细胞的增殖或活化的由初始t细胞向th1细胞的分化诱导的含义。
[0136]
对肠道内的th1细胞诱导增殖或活化的作用,可通过定量检测th1细胞特异性标记(例如cd4及ifn
‑
γ)来评价。该定量的检测可通过公知的手法来进行,可通过例如,流式细胞术、图像细胞术、elisa法、放射免疫测定、免疫组织化学染色法、免疫沉淀法、免疫印迹法、抗体阵列分析法等利用抗体来进行检测的方法(免疫学手法)来进行。
[0137]
关于任意的菌等是否具有诱导肠道内的th1细胞的增殖或活化的作用,例如,当通过流式细胞术所检测出的肠道内的cd4
tcrβ
t细胞中的ifn
‑
γ
细胞的比例为10%以上时,可判定为所述菌等具有诱导肠道内的th1细胞的增殖或活化的作用(优选为25%以上时,判定为所述菌等具有诱导肠道内的th1细胞的增殖或活化的作用;更优选为30%以上时,判定为所述菌、物质等具有诱导肠道内的th1细胞的增殖或活化的作用)。
[0138]
本发明中所称“th1细胞所引起的疾病”,是指由th1细胞的增殖或活化所诱发的疾病,可举出炎症性肠疾病(克罗恩病、溃疡性大肠炎、炎症性肠疾病这样的慢性炎症性肠疾病等)、1型糖尿病、类风湿性关节炎、实验性自身免疫性脑炎(eae)、多发性硬化症、系统性红斑狼疮等自身免疫性疾病、慢性炎症性疾病。另外,本发明中被抑制的“免疫”不仅包含黏膜免疫(肠道免疫等),也包含全身免疫。而且,不仅包含细胞免疫,也包含体液免疫。
[0139]
另外,将本发明的抗菌组合物作为药物组合物使用时,也可进一步包含用于th1细胞所引起的疾病的治疗、预防或改善的公知的物质(例如抗炎症剂、免疫抑制剂),还可与所述物质联合使用。
[0140]
此外,关于上述<1>~<4>中的其他语句,请适当参照上述的<抗菌组合物及药物组合物>及<治疗方法等>。
[0141]
<耐药性细菌等所引起的疾病的检查用组合物>
[0142]
本发明中,已阐明可抑制耐药性细菌等定植于肠道等的肠内细菌的存在。因此,通过检测该肠内细菌的存在,可检查耐药性细菌等所引起的疾病。
[0143]
因此,本发明是提供以下的用于检查耐药性细菌等所引起的疾病的组合物。
[0144]
用于检查耐药性细菌等所引起的疾病的组合物,包含特异性地识别本发明的肠内细菌等的抗体。
[0145]
用于检查耐药性细菌等所引起的疾病的组合物,包含用于检测本发明的耐药性细菌等的特异性核苷酸序列的多核苷酸。
[0146]
本发明中,“特异性地识别本发明的肠内细菌等的抗体”,只要能够特异性地识别该细菌,则可为多克隆抗体,也可为单克隆抗体,还可为抗体的功能性片段(例如,fab、fab’、f(ab’)2、可变区片段(fv)、二硫键fv、单链fv(scfv)、sc(fv)2、双特异性抗体、多特异性抗体或它们的聚合物)。本发明的抗体若为多克隆抗体,则可用抗原(源自本发明的肠内
细菌等的多肽、多核苷酸、糖链、脂质等)使免疫动物免疫,并由其抗血清,通过现有手段(例如,盐析、离心分离、透析、层析等)进行纯化而获得。另外,单克隆抗体可通过杂交瘤法或重组dna法来制作。
[0147]
另外,作为本发明的检查所使用的抗体,可使用结合有标记物的抗体。通过检测该标记物,可直接测定结合于本发明的肠内细菌等或源自该细菌的物质的抗体量。作为标记物,只要是可结合于抗体、且可于化学或光学方法中检测出来的就不特别限制,可举出例如,荧光色素(gfp等)、酶(hrp等)、放射性物质。
[0148]
本发明的检查用组合物中,除抗体成分外,也可包含作为组合物可容许的其他成分。作为这样的其他成分,可举出例如,载体、赋形剂、崩解剂、缓冲剂、乳化剂、悬浮剂、稳定剂、保存剂、防腐剂、生理食盐、标记物、二抗。另外,除上述检查用组合物外,也可组合标记物的检测所需的底物、用于阳性对照、阴性对照或者试样的稀释或洗涤的缓冲液、用于试样与本发明的抗体的反应的管或板等,也可制成耐药性细菌等所引起的疾病的检查用试剂盒。另外,以未标记的抗体作为抗体标准品时,可组合将结合于该抗体的物质(例如二抗、蛋白g、蛋白a等)标记化而得的物质。再者,所述耐药性细菌等所引起的疾病的检查用试剂盒中可包含该试剂盒的使用说明书。
[0149]
进而,本发明的检查用组合物也可组合用于检测本发明的抗体的装置。作为所述装置,可举出例如,流式细胞仪、酶标仪。
[0150]
本发明中,作为“用于检测本发明的肠内细菌等的特异性核苷酸序列的多核苷酸”,只要能检测该细菌的特异性序列就不特别限制,可举出例如,具有至少15个核苷酸的链长的作为下述(a)~(b)所记载的任一项的多核苷酸。
[0151]
(a)作为以夹入所述特异性核苷酸序列的方式设计的一对引物的多核苷酸
[0152]
(b)作为与包含所述特异性核苷酸序列的核苷酸序列杂交的引物或探针的多核苷酸。
[0153]
本发明的多核苷酸具有与本发明的肠内细菌等的核苷酸序列互补的碱基序列。此处所称“互补”,只要可进行杂交,也可以不完全地互补。这些多核苷酸相对于所述核苷酸序列,通常具有80%以上、优选为90%以上、更优选为95%以上、特别优选为100%的同源性。
[0154]
作为本发明的多核苷酸的“链长”,在作为引物使用时,通常为15~100个核苷酸,优选为17~30个核苷酸,更优选为20~25个核苷酸。另外,在作为探针使用时,则通常为15~1000个核苷酸,优选为20~100个核苷酸。
[0155]
本发明的多核苷酸可为dna也可为rna,还可于其一部分或全部中通过lna(注册商标、交联化核酸)、ena(注册商标、2
’‑
o,4
’‑
c
‑
ethylene
‑
bridged nucleic acids)、gna(甘油核酸)、tna(苏糖核酸)、pna(肽核酸)等人工核酸来置换核苷酸。
[0156]
此外,本发明的多核苷酸可利用市售的核苷酸自动合成仪等以化学方式来合成。另外,作为用于本发明的检查的多核苷酸,可使用结合有标记物的多核苷酸。作为标记物,只要是可结合于多核苷酸、且能以化学或光学方法检测出来的就不特限制,例如,荧光色素(deac、fitc、r6g、texred、cy5等),荧光色素以外尚可举出dab等色素(色原,chromogen)、酶、放射性物质。
[0157]
本发明的检查用组合物中,除所述的多核苷酸外,也可包含药理学上可容许的其他成分。作为这样的其他成分,可举出例如,缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理
食盐等。
[0158]
另外,除上述检查用组合物外,也可组合附加于多核苷酸的标记物的检测所需的底物、阳性对照、阴性对照、或者用于试样的稀释或洗涤的缓冲液等标准品,或组合用于试样与本发明的多核苷酸的反应的管或板等,也可制成耐药性细菌等所引起的疾病的检查用试剂盒。再者,所述耐药性细菌等所引起的疾病的检查用试剂盒中可包含该试剂盒的使用说明书。
[0159]
另外,本发明的检查用组合物也可组合用于检测本发明的肠内细菌等的特异性核苷酸序列的装置。作为所述装置,可举出例如,热循环仪、测序仪、微阵列。
[0160]
再者,本发明中也提供耐药性细菌等所引起的疾病的检查方法,其中,使用所述的抗体、多核苷酸、或检查用组合物。即,
[0161]
本发明是提供耐药性细菌等所引起的疾病的检查方法,包括:使所述抗体、多核苷酸或检查用组合物与由受检体分离出的试样接触的工序;及通过该接触,来检测在肠道内存在或不存在本发明的肠内细菌等的工序。
[0162]
作为受检体不特别限制,可举出疑似罹患耐药性细菌等所引起的疾病的人等动物。另外,作为由所述受检体分离出的试样,也不特别限制,受检体的粪便试样、其培养物、或由这些所提取出来的多肽、多核苷酸、糖链、脂质等适合在本发明的方法中使用。
[0163]
作为通过使本发明的抗体或包含该抗体的检查用组合物与所述试样接触,来检测存在或不存在本发明的肠内细菌等的方法,可举出例如,elisa法、免疫印迹法、抗体阵列分析法、免疫组织化学染色法、流式细胞术、图像细胞术、放射免疫测定、免疫沉淀法等利用抗体来进行检测的方法(免疫学手法)。
[0164]
另外,作为通过使本发明的多核苷酸或包含该多核苷酸的检查用组合物与所述试样接触,来检测本发明的肠内细菌等的存在或不存在的方法,可使用例如,pcr(rt
‑
pcr、实时pcr、定量pcr)、dna微阵列分析法、rna印迹、16srrna测序、新一代测序法(合成测序法(sequencing
‑
by
‑
synthesis,例如通过illumina公司制solexa基因组分析仪或hiseq(注册商标)2000的测序)、焦磷酸测序法(例如,通过roche diagnostics(454)公司制测序仪gslx或flx的测序(所谓454测序))、连接酶反应测序法(例如,通过life technology公司制solid(注册商标)或5500xl的测序)、珠阵列(beads array)法、原位杂交法、斑点印迹法、rnase保护检测法、质谱法、基因组pcr法、dna印迹法。
[0165]
本发明中所称耐药性细菌等所引起的疾病的“检查”,不仅包含检查有无发生该疾病,也包含检查其发病风险;只要通过所述方法,在肠道内检测出本发明的肠内细菌等的存在,则可判定为耐药性细菌等所引起的疾病未发生或其发病风险较低。
[0166]
受检体中由耐药性细菌等所引起的疾病的诊断通常是由医师(也包含受医师指示者)来进行;根据本发明的方法所得的数据有助于医师的诊断。从而,本发明的方法也可表现为收集有助于医师的诊断的数据,并予以出示的方法。
[0167]
另外,本发明中,也可提供利用所述的检查方法的伴随诊断法及其药剂。即,本发明是提供以下方案。
[0168]
判定本发明的药物组合物等或它们的有效成分等在耐药性细菌等所引起的疾病的治疗、改善或预防中的有效性的方法,该方法包括:使所述抗体、多核苷酸或检查用组合物与由受检体分离出的试样接触的工序;通过该接触,来检测存在或不存在所述肠内细菌
等的工序;在所述工序中未检测出该细菌存在时,判定为所述受检体中的本发明的药物组合物等或它们的有效成分等在所述疾病的治疗、改善或预防中的有效性较高。
[0169]
治疗、改善或预防耐药性细菌等所引起的疾病的方法,该方法包括:使通过所述判定方法判定为本发明的药物组合物等或它们的有效成分等的有效性较高的患者,摄取该药物组合物等或它们的有效成分等的工序。
[0170]
包含本发明的肠内细菌等作为有效成分的用来治疗、改善或预防耐药性细菌等所引起的疾病的组合物,该组合物被通过所述判定方法判定为有效性较高的受检体所摄取。
[0171]
<筛选在肠道内针对耐药性细菌等具有抗菌活性的肠内细菌的方法>
[0172]
由本发明者们首次阐明,在肠内细菌中存在在肠道内抑制耐药性细菌等的定植等的细菌。因此,本发明是提供筛选针对耐药性细菌等具有抗菌活性的肠内细菌的方法,包括以下工序。
[0173]
使非人无菌动物摄取肠道内的耐药性细菌等与受试肠内细菌的工序;
[0174]
在该非人无菌动物的肠道内检测所述耐药性细菌等的工序;
[0175]
在所述工序中检测出的细菌数与未使其摄取所述受试肠内细菌的情形相比减少时,将该受试肠内细菌判定为针对耐药性细菌等具有抗菌活性的肠内细菌的工序。
[0176]
关于“耐药性细菌等”如上所述。“非人无菌动物”是指在无菌条件下出生及生长的人以外的动物。作为人以外的动物,可举出例如,小鼠、大鼠、猴、猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、狗、猫、兔、仓鼠等,但不限制于这些。另外,这些动物中,优选利用小鼠。
[0177]
作为使非人无菌动物摄取的受试肠内细菌,只要是存在于动物的肠内的细菌即可,作为所述动物,可举出人、非人动物(小鼠、大鼠、猴、猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、狗、猫、兔、仓鼠等)。另外,使非人无菌动物摄取的受试肠内细菌也可为经分离的肠内细菌,但也可举出包含肠内细菌的试样(例如,所述动物的粪便试样、或其培养物)。
[0178]
此外,作为使非人动物“摄取”受试肠内细菌及耐药性细菌等的方法不特别限制,一般是通过口服施与来进行,也可为非口服施与(例如对肠道内的施与)。另外,受试肠内细菌与耐药性细菌等的摄取可为同时,也可使非人动物摄取受试肠内细菌后再使该动物摄取所述耐药性细菌等,也可使非人动物摄取所述耐药性细菌等后再使该动物摄取受试肠内细菌。
[0179]
肠道内的耐药性细菌等的“检测”,可通过检测该耐药性细菌等的特异性核苷酸序列来进行。作为所述检测方法,可举出例如,pcr(rt
‑
pcr、实时pcr、定量pcr)、dna微阵列分析法、rna印迹法、16srrna测序、新一代测序法(合成测序法(sequencing
‑
by
‑
synthesis,例如通过illumina公司制solexa基因组分析仪或hiseq(注册商标)2000的测序)、焦磷酸测序法(例如通过roche diagnostics(454)公司制测序仪gslx或flx的测序(所谓454测序))、连接酶反应测序法(例如通过life technology公司制solid(注册商标)或5500xl的测序)、珠阵列(beads array)法、原位杂交法、斑点印迹法、rnase保护检测法、质谱法、基因组pcr法、dna印迹法。
[0180]
另外,肠道内的耐药性细菌等的“检测”,例如可通过检测该耐药性细菌等的特异性氨基酸序列来进行。作为所述检测方法,可举出elisa法、免疫印迹法、抗体阵列分析法、免疫组织化学染色法、流式细胞术、图像细胞术、放射免疫测定法、免疫沉淀法等利用抗体来进行检测的方法(免疫学手法)。作为检测的时间点,不特别限制,只要为本领域技术人
员,就能依据所用动物的种类等来适宜调整。
[0181]
此外,本发明的筛选方法中,通过实施1次而无法筛选出针对耐药性细菌等具有抗菌活性的肠内细菌时,可通过将所得的包含该细菌的肠道内试样作为下一次的受试肠内细菌,使新的非人无菌动物摄取并进行所述筛选多次,即可分离出具有所述抗菌活性的肠内细菌。
[0182]
实施例
[0183]
(实施例1)
[0184]
如图1的上部所示,对无菌小鼠施与克雷伯氏菌属2h7株(kp2h7),于1周后施与健常志愿者的粪便样品。
[0185]
具体而言,关于无菌小鼠,将c57bl/6n(日本clea株式会社)的4~8周龄的在饲养用塑料隔离器(无菌隔离器)(icm株式会社制;icm
‑
1b)内,以自由饮水喂食条件饲养1周以上,使其经过环境驯化后使用。实验开始时的周龄为8~14周龄。本说明书中的其他实施例也同样。
[0186]
将克雷伯氏菌属的菌液置入lb液体培养基中以37℃培养一夜,将od值调整为1.2(相当于1*10^9cfu/ml),并使用探棒将200μl/只(相当于2*10^8cfu/只)的菌液施与至小鼠的胃内。
[0187]
关于粪便样品,将由日本人健常志愿者(#a、#f、#i、#j、#k)所提供的粪便以甘油pbs溶液(甘油的终浓度:20体积%)稀释成5倍重量,以直径100μm过滤器过滤后调成储备液于
‑
80℃保存。粪便施与时在厌氧室内将储备液以pbs稀释10倍,各以200μl/只使用探棒施与至小鼠的胃内。
[0188]
将小鼠的粪便样品以50mg粪便/ml的比例溶解于在pbs中混有甘油(终浓度20%)及edta(终浓度10mm)的溶液中。将粪便溶解液在进行适当的稀释后接种于掺有50mg/l氨苄青霉素及50mg/l壮观霉素的dhl培养基中,以37℃培养一夜后计数菌落数,算出每1g粪便的cfu数。
[0189]
本说明书中的其他实施例中,克雷伯氏菌属的菌液及粪便的施与也以同样的方法进行,且cfu也以同样的方法来计数。
[0190]
其结果如图1的下部(曲线图)所示,虽使用了5种粪便,但任一种样品中皆可看出kp2h7菌量明显降低。
[0191]
(实施例2)菌从健常志愿者粪便的分离
[0192]
将实施例1中所制备的源于取自健常人f、k及i的粪便(f便、k便及i便)的各冷冻粪便样品在常温下融解后,以pbs稀释,在eg培养基、改方gam琼脂培养基(日水制药株式会社;05426)、reinforced clostridial agar(rcm agar)(thermo fisher scientific inc;cm0151)或schaedler血液培养基(wako公司制;517
‑
45805)的各琼脂平皿中,于37℃、10%co2厌氧环境下进行培养,并分离出形成的菌落。由f便中分离出37株,由i便中分离出42株,由k便中分离出47株。其后对于k便再度进行分离,最终由k便中分离出68株。
[0193]
分离菌是通过采用桑格法的16srdna分析,来进行基因序列的分析及菌的推定。测序分析使用thermo fisher scientific公司制3130dna analyzer及以下序列的引物集来进行。
[0194]
27forward
‑
mod:5
’‑
agrgtttgatymtggctcag
‑3’
(序列编号:148)
[0195]
1492reverse:5
’‑
ggytaccttgttacgactt
‑3’
(序列编号:149)
[0196]
其中,r:a或g;y:c或t;m:a或c。
[0197]
进而,针对源于f便的37菌株,使用新一代测序仪来确定基因组序列。即,使用illumina公司制miseq及pacific biosciences公司制sequel,分别进行基因组测序,并通过使用unicycler的混杂组合装置(hybrid assembly)分分别获得全基因组序列。对此各基因组序列,使用rnammer提取16srrna序列,由此获得在以所述桑格法确定的16s rdna序列中无法确定的包含两末端序列的更高准确度的序列。
[0198]
将如此进行分析的结果示于表1~4。另外,将对取自捐赠者f、i、k的3种粪便进行16s元分析(meta
‑
analysis)的结果示于图2。
[0199]
(实施例3)
[0200]
如图3的上部所示,对无菌小鼠施与kp2h7,于1周后施与混合的分离菌(源于f便的37株(f37mix)、源于i便的42株(i42mix)、源于k便的47株(k47mix))或i便。
[0201]
分离菌使用mgam液体培养基、eg培养基或cm0149培养基,于37℃下在厌氧室内培养24~48小时并混合。将混合液浓缩5倍,使用探棒将200μl/只(总菌量相当于1*10^9cfu/只)的菌液施与至胃内。以下实施例中的混合分离菌株的施与也以同样的方法进行。
[0202]
其结果如图3的下部(曲线图)所示,表明源于f便的37株是与克雷伯氏菌属从小鼠肠道内的排除能力有关,且具有与i便同等的活性。
[0203]
(实施例4)
[0204]
如图4的上部所示,对无菌小鼠施与kp2h7,于1周后施与混合的分离菌(源于f便的37株、源于k便的68株)。其结果如图4的下部(曲线图)所示,源于f便的37株与源于k便的68株同等地将克雷伯氏菌属由小鼠的肠道内排除。
[0205]
(实施例5)
[0206]
如图5的上部所示,对无菌小鼠施与kp2h7,于1周后施与混合的分离菌(f37mix),自分离菌施与后饮水施与氨苄青霉素200mg/l。为了探讨施与的各菌的菌量变化,而使用各菌的特异性引物进行pcr。将用于分析的引物示于表7。
[0207]
表7
[0208][0209]
其结果如图5的下部所示,通过施与氨苄青霉素,克雷伯氏菌属的菌量暂时性上升,但其后再度减少。
[0210]
另外,针对总菌量中的各分离菌的存在比率,与kp2h7的存在比率共同分析其经时变化。将所得结果示于图6a~6h。进而,算出克雷伯氏菌属的菌量与各菌的斯皮尔曼等级相关系数,按照正的相关性由高至低依序排列。将所得结果示于图7。
[0211]
如图7所示,判明属于拟杆菌门(bacteroidetes)的株与克雷伯氏菌属的动态无关
地变化。另一方面,成负相关的株多属于furmicutes属。
[0212]
(实施例6)
[0213]
如图9所示,将源于f便的37株分成属于拟杆菌门(bacteroidetes)的8株(f8mix)与此外的29菌株(f29mix)并分别混合,使kp2h7定植于无菌小鼠后,施与混合的分离菌。此外,图9、10及12所示系统树是将分离菌的采用桑格法的16srdna分析结果的dna碱基序列,使用mega x,通过邻接(neighbor
‑
joining)法制成的。
[0214]
其结果如图8所示,f37mix与f29mix同等地将克雷伯氏菌属从小鼠的肠道内排除。另一方面,在属于拟杆菌门(bacteroidetes)的f8mix施与组中,克雷伯氏菌属的菌量不变,启示f8mix与克雷伯氏菌属的排除无关。
[0215]
(实施例7)
[0216]
从37株中排除属于拟杆菌门(bacteroidetes)的株、在16srdna水平上重复的株、因施与氨苄青霉素而消失的株、显示与克雷伯氏菌属无关的行为的株,选出18株(参照图10)。
[0217]
然后,如图11的上部所示,对无菌小鼠施与kp2h7株,于1周后施与混合的分离菌(源于f便的37株(f37mix)、18株(f18mix)、源于i便的42株(i42mix))。
[0218]
其结果如图11的下部(曲线图)所示,表明图10所示18株也与37株同等地可发挥克雷伯氏菌属株排除能力。
[0219]
(实施例8)
[0220]
基于系统树将图10所示18株分成4组(blautia、lachonoclostridum、other firmicutes、other phyla)(参照图12)。进而,将此4组由18菌株(f18mix)中抽出而制作f15mix(f18mix
‑
other phyla)、f12mix(f18mix
‑
lachnoclostiridum)、f14mix(f18mix
‑
blautia)、f13mix(f18mix
‑
other firmicutes)的菌株组。另外,也制作将由37株中排除重复的株,并由该31株中进一步排除所述18株而得的13株(f13mix(f31
‑
18mix))混合而成的菌株组。然后,如图13的上部所示,对无菌小鼠施与kp2h7,于1周后施与如上所述混合的各分离菌。
[0221]
其结果如图13的下部(曲线图)所示,f18mix最好地排除克雷伯氏菌属。然而,自其中排除任何一组,克雷伯氏菌属的菌量均显著地变多。另外,如图14所示,就图13所示实验中的第28天的时间点的各施与组的便中克雷伯氏菌属的cfu而言,f18mix比起f37mix以外的其他组,均可统计学上显著地减少克雷伯氏菌属。
[0222]
由以上启示,图10所示的4组均与克雷伯氏菌属的排除有关,作为菌群而进行克雷伯氏菌属的排除。
[0223]
另外,在图13所示的实验中,由f37mix、f18mix、f31
‑
18mix的组的小鼠提取大肠黏膜固有层的淋巴细胞,提供给利用流式细胞术的分析。
[0224]
其结果如图15所示,cd4 ifnγ 细胞的比例在f13mix(f31
‑
18mix)组中较高,表明f37mix、f18mix抑制th1细胞的诱导。
[0225]
(实施例9)
[0226]
如实施例8所示,在由f18mix排除各组的菌的实验中,排除了otherphyla的3株的f15mix在克雷伯氏菌属排除能力方面最低。因此,着眼于此组,制作由源于f便的18株中将此3株(e.coli、bifidobacterium、fusobacterium)逐一排除而得的组。然后,如图16的上部
所示,对无菌小鼠施与kp2h7株,于1周后施与如所述混合的分离菌、f18mix或f15mix。
[0227]
其结果如图16的下部(曲线图)所示,通过排除所述3株的任一者,可看出克雷伯氏菌属菌量增加1log左右,启示任一株均与克雷伯氏菌属的排除有关。
[0228]
(实施例10)
[0229]
为了探索f37mix排除克雷伯氏菌属的机制,而着眼于宿主的免疫是否与本机制有关。因此,如图17的上部所示,对无菌的rag2
‑
/
‑
γc
‑
/
‑
小鼠、myd88
‑
/
‑
triff
‑
/
‑
小鼠或野生型小鼠施与克雷伯氏菌属2h7株,于1周后施与混合的f37mix。
[0230]
其结果如图17的下部(曲线图)所示,在任一类型的小鼠中,均可看出通过f37mix的同等程度的克雷伯氏菌属2h7株的排除。由此启示,宿主的主要天然免疫、获得性免疫是与克雷伯氏菌属的排除无关。
[0231]
其次,评价分离的菌株对kp2h7株以外的病原菌、耐药性菌的排除效果。此外,分析中作为各菌的特异性引物,使用表8所示的引物。
[0232]
表8
[0233][0234]
(实施例11)
[0235]
首先,如图18的上部所示,对无菌小鼠施与碳青霉烯类耐性克雷伯氏菌属(cre),于1周后施与混合的f37mix、k68mix或i42mix。将所得结果示于图18的下部。
[0236]
此外,将cre的菌液置入lb液体培养基中于37℃培养一夜,将od值调整成1.2(相当于1*10^9cfu/ml),并使用探棒将200μl/只(相当于2*10^8cfu/只)的菌液施与至小鼠的胃内。cre的cfu的计数使用含氨苄青霉素30mg/l、壮观霉素30mg/l的dhl培养基作为选择培养基,于37℃需氧条件下培养一夜。
[0237]
另外,对施与混合的分离菌后1个月的小鼠进行解剖,将大肠以4%pfa固定并用石
蜡包埋后,制成薄切切片。将此切片以苏木精液及伊红液染色,观察组织的炎症影像。将所得结果示于图19。
[0238]
如图18的下部(曲线图)所示,结果是f37mix及k68mix显示同等的cre排除能力,i42mix为较它们略差。另外,如图19所示,在任一小鼠中,均未看出溃疡形成、炎症细胞的浸润等炎症迹象。由此表明,通过施与所述各分离菌混合组,可抑制大肠中的炎症诱导。
[0239]
(实施例12)
[0240]
如图20的上部所示,对无菌小鼠施与万古霉素耐性屎肠球菌(enterococcus faecium)(vre),于1周后施与混合的f37mix、k68mix或i42mix。
[0241]
此外,将vre的菌液置入lb液体培养基中于37℃培养一夜而调整成od值1.2(相当于1*10^9cfu/ml),并使用探棒将200μl/只(相当于2*10^8cfu/只)的菌液施与至小鼠的胃内。vre的cfu计数使用vre培养基(日本becton),于37℃需氧条件下培养一夜。
[0242]
其结果如图20的下部(曲线图)所示,对vre,k68mix发挥最高的排除能力。另外,如图21所示,在任一小鼠中,均未看出溃疡形成、炎症细胞的浸润等炎症迹象。由此表明,通过施与所述各分离菌混合组,可抑制大肠中的炎症诱导。
[0243]
(实施例13)
[0244]
如图22的上部所示,对无菌小鼠施与粘附侵袭性大肠杆菌(adhesion
‑
invasive e.coli)(aiec lf82),于1周后施与混合的f37mix、k68mix、i42mix。
[0245]
此外,将aiec lf82的菌液置入lb液体培养基中于37℃培养一夜而调整成od 1.2(相当于1*10^9cfu/ml),并使用探棒将200μl/只(相当于2*10^8cfu/只)的菌液施与至小鼠的胃内。aiec lf82的cfu的计数使用含1mg/l头孢噻肟的麦康凯培养基作为选择培养基,于37℃需氧条件下培养一夜而算出cfu。
[0246]
其结果如图22的下部(曲线图)所示,f37mix对aiec lf82的排除能力最高。
[0247]
(实施例14)
[0248]
如图23的上部所示,对无菌小鼠施与产生esbl的克雷伯氏菌属(kp
‑
esbl)(atcc 700721),于1周后施与混合的f37mix、k68mix、i42mix或f便。
[0249]
此外,将kp
‑
esbl的菌液置入lb液体培养基中于37℃培养一夜而调整成od 1.2(相当于1*10^9cfu/ml),并使用探棒将200μl/只(相当于2*10^8cfu/只)的菌液施与至小鼠的胃内。kp
‑
esbl的cfu的计数使用含氨苄青霉素30mg/l、壮观霉素30mg/l的dhl培养基作为选择培养基,于37℃需氧条件下培养一夜而算出。
[0250]
其结果如图23的下部(曲线图)所示,f37mix及k68mix显示与f便同等的kp
‑
esbl排除能力。
[0251]
(实施例15)
[0252]
如图24及25的上部所示,对无菌小鼠施与空肠弯曲杆菌(campylobacter jejuni)81
‑
176(atcc baa2151),于1周后施与混合的f37mix、k68mix、i42mix或f便。
[0253]
将空肠弯曲杆菌(campylobacter jejuni)的菌液置入ts液体培养基中,与微需氧性anaeropack(安宁包)共同置入厌氧瓶中于42℃下培养48小时,并使用探棒将其菌液施与至小鼠的胃内。
[0254]
对于空肠弯曲杆菌(campylobacter jejuni),为了显示其菌量,使用cfu及qpcr。
[0255]
cfu计数使用chromagar campylobacter,与anaeropack(安宁包)共同置入厌氧瓶
中于42℃下培养48小时。将所得结果示于图24。
[0256]
qpcr测定按照以下步骤进行。
[0257]
使用lightcycler(注册商标)480ii(roche;05015243001)及thunderbird(注册商标)sybr(注册商标)qpcr mix(toyobo;qps
‑
201x5),以空肠弯曲杆菌(campylobacter jejuni)基因组特异性的引物及通用细菌引物进行扩增定量,将算出的dna浓度比率作为空肠弯曲杆菌(campylobacter jejuni)的存在比率。将所得结果示于图25。
[0258]
此外,作为qpcr的空肠弯曲杆菌(campylobacter jejuni)基因组特异性的引物,使用序列编号:220及221所记载的引物集;作为通用细菌引物,使用序列编号:222及223所记载的引物集。
[0259]
另外,菌基因组的提取通过以下工序进行。
[0260]
对小鼠粪便10mg添加5倍重量的含有edta及甘油的pbs溶液(edta的终浓度:10mm、甘油的终浓度:20体积%),剧烈振荡搅拌而进行破碎悬浮。对样品液100μl添加溶有15mg溶菌酶(sigma
‑
aldrich公司制,lysozyme from chicken egg white;l4919)及5μl rnase(thermo fisher scientific公司制,purelink rnase a(20mg/ml);12091
‑
021)的10mm tris/10mm edta缓冲液(ph8.0,以下也称“te10”)800μl,于37℃振荡1小时。接着,添加achromopeptidase(注册商标)(wako;015
‑
09951)2,000u,于37℃振荡30分钟而使菌溶解。然后,添加20%sds te10溶液50μl与溶有终浓度为20mg/ml的蛋白酶k(roche,proteinase k,recombinant,pcr grade;03115852001)的te10溶液50μl,于55℃振荡60分钟。接着,由400μl的溶液使用maxwell(注册商标)rsc cultured cells dna kit(promega公司)而得到dna。
[0261]
如图24及25所示,对空肠弯曲杆菌(campylobacter jejuni),任一种混合的菌均具有与f便同等良好的菌排除能力。
[0262]
(实施例16)
[0263]
如图26的上部所示,对无菌小鼠施与clostridum difficile(st.630),于1周后施与混合的f37mix、k68mix、i42mix、k47mix或f便。此外,k47mix是由取自#k的粪便试样分离出来的47株,除1种菌株外,与所述68菌株重复(表1及2所记载的k1~k46)。
[0264]
将c.difficle的菌液芽孢(spore)化,调整成1x10^5个细胞左右并使用探棒施与至小鼠的胃内。芽孢化以clospore培养基培养8日,并于37℃厌氧室内培养,将培养基以pbs清洗(wash)后进行超音波处理并添加lysoizyme(溶菌酶)及trypsin(胰蛋白酶),以45℃、6小时,其后以70℃、10分钟实施处理而制作。
[0265]
关于c.difficle,为了定量其菌量,使用qpcr。qpcr的引物使用序列编号:224及225所记载的引物集。
[0266]
其结果如图26的下部所示,对c.difficile,k68mix及k47mix中均可看出高排除能力。
[0267]
产业可利用性
[0268]
如以上所说明,根据本发明,通过抑制耐药性细菌及炎症诱导性细菌向肠道的定植等,可治疗、改善或预防这些细菌所引起的疾病。因此,本发明对于与耐药性细菌或炎症诱导性细菌所引起之感染症等有关的药品的开发、治疗、改善及预防等极为有用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。