1.本发明属于生物领域,涉及一种微流控装置及其制备方法和应用。
背景技术:
2.临床前和临床实验结果表明,肿瘤的发生与发展常伴随着异常凝血症状的产生。患有深静脉血栓并发症的癌症患者的死亡率要高于非血栓病并发的癌症患者。据统计,除了肿瘤的发生发展,血栓疾病是癌症患者第二大致死原因。因此,根据凝血功能检测结果,为癌症治疗过程提供合理有效和及时的抗凝血辅助治疗指导,对于延长患者生存期以及减轻患者病痛负担显得尤为重要。经过近几十年的研究,种类多样的检测技术和装置涌现出来,以血液凝固和血小板行为等指标为出发点,推出了凝血测试,血栓弹力图分析和粘附性测试等一系列成熟的方法学。尽管上述检测方法在科学研究与临床诊断上得到了较大程度的推广,检测限过高以及检测指标较多等问题却一直没有十分有效的解决方法,传统方法的检测灵敏性和可行性因而受到了不同程度的制约。加之传统凝血检测的样本需求量相对较大,与减轻病人痛苦的低样本需求检测宗旨背道而驰。
3.在过去的几十年里,随着微加工技术的进步,以相对较低的成本进行大批量易于复制的微流控设备为现代生物医学的检测和分析带来了新的希望。已经有相关技术手段从血栓形成风险、血小板功能和止血功能等方面入手,进行了有效的微流控装置设计和制造,且设计思路集中于利用微流控流道与病理性血管尺寸的相似性,尝试模拟血管栓塞的过程,从而达到检测的目的。然而生理环境的复杂性仍然是这种设计思路在推行过程中的障碍。另一方面,血小板在栓块收缩过程中所输出的机械力引起了研究者的关注,并被证明可以作为评估血栓风险的新型指标。
4.因为,提供一种集成度高、检测准确以及检测灵敏度高的检测装置非常有必要。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种微流控装置及其制备方法和应用,本发明的微流控装置将微流控技术与生物技术相结合,在微流控芯片的微流道中引入血小板捕获网络,血小板捕获网络中的纤维蛋白原能够捕获血小板中的受体gpiibiiia,能够检测血液中的凝血状态,此外血小板捕获网络是填充在微流道中的,能够增加血小板在流道中的捕获强度,增加了检测的准确度以及灵敏度,从而为肿瘤抗凝血辅助治疗方案提供重要的依据。
6.本发明的目的之一在于提供一种微流控装置,微流控装置包括微流控芯片以及血小板捕获网络,所述微流控芯片包括基体以及设置在基体一侧表面的微流道,所述血小板捕获网络填充在所述微流道中。
7.本发明的微流控装置将微流控技术与生物技术相结合,在微流控芯片的微流道中引入血小板捕获网络,血小板捕获网络中的纤维蛋白原能够捕获血小板中的受体gpiibiiia,能够检测血液中的凝血状态,此外血小板捕获网络是填充在微流道中的,能够
增加血小板在流道中的捕获强度,增加了检测的准确度以及灵敏度,从而为肿瘤抗凝血辅助治疗方案提供重要的依据。
8.在本发明中用微流控芯片可以直接通过市面购买得到,也可以自行制备。
9.在本发明中,优选血小板捕获网络部分填充在微流道中,能够捕获活化状态的血小板,其中针对不同的血液样品,血小板捕获的数目不同,整体位置也不同,根据数目和位置对血液样品的凝态进行评估。
10.在本发明中,所述基体的材质为聚二甲基硅氧烷。
11.在本发明中,所述微流道是通过将基体刻蚀得到的,本发明对微流道的形状不做具体限定,本领域技术人员可根据实际需要进行选择与调整。
12.本发明中,所述微流控装置还包括玻璃基板,所述玻璃基板与设置有微流道一侧的基体表面相连接。
13.在本发明中,所述血小板捕获网络的孔径为3-5μm,例如3μm、3.2μm、3.5μm、3.7μm、4μm、4.2μm、4.5μm、4.7μm、5μm等;若血小板捕获网络的孔径过大,则导致网络捕获能力过低,无法截获具有统计意数目的血小板;若血小板捕获网络的孔径过小,则会导致过多血小板在流道起始位置大量聚集,发生堵塞,影响测试。
14.在本发明中,所述血小板捕获网络是部分填充在微流道中的,所述填充的部分的体积为微流道总体积的30-60%,例如30%、35%、40%、45%、50%、55%、60%等。
15.在本发明中,所述血小板捕获网络为纤维蛋白原和凝血酶组成的血小板捕获网络。
16.在检测之前对血小板采用mask
tm
orange进行荧光染色,当待测血小板进入微流道中时,活化状态的血小板通过受体gpiibiiia与微流控流道内纤维蛋白网络更易结合,活化状态弱的血小板与纤维蛋白网络不易结合,具有统计意义数量不同活化状态的血小板在流道中呈现出不同的截留位置,通过统计血小板在流道中的截留位置和截留数目的不同,而实现对不同血样血液高凝态风险的检测。
17.本发明的目的之二在于提供一种如目的之一所述的微流控装置的制备方法,所述微流控装置的制备方法包括:在凝固时间内,将预混剂注入微流控芯片的微流道中,得到所述微流控装置。
18.本发明中微流控装置的检测方法简单,原料易得,价格低廉,易于实现,便于工业大规模生产应用。
19.在本发明中,所述预混剂为纤维蛋白原溶液和凝血酶溶液的混合物。
20.在本发明中,所述预混剂的制备方法包括:将纤维蛋白原溶液和凝血酶溶液搅拌混合1-5s(例如1s、2s、3s、4s、5s),得到所述预混剂。
21.在本发明中,所述搅拌混合是在冰浴中进行的。
22.在本发明中,所述纤维蛋白原溶液是通过将纤维蛋白原粉末溶于二次水中,超声5-10min(例如5min、6min、7min、8min、9min、10min等)得到的。
23.在本发明中,所述凝血酶溶液是通过将凝血酶粉末溶于水中,超声5-10min(例如5min、6min、7min、8min、9min、10min等)得到的。
24.在本发明中,所述纤维蛋白原溶液的浓度为5-20mg/ml,例如6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、
18mg/ml、19mg/ml、20mg/ml等。
25.在本发明中,所述凝血酶溶液的浓度为0.5-2u/ml,例如0.5u/ml、0.6u/ml、0.7u/ml、0.8u/ml、0.9u/ml、1u/ml、1.1u/ml、1.2u/ml、1.3u/ml、1.4u/ml、1.5u/ml、1.6u/ml、1.7u/ml、1.8u/ml、1.9u/ml、2u/ml等。
26.在本发明中,所述凝固时间为1-2min,例如1min、1.1min、1.2min、1.3min、1.4min、1.5min、1.6min、1.7min、1.8min、1.9min、2min等。
27.在本发明中,所述微流控装置的制备方法还包括:将注入后得到的凝固体进行后处理。
28.在本发明中,所述后处理包括将凝固体先在35-40℃(例如35℃、36℃、37℃、38℃、39℃、40℃等)保存0.5-2h(例如0.5h、0.6h、0.7h、0.8h、0.9h、1h、1.1h、1.2h、1.3h、1.4h、1.5h、1.6h、1.7h、1.8h、1.9h、2h等),而后进行冻干干燥处理12-36h(例如12h、14h、16h、18h、20h、22h、24h、26h、28h、30h、32h、34h、36h等)。
29.在本发明中,所述微流控芯片的制备方法包括:将聚二甲基硅氧烷和固化剂混合,固化,得到基体,其次将基体一侧表面刻蚀形成微流道,另一侧表面在预定位置打孔用于预混剂的注入,而后将玻璃基板盖到形成有微流道的基体一侧的表面,进行等离子体处理,得到所述微流控芯片。
30.在本发明中,所述聚二甲基硅氧烷和固化剂的质量比为(10-11):1,例如10:1、10.1:1、10.2:1、10.3:1、10.4:1、10.5:1、10.6:1、10.7:1、10.8:1、10.9:1、11:1等。
31.在本发明中,所述固化剂为sylgard 184b。
32.在本发明中,所述混合的温度为10-40℃(例如10℃、15℃、20℃、25℃、30℃、35℃、40℃等),混合的时间为10-20min(例如10min、11min、12min、13min、14min、15min、16min、17min、18min、19min、20min等)。
33.在本发明中,所述固化的温度为60-100℃(例如60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃、100℃等),固化的时间为2-5h(例如2h、2.5h、3h、3.5h、4h、4.5h、5h等)。
34.作为本发明的优选技术方案,所述微流控装置的制备方法包括如下步骤:
35.(1)将聚二甲基硅氧烷和固化剂10-40℃混合10-20min,60-100℃固化2-5h,得到基体,其次将基体一侧表面刻蚀形成微流道,另一侧表面在预定位置打孔用于预混剂的注入,而后将玻璃基板盖到形成有微流道的基体一侧的表面,进行等离子体处理,得到微流控芯片;
36.(2)将凝血酶粉末溶于水中,超声5-10min得到浓度为0.5-2u/ml的凝血酶溶液,并将纤维蛋白原粉末溶于二次水中,超声5-10min得到浓度为5-20mg/ml的纤维蛋白原溶液,而后将纤维蛋白原溶液置于冰浴中5-10min,加入凝血酶溶液搅拌混合1-5s,得到预混剂;
37.(3)在凝固时间为1-2min内,将步骤(2)得到的预混剂注入步骤(1)得到的微流控芯片的微流道中,其次在35-40℃保存0.5-2h,而后进行冻干干燥处理12-36h,得到所述微流控装置。
38.本发明的目的之三在于提供一种如目的之一所述的微流控装置在血液凝血检测装置中的应用。
39.相对于现有技术,本发明具有以下有益效果:
40.本发明提供的微流控装置将微流控技术与生物技术相结合,将微流控芯片的微流
道中填充纤维蛋白网络,利用纤维蛋白网络能够和血小板中的受体gpiibiiia相结合的特点,能够检测血液中的凝血状态,此外血小板捕获网络是填充在微流道中的,能够增加血小板在流道中的捕获强度,增加了检测的准确度以及灵敏度,从而为肿瘤抗凝血辅助治疗方案提供重要的依据;并确认了微流控装置在制备过程中的纤维蛋白原溶液的最佳浓度为10mg/ml,且在对血小板进行剪切时最佳剪切率为1000s-1
。
附图说明
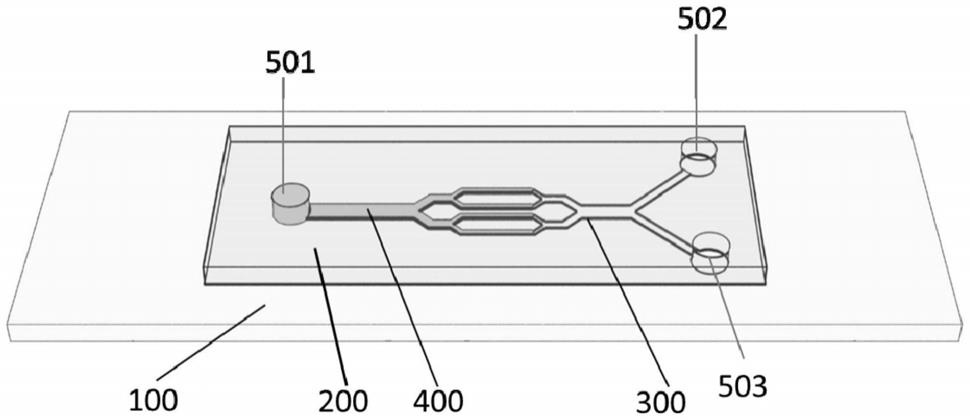
41.图1为实施例1中微流控装置的结构示意图;
42.图2为血小板捕获网络的扫描电镜图,标尺为10μm;
43.图3为染色后的血小板捕获网络的明场图片和暗场图片;
44.图4为实施例1中微流控装置在捕获血小板时的扫描电镜图,标尺为10μm;
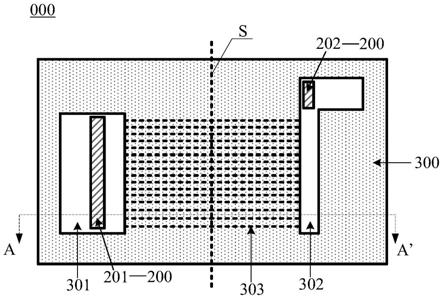
45.图5为实施例1中微流控装置检测血小板凝态的示意图;
46.图6为实施例1中微流控装置检测血小板凝态的检测原理示意图;
47.图7为实施例1中微流控装置检测血栓模型小鼠和健康小鼠血小板截留位置和强度统计图;
48.图8a为血栓模型小鼠和健康小鼠血小板的流式细胞术测试图;
49.图8b为血栓模型小鼠和健康小鼠血小板的凝血四项测试结果;
50.图9为实施例2中不同浓度的纤维蛋白原溶液得到的微流控装置对血小板捕获图。
具体实施方式
51.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
52.实施例1
53.本实施例提供一种微流控装置,如图1所示,包括层叠设置的玻璃基板100和基体200,其中基体200与玻璃基板100相接触的一侧表面设置有微流道300,且微流道300中部分填充有血小板捕获网络400,基体200远离玻璃基板100一侧的表面设置有第一孔501、第二孔502以及第三孔503;其中第一孔用于微流控装置制备过程中预混剂的注入,第二孔用于微流控装置在检测血小板时,血小板的注入,第三孔用于微流控装置在检测血小板时,pbs溶液的注入以清洗未发生截留的血小板;基体的材质为聚二甲基硅氧烷;血小板捕获网络为纤维蛋白原和凝血酶组成的血小板捕获网络;其中微流道从左至右包括第一主流道,由第一主流道分支得到的两个第二分流道,由两个第二分流道形成的四个第三分流道,由四个第三分流道两两结合形成两个第四分流道,由两个第四分流道汇合成一个第五主流道,由第五主流道分支成两个第六分流道。
54.本实施例提供一种微流控装置的制备方法,包括如下步骤:
55.(1)预混剂的制备,包括:将10mg纤维蛋白原粉末(购自上海吉至生化科技有限公司)溶解于500μl二次水中配制成纤维蛋白原溶液,超声5min,并震荡溶解;将1u凝血酶粉末溶解于500μl水中配制成凝血酶溶液,超声5min,并震荡溶解。将上述溶液样品置于0℃冰浴保存5min后,在冰浴中吸取上述凝血酶溶液,加到上述纤维蛋白原溶液中,使用100μl移液器吸头顺时针搅拌5s后制备成纤维蛋白预混液;
56.(2)基体的制备,包括:取15g pdms(购自北京沫之东生物技术有限公司)于50ml烧杯,再加入1.5g道康宁sylgard184固化剂(购自北京沫之东生物技术有限公司),室温下搅拌15min,并进行真空处理2h。将特定形状的硅模具置于10cm培养皿,将真空去除气泡的混合液缓缓倒入培养皿中,80℃固化3h,形成带有微流道的基体;
57.(3)微流控芯片的制备,包括:使用手术刀将步骤(2)得到带有微流道的基体从模具中划取出来,其次在基体的另一侧表面的预定位置进行打孔(包括第一孔、第二孔和第三孔),而后将玻璃基板盖到形成有微流道的基体一侧的表面,进行空气等离子处理,形成微流控芯片;
58.(4)微流控装置的制备,包括:将步骤(1)得到的纤维蛋白预混液沿第一孔注入微流道中,其中注入的位置包括图1中的第一主流道,两个第二分流道以及四个第三分流道,注入时间为1分40秒,先在37℃保存1h,后进行冻干干燥处理24h,得到微流控装置。
59.图2为血小板捕获网络的扫描电镜(型号日立su8220)图,从图2可知,形成的血小板捕获网络为网状结构,且网状结构的平均孔径为4μm。
60.图3为染色后的血小板捕获网络的明场图片和暗场图片(左侧图为明场图,右侧图为暗场图),从图3可知纤维蛋白前体物质纤维蛋白原已经填充到微流控流道中。
61.对本实施例得到的微流控装置进行性能测试,包括如下步骤:
62.(1)待测小鼠血小板的提取:通过尾静脉取血方式,将全血收集到1.5ml acd抗凝管中(acd与全血的体积比为1:3),室温下1100rpm离心11min,吸取保留上清富血小板血浆,再将血浆于室温下3000rpm离心3min,弃去上清液,并使用改性酪氨酸缓冲液(成分:134mm nacl,12mm nahco3,2.9mm kcl,0.34mm na2hpo4,1mm mgcl2,10mm hepes,ph 7.4的一种混合盐溶液)小心缓慢重悬血小板,并使用血细胞计数器,将细胞密度调整至3
×
108ml-1
,并储存于22℃。血小板提取结束至开始使用的时间间隔不得超过2h;
63.(2)避光条件下取1000x浓度cellmask染料1ul,滴加至1000ul步骤(1)的血小板细胞悬液中,并轻微搅拌混匀,对血小板细胞进行染色;
64.(3)持续4s以1000s-1
的剪率将步骤(2)染色后的血小板细胞注射至上述微流控装置中,再持续3~4s注射pbs溶液冲洗未发生截留的血小板。对荧光染色的血小板在微流道中的分布位置和分布强度进行统计和分析,辅以sem成像,如图4所示,发现血小板在流道初始位置和中间位置都能发生有效的截留。
65.图5为微流控装置检测血小板凝态的示意图,图6为微流控装置检测血小板凝态的检测原理示意图,从图5和图6可知:活化血小板通过gpiibiiia受体结合到纤维蛋白网络,且血小板活化后会发生体积铺展,伸出伪足进一步降低了其在网络中的通过性;活化的血小板会分泌adp和txa2,进一步激活静息状态的血小板发生活化,从而提高了截获数量,提高了装置测试灵敏度。
66.使用本实施例制备的微流控装置对血栓动物模型(脑卒中模型和肺栓塞模型)的血小板样品和健康小鼠的血小板样品进行测试,统计血小板捕获位置信息和强度信息,并进行显著性差异分析。图7为使用本实施例制备的微流控装置测试的血栓模型小鼠和健康小鼠血小板截留位置和强度统计(其中“*”表示显著性差异分析结果,***代表p<0.001,**代表p<0.01,*代表p<0.05,其中p值越小,代表显著性差异越强,若后文出现相同的符号,指代的意义均与此处相同,不再进行赘述),图8a为血栓模型小鼠和健康小鼠血小板的流式
细胞术测试图,图8b为血栓模型小鼠和健康小鼠血小板的凝血四项测试结果,将本实施例的结果与流式细胞术和凝血四项测试进行对比,可知本装置的检测结果与流式细胞术以及凝血四项检测结果相符,说明具有较好的准确性,此外,本实施例的微流控装置能够更加灵敏的区别出血栓动物模型组和健康动物组的差异,具有较好的灵敏度。
67.实施例2
68.为确定纤维蛋白原溶液最佳的浓度,对此,取5只1.2ml的离心管,加入1mg,2mg,5mg,10mg,20mg纤维蛋白原粉末(购自上海吉至生化科技有限公司),再加入500μl二次水配制成2mg/ml,4mg/ml,10mg/ml,20mg/ml,40mg/ml的纤维蛋白原溶液,并且加入500μl 1u/ml的凝血酶溶液(凝血酶购自北京索莱宝科技有限公司),配置预混剂,其中配置方法与实施例1相同,而后将配置的预混剂按照与实施例1相同的方法制备成微流控装置。
69.对待测小鼠血小板进行提取,提取的方式与实施例1相同,持续4s以1000s-1
的剪率将待测血小板样品注射至微流控装置中,再持续3~4s注射pbs溶液冲洗未发生截留的血小板。对荧光染色的血小板在微流控流道中的分布位置和分布强度进行统计和分析,辅以sem成像,对不同纤维蛋白原浓度组的微流控流道进行拍摄和观察,由图9(开始位置是指图1中的第一主流道的左边界,中间位置是指图1中第三分流道的垂直平分线位置)可知,在2mg/ml和5mg/ml的浓度组均没有观察到具有统计意义数量的血小板,说明没有发生有效的捕获,20mg/ml和40mg/ml浓度组虽然在流道初始位置能够观察到血小板,但是在流道中间位置无法观察到血小板,说明发生了堵塞;10mg/ml在流道初始位置和中间位置均观测到了血小板,说明既能保证流道不堵塞又能对血小板进行有效捕获,因此确认了纤维蛋白原的溶液的最佳浓度为10mg/ml。
70.实施例3
71.为探索最佳血小板注射剪率,对待测小鼠的血小板进行提取,提取方式同实施例1,持续4s分别以400s-1
,600s-1
,800s-1
,1000s-1
,1200s-1
,1400s-1
,1600s-1
的剪率,使用10mg/ml的纤维蛋白原(纤维蛋白原购自上海吉至生化科技有限公司)溶液浓度,按照实施例1的方法,对荧光染色的血小板在微流控六道中的分布位置和分布强度进行统计和分析,确认分布位置在观察视野的中心位置,可知,在400s-1
,600s-1
,800s-1
,1000s-1
,1200s-1
,1400s-1
,1600s-1
的剪率均能发生有效截留。为了保证在观察视野中,血小板整体截留位置处于视野中间部分,选用了1000s-1
作为最佳剪率。。
72.实施例4
73.本实施例中微流控装置的结构与实施例1相同。
74.本制备例提供一种微流控装置的制备方法,包括如下步骤:
75.(1)预混剂的制备,包括:将10mg纤维蛋白原粉末(购自上海吉至生化科技有限公司)溶解于500μl二次水中配制成纤维蛋白原溶液,超声8min,并震荡溶解;将0.5u凝血酶粉末溶解于500μl水中配制成凝血酶溶液,超声8min,并震荡溶解。将上述溶液样品置于0℃冰浴保存5min后,在冰浴中吸取上述凝血酶溶液,加到上述纤维蛋白原溶液中,使用100μl移液器吸头顺时针搅拌3s后制备成纤维蛋白预混液;
76.(2)基体的制备,包括:取15g pdms(购自北京沫之东生物技术有限公司)于50ml烧杯,再加入1.5g道康宁sylgard184固化剂(购自北京沫之东生物技术有限公司),室温下搅拌15min,并进行真空处理2h。将特定形状的硅模具置于10cm培养皿,将真空去除气泡的混
合液缓缓倒入培养皿中,80℃固化5h,形成带有微流道的基体;
77.(3)微流控芯片的制备,包括:使用手术刀将步骤(2)得到带有微流道的基体从模具中划取出来,其次在基体的另一侧表面的预定位置进行打孔(包括第一孔、第二孔和第三孔),而后将玻璃基板盖到形成有微流道的基体一侧的表面,进行空气等离子处理,形成微流控芯片;
78.(4)微流控装置的制备,包括:将步骤(1)得到的纤维蛋白预混液沿第一孔注入得到微流道中,其中注入的位置包括第一主流道,两个第二分流道以及四个第三分流道,注入时间为1分30秒,先在35℃保存2h,后进行冻干干燥处理12h,得到微流控装置。
79.按照实施例1的方法,对荧光染色的血小板在微流控六道中的分布位置和分布强度进行统计和分析,辅以sem成像,确认血小板在流道初始位置和中间位置都能发生有效的截留,说明本实施例得到的微流控装置对血小板均能发生有效的截留。
80.将本实施例中的微流控装置对血栓模型小鼠和健康小鼠进行血小板截留位置和强度进行统计,并和常规的流式细胞术测试和凝血四项测试结果进行对比,可知本实施例中微流控装置的检测结果与常规的流式细胞术测试和凝血四项测试结果的相符,说明本实施例得到的微流控装置在检测血液凝态过程中具有较高的准确性和灵敏度。
81.实施例5
82.本实施例中微流控装置的结构与实施例1相同。
83.本制备例提供一种微流控装置的制备方法,包括如下步骤:
84.(1)预混剂的制备,包括:将10mg纤维蛋白原粉末(购自上海吉至生化科技有限公司)溶解于500μl二次水中配制成纤维蛋白原溶液,超声10min,并震荡溶解;将2u凝血酶粉末溶解于500μl水中配制成凝血酶溶液,超声10min,并震荡溶解。将上述溶液样品置于0℃冰浴保存5min后,在冰浴中吸取上述凝血酶溶液,加到上述纤维蛋白原溶液中,使用100μl移液器吸头顺时针搅拌5s后制备成纤维蛋白预混液;
85.(2)基体的制备,包括:取15g pdms(购自北京沫之东生物技术有限公司)于50ml烧杯,再加入1.5g道康宁sylgard184固化剂(购自北京沫之东生物技术有限公司),室温下搅拌15min,并进行真空处理5h。将特定形状的硅模具置于10cm培养皿,将真空去除气泡的混合液缓缓倒入培养皿中,100℃固化2h,形成带有微流道的基体;
86.(3)微流控芯片的制备,包括:使用手术刀将步骤(2)得到带有微流道的基体从模具中划取出来,其次在基体的另一侧表面的预定位置进行打孔(包括第一孔、第二孔和第三孔),而后将玻璃基板盖到形成有微流道的基体一侧的表面,进行空气等离子处理,形成微流控芯片;
87.(4)将步骤(1)得到的纤维蛋白预混液沿第一孔注入得到微流道中,其中注入的位置包括第一主流道,两个第二分流道以及四个第三分流道,注入时间为1分30秒,先在40℃保存0.5h,后进行冻干干燥处理36h,得到微流控装置。
88.按照实施例1的方法,对荧光染色的血小板在微流控六道中的分布位置和分布强度进行统计和分析,辅以sem成像,确认血小板在流道初始位置和中间位置都能发生有效的截留,说明本实施例得到的微流控装置对血小板均能发生有效的截留。
89.将本实施例中的微流控装置对血栓模型小鼠和健康小鼠进行血小板截留位置和强度进行统计,并和常规的流式细胞术测试和凝血四项测试结果进行对比,可知本实施例
中微流控装置的检测结果与常规的流式细胞术测试和凝血四项测试结果的相符,说明本实施例得到的微流控装置在检测血液凝态过程中具有较高的准确性和灵敏度。
90.申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。