1.本发明涉及一种基于均相时间分辨荧光的生物素定量测定方法,属于体外诊断均相时间分辨荧光技术领域。
背景技术:
2.生物素是维生素b族中的一种小分子,存在于每个活细胞中并发挥着重要的生化作用。生物素可以偶联到多种试剂上,如蛋白质、多肽、dna、配体、量子点和纳米粒子等。这些试剂的生物活性几乎不受生物素偶联的影响。并且,生物素与亲和素及其同系物具有高度选择性和稳定性的相互作用。生物素与亲和素的相互作用是目前已知最强的非共价相互作用,其亲和常数高达10
15
mol/l。除了常用的链霉亲和素外,越来越多新的链霉亲和素变体被设计用于满足体内外研究中不同的实验特性和要求。同时,基于生物素
‑
链霉亲和素体系的多种化学和酶促生物素化技术可适用于多种实验,如信号放大和目标分离。此外,生物素作为抗体、核酸、纳米颗粒等的标记物在体外诊断行业的广泛应用,使得生物素浓度的定量测定具有重要的潜在价值。
3.目前,研究者已经成功研究出了elisa(具体可见参考文献:yuo
‑
sheng chang,c.
‑
h.w.,re
‑
jiin chang,david shiuan,determination of biotin concentration by a competitive enzyme
‑
linked immunosorbent assay(elisa)method.j.biochern.biophys.methods 1994,29,321
‑
329.)、化学发光(具体可见参考文献:xing
‑
guang,t.z.s.a.s.,determination ofbiotin in pharmaceutical formulations by potassium permanganate
‑
luminol
‑
cdte nanoparticles chemiluminescence system.chem.res.chinese universities 2012,28(4),604
‑
608.)和电化学竞争(具体可见参考文献:liu,s.
‑
l.;chen,s.
‑
z.;zhao,q.;xu,z.
‑
h.;li,y.;jia,j.
‑
h.;guo,l.
‑
h.,photoelectrochemical competitive detection of biotin.chinese journal ofanalytical chemistry 2013,41(10),1477
‑
1481.)等基于免疫分析的生物素定量测定方法,所测得的检测限(lod)和检测范围可从纳摩尔到微摩尔级别。
4.然而,随着体外诊断技术的日益发展,许多特殊场景对生物素定量测定的灵敏度和准确度要求日益提升,elisa、化学发光和电化学发光技术等基于免疫分析的生物素定量测定方法已经不能满足这些特殊场景对生物素定量测定在灵敏度和准确度方面的高要求。例如,现阶段,以生物素作为抗体、核酸、量子点和纳米颗粒等的标记分子的免疫分析技术占据着体外诊断行业的大部分市场。若能在生物素标记诊断试剂的研发初期,对试剂的生物素化水平进行准确定量,则可有效指导试剂的研发方向,大大缩短研发周期。并且,在以生物素
‑
链霉亲和素为基础的免疫分析中,未知样品中存在的生物素可与生物素标记的试剂发生竞争,从而对测试结果产生干扰。又例如,在过去几年里,生物素已被添加进一些非处方药中,并被越来越多的人用于美容需求,如头发、指甲和皮肤保养。频繁接触或食用生物素保养品,可能会间接或直接造成血液中生物素浓度升高,从而导致临床血液分析的误诊。并且,生物素本身是参与人体代谢的一种不可缺少的维生素,正常人血浆的生物素浓度
不超过2.05nm。对血浆中生物素水平的精准监测,可有效筛查生物素缺乏的遗传代谢病,并指导患者合理的生物素服用。上述特殊场景均需要对较低生物素水平样品的高灵敏和高精准检测,以判断基于生物素
‑
链霉亲和素的免疫分析的生物素干扰,以及,指导体外诊断试剂研发和临床生物素治疗。
5.此外,elisa、化学发光和电化学发光技术等基于免疫分析的生物素定量测定方法还存在一些缺陷。例如,elisa需要酶底物和额外的清洗,测定周期长达数小时。又例如,elisa、化学发光和电化学发光技术等基于免疫分析的生物素定量测定方法均是基于即时信号的检测,容易受到试剂、底物和溶剂自发光的干扰,造成结果的偏差。
6.因此,亟需找到一种灵敏度高、准确度好、步骤简单且测定周期短的生物素定量测定方法。
技术实现要素:
7.为解决上述问题,本发明提供了一种基于均相时间分辨荧光的定量测定样本中生物素的方法,所述方法包括酶切步骤;所述酶切步骤为:
8.将样本与蛋白酶混合后进行酶解,得到经酶切的样本。
9.在本发明的一种实施方式中,所述蛋白酶为丝氨酸蛋白酶。
10.在本发明的一种实施方式中,所述丝氨酸蛋白酶为蛋白酶k、糜蛋白酶、胰蛋白酶和弹性蛋白酶中的至少一种。
11.在本发明的一种实施方式中,所述蛋白酶为浓度50~100μg/ml的蛋白酶溶液。
12.在本发明的一种实施方式中,所述蛋白酶溶液的溶剂为水、4
‑
羟乙基哌嗪乙磺酸(hepes)、三(羟甲基)氨基甲烷(tris)、nah2po4&na2hpo4和k2hpo4&kh2po4中的至少一种。
13.在本发明的一种实施方式中,所述酶解为:于55~65℃酶解15~120min。
14.在本发明的一种实施方式中,所述酶解为:于700rpm、58℃下酶解2h。
15.在本发明的一种实施方式中,所述样本与蛋白酶的混合体积比为100~200:1。
16.在本发明的一种实施方式中,所述样本与蛋白酶的混合体积比为150:1。
17.在本发明的一种实施方式中,所述酶切步骤后还包括孵育步骤;所述孵育步骤为:
18.先将经酶切的样本与用荧光基团1标记的工作试剂1混合后进行孵育,得到孵育液1,然后将孵育液1与用荧光基团2标记的工作试剂2混合后进行孵育,得到孵育液2。
19.在本发明的一种实施方式中,所述用荧光基团1标记的工作试剂1为别藻蓝蛋白标记的生物素和eu
3
标记的链霉亲和素中的至少一种。
20.在本发明的一种实施方式中,当用荧光基团1标记的工作试剂1为别藻蓝蛋白标记的生物素时,所述用荧光基团2标记的工作试剂2为eu
3
标记的链霉亲和素;
21.当用荧光基团1标记的工作试剂1为eu
3
标记的链霉亲和素时,所述用荧光基团2标记的工作试剂2为别藻蓝蛋白标记的生物素。
22.在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素为生物素浓度1~20nm的别藻蓝蛋白标记的生物素溶液。
23.在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素为生物素浓度12.5nm的别藻蓝蛋白标记的生物素溶液。
24.在本发明的一种实施方式中,所述eu
3
标记的链霉亲和素为链霉亲和素浓度0.2~
4nm的eu
3
标记的链霉亲和素溶液。
25.在本发明的一种实施方式中,所述eu
3
标记的链霉亲和素为链霉亲和素浓度2.5nm的eu
3
标记的链霉亲和素溶液。
26.在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素溶液和eu
3
标记的链霉亲和素溶液的溶剂为工作液;所述工作液的成分包含缓冲剂、盐和蛋白质保护剂。
27.在本发明的一种实施方式中,所述缓冲剂为4
‑
羟乙基哌嗪乙磺酸(hepes)、三(羟甲基)氨基甲烷(tris)、nah2po4&na2hpo4和k2hpo4&kh2po4中的至少一种;所述盐为氟化钾;所述蛋白质保护剂为牛血清白蛋白。
28.在本发明的一种实施方式中,所述工作液的成分包含2~60g/l缓冲剂、5~100g/l盐和0.4~10g/l蛋白质保护剂。
29.在本发明的一种实施方式中,所述工作液的成分包含5~15g/l缓冲剂、10~30g/l盐和1~3g/l蛋白质保护剂。
30.在本发明的一种实施方式中,所述工作液的成分包含11.916g/l缓冲剂、23.24g/l盐和2g/l蛋白质保护剂。
31.在本发明的一种实施方式中,所述工作液的成分还包含表面活性剂。
32.在本发明的一种实施方式中,所述工作液的成分还包含0.1~1ml/l表面活性剂。
33.在本发明的一种实施方式中,所述工作液的成分还包含0.5ml/l表面活性剂。
34.在本发明的一种实施方式中,所述表面活性剂为非离子型表面活性剂。
35.在本发明的一种实施方式中,所述非离子型表面活性剂为吐温20、吐温40、吐温60、吐温80、曲拉通100和曲拉通114中的至少一种。
36.在本发明的一种实施方式中,所述工作液的成分还包含防腐剂。
37.在本发明的一种实施方式中,所述工作液的成分还包含0.1~1ml/l防腐剂。
38.在本发明的一种实施方式中,所述工作液的成分还包含0.5ml/l防腐剂。
39.在本发明的一种实施方式中,所述防腐剂为proclin系列生物防腐剂。
40.在本发明的一种实施方式中,所述proclin系列生物防腐剂为proclin150、proclin200、proclin300和proclin5000中的至少一种。
41.在本发明的一种实施方式中,所述工作液的ph为6.0~8.0。
42.在本发明的一种实施方式中,所述工作液的ph为7.3。
43.在本发明的一种实施方式中,所述工作液的ph使用质量浓度8%的氢氧化钠水溶液调节。
44.在本发明的一种实施方式中,所述孵育为:于25~43℃孵育5~30min。
45.在本发明的一种实施方式中,所述孵育为:于37℃孵育10min。
46.在本发明的一种实施方式中,所述经酶切的样本与用荧光基团1标记的工作试剂1的混合体积比为2.5~10:5~9。
47.在本发明的一种实施方式中,所述经酶切的样本与用荧光基团1标记的工作试剂1的混合体积比为2:1。
48.在本发明的一种实施方式中,所述孵育液1与用荧光基团2标记的工作试剂2的混合体积比为11.5~15:5~9。
49.在本发明的一种实施方式中,所述孵育液1与用荧光基团2标记的工作试剂2的混
合体积比为3:1。
50.在本发明的一种实施方式中,所述孵育步骤后还包括测定步骤;所述测定步骤为:
51.先对孵育液2进行荧光激发,然后确定孵育液2的荧光信号,最后根据荧光信号和荧光信号与生物素浓度之间的关系,计算得到样本中生物素的浓度。
52.在本发明的一种实施方式中,所述荧光信号的激发波长为320nm。
53.在本发明的一种实施方式中,所述荧光信号的发射波长为620nm和665nm。
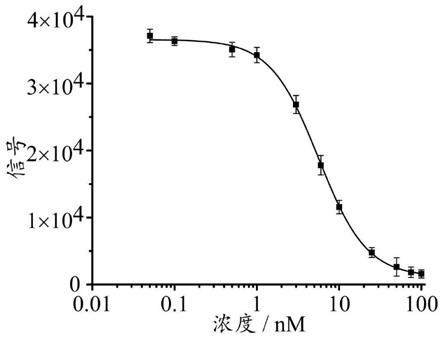
54.在本发明的一种实施方式中,所述计算为:将荧光信号带入根据荧光信号与生物素浓度之间的关系拟合而得的拟合方程;所述拟合方程如下:
55.y=36311.3/[1 (x/5.398)^
‑
1.395] 975.7;
[0056]
拟合方程中,x为样本中生物素的浓度,单位nm,y为信号值s;其中,信号值s的计算公式如下:
[0057]
s=(λ
665nm
/λ
620nm
)^10000;
[0058]
公式中,λ
665nm
为孵育液2在发射波长为665nm下的荧光信号,单位为au;λ
620nm
为孵育液2在发射波长为620nm下的荧光信号,单位为au。
[0059]
本发明还提供了一种用于定量测定样本中生物素的试剂盒,所述试剂盒包括蛋白酶、用荧光基团1标记的工作试剂1以及用荧光基团2标记的工作试剂2。
[0060]
在本发明的一种实施方式中,所述蛋白酶为丝氨酸蛋白酶。
[0061]
在本发明的一种实施方式中,所述丝氨酸蛋白酶为蛋白酶k、糜蛋白酶、胰蛋白酶和弹性蛋白酶中的至少一种。
[0062]
在本发明的一种实施方式中,所述蛋白酶为浓度50~100μg/ml的蛋白酶溶液。
[0063]
在本发明的一种实施方式中,所述蛋白酶溶液的溶剂为水、4
‑
羟乙基哌嗪乙磺酸(hepes)、三(羟甲基)氨基甲烷(tris)、nah2po4&na2hpo4和k2hpo4&kh2po4中的至少一种。
[0064]
在本发明的一种实施方式中,所述用荧光基团1标记的工作试剂1为别藻蓝蛋白标记的生物素和eu
3
标记的链霉亲和素中的至少一种。
[0065]
在本发明的一种实施方式中,当用荧光基团1标记的工作试剂1为别藻蓝蛋白标记的生物素时,所述用荧光基团2标记的工作试剂2为eu
3
标记的链霉亲和素;
[0066]
当用荧光基团1标记的工作试剂1为eu
3
标记的链霉亲和素时,所述用荧光基团2标记的工作试剂2为别藻蓝蛋白标记的生物素。
[0067]
在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素为生物素浓度1~20nm的别藻蓝蛋白标记的生物素溶液。
[0068]
在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素为生物素浓度12.5nm的别藻蓝蛋白标记的生物素溶液。
[0069]
在本发明的一种实施方式中,所述eu
3
标记的链霉亲和素为链霉亲和素浓度0.2~4nm的eu
3
标记的链霉亲和素溶液。
[0070]
在本发明的一种实施方式中,所述eu
3
标记的链霉亲和素为链霉亲和素浓度2.5nm的eu
3
标记的链霉亲和素溶液。
[0071]
在本发明的一种实施方式中,所述别藻蓝蛋白标记的生物素溶液和eu
3
标记的链霉亲和素溶液的溶剂为工作液;所述工作液的成分包含缓冲剂、盐和蛋白质保护剂。
[0072]
在本发明的一种实施方式中,所述缓冲剂为4
‑
羟乙基哌嗪乙磺酸(hepes)、三(羟
甲基)氨基甲烷(tris)、nah2po4&na2hpo4和k2hpo4&kh2po4中的至少一种;所述盐为氟化钾;所述蛋白质保护剂为牛血清白蛋白。
[0073]
在本发明的一种实施方式中,所述工作液的成分包含2~60g/l缓冲剂、5~100g/l盐和0.4~10g/l蛋白质保护剂。
[0074]
在本发明的一种实施方式中,所述工作液的成分包含5~15g/l缓冲剂、10~30g/l盐和1~3g/l蛋白质保护剂。
[0075]
在本发明的一种实施方式中,所述工作液的成分包含11.916g/l缓冲剂、23.24g/l盐和2g/l蛋白质保护剂。
[0076]
在本发明的一种实施方式中,所述工作液的成分还包含表面活性剂。
[0077]
在本发明的一种实施方式中,所述工作液的成分还包含0.1~1ml/l表面活性剂。
[0078]
在本发明的一种实施方式中,所述工作液的成分还包含0.5ml/l表面活性剂。
[0079]
在本发明的一种实施方式中,所述表面活性剂为非离子型表面活性剂。
[0080]
在本发明的一种实施方式中,所述非离子型表面活性剂为吐温20、吐温40、吐温60、吐温80、曲拉通100和曲拉通114中的至少一种。
[0081]
在本发明的一种实施方式中,所述工作液的成分还包含防腐剂。
[0082]
在本发明的一种实施方式中,所述工作液的成分还包含0.1~1ml/l防腐剂。
[0083]
在本发明的一种实施方式中,所述工作液的成分还包含0.5ml/l防腐剂。
[0084]
在本发明的一种实施方式中,所述防腐剂为proclin系列生物防腐剂。
[0085]
在本发明的一种实施方式中,所述proclin系列生物防腐剂为proclin150、proclin200、proclin300和proclin5000中的至少一种。
[0086]
在本发明的一种实施方式中,所述工作液的ph为6.0~8.0。
[0087]
在本发明的一种实施方式中,所述工作液的ph为7.3。
[0088]
在本发明的一种实施方式中,所述工作液的ph使用质量浓度8%的氢氧化钠水溶液调节。
[0089]
本发明还提供了上述方法或上述试剂盒在生物素定量测定中的应用。
[0090]
本发明技术方案,具有如下优点:
[0091]
本发明提供了一种基于均相时间分辨荧光的定量测定样本中生物素的方法,所述方法包括酶切步骤,所述酶切步骤为:将样本与蛋白酶混合后进行酶解,得到经酶切的样本;所述方法基于均相时间分辨荧光,均相时间分辨荧光可通过时间分辨监测,很容易地从短寿命荧光背景中分辨出荧光信号,进而有效避免背景光干扰,使定量测定结果更加准确;所述方法通过酶切有效避免了蛋白质生物素化水平的差异和空间位阻对固定化生物素测定结果造成的偏差,进一步提高了定量测定结果的准确性;使用所述方法定量测定生物素的检测限(lod)仅有0.03nm,测定灵敏度极高;与传统的elisa法相比,所述方法无需清洗未反应试剂,极大的简化了样本中生物素定量测定的步骤,同时,测定过程仅需10~20min,显著的缩短了样本中生物素定量测定的周期。
[0092]
进一步地,所述方法使用的工作试剂以工作液为溶剂,所述工作液的成分包含4
‑
羟乙基哌嗪乙磺酸、氟化钾和牛血清白蛋白;此工作液能有效维持离子特性和ph值稳定;所含氟离子可与eu
3
形成配位,从而改善荧光信号;所含牛血清白蛋白可保护工作试剂中的别藻蓝蛋白,使试剂活性处于长期稳定的状态。
附图说明
[0093]
图1:以生物素校准品溶液的浓度为x轴,以信号值s为y轴,通过四参数拟合绘制而得的校准曲线。
[0094]
图2:实验例2中样品
‑
生物素试剂预混模式下生物素水平的测定曲线。
[0095]
图3:实验例3中样品
‑
亲和素试剂预混模式下生物素水平的测定曲线。
具体实施方式
[0096]
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
[0097]
下述实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
[0098]
实施例1:一种用于定量测定样本中生物素的试剂盒
[0099]
本实施例提供了一种用于定量测定样本中生物素的试剂盒,所述试剂盒包括:
[0100]
浓度10μg/ml的蛋白酶k溶液,蛋白酶k:购自sigma公司,溶剂:去离子水;
[0101]
生物素浓度12.5nm的别藻蓝蛋白标记的生物素溶液,别藻蓝蛋白标记的生物素取自生物素标记试剂盒,生物素标记试剂盒:购自elabscience公司,溶剂:工作液;
[0102]
链霉亲和素浓度2.5nm的eu
3
标记的链霉亲和素溶液,eu
3
标记的链霉亲和素:购自thermofisher scientific公司,溶剂:工作液;
[0103]
其中,所述工作液的成分包含11.916g/l 4
‑
羟乙基哌嗪乙磺酸、23.24g/l氟化钾、2g/l牛血清白蛋白、0.5ml/lproclin300和0.5ml/l吐温20,所述工作液的ph使用质量浓度8%的氢氧化钠水溶液调节至7.3。
[0104]
实施例2:一种基于均相时间分辨荧光的定量测定样本中生物素的方法
[0105]
本实施例提供了一种基于均相时间分辨荧光的定量测定样本中生物素的方法,具体步骤如下:
[0106]
酶切步骤:将150μl样本与1μl实施例1中的浓度10μg/ml的蛋白酶k溶液混合后,先于700rpm、58℃下酶解2h,再用95℃水浴灭酶10min,得到经酶切的样本;
[0107]
孵育步骤:先将10μl经酶切的样本与5μl生物素浓度12.5nm的别藻蓝蛋白标记的生物素溶液混合后,于37℃孵育10min,得到孵育液1,然后将孵育液1与5μl链霉亲和素浓度2.5nm的eu
3
标记的链霉亲和素溶液混合后,于37℃孵育10min,得到孵育液2;
[0108]
测定步骤:使用infinite 200pro酶标仪对孵育液2先于320nm(带宽25nm)的激发波长下进行荧光的激发,然后分别于620nm(带宽20nm)和665nm(带宽8nm)的发射波长进行荧光信号的检测(延迟时间50μs、积分时间400μs);
[0109]
计算步骤:将测得的荧光信号带入根据荧光信号与生物素浓度之间的关系拟合而得的拟合方程,计算得到样本中生物素的浓度;所述拟合方程(r2为0.994、lod为0.03nm)如下:
[0110]
y=36311.3/[1 (x/5.398)^
‑
1.395] 975.7;
[0111]
拟合方程中,x为样本中生物素的浓度,单位nm,y为信号值s;其中,信号值s的计算公式如下:
[0112]
s=(λ
665nm
/λ
620nm
)^10000;
[0113]
公式中,λ
665nm
为孵育液2在发射波长为665nm下的荧光信号,单位为au;λ
620nm
为孵育液2在发射波长为620nm下的荧光信号,单位为au。
[0114]
拟合方程的获得过程包括如下步骤:
[0115]
校准品的配置:使用工作液配制生物素浓度分别为100nm、75nm、50nm、25nm、10nm、6nm、3nm、1nm、0.2nm、0.05nm、0nm的共11个生物素校准品溶液;
[0116]
孵育步骤:先将10μl各浓度的生物素校准品溶液分别与5μl用荧光基团1标记的工作试剂1混合后,于37℃孵育10min,得到孵育液1,然后将各孵育液1分别与5μl用荧光基团2标记的工作试剂2混合后,于37℃孵育10min,得到孵育液2;
[0117]
测定步骤:使用infinite 200pro酶标仪对各孵育液2先于320nm(带宽25nm)的激发波长下进行荧光的激发,然后分别于620nm(带宽20nm)和665nm(带宽8nm)的发射波长进行荧光信号的检测(延迟时间50μs、积分时间400μs);
[0118]
拟合步骤:先收集各孵育液2测得的发射波长为665nm下的荧光信号和发射波长为620nm下的荧光信号,并计算发射波长为665nm下的荧光信号与发射波长为620nm下的荧光信号的比值的10000倍,以此值作为样品中生物素浓度所对应的信号值s,然后以生物素校准品溶液的浓度为x轴,以信号值s为y轴,通过四参数拟合绘制校准曲线,得到根据荧光信号与生物素浓度之间的关系拟合而得的拟合方程。
[0119]
实施例3:一种基于均相时间分辨荧光的定量测定样本中生物素的方法
[0120]
本实施例提供了一种基于均相时间分辨荧光的定量测定样本中生物素的方法,所述方法与实施例2相比,区别在于:
[0121]
孵育步骤:先将10μl经酶切的样本与5μl链霉亲和素浓度2.5nm的eu
3
标记的链霉亲和素溶液混合后,于37℃孵育10min,得到孵育液1,然后将孵育液1与5μl生物素浓度12.5nm的别藻蓝蛋白标记的生物素溶液混合后,于37℃孵育10min,得到孵育液2。
[0122]
实验例1:样本中生物素的定量测定
[0123]
本实验例提供了样本中生物素的定量测定实验,实验过程如下:
[0124]
选择罗氏电化学发光pct、afp、cea试剂盒(购自罗氏诊断产品(上海)有限公司)中的生物素标记抗体为样品,分别记为pct
‑
b、afp
‑
b、cea
‑
b,pct
‑
b、afp
‑
b、cea
‑
b提供的生物素标记抗体浓度分别为2.0mg/ml、4.5mg/ml和3.0mg/ml。
[0125]
以未酶切样品作为对照,使用实施例2中记载的方法分别定量测定pct
‑
b、afp
‑
b、cea
‑
b中的生物素浓度。测定结果见表1。
[0126]
由表1可知,在样品
‑
生物素试剂预混模式下,样品经过酶切后,生物素浓度测定结果增大,高出未酶切样品38%以上。结果说明生物素定量测定的准确度受生物素存在状态的影响。标记试剂产品中固定化的生物素经酶切后以游离形式存在,酶切有效避免了蛋白质生物素化水平的差异和固定化生物素间的空间位阻对测试结果的影响,进一步提高了定量测定结果的准确性。
[0127]
表1 pct
‑
b、afp
‑
b、cea
‑
b中生物素的浓度
[0128][0129][0130]
实验例2:样本中生物素的定量测定
[0131]
本实验例提供了样本中生物素的定量测定实验,实验过程如下:
[0132]
选择生物素标记的牛血清白蛋白(牛血清白蛋白购自sigma公司,生物素标记试剂盒购自elabscience公司,标记方法参见生物素标记试剂盒的实验手册)为样品(记为bsa
‑
b),标记时分别按体积比2:1、4:1、8:1、12:1、16:1和20:1的生物素/牛血清白蛋白(b/bsa)的比率进行(分别记为b2、b4、b8、b12、b16和b20)。
[0133]
将样品用实施例1的工作液稀释至bsa浓度为5nm后,使用实施例2中记载的方法分别定量测定b2、b4、b8、b12、b16和b20中的生物素含量。测定结果见表2和图2。
[0134]
由表2和图2可知,在样品
‑
生物素试剂预混模式下,控制被标记蛋白质均为牛血清白蛋白,而生物素标记比率不同,酶切后生物素浓度测定结果相对于未酶切样品增大,其相对偏差随着b/bsa的增大而增大,最终稳定在20%左右。在b/bsa为4时,酶切与未酶切结果相差很小。结果说明b/bsa的增加使得固定化生物素间的空间位阻增大,导致存在更多未能与亲和素试剂结合的生物素,从而造成固定化生物素测定结果(未酶切)低于实际的生物素水平(酶切)。可见,在未能确定生物素的存在形式以及蛋白质生物素化水平时,采用实施例1和实施例2的方法,可有效防止生物素的漏检,并提高检测准确度。
[0135]
表2 b2、b4、b8、b12、b16和b20中生物素的含量
[0136][0137][0138]
实验例3:样本中生物素的定量测定
[0139]
本实验例提供了样本中生物素的定量测定实验,实验过程如下:
[0140]
选择生物素标记的牛血清白蛋白(牛血清白蛋白购自sigma公司,生物素标记试剂盒购自elabscience公司,标记方法参见生物素标记试剂盒的实验手册)为样品(记为bsa
‑
b),标记时分别按体积比2:1、4:1、8:1、12:1、16:1和20:1的生物素/牛血清白蛋白(b/bsa)的比率进行(分别记为b2、b4、b8、b12、b16和b20)。
[0141]
将样品用实施例1的工作液稀释至bsa浓度为5nm后,使用实施例3中记载的方法分别定量测定b2、b4、b8、b12、b16和b20中的生物素含量。测定结果见表3和图3。
[0142]
由表3和图3可知,在样品
‑
亲和素试剂预混模式下,控制被标记蛋白质均为牛血清白蛋白,而生物素标记比率不同,酶切后生物素浓度测定结果相对于未酶切样品增大,其相对偏差均不超过9%,相比样品
‑
生物素试剂预混模式降低约11%。此外,当测试的生物素/牛血清白蛋白体积比在1~8范围内时,酶切前后的相对偏差不超过2%。可见,实施例3中的样品
‑
亲和素试剂预混模式可明显降低因酶切带来的结果偏差,比样品
‑
生物素试剂预混模式更加适用于固定化生物素的定量测定。且蛋白质的生物素化水平一般不超过10生物素/蛋白,故而测试时也可以直接省略酶切步骤,快速获取测试结果。
[0143]
表3 b2、b4、b8、b12、b16和b20中生物素的含量
[0144][0145][0146]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。