1.本发明涉及微生物发酵技术领域,特别涉及一种丁酸梭菌固体发酵料的制备方法及发酵料。
背景技术:
2.丁酸梭菌(clostridium butyricum)即丁酸梭状芽孢杆菌,是一种g
的厌氧微生物,主要代谢产物为丁酸、乙酸、氢气、二氧化碳以及少量的乙醇。研究表明,益生型丁酸梭菌不仅可以与肠道中其它益生菌共生、促进它们的生长与增殖,还能抑制葡萄球菌、致病性大肠杆菌、痢疾杆菌等肠道致病菌的生长,减少致病菌分泌的有害物质(胺类、吲哚等)在肠道中的积累,调节肠道微生态平衡。
3.现有技术中丁酸梭菌制剂主要采用液体发酵方式制备,此种方式制备成本较高,因此获得的丁酸梭菌制剂的价格也较高。在菌类发酵技术中除了液体发酵方式外还有固体发酵方式,然而丁酸梭菌的厌氧特性致使其固体发酵技术发展缓慢。
技术实现要素:
4.为了解决现有技术中的至少一个技术问题,本发明实施例提供了一种丁酸梭菌固体发酵料的制备方法及发酵料。技术方案如下:
5.第一方面,提供了一种丁酸梭菌固体发酵料的制备方法,包括:
6.将丁酸梭菌和黑曲霉菌一同在密封条件下进行分段控温培养,获得丁酸梭菌固体发酵料,
7.所述分段控温培养至少包括两个阶段:
8.第一控温培养阶段,温度为33℃-36℃,
9.第二控温培养阶段,温度为36℃-39℃。
10.进一步地,所述将丁酸梭菌和黑曲霉菌一同在密封条件下进行分段控温培养,包括:
11.利用丁酸梭菌芽孢发酵液在培养基内接种丁酸梭菌;
12.将接种获得的丁酸梭菌进行制粒,获得菌体颗粒;
13.对所述菌体颗粒喷淋黑曲霉菌发酵液,以接种黑曲霉菌获得接种颗粒;
14.将所述接种颗粒密封并进行分段控温培养,获得丁酸梭菌固体发酵料。
15.进一步地,所述培养基包括:小麦和/或大米,以及豆粕、无机盐营养剂。
16.进一步地,所述培养基包括按质量百分比计的:
17.小麦,50%-60%;
18.大米,20%-30%;
19.豆粕6%-26%;
20.无机盐营养剂2%-4%。
21.进一步地,所述无机盐营养剂包括如下的任一种或多种的混合:硫酸铵、磷酸氢二
钾、硫酸镁、碳酸钙、硫酸亚铁、碳酸氢钠。
22.进一步地,所述无机盐营养剂,包括按质量百分比计的:
23.硫酸铵,0.6%-1.0%;
24.无水磷酸氢二钾,0.1%-0.2%;
25.无水硫酸镁,0.2%-0.5%;
26.碳酸钙0.5%-0.8%;
27.硫酸亚铁0.1%-0.5%;
28.碳酸氢钠0.5%-1.5%。
29.进一步地,所述培养基的配料和水的质量比为1:(0.8-0.9)。
30.进一步地,所述将所述接种颗粒密封,包括:
31.将所述接种颗粒装入自排气阀塑料袋中,密封袋体排出袋中气体。
32.进一步地,所述将所述接种后的丁酸梭菌进行制粒,获得菌体颗粒,包括:
33.将接种后的丁酸梭菌制成直径为8mm-12mm且长度为20mm-30mm的圆柱状颗粒,制粒后所述菌体颗粒的温度为30℃-45℃。
34.第二方面,提供了一种丁酸梭菌固体发酵料,该发酵料通过第一方面任一项公开的制备方法制备而成,发酵料的丁酸梭菌菌数为(1-2)
×
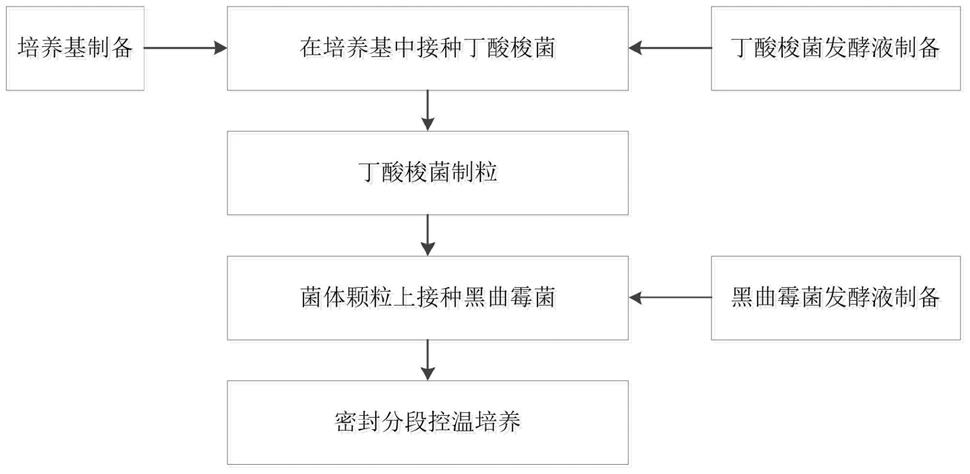
108cfu/g,丁酸含量为1-5g/kg,乙酸含量为0.3-1g/kg。
35.本发明实施例提供的技术方案带来的有益效果至少包括:
36.1、本发明公开的技术方案利用黑曲霉菌消耗丁酸梭菌培养环境中的氧气,以获得丁酸梭菌的厌氧生长环境,可有效提高发酵料中丁酸梭菌的菌数以及提高丁酸梭菌的代谢产物含量;
37.2、本发明公开的技术方案采用丁酸梭菌接种培养基中含有丁酸梭菌所需的碳源、氮源、无机盐等养分,且培养基保证了培养基的粘性,降低了培养基孔隙氧含量,培养基还可进一步消耗氧气,有利于为丁酸梭菌的增殖和代谢提供无氧环境。
附图说明
38.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
39.图1是本发明实施例公开的丁酸梭菌固体发酵料制备方法的流程图。
具体实施方式
40.本发明实施例中披露的任何数值或数值范围均不限于该精确的范围或值,而应当被理解为包含接近该数值或者数值范围的值。在数值范围中,各端点值之间、各个范围的端点值和单独的数值之间,以及单独的数值之间可以组合得到一个或多个新的数值范围,这些数值范围应当被视为在本发明中公开。
41.如背景技术所述现有的液体发酵方式制备出的丁酸梭菌制剂仅含有少量甚至不含有代谢产物,这使得丁酸梭菌的应用价值大大降低,然而由于丁酸梭菌只能在厌氧环境
下增殖和代谢,因此采用固体发酵的方式难度较大。为此,本发明提供了一种制备丁酸梭菌固体发酵料的技术方案,本发明不仅确保了制备出的丁酸梭菌发酵料具有较高的菌数,以及含有较高含量的代谢产物,还实现了在厌氧环境下采用固体发酵的方法制备丁酸梭菌发酵料。
42.第一方面,本发明公开了一种丁酸梭菌固体发酵料的制备方法,包括:
43.将丁酸梭菌和黑曲霉菌一同在密封条件下进行分段控温培养,获得丁酸梭菌固体发酵料,其中,分段控温培养至少包括两个阶段:第一控温培养阶段,温度为33℃-36℃,第二控温培养阶段,温度为36℃-39℃。
44.上述,需要说明的是,所述的丁酸梭菌芽孢发酵液可采用本领域常规使用的丁酸梭菌菌株厌氧发酵后制备的发酵液,优选为采用经耐酸耐氧驯化后具有高活力纯化丁酸梭菌菌株的发酵液。所述的黑曲霉发酵液可采用本领域常规使用的黑曲霉经培养后形成的发酵液,优选为采用经淀粉酶、糖化酶、蛋白酶组合酶活筛选的黑曲霉菌菌株经培养后形成的发酵液。
45.上述,第一控温培养阶段,可使黑曲霉加快生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,使颗粒软化。第二控温培养阶段,不利于黑曲霉生长,但利于酶解反应,使颗粒物料转化为更好利用的可溶性糖和肽与氨基酸,更适合丁酸梭菌充分生长。由此可见,本发明中黑曲霉在丁酸梭菌充分生长之前消耗掉了密封环境中的氧气,从而为丁酸梭菌提供了无氧环境。需要说明的是第一控温培养阶段的时间要短于第二控温培养阶段的时间,以使丁酸梭菌可以有足够时间生长繁殖。
46.需要说明的是:第一控温培养阶段的温度和第二控温培养阶段的温度可以均是36℃,但是更优选地第二控温阶段的温度比第一控温阶段的温度高2℃-6℃。
47.上述,将丁酸梭菌和黑曲霉菌一同在密封条件下进行分段控温培养可以是将丁酸梭菌和黑曲霉菌一同接入培养基内分段控温培养,然而上述做法可能导致黑曲霉菌在培养基内掠夺丁酸梭菌的养分以及生长空间,因此,作为一种优选情况地,如图1所示,将丁酸梭菌和黑曲霉菌一同在密封条件下进行分段控温培养,包括:
48.利用丁酸梭菌芽孢发酵液在培养基内接种丁酸梭菌;
49.将接种后获得的丁酸梭菌进行制粒,获得菌体颗粒;
50.对菌体颗粒喷淋黑曲霉菌发酵液,以接种黑曲霉菌获得接种颗粒;
51.将接种颗粒密封并进行分段控温培养,获得丁酸梭菌固体发酵料。
52.作为一种情况地,接种丁酸梭菌芽孢发酵液的培养基包含有机营养剂和无机盐营养剂,具体包括小麦和/或大米,以及豆粕、无机盐营养剂,其中无机盐营养剂包括如下的任一种或多种的混合:硫酸铵、磷酸氢二钾、硫酸镁、碳酸钙、硫酸亚铁、碳酸氢钠。进一步地,培养基包括按质量百分比计的:
53.小麦,50%-60%;
54.大米,20%-30%;
55.豆粕6%-26%;
56.无机盐营养剂2%-4%。
57.上述,小麦和大米作为丁酸梭菌的碳源供给,豆粕作为丁酸梭菌的氮源供给,除豆粕之外也可以用豆粉。优选地,大米为碎大米,优选地,小麦和碎大米经过预先粉碎,粉碎后
小麦的粒径不大于2.5mm,粉碎后大米的粒径不大于1mm。按照上述配料配比的培养基保证了培养基的粘性,降低了培养基孔隙氧含量,有利于为丁酸梭菌的增殖和代谢提供无氧环境。
58.上述,硫酸铵可进一步为丁酸梭菌提供氮源。硫酸亚铁和碳酸氢钠可消耗部分氧气,有助于为丁酸梭菌的增殖和代谢提供无氧环境。
59.作为一种具体情况地,无机盐营养剂包括按质量百分比计的:
60.硫酸铵,0.6%-1.0%;
61.无水磷酸氢二钾,0.1%-0.2%;
62.无水硫酸镁,0.2%-0.5%;
63.碳酸钙0.5%-0.8%;
64.硫酸亚铁0.1%-0.5%;
65.碳酸氢钠0.5%-1.5%。
66.作为一种进一步情况地,培养基的配料和水的质量比为1:(0.8-0.9)。
67.作为一种情况地,将接种后的丁酸梭菌进行制粒,获得菌体颗粒,包括:
68.将接种后的丁酸梭菌制成直径为8mm-12mm且长度为20mm-30mm的圆柱状颗粒,制粒后所述菌体颗粒的温度为30℃-45℃。
69.作为一种情况地,对接种颗粒进行密封培养,具体包括:
70.将接种颗粒装入自排气阀塑料袋中,密封袋体并排出袋中气体。
71.第二方面,基于上述第一方面公开的丁酸梭菌固体发酵料的制备方法,本发明还公开一种由上述制备方法制备出丁酸梭菌固体发酵料,该发酵料的丁酸梭菌菌数为(1-2)
×
108cfu/g,丁酸含量为1-5g/kg,乙酸含量为0.3-1g/kg。
72.为了更详细地说明本发明公开的技术方案并体现本发明公开的丁酸梭菌固体发酵料制备方法的技术效果,下面结合具体的实施例以及对比例对本技术方案作详细说明。
73.需要说明的是,尽管本发明公开的丁酸梭菌固体发酵料的制备方法可以采用本技术领域常规的丁酸梭菌芽孢发酵液以及黑曲霉发酵液,但为了充分体现本发明的技术效果,下述实施例及对比例中采用的丁酸梭菌芽孢发酵液均为经耐酸耐氧驯化后的高活力纯化菌株的发酵液。黑曲霉发酵液均为经淀粉酶、糖化酶、蛋白酶组合酶活筛选菌株发酵后形成的发酵液。
74.丁酸梭菌芽孢发酵液中丁酸梭菌芽孢菌菌数为(0.5-1)
×
109cfu/ml,具体的制备方法,包括:培养丁酸梭菌一级种子液;在发酵罐内对一级种子液进行二级、三级的扩大培养。一级种子液的培养基包括按质量百分比计的如下组分:葡萄糖1%,乳清粉0.5%,蛋白胨1%,酵母浸膏0.5%,牛肉膏0.5%,k2hpo40.2%,mgso4·
7h2o 0.1%,nahco30.1%,cacl20.02%,半胱氨酸盐酸盐0.1%。一级种子液的培养基ph为7.5,并在121℃,灭菌30min。一级种子液的培养条件为:37℃,转速为60rpm,振荡培养7-10h。二级及三级发酵扩大培养的培养基包括按质量百分比计的如下组分:葡萄糖1.5%,乳清粉2%,蛋白胨1.5%,酵母浸膏0.5%,牛肉膏0.5%,k2hpo40.2%,mgso4·
7h2o 0.1%,caco30.1%,mnso4·
h2o 0.1%,feso4·
7h2o 0.2%。二级及三级发酵扩大培养的培养基ph为7.5,并在121℃,灭菌30min。二级及三级培养的降温过程通入氮气保持罐压为0.05mpa,培养条件为:温度为37
±
1℃,转速为60-90rpm,厌氧发酵,培养周期为30-40h。
75.黑曲霉发酵液均采用麦芽汁(8-10波美度)做培养基。发酵罐培养条件为:温度为30
±
2℃,转速180rpm,通气量为1:0.5,罐压为0.05mpa,培养周期为24h。最终形成细腻的菌丝,菌丝粘稠。
76.实施例1
77.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)60%、碎大米(预先粉碎,粒径不大于1mm)20%、豆粕17%、硫酸铵1.0%、磷酸氢二钾0.2%、硫酸镁0.5%、碳酸钙0.5%、硫酸亚铁0.3%、碳酸氢钠0.5%,料水比为1:0.9。灭菌温度为115℃,灭菌时间为20min。
78.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至75℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入。
79.对接种后的丁酸梭菌制粒:将接种获得的丁酸梭菌菌株快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为圆柱状,直径为8-12mm,且长度为20mm-30mm。
80.黑曲霉发酵液接种与装袋:采用外接无菌压力管道喷头将黑曲霉发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
81.密封分段控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为33℃,使黑曲霉加快生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,使颗粒软化,然后调整室温为39℃继续培养3天,该温度条件不利于黑曲霉生长但利于酶解反应,更适合丁酸梭菌充分生长。
82.发酵完成后,获得的丁酸梭菌固体发酵料具有明显的丁酸味道,菌数为2
×
108cfu/g,丁酸含量为5g/kg,乙酸含量为1g/kg。
83.实施例2
84.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)50%、碎大米(预先粉碎,粒径不大于1mm)20%、豆粕26%、硫酸铵0.8%、磷酸氢二钾0.2%、硫酸镁0.5%、碳酸钙0.5%、硫酸亚铁0.5%、碳酸氢钠1.5%,料水比为1:0.8。灭菌温度为115℃,灭菌时间为20min。
85.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至70℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入。
86.对接种后的丁酸梭菌制粒:将接种获得的丁酸梭菌菌株快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为圆柱状,直径为8mm-12mm且长度为20mm-30mm。
87.黑曲霉发酵液接种与装袋:采用外接无菌压力管道喷头将黑曲霉发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
88.密封分段控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为35℃,使黑曲霉加快生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,使颗粒软化,然后调
整室温为39℃继续培养3天,该温度条件不利于黑曲霉生长但利于酶解反应,更适合丁酸梭菌充分生长。
89.发酵完成后,获得的丁酸梭菌固体发酵料具有明显的丁酸味道,菌数为1.3
×
108cfu/g,丁酸含量为3g/kg,乙酸含量为0.4g/kg。
90.实施例3
91.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)55%、碎大米(预先粉碎,粒径不大于1mm)25%、豆粕18%、硫酸铵0.6%、磷酸氢二钾0.1%、硫酸镁0.2%、碳酸钙0.5%、硫酸亚铁0.1%、碳酸氢钠0.5%,料水比为1:0.9。灭菌温度为115℃,灭菌时间为20min。
92.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至70℃,将丁酸梭菌芽孢发酵液按占物料质量比为10%接入。
93.对接种后的丁酸梭菌制粒:将接种获得的丁酸梭菌菌株快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为圆柱状,直径为8mm-12mm且长度为20mm-30mm。
94.黑曲霉发酵液接种与装袋:采用外接无菌压力管道喷头将黑曲霉发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
95.密封分段控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为33℃,使黑曲霉加快生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,使颗粒软化,然后调整室温为36℃继续培养3天,该温度条件不利于黑曲霉生长但利于酶解反应,更适合丁酸梭菌充分生长。
96.发酵完成后,获得的丁酸梭菌固体发酵料具有明显的丁酸味道,菌数为1
×
108cfu/g,丁酸含量为1g/kg,乙酸含量为0.4g/kg。
97.实施例4
98.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)60%、碎大米(预先粉碎,粒径不大于1mm)30%、豆粕6%、硫酸铵0.8%、磷酸氢二钾0.2%、硫酸镁0.5%、碳酸钙0.5%、硫酸亚铁0.5%、碳酸氢钠1.5%,料水比为1:0.8。灭菌温度为115℃,灭菌时间为20min。
99.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至75℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入。
100.对接种后的丁酸梭菌制粒:将接种获得的丁酸梭菌菌株快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为圆柱状,直径为8mm-12mm且长度为20mm-30mm。
101.黑曲霉发酵液接种与装袋:采用外接无菌压力管道喷头将黑曲霉发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
102.密封分段控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为35℃,使黑曲霉加快
生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,使颗粒软化,然后调整室温为37℃继续培养3天,该温度条件不利于黑曲霉生长但利于酶解反应,更适合丁酸梭菌充分生长。
103.发酵完成后,获得的丁酸梭菌固体发酵料具有明显的丁酸味道,菌数为1.7
×
108cfu/g,丁酸含量为4.5g/kg,乙酸含量为0.8g/kg。
104.对比例1
105.本对比例以酵母菌作为丁酸梭菌发酵培养环境中氧气的消耗菌种。
106.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)60%、碎大米(预先粉碎,粒径不大于1mm)20%、豆粕17%、硫酸铵1.0%、磷酸氢二钾0.2%、硫酸镁0.5%、碳酸钙0.5%、硫酸亚铁0.3%、碳酸氢钠0.5%,料水比为1:0.9。灭菌温度为115℃,灭菌时间为20min。接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至70℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入培养容器中。
107.添加酵母菌:在培养容器中加入酵母菌。
108.密封控温培养:密封培养容器,将培养容器置于36℃温度环境中发酵培养。酵母菌在有氧和无氧环境下均可以生长和繁殖。发酵初期,酵母菌优先生长,消耗培养容器中的氧气。待培养容器中的氧气消耗殆尽后,培养容器中具备了丁酸梭菌的厌氧生长条件,丁酸梭菌生长繁殖。
109.发酵完成后,获得的丁酸梭菌固体发酵料不具有明显的丁酸味道,菌数为0.4
×
108cfu/g,丁酸含量为1.2g/kg,乙酸含量为0.2g/kg。
110.对比例2
111.本对比例采用按照本发明实施例公开的丁酸梭菌固体发酵料制备方法,但以酵母菌作为丁酸梭菌发酵培养环境中氧气的消耗菌种。
112.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:小麦(预先粉碎,粒径不大于2.5mm)60%、碎大米(预先粉碎,粒径不大于1mm)30%、豆粕6%、硫酸铵0.8%、磷酸氢二钾0.2%、硫酸镁0.5%、碳酸钙0.5%、硫酸亚铁0.5%、碳酸氢钠1.5%,料水比为1:0.8。灭菌温度为115℃,灭菌时间为20min。
113.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至70℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入培养容器中。
114.对接种后的丁酸梭菌制粒:快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为圆柱状,直径为8mm-12mm且长度为20mm-30mm。
115.酵母菌发酵液液接种与装袋:采用外接无菌压力管道喷头将酵母菌发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
116.密封控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为33℃,使酵母菌加快生长,消耗袋中氧气,然后调整室温为39℃继续培养3天,该温度条件下更适合丁酸梭菌生长。虽然酵母菌消耗袋中氧气,但是不产生淀粉酶、糖化酶、蛋白酶等复合酶,不利于软化颗粒,使丁酸梭菌生长缓慢。
117.发酵完成后,获得的丁酸梭菌固体发酵料不具有明显的丁酸味道,菌数为0.2
×
108cfu/g,丁酸含量为0.5g/kg,乙酸含量为0.2g/kg。
118.对比例3
119.本对比例采用本技术领域中常用的培养基作为丁酸梭菌的发酵培养基。
120.制备丁酸梭菌固体发酵培养基:按如下质量百分比配制而成:麸皮50%、豆粉50%,料水比为1:0.9。灭菌温度为115℃,灭菌时间为20min。
121.接种丁酸梭菌:采用除菌空气使灭菌物料快速降温至70℃,将丁酸梭菌芽孢发酵液按占物料质量比为15%接入培养容器中。
122.对接种后的丁酸梭菌制粒:快速转入set-140螺杆挤出造粒机,挤出形式为前出料。接种后粘性物料(50℃左右)在螺杆输送、挤压作用下,从机头开孔模板挤出,颗粒形状为近圆柱状,直径为10mm左右,长度为20mm-30mm。该固体培养基制备的菌体颗粒较松散,粘性略差。
123.黑曲霉发酵液液接种与装袋:采用外接无菌压力管道喷头将黑曲霉发酵液喷于菌体颗粒表面,然后装于带自排气阀塑料袋(40*80cm),尽量装至袋口并挤压方式排出袋内气体,快速用自锁式尼龙扎带扎口。
124.密封分段控温培养:将装有喷淋后菌体颗粒的塑料袋置于发酵室,将发酵袋依次排列整齐,采取分段控温方式进行培养。培养初期(第一天)控制室温为33℃,使黑曲霉加快生长,消耗袋中氧气,生成菌丝,产生淀粉酶、糖化酶、蛋白酶等复合酶,然后调整室温为39℃继续培养3天,由于菌体颗粒偏松散,丁酸梭菌生长较慢,菌体量和代谢产物偏低。
125.发酵完成后,获得的丁酸梭菌固体发酵料具有明显的丁酸味道,菌数为0.5
×
108cfu/g,丁酸含量为0.2g/kg,乙酸含量为0.1g/kg。
126.上述实施例1-4与对比例1相比可以看出,本发明实施例公开的丁酸梭菌固体发酵料的制备方法采用黑曲霉菌作为丁酸梭菌生长和繁殖过程中的氧气消耗菌种,相较于采用酵母菌,可获得较高菌数的丁酸梭菌。对于酵母菌由于其在有氧和无氧环境中均可生长繁殖,因此在发酵中极大的侵占了丁酸梭菌的养分和生长空间,进而导致丁酸梭菌的菌数不高。
127.上述实施例1-4与对比例2相比可以看出,即使采用相同制粒以及其他菌种发酵液接种颗粒的制备方法,通过本发明实施例公开的丁酸梭菌固体发酵料的制备方法获得的固体发酵料中丁酸梭菌菌数的含量以及代谢物的含量仍然要高于喷淋了酵母菌的固体发酵料。
128.上述实施例1-4与对比例3相比可以看出,本发明实施例公开的丁酸梭菌培养基在丁酸梭菌固体发酵中可以显著增加了丁酸梭菌固体发酵料的菌数并且提高了丁酸梭菌代谢物含量。
129.以上对本技术所提供技术方案,进行了详细介绍,本文中应用了具体个例对本技术的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本技术的方法及其核心思想;同时,对于本领域的一般技术人员,依据本技术的思想,在具体实施方式及应用范围上均会有改变之处。综上所述,本说明书内容不应理解为对本技术的限制。
130.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
