南京椴不同组织及胁迫处理条件下实时定量pcr内参基因及其筛选方法和应用
技术领域
1.本发明属于植物基因工程技术领域,涉及一种南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因及其筛选方法和应用。
背景技术:
2.南京椴是我国重要的乡土树种,也是优良的园林观赏树种和城市行道树。同时南京椴是集蜜源、香花、材用、纤维用及药用等多用途经济树种。随着栽培及推广工作的逐步开展,全国范围内南京椴栽培初具规模。然而,目前该属植物遗传育种及功能基因的研究领域尚属空白。在南京椴中,仅分离并鉴定了药用成分萜类合成途径中的关键酶hmgr编码基因,基因表达分析中采用了actin基因作为内参基因。但是在研究中发现不同物种及组织中稳定表达的内参基因不尽相同,即使同一物种不同生理条件下的内参基因也并非一成不变。植物中内参基因的选择并没有绝对的通用性。因此,在分析目标基因表达模式时,应根据实验条件的改变而选择合适的内参基因。目前南京椴内参基因筛选未见报道。
技术实现要素:
3.本发明所要解决的技术问题是克服现有技术的缺陷,提供一种南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因及其筛选方法和应用,进行南京椴不同组织及不同胁迫处理条件下内参基因的筛选,为南京椴功能基因分离及表达分析提供可靠保障,从而为揭示南京椴生物特性的分子机理方面奠定基础。
4.为解决上述技术问题,本发明提供南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因,包括15个内参基因,所述内参基因分别为:18s核糖体rna(18srrna)、肌动蛋白(act1)、网格蛋白(ap47)、水孔蛋白(aqp)、延伸因子(ef1α)、甘油醛-3-磷酸脱氢酶(gapdh)、组蛋白(his)、蛋白磷酸酶(pp2α)、核糖体蛋白s13(rps13)、s-腺苷甲硫氨酸脱羧酶(samdc)、ski互作蛋白(skip)、微管蛋白tua、微管蛋白tub、泛素缀合酶(ubc)、多聚泛素基因(ubq10),所述内参基因的核苷酸序列分别如seq id no.1~seq id no.15所示。
5.本发明还提供用于实时荧光pcr扩增上述的南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因的引物,用于扩增18srrna的引物序列为seq id no.16/seq id no.17,用于扩增肌动蛋白的引物序列为seq id no.18/seq id no.19,用于扩增网格蛋白的引物序列为seq id no.20/seq id no.21,用于扩增水孔蛋白的引物序列为seq id no.22/seq id no.23,用于扩增延伸因子的引物序列为seq id no.24/seq id no.25,用于扩增甘油醛-3-磷酸脱氢酶的引物序列为seq id no.26/seq id no.27,用于扩增组蛋白的引物序列为seq id no.28/seq id no.29,用于扩增蛋白磷酸酶的引物序列为seq id no.30/seq id no.31,用于扩增核糖体蛋白s13的引物序列为seq id no.32/seq id no.33,用于扩增s-腺苷甲硫氨酸脱羧酶的引物序列为seq id no.34/seq id no.35,用于扩增ski互作蛋白的引物序列为seq id no.36/seq id no.37,用于扩增微管蛋白tua的引
物序列为seq id no.38/seq id no.39,用于扩增微管蛋白tub的引物序列为seq id no.40/seq id no.41,用于扩增泛素缀合酶的引物序列为seq id no.42/seq id no.43,用于扩增多聚泛素基因的引物序列为seq id no.44/seq id no.45。
6.本发明还提供南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因的筛选方法,包括:
7.(1)采用南京椴不同组织(根、茎、叶、苞片、花、果6个组织)等量rna混样构建全长cdna文库,并进行转录组测序;利用获得的南京椴全长转录组测序数据,以拟南芥中相应的15个内参基因序列为参考,采用本地blast获得上述的15个南京椴内参基因序列;依据上述内参基因序列设计全长引物,以南京椴cdna为模板扩增上述序列,并对扩增产物进行测序验证;
8.(2)以经过验证一致的序列作为模板,采用oligo7软件进行实时荧光定量pcr引物的设计,要求引物扩增片段长度为100~250bp,随后采用pcr扩增结合琼脂糖凝胶电泳验证引物扩增特异性,南京椴cdna为模板对特异性扩增的引物进行实时荧光定量pcr扩增并进行溶解曲线分析,获得上述的15个内参基因实时荧光定量pcr溶解曲线呈现单峰扩增的引物;
9.(3)分别采集南京椴不同组织以及胁迫处理后的不同组织样本,液氮速冻后,-70℃至-80℃冰箱保存;
10.(4)分别提取上述样本的总rna后,经反转录反应获得互补的cdna样本。以反转录后获得cdna为模板进行实时荧光定量pcr检测,并记录ct值;
11.(5)对实时荧光定量pcr得到的ct值数据,进行不同组织及胁迫条件下内参稳定性和内参数目分析,筛选出最优内参基因和内参基因组合,最后对内参基因的稳定性进行综合排序;
12.(6)在不同的实验条件下,采用2-δδct
法分别选取最稳定和最不稳定的内参基因进行校正目标基因的表达进行验证。
13.优选地,所述步骤(2)中,南京椴实时定量pcr中引物扩增特异性检测,采用普通pcr产物电泳和实时荧光定量pcr反应生成的溶解曲线法,其中电泳检测单一条带,片段大小100~250bp且实时荧光定量pcr溶解曲线为单峰,则证明荧光定量pcr引物局扩增的特异性,采用linregpcr软件计算引物扩增效率,确保扩增效率大于1.80。
14.优选地,所述步骤(3)中,所述的不同组织样本采自15年生南京椴成熟植株的嫩根、嫩茎、成叶、苞片、花苞、盛开花、果实、未成熟种子和成熟种子共9个组织,胁迫处理包括低温、高温、淹水、干旱和盐胁迫7种处理,处理后分别于0、1、3、6、12、24和48h采集南京椴组培苗组织材料,其中高温和低温胁迫处理仅采集叶片组织,淹水、干旱和盐胁迫处理下分别采集叶片及根两个组织。
15.优选地,所述的胁迫处理条件为:低温胁迫温度为0℃至8℃,高温胁迫温度为36℃至42℃,淹水胁迫为水面高于栽培基质表面2cm,盐胁迫采用hoagland’s水培营养液中添加3
‰
nacl模拟,水培营养液的ph=5.5,干旱采用hoagland’s水培营养液中添加15%peg-6000模拟,水培营养液的ph=5.5。
16.优选地,所述步骤(4)中各组织及处理条件下的试验材料在反转录反应中rna模板的用量均为0.5μg,反转录后获得的cdna原液稀释5倍,取1μl进行实时荧光定量pcr扩增,实
时荧光定量pcr反应体系为10μl,上下游引物浓度0.5μm。
17.优选地,所述步骤(4)中实时荧光定量pcr反应程序为:第一步预变性94℃30s;第二步pcr反应95℃10s,60℃15s,40个循环;第三步溶剂曲线60℃-95℃逐渐升温。
18.优选地,所述步骤(5)中采用genorm、normfinder、bestkeeper和deltact 4种算法,分析内参基因的稳定性并排序;利用reffinder对4种算法得到的候选内参基因稳定性排序结果进行综合排名,得到综合排序结果。
19.优选地,所述步骤(6)中利用2-δδct法对应用内参基因进行目标基因基因表达量分析验证,δct=ct(目标基因)-ct(内参基因),δδct=δct(处理)-δct(对照),2-δδct
=目标基因相对表达量。
20.本发明还提供上述的南京椴不同组织及胁迫处理条件下实时定量pcr内参基基因在计算目标基因相对表达量中的应用,选取实验条件下稳定性排名前两名和最后一名的3个基因,基因名称如下pp2α、samcd和18srrna(淹水胁迫叶),tub、tua和ubc(淹水胁迫根),ef1α、gapdh和ubc(干旱胁迫叶),pp2α、his和rps13(干旱胁迫根),tub、gapdh和ubc(盐胁迫叶)和tub、rps13和gapdh(盐胁迫根),对目标基因myb在不同胁迫样本中表达量分别进行计算,继而验证在不同试验条件下筛选获得稳定表达内参基因的可用性。
21.本发明所达到的有益效果:
22.(1)本发明填补了南京椴稳定内参基因筛选的空白,以南京椴根、茎、叶、苞片、花、果6个组织的全长转录组数据为依据,选择了15个候选内参基因,并设计特异性的实时荧光定量pcr引物。
23.(2)本发明采用4种内参基因稳定性分析算法分析了15个候选基因的表达稳定性,并采用reffinder算法对上述4种算法得到的结果进行综合排序,获得了不同组织中稳定性表达基因为pp2α和skip;高温胁迫下稳定表达基因为rps13和samcd;低温胁迫下稳定表达基因为samcd和ef1α;水淹胁迫叶片中稳定表达基因为pp2α和samcd,根中稳定表达基因为tua和tub;干旱胁迫叶片中稳定表达基因为ef1α和gapdh,根中稳定表达基因为pp2α和his;盐胁迫叶片中稳定表达基因为tub和gapdh,根中稳定表达基因为tub和rps13。同时在所有条件下最稳定的内参基因为act1和tub。
附图说明
24.图1南京椴基因实时定量pcr引物熔解曲线;
25.图2实时荧光定量pcr内参基因ct值箱式图;
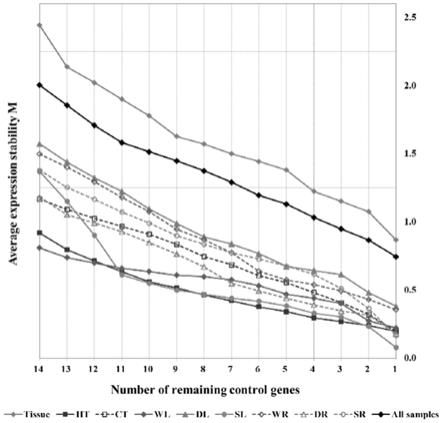
26.图3基于genorm算法对南京椴不同组织和条件下15个候选基因表达稳定度平均值(m);
27.图4基于gernorm算法的不同组织及处理条件下15个候选内参基因比较变异值(vn/vn 1)分析;
28.图5不同胁迫处理下myb目标基因相对表达量。
具体实施方式
29.下面结合附图及实施例对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
30.实施例1
31.本实施例为本发明所述的15个南京椴候选内参基因序列提取及验证。
32.分别提取南京椴、茎、叶、苞片、花、果6个组织rna,等量混合后构建全长cdna文库,通过转录组测序及数据分析获得的南京椴全长转录组测序数据。依据tair拟南芥数据库中的18srrna、act1、ap47、aqp、ef1α、gapdh、his、pp2α、rps13、samdc、skip、tua、tub、ubc和ubq10基因序列,序列编号见表1,采用本地blast获得南京椴全长转录组序列中同源序列。采用bioxm软件序列分析南京椴上述15个同源序列的cds区域,采用oligo7软件在cds区域两端设计引物。采用pcr反应扩增15个同源序列的cds区域,应用dnaman软件对测序获得cds区域与转录组中通过blast获得的同源序列进行多重序列比对,结果一致则证实blast获得的南京椴同源基因序列真实可靠。经过验证后获得的15个南京椴候选内参基因序列分别为:18s核糖体rna(18srrna)核苷酸序列为seq id no.1,肌动蛋白(act1)核苷酸序列为seq id no.2,网格蛋白(ap47)seq id no.3,水孔蛋白(aqp)seq id no.4,延伸因子(ef1α)seq id no.5,甘油醛-3-磷酸脱氢酶(gapdh)seq id no.6,组蛋白(his)seq id no.7,蛋白磷酸酶(pp2α)seq id no.8,核糖体蛋白s13(rps13)seq id no.9,s-腺苷甲硫氨酸脱羧酶(samdc)seq id no.10,ski互作蛋白(skip)seq id no.11,微管蛋白(tua)seq id no.12,微管蛋白(tub)seq id no.13,泛素缀合酶(ubc)seq id no.14,多聚泛素基因(ubq10)seq id no.15。
33.表1.15个候选内参基因
34.编号基因缩写基因拟南芥同源序列118srrna18s核糖体rnaat3g417682act1肌动蛋白at5g098103ap47网格蛋白at5g466304aqp水孔蛋白at2g371705ef1α延伸因子at5g603906gapdh甘油醛-3-磷酸脱氢酶at2g242707his组蛋白at4g400408pp2α蛋白磷酸酶at3g258009rps13核糖体蛋白s13at4g0010010samdcs-腺苷甲硫氨酸脱羧酶at3g0247011skipski互作蛋白at1g4502012tua微管蛋白at5g1978013tub微管蛋白at1g7578014ubc泛素缀合酶at1g6423015ubq10泛素家族基因at3g52590
35.实施例2
36.本实施例提供了用于扩增实施例15个候选内参基因的荧光定量pcr引物。
37.依据实施例1中的15个候选内参基因序列,采用oligo 7软件进行引物设计。设计原则遵循以下原则:(1)扩增产物长度在100bp~250bp;(2)引物长度在15-22bp之间;(3)溶解温度(tm)在57-60℃之间;(3)gc含量在40-60%之间;(4)无发卡结构、引物二聚体。
38.引物设计完成后,通过pcr扩增初步筛选引物,pcr反应体系共10μl,其中cdna模板1μl,上下游引物各0.5mm。pcr反应程序为:(1)预变性:94℃,5min;(2)变性:94℃-10s,(3)退火:56℃-10s,(4)延伸:72℃-10s,共计35个循环;(5)最后延伸:72℃-10min。取5μlpcr产物经1.5%琼脂糖凝胶电泳检测,选取单一扩增产物且条带大小符合预期的pcr产物进行测序,测序结果与实施例1中的相应序列一致时,保留相应引物。
39.比对结果一致后,选取对应的引物进行实时荧光定量pcr扩增,反应体系为10μl,上下游引物浓度0.5μm。反应程序为:第一步预变性94℃-30s;第二步pcr反应95℃-10s,60℃-15s,40个循环;第三步溶剂曲线60℃-95℃逐渐升温。采用linregpcr软件计算实时荧光定量pcr溶解曲线呈单峰的引物(见图1)的扩增效率,确保扩增效率>1.8。
40.用于扩增18srrna的引物序列为seq id no.16/seq id no.17,扩增效率1.88;用于扩增act1的引物序列为seq id no.18/seq id no.19,扩增效率1.87;用于扩增ap47的引物序列为seq id no.20/seq id no.21,扩增效率1.79;用于扩增aqp的引物序列为seq id no.22/seq id no.23,扩增效率1.87;用于扩增ef1α的引物序列为seq id no.24/seq id no.25,扩增效率1.88;用于扩增gapdh的引物序列为seq id no.26/seq id no.27,扩增效率1.90;用于扩增his的引物序列为seq id no.28/seq id no.29,扩增效率1.90;用于扩增pp2α的引物序列为seq id no.30/seq id no.31,扩增效率1.92;用于扩增rps13的引物序列为seq id no.32/seq id no.33,扩增效率1.88;用于扩增samdc的引物序列为seq id no.34/seq id no.35,扩增效率1.90;用于扩增skip的引物序列为seq id no.36/seq id no.37,扩增效率1.84;用于扩增tua的引物序列为seq id no.38/seq id no.39,扩增效率1.89;用于扩增tub的引物序列为seq id no.40/seq id no.41,扩增效率1.87;用于扩增ubc的引物序列为seq id no.42/seq id no.43,扩增效率1.90;用于扩增ubq10的引物序列为seq id no.44/seq id no.45,扩增效率1.90;。
41.实施例3
42.本实施例提供了用于南京椴候选内参基因筛选的材料及处理方法。
43.不同组织样本:采自15年生南京椴成熟植株的嫩根、嫩茎、成叶、苞片、花苞、花(盛开)、果实、未成熟种子和成熟种子共9个组织,每个组织3个生物学重复。选取生长一致的南京椴组培苗,进行不同胁迫处理:(1)高温胁迫植株放置于光照培养箱中,光周期设置为16h光照/8h黑暗,温度设置为42℃;(2)低温胁迫植株放置于光照培养箱中,光周期设置为16h光照/8h黑暗,温度设置为4℃;(3)淹水胁迫盆栽植株淹水处理,水面高于基质表面2cm左右;(4)干旱胁迫南京椴组培苗栽植于hoagland’s水培营养液(ph=5.5)中,在营养液中额外添加15%peg-6000;(5)盐胁迫南京椴组培苗栽植于hoagland’s水培营养液(ph=5.5)中,在营养液中额外添加3
‰
nacl。各胁迫处理中,分别在处理0、1、3、6、12、24和48h采集南京椴组培幼苗组织材料,其中高温和低温胁迫处理仅采集叶片组织,淹水、干旱和盐胁迫处理下分别采集叶片及根2个组织。每个时间点设置3个生物学重复,样品采集后液氮速冻并-80℃冰箱保存。
44.实施例4
45.本实施例提供了南京椴候选内参基因筛选的实时荧光定量pcr反应实验方法。
46.采用多糖多酚植物rna提取试剂盒(no:0416-50gk,华越洋,北京)提取实例3中各样本的rna,rna样品经1.2%琼脂糖凝胶电泳检测总rna完整性,并采用用超微量紫外分光
光度计(colibri lb 915)检测rna的纯度和浓度,保留完整性好,浓度大于50ng/μl,od260/280值在2.0左右的rna样本。利用goldenstar
tm
rt6 cdna synthesis kit(tsk301s,南京擎科生物科技有限公司)进行cdna的合成。反转录体系共20μl,其中rna-0.5μg,oligo dt和randomers引物-0.5mm,其他成分参考说明书;反应程序:25℃-10min,50℃-15min,85℃-5min。反转录产物稀释5倍后,放置于-20℃保存备用。
47.以上述反应中获得的cdna为模版,选取实例2中获得的15对荧光定量引物,使用chamq universal sybr qpcr master mix(q711-02,南京诺唯赞生物科技有限公司)试剂盒,在stepone
tm
real-time pcr system上进行实时荧光定量pcr扩增,每个样品设置3个重复。pcr反应体系为10μl,其中上下游引物浓度0.5μm,cdna模版1μl。反应程序为:第一步预变性94℃-30s;第二步pcr反应95℃-10s,60℃-15s,40个循环;第三步溶剂曲线60℃-95℃逐渐升温,每0.5℃收集一次荧光信号。实时荧光定量pcr得到的所有内参基因的ct均值见图2。
48.如图2所示,所有15个候选基因的ct值范围在13~31之间,其中18srrna表达量最高,ct均值为12.68;tua表达量最低,ct均值为30.81。同时skip为最稳定表达的基因,在所有样品中ct值的标准差(1.75)最小;ubc为最不稳定表达基因,在所有样品中ct值的标准差(4.42)最大。
49.实施例5
50.本实施例提供了采用genorm算法进行南京椴实时荧光定量候选内参基因稳定性排序分析。
51.本发明中genorm软件下载地址为https://genorm.cmgg.be/,其步骤和标准如下:
52.genorm首先计算候选内参基因表达稳定度平均值(m),m值越小表明内参基因稳定性越好,计算结果见表2和图3。候选内参基因的m值低于1.5时,可作为的内参基因的备选项。在组织样品中,最稳定两个基因为his和pp2α,最不稳定的是ubq,其中ubq、apq、rps13、ap47、tua、skip和tub基因的m值大于1.5,不宜作为备选内参基因。在胁迫处理条件下,其中高温胁迫中,最稳定两个基因为samcd和tua,最不稳定的是ubc,全部候选内参基因m值均小于1.5;低温胁迫中,最稳定两个基因为ef1α和samcd,最不稳定的是18srrna,全部候选内参基因m值均小于1.5;淹水胁迫叶片中,最稳定两个基因为pp2α和skip,最不稳定的是18srrna,全部候选内参基因m值均小于1.5;干旱胁迫叶片中,最稳定两个基因为act1和ef1α,最不稳定的是ubc,其中基因的m值大于1.5,不宜作为备选内参基因;盐胁迫叶片中,最稳定两个基因为act1和samcd,最不稳定的是ubc,全部候选内参基因m值均小于1.5;淹水胁迫根中,最稳定两个基因为act1和ef1α,最不稳定的是skip,全部候选内参基因m值均小于1.5;干旱胁迫根中,最稳定两个基因为ef1α和his,最不稳定的是ubc,全部候选内参基因m值均小于1.5;盐胁迫根片中,最稳定两个基因为act1和ef1α,最不稳定的是ubc,全部候选内参基因m值均小于1.5;在全部样品中,最稳定两个基因为act1和ef1α,最不稳定的是ubq,其中ubq、ubc、ap47、18srrna和aqp基因的m值大于1.5,不宜作为备选内参基因。
53.其次,genorm软件通过标准化因子配对差异分析得出两两比较的变异值v,最终选择适合的内参基因数量。当vn/n 1值小于阈值0.2时,最合适的基因内参数目为n,选择内参基因表达稳定度平均值(m)前n个基因作为内参基因。genorm程序可用于筛选任何条件下任意数量的内参基因,选择出两个以上内参基因,而不是传统地使用单一内参基因,这将有利
于系统偏差的校正,得到更可靠的基因准确定量结果,对于细微表达差异的生物学研究具有极其重要的意义。研究结果表明南京椴组织材料分析时的v6/7(0.193)小于0.2,因此需要6个内参基因类共同校正和标准化就能得到准确的定量;在高温胁迫、低温胁迫、淹水胁迫叶片、干旱胁迫叶片、盐胁迫叶片、淹水胁迫根、干旱胁迫根和盐胁迫根8组材料中,变异值v均小于0.2,因此仅需要1个内参基因的标定就能得到准确的表达量;在全部材料综合分析时v5/v6(0.194)小于0.2,因此需要6个内参基因类共同校正和标准化就能得到准确的定量。
54.表2.基于不同算法在不同材料及胁迫处理下15个候选内参基因稳定性排序
55.56.57.[0058][0059]
注明:genorm算法排序结果中方框标注的基因m值大于1.5的基因,不适宜作为在此条件下的备选内参基因。
[0060]
实施例6
[0061]
本实施例提供了采用normfinder算法进行南京椴实时荧光定量候选内参基因稳定性排序分析。
[0062]
本发明中normfinder软件下载地址为https://www.moma.dk/normfinder-software/,其步骤和标准如下:
[0063]
normfinder是基于方差分析的算法,通过计算基因表达稳定值(sv)来评估内参稳定性,值越小则稳定性越号;反之稳定性越差。内参基因的稳定性分析结果见表2。经normfinder分析后,在组织样品中,最稳定的基因为skip,最不稳定的基因是ubq;在高温胁迫下,最稳定的基因为rps13,最不稳定的基因是ubc;在低温胁迫下,最稳定的基因为samcd,最不稳定的基因是samcd;在淹水胁迫下叶片中,最稳定的基因为ap47,最不稳定的基因是18srrna;在干旱胁迫叶片中,最稳定的基因为gapdh,最不稳定的基因是ubc;在盐胁迫叶片中,最稳定的基因为his,最不稳定的基因是ubc;在淹水胁迫下根中,最稳定的基因为tub,最不稳定的基因是skip;在干旱胁迫根中,最稳定的基因为pp2α,最不稳定的基因是ubc;在盐胁迫根中,最稳定的基因为tub,最不稳定的基因是ubc;全部材料综合分析结果显示,最稳定的基因为tub,最不稳定的基因为ubq。比较normfinder于genrom结果可知,两种算法获得的最稳定基因存在一定的差异,但是最不稳定基因是一致的。
[0064]
实施例7
[0065]
本实施例提供了采用bestkeeper算法进行南京椴实时荧光定量候选内参基因稳定性排序分析。
[0066]
本发明中bestkeeper软件下载地址为https://www.gene-quantification.de/bestkeeper.html,其步骤和标准如下:
[0067]
bestkeeper程序主要通过比较ct值的标准偏差和变异系数来选择表达最稳定的基因,标准偏差和变异系数越小,稳定性越好,反之稳定性越差。内参基因的稳定性分析结果见表2。经bestkeeper分析后,在组织样品中,最稳定的基因为ubc,最不稳定的基因是ubq;在高温胁迫下,最稳定的基因为act1,最不稳定的基因是ubc;在低温胁迫下,最稳定的基因为rps13,最不稳定的基因是18srrna;在淹水胁迫下叶片中,最稳定的基因为samcd,最不稳定的基因是18srrna;在干旱胁迫叶片中,最稳定的基因为rps13,最不稳定的基因是18srrna;在盐胁迫叶片中,最稳定的基因为ef1α,最不稳定的基因是ubc;在淹水胁迫下根中,最稳定的基因为skip,最不稳定的基因是gapdh;在干旱胁迫根中,最稳定的基因为ubq,最不稳定的基因是samcd;在盐胁迫根中,最稳定的基因为ubc,最不稳定的基因是ef1α;全部材料综合分析结果显示,最稳定的基因为skip,最不稳定的基因为ubq。与genrom和normfinder结果比较可知,最稳定基因存在一定的差异,但是最不稳定基因基本一致。
[0068]
实施例8
[0069]
本实施例提供了采用delta ct算法进行南京椴实时荧光定量候选内参基因稳定性排序分析。
[0070]
本发明中delta ct算法参考::silver n,best s,jiang j,thein sl.selection of housekeeping genes for gene expression studies in human reticulocytes using real-time pcr.bmc molecular biology,2006,7:33。其步骤和标准如下:
[0071]
delta ct算法主要通过比较在同一样本中成对基因的相对表达量来判定内参基因的稳定性。内参基因的标准差(sd)被用来做为排序的标准,标准差越小,稳定性越好,反之稳定性越差。内参基因的稳定性分析结果见表2。经delta ct分析后,在组织样品中,最稳定的基因为skip,最不稳定的基因是ubq;在高温胁迫下,最稳定的基因为rps13,最不稳定的基因是ubc;在低温胁迫下,最稳定的基因为samcd,最不稳定的基因是18srrna;在淹水胁迫下叶片中,最稳定的基因为ubq,最不稳定的基因是18srrna;在干旱胁迫叶片中,最稳定的基因为gapdh,最不稳定的基因是ubc;在盐胁迫叶片中,最稳定的基因为tub,最不稳定的基因是ap47;在淹水胁迫下根中,最稳定的基因为tub,最不稳定的基因是skip;在干旱胁迫根中,最稳定的基因为pp2α,最不稳定的基因是ubc;在盐胁迫根中,最稳定的基因为tub,最不稳定的基因是ubc;全部材料综合分析结果显示,最稳定的基因为act1,最不稳定的基因为ubq。与genrom、normfinder和bestkeeper结果比较可知,最稳定基因存在一定的差异,但是最不稳定基因基本一致。
[0072]
实施例9
[0073]
本实施例提供了采用reffinder算法对不同算法获得的南京椴实时荧光定量候选内参基因稳定性结果的综合排序。
[0074]
本发明中reffinder软件下载地址为https://wwwleonxie.com/referencegene.php,其步骤和标准如下:
[0075]
reffinder程序主要通过计算genorm,normfinder,bestkeeper和delta ct四种算法对15个候选内参基因稳定性排序进行几何平均数计算,得到最终的综合排名。内参基因的稳定性分析结果见表2。经reffinder分析后,在组织样品中,最稳定的基因为pp2α,最不
稳定的基因是ubq;在高温胁迫下,最稳定的基因为rps13,最不稳定的基因是ubc;在低温胁迫下,最稳定的基因为samcd,最不稳定的基因是18srrna;在淹水胁迫下叶片中,最稳定的基因为pp2α,最不稳定的基因是18srrna;在干旱胁迫叶片中,最稳定的基因为ga pdh,最不稳定的基因是ubc;在盐胁迫叶片中,最稳定的基因为ef1α,最不稳定的基因是ubc;在淹水胁迫下根中,最稳定的基因为tub,最不稳定的基因是ubc;在干旱胁迫根中,最稳定的基因为pp2α,最不稳定的基因是rps13;在盐胁迫根中,最稳定的基因为tub,最不稳定的基因是gapdh;全部材料综合分析结果显示,最稳定的基因为act1,最不稳定的基因为ubq。
[0076]
实施例10
[0077]
本实施例为验证本发明提供的候选内参基因应用的效果。选用myb基因为目标基因,核苷酸序列为seq id no.46。该基因于tair拟南芥数据库中at4g38620核苷酸序列同源。myb转录因子是植物中广泛存在的转录因子家族,参与类黄酮代谢途径、硫代葡萄糖苷的生物合成、花青素的生物合成及植物次生细胞壁的形成等多种次生代谢反应过程,在细胞周期调控、次生代谢及胁迫应答等生命活动起着重要的作用。研究表明myb转录因子科通过间接或直接调控抗逆相关基因的表达,使植物抵制干旱、低温、高盐、光照等不良外界环境。因此本实例分别选取稳定性最好的两个内参基因和较差的1个内参基因,利用实时定量pcr反应对南京椴myb基因在淹水胁迫、干旱胁迫和盐胁迫处理下叶片及根中表达量进行验证,比较应用效果。具体步骤如下:
[0078]
(1)试验材料与处理方法
[0079]
实验材料选取南京椴组培苗经炼苗移栽30d后,进行以下胁迫处理。其中淹水胁迫采用套盆法,处理期间保持水面高于栽培基质表面2cm;干旱胁迫采用水培条件下增施peg-6000模拟,试验材料转入hoagland’s水培营养液(ph=5.5)后加入15%peg-6000;盐胁迫采用水培条件下增施nacl模拟,试验材料转入hoagland’s水培营养液(ph=5.5)后加入3
‰
nacl。
[0080]
处理后分别于0、1、3、6、12、24和48h共7个时间点采集南京椴组培苗分别采集叶片及根2个组织材料。每个时间点设置3个生物学重复,样品采集后液氮速冻并-80℃冰箱保存。
[0081]
(2)rna提取与cdna合成
[0082]
采用多糖多酚植物rna提取试剂盒(no:0416-50gk,华越洋,北京)提取各样本的rna,rna样品经1.2%琼脂糖凝胶电泳检测总rna完整性,并采用用超微量紫外分光光度计(colibri lb 915)检测rna的纯度和浓度,保留完整性好,浓度大于50ng/μl,od260/280值在2.0左右的rna样本。
[0083]
利用goldenstar
tm
rt6 cdna synthesis kit(tsk301s,南京擎科生物科技有限公司)进行cdna的合成。反转录体系共20μl,其中rna-0.5μg,oligo dt和randomers引物-0.5mm,其他成分参考说明书;反应程序:25℃-10min,50℃-15min,85℃-5min。反转录产物稀释5倍后,放置于-20℃保存备用。
[0084]
(3)myb目标基因实时定量pcr引物设计及特异性验证
[0085]
依据南京椴myb基因核苷酸序列seq id no.46,采用oligo 7软件进行引物设计。设计原则遵循以下原则:(1)扩增产物长度在100bp~250bp;(2)引物长度在15-22bp之间;(3)溶解温度(tm)在57-60℃之间;(3)gc含量在40-60%之间;(4)无发卡结构、引物二聚体。
[0086]
引物设计完成后,通过pcr扩增初步筛选引物,pcr反应体系共10μl,其中cdna模板1μl,上下游引物各0.5mm。pcr反应程序为:(1)预变性:94℃,5min;(2)变性:94℃-10s,(3)退火:56℃-10s,(4)延伸:72℃-10s,共计35个循环;(5)最后延伸:72℃-10min。取5μlpcr产物经1.5%琼脂糖凝胶电泳检测,选取单一扩增产物且条带大小符合预期的pcr产物进行测序,测序结果与目标基因序列一致时,保留此引物。
[0087]
比对结果一致后,选取对应的引物(seq id no.47、seq id no.48)进行实时荧光定量pcr扩增,反应体系为10μl,上下游引物浓度0.5μm。反应程序为:第一步预变性94℃-30s;第二步pcr反应95℃-10s,60℃-15s,40个循环;第三步溶剂曲线60℃-95℃逐渐升温。采用linregpcr软件计算实时荧光定量pcr溶解曲线呈单峰的引物(见图1)的扩增效率为1.921。
[0088]
(4)实时定量pcr反应
[0089]
选取实例9中分析获得的各胁迫条件下最稳定的2个基因和最不稳定的一个基因(见表3)。以步骤(2)中获得cdna为模版,对选用验证的内参基因和目标基因同时进行实时荧光定量pcr扩增,获得相应的ct值。试验过程中使用chamq universal sybr qpcr master mix(q711-02,南京诺唯赞生物科技有限公司)试剂盒,在stepone
tm
real-time pcr system上进行实时荧光定量pcr扩增,每个样品设置3个重复。pcr反应体系为10μl,其中上下游引物浓度0.5μm,cdna模版1μl。反应程序为:第一步预变性94℃-30s;第二步pcr反应95℃-10s,60℃-15s,40个循环;第三步溶剂曲线60℃-95℃逐渐升温,每0.5℃收集一次荧光信号。
[0090]
表3.不同胁迫条件下内参基因的选择
[0091][0092]
(1)数据处理与分析
[0093]
ct值与基因的表达量呈反比,ct值越大,基因的表达量越低,反之,ct值越小,代表基因的表达量越高;基因相对表达量的计算方法应用2-δδct法,具体步骤如下:δct=ct(目标基因)-ct(内参基因),δδct=δct(处理)-δct(对照),2-δδct
=相对表达量。
[0094]
(2)试验结果与分析
[0095]
如图5所示,在淹水胁迫处理条件下,内参基因myb的相对表达量如图5a和5b所示。在叶片组织中,采用稳定性较好的pp2α和samcd作为内参基因时,目标基因myb的相对表达量较为一致,即在处理后表达量呈现显著下降;而采用稳定性较差的18srrna作为内参基因,myb基因下调的幅度被一定程度的高估(见图5a)。在根组织中,采用稳定性较好的tub和
tua作为内参时,目标基因的相对表达量较为一致,myb基因上调表达,分别于1h/12h和3h/12h达到峰值,而后表达量逐渐降低;而采用稳定性较差的ubc作为内参基因,myb基因的上调幅度被严重的低估(见图5b)。
[0096]
在干旱胁迫条件下,内参基因myb的相对表达量如图5c和5d所示。在叶片组织中,采用稳定性较好的ef1α和gapdh作为内参基因时,目标基因myb的相对表达量较为一致,即在处理后表达量呈现显著下降;而采用稳定性较差的ubc作为内参基因,myb基因的下降幅度一定程度的高估(见图5c)。在根组织中,采用稳定性较好的pp2α和his作为内参时,目标基因的相对表达量较为一致,在处理1h时myb表达量显著下降;而采用稳定性较差的rps13作为内参基因,myb基因的相对表达量在处理后呈现异常的上调趋势(见图5d)。
[0097]
在盐胁迫条件下,内参基因myb的相对表达量如图5e和5f所示。在叶片组织中,采用稳定性较好的tub和gapdh作为内参基因时,目标基因myb的相对表达量较为一致,即在处理后呈现显著下降;而采用稳定性较差的ubc作为内参基因,myb基因在处理后3h和48小时呈现异常上调(见图5e)。在根组织中,采用稳定性较好的tub和rps13作为内参时,目标基因的相对表达量较为一致,即myb基因表达量呈现上升趋势,且在处理6h和48h时出现峰值;而采用稳定性较差的gapdh作为内参基因,myb基因的相对表达量呈现异常的升高,在处理后24h达到最高值(见图5f)。
[0098]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。