一种m-mlv逆转录酶的酶活测定组合物及测定方法
技术领域
1.本发明涉及rna逆转录酶技术领域,具体为一种m-mlv逆转录酶的酶活测定组合物及其测定方法。
背景技术:
2.莫洛尼鼠白血病病毒(moloneymurineleukeminvirus)逆转录酶(简称m-mlv rtase)逆转录酶这个酶已经作了遗传性上的改变,即除去了与它联在一起的核糖核酸酶h活性(一种专门切割dna与rna杂交链上rna分子的酶)。这个酶应用于cdna的第一链合成和引物的延伸。这种酶需要镁离子或锰离子作为辅助因子,当以mrna为模板时,先合成单链dna(ssdna),再在逆转录酶和dna聚合酶ⅰ作用下,以单链dna为模板合成“发夹”型的双链dna(dsdna),再由核酸酶s1切成二条单链的双链dna。因此,逆转录酶可用来把任何基因的mrna逆转录成cdna拷贝,然后可大量扩增插入载体后的cdna。也可用来标记cdna作为放射性的分子探针。
3.逆转录酶(m-mlv)从moloneymurineleukemiavirus分离出来,可用于合成第一链 cdna、制作cdna探针、rna转录、测序和rna的逆转录反应。本酶是通过点突变使 rnaseh活性缺失,所以它具有的dna聚合酶的活性与野生型相同,同时其延伸能力也有显著提高。
4.现有酶活测定方法缺点:误差大(需要用肉眼比较,人为因素大),耗时长,成本高 (商品酶和待测酶用量大),需要先做pcr扩增才能跑胶,容易造成气溶胶污染。
技术实现要素:
5.基于上述情况,我们公开了一种m-mlv逆转录酶的酶活测定方法,解决上述技术问题。
6.我们采用荧光定量的方法进行m-mlv逆转录酶活测定,在37℃条件下等温延伸。 sybr染料结合cdna链发出荧光,oligreen染料与单链结合发出荧光,比较sybr染料和oligreen染料这两种方法,选择出最高效最稳定、灵敏度高的酶活测定方法。
7.为了解决上述技术问题,本发明提供如下技术方案:
8.一种m-mlv逆转录酶的酶活测定组合物,包括:rna模板、oligod(t)、逆转录缓冲液、dntp、超纯水、荧光染料、rnase抑制剂、mmlv存储缓冲液和甘油;
9.所述逆转录缓冲液由如下成分组成:
10.50mm tris-hcl,ph8.375mm kcl10mm mgcl20.4mg/ml bsa0.2%ca
630
1%海藻糖0.2mm tcep
7.5%甘油4mm精氨酸4mm谷氨酸
11.所述mmlv存储缓冲液组成成分如下:
12.试剂终浓度tris-hcl(ph7.6)50mmnacl150mmdtt1.0mmedta0.1mm甘油50%triton x-1000.10%去rna酶水 13.所述rna模板序列如seq id no.1所示;
14.所述oligod(t)序列如seq id no.2所示。
15.优选的,荧光染料为:sybr green;
16.所述测定组合物的具体组分为:
17.样品终浓度超纯水/逆转录缓冲液1
×
sybr green0.4
×
dntp0.50mm eacholigo dt0.20umrnase抑制剂0.16u/ulrna模板25ng/ul甘油每24份中含1.7份75%甘油
18.优选的,荧光染料为:oligreen,所述测定组合物的具体组分如下。
19.样品终浓度超纯水/逆转录缓冲液1
×
oligreen1
×
dntp0.50mm eacholigo dt0.20umrnase抑制剂0.16u/ulrna模板25ng/ul甘油每24份中含1.7份75%甘油
20.优选的,
21.根据标准酶使用量x及其荧光信号值y,建立标准曲线y=kx b,得到荧光信号值与酶量的关系,相同反应条件下获得待测酶的荧光信号值y1,所述待测酶的酶活s1=(y
1-b)/
k,所述y1需在y值范围内。
22.优选的,具体包括以下步骤:
23.(1)将dna标准品稀释不同梯度且用染料预染5min;
24.(2)待测酶与rna模板在体系中延伸反应,延伸结束后,产物95℃放置30min,使 cdna链裂解;
25.(3)加入user酶水解引物、加入rnase水解rna;
26.(4)然后在体系中加入oligreen染料,将dna标准品及处理好的体系放入仪器测得荧光信号;
27.(5)根据dna标准品建立标准曲线,得到荧光信号与dna量的关系,计算得到待测酶酶活。
28.优选的,所述步骤(2)中延伸反应的条件为:(42℃,1分钟)20分钟;
29.优选的,所述步骤(5)中的计算公式为:
30.s2=[((y
3-b1)/k1)/(2*324.5)-0.003)]*d/1.77;
[0031]
式中,s2为待测酶的酶活力,单位为u/ml,k1为所述dna标准品建立标准曲线的斜率,b1为所述dna标准品建立标准曲线的截距,y3为待测酶得到的荧光信号差值,2为计算新生dna为双链所以需乘以2,324.5为dntp的相对平均分子质量,d为待测酶的稀释倍数。
[0032]
本发明的技术原理如下:
[0033]
sybr染料结合cdna链发出荧光,oligreen染料与单链结合发出荧光。
[0034]
sybr green是一种结合于所有dsdna双螺旋小沟区域的具有绿色激发波长的染料。在游离状态下,sybr green i发出微弱的荧光,但一旦与双链dna结合后,荧光大大增强。因此,sybr green i的荧光信号强度与双链dna的数量相关,可以根据荧光信号检测出pcr体系存在的双链dna数量。
[0035]
oligreen是一种只特异性结合单链核酸的染料,不与双链核酸结合。
[0036]
与现有技术相比,本发明所达到的有益效果是:
[0037]
1、提供一种检测逆转录酶酶活的方法,使逆转录酶酶活测定操作简单,耗时短;
[0038]
2、sybr染料法操作简单,耗时短;
[0039]
3、oligreen染料方法可以做到绝对定量,使酶活测定重复性很好。
附图说明
[0040]
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
[0041]
图1是引物选择实验中随机引物的标准曲线;
[0042]
图2是引物选择实验中oligod(t)的标准曲线;
[0043]
图3是引物选择实验中随机引物 oligod(t)的标准曲线;
[0044]
图4是现有检测方法检测酶活的凝胶电泳图;
[0045]
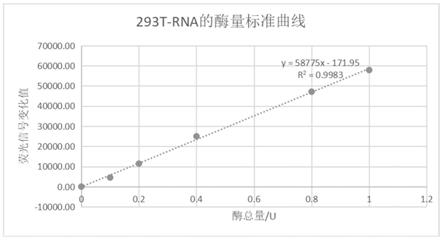
图5是实例一293t-rna的酶量标准曲线图;
[0046]
图6是实例二oligreen染料稀释为1x反应图;
[0047]
图7是实例二293t-25ng标准曲线图;
[0048]
图8是实例三oligreen染料稀释为1x反应图一;
[0049]
图9是实例三293t-rna的酶量标准曲线图。
具体实施方式
[0050]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0051]
需要的试剂
[0052]
rna模板(293t rna)
[0053]
随机引物、oligod(t)
[0054]5×
逆转录buffer
[0055]
dntp(datp、dctp、dgtp、dttp)dntps(10mm each)
[0056]
18兆水
[0057]
对照酶maxima h minus reverse transcriptase(200u/ul)、待测酶
[0058]
荧光染料sybr green i(100
×
)、oligreen
[0059]
rnase抑制剂(thermo)rnase inhibitor(40u/ul)
[0060]1×
mmlv storage buffer with glycerol
[0061]
甘油
[0062]
试剂厂家和货号如下:
[0063]
sybr green i:invitrogen货号s7563,批号:2118951
[0064]
oligreen:invitrogen货号:11492
[0065]
rnase inhibitor:promega货号:n2615批号:0000332031
[0066]
甘油:国药,货号10010618批号20200424
[0067]
tris:sigma货号:93362-1kg批号:bccd3283
[0068]
hcl:国药,货号10011018,批号20181023
[0069]
kcl:国药,货号10016318,批号20181221
[0070]
mgcl2:sigma货号m8266-100g批号slbt5102
[0071]
bsa:bbi货号a500023-0025批号g423ba000-7
[0072]
ca
630
:simga货号i8896-100ml批号mkcg8897
[0073]
海藻糖:macklin货号:d818474-25g批号:c10222306
[0074]
tcep:bbi货号:a600974-0005批号:ec18ba0021
[0075]
精氨酸:阿拉丁货号32042436
[0076]
谷氨酸:sigma货号g1501-100g批号slbx4800
[0077]
triton x:sigma货号t8787-250ml批号slbw7103
[0078]5×
逆转录buffer组成见表1:
[0079][0080]1×
mmlv storage buffer with glycerol组成见表2:
[0081]
表2 1
×
mmlv storage buffer with glycerol
[0082][0083][0084]
引物选择实验
[0085]
我们对随机引物及oligo dt引物进行筛选,选择更匹配的引物及引物使用量,使
荧光信号更高。
[0086]
我们使用7500仪器进行验证,验证数据如下图:
[0087]
由图1-3可得:随着引物量的增加,荧光信号逐渐增加,oligo dt引物结合能力最强, sybr染料及oligreen染料这两种方法均使用oligo dt引物。
[0088]
本发明使用的rna为总rna,其中包含mrna,mrna有ploy(a)尾巴,可以与 oligo dt引物特异结合进行逆转录。
[0089]
现有方法检测酶活
[0090]
商品酶(1u/μl)和待测酶(稀释n倍)同时等比例稀释4-5个梯度(1/4,1/8,1/16, 1/32,1/64)进行跑胶,比较商品酶和待测酶的条带亮度进行酶活定量。
[0091]
电泳图见图4。
[0092]
本图中商品酶为maxima h minus reverse transcriptase,待测酶1(中间的待测酶)的 1/128稀释比例的条带亮度与商用酶的1/128的亮度一致,认为待测酶1的酶浓度为1u/ul;待测酶2的1/64稀释比例的条带亮度与商用酶的1/128的亮度一致,认为待测酶2的酶浓度为0.5u/ul。最后乘以稀释倍数就得到待测酶的真实酶活。
[0093]
现有酶活测定方法缺点:误差大(需要用肉眼比较,人为因素大),耗时长,成本高 (商品酶和待测酶用量大),需要先做pcr扩增才能跑胶,容易造成气溶胶污染。
[0094]
本发明检测酶活的过程
[0095]
sybr染料是相对测活,测试方法如下:
[0096]
商品酶稀释7个梯度,待测酶稀释4个梯度待用;
[0097]
配制反应体系,且分装体系进行反应;
[0098]
根据商品酶使用量及其荧光信号值,建立标准曲线,得到荧光信号值与酶量的关系;
[0099]
计算待测酶酶活。
[0100]
oligreen染料是绝对测活,测试方法如下:
[0101]
将dna标准品稀释7个梯度且用染料预染5min,待测;
[0102]
待测酶与rna模板在体系中延伸反应,延伸结束后,产物95℃放置30min,使cdna 链裂解。
[0103]
加入user酶水解引物、加入rnase水解rna。
[0104]
然后在体系中加入oligreen染料,将dna标准品及处理好的体系放入仪器测得荧光信号
[0105]
根据dna标准品建立标准曲线,得到荧光信号与dna量的关系,计算得到待测酶酶活。
[0106]
数据处理(sybr)
[0107]
选取第11min的rn值,减去起始信号值r1,得到δrn,计算δrn平均值和标准偏差。
[0108]
以对照酶每个浓度梯度的δrn平均值为y,对应的酶量mu为x,做单项式曲线,得到公式y=kx b,r2﹥0.99。
[0109]
将待测酶的δrn平均值作为y带入公式中,计算得x即对应的酶量mu,再除以1000 将酶量单位换算成u,然后除以理论酶量(u),得到1u/ul待测酶的实际浓度(u/ul),计算其平均值。
[0110]
将上述得到的浓度平均值
×
稀释到1u/ul的稀释倍数,得到待测酶母液相对于商品酶的浓度(u/ul)。
[0111]
数据处理(oligreen)
[0112]
(1)dna标准曲线制作
[0113]
a、选取dna标准品和背景对照的第11min的荧光值,减去起始信号值r1,得到δrn,并计算平均荧光值,标准偏差sd;
[0114]
b、以dna标准品dna量(ng)为x轴,以各梯度净荧光值的平均值为y轴,制作工作曲线,从中获得净荧光值与双链dna浓度的关系曲线,得到公式
[0115]
y2=k1x2 b1,r2﹥0.99。
[0116]
式中:
[0117]
k1‑‑‑‑
截距
[0118]
b1‑‑‑‑
斜率
[0119]
(2)新生dna量计算:x3=(y
3-b1)/k1[0120]
选取待测酶和背景对照的第11min的荧光值,减去起始信号值r1,得到δrn,并计算平均荧光值y3,将各净荧光值代入式y3=k1x3 b1计算新生成的双链dna量x3。
[0121]
(3)dntp消耗量计算
[0122]
dntp消耗量以y4表示,单位为nmol,
[0123]
y4=x3/(2*324.5)
[0124]
式中:
[0125]
x3‑‑‑‑‑
新生成的双链dna量,单位为ng
[0126]
‑‑‑‑‑‑
双链dna由两条单链dna组成
[0127]
324.5
‑‑‑
dntp的相对平均分子质量
[0128]
(4)酶活计算,参照gb/t 36755~36756-2018工具酶活性测定通用要求和bstdna 聚合酶(合订),根据dntp消耗量来计算m-mlv逆转录酶的酶活。
[0129]
s2=(y
4-0.003)*d/1.77
[0130]
式中:
[0131]
s2‑‑‑‑‑‑
酶活力,单位为u/ml
[0132]d‑‑‑‑‑‑‑
酶的稀释倍数
[0133]
最终的计算公式为:s2=[((y
3-b1)/k1)/(2*324.5)-0.003)]*d/1.77。
[0134]
实施例1:
[0135]
sybr染料相对酶活测定过程:
[0136]
1、不同的商品酶稀释,每次取1ul与步骤2中的mix混合。
[0137][0138]
2、mix配制
[0139][0140][0141]
4、数据处理,详见图5。
[0142][0143]
4、实验分析
[0144]
sybr染料测试m-mlv酶的酶活,可以建立标准曲线且r2可以达到0.99
[0145]
实施例2:
[0146]
1、oligreen染料稀释为1x
[0147]
2、rnase a酶配制
[0148]
(1)称量100mg rnase a粉末(使用高兵兵的天平),放入50ml离心管中;
[0149]
(2)加入100ul tris-hcl(1m)、50ulnacl(3m),加入7mlnf水溶解rnase a粉末;
[0150]
(3)用hcl和naoh将溶液ph值调为7.5,然后用水定容至10ml,充分混匀溶液;
[0151]
(4)用金属浴100℃煮沸15min,缓慢降到室温(有絮状产生);
[0152]
(5)将降到室温的rnase a溶液3500rmp离心5min,用0.22um的滤芯过滤,到-20 保存。
[0153]
3、mix配制
[0154]
te加入量/ul9.279.028.778.277.77293t-rna量/ul0.730.730.730.730.73rnase a酶量/ul00.250.511.5oligreen量/ul1010101010
[0155]
4、在酶标仪上反应,(37℃,5min)30min
[0156]
5、图谱,详见于图6
[0157]
6、数据处理,详见于图7
[0158][0159]
7、实验现象及结论
[0160]
(1)oligreen与rna结合产生荧光;
[0161]
(2)rnase a酶量越大,荧光信号越弱;
[0162]
(3)rnase a可以有效水解rna使荧光信号有变化。
[0163]
实施例3:
[0164]
1、oligreen染料稀释为1x
[0165]
2、商品酶(maxima h minus reverse transcriptase)稀释
[0166][0167]
3、mix配制
[0168][0169][0170]
4、在酶标仪,仪器上进行扩增,(42℃,1min)20min
[0171]
5、实验图谱,详见于图8
[0172]
6、数据处理,详见于图9
[0173][0174]
7、实验分析
[0175]
(1)体系中有本底信号,酶加入量为0时,oligreen可能与rna、引物等单链结合产生荧光;
[0176]
(2)体系中mmlv酶加入量越多,荧光信号越低;
[0177]
(3)oligreen染料测试m-mlv酶时,有荧光信号变化,可以测试此酶活。
[0178]
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0179]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。