一种
ε-己内酯高产菌株的高通量筛选方法
技术领域
1.本发明涉及一种ε-己内酯高产菌株的高通量筛选方法,属于高通量筛选技术领域。
背景技术:
2.ε-己内酯为无色透明油状液体,具有芳香气味,易溶于水、乙醇、苯等溶剂,不溶于石油醚,是一种用途广泛的有机化工中间体,可作为单体合成高性能聚合物材料,如聚己内酯。由于聚己内酯具有独特的生物相容性、优秀的生物降解性以及良好的渗透性,在生物医学工程领域及生物降解领域存在广泛应用:可用作各种可生物降解的医用材料,如手术缝合线、可控制药物释放的载体、骨骼夹板等;可用于合成环境友好型材料,如可降解塑料、全降解膜材料等,有利地减少白色污染。
3.目前ε-己内酯的合成方法主要分为化学氧化法和生物转化法两种,其合成是基于1899年阿道夫
·
冯
·
拜尔(adolf von baeyer)和维克多
·
维利格(victor villiger)发现的baeyer-villiger反应出发的,该反应是指将酮氧化为酯的一类有机合成反应。根据氧化剂的不同,化学氧化法又可分为过氧酸氧化法、过氧化氢氧化法和氧气氧化法,目前国内多采用过氧酸氧化环己酮的技术化学生产ε-己内酯,但该方法存在易爆炸安全性低、环境污染严重、操作繁琐等缺陷。为响应绿色化学的号召,生物催化法近年来备受关注。
4.1976年,研究人员在钙化不动杆菌acinetobacter sp.ncimb 9871中鉴定出一种依赖氧和nadhph的环己酮单加氧酶(cyclohexanone monooxygenase,chmo),经验证认定其可以催化环己酮向ε-己内酯的转化。由于chmo在体外参与酶促反应需要额外添加昂贵的辅助因子nadph,体外生物催化法并不适于工业大规模应用。为解决该问题,全细胞催化产ε-己内酯的双酶或多酶级联反应相继建立。其中,以空气中的氧气为氧化剂,通过醇脱氢酶adh和环己酮单加氧酶chmo对底物环己醇进行催化氧化,进一步产生中间产物环己酮和最终产物ε-己内酯(schmidt s,scherkus c,muschiol j,et al.an enzyme cascade synthesis of epsilon-caprolactone and its oligomers[j].angew chem int ed engl,2015,54(9):2784-2787.),过程中的两步氧化反应可实现辅助因子nadph循环利用。但该反应仍存在nadph不平衡,底物和产物浓度抑制和氧气传递速率低等问题。近年来,为了进一步解决级联反应过程中nadph不平衡的问题,已有相关研究针对上述级联系统中的adh和chmo蛋白单独进行rbs改造,但由于改造菌株数量较少,突变菌株催化效果仅获得有限的提升。目前突变文库构建方法多样、高效,如易错pcr、基因重组、序列饱和突变(sesam)、基因编辑等。要想从突变文库中快速获得目标优势突变株,一种快速准确的高通量筛选方法不可或缺。
[0005]
现有ε-己内酯生产菌株的筛选,一般是采用摇瓶催化后使用气相色谱法检测,过程繁琐耗时,目前无人应用高通量筛选技术来筛选ε-己内酯高产菌株。
技术实现要素:
[0006]
为了克服现有技术的缺点与不足,本发明的目的在于提供一种ε-己内酯高产菌株的高通量筛选方法。
[0007]
本发明的目的是为了突破目前ε-己内酯高产菌株无法通过高通量筛选获得的瓶颈,提供了一种具有较高应用价值且简单易行的ε-己内酯高产菌株的高通量筛选方法。
[0008]
本发明的目的通过下述技术方案实现:
[0009]
本发明将adh和chmo双酶级联反应产物ε-己内酯的浓度与中间产物环己酮的浓度进行相关性分析发现,具有不同催化性能的菌株在全细胞催化反应后,中间产物环己酮浓度与产物ε-己内酯浓度呈负相关关系,因此可以以中间产物环己酮为筛选标记,通过高通量筛选具有低环己酮浓度的菌株得到高产ε-己内酯的菌株。
[0010]
本发明提供的一种ε-己内酯高产菌株的高通量筛选方法,包括如下步骤:
[0011]
(1)将产ε-己内酯的突变文库菌株单菌落挑取至装有液体培养基的微孔板中,振荡培养;转接种子液于新的微孔板液体培养基中,振荡培养至od
600
介于0.5~0.7之间时加入诱导剂iptg诱导蛋白表达;
[0012]
(2)离心去除上清培养基,使用含有一定浓度环己醇的缓冲液重悬菌体全细胞,在微孔板中进行全细胞催化环己醇生成ε-己内酯的反应;
[0013]
(3)反应结束后加入2,4-二硝基苯肼溶液,使全细胞催化体系中的中间产物环己酮与2,4-二硝基苯肼充分反应,生成对应的苯腙化合物;加入naoh溶液进行显色反应,使对应的苯腙化合物可与碱液反应生成苯醌化合物,离心,取上清液于新的微孔板中并使用酶标仪测定特定吸收波长下样品吸光值,通过两步反应测定催化体系中的环己酮浓度;以产ε-己内酯的出发菌株rcl0为阴性对照,在相同条件下反应,特征吸收波长下吸光值与阴性对照吸光值比值低于1的突变菌株为阳性突变菌株;吸光值比值越低,相应菌株的ε-己内酯的产量越高;
[0014]
(4)将通过2,4-二硝基苯肼显色反应筛选得到的阳性突变菌株进行摇瓶催化实验进行产量验证。
[0015]
进一步地,步骤(1)中所述产ε-己内酯的突变文库菌株是通过rbs工程技术对出发菌株rcl0中adh和chmo基因的原始核糖体结合位点序列同时进行突变获得,以大肠杆菌bl21(de3)为宿主,以prsfduet-1为表达载体。
[0016]
所述的出发菌株rcl0为重组菌株bdr-3,在文献“熊婧卉.大肠杆菌全细胞高效合成ε-己内酯体系构建及催化性能研究[d].华南理工大学,2020.”中公开。
[0017]
优选的,步骤(1)、(2)、(3)中所述的微孔板为96孔或48孔微孔板;
[0018]
优选的,步骤(1)中所述的振荡培养的条件为36~38℃、900~1100rpm、10~14h;进一步为37℃、1000rpm培养12h;
[0019]
优选的,步骤(1)中所述的液体培养基为lb液体培养基;
[0020]
优选的,步骤(1)中所述的诱导蛋白表达的条件为于28~32℃、800~1000rpm诱导6~8h;进一步为于30℃、900rpm诱导7h;
[0021]
优选的,步骤(1)中所述的iptg的终浓度为0.4~0.6mm;进一步为0.5mm;
[0022]
优选的,步骤(2)中所述的离心的条件为4~8℃、1800~2000g条件下离心10~15min;进一步为4℃、2000g条件下离心10min;
[0023]
优选的,步骤(2)中所述的环己醇的终浓度为40~60mm;进一步为60mm;
[0024]
优选的,步骤(2)中所述的缓冲液为tris-hcl缓冲液;进一步为20mm,ph 7.5的tris-hcl缓冲液;
[0025]
优选的,步骤(2)中所述的反应的条件为23~27℃、700~900rpm反应14~18h;进一步为25℃、800rpm反应16h;
[0026]
优选的,步骤(3)中所述的2,4-二硝基苯肼溶液的浓度为15~25mm(进一步为20mm);使用95%乙醇(分析纯)溶解且含有3%的硫酸溶液,需避光保存;
[0027]
优选的,步骤(3)中所述的naoh溶液的浓度为1.2~1.8m;进一步为1.5m;
[0028]
优选的,步骤(3)中,环己酮与2,4-二硝基苯肼充分反应的条件为28~32℃、700~900rpm转速下反应25~35min;进一步为30℃、800rpm转速下反应30min;
[0029]
优选的,步骤(3)中,显色反应的条件为28~32℃静置反应10~20min;进一步为30℃静置反应15min;
[0030]
优选的,步骤(3)中,所述的离心的条件为于4~8℃,1800~2000g条件下离心5~10min;进一步为于4℃,2000g条件下离心5min;
[0031]
优选的,步骤(3)中所述的特定吸收波长为530~550nm;进一步为540nm。
[0032]
优选的,步骤(3)中催化体系中的中间产物环己酮与2,4-二硝基苯肼反应的流程为:突变菌株的微孔板(96孔板)全细胞催化反应结束后,取20μl催化反应液于微孔板(96孔板)中,向其中加入20μl 2,4-二硝基苯肼溶液,混匀后在30℃、800rpm转速下反应30min;接着,向其中加入200μl的1.5mnaoh溶液,混匀后30℃静置反应15min;接着,于4℃,2000g条件下离心5min,取100μl上清液于一新的微孔板(96孔板)中,使用酶标仪测定其在540nm处的吸光值。
[0033]
上述ε-己内酯高产菌株的高通量筛选方法在筛选高产ε-己内酯的菌株中的应用。
[0034]
本发明还提供ε-己内酯高产菌株,通过上述高通量筛选方法得到。
[0035]
所述的ε-己内酯高产菌株为rcl01、rcl02、rcl03、rcl04、rcl05、rcl06、rcl07;是通过rbs工程技术对出发菌株rcl0中adh和chmo基因的原始核糖体结合位点序列同时进行突变获得,以大肠杆菌bl21(de3)为宿主,以prsfduet-1为表达载体;
[0036]
其中,rcl01~rcl07中adh的核糖体结合位点序列分别如seq id no.7、seq id no.9、seq id no.10、seq id no.12、seq id no.13、seq id no.15、seq id no.17所示;
[0037]
rcl01~rcl07中chmo的核糖体结合位点序列分别如seq id no.8、seq id no.8、seq id no.11、seq id no.11、seq id no.14、seq id no.16、seq id no.18所示。
[0038]
上述ε-己内酯高产菌株在发酵生产ε-己内酯中的应用。
[0039]
本发明相对于现有技术具有如下的优点及效果:
[0040]
(1)本发明提供的一种ε-己内酯高产菌株的高通量筛选方法,解决以往ε-己内酯生产菌株筛选过程依赖于气相色谱法的瓶颈,创新地以级联反应中间产物为筛选标记,通过高通量检测不同突变菌株在全细胞催化反应后体系中的中间产物环己酮浓度,以高通量筛选产物ε-己内酯高产的菌株。操作步骤简单,可大幅降低菌株筛选过程的实验成本并缩短筛选周期。
[0041]
(2)本发明利用rbs工程技术构建ε-己内酯产生菌的突变文库,筛选得到的七株突变菌株并进行摇瓶实验验证,催化70mm环己醇的ε-己内酯产量,与出发菌株rcl0相比均获
得显著提高;其中,最优突变菌株rcl07催化效率高、长期稳定性强,在40mm环己醇的分批补料实验中,可于54h内实现0.236mm/gcell/h的ε-己内酯时空产率,为现有分批补料报道中ε-己内酯产量和时空产率的最高记录。
附图说明
[0042]
图1是大肠杆菌全细胞催化环己醇产ε-己内酯的级联反应图。
[0043]
图2是实施例1中不同工程菌株参与40mm(a)和60mm(b)环己醇的全细胞催化反应后中间产物环己酮浓度与产物ε-己内酯浓度的相关性分析图。
[0044]
图3是adh和chmo基因的组合rbs突变文库组成图。
[0045]
图4是级联反应中间产物环己酮与2,4-二硝基苯肼反应原理图。
[0046]
图5是实施例4中不同工程菌株催化70mm环己醇的结果示意图。
具体实施方式
[0047]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0048]
值得注意的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所使用的试剂、材料及仪器,如无特别说明,均可视为可通过从商业途径得到的常规产品。
[0049]
本发明中大肠杆菌全细胞催化环己醇产ε-己内酯的级联反应图,如图1所示。
[0050]
本发明中的adh(genbank:ay267012.1),经密码子优化后的核苷酸序列如seq id no.1所示。
[0051]
本发明中的chmo是指chmo(genbank:baa86293.1)突变体chmo-qm,包含4个突变位点:c376l/m400i/t415c/a463c,经密码子优化后的核苷酸序列如seq id no.2所示。
[0052]
实施例1级联反应中间产物浓度与产物浓度的相关性发现
[0053]
实验室前期已构建多株ε-己内酯产生菌bdr-2、bdr-5~bdr-13,并使用上述10株菌株分别进行了40mm和60mm环己醇的全细胞催化反应,结果发现各菌株ε-己内酯产量各异(熊婧卉.大肠杆菌全细胞高效合成ε-己内酯体系构建及催化性能研究[d].华南理工大学,2020.)。通过对上述一系列菌株的全细胞催化结果的进一步分析,我们发现,不同菌株催化相同浓度底物环己醇后,反应体系中的产物ε-己内酯浓度与中间产物环己酮浓度呈较好的负相关关系(图2)。因此,我们推测可通过对催化反应后体系中中间产物环己酮浓度的检测以表征己内酯产量的高低即级联反应效率的高低,从而对菌株进行筛选。
[0054]
实施例2基于rbs工程技术构建产ε-己内酯的突变菌株文库
[0055]
实验室前期已构建一株含重组载体prsf-rbs
10-adh-rbs
20-chmo(prsf-a10c20)的ε-己内酯产生菌株bdr-3(熊婧卉.大肠杆菌全细胞高效合成ε-己内酯体系构建及催化性能研究[d].华南理工大学,2020.)。本发明中,将prsf-rbs
10-adh-rbs
20-chmo重新命名为prsf-rbs
a0-adh-rbs
c0-chmo(rbs
a0
和rbs
c0
分别如seq id no.3和seq id no.4所示);将bdr-3重新命名为rcl0。以重组载体prsf-rbs
a0-adh-rbs
c0-chmo为文库构建的出发载体,对adh和chmo基因的原始核糖体结合位点序列中的sd序列进行突变,利用rbs library calculator网页软件和redlibs算法设计两基因的简并sd序列,设计含简并sd序列的引物
并以出发载体为模板进行扩增,同源重组以构建双酶rbs组合突变文库。具体实施步骤如下:
[0056]
1.adh和chmo的rbs简并序列的获取
[0057]
将出发载体上adh和chmo基因的6bp的sd序列设为完全简并形式(nnnnnn),两基因的蛋白质编码序列(cds)及其sd序列完全简并后的rbs序列被分别输入预测模式的rbs library calculator v2.0(https://salislab.net/software/),获得两基因的4096条rbs序列及其对应的起始翻译速率值(tir)数据集。截取rbs序列中存在差异的sd序列,将sd序列-tir值数据集输入redlibs算法(jeschek m,gerngross d,panke s.rationally reduced libraries for combinatorial pathway optimization minimizing experimental effort[j].nat commun,2016,7:11163.),使用说明见https://www.bsse.ethz.ch/bpl/software/redlibs,文库大小设为24,文库分布尽可能接近均匀分布,分别得到adh和chmo基因的6bp的sd简并序列,对应形成两基因的rbs简并序列rbs
a(lib)
和rbs
c(lib)
,分别如seq id no.5和seq id no.6所示。
[0058]
2.pcr扩增片段
[0059]
设计并合成含rbs
a(lib)
序列的简并引物comrbs1-deg-f和含rbs
c(lib)
序列的简并引物comrbs2-deg-r,设计并合成质粒骨架引物对bb-right-f和bb-left-r。以出发载体为模板,以comrbs1-deg-f和comrbs2-deg-r引物对扩增含adh和chmo的简并sd序列及adh基因的片段,以bb-right-f和bb-left-r引物对扩增含chmo基因及prsfduet-1质粒骨架片段。
[0060]
comrbs1-deg-f:5
′‑
taattttgtttaactttaatargrrhatataccatgacggatcgtctg-3
′
;
[0061]
comrbs2-deg-r:5
′‑
gctgctgcccatatgtatatdnccyccttatacttaactaatatac-3
′
;
[0062]
bb-right-f:5
′‑
atatacatatgggcagcagccatcaccatcatc-3
′
;
[0063]
bb-left-r:5
′‑
attaaagttaaacaaaattatttctacag-3
′
。
[0064]
3.产ε-己内酯的rbs组合突变菌株文库的构建
[0065]
使用ii重组克隆试剂盒,将含有同源臂的两片段进行重组,获得含有adh和chmo基因rbs序列突变的质粒文库prsf-rbs
a(lib)-adh-rbs
c(lib)-chmo,文库大小为576,将质粒文库dna通过化学转化法转入e.coli bl21(de3)感受态细胞,获得rbs组合突变菌株文库(图3)。
[0066]
实施例3ε-己内酯高产菌株的高通量筛选
[0067]
1.突变文库菌株的孔板培养及全细胞催化
[0068]
挑取实施例2中突变菌株文库的1743个单菌落接种于96孔板中的150μllb培养基(含卡那霉素),37℃、1000rpm培养12h后,种子液按1:50转接于200μl新鲜lb培养基(含卡那霉素)中,相同条件下培养直至od
600
达到0.5~0.7,添加诱导剂异丙基-β-d-硫代半乳糖吡喃糖苷(iptg)至最终浓度0.5mm以诱导蛋白表达。于30℃、900rpm诱导7h后,将发酵液于4℃、2000g条件下离心10min以收集大肠杆菌菌体,去除上清液,使用200μl含60mm环己醇的tris-hcl缓冲液(20mm,ph 7.5)重悬菌体,于25℃、800rpm进行全细胞催化反应16h。
[0069]
2.突变文库菌株的高通量筛选
[0070]
催化反应16h后,使用2,4-二硝基苯肼溶液对孔板中催化反应液的环己酮浓度进行高通量检测。第一步反应:取20μl催化反应液至含20μl2,4-二硝基苯肼溶液(20mm)的96孔板中,混匀后置于微孔板恒温振荡器于30℃,800rpm条件下反应30min。第二步反应:向混
合物中加入200μl naoh溶液(1.5m),混匀后置于30℃培养箱静置反应15min;两步反应(图4)结束后,使用孔板离心机对96孔板进行离心,条件为4℃,2000g离心5min,随后取100μl上清液于一新的96孔板中,使用酶标仪测定其在540nm处的吸光值以检测环己酮的浓度。吸光值越低说明检测到的环己酮浓度越低,对应菌株的ε-己内酯产量越高。以产ε-己内酯的出发菌株rcl0为阴性对照,在相同条件下反应,突变菌株所测吸光值与阴性对照吸光值比值低于1的为阳性突变菌株,将比值最低的7株阳性突变菌株分别命名为rcl01、rcl02、rcl03、rcl04、rcl05、rcl06、rcl07,它们分别含有质粒prsf-rbs
a(01)-adh-rbs
c(01)-chmo、prsf-rbs
a(02)-adh-rbs
c(01)-chmo、prsf-rbs
a(03)-adh-rbs
c(02)-chmo、prsf-rbs
a(04)-adh-rbs
c(02)-chmo、prsf-rbs
a(05)-adh-rbs
c(03)-chmo、prsf-rbs
a(06)-adh-rbs
c(04)-chmo和prsf-rbs
a(07)-adh-rbs
c(05)-chmo。上述7株突变菌株的adh和chmo的rbs序列各不相同:rbs
a(01)
如seq id no.7所示,rbs
c(01)
如seq id no.8所示;rbs
a(02)
如seq id no.9所示;rbs
a(03)
如seq id no.10所示,rbs
c(02)
如seq id no.11所示;rbs
a(04)
如seq id no.12所示;rbs
a(05)
如seq id no.13所示,rbs
c(03)
如seq id no.14所示;rbs
a(06)
如seq id no.15所示,rbs
c(04)
如seq id no.16所示;rbs
a(07)
如seq id no.17所示,rbs
c(05)
如seq id no.18所示。
[0071]
实施例4七株突变菌株ε-己内酯产量的摇瓶实验验证
[0072]
将实施例3中的7株阳性突变菌株从-80℃冰箱取出,活化于含卡那霉素的lb固体平板,37℃培养箱培养12h,挑取单菌落接种于试管含卡那霉素的lb液体培养基中,于37℃摇床220rpm过夜培养12h。随后,将种子液按1:50比例转接于摇瓶含卡那霉素的lb培养基中扩大培养,于对数生长期加入诱导剂以诱导菌株体内adh和chmo的表达。具体步骤如下:
[0073]
1.七株突变菌株的摇瓶培养及蛋白诱导表达
[0074]
将过夜培养的种子液按1:50的体积比转接到装有200ml lb液体培养基(含卡那霉素)的500ml摇瓶中,置于37℃摇床220rpm培养1.5~2.5h,期间测定od
600
值,待菌体处于对数生长期(od
600
介于0.5~0.7之间)时,加入100μl 1m的异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,iptg)储液,终浓度为0.5mm。将摇瓶置于30℃摇床在180rpm转速下诱导7h,随后收集菌液于50ml离心管,在1340g,4℃条件下离心30min以收集菌体,去除上清培养基后使用20mm tris-hcl(ph 7.5)缓冲液重悬菌体至菌体浓度为100g
wcw
/l,于4℃冰箱保存。
[0075]
2.七株突变菌株的摇瓶产量验证
[0076]
以环己醇为底物,使用实施例4中诱导表达后的7株突变菌株进行全细胞催化反应。以1:100的比例向100g
wcw
/l的菌悬液加入二甲基亚砜(dimethylsulfoxide,dmso),轻柔地混匀后冰置30min,离心去除上清液,用20mm tris-hcl(ph 7.5)缓冲液重悬至原体积,置于4℃冰箱保存,待用于全细胞催化反应。
[0077]
全细胞催化反应于50ml摇瓶中进行,反应体系如下表1所示。
[0078]
表1
[0079]
试剂体积环己醇74.0μl(70mm)100g
wcw
/l的细胞悬液1ml20mm tris-hcl(ph7.5)缓冲液9ml
[0080]
首先向50ml摇瓶中加入9ml缓冲液,随后加入74μl环己醇溶液,吹打均匀使环己醇
充分溶解于缓冲液中,1ml全细胞悬液最后加入,混匀后立即用封口膜封口,置于25℃摇床120rpm反应16h。每株突变菌株设置三个平行。对照组使用1ml的20mm tris-hcl(ph7.5)缓冲液替换1ml全细胞悬液,其他成分相同,混匀后取800μl样品于2ml离心管中冻存,待检测作为催化前的实际底物投入值。
[0081]
3.产物ε-己内酯的萃取及检测
[0082]
催化反应结束后,混合均匀摇瓶中的反应液,取800μl反应液于2ml离心管中,同时取出冻存的对照组反应液,分别向上述离心管中加入800μl乙酸乙酯溶液(含有2mm乙酰苯),振荡器震荡萃取10min后,于14000rpm转速下离心5min,用1ml注射器吸取上层有机相500μl,经0.22μm无菌滤头过滤后使用gc检测。
[0083]
检测有机相成分含量用的是型号为岛津gc-2014c的气相色谱仪,色谱柱为hp-5柱,规格为30m
×
0.32mm
×
0.25μm,检测器为火焰离子化检测器(fid),检测器和注射器的温度分别设置为280℃和250℃。以氮气为载气,以30:1的分流比,3ml/min的流速,以分流模式注入1μl的等分样品。设置的程序如下:柱箱初始温度为50℃,以10℃/min的速率升温至100℃,再以20℃/min的速率升温至200℃,总时间为17min。
[0084]
gc分析结果如图5所示,7株突变菌株催化70mm环己醇所得产物ε-己内酯浓度不一,均比出发菌株rcl0高。其中,突变菌株rcl07的产量最高,达47.0mm。这说明通过高通量筛选得到的7株阳性突变菌株的催化能力经验证较出发菌株强,同时验证了实施例1中的“产物ε-己内酯浓度与中间产物环己酮浓度呈较好的负相关关系”的推测确实可行,也表明本发明所提供的ε-己内酯高产菌株的高通量筛选方法有效。
[0085]
实施例5突变菌株rcl07的分批补料催化应用
[0086]
将实施例4中ε-己内酯产量最高的rcl07突变菌株用于分批补料全细胞催化实验中,旨在进一步提高ε-己内酯的产量。菌株培养、蛋白表达步骤同实施例4,分批补料催化步骤如下:
[0087]
1.分批补料催化的体系组成
[0088]
以40mm环己醇为底物,使用实施例4中dmso处理后的100g
wcw
/l的rcl07细胞悬液进行分批补料全细胞催化反应。反应于250ml摇瓶中进行,体系如下表2所示。
[0089]
表2
[0090]
试剂体积环己醇211μl(40mm)100g
wcw
/l的细胞悬液5ml20mm tris-hcl(ph7.5)缓冲液45ml
[0091]
2.分批补料催化的流程及结果
[0092]
首先向250ml摇瓶中加入45ml缓冲液,随后加入211μl环己醇溶液,混合均匀使环己醇充分溶解于缓冲液中,最后加入5ml细胞悬液,混匀后立即用封口膜封口,置于25℃摇床120rpm,每隔数小时取样一次。设置三个平行。对照组使用5ml的20mm tris-hcl(ph7.5)缓冲液替换5ml细胞悬液,其他成分相同,混匀后取800μl样品于2ml离心管中冻存,待检测作为催化前的实际底物投入值。单批次反应结束后,收集催化体系于4℃低温离心机离心30min以回收菌体,再次配制含相同浓度环己醇的催化体系重悬菌体以开始下一批次分批补料实验,共进行4批次反应,前两个批次反应11h,后两个批次反应16h,底物总投入量为
160mm。每隔数小时取800μl反应液,按实施例4所述步骤制样以检测底物及产物浓度变化。
[0093]
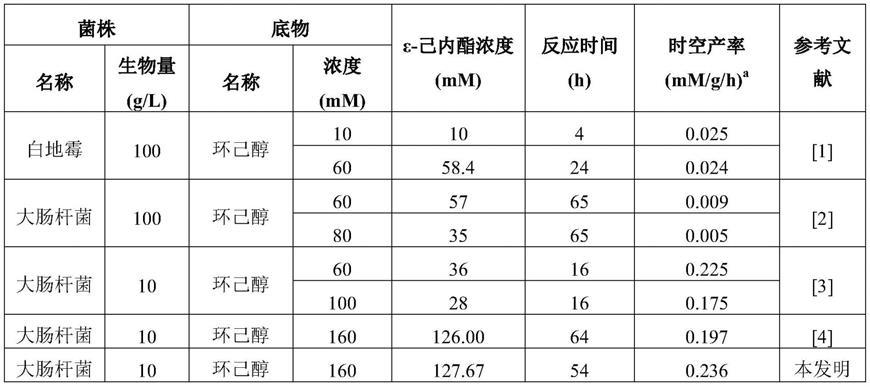
突变菌株rcl07具有较强的催化活性和长期稳定性,分批补料结果(表3)显示其于54h内催化4批次底物实现0.236mm/g/h的ε-己内酯时空产率,为现有分批补料报道中ε-己内酯产量和时空产率的最高记录。
[0094]
表3
[0095][0096]
a时空产率是指单位时间内单位生物量的细菌催化产生的ε-己内酯的浓度。
[0097]
参考文献:
[0098]
[1]silva al p,batista p k,filho a d,et al.rapid conversion of cyclohexenone,cyclohexanone and cyclohexanol toε-caprolactone by whole cells of geotrichumcandidum cct1205[j].biocatalysis and biotransformation,2017,35(3):185-190.
[0099]
[2]schmidt s,scherkus c,muschiol j,et al.an enzyme cascade synthesis of epsilon-caprolactone and its oligomers[j].angew chem int ed engl,2015,54(9):2784-2787.
[0100]
[3]kohl a,srinivasamurthy v,bottcher d,et al.co-expression of an alcohol dehydrogenase and a cyclohexanone monooxygenase for cascade reactions facilitates the regeneration of the nadph cofactor[j].enzyme microb technol,2018,108:53-58.
[0101]
[4]xiong j,chen h,liu r,et al.tuning a bi-enzymatic cascade reaction in escherichia coli to facilitate nadph regeneration forε-caprolactone production[j].bioresources and bioprocessing,2021,8(1).
[0102]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。