pr2005有可能成为一种用于治疗新冠病毒肺炎的临床用药品。
7.一方面,本技术要求保护孕激素在制备抑制细胞因子风暴综合征的药物中的应用。
8.另一方面,本技术要求保护用于抑制细胞因子风暴综合征的药物组合物,其特征在于,包含孕激素。
9.再一方面,本技术要求保护治疗冠状病毒感染疾病的方法,其特征在于,施用孕激素。
10.所述孕激素可选己酸羟孕酮、醋酸甲羟孕酮、黄体酮等,优选己酸羟孕酮。
11.所述细胞因子风暴综合征可以为各类病毒感染,大分子抗体治疗,器官移植或car-t 治疗引起的细胞因子风暴综合征。
12.所述感染可以为冠状病毒,流感病毒和其他病毒感染。
13.所述冠状病毒感染疾病可以为新型冠状病毒肺炎、中东呼吸综合征和严重急性呼吸综合征,优选新型冠状病毒肺炎,通过施用孕激素抑制这些疾病中的细胞因子风暴来治疗这些疾病
14.本技术中所述的新型冠状病毒有多种命名方式,包括但不限于新型冠状病毒、 2019-ncov、sars-cov-2(国际病毒分类委员会正式命名);该病毒感染后引起的疾病可称为新型冠状病毒肺炎、ncp、covid-19(国际卫生组织正式命名)等。
15.本技术中己酸羟孕酮也被称为17-α己酸羟孕酮、17-hpc、17-己酸羟孕酮、17-羟己孕酮,cas编号为630-56-8,在实验部分中使用pr2005的代号。
16.本技术中的药物可以为临床上任何可接受的剂型形式,本技术的治疗中药物可以以临床上任何可接受的剂型形式施用。具体剂型包括但不限于:片剂、胶囊剂、口服液、针剂、粉针剂等。
17.本发明所制备的药物中还可以含有其他已知和未知的治疗相关疾病的药物,本发明的治疗方法中也可以使用其他已知和未知的治疗相关疾病的药物,这些药物包括但不限于:用于治疗自身免疫疾病的药物,如免疫抑制剂、过氧化物酶体增殖物激活受体激动剂、鞘氨醇-1-磷酸酯受体激动剂、环氧化酶抑制剂、抗氧化剂、抗肿瘤坏死因子治疗、静脉注射免疫球蛋白以及其他疗法。用于治疗感染的药物,如抗生素、抗真菌药、病毒复制抑制剂、病毒侵入抑制剂,以及治疗相关疾病中发烧、呕吐、皮肤问题等症状的已知和未知药物。
18.根据制备/施用的剂型,药物中可以选用各种药学可接受的辅料,包括但不限于包衣材料、溶剂、增溶剂、粘合剂、稳定剂、抗氧化剂、ph调节剂、矫味剂,这些辅料成分本领域技术人员可以根据药剂学常识选用。
具体实施方式
19.试验动物和材料:
20.试验中使用无特定病原体条件下培育出的人源化小鼠。所有试验程序受到了动物伦理委员会批准。所有用于流式细胞分析的抗体均来自外购。这些抗体的内毒素水平均小于0.5iu/mg。
21.人类外周血单核细胞(pbmcs)也用于本次试验。先用磷酸盐缓冲液冲洗分离后的人累pbmcs。溶解掉红细胞以后,再使用磷酸盐缓冲液洗涤有核细胞三次。
22.试验方法和流程:
23.一般来说,在人类外周血单个核细胞(pbmc)过继移植10天后(post-adaptivetransfer),人源化严重联合免疫缺陷(hu-scid)小鼠的脾脏和血液中人cd45细胞与小鼠cd45细胞的比例分别为3:1和0.4:1。这相当于在脾脏中有1-2
×
107个人cd45细胞,每毫升血液中有1
×
106个人cd45细胞。
24.据报道,莫罗单抗-cd3(okt3)在输注后都会产生严重的不良反应。在人pbmc 过继移植10天后,从hu-scid小鼠脾脏中分离出来的人体细胞仍能与okt3相结合。
25.在试验中,我们选择了静脉(iv)和腹腔(ip)两种给药途径,因为腹腔注射后的抗体吸收更为缓慢。
26.首先向每只试验用人源化小鼠静脉注射2
×
107个pbmc。10天之后,向每只小鼠注射okt3或对照用igg(2μg或10μg,iv或ip)。
27.在给药okt3和对照igg之后,于10min、20min和60min的时间点对小鼠进行采血。然后对收集的肝素化血浆应用多重免疫分析系统来分析细胞因子。测量的细胞因子包括人il-1β、il-2、il-4、il-5、il-6、il-10、il-12(p70)、il-13、il-17,ifn-γ和tnf-α。在末次采血(60min)之后,小鼠被处死。然后用流式细胞术分析其活化标志物。用2.4g2阻断小鼠脾脏人外周血单个核细胞,然后用荧光标记的cd69、cd25、cd45 和cd3染色。
28.体温测量:处理前测量小鼠的直肠温度,在每个采血点前再次测量直肠温度。测量温度是通过插入一个直肠热电偶探头,等待数字稳定后(~10s)获取读数。处死体温 <32℃的小鼠。
29.临床评分测量:按照加拿大动物保护协会 (www.ccac.ca/en_/standards/guidelines)的建议,我们进行了初步研究来确定最合适的临床症状和评分标准。在每个时间点观察小鼠并给予一个临床评分。分值:0=正常活动;1=正常活动,毛发直立,踮脚步态;2=弓背,活动减少,但仍有活动;3=活动过少,但提示时仍有活动;4=濒死。处死临床评分为4分的小鼠。然后对试验数据的组间差异进行了统计学分析。
30.试验结果:
31.注射抗体后的症状观察:
32.okt3 注射的动物:
33.ip注射组:在低剂量2μg ip途径给药中,所有hu-scid小鼠均未受影响。接受 10μg okt3 ip给药的hu-scid小鼠临床评分为中度(弓背,活动过少),5只小鼠中有1只出现濒死并在2h时处死。
34.iv注射组:当给予2μg iv的okt3时,hu-scid小鼠在1h内出现中度到重度的反应。4只小鼠中有2只需要实施安乐死,而其余2只小鼠虽然表现出中度症状,但在5小时内慢慢恢复。小鼠对10μg okt3 iv的反应为重度,故在1h时间点时将全部小鼠都进行了处死。
35.多克隆抗体 atg注射的动物:
36.无论ip,还是iv注射对照igg的hu-scid小鼠均未出现临床症状。
37.注射抗体后体温过低
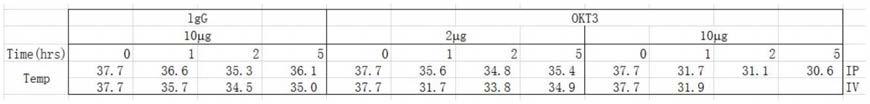
38.体温过低和体温过高均会出现在细胞因子风暴中。为此,我们进行了观察。
39.okt3组:无论是以ip还是iv注射10μg okt3后,直肠温度在1h内均从37℃严重下降至32℃以下。在2μg的较低剂量下,iv途径给药导致在1h时出现瞬态体温过低(~32℃),在
5h后部分恢复;ip途径给药后出现的适度改变与注射对照人igg 出现的结果相似。
40.igg对照组:体温无明显变化。
41.抗体注射后的循环细胞因子变化:
42.在注射抗体之后,为确定是否诱发了细胞因子风暴,我们检测了hu-scid小鼠血浆中的细胞因子(人il-1β、il-2、il-4、il-5、il-6、il-10、il-12(p70)、il-13、 il17,ifn-γ和tnf-α)。
43.okt3组:高剂量(10μg)注射ip的okt3-ip可诱导产生多种细胞因子,包括il-1β、 il-2、il-4、il-5、il-6、il-10和ifn-γ,其浓度在5h的试验时程内逐渐增加;另外还诱导了tnf-α的产生,但其峰值出现得较早(在1h时)。接受高剂量okt3之iv 注射的hu-scid小鼠在1h后被处死,因此在这个时间点之后的细胞因子无法进行检测。无论以ip还是iv的方式注射2μg okt3,在任何时间点都很少检测到诱导的细胞因子。
44.igg对照组:未见细胞因子变化。
45.pr2005治疗组:
46.在人源化小鼠静脉注射pbmc后的第8天和第9天(给予抗体注射前的48小时和24 小时),(5mg/kg)候选药物pr2005以ip的方式注射给动物。使用pr2005之后,动物在接受okt3后没有出现明显的体温变化。在pr2005和okt3同时使用的动物组,血液中细胞因子的浓度也大幅度的低于仅使用okt3的动物。结果详见表1-表4。
47.表1.注射okt3后诱导出现的hu-scid小鼠直肠温度下降。数据为每组动物的均值。与同一时间点的对照组相比。
[0048][0049]
表2.注射okt3后诱导的细胞因子。对hu-scid小鼠注射10μg okt3 ip(黑色条)或 igg对照ip(灰色条)。分别于1h、2h、5h采血,测定循环细胞因子浓度。分析方法的灵敏度(检测限)为1ng ml-1
。数据表示为每组动物的均值。与同一时间点的对照组相比。
[0050][0051]
表3.给予抗体注射前的48小时,(5mg/kg)候选药物pr2005以ip的方式注射给动物。分别于1h、2h、5h采血,测定循环细胞因子浓度。分析方法的灵敏度(检测限)为1 ng ml-1
。数据表示为每组动物的均值。与同一时间点的对照组相比。
[0052][0053]
表4.给予抗体注射前的24小时,(5mg/kg)候选药物pr2005以ip的方式注射给动物。分别于1h、2h、5h采血,测定循环细胞因子浓度。分析方法的灵敏度(检测限)为1 ng ml-1
。数据表示为每组动物的均值。与同一时间点的对照组相比。
[0054][0055]
结论:试验结果显示pr2005可以在动物模型上抑制okt3引起的免疫风暴。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。