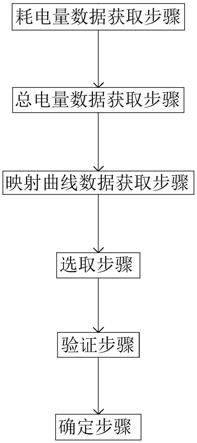
1.本发明涉及生物医学技术领域,具体涉及一种微流控装置及其制备方法、应用。
背景技术:
2.外泌体是由体内或体外培养的几乎所有类型的细胞分泌的具有脂质双层膜结构的囊泡,存在于几乎所有体液中,如血浆、胆汁、尿液、母乳、唾液、胸腔积液、淋巴、胃酸、支气管肺泡灌洗液、脑脊液、眼泪、精液、滑膜液、羊水、腹水、鼻分泌物和子宫抽吸液等。外泌体是通过内体膜途径的内陷产生的,外形呈杯状,直径为30
‑
150nm,密度为1.13
‑
1.19g/ml。
3.几乎所有的细胞在生理和病理状态下都能产生外泌体,并随多泡体的胞吐作用而释放。因此可以从患者体液中收集或从自身供体细胞培养分离外泌体。此外,外泌体具有分泌细胞的特性,可以通过外泌体特征的分析获知患者的生理病理状态。外泌体的储存简单方便,在4℃条件下即可保存较长时间。
4.外泌体作为一种生物信息载体,其实际价值如同血浆、血清、尿液、脑脊液、胸水、腹水等,但其分离纯化的特异性及效率却是影响其应用的重要问题。目前外泌体的提取方法按照不同的分离原理有:超速离心沉淀法、磁珠免疫分析法、聚合物沉淀法和尺寸排阻法。
5.外泌体的分离和提纯是分步进行,不仅操作繁琐,影响效率,而且容易导致外泌体污染。超速离心沉淀法提取外泌体费时费力、提取效率较低、对外泌体损伤较大、提取的外泌体容易受到蛋白质的污染且提取纯度较低;磁珠免疫分析法所需成本较高且外泌体与磁珠的分离过程非常耗时,可能需要超过一天才能达到最佳回收率;聚合物沉淀法分离的外泌体杂蛋白质较多、难以去除聚合物、试剂也较昂贵。尺寸排阻法是利用外泌体的直径小于细胞、微泡及凋亡小体,可以通过基于大小的分离技术来分离外泌体,尺寸排阻法比超速离心更快,且不需要特殊设备。目前基于尺寸排阻的外泌体分离技术主要有超滤和色谱;其中,超滤方法难以去除污染的蛋白质;施加压力使样品通过滤过膜时,可能导致外泌体结构功能受到影响,从而影响下游分析结果;色谱方法不仅设备昂贵,且色谱通常与超速离心或其他技术相结合使用,以纯化最终外泌体制剂。
技术实现要素:
6.本发明的目的在于提供一种微流控装置,解决现有外泌体分离方法导致分离纯度低、对外泌体损伤大、效率低、成本高的问题,且能够实现外泌体的分离提纯与检测一步操作完成,避免外泌体污染,且操作简单方便。
7.此外,本发明还提供上述微流控装置的制备方法、应用。
8.本发明通过下述技术方案实现:
9.一种微流控装置,包括孔板,所述孔板上设置有若干反应孔;
10.所述反应孔内从上到下依次设置有分子筛和生物传感器组件,所述分子筛上设置有若干第一微孔;所述生物传感器组件包括电极板,所述电极板上设置有若干第二微孔,所
述电极板上安装有对电极、工作电极和参比电极,所述电极板和分子筛之间形成反应池,通过分子筛和电极板上微孔的过滤作用,确保反应池内只含有待分离生物体;
11.所述工作电极上固定有用于检测生物体的电化学发光标记探针或标记抗体。
12.本发明首先采用基于粒子大小的尺寸排阻方法设计的分子筛和微孔筛(电极板)组合,在分子筛(第一微孔)和微孔筛(第二微孔)之间形成反应池,通过分子筛和电极板上微孔的过滤作用,确保反应池内只含有待分离生物体,具有高效、简便、杂质少、高通量和对外泌体损伤小等优点;其次,本发明通过微流控制,将反应池中的分离液换成生物体裂解液,使生物体内部分子得以充分释放,并在反应池中与检测分子充分反应,最后本发明采用生物传感器将生物体内含物与固定在工作电极上的锚定探针/抗体(电化学发光标记探针和标记抗体)的结合强弱转换为电信号,通过电信号实现生物体的定量检测。
13.本发明在使用时液体从孔板上方流入,从孔板下方留出,孔板上每个微孔的结构均相同,即液流从分子筛侧流入,从生物传感器侧流出。本发明所述电化学发光标记探针和标记抗体用于检测反应使用,所述工作电极、对电极和参比电极,供收集传输电信号使用。
14.本装置适用于外泌体的分离检测。当本发明所述装置适用于外泌体分离纯化和检测鉴定时,根据外泌体的特性和尺寸设计对应的电化学发光标记探针和标记抗体,以及分子筛和微孔筛即可。
15.进一步地,第二微孔的孔径小于第一微孔的孔径,所述分子筛用于截留尺寸大于待分离生物体的物质,所述电极板用于截留待分离生物体且通过尺寸小于待分离生物体的物质。
16.进一步地,待分离生物体包括外泌体。
17.进一步地,当所述待分离生物体为外泌体时,第一微孔的孔径为150
‑
200nm,第二微孔的孔径小于30nm。
18.进一步地,工作电极上固定有多种电化学发光标记探针,多种电化学发光标记探针上分别设置有不同的标记物。
19.进一步地,当所述待分离生物体为外泌体时,其中一种电化学发光标记探针上设置有钌联吡啶衍生物作为标记物。
20.上述的钌联吡啶衍生物仅仅为本发明的例举的一种标记物,其他标记物同样适用于本发明。
21.进一步地,工作电极上固定有多种标记抗体,多种标记抗体上分别设置有不同的标记物。
22.进一步地,当所述待分离生物体为外泌体时,其中一种标记抗体上设置鲁米诺还原纳米银作为标记物。
23.上述的鲁米诺还原纳米银仅仅为本发明的例举的一种标记物,其他标记物同样适用于本发明。
24.一种微流控装置的制备方法,包括以下步骤:
25.s1、根据待分离生物体的性质分别制备电化学发光标记探针和标记抗体;
26.s2、根据待分离生物体的尺寸分别制备分子筛和电极板;
27.s3、组装生物传感器组件,并完成分子筛和生物传感器组件的安装,将生物传感器组件与控制单元电连接。
28.一种微流控装置的应用,用于生物体的分离和检测,所述生物体包括外泌体。
29.本发明与现有技术相比,具有如下的优点和有益效果:
30.1、本发明的设计有效结合了外泌体的分离纯化和检测鉴定系统为一体,可通过一步法完成复杂血液样品、尿液样品等各类体液样品的外泌体定量检测。
31.2、发明的设计可以保证外泌体的纯度,以及对外泌体的损伤达到最小化,由此可以更为精确地检测外泌体的内含物的量。
32.3、本发明设计有多重锚定探针/抗体,可以同时检测多种外泌体内含物。
33.4、本发明所述微流控装置的适用范围广,可用于除了外泌体之外的其他生物体的分离提纯和/或检测。
附图说明
34.此处所说明的附图用来提供对本发明实施例的进一步理解,构成本技术的一部分,并不构成对本发明实施例的限定。在附图中:
35.图1为微流控装置的整体结构示意图;
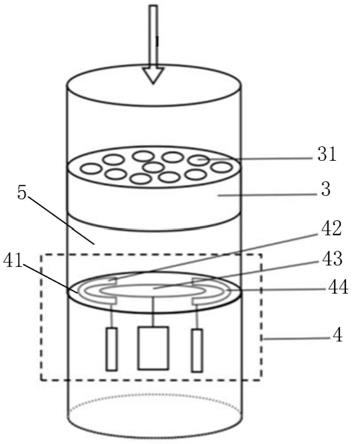
36.图2为微流控装置的单个反应孔的结构示意图;
37.图3为微流控装置的分子筛的工作原理模式图;
38.图4为微流控装置的生物传感器核酸类内含物检测示意图;
39.图5为微流控装置的生物传感器抗原/抗体类内含物检测示意图
40.图6为微流控装置的生物传感器的检测信号示意图;
41.图7为外泌体的透射电镜图;
42.图8为外泌体所含microrna的二代测序热图;
43.图9为mir
‑
135家族成员在患者血清和对照者血清中的表达谱图。
44.附图中标记及对应的零部件名称:
[0045]1‑
孔板,2
‑
反应孔,3
‑
分子筛,4
‑
生物传感器组件,5
‑
反应池,31
‑
第一微孔,41
‑
电极板,42
‑
对电极,43
‑
工作电极,44
‑
参比电极,45
‑
电化学发光标记探针,46
‑
标记抗体。
具体实施方式
[0046]
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
[0047]
实施例1:
[0048]
能够发出荧光信号的标记物很多,在本实施例中就不一一例举,本实施例以钌联吡啶衍生物作作为电化学发光标记探针45的标记物进行说明;能够发生发光反应的记物很多,在本实施例中就不一一例举,本实施例以鲁米诺还原银纳米作为标记抗体46的标记物进行说明。
[0049]
如图1
‑
图2所示,一种微流控装置,包括孔板1,所述孔板1上设置有若干反应孔2;
[0050]
所述反应孔2内从上到下依次设置有分子筛3和生物传感器组件4,所述分子筛3上设置有若干第一微孔31;所述生物传感器组件4包括电极板41,所述电极板41上设置有若干第二微孔,所述电极板41上安装有对电极42、工作电极43和参比电极44,所述电极板41和分
子筛3之间形成反应池5,通过分子筛3和电极板41上微孔的过滤作用,确保反应池5内只含有待分离生物体;
[0051]
所述工作电极43上固定有用于检测生物体的电化学发光标记探针45或标记抗体46。
[0052]
本实施例以待分离生物体为外泌体进行说明:
[0053]
第一微孔31的孔径为150
‑
200nm,第二微孔的孔径小于30nm;电化学发光标记探针45上设置有钌联吡啶衍生物作为标记物;标记抗体46上设置鲁米诺还原纳米银作为标记物,生物传感器的化学反应为氧化
‑
还原反应。
[0054]
所述第一微孔31为纳米孔,可以阻挡细胞、囊泡、凋亡小体等直径大于外泌体的生物成分;而直径过小的蛋白质类、脂类、核酸类成分随液体流动通过生物传感组件上的第二微孔。另外,生物传感组件上分布有工作电极、对电极和参比电极,供收集传输电信号使用。
[0055]
本实施例分离纯化外泌体的原理如图3所示,液流从孔板1的上方流入,细胞(平均直径10
‑
20um)、囊泡(直径100
‑
1000nm)和凋亡小体(直径0.5
‑
5um)均被拦在分子筛3上方,而外泌体(直径30
‑
150nm)和蛋白质、核酸、脂质等可以通过分子筛3。更进一步,蛋白类分子、核酸类分子和脂质随不断的液流流出电极板41上的第二微孔,仅留下外泌体存在于分子筛3与电极板41之间的反应池5内。
[0056]
本实施例的电化学发光生物传感器的工作(检测)原理如图4和图5所示,当分子筛3与生物传感器组件4之间只有外泌体时,从液流方向上加入外泌体裂解液,使外泌体内成分释放,并在分子筛3与电极板41之间的反应池5内发生反应。外泌体内核酸类成分通过分子杂交原理与固定在工作电极上的电化学发光标记探针45结合,发出荧光信号,进一步转换为电信号,由生物传感器收集并量化,如图4所示。外泌体内蛋白类成分通过抗原
‑
抗体的免疫亲和原理与固定在工作电极上的标记抗体46结合,发生发光反应,转换为电信号由生物传感器采集,如图5所示。
[0057]
本实施例采集的数据显示形式如图6所示,生物传感器组件4采集的由电化学发光转换过来的电信号经电极传输给计算机,经换算转化为量化的柱形图。其中,不同的柱子代表不同探针/抗体检测到的不同核酸/蛋白,柱高为其各自的含量。也就是说,经过优化,本实施例所述的微流控装置可同时检测微量样本外泌体中的多种内容物成分含量。
[0058]
本实施例首先采用基于粒子大小的尺寸排阻方法设计了分子筛3和微孔筛(电极板41)组合,将直径在30
‑
150nm的外泌体从细胞、囊泡、凋亡小体和蛋白、核酸、脂质中分离出来,具有高效、简便、杂质少、高通量和对外泌体损伤小等优点。其次,通过微流控制,将反应池中的分离液换成外泌体裂解液,使外泌体内部分子得以充分释放,并在反应池5中与检测分子充分反应。最后,本实施例采用电化学发光生物传感器,将外泌体内含物与固定在工作电极上的锚定探针/抗体(电化学发光标记探针45和标记抗体46)的结合强弱转换为电信号,绘制出直方图,图形中的柱高与样品中外泌体内含物的量呈正相关。
[0059]
因此,本实施例分离的外泌体纯度高,对外泌体损伤小,可尽可能保留外泌体的原始形态;还能将外泌体的提取与分析结合,具有自动化、一体化、操作简单的特点。
[0060]
本实施例所述微流控装置的制备方法,包括以下步骤:
[0061]
s1、根据待分离生物体的性质分别制备电化学发光标记探针45和标记抗体(46);
[0062]
制备电化学发光标记探针45:将钌联吡啶衍生物作为标记物,连接到dna探针上制
成电化学发光探针,将其自组装到金电极上构成新型电化学发光传感器,根据杂交前后电化学发光信号强度的不同进行目标序列的检测:
[0063]
联吡啶钌的合成与活化:在烧瓶中加入1.996g rucl3 xh2o和3.162g 2,2'
‑
联吡啶,加入200ml乙二醇,加热回流6h后,冷却至室温,用丙酮和乙醚溶液萃取、抽滤,再用无水乙醇冲洗3次,得到氯化二联吡啶钌。取制得的ru(bpy)2cl2 1.28g、nahco3 1.28g和4,4'
‑
二羧基
‑
2,2'
‑
联吡啶0.96g,加到80ml甲醇溶液中。将混合液于三口烧瓶中加热回流4h,用hcl调节至ph 4.4,抽滤混合物后,再用甲醇冲洗3次。取16.0g napf6溶于112ml水中,加入到上述滤液中,反应生成沉淀,过滤并干燥,得到二联吡啶
‑
4,4'
‑
二羧基
‑
2,2'
‑
联吡啶合钌六氟磷酸盐(ru(bpy)2(dcbpy)(pf6)。
[0064]
在烧杯中加入10ml含1.532g上述产物的二甲亚砜溶液,再加入15ml含0.46g edc和0.238g nhs的二甲亚砜溶液,搅拌反应2h,得到活化的ru(bpy)2(dcbpy)nhs。
[0065]
制备标记抗体46:
[0066]
一步法合成鲁米诺还原银纳米:在剧烈的搅拌作用下,将3ml5mmol
·
l
‑
1agno3水溶液加入到装有由9ml无水乙醇和5ml蒸馏水组成的混合溶液的圆底烧瓶中,随后再将0.5ml0.01mol
·
l
‑
1鲁米诺溶液(溶于0.1mol
·
l
‑
1naoh)迅速加入混合溶液中去。然后将烧瓶保持在室温剧烈搅拌下反应2h。等待混合溶液颜色由无色到淡黄色,再到深黄色即得到鲁米诺还原纳米银。
[0067]
鲁米诺还原纳米银标记抗体的制备:将25μl含有1mg
·
ml
‑
1目标抗原的pbs(0.010mol
·
l
‑
1,ph7.4)加入到1ml鲁米诺还原纳米银(用0.1mol
·
l
‑
1naoh将ph调至6.5),随后在37℃下旋转混合孵育30min。然后,加入250μl5%bsa,继续孵育5min。将混合物在12500rpm下离心30min,除去上清液,将离心管下方沉淀物重新溶解于250μlpbs中。
[0068]
竞争型免疫传感器的制备:将金电极在金相砂纸上打磨后,用al2o3悬浊液将电极抛光成镜面,依次于30%的硝酸溶液、无水乙醇和水中各超声5min,于空气中晾干备用。将处理好的金电极浸入含有5.0mmol
·
l
‑
1 1,3
‑
丙二硫醇的乙醇溶液中,并在室温下孵育20h。取出后用乙醇和蒸馏水冲洗后,在金电极表面得到富含巯基的自组装层。采用柠檬酸钠还原氯金酸方法制备16nm的纳米金。将电极浸入所合成的纳米金溶液中,在4℃冰箱中放置过夜,取出后用蒸馏水洗净。随后,滴加30μl含有50μg
·
ml
‑
1目标抗原单克隆抗体的pbs(0.010mol
·
l
‑
1,ph7.4)到电极上,37℃下孵育2h。再将30μl5%bsa溶液滴加到电极上封闭1h,以减少非特异性吸附,蒸馏水冲洗后,4℃备存待用。
[0069]
免疫反应过程和电化学发光检测:将制备的免疫传感器置于20μl样品和10μl鲁米诺还原纳米银标记的目标抗原的混合溶液孵育1.5h,以完成免疫竞争反应。处理后的免疫传感器工作电极与铂对电极,ag/agcl参比电极组成三电极体系,置于含有1.5mmol
·
l
‑
1h2o2的pbs(0.050mol
·
l
‑
1,ph10.5)的检测池中。使用阶跃脉冲法在工作电极上处施加0.8v电压,脉冲周期30s,脉冲时间1s,初始脉冲电压0v,测定电化学发光信号强度,所有样品均平行测定5次。
[0070]
s2、根据外泌体的尺寸分别制备分子筛3和电极板41;
[0071]
s3、组装生物传感器组件4,并完成分子筛3和生物传感器组件4的安装,将生物传感器组件4与控制单元电连接,所述控制单元为计算机。
[0072]
实施例2:
[0073]
实施例1微流控装置用于外泌体的分离和检测。
[0074]
收集肝癌患者血清样本,将2ml血清通过0.22um孔径滤膜过滤,去除细胞碎片、囊泡、凋亡小体等。进一步采用可截留100kd分子量的超滤管,4摄氏度低温离心3500g,15分钟,留取浓缩上清中的外泌体,得到外泌体浓缩液,pbs反复洗涤3次,最终按后续实验要求定容至一定体积,得到外泌体悬液。上述处理过程与本实施例所述装置的原理相同。
[0075]
首先,通过透射电镜进行外泌体的形态学和粒径大小的鉴定。于4℃条件下,取上述分离纯化外泌体浓缩液10μl,加入等体积平衡盐pbs溶液稀释,滴加于直径2mm的载样铜网上,于室温静置1分钟后,用滤纸将多余液体轻轻吸去;用3%磷钨酸钠溶液(ph 6.8)室温负染5min,用双蒸水轻轻洗一遍后室温晾干2min;于120kv电压下透射电镜观察并照相。各视野区随机选取20个外泌体测量其直径。电镜照片如图7所示,外泌体呈现典型的杯子样形态,双层膜构成,内部染色较浅,外部染色较深,大小在30
‑
100nm之间。此外,冷冻电子显微镜下可以不使用染色及化学固定的方法,观察到最接近生物活性的外泌体,断层成像及图像的三维重构技术还可以帮助研究者观察到外泌体更复杂的结构。
[0076]
其次,用bca法测定外泌体蛋白质浓度。将牛血清白蛋白bsa(2g/l)梯度稀释成0.125,0.25,0.5,1.0,2.0g/l,制作标准曲线;将待测蛋白样本进行稀释,使其浓度处于标准曲线范围内;将试剂盒中的solution a和solution b按体积为50:1混合,配制bca工作液;分别将2μl各稀释浓度的牛血清白蛋白标准溶液和待测样本依次加入至96孔板中;按照蛋白质溶液与工作液比例为1:20,加入40μl bca工作液。每个样品设置3个复孔;将加好液体的孔板恒温孵育0.5h,待其冷却达室温水平;选择波长为562nm处测吸光度值,空白对照为不含bsa的样本;根据吸光度值绘制标准曲线,计算样本中的蛋白浓度。
[0077]
接下来,提取外泌体中rna成分,进行高通量二代测序(图8)和实时荧光定量聚合酶链式反应(图9)的检测。肿瘤来源的外泌体中不仅携带蛋白质,还携带有大量核酸成分,其中的microrna常常可以作为肿瘤标志物用于肿瘤的辅助诊断,对肿瘤的发生发展有着重要的作用。外泌体microrna也是目前研究的热点之一,对于肿瘤的诊断及预后监测均有着重要的作用。实时荧光定量pcr技术,采用taqman荧光探针,在pcr扩增期间荧光产物与pcr产物成同步增加,可以动态监测特异性产物的量。而二代测序,可以高通量检测外泌体中已知和未知的所有microrna成分,将其表达谱绘制成热图,使研究者一目了然地获知外泌体中microrna成分的情况。
[0078]
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。