用于核医学和放射引导医学的诊断/治疗用途的放射性药物
背景技术:
1.放射性药物(也称为放射性示踪剂或放射追踪器)是包括一种或多种能够发射辐射的放射性同位素的药物。
2.放射性示踪剂可用于肿瘤的放射引导手术(rgs),即利用放射性示踪剂发射的辐射来区分癌症组织和周围健康器官,从而改善肿瘤切除过程的外科技术。放射性示踪剂优先被肿瘤细胞捕获,这种肿瘤细胞由一个能够检测到放射性示踪剂发出的辐射的装置来识别,称为探针。rgs允许外科医师实时评估肿瘤切除的完整性,将健康组织的切除量降到最低。
3.对于切除肿瘤块是唯一治疗选择的肿瘤患者来说,rgs可能对患者的生存至关重要。
4.传统上,rgs是基于发射γ辐射的放射性药物和对这种辐射敏感的特定探针的组合。尽管γ辐射的rgs被广泛验证,但目前这种技术的临床应用仅限于结肠癌(放射免疫引导手术)、恶性黑色素瘤和乳腺癌的前哨淋巴结定位、甲状旁腺瘤和一些骨肿瘤的鉴定。使用γ射线发射体的rgs的主要限制实际上是γ射线的高穿透力。由于这些射线可以穿过大量的组织,肿瘤周围的健康组织对放射性示踪剂的每一次可能的吸收都会导致不可忽视的背景辐射(与来自肿瘤病灶的信号相当或更高),这可能会阻碍该技术的应用。出于同样的原因,医务人员可能会受到相当大剂量的辐射,除非给予非常低剂量的放射性示踪剂。因此,γ射线的rgs不能应用于许多肿瘤,例如脑瘤(考虑到健康大脑的高吸收率)、腹部肿瘤(尤其是靠近肾脏、膀胱和肝脏的肿瘤,因为这些器官对示踪剂的吸收量很大)和儿科肿瘤(由于体积小,器官之间的距离非常短)。
5.rgs也与β
辐射发射体组合应用。然而,检测β
放射性药物发射体的探针的实施和使用是复杂的,因为这种探针必须屏蔽γ射线,然而当发射的β
正电子通过与身体组织的电子相互作用而湮灭时,就会产生γ射线。由于这个原因,使用β
的rgs的开发从未通过临床前阶段。
6.最近,为了克服上述用γ或β
辐射进行rgs的局限性,已有提议在rgs中使用纯电子发射体的放射性示踪剂,即β
‑
粒子。β
‑
辐射只穿透组织几毫米,而且根据使用的放射性核素,可能基本没有γ污染。此外,特定的β
‑
探针是紧凑且易于处理的。此外,与传统的γ或β
放射性示踪剂的给药量相比,用β
‑
的rgs以给予较低量的β
‑
放射性示踪剂的也是有效的,因此允许在肿瘤病灶周围的健康组织中以较低的背景进行操作,并为肿瘤病灶的边缘提供更清晰的划分。这使得rgs的应用范围在周围健康器官大量吸收的情况下也得以扩大。较低的吸收剂量和较短的电子(β
‑
辐射)作用范围意味着医疗和辅助医务人员的辐射暴露几乎可以忽略不计。
7.β
‑
‑
示踪剂放射性引导手术(β
‑
‑
rgs)的验证和适用性严格取决于β
‑
发射的放射性药物的可用性,而目前这一点非常有限。
8.因此,需要开发能够发射显示出优先被肿瘤组织/病灶吸收的β
‑
辐射的放射性药物,其必须通过rgs进行切除并且显示出用于给予人类的最佳药代动力学特征。
9.发明目的
10.本发明的目的是提供一种适合用于进行放射引导手术、影像诊断、放射代谢治疗以及其他应用的放射性药物,特别是发射β
‑
的放射性药物。
11.本发明的目的还在于提供包含所述放射性药物的组合物,特别是发射β
‑
的放射性药物。
12.最后,本发明的目的是提供所述放射性药物的用途和应用,特别是发射β
‑
的放射性药物。
13.本发明的目的还在于提供放射性药物和包含它的组合物,通过适当改变放射性金属,其可用于pet和spect影像诊断。
技术实现要素:
14.这些和其他目的是通过式i化合物实现的:
[0015][0016]
其中a是键合到能够键合l的苄基胍(bg)的间位或对位的锚定部分,l是接头部分,bfc是双功能螯合剂,me是发射辐射或非发射辐射的金属阳离子。特别优选发射β
‑
辐射的金属阳离子。
[0017]
或者,所述金属阳离子是发射γ或β
辐射的金属阳离子。特别地,参考式i:
[0018]
a是锚定部分,选自甲酰胺、苯胺、醚、胺和磺酰胺官能团,优选它是键合到bg的间位或对位的甲酰胺;
[0019]
l是接头部分,其为二氨基烷基链或二氨基聚乙二醇链,优选乙二胺链;
[0020]
bfc是双功能螯合剂,选自四氮杂环十二烷
‑
四乙酸(dota)、1,4,7
‑
三氮杂环壬烷
‑
n,n
′
,n
″‑
三乙酸(nota)和二亚乙基三氨基五乙酸(dtpa),优选dota;
[0021]
me是发射辐射或非发射辐射的金属阳离子。如果金属阳离子是纯β
‑
发射体,优选为
90
y
3
。如果放射性金属是非纯β
‑
发射体,例如选择
177
lu
3
。如果金属阳离子是β
发射体,例如选择
86
y
3
和
68
ga
3
。如果金属阳离子是γ发射体,例如选择
111
in
3
。如果金属阳离子是非发射辐射金属阳离子,优选选择
89
y
3
。
[0022]
本发明的一个目的是具有式i的化合物,其中a是选自酰胺、苯胺、醚、胺和磺酰胺
的锚定部分,与苄基胍(bg)间位或对位键合;l是选自长度为2至6个亚甲基单元的二氨基烷基链和长度为2至6个乙二醇单元的二氨基聚乙二醇链的接头部分;bfc是选自dota、nota、teta和dtpa的双功能螯合剂;me是发射辐射的金属阳离子,选自
90
y
3
、
177
lu
3
、
86
y
3
、
68
ga
3
和
111
in
3
,或其他非发射辐射的金属阳离子,例如
89
y
3
。
[0023]
正如在实验部分可以观察到的,式i化合物,即本发明的化合物,主要是纯β
‑
放射性示踪剂,已经证明对于过度表达去甲肾上腺素转运体(net)的儿茶酚胺高分泌型肿瘤,以及其他应用(例如,治疗应用,通过适当改变放射性金属,还有诊断应用)具有惊人的效果。
[0024]
本发明的化合物由五种主要成分组成(将在下文详细描述):对一些类型的肿瘤细胞具有选择性功能的苄基胍部分、发射β
‑
辐射的金属阳离子me、双功能螯合剂(bfc)、接头部分l(即接头)和锚定部分a,后两者可用于将苄基胍部分键合到双功能螯合剂bfc。
[0025]
本发明的化合物是纯β
‑
放射性发射体并且是去甲肾上腺素(ne)轴突运载体的优先底物。因此,本发明的化合物将优先被过表达net(儿茶酚胺高分泌)的肿瘤细胞捕获。其中有许多神经内分泌肿瘤,如嗜铬细胞瘤、副神经节瘤、类癌瘤和神经母细胞瘤,其将从通过β
‑
‑
rgs的完全切除以及利用正电子发射断层摄影术(pet)的影像诊断监测中显著获益。由过表达net的肿瘤细胞优先摄取可能是由于本发明化合物中所含的苄基胍与神经激素ne的结构类似,ne是net的内源性底物。
[0026]
当适当选择金属阳离子时,本发明的化合物能够发射β
‑
辐射,因为其可以具有三价放射性金属(me
3
),其通过衰减发射β
-
辐射。me更优选为
90
y
3
,因为它的半衰期特征(64小时)、能谱(~2mev)和无伴随的γ衰变(纯发射体)使它非常适合用于β
‑
‑
rgs。金属阳离子
90
y
3
通常用于核医学的治疗目的,例如用于利用β
‑
发射的具有标记肽(prrt,肽受体放射性核素治疗)的受体放射代谢治疗。金属阳离子
90
y
3
从未与作为β
‑
放射性示踪剂的使用有关,可用于在net
‑
阳性肿瘤的rgs方法中对肿瘤病灶的定位。因此,本发明的化合物首次证明了包含在式i化合物中的金属阳离子
90
y
3
在过表达net的肿瘤的放射引导手术(rgs)中作为β
‑
放射示踪剂的有效性。
[0027]
在替代实施方式中,me可以是不发射辐射的金属阳离子,例如
89
y
3
。本发明的化合物包含这种金属,因此是“冷”化合物,即未标记的,并且可用于表征本发明的化合物,因为它具有化学
‑
物理和化学
‑
生物学特性,例如药代动力学和药效动力学特性,与本发明的标记化合物的那些性质一致。三价金属阳离子me替代性地可以是用于诊疗(teragnostic)应用(利用β
‑
发射的放射代谢疗法和利用γ发射的现代spect成像)的
177
lu
3
,用于利用β
发射的pet成像应用的
86
y
3
和
68
ga
3
,用于利用γ发射的spect成像应用的
111
in
3
。
[0028]
由于双功能粘合剂bfc(“双功能螯合剂”),金属阳离子me通过配位键与本发明的化合物键合。bfc是指具有螯合金属阳离子和同时有利地共价键合功能部分的双重功能的分子。在本发明化合物的情况下,功能部分是苄基胍;这种功能部分通过锚定部分a和接头部分l与bfc键合。根据本发明优选的双功能螯合剂bfc是dota(四氮杂
‑
环十二烷四
‑
乙酸)。对本发明的三价金属阳离子目标有利的其他双功能螯合剂bfc(
90
y
3
、
68
ga
3
、
86
y
3
、
89
y
3
、
177
lu
3
和
111
in
3
),因为它们在标记效率和所得螯合物的整体化学/代谢稳定性方面更好,是dota的线性或环状类似物,以及1,4,7
‑
三氮杂环壬烷
‑
n,n
′
,n
″‑
三乙酸(nota)、四氮杂环十四烷
‑
1,4,8,11
‑
四乙酸(teta)和二亚乙基三氨基五乙酸(dtpa)。
[0029]
接头部分l是避免金属螯合剂和苄基胍之间的干扰(例如,空间和/或功能干扰)的
任何部分。优选地,当bfc是dota时,接头部分l是乙二胺部分。根据本发明的化合物,可以使用其他接头部分l,例如长度为2至6个亚甲基单元的二氨基烷基链、长度为2至6个乙二醇单元的二氨基聚乙二醇链。接头部分l优选与双功能螯合剂bfc和锚定部分a共价键合,例如,当所述接头部分l是乙二胺部分并且所述双功能螯合剂bfc是dota时,通过酰胺键。
[0030]
锚定部分a是与本发明化合物的苄基胍间位或对位键合的官能团。锚定部分a将接头部分l与苄基胍结合。锚定部分a可以是各种性质的化学基团,并且可以取决于接头部分l。根据本发明化合物的有用的锚定部分a的实例是酰胺、苯胺、醚、胺和磺酰胺基团;优选地,锚定部分a是酰胺基团。
[0031]
在一个优选的实施方式中,本发明的化合物是式ii的化合物:
[0032][0033]
其中,关于通式i,me是发射辐射或不发射辐射的金属阳离子,例如纯发射β
‑
辐射的金属阳离子,例如
90
y
3
。在一个替代实施方式中,me可以是非放射性金属阳离子,例如
89
y
3
,其可用于本发明化合物的化学
‑
物理和化学
‑
生物表征。在另外的替代性实施方式中,me可以是用于诊疗应用(利用β
‑
发射的放射代谢疗法和利用γ发射的现代spect成像)的金属阳离子
177
lu
3
,用于pet利用β
发射的pet成像应用的
86
y
3
和
68
ga
3
,和最后,用于利用γ发射的spect成像应用的
111
in
3
。
[0034]
式ii化合物是式i化合物,其中锚定部分a是与bg间位键合的甲酰胺基团,接头部分l是乙二胺基团且双官能粘结剂bfc是dota。
[0035]
已显示式ii化合物在用于过表达net的肿瘤中特别有效:实际上,式ii化合物,其中me为
89
y
3
,已经在人神经母细胞瘤系sk
‑
n
‑
sh上测试了与3h
‑
ne的竞争实验,显示出对3h
‑
ne摄取的剂量依赖性抑制(ic
50
~10μm),在高达最高测试浓度(100μm)时没有明显的剂量依赖性细胞毒性作用。
[0036]
此外,式ii的化合物,其中me是
90
y
3
,然后已经以>99%的放射性标记产率和>99%的放射化学纯度制备。
[0037]
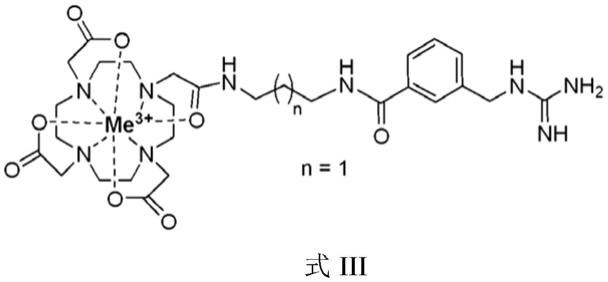
在一个实施方式中,本发明的化合物是式iii的化合物:
[0038][0039]
其中,关于式iii,me为发射辐射或不发射辐射的金属阳离子,例如纯发射β
‑
辐射的金属阳离子,如
90
y
3
,锚定部分a为间位键合bg的甲酰胺基团,当n等于1时,接头部分l是丙二胺基团,因此包含3个亚甲基单元,且双功能粘结剂bfc是dota。
[0040]
在一个替代实施方式中,me可以是非放射性金属阳离子,例如
89
y
3
,其可用于本发明化合物的化学
‑
物理和化学
‑
生物表征。
[0041]
在另外的替代性实施方式中,me可以是用于诊疗应用(利用β
‑
发射的放射代谢疗法和利用γ发射的现代spect成像)的金属阳离子
177
lu
3
,用于pet利用β
发射的pet成像应用的
86
y
3
和
68
ga
3
,和最后,用于利用γ发射的spect成像应用的
111
in
3
。
[0042]
根据另一个事实方式,当n等于2时,化合物为式iv。
[0043][0044]
其中me为发射辐射或不发射辐射的金属阳离子,例如纯发射β
‑
辐射的金属阳离子,如
90
y
3
,锚定部分a为间位键合bg的甲酰胺基团,当n等于2时,接头部分l是丁二胺基团,因此包含4个亚甲基单元,且双功能粘结剂bfc是dota。
[0045]
式iii和iv化合物是式ii化合物的两个优良同系物,具有带3和4个亚甲基单元的接头部分l。根据本发明的式iii和iv化合物在用于过表达net的肿瘤时表现出特别有效:实际上,式iii和iv化合物已经在人神经母细胞瘤系sk
‑
n
‑
sh上测试了与3h
‑
ne的竞争实验,显示出对3h
‑
ne摄取的剂量依赖性抑制:式iii和iv的化合物证明是类似于mibg的net底物,并且在高达最高测试浓度(100μm)时没有细胞毒性作用。
[0046]
因此,本发明化合物是net的底物,并且可以具有多种临床应用,例如根据所选择的金属阳离子me的类型而变化。本发明的化合物,由于是纯β
‑
发射体,实际上可发现其在过表达net的神经内分泌肿瘤(例如嗜铬细胞瘤、副神经节瘤、类癌瘤和神经母细胞瘤)的rgs中的应用。此外,本发明的化合物还可用于相同神经内分泌肿瘤的放射代谢治疗,并且还可用于诊断,特别是影像诊断。例如,当me为放射性金属
68
ga
3
时,本发明化合物可用于net阳性神经内分泌肿瘤的pet成像,而当me为
111
in
3
时,本发明化合物可用于单光子发射计算机
断层摄影术spect成像。另外,当me是
177
lu
3
时,本发明的化合物具有诊疗功能,即治疗和诊断功能,并且除了放射代谢疗法外,还可用于成像目的(spect)和剂量测定评估。
[0047]
因此,本发明的一个目的也是本发明化合物,其用作药物。
[0048]
一个实施方式提供了本发明的化合物,其用于诊断和/或治疗肿瘤,优选治疗过度表达去甲肾上腺素转运体(net)的神经内分泌肿瘤,甚至更具体地用于治疗选自下组的肿瘤:嗜铬细胞瘤、副神经节瘤、类癌瘤和神经母细胞瘤。
[0049]
另一个实施方式提供了本发明化合物,其用作β
‑
放射性示踪剂,优选作为纯β
‑
放射性示踪剂。
[0050]
此外,一个实施方式提供了本发明化合物,其用于放射引导手术(rgs)。有利的是,式i的化合物以及式ii、iii和iv的化合物已证明在通过β
‑
粒子检测的放射引导手术(β
‑
‑
rgs)中特别有效。因此,本发明的一个目的也是本发明的化合物在肿瘤的放射引导手术中的用途,优选通过β
‑
粒子检测(β
‑
‑
rgs)。
[0051]
本发明的一个目的还是患有肿瘤的对象的治疗方法,包括向对象给予有效剂量的本发明化合物,其中所述肿瘤选自过表达net的神经内分泌肿瘤。这种治疗可以提供放射引导手术(rgs)。
[0052]
本发明的化合物可以通过常规技术合成。通用合成方案规定,在胍基水平上保护并在具有锚定部分的间位或对位适当官能化的苄基胍,通过常规偶联方法键合到分别制备的合成子上,该合成子由适当保护并预先键合到接头部分l的bfc构成。偶联后,完全保护的偶联物bfc
‑
la
‑
bg经受最终脱保护步骤,产生游离粘结剂,即不含me的式i化合物,准备好进行最终的放射性标记反应。这种反应在85
‑
115℃,优选90℃的温度下进行,在ph=5.5
‑
6的乙酸铵缓冲液中通过将粘结剂bfc
‑
l
‑
a
‑
bg与要络合的放射性金属的合适的盐进行短时间的孵育,15
‑
40分钟,优选30分钟。当放射性金属为
90
y
3
时,优选的盐为
90
ycl3。
[0053]
本发明的化合物具有与苄基胍间位或对位共价键合的锚定部分a。适当地,所述锚定部分a仅在本发明化合物的合成路线的最后步骤中与由bfc构成的合成子偶联,所述合成子与接头部分l键合,因此允许具有“收敛合成方法”的典型优点,例如高度的合成多功能性与极短的制备时间和成本相关。
[0054]
优选地,可以在不存在me的情况下,即,在一些情况下,在最终的放射性标记之前,合成式i的化合物。这保证了在优化最终螯合物的药代动力学和药效学特性方面的多功能性,高放射化学产率/纯度和短时间,同时减少了辐射防护问题并节省了要纳入的金属me的许多放射性半衰期,对于相同的双功能螯合剂bfc,可以在不同的三价阳离子(
86/90
y
3
、
111
in
3
、
177
lu
3
等)之间变化很大,还包括半衰期短的放射性金属,如
68
ga
3
。
[0055]
本发明的一个目的最终是包含本发明化合物和药学上合适的赋形剂的药物组合物。
[0056]
优选地,这种组合物的特征在于其中进行放射性标记的溶液,其用乙酸铵溶液稀释,该溶液在ph 7.2
‑
7.4下缓冲,含有合适的稳定剂,例如抗坏血酸(优选的一种)、龙胆酸或用于输注的氨基酸溶液,其作为自由基拦截剂抑制化合物的自辐射,在适当的过滤器上过滤以确保其无菌后,将其储存在小瓶中以备静脉内输注。
[0057]
实验部分
[0058]
式ii化合物1的制备
[0059]
式ii化合物1(也表示为
90
y
‑
dota
‑
bg螯合物,化合物1或mc4324)的制备如方案1中所述进行。市售的轮环藤宁(cyclen)2已经通过在室温下与溴乙酸乙酯在二氯甲烷(dcm)中反应转化为单烷基化中间体3。在无水碳酸钾存在下化合物3与溴乙酸叔丁酯在无水乙腈中烷基化反应,然后提供2,2',2
”‑
(10
‑
(2
‑
乙氧基
‑2‑
氧代乙基)
‑
轮环藤宁
‑
1,4,7
‑
三
‑
基)三乙酸三叔丁酯4,然后在室温下用过量的纯乙二胺处理得到合成子a(5)(方案1a)。合成子b(7)的合成已经从市售3
‑
(氨基甲基)
‑
苯甲酸6开始,通过在室温下,在三乙胺(tea)存在下,在无水四氢呋喃(thf)中进行与n,n'
‑
双
‑
叔丁氧基羰基
‑
1h
‑
吡唑
‑1‑
甲脒的胍基化反应(方案1b)。合成子a(5)和合成子b(7)在室温下无水dcm中在n
‑
(3
‑
二甲氨基丙基)
‑
n'
‑
乙基碳二亚胺(edci)、水合1
‑
羟基苯并三唑(hobt)和tea存在下偶联,然后使用三氟乙酸(tfa):三异丙基硅烷(tis):水为95/2.5/2.5(体积/体积/体积)的混合物进行完全脱保护反应,然后产生游离粘结剂9(mc4325)(方案1c)。然后dota
‑
bg偶联物9已在封闭小瓶中在ph 5.5
‑
6乙酸铵缓冲液存在下与略微过量的
89
y(no3)3热络合,以得到式ii化合物的非放射性类似物,也称为“冷示踪剂”(1a,mc4324)。dota
‑
bg偶联物9已最终仍在ph 5.5
‑
6的乙酸铵缓冲液存在下以对于用
90
ycl3热放射性标记大量过量使用(方案1c)以得到式ii化合物(1,mc4324)。
[0060]
方案1
[0061][0062]
试剂和条件:(a)溴乙酸乙酯,dcm,在0℃下2小时
→
室温下22小时;(b)溴乙酸叔丁酯,无水碳酸钾,无水乙腈,室温下4小时;(c)纯乙二胺,室温下65小时;(d)tea,n,n
′‑
双
‑
叔丁氧基羰基
‑
1h
‑
吡唑
‑1‑
甲脒,无水thf,室温下24小时;(e)edci,hobt,tea,无水dcm,室温下25小时;(f)tfa:三异丙基硅烷:水为95:2.5:2.5,从0℃至室温,22小时;g)89y(no3)3,1m乙酸铵缓冲液(ph=5.5
‑
6),90℃下3小时;h)
90
ycl3(0.05m hcl溶液),1m乙酸铵缓冲液(ph=5.5
‑
6),90℃下30分钟。
[0063]
通过使用布鲁克ac 400谱仪,分别在400mhz和100mhz记录了1h
‑
nmr和
13
c
‑
nmr谱图;以δ单位(ppm)记录了相对于用作内部参照的四甲基硅烷(me4si)化学位移。通过使用布鲁克ac 600谱仪,分别在600mhz和150mhz记录式ii化合物(
89
y
‑
dota
‑
bg,化合物1a或mc4324)的1h
‑
nmr和
13
c
‑
nmr谱图。低分辨率质谱已经记录在api
‑
tof mariner透视生物系统(美国德克萨斯州斯特拉特福德)上,样品由哈佛泵以5
‑
10μl/分钟的流速注入到电喷雾系统。高分辨率质谱(hr
‑
ms)已经记录在orbitrap exactive谱仪(赛默飞世尔科技公司(thermo fisher scientific),美国德克萨斯州奥斯汀市)。化合物8,9和
89
y
‑
dota
‑
bg作为
式ii化合物(1a或mc4324)的非放射性类似物的分析型hplc分析已在以下条件下进行:
[0064]
‑
液相色谱仪uhplc accela,配备有泵系统、自动进样器和与质谱仪ltq离子阱相连的配备有esi接口的pda accela检测器(赛默飞世尔科技公司,美国德克萨斯州奥斯汀市);实验数据已通过xcalibur软件(赛默飞世尔科技公司,美国德克萨斯州奥斯汀市)获取、处理和重制;
[0065]
‑
shimadzu nexera液相色谱仪,配备有cbm
‑
20a控制器、四个lc
‑
30ad泵、dgu
‑
20a5r脱气机、spd
‑
m20a pda检测器(标准分析2.50μl半微量池),进样速度:100赫兹;分辨率:4.0nm),cto
‑
20ac外壳的恒温柱和自动进样器sil
‑
30ac;elsd检测器(sedex 90,sedere,法国)与系统串联;实验数据已通过labsolution软件(意大利岛津有限责任公司(shimadzu italia s.r.l.),意大利米兰)获取、处理和重制。
[0066]
作为式ii化合物(1或mc4324)的非放射性类似物的化合物
89
y
‑
dota
‑
bg(1a或mc4324)已经在配备有waters 590型泵、250μl注射器和具有可变波长的uv分光光度检测器和omniscribe纸上记录器的waters半制备液相色谱仪(rp
‑
hplc)上进行纯化。
[0067]
所有化合物都通过tlc和1h
‑
nmr常规控制。tlc是在由铝支撑的硅胶板(默克(merck)dc,alufolien kieselgel 60f254)上进行的,通过uv光或通过使用的kmno4碱性溶液显示斑点。通过使用在约20托(torr)的减压下操作的旋转蒸发器进行了反应和萃取后溶液的浓缩。有机溶液已在无水硫酸钠或无水硫酸镁上干燥。所有化学反应物均购自:西格玛奥德里奇有限责任公司(sigma aldrich s.r.l.)(意大利米兰),tci欧盟交易所(比利时兹韦恩德雷赫特)或铂金埃尔默(perkin elmer)(美国)并具有最高纯度。通常,制备用于物理和生物试验的样品已在p2o5上高真空干燥了20小时,温度在25和40℃之间,取决于样品的熔点。下文描述了化合物1
‑
9的制备和化学
‑
物理表征的实验过程。
[0068]
化合物2
‑
(1,4,7,10
‑
四氮杂环十二烷
‑1‑
基)乙酸乙酯(3)的合成。将溴乙酸乙酯(1.0g;6.0mmol)在dcm(10ml)中的溶液在10分钟内滴加到市售轮环藤宁2(1.36g,7.9mmol)在dcm(16ml)中的溶液,该溶液在冰浴中冷却。2小时后,将反应混合物升至室温,并让其再反应22小时。所得悬浮液被过滤,滤液在减压下蒸发。粗制的、油状的黄色反应产物最终通过快速色谱(从100%的dcm到dcm/甲醇/氨/水为70:30:5:5)纯化,从而得到白色粘稠油状的化合物3(1.61g,79%)。1h
‑
nmr(cdcl3)δppm:1.27(t,j=7.2hz,3h;ch2ch3),2.84(m,8h,ch2),2.95(m,8h,ch2),3.49(m,2h,nch2cooch2ch3),4.16(q,j=7.2hz,3h,c(o)och2ch3).ms(esi):259[m h] 。
[0069]
2,2',2
”‑
(10
‑
(2
‑
乙氧基
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三
‑
基)三乙酸三叔丁酯(4)的合成。向单烷基化轮环藤宁3(0.98g,3.8毫摩尔)在乙腈(35ml)中的溶液中加入无水碳酸钾(3.14g,22.8毫摩尔)。在20分钟内向该悬浮液中滴加溴乙酸叔丁酯(2.22g,11.4毫摩尔)在乙腈(10ml)中的溶液。该悬浮液在室温搅拌4小时。然后通过过滤除去悬浮固体,在减压下蒸发溶剂并最终通过快速色谱(从100%dcm到20%甲醇/dcm)纯化残余物得到白色泡沫状化合物4(1.90g,84%)1h
‑
nmr(cdcl3)δppm:1.15(t,j=7.2hz,3h,c(o)och2ch3),1.33(s,9h,tbu),1.34(s,9h,tbu),1.35(s,9h,tbu),1.80
‑
3.70(非常宽的多峰集,整体对应于24h,ch2),4.04(q,j=7.2hz,3h,c(o)och2ch3).ms(esi):623[m na] 。
[0070]
2,2',2
”‑
(10
‑
(2
‑
((2
‑
氨基乙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸三叔丁酯(5,合成子a)的合成。化合物4(1.31g,2.18毫摩尔)已被溶
于纯乙二胺(2ml,29.9毫摩尔),且所得溶液置于室温下搅拌65小时。在反应结束时,乙二胺已经在减压下除去,残余物真空干燥以得到淡黄色泡沫,其最终通过快速色谱纯化(从100%的dcm到dcm/甲醇为1:1)以提供白色泡沫状化合物5(1.04g,72%)。1h
‑
nmr(cdcl3)δppm:1.38(s,27h,3x tbu),1.48(m,2h,nh2),2.45(m,4h,2xch2),2.63(m,4h,2x ch2),2.72(t,2h,ch2),2.77
‑
2.80(m,8h,4x ch2),2.99(s,2h,ch2),3.17(br s,4h,2x ch2),3.20(s,2h,ch2),3.21
‑
3.27(q,2h,ch2),8.68(t,1h,conh);13c
‑
nmr(cdcl3)δppm:27.68,27.84,36.60,40.03,55.39,55.51,55.90,81.61,81.70,172.17,172.27.ms(esi):637[m na] 。
[0071]
n,n'
‑
双
‑
叔丁氧羰基
‑3‑
胍基甲基
‑
苯甲酸(7,合成子b)的合成。向市售的3
‑
(氨基甲基)
‑
苯甲酸6(1.66mmol,250.0mg)在无水甲醇(16.5ml)和无水thf(16.5ml)的混合物悬浮液中,依次添加tea(6.61mmol,669.4mg,0.92ml)和n,n'
‑
双
‑
叔丁氧羰基
‑
1h
‑
吡唑
‑1‑
甲脒(1.98mmol,615.9mg)且所得混合物被置于室温下搅拌24小时。反应完成后,减压蒸去溶剂,残余物溶于乙酸乙酯,依次用0.1n硫酸氢钾和氯化钠饱和溶液洗涤。因此,有机相已用硫酸镁干燥并在减压下除去溶剂。粗反应产物最终通过在硅胶(biotage isolera )上的快速色谱法通过用氯仿/甲醇0
→
6%混合物洗脱来纯化,以提供白色固体状的中间体7。1h
‑
nmr(dmso
‑
d6)δppm:1.38(s,9h,c(ch3)3),1.49(s,9h,c(ch3)3),4.58(d,2h,nhch2ph
‑
cooh),7.45
‑
7.51(t,1h,ch苯环),7.54
‑
7.56(m,1h,ch苯环),7.83
‑
7.85(m,1h,ch苯环),7.89(s,1h,ch苯环),8.76
‑
8.79(t,1h,nhch2ph
‑
cooh),11.53(s,1h,boc
‑
nh),12.98(br s,1h,cooh).ms(esi):392[m
‑
h]
‑
。
[0072]
2,2',2
”‑
(10
‑
(2
‑
((2
‑
(3
‑
((2,3
‑
双(叔丁氧羰基)胍基)甲基)苯甲酰胺基)乙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸三叔丁酯(8)的合成。向n,n'
‑
双
‑
叔丁氧羰基
‑3‑
胍基甲基
‑
苯甲酸7(0.16mmol,64.0mg)在无水dcm(1.5ml)的溶液中,接连加入hobt(0.21mmol,28.6mg)、edci(0.21mmol,40.5mg)、2,2',2
”‑
(10
‑
(2
‑
((2
‑
氨基乙基)氨基)
‑2‑
氧代乙基)
‑
轮环藤宁
‑
1,4,7
‑
三基)三乙酸三叔丁酯5(100.0mg,0.16mmol)和最后加入tea(0.58mmol,59.2mg,81.6μl),在冰浴中冷却。在室温下约25小时后,蒸发除去溶剂,所得粗产物通过硅胶快速色谱(biotage isolera )纯化用氯仿/甲醇0
→
8%混合物洗脱,以提供白色固体状化合物8(70.5mg,产率=44%)。1h
‑
nmr(cdcl3)δppm:1.35(s,9h,tbu),1.39(s,27h,3x tbu),1.44(s,9h,tbu),1.85
‑
3.65(非常宽的多峰集,整体对应于28h,14xch2),4.60(d,2h,nhch2),7.33
‑
7.36(m,2h,ch苯环),7.99(s,1h,ch苯环),8.15(d,1h,ch苯环),8.49(m,1h,nhch2),8.81(m,1h,conh),9.03(m,1h,conh),11.5(s,1h,bocnh).ms(esi):990[m h] 。
[0073]
2,2',2
”‑
(10
‑
(2
‑
((2
‑
(3
‑
(胍基甲基)苯甲酰胺基)乙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸(9,也表示为mc4325或dota
‑
bg偶联物)的合成。将tfa:三异丙基硅烷:水为95:2.5:2.5v:v:v(6.0ml)的混合物加入中间体8(0.091mmol,90.0mg),在0℃冷却。脱保护反应已在以下分析条件下通过rp
‑
hplc检查:柱:sunfire c18,3.5μm(150*4.6mm id);洗脱液:a)h2o/acn 95/5 0.1%tfa,b)acn 0.1%tfa。梯度洗脱(开始a/b 100/0;1分钟a/b 100/0;15分钟a/b 0/100,20分钟a/b 0/100)。流速:1.0ml/分钟。检测:pda(200
‑
400nm),elsd(t:80℃,p:4巴);t col=30℃;样品溶于meoh。在室温下约22小时后,证明反应完成。因此,溶剂已经蒸发并且残余物与无水dcm(6x 3ml)和无水乙醚(5x 3ml)共蒸发数次。然后将由此获得的粗产物用无水乙醚研磨、过滤并
用无水乙醚在过滤器上洗涤以提供白色固体状的所需化合物9(88.2mg,产率=81%)。1h
‑
nmr(d2o)δppm:2.90
‑
3.75(非常宽的多峰集,整体对应于28h,14x ch2),4.41(d,2h,nhch2),7.43(m,2h,ch苯环),7.62(m,2h,ch苯环)。
[0074]
hr
‑
ms(esi):[c
27
h
43
n9o8 h]
的计算质量=622.3307m/z;测定质量:622.3294m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0075]
螯合物
89
y
‑
dota
‑
bg作为式ii化合物(1a,mc4324)的非放射性类似物的制备。向溶于1ml的1m乙酸铵缓冲液(ph=5.5
‑
6)的粘结剂9(36.0mg,30.2μmol)中加入了市售的盐89y(no3)3·
4h2o(15.7mg,45.3μmol)。然后所得溶液在封闭的小瓶中热搅拌(90℃)3小时。在反应结束时,将混合物置于室温下冷却,然后通过半制备型hplc(条件:柱hypersil ods gold5μm;250x10 mm;洗脱液:meoh/h2o为5:95v/v 0.02%tfa,流速:4.0ml/分钟;uv检测254nm)从过量的盐中纯化粗制螯合物,冻干净馏分后,直到提供白色粉末状固体的“冷”螯合物
89
y
‑
dota
‑
bg 1a(mc4324)(19mg,产率=90%)。1h
‑
nmr(d2o,600mhz,t=5℃)δppm:2.08(d,1h,chh),2.22
‑
2.33(m,5h,2x ch
2 and chh),2.53
‑
2.67(m,7h,3x ch
2 and chh),2.98(d,1h,chh),3.08(d,2h,ch2),3.18
‑
3.40(m,6h,3x ch2),3.43
‑
3.56(m,4h,2x ch2),3.64(m,2h,ch2),4.38(d,2h,
‑
ch2‑
胍),7.43(m,2h,ch苯环),7.60(m,2h,ch苯环)。
13
c
‑
nmr(d2o,150mhz,t=5℃)δppm:180.29,179.71,175.80,169.98,156.53,136.86,133.23,130.63,129.15,129.13,126.19,125.21,65.46,65.32,65.22,63.04,55.64,55.47,55.46,55.35,54.73,54.72,54.59,54.18,43.75,39.20,38.40。
[0076]
hr
‑
ms(esi):[c
27
h
40
n9o8y h]
的计算质量=708.2131m/z;测定质量:708.2124m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0077]
式ii化合物(1,
90
y
‑
dota
‑
bg,mc4324)的制备。通过将30μl市售的0.05m hcl中的
90
ycl3溶液(1.07mci,22.1pmol)加入到132μl的1m乙酸铵缓冲液(ph=5.5
‑
6)中的0.1mm粘结剂9的溶液(13.2nmol)中并通过添加338μl相同的1m乙酸铵缓冲液(ph=5.5
‑
6)使终体积达到500μl制备了式ii(1)的螯合物
90
y
‑
dota
‑
bg。然后将所得溶液置于封闭小瓶中,在屏蔽罩下的加热块上在90℃孵育30分钟。反应结束时,冷却到室温后,收集不同等分的溶液(2
‑
10μl),无需稀释,以评估放射性标记产率并通过itlc进行质量控制。itlc方法使用itlc
‑
sg和itlc
‑
sa安捷伦(agilent)板和不同的洗脱液系统例如1m乙酸铵缓冲液(ph=5.5
‑
6):甲醇(50:50v/v)、1m乙酸铵缓冲液(ph=5.5
‑
6):甲醇:氨33%(50:50:5v/v/v)和0.1m乙酸铵缓冲液(ph=6)中的50mm edta。不同色谱运行的结果一致显示>99%的放射性标记产率和放射化学纯度(图1)。
[0078]
图1描绘了关于用于制备式ii的螯合物
90
y
‑
dota
‑
bg(1或mc4324)的用
90
ycl3放射性标记粘结剂9的itlc
‑
sg跑样。
[0079]
螯合物
89
y
‑
dota
‑
bg(1a,mc4324)作为式ii化合物非放射性类似物(1a,mc4324)在生理条件下的化学稳定性。
[0080]
螯合物
89
y
‑
dota
‑
bg(1a,mc4324)(1,mc4324,或式ii化合物的非放射性类似物)在生理条件下的稳定性已经通过使用分析型hplc(shimadzu nexera色谱仪,配备有spd
‑
m20a pda检测器;hypersil ods gold 250x4.6 mm柱;洗脱液:meoh/h2o为5:95v/v 0.02%tfa,
流速:1.0ml/分钟;uv检测214nm)评估,在pbs缓冲液中溶解(c=0.9mg/ml)后以规律的时间间隔重复并保持在t=37℃。5天后,发现螯合物仍然完好无损,化学纯度始终高于99.5%(见表1)。螯合物
89
y
‑
dota
‑
bg(图2a
‑
c色谱图中的峰1)立刻显示峰2的存在(低于0,1%)该峰也随时间保持恒定。
[0081]
表2描述相对于化合物
89
y
‑
dota
‑
bg(1a)溶于pbs缓冲液(c=0.9mg/ml)和t=37℃时间t=0分钟(a),t=21小时(b)和t=5天(c)的hplc图。
[0082][0083]
89
y
‑
dota
‑
bg螯合物(1a,mc4324)(1,mc4324,或式ii化合物的非放射性类似物)作为net的底物在人神经母细胞瘤系sk
‑
n
‑
sh上的生物学验证。
[0084]
89
y
‑
dota
‑
bg螯合物(1a,mc4324)(1,mc4324,或式ii化合物的非放射性类似物)作为net底物作用的能力已在与氚化内源性底物3h
‑
ne关于人神经母细胞瘤细胞sk
‑
n
‑
sh对其的摄取竞争实验中得到评估,已知该细胞大量表达转运体net。在该细胞系中,
89
y
‑
dota
‑
bg螯合物显示出对3h
‑
ne的摄取/内化的剂量依赖性抑制(ic50~10μm),显示为类似于mibg的net底物,即使动力较低(图3)并且没有剂量依赖性细胞毒性作用,这在高达最高测试浓度(100μm)时明显。有趣的是,不含钇的
89
y
‑
dota
‑
bg螯合物的类似物,游离粘结剂9(mc4325)完全无法与3h
‑
ne竞争内化(图3)。这提供了制备具有甚至低特异活性的式ii螯合物(或mc4324)的放射性标记版本的能力,因为螯合物(mc4325)和游离粘结剂9(mc4325)之间不存在对net的竞争,这在过量游离粘结剂9(mc4325)存在下也不会损害螯合物(式ii化合物,mc4324)与net的键合能力。
[0085]
图3描述
89
y
‑
dota
‑
bg螯合物(1a,mc4324)(1,mc4324,或式ii化合物的非放射性类似物)和游离粘结剂9(mc4325)与3h
‑
ne(50nm,孵育1小时,t=37℃)被sk
‑
n
‑
sh细胞摄取的竞争。1h
‑
ne@20μm和mibg@2μm被用作阳性对照。
[0086]
关于细胞测试的材料和方法
[0087]
细胞系和培养条件
[0088]
人神经母细胞瘤细胞系sk
‑
n
‑
sh购自atcc。在含有10%胎牛血清(fbs)、2mm l
‑
谷氨酰胺和抗生素的e
‑
men培养基中,在37℃下在5%co2加湿气氛中维持细胞。
[0089]3h
‑
ne的细胞摄取
[0090]3h
‑
ne购自铂金埃尔默。为了测量细胞摄取3h
‑
ne的初始速度,细胞在仅存在血清的条件下生长16小时,然后用粘结剂培养基(包含0.2%bsa和20mm hepes,ph 7.5的emem)在
37℃水浴锅中加热孵育10分钟。通过向粘结剂培养基中每孔加入0.5ml的50nm 3h
‑
ne持续长时间以起始键合,然后将板置于冰上并用冷冻的pbs洗涤三遍。因此,细胞单层被干燥并用2%naoh 1n sds裂解。每次不同孔中三次的cpm(每分钟“计数”)分别确定。每分钟“计数”或“命中”即在一分钟内的核衰变。这些衰变来自细胞内部,按照以下顺序:1)用3h
‑
ne孵育,2)用pbs洗涤以消除细胞外残余的3h
‑
ne,3)裂解以更好地检测仅由于内化的3h
‑
ne的放射性。因此,cpm是由细胞内化的3h
‑
ne引起的,并且在没有发生竞争时最大(对照/未处理或更优仅用3h
‑
ne处理的细胞)而每次测试的物质与3h
‑
ne的竞争效果越强,cpm降低的方式越显著。
[0091]
背景键合已经在包含400倍摩尔过量的非标记性1h
‑
ne(“冷的”)平行的第四孔中确定。对于竞争研究,细胞已经如上所述铺板,并因此在粘结剂培养基中在不存在和存在
89
y
‑
dota
‑
bg螯合物(式ii化合物,1a或mc4324)(1,mc4324,或式ii化合物的非放射性类似物)和不同的浓度的游离粘结剂9(mc4325)的情况下用50nm 3
h
‑
ne孵育1小时。对于每个浓度值,在孔中分别测定了三次放射性。3h
‑
ne的摄取已表示为蛋白质的mg归一化的总放射性百分比。
[0092]
式ii的螯合物
90
y
‑
dota
‑
bg(1或mc4324)在血清中的稳定性。
[0093]
式ii(1或mc4324)的
90
y
‑
dota
‑
bg螯合物在血清中的稳定性已经通过测量在14天期间金属阳离子
90
y
3
从螯合物释放到血清蛋白质评估,期间其在生理条件下保持。简言之,式ii的
90
y
‑
dota
‑
bg螯合物(1或mc4324)已经在t=37℃与人血清(32mbq用于16ml血清)孵育。定期收集血清等分试样,并通过使用离心过滤管(ultra
‑
4 3k,默克密理博公司(merck millipore))以5500g离心,将血清蛋白与血清的非蛋白部分分离并用液体闪烁β计数器(使用的闪烁液体是铂金埃尔默ultima gold)测量了两个部分的放射性。在14天的观察期间,没有检测到有利于血清的蛋白质部分的可测量的放射性损失(
90
y
3
)。
[0094]
式iii和iv的化合物的制备
[0095]
式iii和iv的化合物(也分别表示为化合物10a、10a’和10b、10b’或mc4801和mc4803)的制备如方案2中所述进行。
[0096]
具体地,当n等于1时,化合物10a和10a’对应于通式iii,且me分别选自
90
y
3
或
89
y
3
。当n等于2时,化合物10b和10b’替代对应于通式iv,且me分别选自
90
y
3
或
89
y
3
。
[0097]
2,2',2
”‑
(10
‑
(2
‑
乙氧基
‑2‑
氧代乙基)
‑
轮环藤宁
‑
1,4,7
‑
三
‑
基)三乙酸三叔丁酯4,如方案1中所示制备,已经用过量适合的市售二胺(1,3
‑
丙二胺或1,4
‑
丁二胺)在室温处理,得到合成子a’11a和11b各自的中间体。然后将这些与如方案1所述制备的合成子b(7)偶联,在n
‑
(3
‑
二甲氨基丙基)
‑
n
′‑
乙基碳二亚胺(edci),水合1
‑
羟基苯并三唑(hobt)和tea在无水dcm中存在的情况下,室温下得到完全保护的衍生物12a和12b。然后通过使用三氟乙酸(tfa):三异丙基硅烷(tis):水为95/2.5/2.5(体积/体积/体积)混合物,将这些经总脱保护反应处理,得到分别的游离粘结剂13a(mc4802)和13b(mc4804)。因此游离粘结剂13a,b已经在封闭小瓶中在ph 5.5
‑
6乙酸铵缓冲液存在情况下与略微过量的
89
y(no3)3热络合,以得到式iii(10a’,mc4801)和iv(10b’,mc4803)的化合物非放射性类似物,也称为“冷示踪剂”。游离粘结剂13a,b已最终仍在ph 5.5
‑
6的乙酸铵缓冲液存在情况下以对于用
90
ycl3热放射标记大量过量使用,以得到式iii(10a,mc4801)和iv(10b,mc4803)的化合物。
[0098]
方案2
[0099][0100]
试剂和条件:(a)1,3
‑
二氨基丙烷或1,4
‑
二氨基丁烷,室温下65
‑
72小时;(b)edci,hobt,tea,无水dcm,室温下24小时;(c)tfa:三异丙基硅烷:水为95:2.5:2.5,从0℃到室温,24小时;d)
89
y(no3)3,1m乙酸铵缓冲液(ph=5.5
‑
6),90℃下3小时;e)
90
ycl3(0.05m hcl溶液),1m乙酸铵缓冲液(ph=5.5
‑
6),90℃下30分钟。
[0101]
通过使用布鲁克ac 400谱仪,在400mhz记录了合成中间体11
‑
13的1h
‑
nmr谱,而式iii和iv的化合物10a’(mc4801)和10b’(mc4803)的1h
‑
nmr和
13
c
‑
nmr谱已通过使用布鲁克ac 600谱仪分别在600mhz和150mhz记录;相对于用作内部参照的四甲基硅烷(me4si)以δ单位(ppm)记录化学位移。低分辨率质谱已经记录在api
‑
tof mariner透视生物系统(美国德克萨斯州斯特拉特福德)上,样品由哈佛泵以5
‑
10μl/分钟的流速注入到电喷雾系统。高分辨率质谱(hr
‑
ms)已经记录在orbitrap exactive谱仪(赛默飞世尔科技公司,美国德克萨斯州奥斯丁市)。化合物12a,b和13a,b和化合物10a’,b’作为式iii(10a,mc4801)和iv(10b,mc4803)化合物的非放射性类似物的分析型hplc分析已在以下条件下进行:
[0102]
‑
液相色谱仪uhplc accela,配备有泵系统、自动进样器和与质谱仪ltq离子阱相连的配备有esi接口的pda accela检测器(赛默飞世尔科技公司,美国德克萨斯州奥斯汀市);实验数据已通过xcalibur软件(赛默飞世尔科技公司,美国德克萨斯州奥斯汀市)获取、处理和重制;
[0103]
‑
shimadzu nexera液相色谱仪,配备有cbm
‑
20a控制器、四个lc
‑
30ad泵、dgu
‑
20a5r脱气机、spd
‑
m20a pda检测器(标准分析2.50μl半微量池),进样速度:100赫兹;分辨率:4.0nm),cto
‑
20ac外壳的恒温柱和自动进样器sil
‑
30ac;elsd检测器(sedex 90,sedere,法国)与系统串联;实验数据已通过labsolution软件(意大利岛津有限责任公司,意大利米兰)获取、处理和重制。
[0104]
包含
89
y
3
[式iii(10a’,mc4801)和iv(10b’,mc4803)的化合物]的化合物作为式iii(10a,mc4801)和iv(10b,mc4803)化合物的非放射性类似物,已经在配备有waters 590型泵,250μl注射器和具有可变波长的uv分光光度检测器和omniscribe纸上记录器的
waters半制备液相色谱仪(rp
‑
hplc)上进行纯化。
[0105]
所有化合物都通过tlc和1h
‑
nmr规律地控制。tlc是在由铝支撑的硅胶板(默克dc,alufolien kieselgel 60f254)上进行的,通过uv光或通过使用的kmno4碱性溶液显示斑点。通过使用在约20托(torr)的减压下操作的旋转蒸发器进行了反应和萃取后溶液的浓缩。有机溶液已在无水硫酸钠或无水硫酸镁上干燥。所有化学反应物均购自:西格玛奥德里奇有限责任公司(意大利米兰),tci欧盟交易所(比利时兹韦恩德雷赫特)或铂金埃尔默(美国)并具有最高纯度。通常,制备用于物理和生物试验的样品已在p2o5上高真空干燥了20小时,温度在25和40℃之间,取决于样品的熔点。下文描述了化合物10
‑
13的制备和化学
‑
物理表征的实验过程。
[0106]
制备中间体11a,b的一般过程。实施例:2,2',2
”‑
(10
‑
(2
‑
((3
‑
氨基丙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸三叔丁酯(11a)。化合物4(1.0g,1.66毫摩尔)已被溶于市售的,纯1,3
‑
二氨基丙烷(1.5ml,17.9毫摩尔),且所得溶液置于室温下搅拌72小时。在反应结束时,丙二胺已经在减压下除去,残余物真空干燥以得到暗黄色泡沫,其最终通过快速色谱纯化(从100%的dcm到dcm/甲醇为40:60v/v)以提供白色泡沫状化合物11a(0.78g,75%)。1h
‑
nmr(cdcl3)δppm:1.39(s,27h,3x tbu),1.47(m,2h,nh2),1.85(m,2h,conhch2ch2ch2nh2),2.44(m,4h,2x ch2),2.63(m,4h,2x ch2),2.66(m,2h,conhch2ch2ch2nh2),2.76
‑
2.81(m,8h,4x ch2),2.98(s,2h,nch2conh),3.16(br s,4h,2x nch2cootbu),3.20(s,2h,nch2cootbu),3.15
‑
3.18(m,2h,cohch2ch2ch2nh2),8.68(t,1h,conh);ms(esi):629[m h] 。
[0107]
2,2',2
”‑
(10
‑
(2
‑
((4
‑
氨基丁基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸酯(11b)。1h
‑
nmr(cdcl3)δppm:1.38(s,27h,3x tbu),1.48(m,2h,nh2),1.51(m,4h,conhch2ch2ch2ch2nh2),2.45(m,4h,2x ch2),2.63(m,4h,2x ch2),2.67(m,2h,conhch2ch2ch2ch2nh2),2.77
‑
2.82(m,8h,4x ch2),2.99(s,2h,nch2conh),3.02
‑
3.05(m,2h,conhch2ch2ch2ch2nh2),3.17(br s,4h,2x nch2cootbu),3.21(s,2h,nch2cootbu),8.67(t,1h,conh);ms(esi):643[m h] 。
[0108]
制备中间体12a,b的一般过程。实施例:2,2',2
”‑
(10
‑
(2
‑
((4
‑
(3
‑
((2,3
‑
双(叔丁氧羰基)胍基)甲基)苯甲酰胺基)丁基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)(z)
‑
三乙酸三叔丁酯(12b)。
[0109]
向n,n'
‑
双
‑
叔丁氧羰基
‑3‑
胍基甲基
‑
苯甲酸7(0.16mmol,65.0mg)在无水dcm(1.5ml)的溶液中,接连加入hobt(0.21mmol,29.0mg)、edci(0.21mmol,41.0mg)、2,2',2
”‑
(10
‑
(2
‑
((4
‑
氨基丁基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸三叔丁酯11b(102.9mg,0.16mmol)和最后加入tea(0.58mmol,59.2mg,82.0μl),在冰浴中冷却。在室温下约24小时后,蒸发除去溶剂,所得粗产物通过硅胶快速色谱(biotage isolera )纯化用氯仿/甲醇0
→
9%混合物洗脱,以提供白色固体状化合物12b(84.7mg,产率=52%)。1h
‑
nmr(cdcl3)δppm:1.35(s,9h,tbu),1.39(s,27h,3x tbu),1.44(s,9h,tbu),1.49
‑
1.57(m,4h,conhch2ch2ch2ch2nhco),1.92
‑
3.58(非常宽的多峰集,整体对应于28h,14x ch2),4.63(d,2h,nhch2),7.34
‑
7.38(m,2h,ch苯环),7.95(m,1h,ch苯环),8.12(d,1h,ch苯环),8.49(m,1h,nhch2),8.81(m,1h,ch2conh),9.03(m,1h,phconh),11.4(s,1h,bocnh).ms(esi):1019[m h] 。
[0110]
2,2',2
”‑
(10
‑
(2
‑
((3
‑
(3
‑
((2,3
‑
双(叔丁氧羰基)胍基)甲基)苯甲酰胺基)丙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)(z)
‑
三乙酸三叔丁酯(12a)。1h
‑
nmr(cdcl3)δppm:1.35(s,9h,tbu),1.39(s,27h,3x tbu),1.44(s,9h,tbu),1.70
‑
1.76(m,2h,conhch2ch2ch2nhco),1.92
‑
3.58(非常宽的多峰集,整体对应于28h,14x ch2),4.63
‑
4.65(d,2h,nhch2),7.35
‑
7.39(m,2h,ch苯环),7.97(m,1h,ch苯环),8.16(d,1h,ch苯环),8.51(m,1h,nhch2),8.83(m,1h,ch2conh),9.07(m,1h,phconh),11.6(s,1h,bocnh).ms(esi):1005[m h] 。
[0111]
制备中间体13a,b的一般过程。实施例:2,2',2
”‑
(10
‑
(2
‑
((3
‑
(3
‑
(胍基甲基)苯甲酰胺基)丙基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸(13a,也表示为mc4802)。将tfa:三异丙基硅烷:水为95:2.5:2.5v:v:v(6.0ml)的混合物加入中间体12a(0.099mmol,100.0mg),在0℃冷却。脱保护反应已在以下分析条件下通过rp
‑
hplc检查:柱:sunfire c18,3.5μm(150*4.6mm id);洗脱液:a)h2o/acn 95/5 0.1%tfa,b)acn 0.1%tfa。梯度洗脱(开始a/b 100/0;1分钟a/b 100/0;15分钟a/b 0/100,20分钟a/b 0/100)。流速:1.0ml/分钟。检测:pda(200
‑
400nm),elsd(t:80℃,p:4巴);t col=30℃;样品溶于meoh。在室温下约24小时后,证明反应完成。因此,溶剂已经蒸发并且残余物与无水dcm(6x 4ml)和无水乙醚(6x 3ml)共蒸发数次。然后将由此获得的粗产物用无水乙醚研磨、过滤并用无水乙醚在过滤器上洗涤以提供白色固体状的所需化合物13a(53.4mg,产率=85%)。1h
‑
nmr(d2o)δppm:1.70
‑
1.76(m,2h,conhch2ch2ch2nhco),2.92
‑
3.73(非常宽的多峰集,整体对应于28h,14x ch2),4.42(d,2h,nhch2),7.45(m,2h,ch苯环),7.63(m,2h,ch苯环)。
[0112]
hr
‑
ms(esi):[c
28
h
45
n9o8 h]
的计算质量=636.3469m/z;测定质量:636.3456m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0113]
2,2',2
”‑
(10
‑
(2
‑
((3
‑
(3
‑
(胍基甲基)苯甲酰胺基)丁基)氨基)
‑2‑
氧代乙基)
‑
1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7
‑
三基)三乙酸(13b,也表示为mc4804)。
[0114]1h
‑
nmr(d2o)δppm:1.50
‑
1.61(m 4h,conhch2ch2ch2ch2nhco),2.88
‑
3.77(非常宽的多峰集,整体对应于28h,14x ch2),4.39(d,2h,nhch2),7.44
‑
7.47(m,2h,ch苯环),7.60
‑
7.63(m,2h,ch苯环)。
[0115]
hr
‑
ms(esi):[c
29
h
47
n9o8 h]
的计算质量=650.3626m/z;测定质量:650.3612m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0116]
制备式iii(10a’,mc4801)和iv(10b’,mc4803)的螯合物“冷”版本的一般过程。实施例:螯合物10a’(mc4801)。向溶于1ml的1m乙酸铵缓冲液(ph=5.5
‑
6)的粘结剂13a(19.1mg,30.2μmol)中加入了市售的盐
89
y(no3)3·
4h2o(15.7mg,45.3μmol)。然后所得溶液在封闭的小瓶中热搅拌(90℃)3小时。在反应结束时,将混合物置于室温下冷却,然后通过半制备型hplc(条件:柱hypersil ods gold 5μm;250x10 mm;洗脱液:meoh/h2o为5:95v/v 0.02%tfa,流速:4.0ml/分钟;uv检测254nm)从过量的盐中纯化粗制螯合物,冻干净馏分后,直到提供白色粉末状固体的“冷”螯合物10a’(mc4801)(19.9mg,产率=92%)。1h
‑
nmr(d2o,600mhz,t=5℃)δppm:1.68(m,2h,conhch2ch2ch2nhco),2.09(d,1h,chh),2.21
‑
2.34
(m,5h,2x ch2和chh),2.54
‑
2.65(m,7h,3x ch2和chh),2.97(d,1h,chh),3.09(d,2h,ch2),3.17
‑
3.42(m,6h,3x ch2),3.44
‑
3.58(m,4h,2x ch2),3.63(m,2h,ch2),4.37(d,2h,
‑
ch2‑
胍),7.44(m,2h,ch苯环),7.61(m,2h,ch苯环).13c
‑
nmr(d2o,150mhz,t=5℃)δppm:180.25,179.70,175.82,169.96,156.56,136.84,133.21,130.62,129.15,129.13,126.17,125.22,65.45,65.30,65.21,63.02,55.63,55.45,55.43,55.35,54.74,54.71,54.57,54.16,43.75,39.18,38.39,29.95.
[0117]
hr
‑
ms(esi):[c
28
h
42
n9o8y h]
的计算质量=722.2293m/z;测定质量:722.2284m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0118]
螯合物10b’(mc4803)。
[0119]1h
‑
nmr(d2o,600mhz,t=5℃)δppm:1.56(m,4h,conhch2ch2ch2ch2nhco),2.07(d,1h,chh),2.21
‑
2.32(m,5h,2x ch2和chh),2.54
‑
2.65(m,7h,3x ch2和chh),2.98(d,1h,chh),3.07(d,2h,ch2),3.16
‑
3.42(m,6h,3x ch2),3.44
‑
3.59(m,4h,2x ch2),3.65(m,2h,ch2),4.37(d,2h,
‑
ch2‑
胍),7.44(m,2h,ch苯环),7.62(m,2h,ch苯环).13c
‑
nmr(d2o,150mhz,t=5℃)δppm:180.30,179.70,175.82,169.97,156.53,136.85,133.22,130.65,129.12,129.10,126.21,125.20,65.46,65.31,65.23,63.05,55.64,55.44,55.42,55.36,54.71,54.70,54.59,54.19,43.77,39.21,38.42,27.17,27.10.
[0120]
hr
‑
ms(esi):[c
29
h
44
n9o8y h]
的计算质量=736.2450m/z;测定质量:736.2442m/z。离子源参数:毛细管温度275℃;喷雾电压3.70kv;鞘流气(sheath gas)6,管透镜电压125v。分辨率输入:100000。样品溶解在meoh(10
‑5m)中。
[0121]
制备式iii(10a,mc4801)和iv(10b,mc4803)的螯合物(放射性标记)的一般过程。实施例:螯合物10a(mc4801)。通过将30μl市售的0.05m hcl中的
90
ycl3溶液(1.07mci,22.1pmol)加入到132μl的1m乙酸铵缓冲液(ph=5.5
‑
6)中的0.1mm粘结剂13a的溶液(13.2nmol)中并通过添加338μl相同的1m乙酸铵缓冲液(ph=5.5
‑
6)使终体积达到500μl制备了式iii(10a)的螯合物。然后将所得溶液置于封闭小瓶中,在屏蔽罩下的加热块上在90℃孵育30分钟。反应结束时,冷却到室温后,收集不同等分的溶液(2
‑
10μl),无需稀释,以评估放射性标记产率并通过itlc进行质量控制。itlc方法使用itlc
‑
sg和itlc
‑
sa安捷伦(agilent)板和不同的洗脱液系统例如1m乙酸铵缓冲液(ph=5.5
‑
6):甲醇(50:50v/v)、1m乙酸铵缓冲液(ph=5.5
‑
6):甲醇:氨33%(50:50:5v/v/v)和0.1m乙酸铵缓冲液(ph=6)中的50mm edta。不同色谱运行的结果一致显示>99%的放射性标记产率和放射化学纯度。
[0122]
包含
89
y
3
的螯合物[式iii(10a’,mc4801)和iv(10b’,mc4803)的化合物]作为式iii和iv(10a,b或mc4801和mc4803)的螯合物的非放射性类似物在生理条件下的化学稳定性。
[0123]
式iii和iv的螯合物的非放射性类似物,(10a’,b’或mc4801和mc4803)在生理条件下的化学稳定性已经通过使用分析型hplc(shimadzu nexera色谱仪,配备有spd
‑
m20a pda检测器;hypersil ods gold 250x4.6 mm柱;洗脱液:meoh/h2o为5:95v/v 0.02%tfa,流速:1.0ml/分钟;uv检测214nm)评估,在pbs缓冲液中溶解(c=0.9mg/ml)后以规律的时间间隔重复并保持在t=37℃。5天后,发现两种螯合物仍然完好无损,化学纯度始终高于99.5%。
[0124]
包含
89
y
3
的螯合物[式iii(10a’,mc4801)和iv(10b’,mc4803)的化合物]作为式iii(10a,mc4801)和iv(10b,mc4803)的螯合物的非放射性类似物作为net的底物在人神经母细胞瘤系sk
‑
n
‑
sh上的生物学验证。
[0125]
式iii(10a’,mc4801)和iv(10b’,mc4803)的“冷”螯合物作为net底物作用的能力已在与氚化内源性底物3h
‑
ne关于被人神经母细胞瘤细胞sk
‑
n
‑
sh摄取的竞争实验中得到评估,已知该细胞大量表达转运体net。在该细胞系中,螯合物10a’,b’(mc4801和mc4803)都显示出对3h
‑
ne的摄取/内化的剂量依赖性抑制,显示为类似于mibg的net底物,即使动力较低(图4)并且没有剂量依赖性细胞毒性作用,这在高达最高测试浓度(100m)时明显。有趣的是,在这种情况下也是,与使用式ii(mc4324)的化合物的游离粘结剂9(mc4325)已经观察到的相似,发现了通式iii(mc4801)和iv(mc4803)的化合物的游离粘结剂13a,b(分别表示为mc4802和mc4804)直到更高的测试浓度也完全无法与3h
‑
ne竞争内化(图4)。因此,在这种情况下,也可以制备具有低特异活性的式iii(10a,mc4801)和iv(10b,mc4803)螯合物的放射性标记版本,因为螯合物10a,b(mc4801和mc4803)之间不存在对net的竞争,各自的游离粘结剂13a,b(mc4802和mc4804)也在过量的游离粘结剂13a,b(mc4802和mc4804)存在下不损害螯合物[式iii(10a,mc4801)和iv(10b,mc4803)化合物]与net键合的能力。
[0126]
图4描述式iii(10a’,mc4801)和iv(10b’,mc4803)的“冷”螯合物和各自的游离粘结剂13a,b(mc4802和mc4804)与3h
‑
ne(50nm,t=37℃,孵育1小时)关于被sk
‑
n
‑
sh细胞摄取的竞争。20μm的1h
‑
ne和2μm的mibg在类似竞争实验中被用作阳性对照。
[0127]
关于细胞测试的材料和方法
[0128]
细胞系和培养条件
[0129]
人神经母细胞瘤细胞系sk
‑
n
‑
sh购自atcc。在含有10%胎牛血清(fbs)、2mm l
‑
谷氨酰胺和抗生素的e
‑
mem培养基中,在37℃下在5%co2加湿气氛中维持细胞。
[0130]3h
‑
ne的细胞摄取
[0131]3h
‑
ne购自铂金埃尔默。为了测量细胞摄取3h
‑
ne的初始速度,细胞在仅存在血清的条件下生长16小时,然后用粘结剂培养基(包含0.2%bsa和20mm hepes,ph 7.5的emem)在37℃水浴锅中加热孵育10分钟。通过向粘结剂培养基中每孔加入0.5ml的50nm 3
h
‑
ne持续长时间以起始键合,然后将板置于冰上并用冷冻的pbs洗涤三遍。因此,细胞单层被干燥并用2%naoh 1n sds裂解。每次不同孔中三次的内部cpm(每分钟“计数”)分别确定。背景键合已经在包含400倍摩尔过量的非标记性1h
‑
ne(“冷”)平行的第四孔中确定。对于竞争研究,细胞已经如上所述铺板,并因此在粘结剂培养基中在不存在和存在式iii(10a’,mc4801)和iv(10b’,mc4803)的“冷”螯合剂和不同浓度的各自的游离粘结剂13a,b(分别为mc4802和mc4804)的情况下用50nm 3
h
‑
ne孵育1小时。对于每个浓度值,在孔中分别测定了三次放射性。3h
‑
ne的摄取已表示为蛋白质的mg归一化的总放射性百分比。
[0132]
式iii(10a,mc4801)和iv(10b,mc4803)的螯合物在血清中的稳定性。
[0133]
式iii(10a,mc4801)和iv(10b,mc4803)的螯合物在血清中的稳定性已经通过测量在14天期间金属阳离子
90
y
3
从螯合物释放到血清蛋白质评估,期间其在生理条件下保持。简言之,式iii(10a,mc4801)和iv(10b,mc4803)的螯合物已经在t=37℃与人血清(32mbq每16ml血清)孵育。定期收集血清等分试样,并通过使用离心过滤管(ultra
‑
4 3k,默克密理博公司)以5500g离心,将血清蛋白与血清的非蛋白部分分离和用液体闪烁β计数
器(使用的闪烁液体是铂金埃尔默ultima gold)测量了两个部分的放射性。在14天的观察期间,没有检测到有利于血清的蛋白质部分的可测量的放射性损失(
90
y
3
)。
[0134]
附图简要说明
[0135]
图1描绘了关于用
90
ycl3放射性标记粘结剂9的itlc
‑
sg跑样。
[0136]
图2描绘了关于化合物
89
y
‑
dota
‑
bg(1a)随时间推移的化学稳定性的评估的hplc图。
[0137]
图3描绘了式ii(1a,mc4324)的螯合物和各自的游离粘结剂9(mc4325)与3h
‑
ne关于被神经母细胞瘤细胞sk
‑
n
‑
sh摄取的竞争。
[0138]
图4描述式iii(10a’,mc4801)和iv(10b’,mc4803)的螯合物和各自的游离粘结剂13a(mc4802)和13b(mc4804)与3h
‑
ne关于被神经母细胞瘤细胞sk
‑
n
‑
sh摄取的竞争。
[0139]
附图详细说明
[0140]
图1描绘了关于用于制备式ii(1或mc4324)的螯合物
90
y
‑
dota
‑
bg的用
90
ycl3的放射性标记粘结剂9的itlc
‑
sg跑样。
[0141]
图2描绘了关于溶于pbs缓冲液的
89
y
‑
dota
‑
bg螯合物(1a)(c=0.9mg/ml)随时间推移的化学稳定性的hplc图。图2a描绘了溶于pbs缓冲液的
89
y
‑
dota
‑
bg(1a)的图,t=37℃,时间t=0分钟。图2b描绘了溶于pbs缓冲液的
89
y
‑
dota
‑
bg(1a)的图,t=37℃,时间t=21小时。图2c描绘了溶于pbs缓冲液的
89
y
‑
dota
‑
bg(1a)的图,t=37℃,时间t=5天。
[0142]
图3描绘了式ii(1a,mc4324)的螯合物和各自的游离粘结剂9(mc4325)与3h
‑
ne关于通过net被人神经母细胞瘤细胞sk
‑
n
‑
sh摄取/内化的竞争试验结果。图3的左起第一列是关于未处理对照(缺乏竞争)。后面两列是关于两个阳性对照,1h
‑
ne本身(20μm)和mibg(2μm)都没有被标记,其与3h
‑
ne在所述剂量下竞争内化。图3中从第四到第八列描述了式ii的螯合物(1a,mc4324)和3h
‑
ne之间增加剂量(5到100μm)的竞争实验的结果。图3中第九和第十列报告了式ii化合物的游离粘结剂(9或mc4325)和3h
‑
ne之间两个不同浓度(50和100μm)的竞争实验的结果。
[0143]
图4描述式iii(10a’,mc4801)和iv(10b’,mc4803)的螯合物和各自的游离粘结剂13a(mc4802)和13b(mc4804)与3h
‑
ne关于通过net被人神经母细胞瘤细胞sk
‑
n
‑
sh摄取/内化的竞争试验结果。图4的左起第一列是关于未处理对照(不存在竞争)。后面两列是关于两个阳性对照,1h
‑
ne本身(20μm)和mibg(2μm)都没有被标记,其与3h
‑
ne在所述剂量下竞争内化。图4中第四和第五列描绘了两个不同浓度(50和100μm)的式iii(10a’,mc4801)的螯合物和3h
‑
ne之间竞争实验的结果。图4中第六和第七列描绘了两个不同浓度(50和100μm)的式iii(13a,mc4802)的螯合物的游离粘结剂和3h
‑
ne之间竞争实验的结果。图4中第八和第九列描绘了两个不同浓度(50和100μm)的式iv(10b’,mc4803)的螯合物和3h
‑
ne之间竞争实验的结果。图4中第十和第十一列描绘了两个不同浓度(50和100μm)的式iv(13b,mc4804)的螯合物的游离粘结剂和3h
‑
ne之间竞争实验的结果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。