1.本发明涉及体外诊断领域,特别涉及一种胃蛋白酶原多重检测方法和检测试剂盒。
背景技术:
2.近年来,胃癌对人类的健康构成了严重的威胁,随着人们保健意识的提高和医疗手段的进步,虽然胃癌的发生及死亡率有所下降,其发生率仍居我国癌症发病率排行榜前五位,死亡率仅次于肺癌和支气管癌。胃癌的早期临床症状并不明显,大多数早期胃癌患者在病情进展到晚期时才被发现及治疗。而晚期胃癌预后较差,胃癌的5年生存率仍然偏低。在西方国家,包括欧洲和美国在内,胃癌的5年生存率不超过25%,中国甚至更低。而在较早实施胃蛋白酶原联合幽门螺旋杆菌抗体检查作为早期胃癌筛查方法的国家,其胃癌的5年生存率升高。日本有报道表示胃癌患者的5年生存率可达到52%,而且局限于胃粘膜的早期胃癌患者5年生存率可高达95%。人们认为患有胃癌前疾病(萎缩性胃炎(atrophic gastritis,ag)、肠上皮化生(intestinal metaplasia,im)、上皮内瘤变(intraepithelial neoplasia,ine))的人群可能是发展为胃癌的高危人群。因此,通过筛选胃癌的高危人群来改善其预后至关重要。胃癌前病变和早期胃癌的发现对于降低死亡率、提高生存率、改善生活质量具有重要意义。众所周知,内镜和活检检查是胃癌和胃癌前病变诊断的金标准。但由于其侵袭性,其在人群筛查中的应用有限。因此,有必要寻找新颖、简便、经济、可操作的癌前病变及胃癌的筛查方法。而作为“血清学活检”的胃蛋白酶原及胃泌素
‑
17一直是人们研究的重点。
3.胃蛋白酶原(pepsinogens,pg)是一种消化性蛋白酶,是胃蛋白酶的前体,主要由胃主细胞分泌。在生物化学和免疫化学上分为两个亚型,胃蛋白原i(pepsinogen i,pgⅰ)和胃蛋白酶原ⅱ(pepsinogenⅱ,pgⅱ)。pgⅰ和ⅱ由胃主细胞分泌到胃腔内,在血清中约占1%,其反应了胃黏膜的结构和功能的特性。有研究表明,胃蛋白酶原(pg)与胃黏膜萎缩有关,萎缩的严重程度与pgⅰ/pgⅱ比值(the ratio of pepsinogen i and pepsinogenⅱ,pgr)呈负相关,即萎缩越严重,pgr的血清学水平越低。因为pgⅱ分布较广,除和pgⅰ一样由胃底腺的主细胞和颈黏液细胞分泌外,pgⅱ也可由贲门腺和胃窦幽门腺的黏液颈细胞以及十二指肠上段产生。故相较pgⅰ而言,pgⅱ受胃黏膜萎缩程度的影响较小。当胃体发生萎缩,尤其是扩展到胃大弯时,可见pgⅰ及pgr下降。萎缩的程度越重,其pgr越低。这可能是由于胃底腺体的萎缩,主细胞的数量及功能减弱,导致分泌的pgⅰ减少,而pgⅱ相对恒定,从而导致pgr显著下降。故血清学标记物pgⅰ和pgⅱ及其比值被认为是各种胃部疾病的预测因子。有研究表明血清胃蛋白酶原异常的人群,在之后长时间的随访中发现,发生胃癌的风险远高于正常的人群。这可以说明,血清胃蛋白酶原与胃癌之间有一定的关联,可以作为预测胃癌的指标。chang等人对已经发生胃黏膜上皮内瘤变的患者进行胃蛋白酶原血清学水平的检测及研究,发现pgr在胃黏膜低级别上皮内瘤变时即开始明显下降,提出胃蛋白酶原尤其是pgr对于上皮内瘤变的诊断具有重要意义。这都为血清胃蛋白酶原作为筛查早期胃癌及胃
癌前病变的血清学指标提供了有利的理论依据,表明在人群中使用血清胃蛋白原检查进行胃癌筛查是可行的。
4.血清胃蛋白酶原检查作为一项非侵入性检查已被人们所接受,在韩国及日本已作为一项疾病筛查的项目,在全国推广。在日本,早期胃癌筛查的最佳分界值为pgⅰ≤70ng/ml和pgr≤3.0。而在韩国,有研究表示pgⅰ≤59.3μg/l及pgr≤3.6较为合理。在中国,有研究表明pg i≤70μg/l及pgr≤6的特异性和敏感性较高。不同地域人们所处的环境、饮食习惯有所不同,故不同的国家,有着不同的血清学诊断标准。我国关于血清胃蛋白酶原在早期胃癌筛查中的最佳分界值的论文相对较少,近年来有上升趋势,但还需要有大量的研究加以证明,需进一步完善。
5.免疫法是检测胃蛋白酶原的常用检测方法,目前的免疫分析技术通常只能进行单指标的检测,常规实验室或医疗单位通常采用单一试剂盒对患者血清中的胃蛋白酶原含量进行测定,此种方法检测步骤繁琐,两种待检物不同时检测可能会存在各种反应条件和参数等不同而导致检测结果不准确,出现检测误差等问题。因此,开发一种能够同时进行多指标检测且准确率高的检测方法非常有必要。
技术实现要素:
6.本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种胃蛋白酶原多重检测方法和检测试剂盒。液相芯片是一种结合流式细胞术的蛋白研究平台,其应用范围广泛,能够快速进行细胞因子、肿瘤标志物、自身免疫性疾病诊断、感染性疾病病原体鉴别、过敏原筛查等检测。其原理是采用多种染料标记微球,将微球编码,通过对微球表面修饰可用基团实现检测。本发明结合液相芯片技术,将磁性编码微球作为载体,以胃蛋白酶原为待检测对象,与微球表面标记的抗体进行免疫反应,形成微球
‑
免疫复合体
‑
报告分子的检测体系,利用流式细胞仪进行分析测试,该方法检测灵敏度、可靠性高,能极大程度地缩短检测周期,降低检测成本。
7.为实现上述目的,本发明采用的技术方案是:一种胃蛋白酶原多重检测方法,包括:
8.1)合成两种具有不同荧光强度的磁性编码微球;
9.2)在步骤1)得到的两种磁性编码微球上分别偶联可与胃蛋白酶原pgⅰ结合的pgⅰ捕获抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ捕获抗体;
10.3)制备标记有相同生物素的可与胃蛋白酶原pgⅰ结合的pgⅰ检测抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ检测抗体;
11.4)免疫反应:将待测样本、步骤2)得到的偶联有捕获抗体的两种磁性编码微球混合反应,分离出的磁性编码微球与步骤3)制备的标记有相同生物素的pgⅰ检测抗体和pgⅱ检测抗体混合进行反应,分离出的磁性编码微球与亲和素化的藻红蛋白混合,反应完成后得到磁性编码微球溶液;
12.5)用流式细胞仪检测步骤4)得到的磁性编码微球溶液,根据两种磁性编码微球的荧光强度分别计算得到待测样本中的胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。
13.优选的是,所述步骤1)具体包括:
14.将磁性多孔微球分散到十二烷基硫酸钠溶液中并超声处理,获得均匀分散的悬浮
液后,加入dvb甲醇溶液和apc染料,放入三口瓶中搅拌后,加热,反应结束后,得到磁性编码微球,用去离子水清洗,分离烘干待用;其中,通过加入不同量的apc染料获得两种具有不同荧光强度的磁性编码微球。
15.优选的是,所述步骤2)具体包括:
16.将步骤1)制得的两种磁性编码微球分别分散到两个容器中,对两个容器均进行如下处理:加入吗啉乙磺酸水溶液,超声混匀,加入nhs和edc水溶液,混匀;然后在两个容器中分别加入pgⅰ捕获抗体和pgⅱ捕获抗体,超声混匀后,避光震荡;反应完成后,磁吸分离出偶联有捕获抗体的磁性编码微球,清洗后加入封闭液,避光4℃过夜封闭;封闭完成后,磁吸分离出磁性编码微球,清洗,得到两种偶联有捕获抗体的磁性编码微球。
17.优选的是,所述步骤3)具体包括:
18.在容器中加入生物素和去离子水,超声震荡使生物素完全溶解,再加入nhs和edc水溶液,避光震荡,旋蒸后获得带有活泼酯的生物素;把带有活泼酯的生物素溶于去离子水中,分别和pgⅰ检测抗体、pgⅱ检测抗体混合,避光震荡,待反应完成后,用超滤管除去多余的生物素,分别得到标记有生物素的pgⅰ检测抗体和标记有生物素的pgⅱ检测抗体。
19.优选的是,所述步骤4)具体包括:
20.将待测样本和步骤2)得到的两种偶联有捕获抗体的磁性编码微球加入到容器中,水浴加热,反应完成后磁吸分离出磁性编码微球,并用磷酸盐缓冲液清洗;将磁性编码微球与步骤3)得到的标记有生物素的pgⅰ检测抗体和pgⅱ检测抗体混合,水浴加热,反应完成后磁吸分离出磁性编码微球,并与亲和素化的藻红蛋白混合,避光震荡,反应完成后得到磁性编码微球溶液。
21.优选的是,所述步骤5)中,通过两种具有不同荧光强度的磁性编码微球对两种胃癌肿瘤标志物进行通道分类,通过亲和素化的藻红蛋白作为报告分子,根据两个通道的荧光信号强度分别计算出胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。
22.本发明还提供一种胃蛋白酶原多重检测试剂盒,包括如上所述的磁性编码微球、pgⅰ捕获抗体、pgⅱ捕获抗体、pgⅰ检测抗体、pgⅱ检测抗体以及亲和素化的藻红蛋白,该检测试剂盒采用如上所述的检测方法进行胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的检测。
23.本发明的有益效果是:本发明提供的检测方法能同时检测患者血样中的胃蛋白酶原pgⅰ和pgⅱ,两种待检物能同时完成分析,减少了操作步骤,避免了实验中不同试剂带来的检测误差,缩短了检测时间,极可大程度的提高效率和检测的准确性。
附图说明
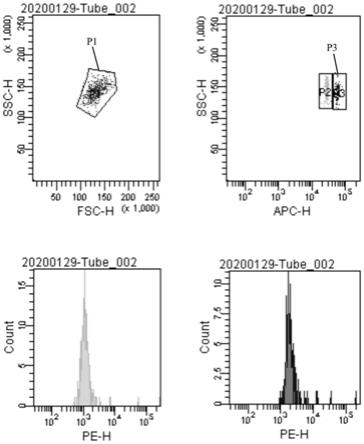
24.图1为本发明的实施例2中的流式检测结果;
25.图2为本发明的实施例2中的pgⅰ的标准曲线;
26.图3为本发明的实施例2中的pgⅱ的标准曲线;
27.图4为本发明的实施例2中的偶联有pgⅰ捕获抗体的磁性编码微球a的特异性检测结果;
28.图5为本发明的实施例2中的偶联有pgⅱ捕获抗体的磁性编码微球b的特异性检测结果。
具体实施方式
29.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
30.应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
31.实施例1
32.本实施例提供的一种胃蛋白酶原多重检测方法,包括以下步骤:
33.1)合成两种具有不同荧光强度的磁性编码微球:
34.将磁性多孔微球分散到sds(十二烷基硫酸钠)溶液中并超声处理,获得均匀分散的悬浮液后,加入dvb(二乙烯基苯)甲醇溶液和apc(别藻蓝蛋白)染料,放入三口瓶中搅拌后,加热,反应结束后,得到磁性编码微球,用去离子水清洗,分离烘干待用;其中,通过加入不同量的apc染料获得两种具有不同荧光强度的磁性编码微球。
35.2)在步骤1)得到的两种磁性编码微球上分别偶联可与胃蛋白酶原pgⅰ结合的pgⅰ捕获抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ捕获抗体:
36.将步骤1)制得的两种磁性编码微球分别分散到两个容器中,对两个容器均进行如下处理:加入mes(吗啉乙磺酸)水溶液,超声混匀,加入nhs(n
‑
羟基琥珀酰亚胺)和1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc)水溶液,混匀;然后在两个容器中分别加入pgⅰ捕获抗体和pgⅱ捕获抗体,超声混匀后,避光震荡;反应完成后,磁吸分离出偶联有捕获抗体的磁性编码微球,清洗后加入封闭液,避光4℃过夜封闭;封闭完成后,磁吸分离出磁性编码微球,清洗,得到两种偶联有捕获抗体的磁性编码微球。
37.3)制备标记有相同生物素的可与胃蛋白酶原pgⅰ结合的pgⅰ检测抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ检测抗体:
38.在容器中加入生物素和去离子水,超声震荡使生物素完全溶解,再加入nhs和edc水溶液,避光震荡,旋蒸后获得带有活泼酯的生物素;把带有活泼酯的生物素溶于去离子水中,分别和pgⅰ检测抗体、pgⅱ检测抗体混合,避光震荡,待反应完成后,用超滤管除去多余的生物素,分别得到标记有生物素的pgⅰ检测抗体和标记有生物素的pgⅱ检测抗体。
39.4)免疫反应:
40.将待测样本和步骤2)得到的两种偶联有捕获抗体的磁性编码微球加入到容器中,水浴加热,反应完成后磁吸分离出磁性编码微球,并用磷酸盐缓冲液清洗;将磁性编码微球与步骤3)得到的标记有生物素的pgⅰ检测抗体和pgⅱ检测抗体混合,水浴加热,反应完成后磁吸分离出磁性编码微球,并与亲和素化的藻红蛋白混合,避光震荡,反应完成后得到磁性编码微球溶液。
41.5)用流式细胞仪检测步骤4)得到的磁性编码微球溶液,根据两种磁性编码微球的荧光强度分别计算得到待测样本中的胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。其中,通过两种具有不同荧光强度的磁性编码微球对两种胃癌肿瘤标志物进行通道分类,通过亲和素化的藻红蛋白作为报告分子,根据两个通道的荧光信号强度分别计算出胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。
42.实施例2
43.本实施例提供的一种胃蛋白酶原多重检测方法,包括以下步骤:
44.1)合成两种具有不同荧光强度的磁性编码微球:
[0045]1‑
1)将10mg磁性聚苯乙烯多孔微球分散于10mlsds(0.25wt%)溶液中超声分散10min;
[0046]1‑
2)然后依次加入10mg kps(过硫酸钾)、40ul dvb甲醇溶液(1/100,v/v)、apc(别藻蓝蛋白)水溶液(1mg/ml)超声分散10min;
[0047]1‑
3)放入25ml三口瓶中搅拌10min后,逐渐升温至70℃,反应8小时;
[0048]1‑
4)先用水离心清洗三次,再用乙醇溶解磁吸附分离清洗三次,得到apc磁性荧光编码微球;
[0049]
步骤2)中,通过控制加入14ul和64ulapc水溶液(1mg/ml),制得两种具有不同荧光强度的磁性编码微球。
[0050]
2)在步骤1)得到的两种磁性编码微球上分别偶联可与胃蛋白酶原pgⅰ结合的pgⅰ捕获抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ捕获抗体:
[0051]2‑
1)取两种编码微球,分别加入到1号ep管和2号ep管中,微球加入量控制在106个左右,两个号ep管中均加入100ul的ph=6.0、浓度为50mm的mes水溶液,超声30s分散;
[0052]2‑
2)称取nhs和edc各0.05g分别加入到2个容器中,2个容器中均加入mes溶液1ml,分别配置成终浓度0.05g/ml的nhs水溶液和终浓度0.05g/ml的edc水溶液;
[0053]2‑
3)在1号ep管和2号ep管中均加入20ul nhs水溶液和20ul edc水溶液,超声混匀后,在1号ep管中加入pgⅰ捕获抗体10ul,在2号ep管中加入pgⅱ捕获抗体10ul,抗体浓度均为5mg/ml,避光震荡1h。
[0054]
3)制备标记有相同生物素的可与胃蛋白酶原pgⅰ结合的pgⅰ检测抗体和可与胃蛋白酶原pgⅱ结合的pgⅱ检测抗体:
[0055]3‑
1)在ep管中加入生物素10mg,去离子水50ul,超声震荡使生物素完全溶解;
[0056]3‑
2)在ep管中再加入浓度为10mg/ml的nhs和20mg/ml的edc水溶液各10ul,避光震荡,旋蒸后获得带有活泼酯的生物素;
[0057]3‑
3)在两个ep管中加入带有活泼酯的生物素,再加入去离子水30ul,然后分别加入pgⅰ检测抗体10ul、pgⅱ检测抗体10ul,检测抗体浓度均为5mg/ml;
[0058]3‑
4)超声30s混匀,避光震荡30分钟。
[0059]3‑
5)反应完成后,用超滤管除去多余的生物素,分别得到标记有生物素的pgⅰ检测抗体和标记有生物素的pgⅱ检测抗体
[0060]
4)免疫反应:
[0061]4‑
1)取步骤2)得到的两种偶联有捕获抗体的磁性编码微球各5000个,超声混匀后磁吸去上清,加入含有胃蛋白酶原的待测样本100ul,37℃水浴加热30min;反应完成后,磁吸去上清;
[0062]4‑
2)在ep管中加入步骤3)得到的标记有生物素的pgⅰ检测抗体和pgⅱ检测抗体100ul,37℃水浴加热30min;反应完成后,磁吸去上清;
[0063]4‑
3)在ep管中加入亲和素化的pe(藻红蛋白),避光震荡30min;反应完成后加入200ul磷酸盐缓冲液。
[0064]
5)用流式细胞仪检测步骤4)得到的磁性编码微球溶液,根据两种磁性编码微球的荧光强度分别计算得到待测样本中的胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。其中,通过
两种具有不同荧光强度的磁性编码微球对两种胃癌肿瘤标志物进行通道分类,通过亲和素化的藻红蛋白作为报告分子,根据两个通道的荧光信号强度分别计算出胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的浓度。
[0065]
参照图1,为本实施例中的流式检测结果图,上左图中,横纵坐标分别为前向、测向散射光强度,使用这两种参数可以初步按照样品中颗粒尺寸及颗粒度进行分群,圈出的p1即为磁性编码微球颗粒。上右图p2、p3为两种磁性编码微球,下面的两个图分别为两种磁性编码微球的pe荧光检测结果。
[0066]
步骤5)中,可预先制定胃蛋白酶原pgⅰ、pgⅱ的浓度与反应产物的荧光信号强度之间的关系的标准曲线,利用该标准曲线即可根据每个通道的荧光信号强度计算出胃蛋白酶原pgⅰ、pgⅱ的浓度。该标准曲线的建立方法为:采用0
‑
200ng/ml的具有一定浓度梯度的胃蛋白酶原pgⅰ/胃蛋白酶原pgⅱ的标准溶液代替实施例2中的步骤4)中的待测样本,按照实施例2的方法进行检测,根据得到的反应产物的荧光信号强度与胃蛋白酶原pgⅰ/pgⅱ标准溶液的浓度值,拟合得到标准曲线,图2为胃蛋白酶原pgⅰ的浓度与反应产物的荧光信号强度关系的标准曲线,图3为胃蛋白酶原pgⅱ的浓度与反应产物的荧光信号强度关系的标准曲线,可以看出,两条曲线的r2>0.99。
[0067]
本实施例中,还对偶联有pgⅰ捕获抗体的磁性编码微球a和偶联有pgⅱ捕获抗体的磁性编码微球b的特异性进行了检测,以磁性编码微球a的特异性为例,其检测方法为:
[0068]
用磁性编码微球a代替实施例2中的步骤4
‑
1)中的两种偶联有捕获抗体的磁性编码微球,然后用含有pgⅰ、pgⅱ、cea、afp、ca19
‑
9的混合溶液代替实施例2中的步骤4
‑
1)中的待测样本,按照实施例2的方法检测最终的反应产物的荧光信号强度,磁性编码微球a的检测结果如图4所示,磁性编码微球b的检测结果如图5所示,结果显示磁性编码微球a和磁性编码微球b均具有良好的特异性。
[0069]
实施例3
[0070]
本实施例提供一种胃蛋白酶原多重检测试剂盒,包括如实施例2所述的磁性编码微球、pgⅰ捕获抗体、pgⅱ捕获抗体、pgⅰ检测抗体、pgⅱ检测抗体以及亲和素化的藻红蛋白,该检测试剂盒采用如实施例2所述的检测方法进行胃蛋白酶原pgⅰ和胃蛋白酶原pgⅱ的检测。
[0071]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。