环丁基-脲衍生物
【技术领域】
1.本发明系关于式(i)的环丁基-脲衍生物及其作为药物的用途。本发明亦关于包括该等化合物的制备方法、含有一或多种式(i)化合物的医药组合物以及尤其其作为kv7钾通道开放剂的用途的相关方面。
背景技术:
2.kv信道由α-次单元的四聚体构成。各α-次单元由六个跨膜α-螺旋结构(s1-s6)组成,其中nh2及cooh末端均位于胞内。区域s1至 s4构成电压感测域,而s5及s6区域及其接头形成离子选择性孔。另外,辅助蛋白质为细胞溶质次单元或跨膜次单元(β)。
3.kv7家族包含由基因kcnq1-5编码的五个α-次单元kv7.1
‑ꢀ
5。此等α-次单元经配置为均四聚体(kv7.1、kv7.2或kv7.4)或杂四聚体 (kv7.2/3、kv7.3/5或kv7.4/5)。kv7.1主要定位于心肌细胞、胃肠道上皮、骨胳肌、血管及非血管平滑肌以及内耳中。在心肌细胞中,其缓慢激活i
ks
电流,i
ks
电流在心室再极化中起中心作用。kv7.2-kv7.5广泛表现于神经元组织中,其中kv7.2及kv7.3起主要作用且发现为kv7.2均四聚体或kv7.2/7.3及kv7.3/7.5杂四聚体。其为m电流的基础,其使静止膜电位稳定且减少动作电位发射。kv7.4表现于外毛细胞、中央听觉路径细胞核的神经元及腹侧盖区的多巴胺激导性神经元中。kv7.4及kv7.5亦在内脏、血管及呼吸道平滑肌、骨骼肌中广泛表现为kv7.4均四聚体或 kv7.4/7.5杂四聚体。其显著控制平滑肌细胞的听觉生理学及收缩性。最后,kv7.5仅见于异四聚体中,如先前所论述(miceli等人curr.med. chem.,2018,25,2637-2660;jones等人handb exp pharmacol.2021)。
4.kv7通道的激活在大约-60mv的电位下发生且导致钾流出及膜超极化。kv7信道中的功能障碍或突变可在生理学上引起各种离子通道病变(c.bock,a.link,future med.chem.2019,11,337-355)。神经元kv7通道负责调节神经元兴奋性的m-电流。由于m-电流在控制动作电位发射中的主要作用,kv7开放剂可能为神经元兴奋性增强系病理学的重要方面的疾病中的潜在疗法(maljevic等人,j.physiol.2008,586(7), 1791-1801;maljevic等人,pflugers arch.2010,460(2),277-88;jones 等人handb exp pharmacol.2021),诸如癫痫症(diao等人,2017, neuropsychiatry 7(1):26-31)、肌纤维颤动(dedek,kunath等人2001, proc natl acad sci u s a 98(21):12272-12277)、耳鸣(li等人elife 2015;4:e07242)、神经性及发炎性疼痛(rivera-arconada等人.,2017, oncotarget 8(8):12554-12555)、诸如酒精或精神兴奋剂的滥用的物质使用疾患(kang等人2017,neuropsychopharmacology 942(9):1813-1824; knapp等人2014,am j drug alcohol abuse 40(3):244-50;mcguier等人2016.addict biol.21(6):1097-1112),精神障碍,诸如焦虑(costi等人 2021,am j psychiatry 187(5):437-446;hansen等人2008,j physiol 586(7):1823-32;kang等人2017,neuropsychopharmacology 942(9): 1813-1824;tan等人2020,mol psychiatry 25(6):1323-1333)、精神分裂症(hansen等人2008,j physiol 586(7):1823-32)、抑郁(costi等人2021, am j psychiatry 187(5):437-446;
friedman等人2016,natcommun7:11671;su等人2019,frontcellneurosci13:557;tan等人2020,molpsychiatry25(6):1323-1333;su等人,2019,frontcellneurosci.13:557)、躁症(grunnet等人2014,eurjpharmacol726:133-7)、注意力不足过动症(grunnet等人2014,eurjpharmacol726:133-7)、泛自闭症障碍(gilling等人2013,frontgenet4:54;guglielmi等人2015,frontcellneurosci9:34)及躁郁症(borsotto等人2007,pharmacogenomicsj7(2):123-32),神经疾病,诸如肌肉萎缩性侧索硬化(dafinca等人2020,stemcellreports14(5):892-908;ghezzi等人2018,jphysiol596(13):2611-2629;wainger等人2014,cellrep7(1):1-11;wainger等人2021,jamaneurol78(2):186-196)、额颞叶型痴呆(dafinca等人2020,stemcellreports14(5):892-908)、原发性侧索硬化、假延髓性瘫痪、进行性延髓瘫痪、进行性肌肉萎缩、多发性硬化(pitt等人2000,natmed6(1):67-70)、阿兹海默氏病(fernandez-perez等人2020,scirep10(1):19606;ghatak等人2019,elife8;otto等人2004,neurology62(5):714-8)、帕金森氏症(chen等人2018,neuroscibull34(2):341-348;sander等人2012,neuropharmacology62(2):1052-61)、杭丁顿氏症(huntington'sdisease)(burgold等人2019,scirep9(1):6634)、克罗伊茨费尔特-雅各布布病(creuzfeld-jacobdisease)(otto等人2004,neurology62(5):714-8)及急性缺血性中风(gribkoff等人2001,natmed7(4):471-7;bierbowerel.2015,jneurosci35(5):2101-11)。由于kv7信道在其他组织中广泛分布,kv7开放剂亦可适用于影响内脏平滑肌的疾病中,诸如功能性消化不良、大肠急躁症及膀胱过动症,适用于影响血管平滑肌的疾病中,诸如高血压及脑血管痉挛,适用于影响呼吸道平滑肌诸如哮喘及慢性阻塞性肺病的疾病中及适用于听障及耳聋中(haick及byron2016,pharmacolther165:14-25;fosmo及skraastad2017,frontcardiovascmed4:75;xia等人2020.hearres388:107884)。
5.另外,kv7开放剂可为在与kcnq2、kcnq3、kcnq4、kcnq5相关的病症及与kcnq2、kcnq3、kcnq4、kcnq5的突变相关的病症中的潜在疗法(dedek,kunath等人2001,procnatlacadsciusa98(21):12272-12277;wuttke,jurkat-rott等人2007,neurology69(22):2045-2053;millichap,park等人2016,neurolgenet2(5):e96;allen等人2020,eurjpaediatrneurol2020;24:105-116;xia等人2020.hearres388:107884)。
6.更特定言之,kv7开放剂为适合的抗癫痫剂药物,如fda-批准的药物瑞替加滨(retigabine)/依佐加滨(ezogabine)所表明。瑞替加滨/依佐加滨藉由在通道门附近结合而激活不同kv7通道的钾电流,从而导致通道开放状态的稳定且使kcnq激活的电压依赖性转变为更超极化电位(gunthorpe,large等人2012,epilepsia53(3):412-424)。瑞替加滨/依佐加滨减少各种啮齿动物模型中的癫痫发作活性,包括急性癫痫发作模型、癫痫发作敏感性增强的基因模型,诸如展示全身性强直阵挛性癫痫发作的听觉性癫痫发作敏感性dba2小鼠,及诱发癫痫症的模型,诸如呈现局灶性癫痫发作传播至双侧强直阵挛性癫痫发作的大鼠点燃模型(rostock等人1996,epilepsyres23(3):211-223;tober等人1996,eurjpharmacol303(3):163-169;desarrog,dipaolaeg等人2001,naunyn-schmiedeberg'sarchpharmacol363:330-336)。在两项三期试验中,在患有抗药物性局灶性癫痫发作的患者中,瑞替加滨/依佐加滨显著降低癫痫发作频率(brodie,lerche等人2010,neurology75(20):1817-1824;french,abou-khalil等人2011,neurology76(18):1555-1563)。
7.此外,最近在已经诊断患有癫痫性脑病、婴儿/儿童癫痫症症候群或患有癫痫症的神经发育障碍的患者中鉴别出kcnq2及kcnq3 的突变(helbig及tayoun 2016,mol syndromol 7(4):172-181;heyne, singh等人2018,nat genet 50(7):1048-1053)。携带已知会引起野生型钾电流减少且在经诊断患有早发性癫痫症症候群的患者中鉴定出的kcnq2 或kcnq3变异体的基因嵌入型小鼠展示自发癫痫发作、癫痫发作临限值降低及瑞替加滨/依佐加滨减弱毒性的癫痫发作(singh,otto等人2008,j physiol 586(14):3405-3423;otto,singh等人2009,epilepsia 50(7): 1752-1759;tomonoh,deshimaru等人2014,plos one 9(2):e88549; ihara,tomonoh等人2016,plos one 11(2):e0150095;milh, roubertoux等人2020,epilepsia,doi:10.1111/epi.16494)。
8.因此,kv7开放剂可为癫痫症中的潜在疗法,包括具有或不具有受损意识的局灶性癫痫发作、具有运动或非运动发作症状的局灶性癫痫发作及具有或不具有局灶性癫痫发作发展为双侧强直阵挛性癫痫发作的癫痫症。kv7开放剂可为伴以全身性癫痫发作具有运动发作症状的癫痫症以及伴以未知癫痫发作的癫痫症或伴以创伤性脑损伤诱发的癫痫发作的癫痫症中的潜在疗法(diao等人,2017,neuropsychiatry 7(1):26-31; vigil,bozdemir等人2019,j cereb blood flow metab: 271678x19857818)。
9.kv7开放剂可为在具有或不具有神经发育障碍的新生儿发作癫痫症中的潜在疗法,包括诸如othahara症候群或早期婴儿癫痫脑病、早期肌痉挛脑病及具有抑制爆发模式的癫痫症的早期发作癫痫脑病,且亦包括良性或自限性家族性新生儿癫痫症(singh,westenskow等人2003, brain 126(pt 12):2726-2737;weckhuysen,mandelstam等人2012,annneurol 71(1):15-25;olson,kelly等人2017,ann neurol 81(3):419
‑ꢀ
429;milh,roubertoux等人2020,epilepsia,doi:10.1111/epi.16494)。
10.kv7开放剂可为婴儿/儿童癫痫症症候群中的潜在疗法,包括伴以神经发育障碍的癫痫症、儿童的局灶性癫痫症及特发性癫痫症症候群(neubauer等人2008,neurology 71(3):177-83;,kato等人2013, epilepsia 54(7):1282-7;lesca及depienne 2015,rev neurol(paris) 171(6-7):539-57;heyne等人2018,nat genet 50(7):1048-53;lindy等人2018,epilepsia 59(5):1062-71)。
11.wo2019/161877揭示醇衍生物,其激活kv7钾通道且主张治疗对kv7钾通道的激活有反应的病症。适用作钾通道开放剂的不同环状酰胺、乙酰胺及脲已揭示于ep3366683a1及wo2018/158256中,且五环噻吩基及二氢茚基脲衍生物揭示于ep3567034a1中。wo 2020/163268揭示吡啶-4-甲基脲衍生物作为kv7增强剂。
技术实现要素:
12.在旨在鉴别抗痉挛化合物的表型筛选程序的情况下,鉴别出新颖的环丁基脲衍生物,发现该等衍生物药理学上充当kv7开放剂,且可适用于治疗藉由kcnq钾通道来调节的疾病。
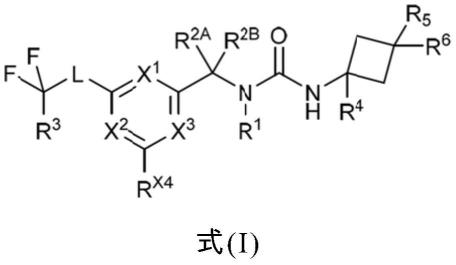
13.1)在第一实施例中,本发明系关于式(i)化合物
其中x1表示氮或cr
x1
;其中r
x1
表示氢、卤素(尤其氟)、(c
1-4
)烷基或(c
1-4
)烷氧基;x2表示氮或cr
x2
;其中r
x2
表示氢、卤素、(c
1-4
)烷基或(c
1-4
)烷氧基;x3表示氮或cr
x3
;其中r
x3
表示氢、卤素、(c
1-4
)烷基、(c
1-4
)烷氧基或羟基;r1表示氢或甲基;r
x4
表示氢、卤素(尤其氟)或(c
1-4
)烷基(尤其甲基);
·r2a
表示氢;(c
1-4
)烷基;(c
2-4
)烯基;(c
2-4
)炔基;(c
3-6
)环烷基;(c
1-4
)氟烷基;(c
1-4
)羟烷基;(c
1-4
)烷氧基-(c
1-2
)烷基;(c
1-2
)烷氧基-(c
1-2
)烷氧基-(c
1-2
)烷基;(c
1-2
)烷基-s-(c
1-2
)烷基;(c
1-2
)烷基-(so2)-(c
1-2
)烷基;氰基;(c
1-2
)氰基烷基;h2n-c(o)-(c
1-2
)烷基;(r
n1
)2n-(c
1-2
)烷基或 (r
n1
)2n-c(o)-,其中r
n1
独立地表示氢或(c
1-2
)烷基;或含有一至四个氮原子的5员杂芳基,其中该5员杂芳基系独立地未经取代或经(c
1-4
)烷基单取代;且r
2b
表示氢或甲基;或
·r2a
及r
2b
与其所连接的碳原子一起形成3至6个成员的环,其中完成该环所需的成员各自独立地选自-ch
2-及-o-,且其中该环不含有超过一个-o-成员;l表示一直接键、环丙-1,1-二基、-chr
l-o-*
、-o-ch
2-*
、-ch
2-nh-*
、
ꢀ‑
ch
2-n(ch3)-*
、-o-或-(so2)-;其中r
l
表示氢、(c
1-4
)烷基(尤其甲基)、 ch
3-o-ch
2-或(ch3)2nch
2-;其中星号表示连接至芳族碳原子的键;r3表示氢或氟;
·
r4表示氢或(c
1-4
)烷基(尤其甲基);r5表示氢、氟或羟基;及r6表示氟或(c1)氟烷基;或
·
r4及r5一起表示选自-ch
2-及-ch2ch
2-的桥连基团;及r6表示氢、氟、(c1)氟烷基或(c
1-4
)烷基(尤其甲基);及关于该等化合物的盐(特定言之医药学上可接受的盐)。【实施方式】
14.本文所提供的定义意欲一律应用于如实施例1)至40)中的任一者中所定义的式(i)化合物(及/或式(i
bc
)),且在细节上做必要的修正,在整个说明书及申请专利范围中除非另外明确地陈述,否则定义提供较宽或较窄定义。应充分理解,一术语的定义或较佳定义与如本文中所定义的任何或所有其他术语的任何定义或较佳定义独立地(及与其组合)定义且可替换各别术语。
15.如实施例1)至40)中的任一者中所定义的式(i)(及/或式(i
bc
))化合物可含有一或多个立体对称或不对称中心,诸如一或多个不对称碳原子。式(i)(及/或式(i
bc
))化合物可
因此以立体异构体的混合物形式或以立体异构富集形式,较佳以纯立体异构体形式存在。立体异构体的混合物可以熟习此项技术者已知的方式来分离。
16.术语「富集」(例如当用于对映异构体的上下文中时)在本发明的上下文中理解为尤其意谓各别对映异构体关于各别其他对映异构体以至少70:30的比率(细节上作必要修改:纯度),且尤其以至少90:10(细节上作必要修改:70%/90%的纯度)存在。较佳地,该术语系指各别基本纯对映异构体。术语「基本上」(例如当用于诸如「基本纯」的术语中时)在本发明的上下文中理解为尤其意谓各别立体异构体/组合物/化合物等以按各别纯立体异构体/组合物/化合物等的重量计至少90%,尤其至少95%且尤其至少99%的量构成。
17.当取代基称为视情况选用时,应理解,此类取代基可不存在(亦即各别残基关于此类视情况选用的取代基为未经取代),在此情况下,所有具有游离价数的位置(此类视情况选用的取代基可能已经连接至该等位置;例如在芳环,具有游离价数的环碳原子及/或环氮原子)在适当时经氢取代。同样地,倘若术语「视情况」用于(环)杂原子的情形下,则该术语意谓各别任选杂原子或类似者不存在(亦即,某一部分不含有杂原子/系碳环/或其类似者),或各别任选杂原子或类似者系如所明确定义而存在。
18.在本专利申请案中,点线展示所标绘的基团的连接点。举例而言,基团为3-(三氟甲基)苯基。
19.术语「卤素」意谓氟、氯或溴,较佳为氟或氯。在r
x1
、 r
x2
或r
x3
表示卤素的情况下,该术语较佳意谓氟-或氯-取代基,且更佳为氟-取代基。在r
x4
表示卤素的情况下,该术语较佳系指氟取代基。
20.单独或组合使用的术语「烷基」系指含有一至四个碳原子的直链或分支链饱和烃链。术语「(c
x-y
)烷基」(x及y各自为整数)系指含有x至y个碳原子的如先前所定义的烷基。举例而言,(c
1-4
)烷基含有一至四个碳原子。(c
1-4
)烷基的代表性实例为甲基、乙基、正丙基、异丙基、正丁基、异丁基、二级丁基及三级丁基;较佳为甲基。在r
x1
、r
x2
、 r
x3
、r
x4
、r
2a
、r4或r6表示「(c
1-4
)烷基」的情况下,该术语较佳意谓甲基。在r
l
表示「(c
1-4
)烷基」的情况下,术语较佳意谓甲基。在「(c
1-4
) 烷基」为「含有一至四个氮原子的5员杂芳基」的取代基的情况下,该术语较佳意谓甲基。
21.单独或组合使用的术语「烷氧基」系指烷基-o-基团,其中该烷基如先前所定义。术语「(c
x-y
)烷氧基」(x及y各自为整数)系指如先前所定义的含有x至y个碳原子的烷氧基。举例而言,(c
1-4
)烷氧基意谓式(c
1-4
)烷基-o-的基团,其中术语「(c
1-4
)烷基」具有此前给出的意义。(c
1-4
)烷氧基的代表性实例为甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、二级丁氧基及三级丁氧基。在r
x1
、r
x2
或r
x3
表示「(c
1-4
)烷氧基」的情况下,该术语较佳意谓甲氧基。
22.术语「(c
xa-ya
)烷氧基-(c
x-y
)烷基」(x、xa、y及ya各自为整数)系指如先前所定义的烷基,其中一个氢原子已经由如先前所定义的含有xa至ya个碳原子的(c
xa-ya
)烷氧基置换。在r
2a
表示「(c
1-4
)烷氧基
‑ꢀ
(c
1-2
)烷基」的情况下,则术语较佳意谓甲氧基甲基。
23.术语「(c
xa-ya
)烷氧基-(c
x-y
)烷氧基」(x、xa、y及ya各自为整数)系指如先前所定义
的含有x至y个碳原子的烷氧基,其中一个氢原子已经由如先前所定义的含有xa至ya个碳原子的(c
xa-ya
)烷氧基置换。举例而言,「(c
1-2
)烷氧基-(c
1-2
)烷氧基」系指如先前所定义含有一或两个碳原子的(c
1-2
)烷氧基,其中一个氢原子已经如先前所定义的含有一或两个碳原子的(c
1-2
)烷氧基置换。较佳地,(c
x-y
)烷氧基的氧原子及(c
xa-ya
)烷氧基的氧原子连接至(c
x-y
)烷氧基的不同碳原子。(c
1-2
)烷氧基-(c
1-2
)烷氧基的代表性实例包括甲氧基-甲氧基、2-甲氧基-乙氧基、乙氧基-甲氧基及2
‑ꢀ
乙氧基-乙氧基。
24.术语「(c
xa-ya
)烷氧基-(c
xb-yb
)烷氧基-(c
x-y
)烷基」(x、xa、 xb、y、ya及yb各自为整数)系指如先前所定义的烷基,其中一个氢原子已经由如先前所定义的(c
xa-ya
)烷氧基-(c
xb-yb
)烷氧基置换。在r
2a
表示「(c
1-2
) 烷氧基-(c
1-2
)烷氧基-(c
1-2
)烷基」的情况下,术语较佳意谓2-甲氧基-乙氧基-甲基。
25.术语「(c
1-4
)氟烷基」系指如先前所定义的含有一至四个碳原子的烷基,其中一或多个(及可能所有)氢原子已由氟置换。术语「(c
x-y
)氟烷基」(x及y各自为整数)系指含有x至y个碳原子的如先前所定义的氟烷基。举例而言,(c
1-4
)氟烷基含有一至四个碳原子,其中一至九个氢原子已经氟置换。(c
1-4
)氟烷基的代表性实例为氟甲基、二氟甲基、三氟甲基、2-氟乙基、2,2-二氟乙基及2,2,2-三氟乙基。较佳为(c1)氟烷基,诸如氟甲基、二氟甲基及三氟甲基。在r
2a
表示「(c
1-4
)氟烷基」或「(c1)氟烷基」的情况下,术语较佳意谓二氟甲基或三氟甲基,且更佳意谓二氟甲基。在r6表示「(c1)氟烷基」的情况下,术语较佳意谓氟甲基、二氟甲基或三氟甲基,且更佳意谓二氟甲基或三氟甲基。
26.单独或组合使用的术语「环烷基」系指含有三至六个碳原子的饱和碳环。术语「(c
x-y
)环烷基」(x及y各自为整数)系指如先前所定义的含有x至y个碳原子的环烷基。举例而言,(c
3-6
)环烷基含有三至六个碳原子。环烷基的代表性实例为环丙基、环丁基、环戊基及环己基。在 r
2a
表示「(c
3-6
)环烷基」的情况下,术语较佳意谓环丙基。
27.单独或组合使用的术语「烯基」系指含有二个至五个碳原子及一个碳-碳双键的直链或分支链烃链。术语「c
x-y
烯基」(x及y各自为整数)系指如先前所定义的含有x至y个碳原子的烯基。举例而言,(c
2-4
)烯基含有两个至四个碳原子。「(c
2-4
)烯基」基团的代表性实例为乙烯基、丙
ꢀ‑
1-烯-1-基、丙-2-烯-1-基、丁-2-烯-1-基、丁-1-烯-1-基及丁-3-烯-1-基。在r
2a
表示「(c
2-4
)烯基」的情况下,术语较佳意谓丙-2-烯-1-基。
28.单独或组合使用的术语术语「炔基」系指含有两个至六个(尤其两个至四个)碳原子的直链或分支链烃基,其中该烃基含有至少一个碳-碳参键。术语「(c
x-y
)炔基」(x及y各自为整数)系指如先前所定义的含有 x至y个碳原子的炔基。举例而言,(c
2-4
)炔基含有两个至四个碳原子。「(c
2-4
)炔基」基团的代表性实例为乙炔基、丙-1-炔-1-基、丙-2-炔-1
‑ꢀ
基、丁-2-炔-1-基、丁-1-炔-1-基及丁-3-炔-1-基。
29.术语「氰基」系指基团-cn。
30.术语「(c
x-y
)氰基烷基」(x及y各自为整数)系指如先前所定义的含有x至y个碳原子的烷基,其中一个氢原子已经氰基置换。「(c
1-2
) 氰基烷基」的代表性实例系氰基甲基及2-氰基乙基。在r
2a
表示「(c
1-2
)氰基烷基」的情况下,术语较佳意谓氰基甲基。
[0031]-(so2)-系指磺酰基且-c(o)-系指羰基。在r
2a
表示「(c
1-2
)烷基-(so2)-(c
1-2
)烷基」的情况下,术语较佳意谓甲基磺酰基-甲基及2
‑ꢀ
甲基磺酰基乙基。
[0032]
在r
2a
表示「(c
1-2
)烷基-s-(c
1-2
)烷基」的情况下,术语较佳意谓2-甲硫基-乙基。
[0033]
在r
2a
表示「h2n-c(o)-(c
1-2
)烷基」的情况下,术语较佳意谓3-胺基-3-侧氧基丙基;「(r
n1
)2n-(c
1-2
)烷基」较佳意谓二甲胺基-甲基;且「(r
n1
)2n-c(o)-」较佳意谓胺基羰基及甲胺基-羰基。
[0034]
在r
2a
表示「(c
1-4
)羟烷基」的情况下,术语较佳意谓羟甲基。
[0035]
单独或组合使用的术语术语「杂芳基」系指如所特定定义的杂芳基,该基团可未经取代或如所特定定义经取代。
[0036]
「含有一至四个氮原子的5员杂芳基」的代表性实例为吡咯基、咪唑基、吡唑基、三唑基、四唑基。该等5员杂芳基未经取代或如明确定义经取代。
[0037]
在l表示一直接键的情况下,此意谓片段表示:
[0038]
不论何时两个取代基一起表示「桥连基团」时,应理解,该等取代基所连接的原子经由如明确定义的-ch
2-或-ch2ch
2-桥连基团连接。
[0039]
2)本发明的第二实施例系关于如实施例1)的式(i)化合物,其中x1表示cr
x1
;其中r
x1
表示氢或卤素(尤其氟);x2表示氮或ch;x3表示氮或ch;r1表示氢;r
x4
表示氢、卤素(尤其氟)或(c
1-4
)烷基(尤其甲基);r
2a
表示氢;(c
1-4
)烷基;(c
1-4
)氟烷基;(c
1-4
)羟烷基;或(c
1-4
)烷氧基-(c
1-2
)烷基;r
2b
表示氢;l表示一直接键、-ch
2-o-*
或-o-;其中星号表示连接至芳族碳原子的键;r3表示氢或氟;
·
r4表示氢或(c
1-4
)烷基(尤其甲基);r5表示氢、氟或羟基;及r6表示氟或(c1)氟烷基;或
·
r4及r5一起表示选自-ch
2-及-ch2ch
2-的桥连基团;及r6表示氢、氟、(c1)氟烷基或(c
1-4
)烷基(尤其甲基);及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0040]
3)本发明的另一实施例系关于如实施例1)或2)中任一项的化合物,其中r
2a
表示氢、(c
1-4
)烷基、(c
1-4
)氟烷基、(c
1-4
)羟烷基或甲氧基甲基(且尤其氢、甲基、二氟甲基、羟甲基或甲氧基甲基);且r
2b
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0041]
4)本发明的另一实施例系关于根据实施例1)或2)中任一项的化合物,其中r
2a
及r
2b
均表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0042]
5)本发明的另一实施例系关于如实施例1)至4)中任一项的化合物,其中l表示一直接键或-ch
2-o-*
,其中星号指示连接至芳族碳原子的键;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0043]
6)本发明的另一实施例系关于如实施例1)至4)中任一项的化合物,其中l表示一直接键;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0044]
7)本发明的另一实施例系关于根据实施例1)至6)中任一项的化合物,其中r3表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0045]
8)本发明的另一实施例系关于根据实施例1)至6)中任一项的化合物,其中r3表示氟;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0046]
9)本发明的另一实施例系关于如实施例1)至8)中任一项的化合物,其中r
x4
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0047]
10)本发明的另一实施例系关于如实施例1)至9)中任一项的化合物,其中r
x1
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0048]
11)本发明的另一实施例系关于如实施例1)至10)中任一项的化合物,其中r
x2
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0049]
12)本发明的另一实施例系关于根据实施例1)至11)中任一项的化合物,其中r
x3
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0050]
13)本发明的另一实施例系关于如实施例1)至12)中任一项的化合物,其中x1表示cr
x1
;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0051]
14)本发明的另一实施例系关于如实施例1)至13)中任一项的化合物,其中x2表示cr
x2
;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0052]
15)本发明的另一实施例系关于如实施例1)至14)中任一项的化合物,其中x3表示cr
x3
;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0053]
16)本发明的另一实施例系关于如实施例1)至9)中任一项的化合物,其中x1、x2及x3各自表示ch;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0054]
17)本发明的另一实施例系关于如实施例1)至4)中任一项的化合物,其中片段表示:
·
其中r
x4
表示氢或卤素(尤其氟);r3表示氢或氟;l表示一直接键、
‑ꢀ
ch
2-o-*
或-o-;其中星号表示连接至芳族碳原子的键;或
·
其中x3表示氮或ch;r
x4
表示氢或(c
1-4
)烷基(尤其甲基);r3表示氢或氟;且l表示-ch
2-o-*
或-o-;其中星号指示连接至芳族碳原子的键;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0055]
18)本发明的另一实施例系关于如实施例1)至12)中任一项的化合物,其中片段:表示:及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0056]
19)本发明的另一实施例系关于如实施例1)至9)中任一项的化合物,其中片段:表示:其中x3表示氮或ch;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0057]
20)本发明的另一实施例系关于如实施例1)至4)中任一项的化合物,其中片段:表示独立地选自以下群组a)至c)的环:a)
或b)或c)其中以上群组a)、b)及c)中的每一者形成特定子实施例;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0058]
21)本发明的另一实施例系关于如实施例1)至3)及5)至20)中任一项的式(i)化合物,其中在r
2b
表示氢且r
2a
与氢不同的情况下,该等取代基 r
2a
及r
2b
所连接的碳原子经(r)-组态;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0059]
22)本发明的另一实施例系关于如实施例1)至3)及5)至20)中任一项的式(i)化合物,其中在r
2b
表示氢且r
2a
与氢不同的情况下,该等取代基 r
2a
及r
2b
所连接的碳原子经(s)-组态;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0060]
23)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中
·
r4表示氢;r5表示氢或氟;及r6表示氟或(c1)氟烷基(尤其氟、二氟甲基或三氟甲基);或
·
r4及r5一起表示-ch
2-桥连基团;且r6表示氢、氟或(c1)氟烷基(尤其二氟甲基或三氟甲基);或及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0061]
24)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中
·
r4及r5表示氢;且r6表示(c1)氟烷基(尤其二氟甲基或三氟甲基);或
·
r4及r5一起表示-ch
2-桥连基团;且r6表示(c1)氟烷基(尤其二氟甲基或三氟甲基);及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0062]
25)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中r4表示
氢;r5表示氢或氟;且r6表示氟、二氟甲基或三氟甲基;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0063]
26)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中r4及r5表示氢;且r6表示二氟甲基;及该等化合物的盐(特定言之,医药学上可接受的盐)。
[0064]
27)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中r4及r5一起表示-ch
2-桥连基团;且r6表示氢、氟、二氟甲基或三氟甲基;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0065]
28)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中r4及r5一起表示-ch
2-桥连基团;且r6表示二氟甲基;及该等化合物的盐(特定言之医药学上可接受的盐)。
[0066]
29)本发明的另一实施例系关于如实施例1)至22)中任一项的化合物,其中片段表示独立地选自以下群组a)至c)的片段:a)b)或c)其中以上群组a)、b)及c)中的每一者形成特定子实施例;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0067]
30)本发明的另一实施例系关于根据实施例1)至29)中任一项的化合物,其中r1表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0068]
31)本发明的另一实施例系关于如实施例1)的化合物,其为式(i
bc
)化合物
其中x1表示cr
x1
;其中r
x1
表示氢或卤素(尤其氟);x2表示氮或ch;x3表示氮或ch;r
x4
表示氢、卤素(尤其氟)或(c
1-4
)烷基(尤其甲基);r
2a
表示氢、(c
1-4
)烷基、(c
1-4
)氟烷基、(c
1-4
)羟烷基或(c
1-4
)烷氧基
‑ꢀ
(c
1-2
)烷基;l表示一直接键、-ch
2-o-*
或-o-;r3表示氢或氟;r6表示氢、氟、(c1)氟烷基或(c
1-4
)烷基(尤其甲基);及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0069]
32)本发明的另一实施例系关于如实施例31)的化合物,其中x1表示 ch,x2表示ch,且x3表示ch;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0070]
33)本发明的另一实施例系关于如实施例31)或32)中任一项的化合物,其中r
x4
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0071]
34)本发明的另一实施例系关于如实施例31)至33)中任一项的化合物,其中r
2a
表示氢、甲基、(c1)氟烷基或甲氧基甲基;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0072]
35)本发明的另一实施例系关于根据实施例31)至33)中任一项的化合物,其中r
2a
表示氢;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0073]
36)本发明的另一实施例系关于如实施例31)至35)中任一项的化合物,其中l表示一直接键;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0074]
37)本发明的另一实施例系关于如实施例31)至36)中任一项的化合物,其中r6表示氟、(c1)氟烷基或甲基;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0075]
38)本发明的另一实施例系关于如实施例31)至36)中任一项的化合物,其中r6表示二氟甲基或三氟甲基;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0076]
39)因此,本发明系关于如实施例1)中所定义的式(i)化合物,及由根据实施例2)
至38)中任一项的特征进一步限制的该等化合物,考虑到其各别相关性;系关于其医药学上可接受的盐;以及系关于如下文进一步描述的该等化合物的用途。为避免任何疑义,尤其与式(i)(及/或式(i
bc
))化合物相关的以下实施例因此为可能的且意欲且因此以个别化形式特定揭示:1、2 1、3 1、3 2 1、4 1、4 2 1、5 1、6 1、6 2 1、 6 3 1、6 3 2 1、6 4 1、6 4 2 1、7 1、8 1、9 1、9 2 1、 9 3 1、9 3 2 1、9 4 1、9 4 2 1、9 5 1、9 6 1、9 6 2 1、 9 6 3 1、9 6 3 2 1、9 6 4 1、9 6 4 2 1、9 7 1、9 8 1、 10 1、11 1、12 1、13 1、14 1、15 1、16 1、16 2 1、16 3 1、16 3 2 1、16 4 1、16 4 2 1、16 5 1、16 6 1、16 6 2 1、 16 6 3 1、16 6 3 2 1、16 6 4 1、16 6 4 2 1、16 7 1、 16 8 1、16 9 1、16 9 2 1、16 9 3 1、16 9 3 2 1、16 9 4 1、 16 9 4 2 1、16 9 5 1、16 9 6 1、16 9 6 2 1、16 9 6 3 1、 16 9 6 3 2 1、16 9 6 4 1、16 9 6 4 2 1、16 9 7 1、 16 9 8 1、17 1、17 2 1、17 3 1、17 3 2 1、17 4 1、 17 4 2 1、18 1、19 1、20 1、20 2 1、20 3 1、20 3 2 1、 20 4 1、20 4 2 1、21 1、22 1、23 1、23 2 1、23 3 1、 23 3 2 1、23 4 1、23 4 2 1、23 5 1、23 6 1、23 6 2 1、 23 6 3 1、23 6 3 2 1、23 6 4 1、23 6 4 2 1、23 7 1、 23 8 1、23 9 1、23 9 2 1、23 9 3 1、23 9 3 2 1、23 9 4 1、 23 9 4 2 1、23 9 5 1、23 9 6 1、23 9 6 2 1、23 9 6 3 1、 23 9 6 3 2 1、23 9 6 4 1、23 9 6 4 2 1、23 9 7 1、 23 9 8 1、23 10 1、23 11 1、23 12 1、23 13 1、23 14 1、 23 15 1、23 16 1、23 16 2 1、23 16 3 1、23 16 3 2 1、 23 16 4 1、23 16 4 2 1、23 16 5 1、23 16 6 1、 23 16 6 2 1、23 16 6 3 1、23 16 6 3 2 1、23 16 6 4 1、 23 16 6 4 2 1、23 16 7 1、23 16 8 1、23 16 9 1、 23 16 9 2 1、23 16 9 3 1、23 16 9 3 2 1、23 16 9 4 1、 23 16 9 4 2 1、23 16 9 5 1、23 16 9 6 1、23 16 9 6 2 1、 23 16 9 6 3 1、23 16 9 6 3 2 1、23 16 9 6 4 1、 23 16 9 6 4 2 1、23 16 9 7 1、23 16 9 8 1、23 17 1、23 17 2 1、23 17 3 1、23 17 3 2 1、23 17 4 1、 23 17 4 2 1、23 18 1、23 19 1、23 20 1、23 20 2 1、 23 20 3 1、23 20 3 2 1、23 20 4 1、23 20 4 2 1、23 21 1、 23 22 1、24 1、25 1、25 2 1、25 3 1、25 3 2 1、25 4 1、 25 4 2 1、25 5 1、25 6 1、25 6 2 1、25 6 3 1、25 6 3 2 1、 25 6 4 1、25 6 4 2 1、25 7 1、25 8 1、25 9 1、25 9 2 1、 25 9 3 1、25 9 3 2 1、25 9 4 1、25 9 4 2 1、25 9 5 1、 25 9 6 1、25 9 6 2 1、25 9 6 3 1、25 9 6 3 2 1、 25 9 6 4 1、25 9 6 4 2 1、25 9 7 1、25 9 8 1、25 10 1、 25 11 1、25 12 1、25 13 1、25 14 1、25 15 1、25 16 1、 25 16 2 1、25 16 3 1、25 16 3 2 1、25 16 4 1、 25 16 4 2 1、25 16 5 1、25 16 6 1、25 16 6 2 1、 25 16 6 3 1、25 16 6 3 2 1、25 16 6 4 1、25 16 6 4 2 1、 25 16 7 1、25 16 8 1、25 16 9 1、25 16 9 2 1、 25 16 9 3 1、25 16 9 3 2 1、25 16 9 4 1、25 16 9 4 2 1、 25 16 9 5 1、25 16 9 6 1、25 16 9 6 2 1、25 16 9 6 3 1、 25 16 9 6 3 2 1、25 16 9 6 4 1、25 16 9 6 4 2 1、 25 16 9 7 1、25 16 9 8 1、25 17 1、25 17 2 1、25 17 3 1、 25 17 3 2 1、25 17 4 1、25 17 4 2 1、25 18 1、25 19 1、 25 20 1、25 20 2 1、25 20 3 1、25 20 3 2 1、25 20 4 1、 25 20 4 2 1、25 21 1、25 22 1、26 1、27 1、27 2 1、27 3 1、 27 3 2 1、27 4 1、27 4 2 1、27 5 1、27 6 1、27 6 2 1、27 6 3 1、27 6 3 2 1、27 6 4 1、27 6 4 2 1、27 7 1、 27 8 1、27 9 1、27 9 2 1、27 9 3 1、27 9 3 2 1、27 9 4 1、 27 9 4 2 1、27 9 5 1、27 9 6 1、27 9 6 2 1、27 9 6 3 1、 27 9 6 3 2 1、27 9 6 4 1、27 9 6 4 2 1、27 9 7 1、 27 9 8 1、27 10 1、27 11 1、27 12 1、27 13 1、27 14 1、 27 15 1、27 16 1、27 16 2 1、27 16 3 1、27
16 3 2 1、 27 16 4 1、27 16 4 2 1、27 16 5 1、27 16 6 1、 27 16 6 2 1、27 16 6 3 1、27 16 6 3 2 1、27 16 6 4 1、 27 16 6 4 2 1、27 16 7 1、27 16 8 1、27 16 9 1、 27 16 9 2 1、27 16 9 3 1、27 16 9 3 2 1、27 16 9 4 1、 27 16 9 4 2 1、27 16 9 5 1、27 16 9 6 1、27 16 9 6 2 1、 27 16 9 6 3 1、27 16 9 6 3 2 1、27 16 9 6 4 1、 27 16 9 6 4 2 1、27 16 9 7 1、27 16 9 8 1、27 17 1、 27 17 2 1、27 17 3 1、27 17 3 2 1、27 17 4 1、 27 17 4 2 1、27 18 1、27 19 1、27 20 1、27 20 2 1、 27 20 3 1、27 20 3 2 1、27 20 4 1、27 20 4 2 1、27 21 1、 27 22 1、28 1、29 1、29 2 1、29 3 1、29 3 2 1、29 4 1、 29 4 2 1、29 5 1、29 6 1、29 6 2 1、29 6 3 1、29 6 3 2 1、 29 6 4 1、29 6 4 2 1、29 7 1、29 8 1、29 9 1、29 9 2 1、 29 9 3 1、29 9 3 2 1、29 9 4 1、29 9 4 2 1、29 9 5 1、 29 9 6 1、29 9 6 2 1、29 9 6 3 1、29 9 6 3 2 1、 29 9 6 4 1、29 9 6 4 2 1、29 9 7 1、29 9 8 1、29 10 1、29 11 1、29 12 1、29 13 1、29 14 1、29 15 1、29 16 1、 29 16 2 1、29 16 3 1、29 16 3 2 1、29 16 4 1、 29 16 4 2 1、29 16 5 1、29 16 6 1、29 16 6 2 1、 29 16 6 3 1、29 16 6 3 2 1、29 16 6 4 1、29 16 6 4 2 1、 29 16 7 1、29 16 8 1、29 16 9 1、29 16 9 2 1、 29 16 9 3 1、29 16 9 3 2 1、29 16 9 4 1、29 16 9 4 2 1、 29 16 9 5 1、29 16 9 6 1、29 16 9 6 2 1、29 16 9 6 3 1、 29 16 9 6 3 2 1、29 16 9 6 4 1、29 16 9 6 4 2 1、 29 16 9 7 1、29 16 9 8 1、29 17 1、29 17 2 1、29 17 3 1、 29 17 3 2 1、29 17 4 1、29 17 4 2 1、29 18 1、29 19 1、 29 20 1、29 20 2 1、29 20 3 1、29 20 3 2 1、29 20 4 1、 29 20 4 2 1、29 21 1、29 22 1、30 1、30 2 1、30 3 1、 30 3 2 1、30 4 1、30 4 2 1、30 5 1、30 6 1、30 6 2 1、 30 6 3 1、30 6 3 2 1、30 6 4 1、30 6 4 2 1、30 7 1、 30 8 1、30 9 1、30 9 2 1、30 9 3 1、30 9 3 2 1、30 9 4 1、 30 9 4 2 1、30 9 5 1、30 9 6 1、30 9 6 2 1、30 9 6 3 1、 30 9 6 3 2 1、30 9 6 4 1、30 9 6 4 2 1、30 9 7 1、 30 9 8 1、30 10 1、30 11 1、30 12 1、30 13 1、30 14 1、 30 15 1、30 16 1、30 16 2 1、30 16 3 1、30 16 3 2 1、 30 16 4 1、30 16 4 2 1、30 16 5 1、30 16 6 1、 30 16 6 2 1、30 16 6 3 1、30 16 6 3 2 1、30 16 6 4 1、 30 16 6 4 2 1、30 16 7 1、30 16 8 1、30 16 9 1、30 16 9 2 1、30 16 9 3 1、30 16 9 3 2 1、30 16 9 4 1、 30 16 9 4 2 1、30 16 9 5 1、30 16 9 6 1、30 16 9 6 2 1、 30 16 9 6 3 1、30 16 9 6 3 2 1、30 16 9 6 4 1、 30 16 9 6 4 2 1、30 16 9 7 1、30 16 9 8 1、30 17 1、 30 17 2 1、30 17 3 1、30 17 3 2 1、30 17 4 1、 30 17 4 2 1、30 18 1、30 19 1、30 20 1、30 20 2 1、 30 20 3 1、30 20 3 2 1、30 20 4 1、30 20 4 2 1、30 21 1、 30 22 1、30 23 1、30 23 2 1、30 23 3 1、30 23 3 2 1、 30 23 4 1、30 23 4 2 1、30 23 5 1、30 23 6 1、 30 23 6 2 1、30 23 6 3 1、30 23 6 3 2 1、30 23 6 4 1、 30 23 6 4 2 1、30 23 7 1、30 23 8 1、30 23 9 1、 30 23 9 2 1、30 23 9 3 1、30 23 9 3 2 1、30 23 9 4 1、 30 23 9 4 2 1、30 23 9 5 1、30 23 9 6 1、30 23 9 6 2 1、 30 23 9 6 3 1、30 23 9 6 3 2 1、30 23 9 6 4 1、 30 23 9 6 4 2 1、30 23 9 7 1、30 23 9 8 1、30 23 10 1、 30 23 11 1、30 23 12 1、30 23 13 1、30 23 14 1、 30 23 15 1、30 23 16 1、30 23 16 2 1、30 23 16 3 1、 30 23 16 3 2 1、30 23 16 4 1、30 23 16 4 2 1、 30 23 16 5 1、30 23 16 6 1、30 23 16 6 2 1、 30 23 16 6 3 1、30 23 16 6 3 2 1、30 23 16 6 4 1、 30 23 16 6 4 2 1、30 23 16 7 1、30 23 16 8 1、 30 23 16 9 1、30 23 16 9 2 1、30 23 16 9 3 1、30 23 16 9 3 2 1、30 23 16 9 4 1、30 23 16 9 4 2 1、 30 23 16 9 5 1、30 23 16 9 6 1、30 23
16 9 6 2 1、 30 23 16 9 6 3 1、30 23 16 9 6 3 2 1、30 23 16 9 6 4 1、 30 23 16 9 6 4 2 1、30 23 16 9 7 1、30 23 16 9 8 1、 30 23 17 1、30 23 17 2 1、30 23 17 3 1、30 23 17 3 2 1、 30 23 17 4 1、30 23 17 4 2 1、30 23 18 1、30 23 19 1、 30 23 20 1、30 23 20 2 1、30 23 20 3 1、30 23 20 3 2 1、 30 23 20 4 1、30 23 20 4 2 1、30 23 21 1、30 23 22 1、 30 24 1、30 25 1、30 25 2 1、30 25 3 1、30 25 3 2 1、 30 25 4 1、30 25 4 2 1、30 25 5 1、30 25 6 1、 30 25 6 2 1、30 25 6 3 1、30 25 6 3 2 1、30 25 6 4 1、 30 25 6 4 2 1、30 25 7 1、30 25 8 1、30 25 9 1、 30 25 9 2 1、30 25 9 3 1、30 25 9 3 2 1、30 25 9 4 1、 30 25 9 4 2 1、30 25 9 5 1、30 25 9 6 1、30 25 9 6 2 1、 30 25 9 6 3 1、30 25 9 6 3 2 1、30 25 9 6 4 1、 30 25 9 6 4 2 1、30 25 9 7 1、30 25 9 8 1、30 25 10 1、 30 25 11 1、30 25 12 1、30 25 13 1、30 25 14 1、 30 25 15 1、30 25 16 1、30 25 16 2 1、30 25 16 3 1、 30 25 16 3 2 1、30 25 16 4 1、30 25 16 4 2 1、 30 25 16 5 1、30 25 16 6 1、30 25 16 6 2 1、 30 25 16 6 3 1、30 25 16 6 3 2 1、30 25 16 6 4 1、 30 25 16 6 4 2 1、30 25 16 7 1、30 25 16 8 1、30 25 16 9 1、30 25 16 9 2 1、30 25 16 9 3 1、 30 25 16 9 3 2 1、30 25 16 9 4 1、30 25 16 9 4 2 1、 30 25 16 9 5 1、30 25 16 9 6 1、30 25 16 9 6 2 1、 30 25 16 9 6 3 1、30 25 16 9 6 3 2 1、30 25 16 9 6 4 1、 30 25 16 9 6 4 2 1、30 25 16 9 7 1、30 25 16 9 8 1、 30 25 17 1、30 25 17 2 1、30 25 17 3 1、30 25 17 3 2 1、 30 25 17 4 1、30 25 17 4 2 1、30 25 18 1、30 25 19 1、 30 25 20 1、30 25 20 2 1、30 25 20 3 1、30 25 20 3 2 1、 30 25 20 4 1、30 25 20 4 2 1、30 25 21 1、30 25 22 1、 30 26 1、30 27 1、30 27 2 1、30 27 3 1、30 27 3 2 1、 30 27 4 1、30 27 4 2 1、30 27 5 1、30 27 6 1、 30 27 6 2 1、30 27 6 3 1、30 27 6 3 2 1、30 27 6 4 1、 30 27 6 4 2 1、30 27 7 1、30 27 8 1、30 27 9 1、 30 27 9 2 1、30 27 9 3 1、30 27 9 3 2 1、30 27 9 4 1、 30 27 9 4 2 1、30 27 9 5 1、30 27 9 6 1、30 27 9 6 2 1、 30 27 9 6 3 1、30 27 9 6 3 2 1、30 27 9 6 4 1、 30 27 9 6 4 2 1、30 27 9 7 1、30 27 9 8 1、30 27 10 1、 30 27 11 1、30 27 12 1、30 27 13 1、30 27 14 1、 30 27 15 1、30 27 16 1、30 27 16 2 1、30 27 16 3 1、 30 27 16 3 2 1、30 27 16 4 1、30 27 16 4 2 1、 30 27 16 5 1、30 27 16 6 1、30 27 16 6 2 1、 30 27 16 6 3 1、30 27 16 6 3 2 1、30 27 16 6 4 1、30 27 16 6 4 2 1、30 27 16 7 1、30 27 16 8 1、 30 27 16 9 1、30 27 16 9 2 1、30 27 16 9 3 1、 30 27 16 9 3 2 1、30 27 16 9 4 1、30 27 16 9 4 2 1、 30 27 16 9 5 1、30 27 16 9 6 1、30 27 16 9 6 2 1、 30 27 16 9 6 3 1、30 27 16 9 6 3 2 1、30 27 16 9 6 4 1、 30 27 16 9 6 4 2 1、30 27 16 9 7 1、30 27 16 9 8 1、 30 27 17 1、30 27 17 2 1、30 27 17 3 1、30 27 17 3 2 1、 30 27 17 4 1、30 27 17 4 2 1、30 27 18 1、30 27 19 1、 30 27 20 1、30 27 20 2 1、30 27 20 3 1、30 27 20 3 2 1、 30 27 20 4 1、30 27 20 4 2 1、30 27 21 1、30 27 22 1、 30 28 1、30 29 1、30 29 2 1、30 29 3 1、30 29 3 2 1、 30 29 4 1、30 29 4 2 1、30 29 5 1、30 29 6 1、 30 29 6 2 1、30 29 6 3 1、30 29 6 3 2 1、30 29 6 4 1、 30 29 6 4 2 1、30 29 7 1、30 29 8 1、30 29 9 1、 30 29 9 2 1、30 29 9 3 1、30 29 9 3 2 1、30 29 9 4 1、 30 29 9 4 2 1、30 29 9 5 1、30 29 9 6 1、30 29 9 6 2 1、 30 29 9 6 3 1、30 29 9 6 3 2 1、30 29 9 6 4 1、 30 29 9 6 4 2 1、30 29 9 7 1、30 29 9 8 1、30 29 10 1、 30 29 11 1、30 29 12 1、30 29 13 1、30 29 14 1、 30 29
15 1、30 29 16 1、30 29 16 2 1、30 29 16 3 1、 30 29 16 3 2 1、30 29 16 4 1、30 29 16 4 2 1、 30 29 16 5 1、30 29 16 6 1、30 29 16 6 2 1、30 29 16 6 3 1、30 29 16 6 3 2 1、30 29 16 6 4 1、 30 29 16 6 4 2 1、30 29 16 7 1、30 29 16 8 1、 30 29 16 9 1、30 29 16 9 2 1、30 29 16 9 3 1、 30 29 16 9 3 2 1、30 29 16 9 4 1、30 29 16 9 4 2 1、 30 29 16 9 5 1、30 29 16 9 6 1、30 29 16 9 6 2 1、 30 29 16 9 6 3 1、30 29 16 9 6 3 2 1、30 29 16 9 6 4 1、 30 29 16 9 6 4 2 1、30 29 16 9 7 1、30 29 16 9 8 1、 30 29 17 1、30 29 17 2 1、30 29 17 3 1、30 29 17 3 2 1、 30 29 17 4 1、30 29 17 4 2 1、30 29 18 1、30 29 19 1、 30 29 20 1、30 29 20 2 1、30 29 20 3 1、30 29 20 3 2 1、 30 29 20 4 1、30 29 20 4 2 1、30 29 21 1、30 29 22 1、 31 1、32 31 1、33 31 1、33 32 31 1、34 31 1、34 32 31 1、 34 33 31 1、34 33 32 31 1、35 31 1、35 32 31 1、 35 33 31 1、35 33 32 31 1、36 31 1、36 32 31 1、 36 33 31 1、36 33 32 31 1、36 34 31 1、36 34 32 31 1、 36 34 33 31 1、36 34 33 32 31 1、36 35 31 1、 36 35 32 31 1、36 35 33 31 1、36 35 33 32 31 1、37 31 1、 37 32 31 1、37 33 31 1、37 33 32 31 1、37 34 31 1、 37 34 32 31 1、37 34 33 31 1、37 34 33 32 31 1、 37 35 31 1、37 35 32 31 1、37 35 33 31 1、 37 35 33 32 31 1、37 36 31 1、37 36 32 31 1、 37 36 33 31 1、37 36 33 32 31 1、37 36 34 31 1、37 36 34 32 31 1、37 36 34 33 31 1、37 36 34 33 32 31 1、 37 36 35 31 1、37 36 35 32 31 1、37 36 35 33 31 1、 37 36 35 33 32 31 1、38 31 1、38 32 31 1、38 33 31 1、 38 33 32 31 1、38 34 31 1、38 34 32 31 1、38 34 33 31 1、 38 34 33 32 31 1、38 35 31 1、38 35 32 31 1、 38 35 33 31 1、38 35 33 32 31 1、38 36 31 1、 38 36 32 31 1、38 36 33 31 1、38 36 33 32 31 1、 38 36 34 31 1、38 36 34 32 31 1、38 36 34 33 31 1、 38 36 34 33 32 31 1、38 36 35 31 1、38 36 35 32 31 1、38 36 35 33 31 1、38 36 35 33 32 31 1。
[0077]
在以上列举中,数字系指根据上文所提供的实施例编号的实施例,而「 」指示与另一实施例的依附性。不同个别化实施例藉由顿号分离。换言之,例如「3 2 1」系指实施例3)视实施例2)而定,视实施例1)而定,亦即,实施例「3 2 1」对应于进一步由实施例2)及3)的特征限制的实施例1)的化合物。
[0078]
40)另一实施例系关于根据实施例1)的式(i)化合物,其系选自以下化合物:1-(3,3-二氟-环丁基)-3-(3-三氟甲基-苄基)-脲;1-双环[1.1.1]戊-1-基-3-[1-(3-三氟甲基-苯基)-乙基]-脲;1-(3-二氟甲基-环丁基)-3-[1-(3-三氟甲基-苯基)-乙基]-脲;1-(3-氟-双环[1.1.1]戊-1-基)-3-[1-(3-三氟甲基-苯基)-乙基]-脲;1-(3-二氟甲基-双环[1.1.1]戊-1-基)-3-[1-(3-三氟甲基-苯基)-乙基]
‑ꢀ
脲;1-双环[1.1.1]戊-1-基-3-[1-(3-三氟甲氧基-苯基)-乙基]-脲;1-(3-二氟甲基-环丁基)-3-[1-(3-三氟甲氧基-苯基)-乙基]-脲;1-(3-氟-双环[1.1.1]戊-1-基)-3-[1-(3-三氟甲氧基-苯基)-乙基]-脲;1-[2,2-二氟-1-(3-三氟甲基-苯基)-乙基]-3-(3-羟基-3-三氟甲基-环丁基)-脲;1-(3,3-二氟-1-甲基-环丁基)-3-[2,2-二氟-1-(3-三氟甲基-苯基)-乙基]-脲;1-双环[1.1.1]戊-1-基-3-[1-(3-二氟甲氧基-苯基)-乙基]-脲;
脲;1-[2-(2,2,2-三氟-乙氧基)-吡啶-4-基甲基]-3-(3-三氟甲基-双环 [1.1.1]戊-1-基)-脲;1-(3-二氟甲基-环丁基)-3-[2-(2,2,2-三氟-乙氧基)-吡啶-4-基甲基]
‑ꢀ
脲;1-(3-二氟甲基-双环[1.1.1]戊-1-基)-3-(3-三氟甲基-苄基)-脲;1-双环[2.1.1]己-1-基-3-(3-三氟甲基-苄基)-脲;1-(3,3-二氟-1-甲基-环丁基)-3-(3-三氟甲基-苄基)-脲;1-(3-(三氟甲基)苄基)-3-((1s,3s)-3-(三氟甲基)环丁基)脲;1-(3-(三氟甲基)苄基)-3-((1r,3r)-3-(三氟甲基)环丁基)脲;1-((1s,3s)-3-(二氟甲基)环丁基)-3-(3-(三氟甲基)苄基)脲;1-((1r,3r)-3-(二氟甲基)环丁基)-3-(3-(三氟甲基)苄基)脲;1-{(s)-1-[2-甲基-6-(2,2,2-三氟-乙氧基)-嘧啶-4-基]-乙基}-3-(3-三氟甲基-双环[1.1.1]戊-1-基)-脲;1-((1r,3r)-3-(二氟甲基)环丁基)-3-((2-(2,2,2-三氟乙氧基)吡啶-4-基) 甲基)脲;1-((1s,3s)-3-(二氟甲基)环丁基)-3-((2-(2,2,2-三氟乙氧基)吡啶-4-基) 甲基)脲;1-((1s,3r)-3-(二氟甲基)环丁基)-3-((s)-1-(3-(三氟甲氧基)苯基)乙基)脲;及1-((1r,3s)-3-(二氟甲基)环丁基)-3-((s)-1-(3-(三氟甲氧基)苯基)乙基) 脲;及关于该等化合物的盐(特定言之医药学上可接受的盐)。
[0079]
应理解,就上列化合物中任一者而言,未明确指定的立体对称中心可呈绝对(r)-或绝对(s)-组态;例如列为1-双环[1.1.1]戊-1-基
‑ꢀ
3-[1-(3-三氟甲基-苯基)-乙基]-脲的化合物可为(s)-1-双环[1.1.1]戊-1-基
‑ꢀ
3-[1-(3-三氟甲基-苯基)-乙基]-脲、(r)-1-双环[1.1.1]戊-1-基-3-[1-(3-三氟甲基-苯基)-乙基]-脲其任何混合物。若该复数形式用于化合物、盐、医药组合物、疾病或其类似者,则此形式欲亦指单一化合物、盐、疾病或其类似者。
[0080]
应理解,适当且有利时,任何提及的如实施例1)至40)中任一项所定义的式(i)(及/或式(i
bc
))化合物亦指该等化合物的盐(及尤其医药学上可接受的盐)。
[0081]
术语「医药学上可接受的盐」系指保留本发明化合物的所需生物活性且展现最小非所需毒理学效应的盐。视本发明化合物中碱性及 /或酸性基团的存在而定,此类盐包括无机酸或有机酸及/或碱的加成盐。出于参考目的,参见例如『handbook of pharmaceutical salts. properties,selection and use.』,p.heinrich stahl,camille g. wermuth(编),wiley-vch,2008及『pharmaceutical salts and co
‑ꢀ
crystals』,johan wouters及luc qu
éré
(编),rsc publishing,2012。
[0082]
本发明亦包括同位素标记,尤指2h(氘)标记的式(i)(及/或式(i
bc
))化合物,该等化合物与式(i)(及/或式(i
bc
))化合物相同,但一或多个原子各自已被具有相同原子序数但原子质量与自然界中通常所见的原子质量不同的原子置换。同位素标记,尤指2h(氘)标记的式(i)(及/或式 (i
bc
))化合物及其盐在本发明的范畴内。用较重同位素2h(氘)取代氢可
产生较大代谢稳定性,使得例如活体内半衰期增加或剂量需求降低,或可降低对细胞色素p450酶的抑制性,从而产生例如改良的安全概况。在本发明的一个实施例中,式(i)(及/或式(i
bc
))化合物未经同位素标记,或其仅用一或多个氘原子标记。在一子实施例中,式(i)(及/或式(i
bc
))化合物完全未经同位素标记。同位素标记的式(i)(及/或式(i
bc
))化合物可类似于下文所述的方法来制备,但使用适合试剂或起始物质的适当同位素变体。
[0083]
每当使用字语「之间」来描述数值范围时,应了解所指示范围的端点明确地包括在范围内。举例而言:若温度范围描述为在40℃与 80℃之间,则此意谓在该范围内包括端点40℃及80℃;或若变量定义为1 与4之间的一整数,则此意谓该变量为整数1、2、3或4。
[0084]
除非用在温度上,否则置放在数值「x」之前的术语「约」(或者「大约」)在本技术案中系指自x减10% x延伸至x加10% x 的区间,且较佳指自x减5% x延伸至x加5% x的区间。在温度的特殊情况中,置放在温度「y」之前的术语「约」(或者「大约」)在本技术案中系指自温度y减10℃延伸至y加10℃的区间,且较佳指自y减5℃延伸至y 加5℃的区间。此外,如本文所用的术语「室温」系指约25℃的温度。
[0085]
如实施例1)至40)中任一项所定义的式(i)(及/或式(i
bc
))化合物及其医药学上可接受的盐可用作药剂,例如呈用于经肠(尤其诸如经口)或非经肠投药(包括局部施用或吸入)的医药组合物形式。
[0086]
可以任何熟习此项技术者所熟悉的方式(参见例如 remington,the science and practice of pharmacy,第21版(2005),第5部分,「pharmaceutical manufacturing」[由lippincott williams&wilkins 出版]),藉由将所描述的式(i)(及/或式(i
bc
))化合物或其医药学上可接受的盐(视情况与其他有治疗价值的物质组合)与适合的无毒惰性治疗兼容性固体或液体载剂材料及必要时与常用医药佐剂一起制成盖伦投药剂型 (galenical administration form)来产生医药组合物。
[0087]
t本发明亦系关于一种用于预防/防治或治疗本文中提及的疾病或病症的方法,其包含向个体投与医药活性量的如实施例1)至40)中的任一项中所定义的式(i)(及/或式(i
bc
))化合物。
[0088]
为避免任何疑义,若化合物经描述为适用于预防或治疗某些疾病,则此等化合物同样适用于制备用于预防或治疗该等疾病的药剂。
[0089]
本发明的另一方面系关于用于预防/防治或治疗患者如下文所提及的疾病或病症的方法,其包含向该患者投与医药活性量的如实施例1)至40)中的任一项中所定义的式(i)(及/或式(i
bc
))化合物或其医药学上可接受的盐。
[0090]
如实施例1)至40)中任一项所定义的式(i)(及/或式(i
bc
))化合物适用于预防/防治或治疗与kcnq2、kcnq3、kcnq4、kcnq5相关的疾病或病症及/或与kcnq2、kcnq3、kcnq4、kcnq5中的突变相关的疾病或病症。
[0091]
此类与kcnq2、kcnq3、kcnq4、kcnq5相关的疾病或病症及/或与kcnq2、kcnq3、kcnq4、kcnq5中的突变相关的疾病或病症可尤其定义为包含癫痫症、肌纤维颤动、耳鸣、听障、神经性及发炎性疼痛、精神障碍、物质使用疾患、神经疾病及影响平滑肌的疾病(及尤其癫痫症、肌纤维颤动、耳鸣、神经性及发炎性疼痛、精神障碍及影响平滑肌的疾病)。
[0092]
癫痫症可定义为包含:伴以局灶性癫痫发作的癫痫症(意识受损或未受损,伴以运动或非运动发作症
状);伴以全身性癫痫发作具有运动发作症状的癫痫症;伴以未知癫痫发作的癫痫症;伴以创伤性脑损伤诱发的癫痫发作的癫痫症;新生儿癫痫症,包括具有或不具有神经发育障碍的早期发作癫痫性脑病(诸如othahara症候群、早期婴儿癫痫性脑病、早期肌痉挛脑病、具有抑制爆发模式的癫痫症、良性或自限性家族性新生儿癫痫症);婴儿/儿童癫痫症症候群,包括伴以神经发育障碍的癫痫症、儿童的局灶性癫痫症及特发性癫痫症症候群。
[0093]
影响平滑肌的疾病可定义为包含影响内脏平滑肌的疾病(诸如功能消化不良、大肠急躁症及膀胱过动症)、影响血管平滑肌的疾病 (诸如高血压及脑血管痉挛)、影响呼吸道平滑肌的疾病(诸如哮喘及慢性阻塞性肺病)及听障。
[0094]
物质使用障碍可定义为包含酒精或精神兴奋剂的滥用。
[0095]
精神障碍可定义为包含焦虑、精神分裂症、抑郁、躁症、注意力不足过动症、躁郁症及泛自闭症障碍(且尤其焦虑、精神分裂症、躁症及自闭症)。
[0096]
神经疾病可定义为包含由神经元及/或运动神经元兴奋性变化引起的疾病(且尤其肌肉萎缩性侧索硬化、额颞叶型痴呆、原发性侧索硬化、假延髓性瘫痪、进行性延髓瘫痪、进行性肌肉萎缩、多发性硬化、阿兹海默症、帕金森氏症、杭丁顿氏症、克罗伊茨费尔特-雅各布布病、急性缺血性中风)。
[0097]
值得注意的是,如实施例1)至40)中任一项的式(i)(及/或式 (i
bc
)化合物或其医药学上可接受的盐适用于预防/防治或治疗神经痛、发炎性疼痛、肌肉萎缩性侧索硬化、抑郁、耳鸣及/或癫痫症(尤其伴以局灶性癫痫发作的癫痫症、伴以全身性癫痫发作的癫痫症、伴以未知发作的癫痫症、新生儿癫痫症,及/或具有或不具有神经发育衰退的婴儿/儿童癫痫症症候群)。
[0098]
尤其,如实施例1)至40)中任一项的式(i)及/或式(i
bc
)化合物或其医药学上可接受的盐适用于预防/防治或治疗癫痫症;且尤其伴以局灶性癫痫发作的癫痫症、伴以全身性癫痫发作的癫痫症、伴以未知发作的癫痫症、新生儿癫痫症,及/或具有或不具有神经发育衰退的婴儿/儿童癫痫症症候群。
[0099]
式(i)化合物的制备本发明的另一方面为一种用于制备式(i)化合物的方法。根据本发明的式(i)的化合物可根据实验部分中所描述的方法,藉由类似方法,或根据下文所概述的一般反应顺序由市售或熟知的起始物质来制备,其中r1、 r
2a
、r
2b
、r3、r4、r5、r6、r
x4
、x1、x2、x3及l如对于式(i)所定义。本文所用的其他缩写明确定义,或如实验部分中定义。在一些情况下,通用基团r1、r
2a
、r
2b
、r3、r4、r5、r6、r
x4
、x1、x2、x3及l可能与以下流程中所示的集合不兼容且因此将需要使用保护基(pg)。保护基团的使用在此项技术中为熟知的(参见例如「protective groups in organicsynthesis」,t.w.greene,p.g.m.wuts,wiley-interscience,1999)。出于此论述的目的,将假定此类保护基视需要存在于适当位置上。所得化合物亦可以本身已知的方式转化成盐、尤其其医药学上可接受的盐。
[0100]
通用制备途径:
一般而言,式i化合物可藉由在诸如net3或dipea的碱存在下,在诸如dcm或mecn的溶剂中,用异氰酸酯3处理结构2的胺(或相应盐,如 hcl或tfa盐)来合成。一般而言,可使结构4的异氰酸酯与胺5(或相应盐,如hcl或tfa盐)在诸如net3或dipea的碱存在下,在诸如dcm或 mecn的溶剂中反应,得到式i-a化合物(流程1)。
[0101]
或者,结构2的胺(或相应盐,如hcl或tfa盐)与氯甲酸4
‑ꢀ
硝基苯酯在如net3或dipea的碱存在下缩合,得到胺基甲酸酯6(流程2)。接着在如net3的碱存在下,在如thf的溶剂中,用胺5(或相应盐,如hcl 或tfa盐)处理胺基甲酸酯6,得到式i化合物。该顺序亦可如下开始:首先使胺5(或相应盐,如hcl或tfa盐)与氯甲酸4-硝基苯酯在如net3或 dipea的碱存在下反应,得到胺基甲酸酯7(流程2)。接着用结构2的胺(或相应盐,如hcl或tfa盐)在如net3的碱存在下在如thf的溶剂中处理胺基甲酸酯7,得到式i化合物。
[0102]
在另一方面中,结构2的胺(或相应盐,如hcl或tfa盐)用如cdi、三光气或三氟乙氧基碳酸酯的试剂活化,且活化中间物经胺5(或相应盐,如hcl或tfa盐)原位处理,得到式i化合物(流程3)。反的,胺 5(或相应盐,如hcl或tfa盐)可用如cdi、三光气或三氟乙氧基碳酸酯的试剂活化,且活化中间物用结构2的胺(或相应盐,如hcl或tfa盐)原位处理,得到式i化合物。
[0103]
结构2-a或结构2-b的胺可藉由利用爱耳门助剂(ellman's auxiliary)来合成(流程4)。因此,在ti(oet)4存在下用三级丁烷亚磺酰胺9 处理醛8,得到三级丁烷亚磺酰基亚胺10。接着用诸如格林纳试剂11的亲核试剂处理化合物10,得到受保护的胺12。接着在如hcl的温和酸性条件下在meoh中裂解三级丁烷亚磺酰基,得到结构2-a的胺(或相应hcl盐)。或者,可在meoh中用如nabh4的还原剂还原亚胺10,得到受保护的胺 13。接着在如hcl的温和酸性条件下在meoh中裂解三级丁烷亚磺酰基,得到结构2-b的胺(或相应hcl盐)。或者,可使酮14在ti(oet)4存在下与三级丁烷亚磺酰胺9反应,得到三级丁烷亚磺酰基亚胺15。接着用格林纳或锂化试剂16处理化合物15,得到受保护的胺17。接着在如hcl的温和酸性条件下在meoh中裂解三级丁烷亚磺酰基,得到结构2-c的胺(或相应hcl 盐)。
[0104]
在另一方面中,可使用光氧化还原催化合成结构2-a的胺 (流程5)。使溴化物18在如[ir{df(cf3)ppy}2(dtbpy)]pf6的铱催化剂及如 nicl2·
乙二醇二甲醚的镍催化剂存在下在如dmso或dma的溶剂中在蓝色led照射下与受boc保护的胺基酸19反应,得到受boc保护的胺 20(science 2014,345,437-440)。接着在如含tfa的dcm或含4m hcl的二烷的酸性条件下裂解boc保护基,得到结构2-a的胺(或相应盐,如 hcl或tfa盐)。
[0105]
结构2-b的胺亦可自相应腈21获得(流程6)。可使用如 ra/ni的催化剂在h
2-氛围(以流动或分批模式)或lialh4于如thf的溶剂中还原腈21于meoh中的溶液,得到结构2-b的胺。或者,可使用如 nicl2·
6h2o的镍催化剂及nabh4在boc2o存在下还原腈21,得到受boc保护的胺22。在如含tfa的dcm或含hcl的二烷的酸性条件下去除保护基,产生结构2-b的胺
(或相应hcl或tfa盐)。亦可使用含memgbr的如 et2o的溶剂,接着酸性水溶液处理将腈21转化为相应酮23。酮23可在如 meoh的溶剂中经受例如乙酸铵及氰基硼氢化钠的还原胺化,得到结构2
‑ꢀ
a的胺(其中r
2a
为甲基)。此外,可首先于如2-甲基四氢呋喃的溶剂中用 memgbr且接着用nabh4处理腈21,得到结构2-a的胺(其中r
2a
为甲基)。腈21亦可在如ti(oipr)4的钛盐及三氟化硼存在下在使用etmgbr的et2o中经受库林科维奇(kulinkovich)反应,得到结构2-d的胺。最后,腈21可在氟化铯及如ir(p-f(t-bu)-ppy)3的铱催化剂存在下,在如dmso或dma的溶剂中,在蓝色led照射下与受boc保护的胺基酸反应,得到受boc保护的胺24(jacs 2014,136,5257-5260)。接着在如含tfa的dcm或含hcl的二烷的酸性条件下裂解保护基,得到结构2-e的胺(或相应hcl或tfa 盐)。
[0106]
醛8-a可如流程7中所述制备。因此,醇25可在如cs2co3或k2co3的碱存在下于如dmf的溶剂中与如烷基磺酸盐、烷基溴或烷基碘的烷基化剂反应,得到醛8-a。类似地,醇26可转化成相应溴化物18
‑ꢀ
a。
[0107]
在如氢化钠的碱存在下在如thf的溶剂中,经由氯或氟腈 27与如三氟乙醇的醇之间的snar反应获得腈21-a(流程8)。替代地,腈27 可在如nmp的溶剂及如net3的碱中在微波照射下经受与胺(或相应hcl盐) 的snar反应,得到腈21-b。最后,在如pd2(dba)3的钯催化剂及如dppf的配位体存在下,在如dmf的溶剂中,氯或溴衍生物28与zncn2之间的氰化作用得到腈21。
[0108]
结构2的胺亦可藉由流程9中所描述的方法制备。因此,可在碱或如ag2o的银盐存在下用如烷基溴或烷基碘的烷基化剂处理受boc保护的胺30,得到受boc保护的胺31。接着在如含tfa的dcm或含4m hcl 的二烷的酸性条件下裂解boc保护基,得到结构2的胺(或相应盐,如 hcl或tfa盐)。或者,醛8可与胺32在如dcm的溶剂中且在如nabh(oac)3的还原剂
及如dipea的碱存在下经受还原胺化,得到结构2 的胺,其中r
2a
及r
2b
表示氢。
[0109]
实验部分:缩写(如本文及上文说明书中所用):anh.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
无水ac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酰基aq.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
水性boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三级丁氧基羰基bu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
丁基cdi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,1'-羰基二咪唑comb.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
组合d
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
日dba
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二亚苄基丙酮dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷dipea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-乙基二异丙胺dma
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基乙酰胺dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基甲酰胺dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲亚砜dppf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1,1'-二茂铁二基-双(二苯膦)eq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
当量et
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基fbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
胎牛血清flipr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
荧光成像盘式读取器fluo-8-am
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2,2'-((4-(6-乙酰氧基甲氧基)-3-侧氧基-3h
‑‑
9-基)-2-(2-(双(2-乙酰氧基甲氧基)-2-侧氧基乙基)胺基)苯氧基)乙氧基)苯基)氮二基)二乙酸双(乙酰氧基甲基)酯h
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
六氟磷酸2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基
hbss
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
汉克氏(hank's)平衡的盐溶液hek293
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
人类胎肾293细胞hepes
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-(2-羟乙基)-哌-1-乙烷磺酸hept
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
庚烷hv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高真空hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相层析ipr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异丙基ir(p-f(t-bu)-ppy)3ꢀꢀ
参(2-(3-三级丁基苯基)-4-三级丁基吡啶)铱[ir{df(cf3)ppy}2(dtbpy)]pf
6 六氟磷酸[4,4'-双(1,1-二甲基乙基)-2,2'-联吡啶-n1,n1']双[3,5-二氟-2-[5-(三氟甲基)-2-吡啶基-n]苯基-c]铱(iii)lc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相层析led
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
发光二极管m
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
莫耳浓度[mol l-1
]me
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱分析min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟n
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
正态性nicl2·
乙二醇二甲醚 氯化镍(ii)乙二醇二甲醚错合物nmda
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-甲基-d-天冬胺酸盐nmp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-甲基-2-吡咯啶酮nmr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核磁共掁org.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
有机pbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
磷酸盐缓冲盐水pg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
保护基ph
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苯基prep.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
制备性ra/ni
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
雷氏(raney)镍rpm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
每分钟转数rt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
室温sat.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
饱和sec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
秒sfc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超临界流体层析soln.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
溶液tbme
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三级丁基甲基醚tbu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三级丁基tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃trꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
滞留时间uplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超效能液相层析
uv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
紫外线xe-991
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10,10-双(4-吡啶基甲基)-9(10h)-蒽酮
[0110]
i.化学物质以下实例说明本发明生物活性化合物的制备但完全不限制其范畴。
[0111]
一般批注:除非另外指明,否则所用的所有溶剂及试剂系自商业来源获得。温度用摄氏度(℃)指定。除非另有指示,否则反应在氩气或氮气氛围下在室温(rt)下发生且在配备有磁性搅拌棒的火焰干燥圆底烧瓶中进行。除非另外指出,否则在混合物中,呈液体形式的溶剂或溶离剂或试剂混合物的部分的关系系以体积关系(v/v)给出。
[0112]
所使用的表征方法:lc-ms 1lc-ms条件:分析型。泵:waters acquity binary,溶剂管理器, ms:waters sq侦测器或xevo tqd,dad:acquity uplc pda侦测器。管柱:来自waters的acquity uplc csh c18 1.7μm,2.1
×
50mm,在acquity uplc管柱管理器中在60℃下恒温。溶离剂:a1:h2o 0.05%甲酸;b1:mecn 0.045%甲酸。方法:梯度:经2.0min 2% b至98% b,流动:1.0ml/min。在214nm以ms侦测,滞留时间tr以min给出。
[0113]
lc-ms 2至4在acquity uplc设置上进行uplc/ms分析。管柱温度为40℃。
[0114]
使用以下溶离条件获得lc滞留时间:-lc-ms 2:agilent zorbax rrhd sb-aq(2.1
×
50mm,1.8μm)上的分析型uplc;在210nm以ms侦测;水/0.04% tfa(a)及mecn(b)的梯度。溶离剂流速为0.8ml/min,且自溶离开始随着时间t变化的溶离混合物比例的特征概述于下表中(在两个连续时间点之间使用线性梯度):t(min)01.21.92.1溶剂a(%)955595溶剂b(%)595955-lc-ms 3:waters xbridge(4.6
×
30mm,2.5μm)上的分析型uplc;在210nm以ms侦测;水/0.04% tfa(a)及mecn(b)的梯度。溶离剂流速为4.5ml/min,且自溶离开始随着时间t变化的溶离混合物比例的特征概述于下表中(在两个连续时间点之间使用线性梯度):t(min)01.001.451.55溶剂a(%)955595溶剂b(%)595955-lc-ms 4:waters beh c18上的分析型uplc(2.1
×
50mm,2.5 μm);在210nm以ms侦测;水/0.04% nh3[c(nh3)=13mmol/l](a)及 mecn(b)的梯度。溶离剂流速为0.8ml/min,且自溶离开始随着时间t变化的溶离混合物比例的特征概述于下表中(在两个连续时间点之间使用线性梯度):t(min)01.21.92.1溶剂a(%)955595溶剂b(%)595955
[0115]
所使用的制备型lc-ms方法:
使用waters xbridge c18或waters atlantis column管柱,在配备有 gilson 215自动进样器、gilson 333/334泵、finnigan aqa ms侦测器系统及dionex uv侦测器的gilson hplc系统上进行制备型hplc/ms纯化,其具有水/甲酸0.02%(a)及mecn(b)(酸性条件)或水/氨水0.02%(a) 及mecn(b)(碱性条件)的线性梯度。
[0116]
combiflash使用来自teledyne isco的combiflash进行急骤管柱层析。
[0117]
所使用的制备型对掌性sfc方法:在sepiatec prep sfc 360系统上进行制备型对掌性sfc纯化。使用以下参数:制备型对掌性sfc 1:使用chiralpak ib管柱(30
×
250mm,5μm)。改质剂为iproh(12%),运行5分钟且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度40℃。制备型对掌性sfc 2:使用chiralpak ih管柱(30
×
250mm,5μm)。改质剂为etoh(15%),运行3.3分钟且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度40℃。制备型对掌性sfc 3:使用regis(r,r)whelk-o1管柱(30
×
250mm, 5μm)。改质剂为etoh(15%),运行3.0min且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度40℃。制备型对掌性sfc 4:使用chiralpak ib管柱(30
×
250mm,5μm)。改质剂为etoh(10%),运行5.5min且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度40℃。制备型对掌性sfc 5:使用regis(r,r)whelk-o1管柱(30
×
250mm, 5μm)。改质剂为meoh(20%),运行4.0min且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度40℃。制备型对掌性sfc 6:使用chiralpak ad-h管柱(30
×
250mm,5 μm)。改质剂为etoh(10%),运行3.0min且流速为160ml/min。使用以下系统设置:背压100巴、泵头温度5℃、部分模块温度20℃及管柱部温度 40℃。
[0118]
nmr在室温下,用配备有bruker的dch低温探针的brucker nmr 500光谱仪1h(500mhz)记录1h-nmr光谱。使用残余溶剂信号作为内部参考,以四甲基硅烷的ppm低场为单位报导化学位移。多重性描述为单峰s、双重峰d、三重峰t、四重峰q、六重峰h或多重峰m。宽峰信号指示为br。
[0119]
实例1:1-(3,3-二氟-环丁基)-3-(3-三氟甲基-苄基)-脲依序向3-(三氟甲基)苄胺(18mg,0.1mmol,1.0eq)于mecn(0.5 ml)的溶液中添加dipea(19μl,0.11mmol,1.1eq)及cdi(32mg,0.2 mmol,2.0eq)于mecn(0.2ml)中的溶液。在60℃下搅拌混合物3小时。添加3,3-二氟环丁-1-胺(21mg,0.2mmol,2.0eq)于mecn(0.5ml)及 h2o(0.1ml)中的溶液。在60℃下进一步搅拌混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10 μm,uv/ms,碱性条件)纯化。lc-ms(1):tr=0.99min;[m h]
: 309.2。
[0120]
实例2:1-双环[1.1.1]戊-1-基-3-[1-(3-三氟甲基-苯基)-乙基]-脲
依序向双环[1.1.1]戊-1-胺盐酸盐(12mg,0.1mmol,1eq)于 mecn(0.5ml)中的溶液中添加dipea(34μl,0.2mmol,2eq)及 cdi(16mg,0.1mmol,1eq)。在60℃下搅拌混合物1小时。添加1-(3-三氟甲基苯基)乙胺(19mg,0.1mmol,1eq)于mecn(0.4ml)及h2o(0.1 ml)中的溶液。在60℃下进一步搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10μm, uv/ms,碱性条件)纯化。lc-ms(1):tr=1.08min;[m h]
:299.2。
[0121]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例2中所描述的程序来合成实例3至实例5。实例3至实例5的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0122]
实例6:1-双环[1.1.1]戊-1-基-3-[1-(3-三氟甲氧基-苯基)-乙基]-脲依序向双环[1.1.1]戊-1-胺盐酸盐(12mg,0.1mmol,1eq)于 mecn(0.5ml)中的溶液中添加dipea(34μl,0.2mmol,2eq)及 cdi(16mg,0.1mmol,1eq)。在60℃下搅拌混合物1小时。添加1-(3
‑ꢀ
(三氟甲氧基)苯基)乙胺(21mg,0.1mmol,1eq)于mecn(0.4ml)及 h2o(0.1ml)中的溶液。在60℃下进一步搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10 μm,uv/ms,碱性条件)纯化。lc-ms(1):tr=1.11min;[m h]
: 315.2。
[0123]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例6中所描述的程序来合成实例7至实例8。实例7至实例8的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0124]
实例9:1-[2,2-二氟-1-(3-三氟甲基-苯基)-乙基]-3-(3-羟基-3-三氟甲基-环丁基)-脲向3-胺基-1-(三氟甲基)环丁-1-醇(19mg,0.12mmol,1.5eq)于 mecn(0.1ml)中的溶液中添加cdi(20mg,0.12mmol,1.5eq)于 mecn(0.2ml)中的溶液。反应混合物在室温下搅拌2小时。添加2,2-二氟
ꢀ‑
1-[3-(三氟甲基)苯基]乙-1-胺(19mg,0.08mmol,1.0eq)及dipea(15 μl,0.09mmol,1.1eq)于mecn(0.5ml)及h2o(0.1ml)中的溶液。混合物在室温下搅拌隔夜。藉由制备型hplc(管柱:waters xbridge,30
×
75 mm,10μm,uv/ms,碱性条件)纯化混合物。lc-ms(1):tr=1.01 min;[m h]
:407.3。
[0125]
实例10:1-(3,3-二氟-1-甲基-环丁基)-3-[2,2-二氟-1-(3-三氟甲基-苯基)
‑ꢀ
乙基]-脲
使用3-3-二氟-1-甲基环丁胺盐酸盐且遵循实例9中所述的程序合成产物。lc-ms(1):tr=1.13min;[m h]
:373.3。
[0126]
实例11:1-双环[1.1.1]戊-1-基-3-[1-(3-二氟甲氧基-苯基)-乙基]-脲依序向1-(3-(二氟甲氧基)苯基)乙-1-胺盐酸盐(37mg,0.1mmol,1 eq)于mecn(0.5ml)中的溶液中添加dipea(51μl,0.3mmol,3eq)及 cdi(32mg,0.2mmol,2eq)。将反应物在室温下搅拌1小时。添加双环 [1.1.1]戊-1-胺盐酸盐于mecn(0.4ml)及h2o(0.1ml)中的溶液。在室温下搅拌反应混合物1小时。藉由制备型hplc(管柱:waters xbridge, 30
×
75mm,10μm,uv/ms,碱性条件)纯化混合物。lc-ms(1):tr= 1.01min;[m h]
:297.3。
[0127]
实例12:1-(3-二氟甲基-双环[1.1.1]戊-1-基)-3-[2-羟基-1-(3-三氟甲基-苯基)-乙基]-脲依序向3-(二氟甲基)双环[1.1.1]戊-1-胺盐酸盐(25mg,0.15mmol, 1.0eq)于mecn(0.8ml)中的溶液中添加dipea(92μl,0.53mmol,3.5 eq)及cdi(37mg,0.23mmol,1.5eq)。在50℃下搅拌混合物40分钟。添加2-胺基-2-(3-三氟甲基-苯基)-乙醇(31mg,0.15mmol,1.0eq)。在 80℃下搅拌反应混合物18小时。使混合物冷却至室温且藉由制备型 hplc(管柱:waters xbridge,30
×
75mm,10μm,uv/ms,碱性条件) 纯化。lc-ms(1):tr=0.96min;[m h]
:365.2。
[0128]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例12中所描述的程序来合成实例13至实例16。实例13至实例16的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0129]
实例17:1-(3-氟-双环[1.1.1]戊-1-基)-3-[3-(2,2,2-三氟-乙氧基)-苄基]-脲在室温下用dipea(43μl,0.25mmol,3.5eq),接着用cdi(12 mg,0.07mmol,1.05eq)处理(3-(2,2,2-三氟乙氧基)苯基)甲胺(14mg, 0.07mmol,1.0eq)于mecn(0.4ml)中的溶液,且在50℃下搅拌所得混合物30min。所得混合物用3-氟双环[1.1.1]戊-1-胺盐酸盐(10mg,0.07 mmol,1.0eq)处理,且在80℃下搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10μm, uv/ms,碱性条件)纯化。lc-ms(1):tr=1.02min;[m h]
:333.3。
[0130]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例17中所描述的程序来合成实例18至实例19。实例18至实例19的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0131]
实例20:1-(3-二氟甲氧基-苄基)-3-(3-氟-双环[1.1.1]戊-1-基)-脲在室温下用dipea(43μl,0.25mmol,3.5eq),接着用cdi(12 mg,0.07mmol,1.05eq)处理3-(二氟甲氧基)苄胺(12mg,0.07mmol, 1.0eq)于mecn(0.4ml)中的溶液,且在50℃下搅拌所得混合物30min。所得混合物用3-氟双环[1.1.1]戊-1-胺盐酸盐(10mg,0.07mmol,1.0eq) 处理,且在80℃下搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10μm,uv/ms,碱性条件)纯化。lc-ms(1):tr=0.95min;[m h]
:301.2。
[0132]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例20中所描述的程序来合成实例21至实例22。实例21至实例22的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0133]
实例23:1-(3-三氟甲氧基-苄基)-3-(3-三氟甲基-双环[1.1.1]戊-1-基)-脲在室温下用dipea(43μl,0.25mmol,3.5eq),接着用cdi(12 mg,0.07mmol,1.05eq)处理3-(三氟甲氧基)苄胺(22mg,0.07mmol, 1.0eq)于mecn(0.4ml)中的溶液,且在50℃下搅拌所得混合物30min。所得混合物用3-(三氟甲基)双环[1.1.1]戊-1-胺盐酸盐(14mg,0.07 mmol,1.0eq)处理,且在80℃下搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge,30
×
75mm,10μm, uv/ms,碱性条件)纯化。lc-ms(1):tr=1.17min;[m h]
:369.2。
[0134]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例23中所描述的程序来合成实例24至实例26。实例24至实例26的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
实例编号名称tr[m h]
241-(3-氟-双环[1.1.1]戊-1-基)-3-(3-三氟甲氧基-苄基)-脲1.05319.2251-(3-二氟甲基-环丁基)-3-(3-三氟甲氧基-苄基)-脲1.03339.2261-双环[1.1.1]戊-1-基-3-(3-三氟甲氧基-苄基)-脲1.06301.2
[0135]
实例27:1-(3-二氟甲基-苄基)-3-(3-二氟甲基-环丁基)-脲依序向[3-(二氟甲基)苯基]甲胺盐酸盐(14mg,0.07mmol,1.0eq) 于mecn(0.4ml)中的溶液中添加dipea(43μl,0.25mmol,3.5eq)及 cdi(17mg,0.11mmol,1.5eq)。在50℃下搅拌所得混合物1.5h。添加 3-(二氟甲基)环丁-1-胺盐酸盐(11mg,0.07mmol,1.0eq)。在80℃搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:watersxbridge,30
×
75mm,10μm,uv/ms,碱性条件)纯化。lc-ms(1):tr=0.92min;[m h]
:305.2。
基)乙-1-胺(125mg, 0.531mmol,1.0eq)于mecn(1.1ml)中的溶液。在80℃搅拌反应混合物隔夜。使混合物冷却至室温且藉由制备型hplc(管柱:waters xbridge, 30
×
75mm,10μm,uv/ms,碱性条件)纯化。lc-ms(1):tr=1.12 min;[m h]
:413.3。
[0143]
实例35:1-双环[1.1.1]戊-1-基-3-(3-三氟甲基-苄基)-脲向双环[1.1.1]戊-1-胺盐酸盐(10mg,0.08mmol,1eq)于thf(1 ml)中的溶液中依序添加net3(45μl,0.32mmol,4eq)及(3-(三氟甲基) 苯甲基)胺基甲酸4-硝基苯酯(27mg,0.08mmol,1eq)。所得混合物在室温下搅拌隔夜。真空浓缩混合物。藉由制备型hplc(管柱:watersxbridge,30
×
75mm,10μm,uv/ms,碱性条件)纯化残余物。lc
‑ꢀ
ms(1):tr=1.03min;[m h]
:285.2。
[0144]
使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例35中所描述的程序来合成实例36至实例42。实例36至实例42的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0145]
实例43:1-双环[1.1.1]戊-1-基-3-[2-(2,2,2-三氟-乙氧基)-吡啶-4-基甲基]
‑ꢀ
脲向双环[1.1.1]戊-1-胺盐酸盐(30mg,0.08mmol,1eq)于thf(1 ml)中的溶液中依序添加net3(45μl,0.32mmol,4eq)及((2-(2,2,2-三氟乙氧基)吡啶-4-基)甲基)胺基甲酸4-硝基苯酯(30mg,0.08mmol,1 eq)。所得混合物在室温下搅拌隔夜。真空浓缩混合物。藉由制备型 hplc(管柱:waters xbridge,30
×
75mm,10μm,uv/ms,碱性条件) 纯化残余物。lc-ms(1):tr=0.98min;[m h]
:316.2。使用适当的胺或胺盐(hcl或tfa)衍生物且遵循实例43中所描述的程序来合成实例44至实例46。实例44至实例46的lc-ms数据列于下表中。所使用的lc-ms条件为lc-ms(1)。
[0146]
实例47:1-(3-二氟甲基-双环[1.1.1]戊-1-基)-3-(3-三氟甲基-苄基)-脲向3-(二氟甲基)双环[1.1.1]戊-1-胺盐酸盐(125mg,0.74mmol,1 eq)于dcm(20ml)的冰冷溶液中依序逐滴添加net3(0.31ml,2.21 mmol,3eq)及1-(异氰酸基甲基)-3-(三氟甲基)苯(156mg,0.74mmol, 1eq)。在0℃搅拌所得混合物2小时。将混合物用饱和nahco3溶液稀释且用dcm萃取(3
×
)。将经合并的有机层用饱和nacl水溶液洗涤,经mgso4干燥,过滤且真空浓缩。藉由制备型hplc(管柱:waters xbridge, 30
×
50mm,10μm,uv/ms,碱性条件)纯化残余物。lc-ms(1):tr= 1.06min;[m h]
:335.2。
[0147]
实例48:1-双环[2.1.1]己-1-基-3-(3-三氟甲基-苄基)-脲依序向双环[2.1.1]己-1-胺盐酸盐(27mg,0.2mmol,1.0eq)于 mecn(0.7ml)中的溶液中添加dipea(87μl,0.5mmol,2.5eq)及1
‑ꢀ
(异氰酸基甲基)-3-(三氟甲基)苯(64mg,0.3mmol,1.5eq)。反应混合物在室温下搅拌隔夜。藉由制备型hplc(管柱:waters xbridge,30
×
50 mm,10μm,uv/ms,碱性条件)纯化混合物。lc-ms(1):tr=1.09 min;[m h]
:299.2。
[0148]
实例49:1-(3,3-二氟-1-甲基-环丁基)-3-(3-三氟甲基-苄基)-脲使用3,3-二氟-1-甲基环丁胺盐酸盐且遵循实例48中所描述的程序来合成产物。lc-ms(1):tr=1.06min;[m h]
:323.2。实例50:1-(3-(三氟甲基)苄基)-3-(3-(三氟甲基)环丁基)脲(立体异构物1)及实例51:1-(3-(三氟甲基)苄基)-3-(3-(三氟甲基)环丁基)脲(立体异构物2)
[0149]
藉由制备型对掌性sfc 1方法分离1-(3-三氟甲基-苄基)-3
‑ꢀ
(3-三氟甲基-环丁基)-脲,得到实例50(第一次溶离,tr=2.9min)及实例 51(第二次溶离,tr=4.0min)。实例50(lc-ms(1):tr=1.07min; [m h]
:341.2),1h-nmr(500mhz,dmso)δ:7.54-7.59(m,4h),6.51
‑ꢀ
6.53(m,2h),4.27(d,j=6.1hz,2h),4.17-4.23(m,1h),2.85-3.12(m, 1h),2.33-2.38(m,2h),2.18-2.24(m,2h)。实例51(lc-ms(1):tr= 1.07min;[m h]
:341.2),1h-nmr(500mhz,dmso)δ:7.53-7.59(m, 4h),6.48-6.65(m,1h),6.39-6.48(m,1h),4.28(d,j=6.1hz,2h), 3.92-4.19(m,1h),2.76-2.88(m,1h),2.35-2.42(m,2h),1.88-1.94(m,2 h)。
[0150]
实例52:1-(3-(二氟甲基)环丁基)-3-(3-(三氟甲基)苄基)脲(立体异构物1)及实例53:1-(3-(二氟甲基)环丁基)-3-(3-(三氟甲基)苄基)脲(立体异构物2)藉由制备型对掌性sfc 2方法分离1-(3-二甲基-环丁基)-3-(3-三氟甲基-苄基)-脲,得到实例52(第一次溶离,tr=2.1min)及实例53(第二次溶离,tr=2.6min)。实例52(lc-ms(1):tr=1.01min;[m h]
:323.2));1h-nmr(500mhz,dmso)δ:7.54-7.59(m,4h),6.38-6.43(m,2h), 5.99(td,j=57.3,4.2hz,1h),4.28(d,j=6.1hz,2h),4.05(h,j=8.4 hz,1h),2.31-2.43(m,1h),2.23-2.28(m,2h),1.76-1.83(m,2h)。实例53(lc-ms(1):tr=1.01min;[m h]
:323.2);1h-nmr(500mhz, dmso)δ:7.54-7.59(m,4h),6.44-6.47(m,2h),6.18(td,j=57.2,4.8 hz,1h),4.27(d,j=6.1hz,2h),4.18(h,j=7.9hz,1h),2.47
‑ꢀ
2.57(m,1h),2.21-2.26(m,2h),2.01-2.07(m,2h)。
[0151]
实例54:1-{(s)-1-[2-甲基-6-(2,2,2-三氟-乙氧基)-嘧啶-4-基]-乙基}-3-(3
‑ꢀ
三氟甲基-双环[1.1.1]戊-1-基)-脲藉由制备型对掌性sfc 3方法分离外消旋1-{1-[2-甲基-6-(2,2,2-三氟-乙氧基)-嘧啶-4-基]-乙基}-3-(3-三氟甲基-双环[1.1.1]戊-1-基)-脲,得到实例54(第一次溶离,tr=1.6min)及1-{(r)-1-[2-甲基-6-(2,2,2-三氟-乙氧基)-嘧啶-4-基]-乙基}-3-(3-三氟甲基-双环[1.1.1]戊-1-基)-脲(第二次溶离,tr=2.2min)。实例54(lc-ms(1):tr=1.12min;[m h]
:413.3)。苄基位置处指定的立体化学已类似于pct/ep2021/060918的实例190,意谓认为更活跃的异构体具有(s)-组态。
[0152]
实例55:1-(3-(二氟甲基)环丁基)-3-((2-(2,2,2-三氟乙氧基)吡啶-4-基)甲基)脲(立体异构物1)及实例56:1-(3-(二氟甲基)环丁基)-3-((2-(2,2,2-三氟乙氧基)吡啶-4-基)甲基)脲(立体异构物2)藉由制备型对掌性sfc 4方法分离1-(3-二氟甲基-环丁基)-3-[2
‑ꢀ
(2,2,2-三氟乙氧基)-吡啶-4-基甲基]脲,得到实例55(第一次溶离,tr=3.6 min)及实例56(第二次溶离,tr=4.6min)。实例55(lc-ms(1):tr=0.96 min;[m h]
:354.3),1h-nmr(500mhz,dmso)δ:8.10-8.11(m,1h), 6.96(dd,j=5.3,1.2hz,1h),6.76(br s,1h),6.39-6.45(m,2h), 6.00(td,j=57.3,4.2hz,1h),4.98(q,j=9.1hz,2h),4.20(d,j=6.1 hz,2h),4.05(h,j=8.5hz,1h),2.32-2.45(m,1h),2.17-2.32(m,2 h),1.77-1.83(m,2h)。实例56(lc-ms(1):tr=0.96min;[m h]
: 354.2),1h-nmr(500mhz,dmso)δ:8.10-8.11(m,1h),6.97(dd,j= 5.2,1.2hz,1h),6.76(br s,1h),6.43-6.51(m,2h),6.18(td,j=57.2, 4.8hz,1h),4.98(q,j=9.1hz,2h),4.15-4.21(m,3h),2.53-2.59(m, 1h),2.22-2.27(m,2h),1.92-2.13(m,2h)。
[0153]
实例57:1-(3-(二氟甲基)环丁基)-3-((s)-1-(3-(三氟甲氧基)苯基)乙基)脲 (立体异构物1)及实例58:1-(3-(二氟甲基)环丁基)-3-((s)-1-(3-(三氟甲氧基)苯基)乙基)脲(立体异构物2)首先藉由制备型对掌性sfc 4方法分离1-(3-二氟甲基-环丁基)-3-[1
‑ꢀ
(3-三氟甲氧基-苯基)-乙基]脲,得到溶离份1(第一次溶离,tr=1.8min)及溶离份2(第二次溶离,tr=2.9min)。溶离份1进一步藉由制备型对掌性 sfc 1方法分离,得到实例57(第一次溶离,tr=2.8min)及实例58(第二次溶离,tr=3.8min)。实例57(lc-ms(1):tr=1.08min;[m h]
:353.2), 1
h-nmr(500mhz,dmso)δ:7.45(t,j=7.8hz,1h),7.31(d,j=7.8 hz,1h),7.19-7.24(m,2h),6.35(d,j=8.0hz,1h),6.16(d,j=8.3 hz,1h),5.99(td,j=57.3,4.2hz,1h),4.76(五重峰,j=7.1hz,1h), 3.98-4.03(m,1h),2.32-2.42(m,1h),2.20-2.26(m,2h),1.72-1.79(m,2 h),1.31(d,j=7.1hz,3h)。实例58(lc-ms(1):tr=1.08min; [m h]
:353.3),1h-nmr(500mhz,dmso)δ:7.45(t,j=7.9hz,1h), 7.32(d,j=7.9hz,1h),7.19-7.24(m,2h),6.39(d,j=8.0hz,1h), 6.23(d,j=8.0hz,1h),6.17(td,j=57.2,4.8hz,1h),4.74-4.79(m,1 h),4.10-4.16(m,1h),2.48-2.53(m,1h),2.17-2.24(m,2h),1.97
‑ꢀ
2.04(m,2h),1.31(d,j=7.0hz,3h)。溶离份2进一步藉由制备型对掌性sfc 6方法分离,得到1-(3-(二氟甲基)环丁基)-3-((r)-1-(3-(三氟甲氧基)苯基)乙基)脲(第一溶离立体异构体,tr=1.7min)及1-(3-(二氟甲基)环丁基)-3-((r)-1-(3-(三氟甲氧基)苯基)乙基)脲(第二溶离立体异构体,tr= 2.3min)。苄基位置处指定的立体化学已类似于pct/ep2021/060918的实例190,意谓认为更活跃的异构体具有(s)-组态。
[0154]
(3-(三氟甲基)苄基)胺基甲酸4-硝基苯酯的合成向3-(三氟甲基)苄胺(1.50g,8.4mmol,1eq)及dipea(4.31ml, 25.2mmol,3eq)于thf(43ml)中的冰冷溶液中添加氯甲酸4-硝基苯酯 (1.74g,8.4mmol,1eq)。在0℃搅拌所得混合物1小时。反应混合物用水(25ml)及etoac(25ml)稀释。分离各层。用etoac(2
×
25ml)萃取水相。将经合并的有机相经mgso4干燥并且真空浓缩。藉由combiflash(管柱:40g,流动:37ml/min,庚烷100%至庚烷 20% etoac)纯化残余物,得到淡黄色固体,其在庚烷/etoac 8:2中进一步湿磨,得到白色固体。lc-ms(2):tr=1.00min;没有离子化。使用适当胺且遵循对(3-(三氟甲基)苄基)胺基甲酸4-硝基苯酯所述的程序合成以下胺基甲酸酯。lcms数据列于下表中。所使用的lc-ms条件为lc-ms(2)。
名称tr[m h]
4-硝基苯基((2-(2,2,2-三氟乙氧基)吡啶-4-基)甲基)胺基甲酸酯0.97372.15
[0155]
(3-(2,2,2-三氟乙氧基)苯基)甲胺的合成步骤1:3-(2,2,2-三氟乙氧基)苯甲醛向3-羟基苯甲醛(3.0g,24.6mmol,1.0eq)及cs2co3(12.0g,36.8 mmol,1.5eq)于dmf(45ml)中的溶液中逐滴添加三氟甲磺酸2,2,2-三氟乙酯(4.25ml,29.5mmol,1.2eq)。在室温下搅拌反应物2h。用水淬灭反应物且用et2o萃取混合物。将经合并的有机相经mgso4干燥并真空浓缩,得到橙色油。产物未经进一步纯化即可使用。lcms(3):tr=0.75 min;没有离子化。步骤2:(
±
,e)-2-甲基-n-(3-(2,2,2-三氟乙氧基)亚苄基)丙烷-2-亚磺酰胺在室温下搅拌3-(2,2,2-三氟乙氧基)苯甲醛(5.01g,24.5mmol,1 eq)、(
±
)-2-甲基-丙烷亚磺酰胺(2.98g,24.5mmol,1eq)及 ti(oet)4(10.3ml,49.1mmol,2eq)于thf(42ml)中的混合物3天。反应物用饱和nacl水溶液淬灭过滤所得悬浮液且用etoac冲洗固体。将过滤物用饱和nacl水溶液洗涤,经mgso4干燥且真空浓缩。藉由急骤管柱层析(sio2,dcm)纯化残余物,得到橙色固体。lc-ms(3):tr=0.87 min;[m h]
:307.98。步骤3:(
±
)-2-甲基-n-(3-(2,2,2-三氟乙氧基)苄基)丙烷-2-亚磺酰胺向(
±
,e)-2-甲基-n-(3-(2,2,2-三氟乙氧基)亚苄基)丙烷-2-亚磺酰胺 (6.85g,22.3mmol,1eq)于meoh(78ml)及dcm(162ml)中的溶液中添加nabh4(5.06g,134mmol,6eq)。在室温下搅拌反应混合物10 min。反应用水淬灭。混合物用dcm萃取。将经合并的有机相经mgso4干燥并且真空浓缩,得到无色油。产物未经进一步纯化即可使用。lc
‑ꢀ
ms(3):tr=0.75min;[m h]
:310.00。步骤4:(3-(2,2,2-三氟乙氧基)苯基)甲胺向(
±
)-2-甲基-n-(3-(2,2,2-三氟乙氧基)苄基))丙烷-2-亚磺酰胺(6.65 g,21.5mmol,1eq)于无水甲醇(80ml)中的冰冷溶液中逐滴添加含4n hcl的二烷(10.8ml,43mmol,2eq)。将反应混合物在0℃下搅拌10 min且进一步在室温下搅拌隔夜。将黄色均匀反应混合物小心地在减压下浓缩至干燥。将残余物分配于dcm(150ml)与水(30ml)之间。添加固体na2co3(11.39g,107mmol,5eq)。分离各层且用dcm(50ml)萃取水相。将经合并的有机相经mgso4干燥并且真空浓缩。产物未经进一步纯化即可使用。lc-ms(3):tr=0.46min;[m h]
:206.06。
[0156]
1-(3-(二氟甲氧基)苯基)乙-1-胺盐酸盐的合成
向3-(二氟甲氧基)苯甲腈(1.0g,5.79mmol,1eq)于thf(5ml)中的溶液中逐滴添加含3.4m溴化甲镁的2-甲基四氢呋喃(5.11ml,17.4 mmol,3eq)。在室温下搅拌混合物2小时。使反应物冷却至15℃且用 meoh(20ml)淬灭。添加nabh4(438mg,11.6mmol,2eq)且在室温下搅拌混合物隔夜。添加2m hcl水溶液(30ml)且在室温下搅拌混合物5分钟。真空移除有机溶剂。将所得溶液分配于dcm(50ml)与饱和nahco3水溶液(30ml)之间。分离各层。将有机相用1.25m hcl的meoh溶液(20 ml)处理且真空浓缩,得到油状物。产物未经进一步纯化即可使用。lc
‑ꢀ
ms(4):tr=0.73min;[m h]
:188.34。
[0157]
(2-(三氟甲氧基)吡啶-4-基)甲胺盐酸盐的合成步骤1:(
±
,e)-2-甲基-n-((2-(三氟甲氧基)吡啶-4-基)亚甲基)丙烷-2-亚磺酰胺向2-(三氟甲氧基)吡啶-4-甲醛(573mg,3mmol,1.0eq)及(
±
)-2-甲基丙烷-2-亚磺酰胺(498mg,3.9mmol,1.3eq)于thf(15ml)中的混合物中逐滴添加乙醇钛(0.68ml,3.3mmol,1.1eq)。在室温下搅拌溶液 17小时。黄色溶液用水(20ml)及dcm(10ml)稀释。过滤所得混合物。分离各层且用dcm(2
×
20ml)萃取水相。将经合并的有机相用h2o(1
×
20 ml)、饱和nacl水溶液(1
×
20ml)洗涤,经mgso4干燥并且真空浓缩。藉由combiflash(管柱:40g,流动:40ml/min,庚烷至庚烷/etoac 100: 30)纯化残余物,得到白色固体。lc-ms(2):tr=0.96min;[m h]
: 295.18。步骤2:(
±
)-2-甲基-n-((2-(三氟甲氧基)吡啶-4-基)甲基)丙烷-2-亚磺酰胺向(
±
,e)-2-甲基-n-((2-(三氟甲氧基)吡啶-4-基)亚甲基)丙烷-2-亚磺酰胺(285mg,0.97mmol,1.0eq)于meoh(20ml)中的冰冷溶液中添加硼氢化钠(55mg,1.45mmol,1.5eq)。在0℃下搅拌混合物2.5小时。将反应混合物真空浓缩。使残余物分配于水(25ml)与dcm(25ml)之间。分离各层。水相用dcm(2
×
25ml)萃取。将经合并的有机相经mgso4干燥并且真空浓缩。产物未经进一步纯化即可使用。lc-ms(2):tr=0.82 min;[m h]
:297.22。步骤3:(2-(三氟甲氧基)吡啶-4-基)甲胺盐酸盐向(
±
)-2-甲基-n-((2-(三氟甲氧基)吡啶基-4-基)甲基)丙烷-2-亚磺酰胺 (279mg,0.94mmol,1eq)于meoh(20ml)中的冰冷溶液中添加含4n hcl的二烷(1.2ml,4.71mmol,5eq)。在0℃搅拌所得混合物1小时。将反应混合物真空浓缩。产物以粗制形式用于下一步骤。lc-ms(2): tr=0.40min;[m h]
:193.28。
[0158]
(
±
)-2-甲氧基-1-(2-(2,2,2-三氟乙氧基)吡啶-4-基)乙-1-胺盐酸盐的合成步骤1:(
±
)-(2-甲氧基-1-(2-(2,2,2-三氟乙氧基)吡啶-4-基)乙基)胺基甲酸三级丁酯依序向4-溴-(2,2,2-三氟乙氧基)吡啶(571mg,2.17mmol,1.0eq) 于脱气dmso(100ml)中的溶液中添加2-{[(三级丁氧基)羰基]胺基}-3-甲氧基丙酸(749mg,3.25mmol,1.5eq)、磷酸三钾(1.41g,6.5mmol, 3.0eq)、4,4'-二-三级丁基-2,2'-二吡啶基(59mg,0.217mmol,0.1eq)、 nicl2·
乙二醇二甲醚(49mg,0.217mmol,0.1eq)及 [ir{df(cf3)ppy}2(dtbpy)]pf6(49mg,0.04mmol,0.02eq)。所得混合物在搅拌的同时用n2脱气15分钟。随后,在室温下在蓝色led照射下搅拌所得混合物隔夜。添加水且用etoac(3
×
)萃取混合物。将经合并的有机层进一步用饱和nacl水溶液洗涤,经mgso4干燥,过滤且真空浓缩。藉由combiflash(管柱:24g,流动:25ml/min,庚烷至庚烷 30% etoac) 纯化残余物,得到黄色
油。lc-ms(2):tr=0.98min;[m h]
:351.25。
[0159]
步骤2:(
±
)-2-甲氧基-1-(2-(2,2,2-三氟乙氧基)吡啶-4-基)乙-1-胺盐酸盐在室温下搅拌(
±
)-(2-甲氧基-1-(2-(2,2,2-三氟乙氧基)吡啶-4-基)乙基)胺基甲酸三级丁酯(600mg,1.71mmol,1eq)于含4n hcl的二烷 (6.85ml,27.4mmol,16eq)中的溶液隔夜。将混合物真空浓缩,得到白色固体。产物未经进一步纯化即可使用。lc-ms(2):tr=0.56min; [m h]
:251.25。
[0160]
(
±
)-1-(2-(二氟甲氧基)吡啶-4-基)乙-1-胺的合成步骤1:1-(2-(二氟甲氧基)吡啶-4-基)乙-1-酮向2-(二氟甲氧基)吡啶-4-腈(1.50g,8.38mmol,1.0eq)于thf(80 ml)中的冰冷溶液中逐滴添加3m溴化甲镁溶液(6.13ml,18.4mmol, 2.2eq)。所得混合物在室温下搅拌隔夜。所得混合物用1m hcl水溶液 (15ml)淬灭且在室温下搅拌所得混合物1h。将反应混合物用饱和 nahco3水溶液及etoac稀释。分离各层且用etoac(1
×
30ml)萃取水相。将经合并的有机相用饱和nacl水溶液(1
×
20ml)洗涤,经mgso4干燥并且真空浓缩。藉由combiflash(管柱:40g,流动:40ml/min,庚烷至庚烷 18% etoac)纯化残余物,得到无色油。lc-ms(2):tr=0.78min; [m h]
:188.26。
[0161]
步骤2:(
±
)-1-(2-(二氟甲氧基)吡啶-4-基)乙-1-胺依序向1-(2-(二氟甲氧基)吡啶-4-基)乙-1-酮(610mg,3.26mmol,1 eq)于meoh(100ml)中的溶液中添加乙酸铵(5.03g,65.2mmol,20 eq)及氰基硼氢化钠(410mg,6.52mmol,2eq)。所得混合物在室温下搅拌隔夜。真空浓缩所得混合物。将残余物用饱和nahco3水溶液及dcm 稀释。分离各层且用dcm(1
×
30ml)萃取水相。将经合并的有机相用饱和 nacl水溶液(1
×
20ml)洗涤,经mgso4干燥并且真空浓缩。残余物未经进一步纯化即可使用。lc-ms(2):tr=0.43min;[m h]
:189.31。
[0162]
(
±
)-1-(2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-基)乙-1-胺的合成步骤1:2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-腈向2,2,2-三氟乙醇(1.0ml,13.6mmol,2.2eq)于thf(8ml)中的冰冷溶液中分批添加氢化钠于矿物油中的60%分散液(569mg,14.2 mmol,2.3eq)。所得混合物经30min升温至室温且在室温下搅拌30 min。将混合物冷却至0℃且逐滴添加6-氯-2-甲基嘧啶-4-腈(1.0g,6.19 mmol,1eq)于thf(4ml)中的溶液。使所得混合物缓慢升温至室温且在室温下搅拌30分钟。将反应混合物缓慢倾入冷水(40ml)中,且随后用 etoac(2
×
40ml)萃取。将经合并的有机层用饱和nacl水溶液洗涤,经 na2so4干燥,过滤且真空浓缩。藉由combiflash(管柱:24g,流动:35 ml/min,庚烷至庚烷 15% tbme)纯化残余物,得到淡黄色油。lc
‑ꢀ
ms(2):tr=0.86min;[m h]
:218.30。
[0163]
步骤2:1-(2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-基)乙-1-酮向在-78℃下冷却的2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-腈(945 mg,4.35mmol,1.0eq)于thf(37ml)中的溶液中逐滴添加3m甲基溴化镁于乙醚中的溶液(9.3ml,27.8mmol,6.4eq)。在室温下搅拌所得混合物1小时。使所得混合物冷却至0℃且用10%乙酸水溶液(15ml)缓慢淬灭。将反应混合物用饱和nahco3水溶液(50ml)及etoac(50ml)稀释。分离各层且用etoac(1
×
50ml)萃取水相。将经合并的有机相用饱和nacl 水溶液(1
×
50ml)洗涤,经na2so4干燥并且真空浓缩。藉由 combiflash(管柱:40g,流动:40ml/min,庚烷至庚烷
12% tbme)纯化残余物,得到黄色固体。lc-ms(2):tr=0.88min;[m h]
:235.28。
[0164]
步骤3:(
±
)-1-(2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-基)乙-1-胺依序向1-(2-甲基-6-(2,2,2-三氟乙氧基)嘧啶-4-基)乙-1-酮(271mg, 1.08mmol,1eq)于meoh(31ml)中的溶液中添加乙酸铵(1.66g,21.5 mmol,20eq)及氰基硼氢化钠(142mg,2.15mmol,2eq)。所得混合物在室温下搅拌隔夜。真空浓缩所得混合物。将残余物用饱和nahco3水溶液(40ml)及dcm(40ml)稀释。分离各层且用dcm(1
×
40ml)萃取水相。将经合并的有机相用饱和nacl水溶液(1
×
40ml)洗涤,经na2so4干燥并且真空浓缩。藉由制备型hplc(管柱:waters xbridge,30
×
50 mm,10μm,uv/ms,碱性条件)纯化残余物。lc-ms(4):tr=0.74 min;[m h]
:236.06。
[0165]
ii.生物分析a)大鼠振荡分析:分析原理此分析为经设计以使用来自胚胎大鼠大脑的原代神经元培养物模拟癫痫性癫痫发作的功能性表型分析,该等神经元培养物形成功能性神经元网络,当在384孔盘中以高密度培养时产生同步胞内钙浓度振荡。癫痫表型系藉由在无镁分析缓冲液中培育神经元来诱导,此举会导致nmda受体活化机率增加,从而引起细胞内钙振荡的频率及幅度增加。在神经元与钙指示染料fluo-8 am(tebu-bio)一起培育后,可使用tetra(荧光盘读取器,molecular devices)实时监测神经元钙振荡。利用此等记录,可量化抗癫痫药物的作用。直接或间接活化kv7通道的化合物的抗癫痫作用可藉由kv7通道阻断剂xe-991来调节。如先前所述(pacico n, mingorance-le meur a.new in vitro phenotypic assay for epilepsy: fluorescent measurement of synchronized neuronal calciumoscillations.plos one 9(1)2014)伴以下文所描述的修改进行分析。
[0166]
神经元培养物动物照护遵循根据瑞士(swiss)机构指南的标准程序。分离的神经元培养物系获自胚胎阶段e18的胚胎韦斯(wistar)大鼠的脑皮质(charlesriver)。藉由剖腹手术自深度麻醉大鼠(isofurane)移除子宫角,且藉由断头术杀死。藉由闭合钳使胚胎断头。使用双筒望远镜在光学控制下在冰冷 pbs(life technologies)中一个接一个地分离及剥离大脑。移除脑膜、嗅球及基底神经节。藉由镊子将皮层半球(仍包括海马区)切成小块,并且将其置于冰上预冷却的hibernate-e培养基(life technology)中。半球接着在 30℃下在含有15u/ml番木瓜蛋白酶(worthington)的10ml hibernate-e 中培育25分钟,伴以每10分钟平缓混合。基因体dna接着藉由在37℃下在4u/ml rdnase i(ambion)存在下延长培育10min来消化。所得悬浮液随后在800g下离心5分钟且将细胞集结粒再悬浮于2ml hibernate-e中,且藉由用塑料巴斯德(pasteur pipette)吸管上下吸移10次而平缓地分离,产生均质细胞悬浮液。此悬浮液立即经由70μm细胞过滤器( smartstrainer,miltenyi)过滤,收集于10ml hibernate-e中且在800g下离心5分钟。将细胞集结粒再悬浮于补充有2% b-27、0.5mm glutamax
‑ꢀ
i、100u/ml青霉素、100μg/ml链霉素(life technologies)的神经基质 (neurobasal)培养基中,且稀释至300'000个细胞/ml的最终浓度。在接种细胞前一天,将384孔盘涂布有25μl/孔的0.1%聚-l-离胺酸溶液 (sigma),在37℃下培育隔夜,用无菌蒸馏水洗涤两次且使其在室温下干燥》2小时。在384孔黑色透明底盘(corning)中以15'000
个细胞/孔的密度以50μl/孔接种神经元,且随后在培育箱中在37℃、5% co2及95%湿度下维持8至10天。3天及7天后,在无菌条件下更新40%培养基。
[0167]
协定大鼠振荡分析使用biotek el406培养盘洗涤器用不含ca
2
及mg
2
的汉克氏平衡盐溶液(hbss)洗涤接种于分析盘中的神经元,该溶液补充有20mmhepes(life technologies)及2mm cacl2(sigma),ph 7.4(下文称作分析缓冲液)。在37℃,5% co2下,神经元于分析缓冲液中装载有1μm fluo
‑ꢀ
8am历时15min。随后移除含有染料的缓冲液且使用biotek el406洗涤器用分析缓冲液洗涤分析盘3次,且使其在室温下于50μl分析缓冲液中平衡25min。使用tetra每秒一次获得的荧光波动的动力学曲线反映神经元钙振荡。在由20min分隔开的两个阶段中执行记录,从而产生两个采集:「急性」及「20min」。在「急性」采集阶段中,在kv7通道阻断剂xee-991存在或不存在下,在500秒时间段内记录荧光。在采集开始之后250秒添加测试化合物。在化合物添加之后20min,再次记录钙振荡 400秒,对应于「20min」采集阶段。
[0168]
化合物的储备溶液以10mm的浓度在dmso(sigma)中制备。首先在dmso中制备化合物的5倍连续稀释液。接着在补充有0.1%无脂肪酸牛血清白蛋白(sigma)的分析缓冲液中稀释化合物,在神经元上达到128pm至10μm的最终化合物浓度。kv7通道阻断剂xe-991(biotrend) 直接稀释于含有0.1%无脂肪酸牛血清白蛋白的分析缓冲液中,产生分析盘中10μm的最终浓度。
[0169]
分析使用软件(molecular devices)导出时序数据,且用 orbit软件(idorsia pharmaceuticals ltd.)转换为与专有分析软件兼容的格式。随后应用高通滤波器以使用htstudio(idorsia pharmaceuticals ltd.) 将信号平坦化,以允许计算所有时间点及化合物浓度的曲线下面积 (auc)。此允许使用如下文所描述的ic50studio(idorsia pharmaceuticals ltd.)计算在「急性」阶段与「20min」阶段的效力(ic
50
)(「ic
50
急性」与「ic
50
20 min」)。注意:可替代地,信号平坦化及ic
50
计算可分别使用来自wave metric(「活动窗」滤波器)的诸如igor的市售软件及来自 graphpad的prism 7.0达成。
·
「ic
50
急性」:将化合物添加之前及之后的auc荧光比率用于使用非线性回归分析与4参数拟合生成浓度-反应曲线(抑制)。
·
「ic
50
20 min」:将化合物添加之后20min量测到的荧光auc用于使用非线性回归分析与4参数拟合生成浓度-反应曲线(抑制)。
[0170]
ic
50
值对应于在媒剂存在下抑制50%神经元振荡的化合物浓度(顶部平台)。抑制最大值对应于振荡的完全去除(底部平台),其藉由添加100μm卡巴马平(sigma)获得。
[0171]
如下计算偏移值:偏移值=(在10μm xe-991存在下的 ic
50
急性值[nm])/(ic
50
急性值[nm])。若在xe-991存在下的ic
50
不可计算,则最小偏移值计算如下:移位=(最高测试浓度[nm])/(ic
50
急性值 [nm]),且偏移值以「》」批注。
[0172]
表1.大鼠振荡ic
50
及偏移
[0173]
c)kv7.2/3分析(在charles river进行):hek293细胞经适当离子通道cdna(人类kcnq2及kcnq3基因)稳定转染。细胞在补充有10%胎牛血清、100u/ml青霉素g钠、100μg/ml 链霉素硫酸盐及选择抗生素的达尔伯克氏改良伊格尔培养基/营养物混合物f-12(d-mem/f-12)中培养。flipr测试程序:对于flipr分析,细胞以15'000至30'000个细胞/孔接种于384孔黑色透明底微量滴定盘(bdbiocoat聚-d-离胺酸多孔细胞培养盘)中。细胞在37℃下培育隔夜或直至细胞在孔中达到足够密度(接近汇合单层)以用于荧光分析。藉由施加激动剂触发的荧光变化系使用tetra记录且以4.2软件 (molecular devices)显示。根据制造商说明书,用
flipr钾分析套组 (molecular devices)进行分析。染料装载:移除生长培养基且在室温下用 20μl染料装载缓冲液替换60分钟。flipr记录(激动剂模式):测试化合物的储备溶液以33.3mm的浓度在dmso中制备。将在荧光放射增强缓冲液(含5mm tl
的无k
缓冲液)中制备的5μl 5倍浓缩测试、媒剂或对照化合物溶液添加至各孔中,且持续荧光记录5分钟。测试或对照化合物对 kv7通道的激动剂作用(ec
50
及作用%)如下测定:使用4.2 软件导出原始数据且使用microsoft excel(microsoft corp.redmond, wa)分析荧光迹线。测试化合物反应表示为相对于对照化合物氟鲁匹汀 (flupirtine)(sigma-aldrich)的最大反应%,其在0.03至100μm范围内的浓度下测试。将浓缩反应数据与希尔(hill)方程拟合。假设简单链接模型,进行非线性最小平方拟合。适当时,拟合由标准偏差加权。没有作出关于拟合参数的假设;藉由算法确定拟合参数。
[0174]
表2.kv7.2/7.3活化实例编号flipr:ec
50
(nm)实例编号flipr:ec
50
(nm)24143475937305382
[0175]
iii.药理学实验调配及投药.将化合物调配于10%聚乙二醇400(peg 400)/0.5%甲基纤维素(mc 0.5%)的90%水溶液中。首先将药物溶解于peg 400中且接着以xmg/5 ml/kg悬浮于mc 0.5%中用于经口管饲(x参见表格)。
[0176]
全身性痉挛性癫痫发作的听觉性癫痫发作敏感性小鼠模型1.程序:在两天适应之后,在雄性幼年dba/2j小鼠(22-24日龄; janvier labs,france)中诱发听觉癫痫发作。将各小鼠单独置放于暴露腔室中,一种在声音减弱箱内的半球形丙烯酸玻璃圆拱(直径:50cm)。声音减弱箱配备有两个照明灯及相机系统(来自unibrain的fire-i)以便观测并记录行为癫痫发作反应。在适应60秒之后,自置放于圆拱的顶部中心上的扬声器播放刺激,一种110db下的15-20khz的混合频率音调(saslablite,avisoft bioacoustics)。刺激施加最多60秒,或直至小鼠展示后肢的强直性伸展。癫痫发作如下归类:0级,正常行为;1级,狂奔;2级,全身性阵挛;3级,后肢的强直性伸展。2.化合物测试:在随机分配8至10只小鼠的独立组中评估急性化合物对听觉性全身性痉挛性癫痫发作的作用。经口投与化合物或媒剂后,评定在声音暴露期间的最大癫痫发作级别。在暴露于刺激之前1小时给与化合物。各小鼠仅暴露于听觉刺激一次且随后藉由吸入co2安乐死。
[0177]
表3.ags小鼠模型中的功效
[0178]
杏仁核点燃大鼠模型:1.程序:成年雄性韦斯大鼠(harlan laboratories,netherlands或 charles rivers,germany;体重300-350g)在异氟醚麻醉下立体定向植入扭转双极涂塑不锈钢电极(ms333-2-biu 10mm,plastics one)至右底侧杏仁核中。为了置放电极,在颅骨中进行穿孔且将电极降至右底侧杏仁核中(自前囟:前后(ap):-2.5mm,中侧(ml):-3.5mm,背腹(dv):
‑ꢀ
8.6mm;α=10
°
)且用螺钉及牙用丙烯酸酯固定至颅骨。在一周恢复之后,其经每日处理且经一周适应点燃装备。点燃程序:对于点燃阶段,将每只大鼠单独置放于光滑丙烯酸塑料圆底碗(高度36cm,basi 运动响应笼饲系统)中且将其颅内植入的电极经由电缆(335-340/3(c),plastics one)连接至刺激器(stg4008,multichannel systems gmbh)及记录装置(powerlab 8/35,adinstruments ltd)。对于点燃程序,每只大鼠每日一次暴露于电刺激,且观察所引起癫痫发作的行为症状且根据经修改的racine量表分级(0级,停滞、颤抖、正常行为;1级,面部抽搐:鼻、嘴唇、眼睛;2级,咀嚼、点头;3级,前肢阵挛;4级,后肢站立,前肢跌倒;5级,后肢站立,侧面或背部跌倒,翻滚)。电刺激由1s的50 hz方波双相脉波列组成,持续时间为1ms,强度为400μa(超过阈限强度)。每天施加刺激直至每只大鼠完全点燃,亦即在至少十个连续点燃阶段中在电刺激后其显示4级及5级严重程度的癫痫发作。资料评分及分析。使用labchart7 pro软件(adinstruments ltd)记录脑电图癫痫发作的持续时间(后放电,ad)。同时,记录视讯以评估癫痫发作级别(ss)。2.化合物测试:在随机交叉设计中评估6-8个完全点燃大鼠的组的急性药物作用,药物与媒剂施用之间为48小时。在经口投与药物或媒剂之后,药物测试包括藉由对处理分配不知情的实验者确定后放电阈值(引起至少3秒持续时间之后放电(脑电图量测到的神经元超同步活性,振幅比基线幅度高2倍且频率≥1hz)所必需的最小刺激强度)及监测在adt(后放电阈值)所引起的癫痫发作的脑电图及行为相关性,包括ad持续时间及ss。
[0179]
表4.大鼠点燃模型中的功效
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。