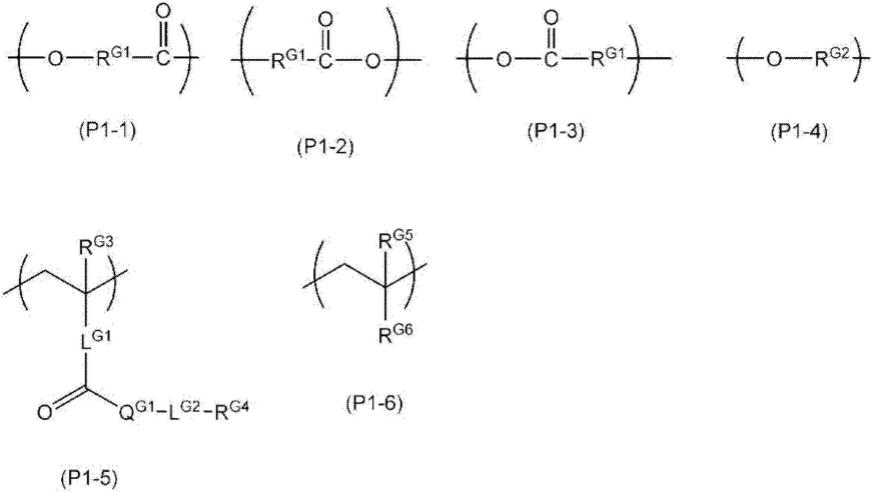
1.本发明广泛地但不仅仅涉及用于菌落挑取的方法和系统。
背景技术:
2.将dna(和其它类似的多核苷酸)引入宿主细胞的过程是重组dna技术的关键方面。将多核苷酸引入宿主细胞的过程称为转化。细菌细胞通常仍然是大多数重组dna实验和基因工程操作的优选宿主。
3.培养和选择细菌细胞的常规方法通常涉及在含抗生素的琼脂板上培养转化的细菌细胞。只有含有引入的dna的细菌细胞才能在抗生素存在的情况下分裂、生长并形成菌落。然后,在执行下游操作之前进行菌落挑取和/或菌落计数。
4.菌落挑取和计数操作冗长且耗时。已在主要通过开发自动菌落挑取器来自动化这些操作方面进行了努力。通过使用图像分析技术和内部算法将实际菌落与由气泡和菌落不规则性引起的背景噪声区分开,可以通过机器人控制的灭菌针对琼脂板上形成的菌落进行计数和挑取,并将其分离到单个孔(通常为96和384孔板)中进行培养。然而,自动菌落挑取器的使用受到设备高成本、所使用的试剂量(类似于手动方法中使用的数量)、污染风险以及所需的设备维护水平的限制。此外,低通量水平(平均约1000个菌落/小时)使自动菌落挑取器难以满足对大规模遗传构建的不断扩大的需求。
5.因此,需要一种规避与现有菌落挑取和/或计数操作相关的问题的菌落挑取和/或计数的自动方法。
6.因此,需要提供一种谋求解决上述至少一个问题的系统和方法,或提供一种有用的替代方案。
技术实现要素:
7.根据本发明的第一方面,提供了一种菌落挑取方法,该方法包括以下步骤:
8.将细菌悬液与油基载液混合,用于生成包含细菌悬液中所含细菌的多个液滴;
9.将该多个液滴孵育预定的时间段,以允许细菌在该多个液滴内生长;
10.筛选流过微流体装置的一个或多个微流体通道的该多个液滴中的每一个,以确定该多个液滴中的每一个的不透明度,其中该不透明度指示该多个液滴中的菌落形成;以及
11.基于该多个液滴中的每一个的不透明度对该多个液滴进行分选。
12.根据本发明的第二方面,提供了一种用于菌落挑取的系统,该系统包含:
13.液滴生成器,用于将细菌悬液与油基载液混合,以生成包含细菌悬液中所含细菌的多个液滴;
14.培养箱,用于培养该多个液滴预定的时间段,以允许细菌在该多个液滴内生长;
15.微流体装置,包含用于接收经孵育的液滴的一个或多个微流体通道,其中该多个液滴中的每一个连续流过该一个或多个微流体通道;
16.光学装置,用于筛选流过该一个或多个微流体通道的该多个液滴中的每一个,以
确定该多个液滴中的每一个的不透明度,其中该不透明度指示该多个液滴中的菌落形成;和
17.分选模块,被配置为基于该多个液滴中的每一个的不透明度对该多个液滴进行分选。
附图说明
18.本发明的实施例仅以实例的方式提供,并且对于本领域的普通技术人员将从以下书面描述和附图中更好地理解并变得显而易见,其中:
19.图1a示出了说明根据示例性实施方案制备含有细菌的液滴的过程的图。
20.图1b示出了说明筛选图1a中液滴存在菌落的过程的图。
21.图1c示出了说明在图1b的液滴的筛选过程中所生成的信号的实例的图。
22.图2示出了根据示例性实施方案的包括分别与直径为40μm和100μm的液滴相关的筛选结果的两组图表。
23.图3示出了说明根据示例性实施方案的用于菌落挑取的方法的流程图。
具体实施方式
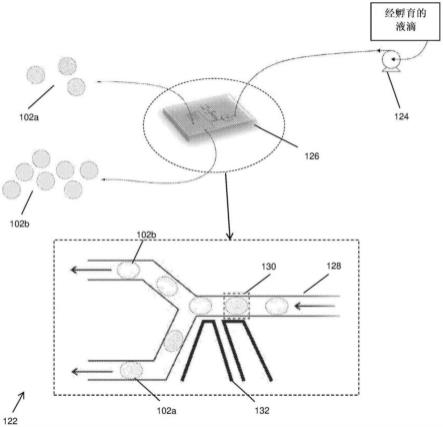
24.图1a示出图100,其说明根据示例性实施方案制备含有细菌的液滴102的过程。制备包括培养基的细菌浓缩物,并孵育预定的时间段。然后用培养基稀释细菌浓缩物,该培养基含有适于对遗传修饰的细菌施加选择压力的组分(例如抗生素),以形成预定浓度的细菌悬液。
25.接下来,将细菌悬液中的每种细菌包封在单细胞液滴中,并在通过微流体系统筛选包括微生物菌落的液滴之前,孵育预定的时间段。根据示例性实施方案的用于菌落挑取的系统和方法的细节将在下面进一步详细解释。
26.通过用培养基将细菌浓缩物稀释至预定浓度例如(例如100个细菌/ml),在第一容器中制备细菌悬液104。该培养基含有抗生素以对细菌施加选择压力。例如,初始细菌浓缩物含有大肠杆菌dh10β(新英格兰生物实验室)细胞,其经过转化并在恢复期间在不含抗生素的溶菌肉汤(lb)培养基中生长。然后用含有抗生素卡那霉素(50μg/μl)(sigma)的lb培养基将细菌浓度稀释为预定浓度的细菌悬液。
27.选择液滴的半径和细菌悬液的浓度以达到每滴1个细菌以进行单细胞包封。具体地,为了达到平均每液滴1个细菌,基于根据公式个细菌/ml的所需液滴的半径确定细菌悬液的浓度,其中r是液滴的半径,单位为μm。
28.在第二容器中制备油基载液106(例如,具有0.15%(v/v)油基生物相容性表面活性剂pico-surf 1(sphere fluidics,美国)的novec 7500氟碳油(3m,美国)。泵108(例如,压力泵和注射泵)用于将细菌悬液104和油基载液106分别施用于微流体液滴生成器114的细菌悬液入口110和油基载体液体入口112。
29.如图1a中的液滴生成器114的扩大视图所示,细菌悬液104和油基载液106沿一个方向(如图1a中箭头116所示)流向汇合处,并混合形成多个液滴102,其中细菌悬液104被油基载液106包封。由于选择了液滴的半径和细菌悬液104的浓度,所生成的液滴102大部分是
空的或含有单个细菌。所生成的液滴102然后流向液滴生成器114中的出口118,并收集在第三容器中。
30.接下来,将所收集的液滴102置于培养箱中,持续预定温度和预定时间(例如,22℃持续24小时)。由于细菌悬液104的培养基中抗生素的存在,在孵育过程120中,只有具有抗生素抗性基因的经成功转化的细菌才会在液滴102中增殖并形成单菌落。
31.图1b示出图122,其说明筛选图1a中液滴102存在菌落的过程。在完成培养过程后,使用泵124将经孵育的液滴102输送到微流体装置126,用于筛选和分选单个液滴102。如图1b中的微流体装置126的放大视图所示,微流体装置126包括一个或多个微流体通道128,其允许该多个液滴102中的每一个连续流过,用于进行筛选和分选过程。应当理解,液滴102可以被收集并在与液滴生成器114和微流体装置126集成的储存器(1cm3)中孵育。储存器可以包括阀,该阀可操作以允许液滴102在不使用泵124的情况下排出储存器并流入微流体通道128。
32.当液滴102穿过微流体通道128时,通过测量与液滴102相关的明视场强度,使用具有带视场130的物镜的光学装置筛选每个液滴102,以确定液滴102的不透明度。液滴102的不透明度指示多个液滴中的菌落形成。光学装置基于所测量的明视场强度生成信号,并将该信号传输至数据采集单元,用于通过分选模块132与预定阈值进行比较。
33.例如,微流体装置126用于筛选带有抗生素抗性质粒的大肠杆菌细胞。对于已经成功带有经转化质粒的细胞,它们将在充满抗生素的培养基中生长,并在液滴102内扩增成菌落,从而增加液滴102的不透明度,并导致光学装置生成低明视场信号。含有细胞的不透明液滴102a可以随后从具有低不透明度的空液滴102b中分选出来。
34.光学装置可以具有两个或三个部件:(1)光源;(2)检测单元;和(3)放大单元,如果信号较弱,用以放大来自检测单元的信号。在某个实例中,光源是卤素灯(德国莱卡),检测单元是倒置显微镜dmi8(德国莱卡),并且放大单元是光电倍增管(pmt)(日本hamamatsu)。
35.用泵(例如,注射泵,美国哈佛仪器)以预定流速(例如,4μl/min)将含有细菌的液滴102施用到具有预定尺寸(例如80
×
80
×
90μm3)的长微流体通道中。用卤素灯连续照射观察窗(例如,211.2
×
211.2μm2的面积),用于检测液滴102通过微流体通道128时的明视场强度。基于明视场强度生成的信号用pmt放大,并输入matlab进行数据处理。
36.分选模块132将光学装置生成的信号与预定阈值进行比较,并基于每个液滴102的不透明度转移液滴102。具体地,如果强度信号低于预定阈值,表明具有成功转化的细菌的不透明液滴102a通过,分选模块132被激活以将不透明液滴102a拉到收集出口。另一方面,如果强度信号高于预定阈值,分选模块132将允许空液滴102b被动地流向废物出口。
37.在某个实例中,分选模块132包括合成非均匀电场的电极,以通过介电泳拉动不透明液滴。主动分选不透明液滴102a的其他实例包括(1)操作隔膜阀以泵送空气/流体来阻塞特定通道,(2)生成表面声波(saw)以推动不透明液滴102a,以及(3)操作动态流体开关以从侧通道注入流体脉冲来推动不透明液滴102a。可替代地,可以被动地分选不透明液滴102a:(1)基于液滴102的含量和质量使用重力,或者(2)基于具有确定性侧向位移(dld)的尺寸差异。
38.图1c示出图134,其说明在图1b的液滴102的筛选过程中所生成的信号的实例。强度(a.u.)绘制在y轴上,时间(s)绘制在x轴上。换言之,图134示出了在微流体通道128的视
场130中由光学装置的物镜捕获的强度信号随时间的变化。如图所示,在y轴上的100a.u.和150a.u.之间预定阈值(在图1c中用参考数字136表示)。分选模块被配置为将强度信号与预定阈值136进行比较,并基于强度信号与预定阈值136的比较将液滴102转移到不同的组。在图1c所示的实例中,强度信号在约时间0.05s左右下降,表明带有经成功转化的细菌的不透明液滴102a正在通过。在这种情况下,分选模块被激活以将不透明液滴102a拉到收集出口。
39.对微生物学家来说,细菌菌落挑取/计数仍然是一项重要但单调的任务。已在主要通过开发自动菌落挑取器来自动化板上的菌落挑取/计数过程进行了努力。然而,自动菌落挑取器仍然受限于高成本、污染风险、繁重的维护要求及其低通量。
40.示例性实施方案的用于菌落挑取的系统和方法涉及使用集成微流体模块,用于基于液滴的不透明度,在孵育过程后自动筛选含有细菌和抗生素的液滴102中的菌落形成。该系统和方法也可以用于筛选酶-突变体库,该酶-突变体库含有通过定点诱变生成的独特蛋白质序列的菌落。有利地,示例性实施方案的方法可以用于在没有任何报告物或标记的情况下筛选细菌,因为细菌菌落基于液滴102的不透明度挑取。
41.示例性实施方案的系统和方法可以通过允许自动菌落挑取过程同时显著降低成本(例如,生物试剂成本)、时间和变异性,促进显著更大的通量(每天1000hz或》百万滴)。转化后和菌落筛选过程之间的间隙的桥接允许在操作之间的完全化学隔离。与使用琼脂板的传统方法相比,这可以最小化不同菌落之间的污染,并减少菌落挑取过程所需的空间。
42.图2示出了根据示例性实施方案的包括分别与直径为40μm和100μm的液滴相关的筛选结果的两组图表(a、b、c和d)。取决于将导致不同增殖速率、细胞大小、细胞透明度等的细菌菌株,在孵育过程中,液滴不透明度的变化程度可以因细菌而异。因此,需要优化液滴大小以产生更准确的选择。
43.在图a、b、c和d中,对于涉及大肠杆菌的实验,由pmt检测的不透明度(a.u.)绘制在y轴上,细菌浓度(/ml)绘制在x轴上。如说明40μm液滴筛选结果的图a和图b所示,在具有细胞培养基(无细胞,阴性对照)、培养4小时的单细胞(8.75e7细胞/ml)、培养6小时的单细胞(3.1e8细胞/ml)、培养7小时的单细胞(3.66e8细胞/ml)和储备细胞悬液(1.01e10细胞/ml,阳性对照)的液滴之间比较了不透明度(图a中的平均不透明度和图b中的不透明度分布)。所有不同浓度的液滴(包括仅含有培养基的液滴和含有高浓度细胞的液滴)的不透明度信号基本重叠。
44.如说明100μm液滴筛选结果的图c和图d所示,比较了具有细胞培养基(阴性对照)、单细胞培养24小时和储备细胞悬液(1.01e10细胞/ml,阳性对照)的液滴中的不透明度(图c中的平均不透明度和图d中的不透明度分布)。如图d所示,在含有培养基的液滴和包含细胞的液滴的不透明度信号中存在可忽略的重叠。不透明度信号中的重叠范围越宽(诸如图a和图b中所示的40μm液滴的重叠范围)将导致难以设定用于分选液滴的阈值。因此,对于大肠杆菌,较大的液滴可以促进筛选过程,因为较大的液滴允许更多的细胞生长,因此不透明度的范围更精确,这可以有助于更准确地区分含有不同浓缩物的液滴。
45.根据实验的应用,可以设定合适的阈值,用于将含有经成功转化的细胞的液滴与其他液滴进行分选。例如,在图d中,线1代表捕获所有阳性液滴的较低阈值。尽管这允许收集更多数量的阳性液滴,但所收集的液滴可能含有更多的假阳性(即空液滴)。线2代表捕获含有尽可能少的阴性液滴的液滴的较高阈值。虽然这减少了待收集的阴性液滴的数量,但
它可能会损害所收集的阳性液滴的数量。
46.图3示出流程图300,其说明根据示例性实施方案的用于菌落挑取的方法。在步骤302,将细菌悬液与油基载液混合,用于生成包含细菌悬液中所含细菌的多个液滴。在步骤304,将多个液滴孵育预定的时间段,以允许细菌在多个液滴内生长。在步骤306,筛选流过微流体装置的一个或多个微流体通道的多个液滴中的每一个,以确定多个液滴中的每一个的不透明度,其中该不透明度指示多个液滴中的菌落形成。在步骤308,基于多个液滴中的每一个的不透明度对多个液滴进行分选。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。