1.本发明涉及重组宿主细胞和从宿主细胞表达目的基因(goi)的方法。本发明特别涉及改善宿主细胞长期稳定表达goi的能力的方法,以及使用该重组宿主细胞的基因疗法。
背景技术:
2.细胞和基因疗法依赖于将转基因插入靶细胞。插入可以以许多不同的方式发生,例如使用转座子或慢病毒载体。转基因插入也可以通过同源定向修复发生,这通过可编程的核酸酶如锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、成簇的规律间隔的短回文重复序列(crispr)、归巢核酸内切酶和大范围核酸酶促进。常用的转基因包括功能有缺陷的基因,也包括嵌合抗原受体(用于car-t疗法)、t细胞受体(用于tcr疗法)或在患者中功能有缺陷的cdna。
3.在真核细胞系中的稳定表达可用于许多项目。例如,它支持在细胞培养物中长时间生产重组蛋白质,或者它有助于转基因真核生物以高产量优化蛋白质生产。保持转基因的稳定表达对于确保功能性是重要的。稳定表达意味着插入基因组。
4.随机插入的基因受到位置效应和沉默的影响,使其表达不可靠和不可预测。在安全港位点的靶向插入已取得了一些进展。为此,可以靶向所谓的安全港基因座,例如,人中的aavs1(也称为ppp1r12c)基因座,这是人基因组中的充分验证的“安全港”,或小鼠和人中的rosa26,其被主动转录。
5.安全港位点基于其相对于连续编码基因、microrna和超保守区的位置来定义,并且例如理解为满足以下标准:距任何基因的5'末端至少50kb的距离,(ii)距任何癌症相关基因至少300kb的距离,(iii)距任何microrna(mirna)至少300kb的距离,(iv)位于人基因组的转录单元之外和(v)位于超保守区(ucr)之外(bejerano g等人science.2004;304:1321
–
1325;pellenz s等人hum gene ther.2019;30(7):814
–
828)。
6.browning jill等人(molecular biology reports 2019,47(2):1491-1498)描述了靶向鼠hipp11基因间区域的crispr以支持诱导型的人转基因表达。
7.keiichiro suzuki等人(nature 2016,540(7631):144-149)描述了通过crispr/cas9介导的同源非依赖性靶向插入进行的基因组编辑。
8.dahodwala hussain等人(current opinion in biotechnology 2019,60:128-137)描述了预测cho细胞系不稳定性的策略。
9.然而,转基因沉默仍然是一个不容易解决的重要问题,并且阻碍了上述方法的可行性。沉默是一种通过在dna或组蛋白上建立抑制性标记来实现的现象,例如,组蛋白h3在赖氨酸9或27上的三甲基化。当发生沉默时,这些抑制性染色质标记会扩散到某个区域,通常至少有几千碱基的dna序列(mlambo等人nucleic acids res.2018;46(9):4456-4468)并且可不仅影响转基因本身,还可影响相邻区域。
技术实现要素:
10.目的是通过选择基因组中不能被沉默的安全港基因座来克服转基因沉默。本发明的另一个目的是提供在延长的时间段内具有改善的基因表达能力的转基因宿主细胞。
11.该目的通过所要求保护的主题来解决。
12.本文提供了一种分离的哺乳动物宿主细胞,其包含在一对相邻必需基因之间的基因间区域内的靶位点处染色体整合的异源目的基因(goi)。
13.本发明提供了一种分离的哺乳动物宿主细胞,其包含在一对相邻必需基因之间的基因间区域内的靶位点处染色体整合的异源目的基因(goi),其中所述对的相邻必需基因各自具有转录起始位点(tss),并且tss之间的距离小于20.000、15.000、10.000、5.000、2.500、1.000、900、800、700、600、500或400个核苷酸(nt)中的任何一个。
14.具体地,相应tss之间的距离至少为80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290 300、310、320、330或340nt中的任何一个。
15.染色体整合是通过在基因间区域内和/或在靶位点处对宿主细胞染色体进行一种或多种遗传修饰而特异性地获得的。
16.具体地,所述一种或多种遗传修饰包括插入或敲入goi或包含goi的表达构建体。
17.具体地,宿主细胞是二倍体细胞(该术语在本文中理解为包括近二倍体细胞),例如包含每个染色体的两个拷贝。
18.具体地,分离的宿主细胞在宿主细胞培养物中提供或作为药物制剂或供体细胞提供用于细胞疗法。
19.具体地,相邻必需基因是仅由基因间区域隔开的连续编码基因,和/或定位使得两个相邻必需基因之间的基因间区域由连续非编码核苷酸序列组成。
20.具体地,本文所述的基因间区域理解为包含基因组安全港或由其组成。具体地,安全港包含用于goi插入的靶位点或基因座。靶位点可以是基因间区域内随机选择的位点,或预定位点。
21.因此,将本文所述的基因间区域理解为在将转基因(例如,goi或包含goi的表达构建体)插入靶位点之前相邻必需基因之间的多核苷酸序列。换言之,将基因间区域理解为包含位于不包含转基因的相邻必需基因之间的某个连续序列。当细胞工程化以在基因间区域内包含转基因时,将基因间区域理解为包含多核苷酸序列或由其组成,该多核苷酸序列在没有转基因的情况下识别相邻必需基因之间的区域,即包含侧翼为转基因的5'末端和3'末端的基因间区域的两个部分或由其组成,否则这些部分融合在一起,从而获得包含侧翼部分的核苷酸序列或由其组成的连续序列。
22.具体地,基因间区域的长度小于20.000、15.000、10.000、5.000、2.500、1.000、900、800、700、600、500或400nt中的任何一个。
23.具体地,基因间区域不包含基因或基因的一部分。
24.具体地,基因间区域是非编码的。
25.具体地,60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的基因间区域的至少一个由人来源的多核苷酸例如人多核苷酸组成。具体地,基因间区域包含seq id no:1-21中任一个的连续部分,其为seq id no:1-21中相应
序列全长的60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%中的至少任何一个。
26.具体地,基因间区域包含以下核酸序列或由其组成,所述核酸序列为与seq id no:1-21中任何一个的90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%相同的至少任何一个。
27.根据具体的实施方案,基因间区域包含人源多核苷酸例如与seq id no:1-21中任何一个100%相同的人多核苷酸或由其组成。
28.具体地,基因间区域包含多核苷酸或由其组成,该多核苷酸是seq id no:1-21中任何一个的天然存在的哺乳动物或人变体,例如如由seq id no:1-21中任何一个识别的多核苷酸,其中多核苷酸序列由人基因组的多核苷酸序列内天然存在的一种或多种单核苷酸多态性修饰。
29.具体地,必需基因各自为人来源的和/或具有与相应人基因序列具有85%、90%、95%、96%、97%、98%、99%序列同一性的至少任何一个,或对相应人基因序列是100%。
30.具体地,必需基因是人基因或其源自不同人的天然变体,或源自不同哺乳动物物种如小鼠、仓鼠、大鼠、狗或猪的其类似物。必需基因的序列在很大程度上是保守的,与人相比,其与非人动物中相应基因的序列同一性至少为80%或85%或90%。例如,来自人的med20的核苷酸序列与仓鼠(cho)中的相应基因93%相同,与小鼠中相应基因90%相同,与狗中相应基因99%相同,与猪中相应基因98%相同。
31.具体地,已知所述必需基因对中的必需基因各自以高表达水平表达蛋白质。必需基因在细胞中具有核心功能,并且通常在物种之间高度保守。将它们定义为失活或缺失导致细胞死亡的基因。
32.具体地,必需基因对是由第一和第二基因组成的对,其中
33.i)第一基因是nfs1,第二基因是romo1;或
34.ii)第一基因是med22,第二基因是rpla7;或
35.iii)第一基因是ddx51,第二基因是noc4l;或
36.iv)第一基因是cenpk,第二基因是ppwd1;或
37.v)第一基因是orc1,第二基因是prpf38a;或
38.vi)第一基因是polr3k,第二基因是snrnp25;或
39.vii)第一基因是cope,第二基因是ddx49;或
40.viii)第一基因是ftsj3,第二基因是psmc5;或
41.ix)第一基因是med20,第二基因是bysl;或
42.x)第一基因是aurka,第二基因是cstf1;或
43.xi)第一基因是nup88,第二基因是rpain;或
44.xii)第一基因是atp6v1d,第二基因是eif2s1;或
45.xiii)第一基因是polr2i,第二基因是tbcb;或
46.xiv)第一基因是ufd1,第二基因是cdc45;或
47.xv)第一基因是ccdc115,第二基因是imp4;或
48.xvi)第一基因是naa50,第二基因是atp6v1a;或
49.xvii)第一基因是sart3,第二基因是iscu;或
50.xviii)第一基因是c1orf109,第二基因是cdca8;或
51.xix)第一基因是polr3a,第二基因是rps24;或
52.xx)第一基因是rps16,第二基因是supt5h;或
53.xxi)第一基因是rps29,第二基因是lrr1。
54.本文所指的必需基因各自都以entrez基因id号为特征。entrez gene是国家生物技术信息中心(national center for biotechnology information)(ncbi)的生成唯一整数(geneid)作为基因的稳定标识符的基因特异性信息的数据库(maglott等人nucleic acids res.2011;39(database issue):d52
–
d57)。基因各自都有一个转录起始位点(tss),它表示由相应基因的启动子启动的转录起始点。核苷酸序列中的tss可以使用公共数据库如refseq或fantom来识别。
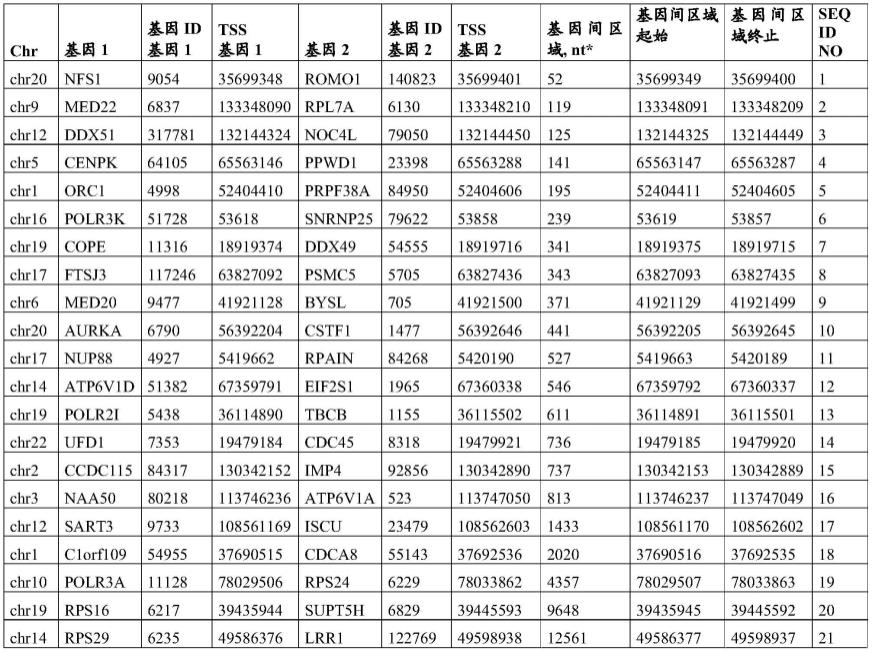
55.具体地,必需基因对和相应的基因间区域的特征如表1所示。
56.表1:示例性必需基因对和包含靶位点的基因间区域。
[0057][0058]
*基因1的tss和基因2的tss之间
[0059]
根据一个具体方面,使用选自表达控制序列的调节序列,例如启动子序列、操纵子序列、转录增强子序列或转录沉默子序列;或编码表达因子例如增强子或抑制子的核苷酸序列。具体地,一个或多个调节序列例如启动子位于所述goi的tss上游2.000或1.000bp和下游100bp之间,在一些情况下位于小的基因间区域,例如tss上游的1.000、5.000、1.000、900、800、700、600、500、400、300、200、150、100或50bp中的任何一个和tss下游50或100bp中的任何一个之间。
[0060]
具体地,必需基因对的转录方向相反。
[0061]
具体地,一对必需基因中的基因各自处于相应的必需基因启动子(egp)的转录控
制下,优选地,与相应基因天然存在的egp是组成型的或诱导型的。
[0062]
具体地,所述必需基因对的基因被定向为使得它们的egp朝向相反的方向。
[0063]
具体地,egp彼此相邻。
[0064]
更具体地,egp相邻并朝向相反的方向。
[0065]
与一对必需基因中的第一和第二基因有效地连接的相应启动子区域优选相邻或紧密接近,使得相应tss之间的距离小于20.000、15.000、10.000、5.000、2.500、1.000、900、800、700、600、500或400nt中的任何一个。
[0066]
具体地,包含靶位点的基因间区域包含相应tss之间的区域或由其组成。优选地,靶位点包含在tss之间的这样的区域中,其中两个必需基因在相反链上编码并且tss非常接近。
[0067]
根据一个具体的实施方案,靶位点至少部分或完全包含在启动子区域内。例如,将转基因插入被认为是两个必需基因之一的启动子的区域内,特别是在证明必需基因功能不受转基因插入影响的情况下。
[0068]
具体地,基因间区域是介于egp转录起始位点之间并跨越egp转录起始位点的区域。
[0069]
具体地,必需基因是所称的“核心必需基因”,即它们在迄今为止研究的许多或所有细胞类型或细胞状态中都是必需的。因此,它们的功能需要在某个物种的所有细胞类型和细胞状态中保持。例如,认为人核心必需基因在所有人细胞系中都是必需的。核心必需基因可以通过全基因组crispr/spcas9敲除筛选,例如由hart等人(g3:genes,genomes,genetics 2017年8月1日第7卷编号8 2719-2727)或wang等人(science.2014;343(6166):80
–
84)所描述的来确定。示例性人核心必需基因列于下表1中(作为基因1和/或基因2)。
[0070]
根据一个具体方面,goi处于异源启动子的转录控制之下。goi可以正向或反向整合在靶位点。
[0071]
具体地,goi包含在整合在靶位点的异源表达盒中。该表达盒可以包含控制元件、启动子或调节元件中的至少一种,其与goi有效地连接。在一些实施方案中,与goi有效地连接的控制元件、启动子或调节元件是诱导型的。
[0072]
具体地,goi是异源基因或转基因。
[0073]
具体地,goi选自以下的任何一种:核酸、抑制子、编码肽或多肽的cdna或基因,以及编码抗体或抗体片段的cdna或基因、融合蛋白、抗原、拮抗剂、激动剂、rnai分子或mirna。在一些实施方案中,cdna或基因编码一种或多种转录因子。
[0074]
靶位点具体理解为插入位点,以插入goi或包含goi的表达盒。
[0075]
靶位点可以包含至少一个或两个位点(即,至少一个或两个位置),用于在靶位点的基因间区域内插入一种或多种goi(或包含goi的表达构建体)。基因间区域可以是天然存在的或源自天然存在的序列,并且可以进一步被修饰,例如以掺入识别靶位点或任何其他异源手段来为转基因的敲入做准备。
[0076]
除了在靶位点插入goi(或包含goi的表达盒)外,基因间区域还可以通过一种或多种突变例如一个或多个核苷酸的缺失、插入或取代来进一步修饰,这可以只是一些,例如最多20nt,或最多15nt,或最多10nt,但也可以改变核苷酸序列,使得修饰的基因间区域(不包括goi序列或异源表达盒)具有50%、60%、70%、80%、85%、90%、95%、98%或99%序列同
一性的至少任何一个,或与天然存在的基因间区域100%相同。
[0077]
以seq id no:1-21中任何一个为特征的示例性基因间区域可具有或不具有一种或多种单核苷酸多态性,特别是天然存在的那些。具体地,基因间区域是天然存在的基因间区域,其可以与seq id no:1-21中的任何一个在一个或多个单核苷酸多态性上不同,或与seq id no:1-21中的任何一个相同。并且没有任何单核苷酸多态性。
[0078]
示例性宿主细胞是干细胞,包括例如造血干细胞、胚胎干细胞、多能干细胞、诱导多能干细胞或内皮细胞。
[0079]
根据一个具体方面,宿主细胞是原代细胞或免疫细胞,例如选自由自然杀伤(nk)细胞、小胶质细胞、巨噬细胞或t细胞如细胞毒性t淋巴细胞(ctl)、调节性t细胞或t辅助细胞组成的组的细胞类型。这种宿主细胞具体用于药物制剂和/或细胞疗法和/或基因疗法。例如,将工程化的t细胞工程化以表达t细胞受体(tcr),特别是异源tcr,或嵌合抗原受体(car)。
[0080]
具体地,宿主细胞是包含嵌合抗原受体(car)的免疫效应细胞,其中goi编码由所述免疫效应细胞表达的car。
[0081]
具体地,宿主细胞是包含嵌合抗原受体(car)例如car-t细胞或car巨噬细胞的免疫效应细胞,并且goi包含编码car或car的一部分如可以由所述宿主细胞在其表面上表达的一个或多个car结构域的任何一个或多个的核苷酸序列。
[0082]
根据一个具体方面,宿主细胞是人来源的,但也可以是非人动物来源的或哺乳动物的,例如小鼠、大鼠、仓鼠、狗、猪或牛。具体地,宿主细胞不是鼠宿主细胞。
[0083]
根据另一个具体方面,宿主细胞是在体外宿主细胞培养物中产生目的蛋白质的生产宿主细胞。
[0084]
具体地,哺乳动物细胞是人或啮齿动物或牛细胞、细胞系或细胞株。适合作为本文所述宿主细胞的特定哺乳动物细胞的实例是小鼠骨髓瘤(nso)-细胞系、中国仓鼠卵巢(cho)-细胞系、ht1080、h9、hepg2、mcf7、mdbk jurkat、mdck、nih3t3、pc12、bhk(小仓鼠肾细胞)、vero、sp2/0、yb2/0、y0、c127、l细胞、cos例如cos1和cos7、qc1-3、hek-293、vero、per.c6、hela、eb1、eb2、eb3、溶瘤或杂交瘤细胞系。
[0085]
本发明进一步提供了本文所述宿主细胞的分离克隆,或这种克隆的体外细胞培养物。
[0086]
根据一个具体方面,本发明提供了一种药物组合物,其包含本文所述的宿主细胞或宿主细胞群,以及药学上可接受的载体。
[0087]
本发明还提供了一种制剂,其包含宿主细胞群,特别是不同(例如,多克隆)细胞的群或库,其中细胞的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%中的至少任何一个是本文所述的宿主细胞,具有染色体同一性,或具有相同的基因型或相同的染色体型(即,基于染色体的证据的同一性)。
[0088]
具体实例是指包含car-t细胞群的药物制剂,其中细胞的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%中的至少任何一个是本文所述的宿主细胞,具有染色体同一性或具有相同的基因型或相同的染色体型,该群体稳定地表
达goi,例如以提供长时间的表达。
[0089]
本发明还提供了本文所述的克隆或制剂的体外宿主细胞培养物,其在表达所述goi,特别是稳定表达所述goi的条件下保持,从而获得例如与宿主细胞表面结合的相应的目的多肽或蛋白质,或分泌到宿主细胞培养基中。
[0090]
本发明还提供了包含本文所述宿主细胞的非人动物。具体地,所述非人动物是包含含有goi的供体序列的遗传修饰的动物(也称为转基因动物),所述供体序列插入动物染色体上的预定插入位点,其中所述预定插入位点是本文进一步描述的靶位点。具体地,本文所述的方法不包括改变人的种系遗传特性。
[0091]
示例性生产方法包括,
[0092]
a)产生在预定插入位点插入供体序列的细胞;和
[0093]
b)将a)产生的细胞引入载体动物以产生遗传修饰的动物。
[0094]
具体地,该细胞是合子或多能干细胞。
[0095]
本发明还提供了一种通配符哺乳动物宿主细胞,其包含异源手段,用于在一对相邻必需基因之间的基因间区域内的靶位点处定点染色体整合外源目的基因(goi),特别是异源goi。这种通配符宿主细胞优选是二倍体宿主细胞。
[0096]
示例性手段可以是一种或多种核酸修饰以将限制性克隆位点掺入基因间区域,或掺入一种或多种核酸酶的一个或多个靶位点。相应的核酸酶可以选自锌指核酸酶(zfn)、tal效应域核酸酶(talen)或crispr/cas系统。特定靶位点可以用于引导rna(grna),例如用于选自以下任何的序列特异性核酸酶:tal-核酸酶、锌指核酸酶(zfn)、大范围核酸酶、megatal或rna引导核酸内切酶(例如,cas9、cpf1、cas9切口酶)。
[0097]
具体手段可以包括在位于或邻近靶位点处对天然存在的基因间序列进行一种或多种核酸修饰。
[0098]
根据一个具体方面,手段选自由由重组酶识别以介导转基因在相应靶位点的敲入的异源靶位点组成的组。例如,可以将识别靶位点掺入如本文所述的基因间区域内以工程化靶位点,并且将识别此类靶位点的相应重组酶用于染色体整合goi。可以使用任何常用的定点重组技术,例如那些需要准备手段来提供如本文所述的通配符宿主细胞的技术。示例性的定点重组技术是flp-frt重组、cre-lox重组或噬菌体λ位点特异性重组。
[0099]
本发明还提供一种产生表达异源goi的重组宿主细胞的生产方法,其中将goi插入包含在一对相邻必需基因之间的基因间区域中的靶位点。
[0100]
本发明还提供了一种产生由目的基因(goi)编码的基因产物的方法,通过转化宿主细胞以将goi染色体整合到一对相邻必需基因之间的基因间区域内,并在表达所述goi的条件下培养转化的宿主细胞,优选其中所述对的相邻必需基因各自具有转录起始位点(tss),并且tss之间的距离为80、90、100或110nt中的至少任何一个,并且小于20.000、15.000、10.000、5.000、2.500或1.000nt中的任何一个。
[0101]
本发明还提供了一种通过在一对相邻必需基因之间的基因间区域内定点染色体整合外源特别是异源goi、目的基因(goi)、特别是异源goi来修饰哺乳动物细胞的方法,优选其中所述对的相邻必需基因各自具有转录起始位点(tss),并且tss之间的距离为80、90、100或110nt中的至少任何一个,并且小于20.000、15.000、10.000、5.000、2.500或1.000nt中的任何一个。
[0102]
根据一个具体实施方案,goi(或包含goi的表达盒)通过采用核酸酶的方法插入。核酸酶可包含与靶位点结合的dna结合结构域和核酸酶切割结构域。具体地,使用核酸酶在靶位点或基因间区域内产生双链断裂(dsb)。双链断裂可以通过非同源末端连接或在存在带有同源区域的供体序列的情况下通过同源定向修复来促进转基因的插入。
[0103]
具体地,该方法使用任何一种可编程核酸酶,例如工程化核酸内切酶,优选锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、crispr核酸内切酶或用于染色体整合的argonaute蛋白。特别地,该方法使用选自crispr/cas9、talen和锌指核酸酶的基因编辑蛋白。
[0104]
具体地,该方法采用基因编辑核酸序列。基因编辑核酸序列可以编码选自由以下组成的组的基因编辑分子:序列特异性核酸酶、一种或多种指导rna、crispr/cas、mad7、核糖核蛋白(rnp)或用于crispri或crispra系统的失活cas或其任意组合。可以通过本领域技术人员已知的技术评估蛋白质的核酸内切酶活性。
[0105]
特别优选的宿主细胞是用crispr-cas系统转导的那些。
[0106]
如本领域公知的,也可以使用argonaute家族蛋白。例如,ttago、pfago和ngago已被证明可引发靶向dna双链断裂,这些断裂可用于通过同源定向修复促进转基因插入(swarts等人nature.2014;507(7491):258
–
261)。
[0107]
具体地,该方法采用基因组编辑技术的手段或方法步骤将goi插入靶位点。
[0108]
根据一个具体方面,将基因间区域修饰以插入以下至少一个或多个:
[0109]
(i)基因编辑核酸序列;
[0110]
(ii)一种或多种核酸酶的靶位点;
[0111]
(iii)goi;或
[0112]
(iv)用于rna引导的dna核酸内切酶的引导rna(grna)识别位点。
[0113]
根据一个具体实施方案,goi通过同源重组插入细胞基因组。例如,可以通过同源重组将包含goi的供体序列插入位于或邻近靶位点的染色体。具体地,基因编辑用载体可用于敲入所需的核酸序列。
[0114]
为此,方便地使用载体,例如病毒载体,例如腺相关病毒载体,其包含靶位点5'同源臂、包含goi的表达盒和靶位点3'同源臂,其中5'同源臂和3'同源臂结合位于基因间区域,特别是基因间区域内的靶位点,并且其中5'和3'同源臂引导同源重组进入位于基因间区域内的基因座(特别是安全港基因座)。示例性的5'和3'同源臂的长度在30-2000bp之间。5'同源臂和3'同源臂特别结合靶位点,所述靶位点为相同基因间区域中空间上不同的核酸序列。通常采用一定程度的同源性,例如,同源臂的任何一个或两个可以是与该互补靶序列杂交的基因间区域内的靶序列65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同源互补中的至少任何一个,或者是与靶序列100%同源和互补。
[0115]
本文所述的同源重组的具体方法可以使用包含以下的载体:
[0116]
a)表达盒,其包含启动子和至少一个goi,或包含与至少一个goi有效地连接的启动子;和
[0117]
b)两个自互补序列,例如不对称或对称,位于所述表达盒的侧翼,其是与核酸酶切割位点上游的核苷酸序列同源的5'同源臂,和与核酸酶切割位点下游的核苷酸序列同源的
3'同源臂。
[0118]
本发明还提供了一组用于基因工程化宿主细胞的工具,包括
[0119]
a)本文所述的通配符宿主细胞;和
[0120]
b)载体和任选的辅助剂,其适用于所述用于在定点整合时表达goi的表达盒的定点染色体整合的手段。
[0121]
具体地,goi由掺入靶位点的表达盒提供或包含在该表达盒中。表达盒可以包含一种或多种调节元件,特别是启动子,和至少一种goi。具体地,表达盒是异源的表达盒。
[0122]
本发明还提供了物质、物质组合物或材料,其选自宿主细胞、克隆、制剂、细胞培养物、通配符宿主细胞和本文所述的工具组,用于医学用途,特别用于细胞疗法(例如,使用car-t细胞或car巨噬细胞)、t细胞受体(用于tcr疗法)或用于基因疗法的cdna。
[0123]
基因疗法的具体应用包括治疗由分泌的基因产物不足引起的或可通过分泌治疗性蛋白质治疗的病症。如果每个受体细胞表达高水平的治疗性goi,则此类病症可通过将治疗性goi递送至许多细胞来潜在地解决。此类应用通常需要稳定、安全和高水平的转基因表达。
[0124]
治疗性goi可以是当染色体整合到靶细胞中时表达治疗活性,特别是基因疗法的cdna。
[0125]
基因疗法的示例性方法采用表达凝血因子例如因子viii或因子ix的治疗性goi,用于治疗血友病例如血友病a或b的方法。
[0126]
具体地,如本文所述使用物质、物质组合物或材料,其中通过在体内表达所述goi来治疗受试者,例如通过转基因动物,例如人或非人动物。通常,体内用途是用于基因疗法。
[0127]
本发明还提供一种治疗受试者的方法,包括施用有效量的物质、物质组合物或材料,其选自宿主细胞、克隆、制剂、细胞培养物、通配符宿主细胞,和本文所述的工具组,用于在体内表达所述goi。
[0128]
根据一个具体方面,医疗用途包含通过一种方法治疗癌症患者,该方法包括:
[0129]
a)从哺乳动物受试者中分离细胞,优选为癌症患者的自体或同种异体细胞,该细胞是免疫细胞或造血细胞;
[0130]
b)通过一种或多种遗传修饰来修饰细胞以在一对相邻必需基因之间的基因间区域内的靶位点处染色体整合异源目的基因(goi),其中所述goi编码嵌合抗原受体(car);和
[0131]
c)将细胞施用于受试者。
[0132]
具体地,免疫细胞是t细胞、小胶质细胞或巨噬细胞。
[0133]
本发明还提供了一种制备嵌合抗原受体(car)t细胞的方法,包括:
[0134]
(a)从哺乳动物受试者获得t细胞,优选人t细胞;和
[0135]
(b)通过一种或多种遗传修饰修饰t细胞,以在一对相邻必需基因之间的基因间区域内的靶位点处染色体整合异源目的基因(goi),其中goi编码嵌合抗原受体(car)。
[0136]
本发明还提供了制备或生产嵌合抗原受体(car)小胶质细胞或巨噬细胞的方法,包括:
[0137]
(a)从哺乳动物受试者获得小胶质细胞或巨噬细胞,优选人小胶质细胞或巨噬细胞;和
[0138]
(b)通过一种或多种遗传修饰修饰小胶质细胞或巨噬细胞,以在一对相邻必需基
因之间的基因间区域内的靶位点处染色体整合异源目的基因(goi),其中goi编码嵌合抗原受体(car)。
[0139]
具体地,修饰的小胶质细胞或巨噬细胞的特征在于如本文进一步描述的宿主细胞的特征。
[0140]
具体地,相邻必需基因对之间的基因间区域的特征如本文进一步描述,例如特征在于以下优选特征中的一个或多个:
[0141]
a)基因间区域位于一对相邻的必需基因之间,其中所述对的相邻必需基因各自具有转录起始位点(tss),并且tss之间的距离小于20.000nt,优选至少80nt;
[0142]
b)基因间区域的长度小于20.000nt;
[0143]
c)基因间区域包含与seq id no:1-21中任何一个至少90%相同的核酸序列或由其组成;
[0144]
d)将所述对的必需基因定向使得它们的启动子朝向相反的方向;或
[0145]
e)goi包含在整合在靶位点的异源表达盒中。本发明还提供物质、物质组合物或材料的离体用途,其选自宿主细胞、克隆、制剂、细胞培养物、通配符宿主细胞和本文所述的工具组,用于体外工程化转基因细胞或重组宿主细胞。可以提供这样的细胞用于在体外例如在细胞培养物中表达goi,或在体内表达goi,例如,在将转基因细胞施用于需要这种细胞治疗的受试者后。
[0146]
附图
[0147]
图1:指定基因座的转基因表达未沉默。将转基因插入位于两个必需基因之间的基因座,其中必需基因启动子非常接近。转基因的表观遗传沉默扩散到相邻的必需基因中的一者(或两者)。这将导致细胞死亡。因此,所有存活的细胞都将转基因表达保持在高水平。
[0148]
图2:精细绘制允许转基因插入区域的实验方法。转基因插入可损害细胞活力。为了绘制允许转基因插入的精确位置,两个必需基因之间的区域与一系列引导rna平铺。作为参考,相邻的必需基因也被一组合适的引导rna靶向。在随后的crispr筛选中识别出其活性被细胞耐受的引导rna。
[0149]
图3:评估指定基因座沉默影响的实验方法。两个必需基因之间的基因座由含有报告基因(egfp)的表达盒靶向,其活性由合适的组成型启动子(sffv)调节。在附近,包括一系列teto位点。插入转基因后,由于支持转基因表达,细胞变为gfp阳性。然后用tetr-krab处理gfp阳性细胞群。tetr-krab使teto位点沉默,从而导致gfp表达减弱。随着沉默扩散到邻近的必需基因,发生gfp沉默的细胞死于细胞死亡。gfp阴性的幸存者不是孤立的。
[0150]
图4:crispr筛选以识别基因间靶向的可行基因座。在该筛选中,必需基因、基因间区域和非必需基因由一组sgrna靶向(如实施例中所述)。在第3天和第21天收获细胞,提取基因组dna并通过pcr扩增引导rna。在此图中,为此处查询的每个sgrna绘制了第21天和第3天之间的倍数变化。
[0151]
图5:crispr筛选以识别基因间靶向的可行基因座。在该筛选中,必需基因、基因间区域和非必需基因由一组sgrna靶向(如实施例中所述)。在第3天和第21天收获细胞,提取基因组dna并通过pcr扩增引导rna。在该图中,第21天和第3天之间的倍数变化在每个基因/基因座的水平上汇总,然后绘制。
[0152]
图6:不同基因座的转基因插入和pcr验证示意图。如实施例中所述,靶向三个基因
座(aavs1、med、ftsj3)。如所示的pcr验证转基因盒(sv40-mkate2-polya)的存在。
[0153]
图7:通过pcr的转基因表达的确认。从在两个必需基因之间携带插入转基因的细胞中分离出基因组dna(详见实施例)。接下来,进行pcr,其中一个引物靶向转基因盒,另一个靶向同源臂以外的区域(参见图6的示意图)。
[0154]
图8:通过流式细胞术检测转基因表达。通过流式细胞术分析在两个基因座(med20,ftsj3)携带sv40-mkate2-polya转基因的细胞。在pe通道中监测mkate2的表达。
[0155]
图9:如本文所述的序列。
[0156]
seq id no:1-21:人基因间区域
[0157]
seq id no:26:
[0158]
med20供体1(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0159]
seq id no:27:
[0160]
med20供体2(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0161]
seq id no:28:
[0162]
ftsj3供体1(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0163]
seq id no:29:
[0164]
ftsj3供体2(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0165]
seq id no:30:
[0166]
tetr-krab
[0167]
seq id no:35:
[0168]
med20同源供体(粗体为左同源臂,斜体为右同源臂)
[0169]
seq id no:36:
[0170]
ftsj3同源供体(粗体为左同源臂,斜体为右同源臂)
[0171]
seq id no:37:
[0172]
cas9表达载体(与aavs1 sgrna整合)
[0173]
seq id no:38:
[0174]
aavs1同源供体(粗体为左同源臂,斜体为右同源臂,大写字母为转基因盒,下划线为sv40启动子,粗体和下划线为mkate2,粗体和斜体为聚腺苷酸化信号)。
[0175]
seq id no:39(med20 sgrna):gggcgtgtctcggcacccct
[0176]
seq idno:40(ftsj3 sgrna):gaattccgggtcaatgggcg
[0177]
seq idno:41(aavs1 sgrna):gtccctagtggccccactgtg
[0178]
发明详述
[0179]
除非另有说明或定义,否则本文使用的所有术语都具有其在本领域中的通常含义,这对于本领域技术人员来说是清楚的。例如参考标准手册,例如sambrook等人"molecular cloning:a laboratory manual"(第2版),1-3卷,cold spring harbor laboratory press(1989);lewin,"genes iv",oxford university press,new york,(1990),和janeway等人"immunobiology"(第5版,或更最近的版本),garland science,new york,2001。
[0180]
权利要求的主题具体涉及人造产品或使用或生产此类人造产品的方法,其可以是天然(野生型)产品的变体。尽管与天然结构可能存在一定程度的序列同一性,但众所周知,
本发明的材料、方法和用途,例如,具体指分离的核酸序列、氨基酸序列、融合构建体、表达构建体、转化的宿主细胞和修饰的蛋白质是“人造的”或合成的,因此不被视为“自然法则”的结果。
[0181]
在整个说明书中使用的特定术语具有以下含义。
[0182]
如本文所用,术语“宿主细胞”被理解为对用包含一种或多种编码本文所述表达产物的多核苷酸的核酸构建体或表达载体进行转化、转染、转导等敏感的任何细胞类型,或对其他引入本文所述的crispr复合物的任何或每个组分敏感的细胞类型。术语“宿主细胞”包括由于例如通过本文描述的方法进行的修饰或在复制期间发生的修饰而与亲代细胞不同的亲代细胞的任何后代,并且应特别指单个细胞、单个细胞克隆、细胞群体,例如包含多克隆细胞的群体,或宿主细胞的细胞系。
[0183]
如本文所用,术语“细胞系”是指已建立的特定细胞类型的克隆,其已获得在延长的时间段内增殖的能力。细胞系通常用于表达内源或重组基因或代谢途径的产物以产生多肽或由此类多肽介导的细胞代谢物。“生产宿主细胞系”或“生产细胞系”,例如本文用于生产poi的,通常理解为准备用于在生物反应器中进行细胞培养以获得生产过程的产物的细胞系。可以使用本文所述的宿主细胞和相应的细胞系,通过在合适的培养基中培养,从培养物中分离表达的产物或代谢物,并任选地通过合适的方法对其进行纯化来产生重组poi。
[0184]
如本文所用,术语“表达”是指多核苷酸从dna模板转录(例如进入和mrna或其他rna转录物)的过程和/或转录的mrna随后翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以统称为基因表达的产物(“基因产物”),例如通过表达goi产生的。如果多核苷酸来源于基因组dna,表达可以包括真核细胞中mrna的剪接。
[0185]
如本文所用,术语“表达盒”是指包含所需编码序列和有效连接的调节或控制序列的核苷酸序列或相应多核苷酸或核酸分子,使得用这些序列转化或转染的宿主能够产生编码的蛋白质或宿主细胞代谢物。示例性表达控制序列可以包括启动子、核糖体结合位点、转录或翻译起始序列和终止序列,或增强子序列或激活子序列中的任何项。
[0186]
表达盒可以包含至少一个内含子。通常,内含子位于开放阅读框的5'末端,但也可以位于3'末端。所述内含子可以位于启动子和或启动子/增强子元件(一种或多种)与编码待表达的目的产物的多核苷酸的开放阅读框的5'末端之间。可以与本公开结合使用的几种合适的内含子在现有技术中是已知的。
[0187]
为了实现转化,表达系统可以包含在表达构建体中,例如,以“载体”的形式,或整合在宿主细胞染色体中的表达盒。表达盒通常是克隆的重组核苷酸序列的转录即重组基因的转录和其mrna在合适的宿主生物体中的翻译所需的dna序列。表达载体通常包含一种或多种宿主细胞中自主复制的起点或基因组整合的基因座、可选择的标记(例如,氨基酸合成基因或赋予对抗生素如博来霉素、卡那霉素、g418或潮霉素、诺尔丝菌素的抗性的基因、许多限制性内切酶切割位点和调节序列,例如任何一种或多种合适的启动子序列、操纵子、增强子、核糖体结合位点,和控制转录和翻译起始和终止的序列。调节序列通常与待表达的dna序列有效连接。
[0188]“载体”在本文中理解为能够将核酸序列转移至靶细胞(例如,病毒载体、非病毒载体、微粒载体和脂质体)。通常,载体理解为“表达载体”或“基因转移载体”,其是能够指导目的核酸表达并且可以将核酸序列转移至靶细胞的任何核酸构建体。因此,该术语包括克隆
和表达载体,以及病毒载体。
[0189]
特定的载体包括自主复制的核苷酸序列(例如质粒)以及基因组整合的核苷酸序列,例如人工染色体,例如酵母人工染色体(yac)。表达载体可以包括但不限于克隆载体、修饰的克隆载体和专门设计的质粒。本文所述的优选表达载体是适合于在真核宿主细胞中表达重组基因的表达载体,并且根据宿主生物体进行选择。
[0190]
相关的dna可以整合到宿主细胞染色体中。宿主细胞的表达可以指分泌的或非分泌的表达产物,包括多肽或代谢物。为了允许重组核苷酸序列在宿主细胞中表达,本文所述的表达盒或载体通常包含有效地连接到goi的启动子,分别为例如与编码序列的5'末端相邻的启动子核苷酸序列,或在目的基因(goi)的上游和附近的启动子核苷酸序列,或者如果使用信号或前导序列,则在所述信号和前导序列的上游和附近的启动子核苷酸序列,以促进goi的表达。启动子序列通常调节和启动与其有效连接的下游核苷酸序列尤其包括goi的转录。
[0191]
具体地,启动子是异源启动子,特别是与宿主细胞异源的和/或不与goi天然结合的启动子。
[0192]
在具体实施方案中,可以使用多克隆载体,其是具有多克隆位点的载体。具体地,可以在多克隆位点整合或掺入所需的异源基因以制备表达载体。在多克隆载体的情况下,启动子通常位于多克隆位点的上游。
[0193]
具体地,crispr系统的优选实施方案采用包含一种或多种载体的递送系统,任选地其中所述载体包含一种或多种病毒载体。具体地,可以使用一种或多种病毒载体,其选自由以下组成的组:慢病毒、逆转录病毒、腺病毒、腺相关病毒或单纯疱疹病毒、慢病毒载体、腺病毒载体或腺相关病毒(aav)载体。具体实例选自由基于hiv的慢病毒组成的组。慢病毒载体可具有某些安全特征,例如,它们可依赖于多个包装质粒,或者它们可具有截短的长末端重复序列。所有这些特征都被认为降低了获得具有复制能力的病毒的机会,即通常这些病毒只能经历一个感染周期。
[0194]
在一些替代实施方案中,crispr系统的元件通过脂质体、颗粒、细胞穿透肽、外泌体、微泡或基因枪或通过靶细胞的电穿孔递送。
[0195]
通过测量所述至少一种基因的mrna或蛋白质水平,特别是靶基因的表达产物的水平,可以定量或定性地确定表达水平。具体地,可以通过测量宿主细胞的转录组或通过流式细胞术评估细胞表面的蛋白质水平来确定表达水平。
[0196]
在某些实施方案中,使用选自由定量rt-pcr(qpcr)、rna测序、与微阵列的杂交和分子标记组成的组的方法确定表达水平。
[0197]“基因表达”具体指将包含在基因中的信息转化为基因产物。基因表达意指包括选自由以下组成的组的至少一个步骤:dna转录成mrna、mrna加工、mrna成熟、mrna输出、翻译、蛋白质折叠和/或蛋白质转运。
[0198]
如本文所用,术语“基因”,例如,如在术语“目的基因”或“goi”中使用的,包括编码基因产物的dna区域,以及任选的一个或多个(或所有)调节基因产物产生的dna区域,无论这种调节序列是否与编码和/或转录序列相邻。因此,基因可以理解为包括启动子序列、终止子、翻译调控序列如核糖体结合位点和内部核糖体进入位点、增强子、沉默子、绝缘子、边界元件、复制起点、基质附着位点和基因座控制区。
[0199]
根据进一步的具体实例,本发明的上下文使用的goi是cdna,和/或编码生物产物、配体(例如抗体)或受体,例如嵌合抗原受体(car)或t细胞受体。
[0200]
合适的car可以包括抗原结合部分或结构域(作为细胞外结合部分)、跨膜结构域和细胞内信号结构域,并且任选地还包括在各种结构域之间的一个或多个接头序列。
[0201]
具体地,car包括与目的靶抗原例如靶细胞表面上的特定抗原结合的抗原结合部分。例如,可以包含在car中的抗原结合部分可以包括抗体、受体(例如,可变t细胞受体或淋巴细胞受体)、受体片段(例如,fc受体片段)、配体、细胞因子、darpin、adnectin、纳米抗体和肽。
[0202]
包含在抗原结合部分中的抗体优选能够特异性识别临床相关的抗原并且可以选自由全长抗体组成的组和包含至少一个抗体可变结构域或抗原结合位点的抗体片段(优选单链可变片段,scfv)。
[0203]
跨膜结构域特异性融合细胞外结合部分和细胞内信号结构域,并将car锚定到细胞的质膜上。各种合适的跨膜结构域是本领域已知的。
[0204]
根据一个具体方面,使用car的至少一个细胞内信号结构域。
[0205]
car的细胞内信号结构域具体是car的一部分,它参与将来自与靶细胞结合的car的信号转导到免疫效应细胞内部以引发效应细胞功能,例如激活、细胞因子产生、增殖和/或细胞毒活性,包括向结合car的靶细胞释放细胞毒性因子,或通过靶点与细胞外car结构域结合而引发的其他细胞反应。
[0206]
car的细胞内信号结构域负责激活已放置car的免疫细胞的至少一种正常效应功能。例如,t细胞的效应功能可以是溶细胞活性或包括细胞因子的分泌的辅助活性。具体地,术语“细胞内信号结构域”是指转导效应子功能信号并指导细胞执行特定功能的蛋白质的部分。
[0207]
虽然通常可以使用整个细胞内信号结构域,但在许多情况下不需要使用整个链。就使用细胞内信号结构域的截短部分而言,该截短部分可用于代替完整链,只要它转导效应子功能信号即可。因此,术语细胞内信号结构域意指包括足以转导效应子功能信号的细胞内信号结构域的任何截短部分。
[0208]
用于car的细胞内信号结构域的优选实例包括t细胞受体(tcr)的细胞质序列和协同作用以在抗原受体接合后启动信号转导的共受体,以及这些序列的任何衍生物或变体以及任何具有相同功能的合成序列。
[0209]
t细胞激活可由两类不同的细胞质信号序列介导:通过tcr(初级细胞质信号序列)启动抗原依赖性初级激活的那些,以及以抗原非依赖性方式发挥作用以提供次级或共刺激信号的那些(次级细胞质信号序列)。
[0210]
初级细胞质信号序列以刺激方式或抑制方式调节tcr复合物的初级激活。以刺激方式起作用的初级细胞质信号序列可包含信号基序,其称为基于免疫受体酪氨酸的激活基序或itam。
[0211]
在本文公开的car中特别使用的含有初级细胞质信号序列的itam的实例包括源自tcrζ(cd3ζ)、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的那些。itam的具体非限制性实例包括具有以下序列的肽:cd3.ζ的氨基酸编号51至164的序列(ncbi refseq:np.sub.
‑‑
932170.1)、fc.ε.ri.γ的氨基酸编号45至86的序列(ncbi refseq:
np.sub.
‑‑
004097.1)、fc.ε.ri.β的氨基酸编号201至244的序列(ncbi refseq:np.sub.
‑‑
000130.1)、cd3.γ的氨基酸编号139至182的序列(ncbi refseq:np.sub.
‑‑
000064.1)、cd3.δ的氨基酸编号128至171的序列(ncbi refseq:np.sub.
‑‑
000723.1)、cd3.ε的氨基酸编号153至207的序列(ncbi refseq:np.sub.
‑‑
000724.1)、cd5的氨基酸编号402至495的序列(ncbi refseq:np.sub.
‑‑
055022.2)、0022的氨基酸编号707至847的序列(ncbi refseq:np.sub.
‑‑
001762.2)、cd79a的氨基酸编号166至226的序列(ncbi refseq:np.sub.
‑‑
001774.1)、cd79b的氨基酸编号182至229的序列(ncbi refseq:np.sub.
‑‑
000617.1)和cd66d的氨基酸编号177至252的序列(ncbi refseq:np.
‑‑
001806.2),以及与这些肽具有相同功能的变体。本文所述的基于ncbi refseq id或genbank的氨基酸序列信息的氨基酸编号基于每种蛋白质的前体(包含信号肽序列等)的全长编号。
[0212]
在一个实施方案中,car中的细胞质信号分子包含源自cd3ζ的细胞质信号序列。
[0213]
在一个具体的实施方案中,car的细胞内结构域可以设计为包含cd3-ζ信号结构域本身或与在car背景下有用的任何其他所需细胞质结构域(一个或多个)组合。例如,car的细胞内结构域可以包含cd3ζ链部分和共刺激信号区。共刺激信号区是指包含共刺激分子的细胞内结构域的car的部分。共刺激分子是淋巴细胞对抗原的有效反应所需的抗原受体或其配体以外的细胞表面分子。此类共刺激分子的实例包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性结合的配体等。
[0214]
此类共刺激分子的具体非限制性实例包括具有以下序列的肽:cd2的氨基酸编号236至351的序列(ncbi refseq:np.
‑‑
001758.2)、cd4的氨基酸编号421至458的序列(ncbi refseq:np.
‑‑
000607.1)、cd5的氨基酸编号402至495的序列(ncbi refseq:np.sub.
‑‑
055022.2)、cd8.α的氨基酸编号207至235的序列(ncbi refseq:np.sub.
‑‑
001759.3)、cd83的氨基酸编号196至210的序列(genbank:aaa35664.1)、cd28的氨基酸编号181至220的序列(ncbi refseq:np.sub.
‑‑
006130.1)、cd137的氨基酸编号214至255的序列(4-1bb,ncbi refseq:np.
‑‑
001552.2)、cd134的氨基酸编号241至277的序列(ox40,ncbi refseq:np.
‑‑
003318.1)和icos的氨基酸编号166至199的序列(ncbi refseq:np.
‑‑
036224.1),以及与这些肽具有相同功能的变体。因此,虽然本文的公开主要以4-1bb作为共刺激信号元件来举例说明,但其他共刺激元件也在本公开的范围内。
[0215]
car的细胞质信号部分内的细胞质信号序列可以以随机或指定的顺序相互连接。任选地,优选长度为2至10个氨基酸的短的寡核苷酸或多肽接头可以形成连接。甘氨酸-丝氨酸双联体提供了特别合适的接头。
[0216]
在一个具体实施方案中,将细胞内结构域设计成包含cd3-ζ的信号结构域和cd28的信号结构域。在另一个实施方案中,将细胞内结构域设计成包含cd3-ζ的信号结构域和4-1bb的信号结构域。在还另一个实施方案中,将细胞内结构域设计成包含cd3-ζ的信号结构域和cd28和4-1bb的信号结构域。
[0217]
具体的优选实施方案包括以下任何一种或多种:
[0218]
a)细胞内信号结构域包含cd3ζ细胞内结构域,
[0219]
b)细胞内信号结构域包含共刺激结构域、初级信号结构域或其任何组合,
[0220]
c)细胞内信号结构域包含共刺激结构域,该共刺激结构域包含选自由以下组成的
组的蛋白质的功能性信号结构域:ox40、cd70、cd27、cd28、cd5、icam-1、lfa-1(cd11a/cd18)、icos(cd278)、dap10、dap12和4-1bb(cd137)。
[0221]
根据一个具体方面,car特异性识别并结合靶细胞表面上的分子。根据具体实例,靶细胞为肿瘤或癌细胞,car特异性识别肿瘤相关抗原(taa),优选cd19、cd20、cd22、b7-h3(cd276)、cd133、gd2、egfrviii、bmsa、msln、cea和her2中的任何一种。
[0222]
根据进一步的具体实例,如在本发明的上下文使用的goi选自由以下组成的组:dna疫苗或治疗性dna分子,例如,
[0223]
a)在患有由所述功能基因的功能失调形式引起的遗传病症的受试者中表达功能基因(例如,杜氏肌营养不良症、囊性纤维化、戈谢病和腺苷脱氨酶(ada)缺乏症、炎性疾病、自身免疫性疾病、慢性和感染性疾病、艾滋病、癌症、神经系统疾病、心血管疾病、高胆固醇血症、各种血液病症(包括各种贫血、地中海贫血和血友病、肺气肿)和实体瘤);
[0224]
b)编码毒性肽(即化学治疗剂如蓖麻毒素、白喉毒素和眼镜蛇毒因子)、抑癌基因(如p53)、编码与转化癌基因反义的mrna序列的基因、抗肿瘤肽如肿瘤坏死因子(tnf)和其他细胞因子,或转化癌基因的跨显性阴性突变体;
[0225]
c)编码活性rna形式(例如,小干扰rna(sirna、mirna、shrna)或小激活rna(sarna);或,
[0226]
d)编码crispr/cas成分(例如cas9酶或sgrna)。
[0227]
e)根据进一步的具体实例,如在本发明的上下文使用的goi在例如细胞培养物中表达目的蛋白质(poi)的治疗性dna分子。
[0228]
具体地,poi与宿主细胞物种是异源的。
[0229]
具体地,poi是分泌的肽、多肽或蛋白质,即从宿主细胞分泌到细胞培养上清液中。
[0230]
具体地,poi是真核蛋白质,优选哺乳动物来源的或相关蛋白质,例如人蛋白质或包含人蛋白质序列的蛋白质,或细菌蛋白质或细菌来源的蛋白质
[0231]
优选地,poi是在哺乳动物中起作用的治疗性蛋白质。
[0232]
在特定情况下,poi是多聚体蛋白,特别是二聚体或四聚体。
[0233]
根据一个具体方面,poi是选自由以下组成的组的肽或蛋白质:抗原结合蛋白、治疗性蛋白、酶、肽、蛋白抗生素、毒素融合蛋白、碳水化合物-蛋白缀合物、结构蛋白、调节蛋白、一种或多种转录因子、疫苗抗原、生长因子、激素、细胞因子、过程酶和代谢酶。
[0234]
具体地,抗原结合蛋白选自由以下组成的组:
[0235]
a)抗体或抗体片段,例如嵌合抗体、人源化抗体、双特异性抗体、fab、fd、scfv、双抗体、三抗体、fv四聚体、微型抗体、单域抗体如vh、vhh、ignar或v-nar中的任何项;
[0236]
b)抗体模拟物,例如adnectins、affibodies、affilins、affimers、affitins、alphabodies、anticalins、avimers、darpins、fynomers、kunitz域肽、单体或nanoclamps;或
[0237]
c)包含一个或多个免疫球蛋白折叠结构域、抗体结构域或抗体模拟物的融合蛋白。
[0238]
特异性poi是抗原结合分子,例如抗体或其片段,特别是包含抗原结合结构域的抗体片段。在特定的poi中是抗体,例如单克隆抗体(mab)、免疫球蛋白(ig)或g类免疫球蛋白(igg)、重链抗体(hcab)或其片段如片段-抗原结合(fab)、fd、单链可变片段(scfv)或其工
程化变体如fv二聚体(双体)、fv三聚体(三体)、fv四聚体或微型抗体和单域抗体如vh、vhh、ignar或v-nar,或任何包含免疫球蛋白折叠结构域的蛋白质。其他抗原结合分子可选自抗体模拟物或(替代)支架蛋白,例如工程化的kunitz结构域、adnectin、affibodies、affiline、anticalins或darpins。
[0239]
如本文所用,术语“内源性”意指包括存在于天然存在的野生型(天然)宿主细胞中的那些分子和序列,特别是内源性基因或蛋白质。特别地,在自然界中发现的特定宿主细胞中确实存在(并且可以从其获得)的内源性核酸分子(例如基因)或蛋白质被理解为“宿主细胞内源性的”或“对宿主细胞内源性的”。此外,“内源性表达”核酸或蛋白质的细胞表达该核酸或蛋白质,就像在自然界中发现的具有相同特定类型的宿主表达该核酸或蛋白质一样。此外,“内源性产生”或“内源性产生”核酸、蛋白质或其他化合物的宿主细胞产生该核酸、蛋白质或化合物,就像在自然界中发现的具有相同特定类型的宿主细胞表达该核酸、蛋白质或化合物一样。
[0240]
如本文所用的关于核苷酸序列、构建体如goi、启动子、表达盒、氨基酸序列或蛋白质的术语“异源的”是指对于给定宿主细胞而言是外来的化合物,即“外生的”,如不天然存在于所述宿主细胞中;或在给定宿主细胞中天然存在的,例如,是“内生的”,然而,在异源构建体或整合在这种异源构建体中的背景下,例如,使用融合或结合内源核酸的异源核酸,从而使构建体为异源性。内源性发现的异源核苷酸序列也可以在细胞中以非天然的量产生,例如大于预期或大于天然发现的量。异源核苷酸序列或包含异源核苷酸序列的核酸可能在序列上与内源核苷酸序列不同,但编码与内源发现的相同的蛋白质。具体地,异源核苷酸序列是在自然界中与宿主细胞不具有相同关系的那些。任何重组或人工核苷酸序列均应理解为异源的。如本文所述,异源多核苷酸的实例是非天然与启动子相关的核苷酸序列,例如以获得杂合启动子,或有效地连接至编码序列的核苷酸序列。结果,可以获得杂合或嵌合多核苷酸。异源化合物的进一步的实例是编码与转录控制元件例如启动子有效地连接的多核苷酸的poi,其中内源的、天然存在的poi编码序列通常不能有效地连接到该转录控制元件上。
[0241]
如本文所用,术语“分离的”或“分离”应指已与其自然相关的环境充分分离,从而以“纯化的”或“基本上纯的”形式存在的此类化合物。术语“分离的”可以指在不同程度上不含、基本上不含或实质上不含在其天然状态下通常伴随它的组分的材料。“分离”也表示与原始来源或环境的分离程度。然而,“分离”并不一定意味着排除与其他化合物或材料的人工或合成混合物,或不干扰基本活性的杂质的存在,并且例如由于不完全纯化,可以是存在的。分离的化合物可以进一步配制以生产其制剂,并且仍然为了实际目的被分离-例如,当用于诊断或治疗时,宿主细胞或poi可以与药学上可接受的载体或赋形剂混合。
[0242]
如本文所用,术语“分离的细胞”是指与天然伴随细胞的分子和/或细胞成分分离的细胞。
[0243]
如本文所用,术语“有效地连接”是指单个核酸分子例如载体或表达盒上的核苷酸序列以使得一个或多个核苷酸序列的功能受存在于所述核酸分子上的至少一个其他核苷酸序列影响的方式结合。通过有效连接,将核酸序列置于与同一核酸分子上的另一核酸序列的功能关系中。例如,当启动子能够影响该编码序列的表达时,该启动子与重组基因的编码序列有效地连接。作为进一步的实例,当编码信号肽的核酸能够以分泌形式表达蛋白质时,该编码信号肽的核酸有效地连接到goi或编码poi的核酸序列,例如成熟蛋白质的预成
型体或成熟的蛋白质。具体地,可立即连接此类有效地彼此连接的核酸,即在编码信号肽的核酸和编码poi的核酸序列之间没有其他元件或核酸序列。
[0244]
如本文所用,术语“重组体”是指“由基因工程制备或通过基因工程获得的结果。重组宿主可以被工程化以插入一个或多个核苷酸、多核苷酸或核苷酸序列,并且可以特别包含含有重组核酸序列的表达载体或克隆载体,特别是使用针对宿主为外来的核苷酸序列。可以通过使用基因工程,即通过人为干预,例如在某个染色体基因座处插入goi来产生重组宿主细胞。当宿主细胞被工程化以在安全港基因座处掺入goi以稳定表达goi时,操作宿主细胞,以使宿主细胞具有在长时间培养期间以一定水平表达此类基因的能力(例如,原位、体内、离体或体外),高于操作前相同条件下宿主细胞的表达水平,或与未针对goi表达进行工程化的宿主细胞相比。
[0245]
基因工程可通过基因组编辑技术、同源重组或其他定点重组技术,例如通过flp-frt重组、cre-lox重组或噬菌体λ位点特异性重组方便的进行。
[0246]
flp-frt重组应理解为一种定点重组技术,涉及通过源自面包酵母酿酒酵母的2μ质粒的重组酶翻转酶(flp)对短翻转酶识别靶(frt)位点之间的序列进行重组。
[0247]
cre-lox重组应理解为一种位点特异性重组酶技术。该系统由单个酶cre重组酶组成,它重组一对称为lox序列的短靶序列。
[0248]
噬菌体λ位点特异性重组利用噬菌体λint蛋白的拓扑异构酶活性,在识别序列处将单链断裂引入双链dna。
[0249]
如本文所用,关于细胞、goi或poi的术语“重组”包括通过重组方式制备、表达、产生或分离的目的细胞、分子或产物,例如如本文所述的工程化以表达goi的细胞,如本文所述的染色体整合到宿主细胞中的goi,或如本文所述由转化以表达poi的宿主细胞产生的poi。根据本发明,可以采用本领域技术范围内的常规分子生物学、微生物学和重组dna技术。此类技术在文献中有充分的解释。参见例如maniatis,fritsch和sambrook,"molecular cloning:a laboratory manual,cold spring harbor,(1982)。
[0250]
与亲本核苷酸或氨基酸序列相比的变体、同源物或直系同源物的术语“序列同一性”表示两个或多个序列的同一性程度。两个或更多个氨基酸序列在相应位置可以具有相同或保守的氨基酸残基,在一定程度上高达100%。两个或更多个核苷酸序列在相应位置可以具有相同或保守的碱基对,在一定程度上高达100%。
[0251]
序列相似性搜索是一种用于识别具有过多(例如,至少50%)序列同一性的同源物的有效且可靠的策略。经常使用的序列相似性搜索工具例如是blast、fasta和hmmer。
[0252]
序列相似性搜索可以通过检测过度相似性和反映共同祖先的统计显著相似性来识别此类同源蛋白质或基因。同源物可包括直系同源物,其在本文中被理解为不同生物体中的相同蛋白质,例如不同不同生物体或物种中此类蛋白质的变体。
[0253]
为了确定两个互补序列的百分比互补性,需要将两个序列中的一个转换为其互补序列,然后才能使用上述算法将百分比互补性计算为第一序列和第二转换序列之间的百分比同一性。
[0254]
关于本文所述的氨基酸序列、同源物和直系同源物的“百分比(%)氨基酸序列同一性”定义为候选序列中与特定多肽序列中的氨基酸残基相同的氨基酸残基的百分比,如果需要,在比对序列并引入空位后,以实现最大百分比序列同一性,并且不考虑将任何保守
取代作为序列同一性的一部分。本领域技术人员可以确定用于测量比对的适当参数,包括在进行比较的序列的全长上实现最大比对所需的任何算法。
[0255]
出于本文所述的目的,两个氨基酸序列之间的序列同一性使用具有以下示例性参数的ncbi blast程序版本blastp 2.8.1确定:程序:blastp,字长:6,期望值:10,hitlist大小:100,空位罚分:11.1,矩阵:blosum62,过滤字符串:f,组成校正:条件式组成得分矩阵校正。
[0256]
关于核苷酸序列例如核酸分子或其部分,特别是编码dna序列的“百分比(%)同一性”定义为候选dna序列中与dna序列中的核苷酸相同的核苷酸的百分比,如果需要,在比对序列并引入空位后,以实现最大百分比序列同一性,并且不考虑将任何保守取代作为序列同一性的一部分。用于确定百分比核苷酸序列同一性目的的比对可以以本领域技术范围内的各种方式例如使用可公开获得的计算机软件来实现。本领域技术人员可以确定用于测量比对的适当参数,包括在进行比较的序列的全长上实现最大比对所需的任何算法。
[0257]
可以使用比对序列的任何合适的算法来确定最佳比对,其非限制性示例包括smith-waterman算法、needleman-wunsch算法、基于burrows-wheeler变换的算法(例如burrows wheeler aligner)、clustalw、clustal x、blat、novoalign(novocraft technologies;可在novocraft.com获得)、eland(illumina,san diego,ca)、soap(可在soap.genomies.org.cn获得)和maq(可在maq.sourceforge.net获得)。
[0258]
如本文所用,在表达、表达体(expressers)或表达构建体的背景下使用的术语“稳定的”意指宿主细胞能够在延长的时间段内正确表达goi。稳定的表达体具体理解为是指保持遗传特性的宿主细胞,具体地,即使在约20代,优选至少30代,更优选至少40代,最优选的至少50代之后,仍将goi表达保持在高水平和/或约恒定水平。具体实施方案是指在至少5、或10、或20、或30、或40、或50次倍增或传代期间的稳定表达。
[0259]
根据一个具体方面,提供了宿主细胞群,其中所述细胞包含稳定整合到其染色体中的异源goi,其中平均至少20%、至少30%、至少40%、至少50%、至少60%的源自所述群的细胞在至少4周、优选8周、优选10周、更优选12周的时间段内损失不超过70%、优选不超过50%的其基因产物表达效价。可以离体(在细胞培养中)或体内(移植后)监测表达。如实施例中所示,在转染和鉴定稳定转染的细胞后,当使用本文所述的细胞时,在长时间培养期间不表现出生产力逐渐丧失的细胞数量增加,即从自选定的细胞群中获得更稳定的细胞克隆。可以通过将来自所述群的独立细胞培养为细胞克隆并确定指定时间段内的效价来测试稳定性特性。可以通过多种方法确定宿主细胞的goi表达,例如通过elisa、通过蛋白质印迹、通过放射免疫测定、通过免疫沉淀、通过测定基因产物的生物活性或通过免疫染色然后进行facs分析。在一个具体方面,goi的表达由蛋白质印迹确定。
[0260]
稳定性可以通过不存在基因沉默来测试,例如实施例3中所述。还可以通过本领域已知的方法通过长时间培养细胞并在体外或体内监测转基因表达水平来测试稳定性。由于可在体内发生转基因插入,因此可以例如通过采集患者样本(例如,来自相关组织的血液或活组织检查)在体内监测转基因表达。通常,如果在观察期间转基因表达大致相同(
±
50%或
±
40%或
±
30%或
±
20%或
±
10%),则认为表达是稳定的。
[0261]
根据表达的基因产物,稳定性率可能因项目而异。然而,在成功转导的宿主细胞群中,具有稳定表达特征的细胞丰度可以显著增加。因此,可以显著降低在长期培养期间逐渐
丧失生产力的不稳定克隆被选择用于治疗或任何其他工业应用的风险。
[0262]
具体地,提供了一种稳定的重组宿主细胞系,当用于工业规模生产时,这被认为具有很大的优势。
[0263]
稳定的表达可以通过转导来实现,例如,通过基因组编辑或本领域已知的用于靶向转基因插入的其他方法,从而将表达构建体整合到宿主细胞的基因组中,其中靶向插入在预定的染色体区域内,该区域被认为是“安全港”,例如本文进一步描述的基因间区域内。稳定转导优于瞬时转导,以产生高表达宿主细胞或克隆,用于在体内或在体外(例如工业规模)表达goi和产生基因产物或poi。稳定表达体群包括相对高比例的高产和稳定生产的克隆。当将goi掺入安全港基因座例如本文所述的基因间区域内时,稳定性特别提高,从而减少或避免转录基因沉默。
[0264]
在本发明的背景下,如本文所述,异源goi的稳定表达是通过允许将相应的表达构建体插入到两个相邻必需基因之间的基因间区域中来实现的。这样的基因间区域被理解为热点区域,这意味着它支持引入基因的高转录,并且这种转录随着时间的推移是稳定的并且对于不同的基因和不同的培养条件是可重复的。
[0265]
术语“必需基因”在本文中应理解为包括宿主细胞中编码必需多肽的那些基因,并且优选地是在宿主细胞中尚未显示是非必需的基因。在一个实施方案中,必需基因是这样一种基因,其缺陷导致宿主细胞在某些培养条件下由于必需多肽在宿主细胞中的表达较低或不表达而无法存活。必需多肽可以是能够产生对于细胞活力来说必不可少的营养物的多肽(例如,其中必需多肽是能够产生对于细胞活力来说必不可少的营养物的酶)或参与产生对于细胞活力来说必不可少的营养物的多肽(例如,其中必需多肽是参与代谢途径的酶,该代谢途径引起对于细胞活力来说必不可少的营养物的产生)。然而,编码必需多肽的必需基因可以是其缺陷导致宿主细胞在所有条件和任何类型的营养培养基中都不能存活的基因。必需多肽可以是其在宿主细胞中的低表达或不表达使得宿主细胞在所有条件下和在任何营养培养基例如基本培养基或复合培养基中都不能存活的多肽。优选地,编码必需多肽的必需基因是编码真核生物必需的多肽的真核生物必需的基因。必需基因类别的合适实例包括但不限于参与dna合成和修饰、rna合成和修饰、蛋白质合成和修饰、蛋白酶体功能、分泌途径、细胞壁生物发生和细胞分裂的基因。众所周知,许多编码参与初级代谢和代谢途径的化合物的基因可以是必需基因,其缺陷会导致宿主细胞无法存活。
[0266]
术语“通配符宿主细胞”是指宿主细胞,其通过基因工程制备以包含人工或异源核苷酸序列,例如本文所述用于定点插入goi,并且准备以掺入goi。通配符细胞也被理解为“空”宿主细胞(即没有转基因的重组宿主细胞),例如可用作重组生产技术的克隆细胞系。相应的细胞可以用异源goi例如使用适当的表达载体转染。
[0267]
因此,通配符细胞系是一种重组宿主细胞系,其特征在于其表达任何所需goi的能力。这遵循了用于产生生产细胞系的创新“通配符”策略,例如,使用位点特异性重组酶介导的盒交换或同源重组。这种新的宿主细胞有助于例如在几天内将goi克隆到预定的基因组表达热点中,以获得可重复的、高效的生产细胞系。
[0268]
因此,本发明提供了一种通过选择基因组中不能被沉默的安全港基因座来克服转基因沉默的新解决方案。沉默是一种通过在dna或组蛋白上建立抑制标记(例如,组蛋白h3在赖氨酸9或27上的三甲基化)来实现的现象。本文描述的是靶向区域,各自被两个必需基
因包围。优选地,这两个必需基因的定向使得它们的启动子紧邻安全港位点并且朝向相反的方向。并且优选地,两个启动子彼此非常接近,从而确保转基因的沉默,如果它发生的话,将沉默邻近的必需基因。因此,转基因的沉默将导致细胞死亡,从而实现一种机制,通过该机制人们可以选择不发生转基因沉默的细胞类型和细胞状态。
[0269]
必需基因优选地在跨多种细胞类型中是高度必需的,因此属于“核心必需基因组”,属于“核心必需基因的组”,涉及基因(i)是高度必需的,因此是绝对必需的,以及(ii)在更高等生物体例如人体中的每个细胞中都是必需的,以使该策略普遍适用。合适的必需基因对理想地彼此靠近(优选地与它们的启动子区域),以便允许在它们之间引入转基因。特别提供了约20个合适基因座的示例性选择,其侧翼是两个高度必需的基因。
[0270]
可以通过多种方式将转基因插入所描述的安全港基因座中。其中包括使用锌指核酸酶,其中一系列锌指蛋白介导与特定基因组序列的结合,而foki核酸酶在锌指结合位点附近触发dna双链断裂。或者,由一系列源自植物的转录激活因子样效应物和foki核酸酶组成的转录激活因子样效应物核酸酶(talen)同样适合。此外,可以使用dna或rna引导的核酸酶。其中包括流行的crispr酶cas9、cas12a/cpf1或cas12b、casx,但也包括更复杂的crispr系统如cascade复合体。它还可包括已用于靶向dna双链断裂诱导的细菌argonautes。转基因也可以通过可编程内切核酸酶与源自aav的dna供体的组合来传递,这通常被选择用于提高同源重组率。
[0271]
当创建表达高水平基因产物如抗体或细胞因子用作生产细胞系的人或其他(例如,cho)细胞系时,来自安全港基因座的转基因表达特别重要。
[0272]
它也可用于基因和细胞治疗。例如,它可用于以靶向方式将嵌合抗原受体(car)引入t细胞,以确保car在t细胞扩增或再灌注期间稳定表达并且不会沉默。同样,它可以应用于t细胞受体(tcr)治疗,其中内源性tcr被外源性tcr代替,以重新编程t细胞的特异性并对其进行工程化以识别新的靶细胞(例如,肿瘤细胞)。
[0273]
此处描述的方法还可用于设计稳定的诱导多能干(ips)细胞系,这些细胞系将转基因表达到高水平,并且转基因表达不受ips细胞分化的影响。后者仍然是干细胞生物学中的一个重要问题。
[0274]
可以通过多种方式在mrna或蛋白质水平监测转基因表达。mrna水平可以通过定量rt-pcr或rna测序来量化。蛋白质水平可以通过蛋白质印迹或elisa确定。在单细胞水平,蛋白质表达可以通过流式细胞术确定。这不仅报告了单个细胞中的蛋白质水平,还报告了群体中表达转基因的细胞比例。当转基因表达良好时,可以通过流式细胞术在单个细胞中监测其表达,从而报告总群体中表达转基因的部分。在dna水平上,可以通过数字微滴pcr评估含有转基因的细胞比例。或者,可以将单个细胞分选到96孔板的各个孔中,并通过基于pcr的方法确定转基因阳性细胞的比例。
[0275]
基因沉默问题可以通过两种方式解决:
[0276]
可以利用人ips细胞,并使用crispr/cas9将表达盒引入候选安全港基因座。表达盒包含驱动egfp或mcherry的强启动子(例如ef1a),从而确保转基因得到强烈表达。一旦分离出已通过pcr验证转基因整合的稳定克隆,ips细胞就会分化成不同的谱系(例如神经元或心肌细胞)。在整个分化过程中,转基因表达由facs监测,以确保稳定保持表达并且不受沉默的影响。
[0277]
人细胞系(例如,hek293、jurkat、u937、hela或人ips细胞)用于使用crispr/cas9将表达盒引入候选安全港基因座。表达盒包含由启动子(例如sffv、cmv或ef1a)驱动的egfp,其侧翼是四环素抗性(teto)序列。在没有tetr-krab的情况下,egfp在受体细胞中强烈表达,并且可以通过facs分选获得稳定的群体或克隆细胞系。tetr-krab的引入导致egfp的沉默。然而,沉默将扩散到控制两个必需基因的相邻启动子,这导致发生有效沉默的细胞死亡。因此,人们会预期所有失去egfp表达的细胞都会死亡。大部分egfp阴性细胞的存活表明,与这种预期相反,确实可以发生该基因座的沉默。
[0278]
参考以下实施例将更充分地理解前述描述。然而,这些实施例仅代表实施本发明的一个或多个实施方案的方法,不应被理解为限制本发明的范围。
实施例
[0279]
实施例1:crispr筛选以精细定位双重必需基因座
[0280]
两个必需基因之间的转基因插入可对受体细胞有害,因为它可以改变两个必需基因中至少一个的表达。因此,评估了哪些引导rna可以用于转基因插入而不损害细胞适合度。为了鉴定这些,将每个必需基因对的转录起始位点之间的整个区域与所有可能的引导rna平铺(图2),并在dropout筛选中评估它们的适合度表型。作为参考,包括靶向所讨论的必需基因的编码区的引导rna,从而证实这些基因确实是必需的。也包括阴性对照,即靶向非必需基因或基因间区域的引导rna。
[0281]
实施例2:靶向安全港基因座和通过实验解决“沉默性”[0282]
已经鉴定了两个人基因对,并评估了靶向各自基因间区域。这两个基因对是:med20/bysl和ftsj3/psmc5。
[0283]
第一对必需基因:第一基因是ftsj3(geneid:117246),第二基因是psmc5(geneid:5705),基因间区域:seq id no:8。
[0284]
第二对必需基因;第一基因是med20(geneid:9477),第二基因是bysl(geneid:705),基因间区域:seq id no:9。
[0285]
对于它们中的每一个,使用下列引导rna靶向两个必需基因之间的区域:
[0286]
med20引导rna 1(seq id no:22):
[0287]
gggcgugucucggcaccccuguuucagagcuaugcuggaaacagcauagcaaguugaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu
[0288]
med20引导rna 2(seq id no:23):
[0289]
gagcucccggguuccggagcguuucagagcuaugcuggaaacagcauagcaaguugaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu
[0290]
ftsj3引导rna 1(seq id no:24):
[0291]
ggggcggcuacucgaguucaguuucagagcuaugcuggaaacagcauagcaaguugaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu
[0292]
ftsj3引导rna 2(seq id no:25):
[0293]
gaauuccgggucaaugggcgguuucagagcuaugcuggaaacagcauagcaaguugaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuu
[0294]
通过同源性定向修复将表达盒(图3)引入每个特定基因座。该表达盒包含通过2a
肽与嘌呤霉素抗性连接的egfp,其表达由sffv启动子驱动。sffv启动子侧翼是如相应的供体序列中所指定的七个teto位点的阵列,图9:
[0295]
seq id no:26,》med20供体1(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0296]
seq id no:27:》med20供体2(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0297]
seq id no:28:》ftsj3供体1(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0298]
seq id no:29:》ftsj3供体2(粗体为teto位点,下划线为egfp,斜体为2a-puror)。
[0299]
用cas9表达质粒以及下列引导rna表达质粒和供体质粒的组合转导hek293细胞:
[0300]
med20引导rna 1与med20供体1
[0301]
med20引导rna 2与med20供体2
[0302]
ftsj3引导rna 1与ftsj3供体1
[0303]
ftsj3引导rna 2与ftsj3供体2
[0304]
在表达cas9和引导rna之后,通过同源定向修复在靶位点处掺入供体。可以选择带有转基因盒同源插入的细胞以使用嘌呤霉素,并通过随后的facs分选进行富集。最终,通过有限稀释获得带有转基因插入的克隆,并使用pcr进行基因分型。
[0305]
一旦获得稳定的细胞系(单克隆或多克隆),就用含有图8中seq id no:30所示的tetr-krab构建体的表达盒转染细胞。
[0306]
tetr-krab构建体在引入受体细胞后表达并结合teto位点阵列。tetr-krab的结合诱导sffv启动子的沉默,从而有效地沉默egfp转基因。然而,沉默扩散到控制两个必需基因(med20/bysl或ftsj3/psmc5)的相邻启动子。因此,发生egfp沉默的细胞死亡。
[0307]
通过流式细胞术测定存活细胞的gfp阳性。为了证明位于两个必需基因之间的新型安全港基因座是功能性的,没有存活的gfp阴性细胞,并且所有存活的细胞都保持gfp表达。
[0308]
实施例3:人ips细胞中转基因沉默的评估
[0309]
使用获自hipsci聚生体的人ips细胞系如bob-c或kolf2。将在组成型启动子(例如cmv、sffv、ef1as、ef1a)控制下的gfp报告基因引入目的安全港基因座。实施例2中提供了两种示例性的引导rna和供体载体的组合。与实施例2相反,供体载体不含任何teto位点。
[0310]
如实施例2中指定的通过crispr-cas9引入后,获得在所需基因座处含有转基因的稳定细胞群(多克隆或单克隆)。使用本领域已知的方案(volpato v等人stem cell reports.2018;11(4):897
–
911;mummery cl等人circ res.2012;111(3):344
–
358)将该群分化成各种谱系。在分化前和分化的各个阶段(早期、晚期、终末)评估转基因表达。根据靶细胞类型,分化需要15天至120天,并且使用本领域已知的合适标记物监测分化。为了证明没有沉默发生,在整个实验过程中稳定地检测(例如,通过流式细胞术)转基因表达。发生转基因沉默的克隆死于细胞死亡,因为沉默不可避免地扩散到至少一个相邻的必需基因(图1)。
[0311]
实施例4:crispr筛选
[0312]
必需基因是其破坏导致健康或生存力丧失的那些基因。在本实施例中,评估表1中指定的21个基因对中的哪些是必需的。此外,靶向两个各自必需基因之间的区域。如果在这些基因间区域中用crispr/cas9靶向是可行的,则人们将预期引导rna表现为中性,即,含有这些引导rna的细胞将不具有适合度表型。
[0313]
为了对上述十种基因对进行规模测试,设计了合适的定制sgrna文库。在该文库中,用大约10个独立的sgrna靶向每个必需基因。选择sgrna以靶向相应的基因的编码外显子。此外,用尽可能多的sgrna靶向每个基因间区域,即选择以g开始并在其序列附近含有ngg pam的每个sgrna。总之,我们的文库具有以下组成:
[0314]
表2
[0315][0316]
sgrna文库还靶向一组10个非必需基因,每个具有10个sgrna。
[0317]
如本领域已知那样克隆sgrna。简而言之,将包含1989个sgrna的合并的寡核苷酸文库克隆到受体sgrna表达载体中。使用lenti-x细胞(基于293t细胞)制备慢病毒,并以低感染复数感染携带cas9的rko细胞。2天后,通过流式细胞术对细胞进行质量控制,以回收10,2%gfp阳性的细胞群。通过嘌呤霉素选择富集含有sgrna的细胞(以0.5μg/ml浓度)。
[0318]
在第3天或第21天收获细胞,并分离基因组dna。使用以下引物对通过两轮pcr扩增sgrna盒:
[0319]
第1轮:
[0320]
pcr1_1_fw,seq id no:31:
[0321]
acacgacgctcttccgatctacataacggtgtggaaaggacgaaacaccg
[0322]
(第3天开始gdna的扩增)
[0323]
或
[0324]
pcr1_2_fw,seq id no:32:
[0325]
acacgacgctcttccgatcttagttacggtgtggaaaggacgaaacaccg
[0326]
(第21天gdna的扩增)
[0327]
pcr1_rev(new seq id no:49):
[0328]
ggtctaaccagagagagccag
[0329]
第2轮:
[0330]
pcr2_fw,seq id no:33:
[0331]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct
[0332]
pcr2_rev,seq id no:34:
[0333]
caagcagaagacggcatacgagatggtctaaccagagagagccag
[0334]
pcr产物进行下一代测序,通过计算倍数变化的对数(第21天/第3天;图4)定量每种sgrna的丰度。该图显示了携带靶向必需基因的sgrna的细胞的强烈耗尽(突出显示)。这表明cas9在本文测试的细胞中是有功能的,并且使用crispr/cas9有效地消除了标记为必需的基因。
[0335]
接下来,在每个基因/基因座的基础上计算合计的得分/倍数变化的对数。使用mageck软件(0.5.9.2版)基于单个sgrna计数计算每个基因/基因座的合计的倍数变化的对数。
[0336]
对所有基因/基因座的倍数变化作图(图5),注意到必需基因从文库中明显耗尽,而非必需基因随机分布在基因间基因座中。这表明本文选择的大多数基因间基因座耐受cas9的切割和随后的内源性nhej机器的修复。这也意味着本文选择的许多基因座至少容许小的插入或缺失,例如来自nhej的那些。重要的是,一个基因间区域不耐受crispr/cas9切割,并且值得注意的是,该区域seq id no:1属于其中两个必需基因的转录起始位点彼此非常接近(52bp)的基因对,为插入/缺失留下非常小的空间。相反,这表明所有其它基因座(seq id no:2至seq id no:21)可以耐受crispr/cas9切割。这是令人惊讶的,特别是因为该实验确定所有本文选择的基因在rko细胞中是明确必需的。
[0337]
实施例5:在两个选定基因座处的转基因插入
[0338]
为了评估在两个必需基因之间插入转基因的可行性,使用两个选定的基因座:第一个包含基因ftsj3和psmc5之间的基因间区域(seq id no:8),第二个包含基因med20和bysl之间的基因间区域(seq id no:9)。
[0339]
因为lenti-x 293t细胞(takara bio)容易转染,所以决定使用它们。简而言之,早上在6孔板的每孔中接种120万个lenti-x 293t细胞。在下午,用500ng含有荧光标记物(sv40-mkate2-pa;通过基因合成获得,侧翼为相应的同源臂,用于通过hdr整合到不同的安全港基因座(seq id no:35和seq id no:36)的质粒以及1500ng编码spcas9和靶向特定基因组区域的sgrna(seq id no:37)的质粒共转染细胞。我们包括靶向aavs1基因座(seq id no:38)的供体,其是常用的安全港基因座。将用于crispr/cas9介导的靶向的sgrna描述为seq id no:39、seq id no:40和seq id no:41(图9中提供的序列)。
[0340]
培养和扩增10天后,将mkate2阳性细胞在bd facsari iii系统上分选,并铺板于t25烧瓶中。培养并扩增细胞3周,然后根据制造商的说明书,用monarch基因组dna纯化试剂盒(#t3010;neb)在每种条件下提取500万个细胞的dna。使用phusion高保真dna聚合酶(#m0530;neb)用所示引物对进行基因分型pcr。
[0341]
进行pcr
[0342]
pcr名称引物正向引物反向扩增子大小(bp)aavs1-mkate2aavs1-基因组mkate2-插入物11539med20-mkate2med20-基因组1mkate2-插入物11422mkate2-med20mkate2-插入物2med20-基因组21481ftsj3-mkate2ftsj3-基因组1mkate2-插入物11310mkate2-ftsj3mkate2-插入物2ftsj3-基因组21276
[0343]
用于基因分型的引物
[0344]
》aavs1-基因组,seq id no:42:gtctggtctatctgcctggc
[0345]
》med20-基因组1,seq id no:43:aaacagacacaagcgggtct
[0346]
》med20-基因组2,seq id no:44:tcctgctgcaatcggagaag
[0347]
》ftsj3-基因组1,seq id no:45:gttacgaaccatccccctgg
[0348]
》ftsj3-基因组2,seq id no:46:acccttcctagctccctctg
[0349]
》mkate2-插入物1,seq id no:47:ggtagccaggatgtcgaagg
[0350]
》mkate2-插入物2,seq id no:48:ccggcgtctactatgtggac
[0351]
pcr反应
[0352]
组分量不含核酸酶的水20μl5x phusion hf缓冲液4μl10mm dntp0.4μl10μm正向引物1μl10μm反向引物1μl基因组dna50ngdmso0.6μl融合dna聚合酶0.2μl
[0353]
图6显示了工程化基因座的示意图以及用于基因分型的引物的位置。对于每个目的基因座(med20/bysl或ftsj3/psmc5),选择它来确认使用两个不同的引物对的靶标整合(on-target integration)。其中一种靶向插入转基因的5'末端,另一种靶向插入转基因的3'末端。
[0354]
图7显示了在上述基因分型反应中获得的pcr产物。所有pcr在跨所有细胞系中进行,从而确定了本文进行的pcr的特异性。pcr证实sv40-mkate2-pa转基因在本文测试的所有基因座处的插入,包括aavs1(作为参照点)、med20/bysl和ftsj3/psmc5。因此,它们建立了靶向本文所述的基因座的技术可行性。重要的是,转基因盒还含有活性基因调节元件,例如启动子和聚腺苷酸化信号,其插入不干扰相邻必需基因的表达。这表明,可以在本文指定的基因座插入类似的盒而不影响细胞适合度。
[0355]
最后,还在其中已通过crispr/cas9插入转基因的细胞中评估了转基因mkate2的表达(见上文)。为此,在bd lsr fortessa
tm
流式细胞仪上对10,000个细胞进行流式细胞术分析,其中藻红蛋白(pe)测量的默认设置用于评估mkate2表达(图8)。在已将转基因引入med20/bysl基因座的细胞中,在6.5%的细胞中检测到mkate2表达。在ftsj3和psmc5之间基
因间区域携带转基因的细胞中,甚至在18,5%的细胞中检测到mkate2。重要的是,这些数据在转导后第28天记录,排除了转基因表达从附加型质粒产生的可能性。
[0356]
总之,本实施例表明在本文挑取的两个基因座处的转基因插入是可行的,并且转基因可以随时间稳定表达,并且达到流式细胞术可检测的水平。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。