抗cd73抗体及其应用
技术领域
1.本发明属于生物医药领域,尤其涉及抗cd73抗体及其应用。
背景技术:
2.cd73(分化簇73)也称为胞外5
′‑
核苷酸酶,人体中其由nt5e基因编码。cd73是通过糖基磷脂酰肌醇固定于细胞表面的一种糖蛋白,其具有酶活性,可将amp转化为腺苷。cd73表达于多种细胞类型,如内皮细胞、淋巴细胞亚群、基质细胞和肿瘤细胞。
3.在肿瘤微环境中,cd73催化amp生成的腺苷能够结合t细胞表面的腺苷受体,并抑制t细胞的扩增及其免疫活性,从而形成免疫抑制微环境。在动物模型中,敲除cd73或靶向抑制cd73酶活性会显示出一定的抗肿瘤效果;同时,靶向抑制cd73能够显著提升如pd-l1/pd1、ctla4或4-1bb等单克隆抗体的抗肿瘤效果。靶向cd73抑制其酶活,解除腺苷介导的免疫抑制微环境,以达到抗肿瘤的效果。研究表明,某些抗cd73抗体结合b细胞后能够提高b细胞活性,有助于抗体的产生及免疫记忆的形成。
4.cd73是癌症治疗的潜在靶标。
技术实现要素:
5.本发明提供了抗cd73抗体或抗原结合片段,这些抗体或抗原结合片段可以特异性结合cd73,阻断cd73下游的免疫抑制信号通路,有助于免疫系统清除肿瘤细胞。
6.一些实施方案提供了抗体或抗原结合片段,所述抗体或抗原结合片段特异性结合cd73,并且包含以下中的一个或多个氨基酸序列:
7.(a)hcdr1,其包含如seq id no:1所示的氨基酸序列或与seq id no:1相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
8.(b)hcdr2,其包含如seq id no:2所示的氨基酸序列或与seq id no:2相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
9.(c)hcdr3,其包含如seq id no:3所示的氨基酸序列或与seq id no:3相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
10.(d)lcdr1,其包含如seq id no:4所示的氨基酸序列或与seq id no:4相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
11.(e)lcdr2,其包含如seq id no:5所示的氨基酸序列或与seq id no:5相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
12.(f)lcdr3,其包含如seq id no:6-9中任一项所示的氨基酸序列或与seq id no:6-9中任一项所示序列相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成。
13.在一些实施方案,所述抗体或抗原结合片段特异性结合cd73,并且包含:
14.(a)hcdr1,其包含如seq id no:1所示的氨基酸序列或与seq id no:1相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
15.(b)hcdr2,其包含如seq id no:2所示的氨基酸序列或与seq id no:2相比具有单
一位点取代、缺失或插入的氨基酸序列,或由其组成;和
16.(c)hcdr3,其包含如seq id no:3所示的氨基酸序列或与seq id no:3相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成。
17.在一些实施方案中,hcdr1包含seq id no:1所示的氨基酸序列或由其组成,hcdr2包含seq id no:2所示的氨基酸序列或由其组成,hcdr3包含seq id no:3所示的氨基酸序列或由其组成。
18.在一些实施方案中,所述抗体或抗原结合片段特异性结合cd73,并且包含:
19.(d)lcdr1,其包含如seq id no:4所示的氨基酸序列或与seq id no:4相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
20.(e)lcdr2,其包含如seq id no:5所示的氨基酸序列或与seq id no:5相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;和
21.(f)lcdr3,其包含如seq id no:6-9中任一项所示的氨基酸序列或与seq id no:6-9中任一项所示序列相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成。
22.在一些实施方案中,lcdr1包含seq id no:4所示的氨基酸序列或由其组成,lcdr2包含seq id no:5所示的氨基酸序列或由其组成,lcdr3包含seq id no:6-9中任一项所示的氨基酸序列或由其组成。在一些实施方案中,lcdr1包含seq id no:4所示的氨基酸序列或由其组成,lcdr2包含seq id no:5所示的氨基酸序列或由其组成,lcdr3包含seq id no:6所示的氨基酸序列或由其组成。在一些实施方案中,lcdr1包含seq id no:4所示的氨基酸序列或由其组成,lcdr2包含seq id no:5所示的氨基酸序列或由其组成,lcdr3包含seq id no:7所示的氨基酸序列或由其组成。在一些实施方案中,lcdr1包含seq id no:4所示的氨基酸序列或由其组成,lcdr2包含seq id no:5所示的氨基酸序列或由其组成,lcdr3包含seq id no:8所示的氨基酸序列或由其组成。在一些实施方案中,lcdr1包含seq id no:4所示的氨基酸序列或由其组成,lcdr2包含seq id no:5所示的氨基酸序列或由其组成,lcdr3包含seq id no:9所示的氨基酸序列或由其组成。
23.在一些实施方案中,所述抗体或抗原结合片段特异性结合cd73,并且包含:
24.(a)hcdr1,其包含如seq id no:1所示的氨基酸序列或与seq id no:1相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
25.(b)hcdr2,其包含如seq id no:2所示的氨基酸序列或与seq id no:2相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
26.(c)hcdr3,其包含如seq id no:3所示的氨基酸序列或与seq id no:3相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
27.(d)lcdr1,其包含如seq id no:4所示的氨基酸序列或与seq id no:4相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;
28.(e)lcdr2,其包含如seq id no:5所示的氨基酸序列或与seq id no:5相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成;和
29.(f)lcdr3,其包含如seq id no:6-9中任一项所示的氨基酸序列或与seq id no:6-9中任一项所示序列相比具有单一位点取代、缺失或插入的氨基酸序列,或由其组成。
30.在一些实施方案中,所述取代为保守氨基酸取代。
31.在一些实施方案中,所述抗体或抗原结合片段包含如seq id no:1所示的hcdr1、
如seq id no:2所示的hcdr2、如seq id no:3所示的hcdr3、如seq id no:4所示的lcdr1、如seq id no:5所述的lcdr2和如seq id no:6所示的lcdr3。
32.在一些实施方案中,所述抗体或抗原结合片段包含如seq id no:1所示的hcdr1、如seq id no:2所示的hcdr2、如seq id no:3所示的hcdr3、如seq id no:4所示的lcdr1、如seq id no:5所述的lcdr2和如seq id no:7所示的lcdr3。
33.在一些实施方案中,所述抗体或抗原结合片段包含如seq id no:1所示的hcdr1、如seq id no:2所示的hcdr2、如seq id no:3所示的hcdr3、如seq id no:4所示的lcdr1、如seq id no:5所述的lcdr2和如seq id no:8所示的lcdr3。
34.在一些实施方案中,所述抗体或抗原结合片段包含如seq id no:1所示的hcdr1、如seq id no:2所示的hcdr2、如seq id no:3所示的hcdr3、如seq id no:4所示的lcdr1、如seq id no:5所述的lcdr2和如seq id no:9所示的lcdr3。
35.在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的氨基酸序列,与seq id no:10所示序列相比具有至少80%同一性的序列,或与seq id no:10所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成;和/或
36.所述抗体或抗原结合片段的轻链可变区包含seq id no:11-14中任一项所示的氨基酸序列,与seq id no:11-14中任一项所示序列相比具有至少80%同一性的序列,或与seq id no:11-14中任一项所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成。
37.在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的序列,和/或所述抗体或抗原结合片段的轻链可变区包含seq id no:11-14中任一项所示的序列。
38.在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的序列,所述抗体或抗原结合片段的轻链可变区包含seq id no:11所示的序列。在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的序列,所述抗体或抗原结合片段的轻链可变区包含seq id no:12所示的序列。在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的序列,所述抗体或抗原结合片段的轻链可变区包含seq id no:13所示的序列。在一些实施方案中,所述抗体或抗原结合片段的重链可变区包含seq id no:10所示的序列,所述抗体或抗原结合片段的轻链可变区包含seq id no:14所示的序列。
39.在一些实施方案中,抗体或抗原结合片段还包含重链恒定区、轻链恒定区、fc区或其组合。在一些实施方案中,轻链恒定区是κ或λ链恒定区。在一些实施方案中,抗体或抗原结合片段是igg、igm、iga、ige或igd其中一种同种型。在一些实施方案中,同种型是igg1、igg2、igg3或igg4。在一些实施方案中,抗体或抗原结合片段是鼠源抗体、嵌合抗体、人源化抗体或全人源抗体。
40.在一些实施方案中,fc是变体fc区。在一些实施方案中,相对于亲本fc区,变体fc区具有一个或多个氨基酸修饰,如取代、缺失或插入。在一些实施方案中,相对于亲本fc区活性,fc区的氨基酸修饰改变了效应功能活性。在一些实施方案中,变体fc区可以具有改变的(即,增加的或降低的)抗体依赖性细胞毒性(adcc)、补体介导的细胞毒性(cdc)、吞噬作用、调理作用或细胞结合。在一些实施方案中,相对于亲本fc区,fc区氨基酸修饰可以改变
变体fc区对fcγr(fcγ受体)的亲和力。在一些实施方案中,所述fc区来源于igg1或igg4。在一些实施方案中,fc区突变是n297a、l234a或l235a(eu编号)。在一些实施方案中,fc区突变是e345r或s440y(eu编号)。
41.在一些实施方案中,所述抗体或抗原结合片段为scfv、fab、fab’或f(ab)2。在一些实施方案中,所述抗体或抗原结合片段为单克隆抗体。
42.在一些实施方案中,所述抗体或抗原结合片段的重链恒定区包含氨基酸序列如seq id no:15或16所示的序列,或与seq id no:15或16所示序列相比具有至少80%同一性的序列,或与seq id no:15或16所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成;和/或
43.所述抗体或抗原结合片段的轻链恒定区包含氨基酸序列如seq id no:17所示的序列,或与seq id no:17所示序列具有相比至少80%同一性的序列,或与seq id no:17示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成。
44.在一些实施方案中,所述抗体或抗原结合片段的重链恒定区包含氨基酸序列如seq id no:15所示的序列,所述抗体或抗原结合片段的轻链恒定区包含氨基酸序列如seq id no:17所示的序列。在一些实施方案中,所述抗体或抗原结合片段的重链恒定区包含氨基酸序列如seq id no:16所示的序列,所述抗体或抗原结合片段的轻链恒定区包含氨基酸序列如seq id no:17所示的序列。
45.在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18或19所示的序列,与seq id no:18或19所示序列相比具有至少80%同一性的序列,或与seq id no:18或19所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成;和/或
46.所述抗体的轻链包含氨基酸序列如seq id no:20-23中任一项所示的序列,与seq id no:20-23中任一项所示序列相比具有至少80%同一性的序列,或与seq id no:20-23中任一项所示序列相比具有一个或多个保守氨基酸取代的氨基酸序列,或由其组成。
47.在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18或19所示的序列,或由其组成;和/或
48.所述抗体的轻链包含氨基酸序列如seq id no:20-23中任一项所示的序列,或由其组成。
49.在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:20所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:21所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:22所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:23所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:20所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:21所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:22所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如
seq id no:19所示的序列,所述抗体的轻链包含氨基酸序列如seq id no:23所示的序列。
50.在一些实施方案中,所述抗体或抗原结合片段为单克隆抗体(包括全长单克隆抗体)、多特异性抗体或抗原结合片段(例如双特异性抗体或其抗原结合片段)。
51.在一些实施方案中,所述抗体具有两条序列相同的重链和两条序列相同的轻链,fc区配对形成二硫键。在一些实施方案中,所述抗原结合片段为fab、fab’、fv或scfv。
52.在一些实施方案中,所述抗体或抗原结合片段为分离的抗体或抗原结合片段。
53.本发明还提供了编码所述抗体或抗原结合片段的核酸。在一些实施方案中,所述核酸为分离的核酸。在一些实施方案中,所述核酸序列选自表6所列的核酸序列。
54.本发明还提供了包含所述核酸的载体。在一些实施方案中,包含所述核酸的载体为核酸片段、质粒、噬菌体或病毒。在一些实施方案中,所述载体为分离的载体。
55.本发明还提供了包含所述核酸或载体的宿主细胞。在一些实施方案中,所述宿主细胞为分离的宿主细胞。在一些实施方案中,所述宿主细胞为cho细胞、hek细胞(如hek293f细胞)、bhk细胞、cos1细胞、cos7细胞、cv1细胞或鼠l细胞。
56.本发明还提供了制备所述抗体或抗原结合片段的方法,其包括在培养基里培养包含编码所述抗体或抗原结合片段的核酸的宿主细胞。在一些实施方案中,所述方法还包括纯化所述抗体或抗原结合片段。纯化可以采用常规方法进行,例如先离心细胞悬液并收集上清液,再次离心进一步去除杂质。protein a亲和柱和离子交换柱等方法可以用于纯化抗体蛋白。
57.本发明还提供了药物组合物,所述药物组合物包含所述抗体或抗原结合片段,以及药学上可接受的辅料。
58.本发明还提供了预防或治疗肿瘤、癌症或感染的方法和用途。在一些实施方案中,提供了用于治疗或改善肿瘤、癌症或感染的方法,所述方法包括向患者施用有效剂量的所述抗体或抗原结合片段。在一些实施方案中,提供了所述抗体或抗原结合片段在用于治疗或改善肿瘤、癌症或感染中的应用。在一些实施方案中,提供了所述抗体或抗原结合片段在制备用于治疗或改善肿瘤、癌症或感染的药物中的应用。
59.在一些实施方案中,所述癌症和肿瘤包括但不限于乳腺癌、内分泌癌、神经内分泌癌、眼睛癌、泌尿生殖癌、生殖细胞癌、妇科癌、头颈癌、血液学/血液癌、肌肉骨骼癌、神经癌、呼吸道癌/胸腔癌、膀胱癌、结肠癌、直肠癌、肺癌、子宫内膜癌、肾癌、胰腺癌、肝癌、胃癌、睾丸癌、食道癌、前列腺癌、脑癌、宫颈癌、卵巢癌和甲状腺癌。在一些实施方案中,癌症和肿瘤包括但不限于白血病、黑色素瘤和淋巴瘤。在一些实施方案中,白血病包括但不限于淋巴细胞白血病或髓细胞性白血病,例如急性淋巴母细胞性白血病(all)、慢性淋巴细胞白血病(cll)、急性骨髓(髓细胞性)白血病(aml)、慢性髓细胞性白血病(cml)、毛细胞白血病、t细胞幼淋巴细胞白血病、大颗粒淋巴细胞白血病或成人t细胞白血病。在一些实施方案中,淋巴瘤包括但不限于组织细胞性淋巴瘤、滤泡性淋巴瘤和霍奇金淋巴瘤。在一些实施方案中,感染包括但不限于慢性感染性疾病,如hiv、hbv、hcv、covid-19和hsv等。
60.本发明还提供了诊断方法和用途。在一些实施方案中,提供了检测样品中cd73表达的方法,使样品与所述抗体或抗原结合片段进行接触,使得所述抗体或抗原结合片段结合cd73,并检测其结合,即样品中cd73的含量。在一些实施方案中,提供了所述抗体或抗原结合片段在制备用于诊断或预后癌症或肿瘤试剂盒中的应用。在一些实施方案中,提供了
一种包含所述抗体或抗原结合片段的诊断或预后试剂盒;任选的,所述试剂盒还包括第二抗体,其特异性识别所述抗cd73抗体;任选的,所述第二抗体还包括可检测的标记,例如放射性同位素、荧光物质、化学发光物质、有色物质或酶;任选的,所述试剂盒用于检测cd73在样品中的存在或其水平;任选的,所述试剂盒还包括针对其它抗原的抗体或抗原结合片段,和/或细胞毒性剂,和任选的,使用说明书。
61.本发明提供了抗cd73抗体及其应用,本发明抗体或抗原结合片段可以特异性结合cd73,阻断cd73下游的免疫抑制信号通路,有助于免疫系统清除肿瘤细胞。本发明抗体或抗原结合片段用于治疗或改善肿瘤、癌症或感染,也用于癌症或肿瘤的诊断和预后。
附图说明
62.图1示scfv与抗原hcd73结合的情况;其中,blk表示对照。
63.图2示抗cd73抗体抑制细胞膜cd73的酶活性。
64.图3a示外周血t细胞中cd73(pe标记)的流式检测结果,其中,a表示峰面积。
65.图3b示外周血b细胞中cd73(pe标记)的流式检测结果,其中,a表示峰面积。
66.图4示抗cd73抗体解除amp对t细胞增殖的抑制。
67.图5示抗cd73抗体上调b细胞激活marker(cd69)的表达;其中,横坐标blk表示对照,纵坐标表示b细胞中cd69的平均荧光强度。
68.术语
69.除非另作说明,否则下列的每一个术语应当具有下文所述的含义。
70.定义
71.应当注意的是,术语“一种”实体是指一种或多种该实体,例如“一种抗体”应当被理解为一种或多种抗体,因此,术语“一种”(或“一个”)、“一种或多种”和“至少一种”可以在本文中互换使用。
72.本文所用的术语
″
包含
″
或
″
包括
″
意味着组合物和方法等包括所列举的元素,例如组份或步骤,但不排除其它。
″
基本上由......组成
″
意味着组合物和方法排除对组合的特征有根本影响的其它元素,但不排除对组合物或方法无本质上影响的元素。
″
由......组成
″
意味着排除未特别列举的元素。
73.术语“多肽”旨在涵盖单数的“多肽”以及复数的“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的氨基酸单体形成的分子。术语“多肽”是指两个或更多个氨基酸的任何单条链或多条链,并且不涉及产物的特定长度。因此,“多肽”的定义中包括肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指两个或多个氨基酸链的任何其他术语,并且术语“多肽”可以用来代替上述任何一个术语,或者与上述任何一个术语交替使用。术语“多肽”也意在指多肽表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割或非天然发生的氨基酸修饰。多肽可以源自天然生物来源或通过重组技术产生,但其不必从指定的核酸序列翻译所得,它可能以包括化学合成的任何方式产生。
[0074]“氨基酸”是指既含氨基又含羧基的有机化合物,比如α-氨基酸,其可直接或以前体的形式由核酸编码。单个氨基酸由三个核苷酸(所谓的密码子或碱基三联体)组成的核酸编码。每一个氨基酸由至少一个密码子编码。相同氨基酸由不同密码子编码称为“遗传密码
的简并性”。氨基酸包括天然氨基酸和非天然氨基酸。天然氨基酸包括丙氨酸(三字母代码:ala,一字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly,g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、甲硫氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)和缬氨酸(val,v)。
[0075]“保守氨基酸取代”是指一个氨基酸残基被另一个含有化学性质(例如电荷或疏水性)相似的侧链(r基团)的氨基酸残基所取代。一般而言,保守氨基酸取代不大会在实质上改变蛋白质的功能性质。含有化学性质相似侧链的氨基酸类别的实例包括:1)脂族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂族羟基侧链:丝氨酸和苏氨酸;3)合酰胺的侧链:天冬酰胺和谷氨酰胺;4)芳族侧链:苯丙氨酸、酪氨酸和色氨酸;5)碱性侧链:赖氨酸、精氨酸和组氨酸;6)酸性侧链:天冬氨酸和谷氨酸。
[0076]“vl、vh的保守氨基酸取代”的氨基酸数目为约1个、约2个、约3个、约4个、约5个、约6个、约8个、约9个、约10个、约11个、约13个、约14个、约15个保守氨基酸取代,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。“重链恒定区、轻链恒定区、重链或轻链的保守氨基酸取代”的氨基酸数目为约1个、约2个、约3个、约4个、约5个、约6个、约8个、约9个、约10个、约11个、约13个、约14个、约15个、约18个、约19个、约22个、约24个、约25个、约29个、约31个、约35个、约38个、约41个、约45个保守氨基酸取代,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0077]
本发明中关于细胞、核酸、多肽、抗体等所使用的术语“分离的”,例如“分离的”dna、rna、多肽、抗体是指分别于细胞天然环境中的其它组分如dna或rna中的一种或多种所分离的分子。本发明使用的术语“分离的”还指当通过重组dna技术产生时基本上不含细胞材料、病毒材料或细胞培养基的核酸或肽,或化学合成时的化学前体或其他化学品。此外,“分离的核酸”意在包括不以天然状态存在的核酸片段,并且不会以天然状态存在。术语“分离的”在本发明中也用于指从其他细胞蛋白质或组织分离的细胞或多肽。分离的多肽意在包括纯化的和重组的多肽。分离的多肽、抗体等通常通过至少一个纯化步骤制备。在一些实施方案中,分离的核酸、多肽、抗体等的纯度至少为约50%、约60%、约70%、约80%、约90%、约95%、约99%,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0078]
术语“重组”涉及多肽或多聚核苷酸,意指天然不存在的多肽或多聚核苷酸的形式,不受限制的实施例可以通过组合产生通常并不存在的多聚核苷酸或多肽。
[0079]“同源性”或“同一性”或“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。可以通过比较每个序列中可以比对的位置来确定同源性。当被比较的序列中的位置被相同的碱基或氨基酸占据时,则分子在该位置是同源的。序列之间的同源程度是由序列共有的匹配或同源位置的数目组成的一个函数。
[0080]“至少80%同一性”为约80%同一性、约81%同一性、约82%同一性、约83%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约90%同一性、约91%同一性、约92%同一性、约94%同一性、约95%同一性、约98%同一性、约99%同一性,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0081]
多聚核苷酸或多聚核苷酸序列(或多肽或抗体序列)与另一序列有具有一定百分比(例如90%、95%、98%或者99%)的“同一性或序列同一性”是指当序列比对时,所比较的
两个序列中该百分比的碱基(或氨基酸)相同。可以使用目测或本领域已知的软件程序来确定该比对和同一性百分比或序列同一性,比如ausubel et al.eds.(2007)在current protocols in molecular biology中所述的软件程序。优选使用默认参数进行比对。其中一种比对程序是使用默认参数的blast,例如blastn和blastp,两者使用下列默认参数:geneticcode=standard;filter=none;strand=both;cutoff=60;expect=10;matrix=blosum62;descriptions=50sequences;sortby=highscore;databases=non-redundant;genbank embl ddbj pdb genbankcdstranslations swissprotein spupdate pir。生物学上等同的多聚核苷酸是具有上述指定百分比的同一性并编码具有相同或相似生物学活性的多肽的多聚核苷酸。
[0082]
多聚核苷酸是由四个核苷酸碱基的特定序列组成:腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t),或当多聚核苷酸是rna时胸腺嘧啶换为尿嘧啶(u)。“多聚核苷酸序列”可以以多聚核苷酸分子的字母表示。该字母表示可以被输入到具有中央处理单元的计算机中的数据库中,并用于生物信息学应用,例如用于功能基因组学和同源性搜索。
[0083]
术语“多聚核苷酸”和“寡核苷酸”可互换使用,是指任何长度的核苷酸的聚合形式,无论是脱氧核糖核苷酸还是核糖核苷酸或其类似物。多聚核苷酸可以具有任何三维结构并且可以执行已知或未知的任何功能。以下是不受限制的多聚核苷酸的实施例:基因或基因片段(例如探针、引物、est或sage标签)、外显子、内合子、信使rna(mrna)、转运rna、核糖体rna、核糖酶、cdna、dsrna、sirna、mirna、重组多聚核苷酸、分支的多聚核苷酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针和引物。多聚核苷酸可以包含修饰的核苷酸,例如甲基化的核苷酸和核苷酸类似物。如果存在该修饰,则对核苷酸的结构修饰可以在组装多聚核苷酸之前或之后进行。核苷酸的序列可以被非核苷酸组分中断。聚合后可以进一步修饰多聚核苷酸,例如通过与标记组分缀合。这个术语也指双链和单链分子。除另有说明或要求外,本公开的任何多聚核苷酸的实施例包括双链形式和已知或预测构成双链形式的两种可互补单链形式中的每一种。
[0084]
术语“编码”应用于多聚核苷酸时,是指被称为“编码”多肽的多聚核苷酸,在其天然状态或当通过本领域技术人员公知的方法操作时,经转录和/或翻译可以产生该多肽和/或其片段。
[0085]
本发明公开的抗体、抗原结合片段包括但不限于多克隆、单克隆、多特异性、全人源、人源化、灵长类化、嵌合抗体、单链抗体、表位结合片段(例如fab、fab
′
和f(ab
′
)2、单链fv(scfv))。
[0086]“抗体”、“抗原结合片段”是指特异性识别和结合抗原的多肽或多肽复合物。抗体可以是完整的抗体及其任何抗原结合片段或其单链。因此术语“抗体”包括分子中含有具有与抗原结合的生物学活性的免疫球蛋白分子的至少一部分的任何蛋白质或肽。抗体和抗原结合片段包括但不局限重链或轻链或其配体结合部分的互补决定区(cdr)、重链可变区(vh)、轻链可变区(vl)、重链恒定区(ch)、轻链恒定区(cl)、框架区(fr)或其任何部分,或结合蛋白的至少一部分。cdr区包括轻链的cdr区(lcdr1-3)和重链的cdr区(hcdr1-3)。抗体及抗原结合片段可以特异性识别和结合一个或多个(如两个)抗原的多肽或多肽复合物。特异性识别和结合多个(如两个)抗原的抗体或抗原结合片段可以被称为多特异性(如双特异性)抗体或抗原结合片段。
[0087]
术语“抗体片段”或“抗原结合片段”指抗体的一部分,本发明抗体片段的组成形式可类似于单特异性抗体片段中的f(ab’)2、f(ab)2、fab
′
、fab、fv、scfv等。不管其结构如何,抗体片段与被完整抗体识别的同一抗原结合。术语“抗体片段”包括适体、镜像异构体和双价抗体。术语“抗原结合片段”还包括通过与特定抗原结合形成复合物起抗体作用的任何合成或基因工程蛋白质。
[0088]“单链可变片段”或“scfv”是指免疫球蛋白的重链(vh)和轻链(vl)的可变区的融合蛋白。在一些方面,这些区域与10个至约25个氨基酸的短接头肽连接。接头可以富含甘氨酸以增加柔韧性,以及富含丝氨酸或苏氨酸以增加溶解性,并且可以连接vh的n端和vl的c端,反之亦然。尽管该蛋白质被除去了恒定区和引入了接头,但其保留了原始免疫球蛋白的特异性。scfv分子通常是本领域中已知的,例如在美国专利5,892,019中有相关描述。
[0089]
术语“抗体”包括可以在生物化学上区分的各种广泛种类的多肽。本领域技术人员将会理解,重链的类别包括gamma、mu、alpha、delta或epsilon(γ、μ、α、δ、ε),其中还有一些亚类(例如γ1-γ4)。该链的性质决定了抗体的“种类”分别为igg、igm、iga、igg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5等已被充分表征并且赋予的功能特异性也已知。所有的免疫球蛋白种类都在本发明公开的保护范围内。在一些实施方案中,免疫球蛋白分子为igg种类。
[0090]
轻链可以分为kappa(κ)或lambda(λ)。每个重链可以与κ或λ轻链结合。一般来说,当由杂交瘤,b细胞或基因工程宿主细胞生产免疫球蛋白时,其轻链和重链通过共价键结合,两条重链的“尾巴”部分通过共价二硫键或非共价键结合。在重链中,氨基酸序列从y构型的叉状末端的n末端延伸至每条链底部的c末端。免疫球蛋白κ轻链可变区为vκ;免疫球蛋白λ轻链可变区为v
λ
。
[0091]
术语“恒定的”和“可变的”根据功能被使用。轻链可变区(vl)和重链可变区(vh)部分决定了抗原识别和特异性。轻链和重链的恒定区赋予重要的生物学性质,如分泌、经胎盘移动、fc受体结合、补体结合等。按照惯例,恒定区的编号随着它们变得更远离抗体的抗原结合位点或氨基末端而增加。n端部分是可变区,c端部分是恒定区;ch3和cl结构域实际上分别包含重链和轻链的羧基端。
[0092]
在天然存在的抗体中,假设抗体在含水环境中呈现其三维构型时,存在于每个抗原结合域中的六个“互补决定区”或“cdr”是形成抗原结合结构域的短的、非连续的与抗原特异性结合的氨基酸序列。抗原结合结构域中被称为“构架”区域的剩余其它氨基酸显示出较小的分子间可变性。构架区大部分采用β-折叠构象,cdr形成与之连接的环状结构,或在某些情况下形成β折叠结构的一部分。因此,框架区通过形成支架从而通过链间非共价相互作用使cdr定位在正确的方位上。具有特定位置的cdr的抗原结合域形成了与抗原上的表位互补的表面,该互补表面促进抗体和其抗原表位的非共价结合。对于给定的重链或轻链可变区,本领域普通技术人员都可以通过已知方法鉴定出包含cdr和框架区的氨基酸(参见kabat,e.,et al.,u.s.department of health and human services,sequences of proteins of immunological interest,(1983)和chothia and lesk,j.mol.biol.,196:901-917(1987))。
[0093]
在本领域中使用和/或接受的术语有两个或多个定义的情况下,除非明确地对立指出,否则本文使用的术语的定义包括所有这些含义。一个具体的例子是使用“互补决定
区”(“cdr”)一词来描述在重链和轻链多肽的可变区内发现的非连续的抗原结合位点。这一特定区域在kabat et al.,u.s.dept.of health and human services,sequences of proteins of immunological interest(1983)和chothia等在j.mol.biol.196:901-917(1987)有相关描述,其通过引用全部并入本文。
[0094]
根据kabat和chothia定义的cdr包括相互比较时的氨基酸残基的重叠或子集。尽管如此,应用任一定义来指代抗体或其变体的cdr都在本发明范围内。包含特定cdr的确切残基编号将根据cdr的序列和大小而变化。本领域技术人员通常可以根据抗体的可变区氨基酸序列确定出cdr包含哪些特定的残基。
[0095]
kabat等人还定义了适用于任何抗体的可变区序列的编号系统。本领域普通技术人员可以不依赖于序列本身以外的其他实验数据将该“kabat编号”系统应用到任何可变区序列。“kabat编号”是指由kabat et al.,u.s.dept.of health and human services在“sequence of proteins of immunological interest”(1983)提出的编号系统。抗体还可以用eu或chothia编号系统。
[0096]
本发明公开的抗体可以来源于任何动物,包括鸟类和哺乳动物。较佳地,抗体是人源、鼠源、驴源、兔源、山羊源、骆驼源、美洲驼源、马源或鸡源抗体。在另一实施方案中,可变区可以是软骨鱼纲(condricthoid)来源(例如来自鲨鱼)。
[0097]“重链恒定区”包括ch1结构域、铰链(例如上、中和/或下铰链区)结构域、ch2结构域、ch3结构域,或变体或片段中的至少一种。抗体的重链恒定区可以来源于不同的免疫球蛋白分子。例如,多肽的重链恒定区可以包括源自igg1分子的ch1结构域和源自igg3分子的铰链区。在另一实施方案中,重链恒定区可以包括部分源自igg1分子和部分源自igg3分子的铰链区。在另一实施方案中,部分重链可以包括部分源自igg1分子和部分源自igg4分子的嵌合铰链区。
[0098]“轻链恒定区”包括来自抗体轻链的一部分氨基酸序列。较佳地,轻链恒定区包含恒定κ结构域或恒定λ结构域中的至少一个。“轻链-重链对”是指可通过轻链的cl结构域和重链的ch1结构域之间的二硫键形成二聚体的轻链和重链的集合。这四条链通过二硫键以“y”构型连接,其中轻链从“y”口开始并延续通过可变区包围重链。
[0099]“vh结构域”包括免疫球蛋白重链的氨基末端可变结构域,“ch1结构域”包括免疫球蛋白重链的第一个(大部分氨基末端)恒定区。完整的天然igg分子中两个ch2结构域中n297各连接一个分支碳水化合物链。ch3结构域从ch2结构域开始延伸到igg分子的c-末端,大约包含108个残基。“铰链区”包括连接ch1结构域和ch2结构域的部分重链区域。所述铰链区包含约25个残基并且是有韧性的,从而使得两个n端抗原结合区能够独立移动。铰链区可以被细分为三个不同的结构域:上、中和下铰链结构域(rouxetal.,j.immunol 161:4083(1998))。
[0100]“二硫键”指两个硫原子之间形成的共价键。半胱氨酸的硫醇基团可以与第二个硫醇基团形成二硫键或桥接。在大多数天然存在的igg分子中,ch1和cl区通过二硫键连接。
[0101]“嵌合抗体”指其可变区从第一个物种中获得或衍生,而其恒定区(可以是完整的、部分的或修饰过的)来源于第二个物种的任何抗体。某些实施方案中,可变区来自非人源(例如小鼠或灵长类动物),而恒定区来自人源。
[0102]“特异性结合”或“对......具有特异性”通常是指抗体或抗原结合片段与特定抗
原通过其抗原结合结构域与表位互补性结合形成相对稳定的复合物。“特异性”可以用抗体或抗原结合片段与特定抗原或表位结合的相对亲和力表达。例如,如果抗体“a”比抗体“b”与同一抗原的相对亲和力大,可以认为抗体“a”比抗体“b”对该抗原具有更高的特异性。特异性结合可以用平衡解离常数(kd)来描述,较小的kd意味着较紧密的结合。确定两个分子是否特异性结合的方法是本领域内众所周知的,并包括例如平衡透析、表面等离子共振、生物膜层光学干涉测量法等。“特异性结合”抗原a的抗体包括与抗原a平衡解离常数kd小于或等于约100nm、小于或等于约10nm、小于或等于约5nm、小于或等于约1nm。
[0103]“治疗”是指治疗性治疗和预防性或防治性措施,其目的是预防、减缓、改善或停止不良的生理改变或紊乱,例如疾病的进程,包括但不限于以下无论是可检测还是不可检测的结果,症状的缓解、疾病程度的减小、疾病状态的稳定(即不恶化)、疾病进展的延迟或减缓、疾病状态的改善、缓和、减轻或消失(无论是部分还是全部)、延长与不接受治疗时预期的生存期限等。需要治疗的患者包括已经患有病症或紊乱的患者,容易患有病症或紊乱的患者,或者需要预防该病症或紊乱的患者,可以或预期从施用本发明公开的抗体或药物组合物用于检测、诊断过程和/或治疗中受益的患者。
[0104]“患者”指需要诊断、预后或治疗的任何哺乳动物,包括人类、狗、猫、兔子、鼠、马、牛等。
[0105]“约”指相关技术领域技术人员容易知道的相应数值的常规误差范围。在一些实施方式中,本文中提到“约”指所描述的数值以及其
±
10%、
±
5%或
±
1%的范围。
[0106]“ec
50”即半最大效应浓度(concentration for 50%of maximal effect,ec
50
)是指能引起50%最大效应的浓度。
[0107]“ic
50”表示50%抑制浓度,即对指定的生物过程抑制一半时所需的药物或者抑制剂的浓度。
[0108]
本发明中
″
亲本fc区
″
可以为天然存在的fc区,编码fc区的基因可来自人、鼠、兔、骆驼、猴子,优选为人和小鼠;例如,亲本fc区为seq id no:18或19中fc区。
[0109]
本文提及出版物的相关描述均通过引用全部并入本文。
[0110]
抗cd73抗体
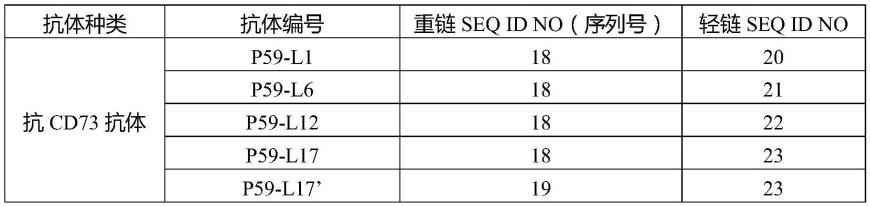
[0111]
本发明提供了对cd73蛋白具有高亲和力的抗体或抗原结合片段。本发明抗cd73抗体或抗原结合片段表现出有效的结合活性、生物学活性,并用于治疗和诊断。比如,这些抗体或抗原结合片段有效阻断抑制性的免疫检查点,激活淋巴细胞释放细胞因子,用于治疗各种类型的癌症、肿瘤或感染等相关疾病。
[0112]
在一些实施方案中,所述抗原结合片段为scfv。
[0113]
在一些实施方案中,scfv中的vh包含氨基酸序列如seq id no:10所示的序列,scfv中的vl包含氨基酸序列如seq id no:11所示的序列。在一些实施方案中,scfv中的vh包含氨基酸序列如seq id no:10所示的序列,scfv中的vl包含氨基酸序列如seq id no:12所示的序列。在一些实施方案中,scfv中的vh包含氨基酸序列如seq id no:10所示的序列,scfv中的vl包含氨基酸序列如seq id no:13所示的序列。在一些实施方案中,scfv中的vh包含氨基酸序列如seq id no:10所示的序列,scfv中的vl包含氨基酸序列如seq id no:14所示的序列。
[0114]
在一些实施方案中,scfv片段中连接重链可变区和轻链可变区的连接子为(g4s)n。
在一些实施方案中,n为1、2、3、4或5。
[0115]
在一些实施方案中,所述抗体为igg1或igg4。
[0116]
在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,抗体的轻链包含氨基酸序列如seq id no:20所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,抗体的轻链包含氨基酸序列如seq id no:21所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,抗体的轻链包含氨基酸序列如seq id no:22所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:18所示的序列,抗体的轻链包含氨基酸序列如seq id no:23所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,抗体的轻链包含氨基酸序列如seq id no:20所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,抗体的轻链包含氨基酸序列如seq id no:21所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,抗体的轻链包含氨基酸序列如seq id no:22所示的序列。在一些实施方案中,所述抗体的重链包含氨基酸序列如seq id no:19所示的序列,抗体的轻链包含氨基酸序列如seq id no:23所示的序列。
[0117]
在一些实施方案中,本发明抗体含有两条序列相同的重链和两条序列相同的轻链。
[0118]
本领域普通技术人员还应当理解,本发明所公开抗体或抗原结合片段序列是可以被替换的,替换后其氨基酸序列不同于该抗体的天然存在的氨基酸序列。例如,替换后的氨基酸序列可以是与起始序列相似的,比如与起始序列具有一定比例的同一性,比如它可以与起始序列的同一性是约80%、约85%、约90%、约95%、约98%、约99%,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0119]
在一些实施方案中,抗体或抗原结合片段包含氨基酸序列具有一个或多个修饰基团。例如,本发明公开的抗体或抗原结合片段可以包含有韧性的接头序列,或者可以被修饰以添加功能性基团(例如peg、药物、毒素或标签)。
[0120]
本发明公开的抗体、抗原结合片段包括被修饰的衍生物,即通过任何类型的分子与抗体或抗原结合片段的共价连接进行修饰,其中共价连接不会阻止抗体或抗原结合片段与表位结合。包括但不限制以下实例,抗体或抗原结合片段可以被糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割、连接至细胞配体或其他蛋白质等。众多化学修饰中的任一种修饰可以通过现有技术进行,包括但不限于特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等。本发明公开的抗体、抗原结合片段及其被修饰的衍生物包括其与酸和/或碱形成的盐。
[0121]
在一些实施方案中,抗体或抗原结合片段可以与治疗剂、药物前体、肽、蛋白质、酶、病毒、脂类、生物反应调节剂、药剂或peg缀合。
[0122]
抗体或抗原结合片段可通过将其偶联至化学发光化合物来被可检测地标记。然后通过检测在化学反应过程中出现的发光从而确定化学发光标记的抗体或抗原结合片段的存在。化学发光标记化合物的实例包括鲁米诺、异鲁米诺、芳香吖啶酯、咪唑、吖啶盐和草酸酯。
[0123]
抗体和编码抗体的多聚核苷酸的制备方法
[0124]
本发明还公开了编码本发明所述抗体、抗原结合片段、及其衍生物的多聚核苷酸或核酸分子。本发明公开的多聚核苷酸可以编码重链可变区、轻链可变区、fc区、部分重链可变区、部分轻链可变区、重链或轻链等。制备抗体的方法是本领域公知的并且在本发明中有所描述。
[0125]
在某些实施方案中,制备的抗体不会在待治疗的动物(例如人类)中引起有害的免疫应答。在一些实施方案中,本发明公开的抗体、抗原结合片段、或衍生物使用本领域公认的技术修饰以降低其免疫原性。例如,抗体可以被人源化、灵长类化、去免疫化或者可以制备嵌合抗体。这些类型的抗体来源于非人抗体,通常是鼠类或灵长类抗体,其保留或基本保留亲本抗体的抗原结合特性但在人体中免疫原性较低。其可以通过多种方法来实现,包括(a)将整个非人源的可变区移植到人源的恒定区以产生嵌合抗体;(b)将一个或多个非人类互补决定区(cdr)的至少一部分移植到人源的框架和恒定区中,保留或不保留关键的框架残基;或(c)移植整个非人源的可变区,但通过用类人源的部分置换表面残基从而“隐藏”它们。通常人框架区中的框架残基将被来自cdr供体抗体的相应残基取代,比如能够改善抗原结合的残基。这些框架替换可以通过本领域公知的方法鉴定,例如通过模拟cdr和框架残基的相互作用以鉴定对抗原结合起重要作用的框架残基和通过序列对比以鉴定特定位置上异常的框架残基。(参考美国专利5,585,089;riechmann et al.,nature 332:323(1988);其全部内容通过引用并入本文)。可以使用本领域公知的多种技术使抗体人源化,例如cdr移植(ep 239,400;wo 91/09967;美国专利5,225,539,5,530,101和5,585,089),修复或者表面重排(ep592,106;ep519,596;padlan,et al.,molecular immunology 28(4/5):489-498(1991);studnicka et al.,protein engineering 7(6):805-814(1994);roguska,et al.,proc.natl.sci.usa 91:969-973(1994)),以及链的重排(美国专利5,565,332),其全部内容通过引用并入本文。
[0126]
去免疫化也可用于降低抗体的免疫原性。在本发明中,术语“去免疫化”包括改变抗体以修饰t细胞表位(参见例如wo/9852976 a1和wo/0034317 a2)。例如,分析来自起始抗体的重链可变区序列和轻链可变区序列,并产生来自每个可变区的人t细胞表位“图谱”,显示表位相对于互补决定区(cdrs)和序列内其它关键残基的位置。分析来自t细胞表位图的单个t细胞表位,以鉴定具有较低改变抗体活性风险的可选择的氨基酸取代。设计包含氨基酸取代组合的一系列可选的重链可变区序列和轻链可变区序列,随后将这些序列掺入到一系列结合多肽中。然后将包含修饰过的可变区和人类恒定区的完整重链和轻链的基因克隆到表达载体中,随后将质粒转入细胞系以产生完整的抗体。然后利用合适的生物化学和生物学实验中比较抗体,鉴定出最佳的抗体。
[0127]
本发明公开的抗体或抗原结合片段的结合特异性可以通过体外实验,例如免疫共沉淀、放射免疫实验(ria)或酶联免疫吸附实验(elisa)来检测。
[0128]
scfv的制备可参见生产单链单元的技术(美国专利4,694,778;bird,science242:423-442(1988)、huston et al.,proc.natl.acad.sci.usa 55:5879-5883(1988)和ward et al.,nature 334:544-554(1989)和nie et al.,antibody therapeutics 3(1):18-62(2020))。通过氨基酸桥接fv区的重链和轻链片段形成单链单元,产生单链融合肽。也可以使用在大肠杆菌中组装功能性fv片段的技术(skerra et al.,science 242:1038-1041(1988))。
[0129]
可用于生产单链fv(scfv)和抗体的技术的实例包括如美国专利4,946,778和5,258,498,以及huston et al.,methods in enzymology 203:46-88(1991)、shu et al.,proc.natl.sci.usa 90:1995-1999(1993)和skerra et al.,science 240:1038-1040(1988)中所述。对于包括在人体内使用抗体和体外检测实验的某些用途,可以使用嵌合抗体、人源化抗体或全人源抗体。嵌合抗体是抗体的不同部分源自不同动物物种的一类分子,例如具有鼠源单克隆抗体的可变区和人源免疫球蛋白恒定区的抗体。生产嵌合抗体的方法是本领域已知的,参见morrison,science 229:1202(1985);oi et al.,bio techniques 4:214(1986);gillies et al.,j.immunol.methods 125:191-202(1989);neuberger et al.,nature372:604-608(1984);takeda et al.,nature 314:452-454(1985);和美国专利5,807,715、4,816,567和4,816,397,其全部内容通过引用并入本文。
[0130]
此外,在newman,biotechnology 10:1455-1460(1992)中公开了另一种生产重组抗体的高效方法,特别地,该技术能产生含有猴可变区和人恒定区序列的灵长类抗体,该参考文献的全部内容通过引用并入本文。此外,该技术也在美国专利5,658,570、5,693,780和5,756,096中有所提及,每个专利的全部内容通过引用并入本文。
[0131]
抗体可以通过本领域已知的多种方法制备,包括使用来自免疫球蛋白序列的抗体文库进行的噬菌体展示方法。也可参考美国专利4,444,887和4,716,111,以及pct公布文本wo 98/46645、wo 98/50433、wo 98/24893、wo 98/16654、wo 96/34096、wo 96/33735和wo 91/10741,每个专利的全部内容通过引用并入本文。
[0132]
在另一实施方案中,使用常规方法(例如使用能够特异性结合编码鼠抗体重链和轻链的基因的寡核苷酸探针),可以分离编码所需单克隆抗体的dna并对其进行测序。分离的和亚克隆的杂交瘤细胞可以作为此类dna的来源。一旦分离出来,dna可以被置于表达载体中然后被转染到原核或真核宿主细胞如大肠杆菌细胞、猿猴cos细胞、中国仓鼠卵巢(cho)细胞或不产生其他免疫球蛋白的骨髓瘤细胞中。分离的dna(如本文所述可以是合成的)也可用于制备抗体的恒定区和可变区的序列,如美国专利5,658,570中所述,其全部内容通过引用并入本文。该方法从所选细胞中提取rna并转化成cdna,然后使用ig特异性引物通过pcr技术进行扩增。适于此目的的合适的探针在美国专利5,658,570中也有所提及。
[0133]
此外,使用常规重组dna技术,可将本发明的抗体的一个或多个cdr插入框架区,例如插入到人类框架区以构建人源化非全人源抗体。框架区可以是天然存在的或共有的框架区,优选人类框架区(参见chothia et al.,j.mol.biol.278:457-479(1998),其列出一系列人类框架区)。一些多核苷酸可以编码框架区和cdr组合产生的与目标抗原的至少一个表位特异性结合的抗体。在框架区内可以进行一个或多个氨基酸取代,可以选择能够改善抗体与其抗原结合的氨基酸取代。另外,可用此法进行参与链间二硫键形成的一个或多个可变区中半胱氨酸残基的取代或缺失,从而产生缺少一个或多个链间二硫键的抗体分子。本领域技术范围内的对多核苷酸进行的其他改变也涵盖于本发明中。
[0134]
抗体可以通过使用常规重组dna技术制备。使用本领域技术人员公知的技术可以选择、构建和培养生产抗体的载体及细胞系等。这些技术在各种实验室手册和主要出版物中均有描述,例如recombinant dna technology for production of protein therapeutics in cultured mammalian cells,d.l.hacker,f.m.wurm,in reference module in life sciences,2017,其全部内容包括补充内容通过引用并入全文。
[0135]
在一些实施方案中,可以按常规方法根据本文所述抗体氨基酸序列设计合成编码抗体的dna,将其置入表达载体中,然后转染宿主细胞,在培养基中培养被转染的宿主细胞产生单克隆抗体。在一些实施方案中,表达抗体载体包括至少一个启动子元件,抗体编码序列,转录终止信号和polya尾。其他元件包括增强子,kozak序列及插入序列两侧rna剪接的供体和受体位点。可以通过sv40的前期和后期启动子,来自逆转录病毒的长末端重复序列如rsv、htlv1、hivi及巨细胞病毒的早期启动子来获得高效的转录,也可应用其它一些细胞的启动子如肌动蛋白启动子。合适的表达载体可包括pires1neo,pretro-off,pretro-on,plxsn,或者plncx,pcdna3.1( /-),pcdna/zeo( /-),pcdna3.1/hygro( /-),psvl,pmsg,prsvcat,psv2dhfr,pbc12mi和pcs2等。常使用的哺乳动物细胞包括293细胞,cos1细胞,cos7细胞,cv1细胞,鼠l细胞和cho细胞等。
[0136]
在一些实施方案中,插入基因片段需含有筛选标记,常见的筛选标记包括二氢叶酸还原酶,谷氨酰胺合成酶,新霉素抗性,潮霉素抗性等筛选基因,以便于转染成功的细胞的筛选分离。将构建好的质粒转染到无上述基因的宿主细胞,经过选择性培养基培养,转染成功的细胞大量生长,产生想要获得的目的蛋白。
[0137]
此外,可以使用本领域技术人员已知的标准技术在编码本发明所述抗体的核苷酸序列中引入突变,包括但不限于导致氨基酸取代的定点突变和pcr介导的突变。变体(包括衍生物)编码相对于原重链可变区和轻链可变区来说少于50个氨基酸的取代、少于40个氨基酸的替换、少于30个氨基酸的取代、少于25个氨基酸的取代、少于20个氨基酸的取代、少于15个氨基酸的取代、少于10个氨基酸的取代、少于5个氨基酸的取代、少于4个氨基酸的取代、少于3个氨基酸的取代或少于2个氨基酸的取代。或者可以沿着全部或部分编码序列时随机引入突变,例如通过饱和突变,以及可以筛选所得突变体的生物活性以鉴定保留活性的突变体。
[0138]
治疗方法
[0139]
本发明还提供了治疗方法和用途。在一些实施方案中,提供了用于治疗或改善各种类型的癌症、肿瘤或感染等相关疾病的方法,所述方法包括向有需要的患者施用有效剂量的抗cd73抗体或抗原结合片段。在一些实施方案中,提供了抗cd73抗体或抗原结合片段在用于治疗或改善癌症、肿瘤或感染等相关疾病中的应用。在一些实施方案中,提供了所述抗cd73抗体或抗原结合片段在制备用于治疗或改善癌症、肿瘤或感染等相关疾病的药物中的应用。
[0140]
对于任何特定患者的具体剂量和治疗方案将取决于各种因素,包括所使用的特定抗体或衍生物、患者的年龄和体重、一般健康状况、性别和饮食,以及给药时间、排泄频率、药物组合,以及所治疗的特定疾病的严重程度。由包括在本领域普通技术人员范围内的医疗护理人员对这些因素进行判断。所述剂量还将取决于待治疗的个体患者、给药途径、制剂类型、所用化合物的特性、疾病的严重程度以及所需的效果。所用剂量可以通过本领域熟知的药理学和药代动力学原理确定。在一些实施方案中,本发明抗体施用于患者的剂量为每次0.01mg/kg至100mg/kg患者体重。在一些实施方案中,每1星期、2星期、3星期、或每月给药一次。在一些实施方案中,本发明抗体或抗原结合片段施用于患者的剂量为0.01mg/kg至100mg/kg患者体重,或0.1mg/kg至20mg/kg患者的体重。在初始剂量之后可随后给予第二剂或多剂该抗体或抗原结合片段,其剂量与初始剂量大致相同或较少,其中该随后的剂量可
相隔至少1天至3天;或至少一星期。可以通过例如脂质化等修饰来增强抗体或抗原结合片段的摄取和组织穿透能力(例如进入脑内),从而减少本发明抗体或抗原结合片段的施用的剂量和频率。
[0141]
在一些实施方案中,抗cd73抗体(如抗体p59-l17或抗体p59-l17’)施用的有效剂量为每剂约15mg至1200mg。在一些实施方案中,抗cd73抗体(如抗体p59-l17或抗体p59-l17’)施用的有效量为约15mg至1200mg每个治疗周期。在一些实施方案中,一个治疗周期为约1周、2周、3周、4周、1个月、5周、6周、7周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。
[0142]
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约15mg、约18mg、约90mg、约120mg、约160mg、约180mg、约200mg、约230mg、约250mg、约280mg、约300mg、约310mg、约334mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约500mg、约600mg、约720mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗cd73抗体的制剂。在一些实施方案中,一个治疗周期为1周至7周给药1次。在一些实施方案中,每个治疗周期内施用抗cd73抗体的有效量为约100mg至300mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周、约4周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约300mg至600mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周、或约4周。在一些实施方案中,每个治疗周期内施用抗cd73抗体的有效量为约700mg至1100mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周、约4周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约60mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约360mg、约420mg、约720mg、约1080mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
[0143]
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约50mg至80mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约60mg,或含此剂量抗cd73抗体的制剂;比如约60mg给药1次。
[0144]
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约150mg至200mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约180mg,或含此剂量抗cd73抗体的制剂;比如约180mg给药1次。
[0145]
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约345mg至380mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约360mg,或含此剂量抗cd73抗体的制剂;比如约360mg给药1次。
[0146]
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约693mg至730mg,或含此剂量抗cd73抗体的制剂;其中,一个治疗周期为约1周、约2周、约3周或约4周。
在一些实施方案中,患者每个治疗周期内施用抗cd73抗体的有效量为约720mg,或含此剂量抗cd73抗体的制剂;比如约720mg给药1次。
[0147]
在一些实施方案中,每次施用的抗cd73抗体(如抗体p59-l17或抗体p59-l17’)为约0.3mg/kg,约1mg/kg,约1.2mg/kg,约2mg/kg,约2.4mg/kg,约3mg/kg,约3.6mg/kg,约4mg/kg,约4.8mg/kg,约5mg/kg,约5.5mg/kg,约6mg/kg,约6.9mg/kg,约7mg/kg,约8.4mg/kg,约9mg/kg,约11mg/kg,约12mg/kg,约15mg/kg,约18mg/kg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗cd73抗体的制剂。
[0148]
在一些实施方案中,抗cd73抗体(如抗体p59-l17或抗体p59-l17’)施用的有效量为约0.3mg/kg至18mg/kg每2周或每3周1次。在一些实施方案中,抗cd73抗体(如抗体p59-l17)施用的有效量为约0.3mg/kg,约1mg/kg,约3mg/kg,约5mg/kg,约6mg/kg,约12mg/kg,约13mg/kg,或约18mg/kg每2周或每3周1次。在一些实施方案中,抗cd73抗体(如抗体p59-l17或抗体p59-l17’)施用的有效量为约5mg/kg每2周1次,约6mg/kg每2周1次,约10mg/kg每2周1次,约3mg/kg每3周1次,约5mg/kg每3周1次,约6mg/kg每3周1次,约7.5mg/kg每3周1次,约12mg/kg每3周1次,约15mg/kg每3周1次,或约18mg/kg每3周1次。
[0149]
在一些实施方案中,患者每个治疗周期内分别给药一次抗cd73抗体。在一些实施方案中,每个治疗周期内多次给药抗cd73抗体,例如2次、3次、4次或5次。在一些实施方案中,患者每个治疗周期只能给药1次或4次。
[0150]
在一些实施方案中,患者接受一个治疗周期治疗。在一些实施方案中,患者接受多个(例如2个、3个或4个)治疗周期治疗。在一些实施方案中,患者接受治疗直至病症得到缓解而不再需要治疗。
[0151]
抗体、抗原结合片段或其衍生物的施用方法包括但不限于真皮内、肌肉、腹腔、静脉、皮下、鼻腔、硬脊膜外和口服施用。药物组合物可以通过任何方便的途径施用,例如通过输注或推注,通过上皮或皮肤粘膜(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂共同施用。因此,含有本发明抗体、抗原结合片段或其衍生物的药物组合物可以口服给药、直肠给药、肠胃外给药、脑池内给药、阴道内给药、腹腔内给药、外敷(如通过粉末,软膏,滴剂或透皮贴剂)、口腔给药或通过口服或鼻腔喷雾给药。
[0152]
本发明使用的术语“肠胃外”是指包括静脉内、肌肉内、腹腔内、胸骨内、皮下和关节内注射和输注的施用方式。施用方式可以是全身施用或局部施用。
[0153]
在一些实施方案中,本发明组合物包含编码抗体或抗原结合片段的核酸或多聚核苷酸,可以通过将其构建为合适的核酸表达载体的一部分来体内施用所述核酸以促进其编码的蛋白质的表达,然后通过下述方式施用上述部分载体使其变为胞内部分,例如通过使用逆转录病毒载体(参见美国专利4,980,286),或通过直接注射,或通过使用微粒轰击(例如基因枪;biolistic,dupont),或用脂质或细胞表面受体或转染试剂包被,或者通过与已知进入细胞核的同源异型盒类肽连接施用(参见例如joliot et al.,1991,proc.natl.acad.sci.usa 88:1864-1868)等等。可选地,核酸可以通过同源重组在引入细胞内并整合至宿主细胞dna中用于表达。
[0154]
各种已知输送系统可用于施用本发明抗体、抗原结合片段或其衍生物或编码其的多核苷酸,例如包封于脂质体、微粒、微胶囊、能够表达所述化合物的重组细胞、受体介导的内吞作用(参见例如wu and wu,1987,j.biol.chem.262:4429-4432)、作为逆转录病毒或其
它载体的一部分的核酸的构建等。
[0155]
联合疗法
[0156]
在一些实施方案中,本发明抗cd73抗体或抗原结合片段可以结合其它治疗或预防方案,包括施用一种或多种本发明抗体或抗原结合片段,以及一种或多种其它治疗剂或方法一起使用或组合使用。在一些实施方案中,其他治疗方案包括但不限于放射疗法、化学疗法、激素疗法和手术疗法等。对于组合治疗,抗体可以与其它治疗剂可同时或分开施用。当分开施用时,可以在施用另一种其它治疗剂之前或之后施用本发明抗体或抗原结合片段。
[0157]
在一些实施方案中,本发明抗体或抗原结合片段可与化学治疗剂组合用于治疗癌症或肿瘤,化学治疗剂包括但不限于:喜树碱(camptothecin,cpt-11)、5-氟尿嘧啶(5-fu)、顺铂(cisplatin)、多柔比星(doxorubicin)、伊立替康(irinotecan)、紫杉醇(paclitaxel)、吉西他滨(gemcitabine)、顺铂、卡铂、蛋白酶体抑制剂(例如硼替佐米(bortezomib)或mg132)、bcl-2抑制剂(例如bh3i-2
′
(bcl-xl抑制剂)、吲哚胺双加氧酶-1(ido1)抑制剂(例如incb24360)、at-101(r-(-)-棉酚衍生物)、abt-263(小分子)、gx-15-070(奥巴克拉(obatoclax))、mcl-1(骨髓样白血病细胞分化蛋白-1)拮抗剂)、iap拮抗剂(例如smac7、smac4、小分子smac模拟物、合成smac肽)、hdac(组蛋白去乙酰酶)抑制剂、靶向vegf及vegfr的抗血管生成剂(例如阿瓦斯汀(avastin))、合成三萜、c-flip(细胞flice抑制蛋白)调节剂(例如pparγ(过氧化物酶体增殖物活化受体γ)的天然及合成配体)、激酶抑制剂(例如索拉菲尼(sorafenib))。
[0158]
在一些实施方案中,本发明抗体或抗原结合片段可与细胞毒性剂组合用于治疗癌症或肿瘤,细胞毒性剂包括但不限于:尿嘧啶氮芥、甲川氯(chlormethine)、环磷酰胺(cytoxantm)、异环磷酰胺、美法仑(melphalan)、苯丁酸氮芥、哌血生(pipobroman)、三乙烯三聚氰胺、三乙烯硫代磷酰胺、白消安(busulfan)、卡莫司汀(carmustine)、洛莫司汀(lomustine)、链脲霉素(streptozocin)、达卡巴嗪及替莫唑胺(temozolomide)。
[0159]
在一些实施方案中,本发明抗体或抗原结合片段可与抗代谢物组合用于治疗癌症或肿瘤,抗代谢物包括但不限于:甲氨蝶呤、5-氟尿嘧啶、氟尿苷、阿糖胞苷(cytarabine)、6-巯基嘌呤、6-硫鸟嘌呤、磷酸氟达拉滨(fludarabine phosphate)、喷司他丁(pentostatine)及吉西他滨。
[0160]
在一些实施方案中,本发明抗体或抗原结合片段可与抗增生剂组合用于治疗癌症或肿瘤,抗增生剂包括但不限于:多西他赛(docetaxel)、海绵内酯(ddm)、迪克他汀(dictyostatin,dct)、培洛赛德(peloruside)a、埃博霉素、埃博霉素a、埃博霉素b、埃博霉素c、埃博霉素d、埃博霉素e、埃博霉素f、呋喃埃博霉素d、去氧埃博霉素b1、海绵内酯、帕土匹龙(patupilone,epo-906)、ilx-651(盐酸泰丝多汀(tasidotin hydrochloride))、软海绵素(halichondrin)b、甲磺酸艾日布林(eribulin mesylate,e-7389)、哈米特林(hemiasterlin,hti-286)、萨托辛(cyrptophycin)、ly-355703、类美登素免疫偶联物(dm-1)、艾榴塞洛素(eleutherobin)、17β-乙酰氧基-2-乙氧基-6-侧氧基-b-均-雌甾-1,3,5(10)-三烯-3-醇、环链汀(cyclostreptin)、异劳力马来(isolaulimalide)和劳力马来。
[0161]
在一些实施方案中,本发明抗体或抗原结合片段可与共刺激受体的激动剂和/或t细胞上抑制信号的拮抗剂组合用于治疗癌症或肿瘤。激动剂或拮抗剂的靶点包括但不限于ctla-4、pd-1、pd-l1、pd-l2、lag-3、tim-3、抗半乳糖凝集素9抗体、vegf、btla、cd69、tigit、
cd113、gpr56、vista、2b4、cd48、garp、pd1h、lair1、tim-1、tim-4、cd39、b7-1、b7-2、cd28、4-1bb、4-1bbl、gitr、gitrl、ox40、ox40l、cd70、cd27、cd40、dr3和cd28h等。在一些实施方案中,可以与本发明抗体或抗原结合片段一起施用的抗体为利妥昔单抗、曲妥珠单抗、托西莫单抗(tositumomab)、替伊莫单抗(ibritumomab)、阿伦珠单抗、依帕珠单抗(eprtuzumab)、贝伐珠单抗(bevacizumab)、伊匹单抗(ipilimumab)、加利昔单抗(galiximab)、鲁卡木单抗(lucatumumab)、莫罗单抗(muromonab)。在一些实施方案中,本发明抗体或抗原结合片段可以与抗pd-1抗体一起施用,如nivolumabpembrolizumabtoripalimabsintilimabcamrelizumabcamrelizumabtislelizumabpenpulimabzimberelimabserplulimab或wo2020207432中披露的抗pd-1抗体等。
[0162]
药物组合物
[0163]
本发明还提供了药物组合物。这样的组合物包含有效剂量的抗cd73抗体或抗原结合片段,以及药学上可接受的辅料。在一些实施方案中,药物组合物包含0.1%-90%的抗cd73抗体或抗原结合片段。在一些实施方案中,药物组合物还包含抗癌剂(例如免疫检查点抑制剂)。
[0164]
在一些实施方案中,术语“药学上可接受的”是指由政府的监管机构批准的或公认药典中列出的用于动物,特别是用于人类的物质。此外,“药学上可接受的辅料”通常指是任何类型的无毒固体、半固体或液体填充剂、稀释剂、包封材料或制剂助剂等。
[0165]
术语“辅料”是指可以与活性成分一起施用于患者的稀释剂、佐剂、赋形剂或载体。这此类药物载体可以是无菌液体,如水和油,包括石油、动植物或合成来源的油,如花生油、大豆油、矿物油、芝麻油等。当药物组合物静脉内给药时,水是优选的载体。盐水溶液和葡萄糖水溶液和甘油溶液也可用作液体载体,特别是用于注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如有需要,组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂如乙酸盐、柠檬酸盐或磷酸盐。抗菌剂如苯甲醇或对羟基苯甲酸甲酯、抗氧化剂如抗坏血酸或亚硫酸氢钠、螯合剂如乙二胺四乙酸,以及调节张力的试剂如氯化钠或右旋葡萄糖也是可以预见的。这些组合物可以采取溶液、悬液、乳剂、片剂、丸剂、胶囊、散剂、缓释制剂等形式。该组合物可以用传统的粘合剂和载体如甘油三酯配制成栓剂。口服制剂可以包括标准载体,例如药物等级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载体的实例在e.w.martin的remington
′
s pharmaceutical sciences中有描述,在此通过引用并入本发明。此类组合物将含有临床有效剂量的抗体或抗原结合片段,优选以纯化后的形式,连同合适数量的辅料,以提供适合于患者的给药形式。该制剂应该适用于给药模式。亲本制剂可以封装在安瓿瓶、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
[0166]
在一些实施方案中,根据常规步骤将组合物配制成适合静脉内注射于人体的药物组合物。用于静脉内给药的组合物通常是在无菌等渗水性缓冲液中的溶液。组合物还可包含增溶剂和局部麻醉剂如利多卡因,从而缓解注射部位的疼痛。一般而言,有效成分以单位剂量形式单独供给或混在一起供给,如以干燥的冻干粉末或无水浓缩物的形式装在可指示活性剂份量的密封容器(如安瓿瓶或小袋)中。在通过输注施用组合物的情况下,可以用含
有无菌药用级水或盐水的输液瓶来分装组合物。在通过注射施用组合物的情况下,可以使用注射用的无菌水或盐水的安瓿瓶,使得可以在施用之前混合有效成分。
[0167]
本发明的化合物可以配制成中性的或盐的形式。药学上可接受的盐包括衍生自如盐酸、磷酸、乙酸、草酸、酒石酸等的与阴离子形成的盐,以及衍生自如钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙氨基乙醇、组氨酸、普鲁卡因等的与阳离子形成的盐。
具体实施方式
[0168]
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改或调整仍属于本发明的保护范围。
[0169]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0170]
实施例1噬菌体筛选
[0171]
采用全人源scfv噬菌体展示文库对抗原hcd73-biotin(acrobiosystems公司,货号为cd3-h82e3)进行筛选。筛选的方法为:将sa-磁珠(dynabeadstm myonetm streptavidin t1,货号为65602,thermo fisher scientific)与hcd73-biotin进行结合,室温2小时或者4℃过夜;将已封闭过的噬菌体展示库加入到pbs(磷酸盐缓冲液)清洗过的上述磁珠中,进行筛选,室温2小时或者4℃过夜;pbst(含0.05%tween-20的pbs缓冲液)洗涤15次,洗掉非特异性结合的噬菌体;使用胰酶室温消化30min,加入1/10体积fbs(胎牛血清)终止酶切反应,将消化后的噬菌体重新侵染至tg1菌种中扩增收集扩增后的噬菌体重复上述步骤3-5轮,第一轮抗原的浓度为10μg/ml,第二轮抗原的浓度为5μg/ml,第三轮抗原的浓度为1μg/ml;通过elisa检测最终富集得到的噬菌体克隆与抗原hcd73的结合,从而得到高亲和力特异性结合抗原cd73的噬菌体克隆最终筛选到4株噬菌体克隆(如图1所示)scfv(p59-l1)、scfv(p59-l6)、scfv(p59-l12)、scfv(p59-l17);然后通过测序技术得到噬菌体克隆的dna序列,即抗人cd73抗体(scfv)的核酸序列。其中,scfv中vh和vl序列由表1所示并通过连接子(g4s)3连接。
[0172]
全人源scfv噬菌体展示文库的构建方法为:通过聚合酶链式反应(polymerase chain reaction,pcr)扩增未免疫的人外周血淋巴细胞(peripheral blood lymphocytes,pbls)中vh基因和vl基因,再通过重叠聚合酶链式反应(overlapping polymerase chain reaction,overlap pcr)将重链vh与轻链vl随机组合成单链抗体(single chain fv,scfv);scfv通过酶切位点插入至phagemid载体中构建成phage库(库容大于10
11
),展示在噬菌体表面,用于抗体筛选(详见,sheets等人(1998)cell biology.95:6157-6162)。
[0173]
表1 scfv的组成
[0174]
scfv编号vh seq id no(序列号)vl seq id noscfv(p59-l1)1011scfv(p59-l6)1012scfv(p59-l12)1013scfv(p59-l17)1014
[0175]
实施例2抗体制备方法
[0176]
依据上述筛选的scfv(p59-l1)、scfv(p59-l6)、scfv(p59-l12)、scfv(p59-l17),
构建igg1型单抗:设计引物对筛选出的scfv中vh和vl的dna片段进行pcr,pcr产物采用双酶切(vh采用的限制位点内切酶为apai/mfei,vl采用的限制位点内切酶为hindiii/bsiwi)后,将片段分别链接到含igg1重链恒定区和含kappa轻链恒定区的pcdna3.1载体(购自invitrogen公司,v79020)中,测序确认序列正确后,将重链和轻链核酸序列进行序列优化(优化后的核酸序列见表6),将优化后的重链和轻链核酸序列分别链接到表达载体上,测序确认正确后,得到用于蛋白表达抗体的轻链质粒和抗体重链质粒。把对应的轻链质粒和重链质粒通过pei(聚醚酰亚胺)共转染hek293细胞(购自atcc)进行瞬时表达,培养7天后收集上清液,之后采用protein a柱(ge healthcare)的固定化金属亲和层析(imac)进行纯化,纯化后的抗体蛋白的纯度>95%。
[0177]
igg1-fc(即igg1的恒定区,包括ch1、铰链区、ch2和ch3)的制备方法为:含igg1-fc的pcdna3.1载体(购自invitrogen公司,v79020)通过pei共转染hek293细胞进行瞬时表达,培养7天后收集上清液进行纯化。
[0178]
无关抗体nr为特异性结合新冠病毒的抗体,其制备方法为:将对应的轻链质粒和重链质粒通过pei共转染至hek293细胞中进行瞬时表达,培养7天后收集上清液进行纯化。
[0179]
抗体nr的重链氨基酸序列(seq id no:30):
[0180]
evqlvqsgpevkkpgtsvkvsckasgftaslsavqwvrqargqrlewigwimpgsgntnyaqkfqervtitrdmststaymelsslrsedtavyycaapycsttlcndgfdiwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0181]
抗体nr的轻链氨基酸序列(seq id no:31):
[0182]
divltqspgtlslspgeratlscrasqsvsssylawyqqkpgqaprlliygassratgisdrfsgsgsgtdftltisrlepedfatyycqqyasspwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0183]
本实施例制备的抗cd73抗体包括抗体p59-l1、p59-l6、p59-l12、p59-l17,抗体实例相关的氨基酸序列和核酸序列见表2-6;表5中重链的fc区用单下划线标出。对纯化后抗体进行测序,测序结果与设计的序列相同。纯化后抗体用于亲和力检测和生物活性鉴定等。
[0184]
表2抗体的组成
[0185][0186]
表3抗cd73抗体的cdr区
[0187][0188][0189]
表4抗cd73抗体的可变区和恒定区
[0190][0191]
表5抗cd73抗体的重链和轻链
[0192][0193][0194]
表6抗cd73抗体相关核酸序列
[0195]
[0196][0197]
实施例3抗体亲和力的测定
[0198]
采用biacore t200表面等离子体共振仪测定抗体的亲和力常数(kd),主要试验过程如下(可参考biacore t200的标准操作规程):将hcd73-his(北京义翘神州科技股份有限公司,catalog为10904-h08h)样品采用hbs-ep缓冲液(150mm nacl,3mm edta,0.005%(v/v)表面活性剂p-20,和10mm hepes,ph 7.4)梯度稀释(初始浓度为32nm,然后2倍稀释);将抗体采用醋酸钠溶液(10mm,ph5.5)分别稀释至最终浓度约为20μg/ml;使用biacoret200,
protein a芯片(ge healthcare,货号为29127556)进行检测,仪器设置如下:抗体捕获结合时间(contact time)为180s,流速为30μl/min;样品结合时间(contact time)为120s,解离时间(dissociation time)为300s,流速为30μl/min;再生(regeneration)条件为:glycine-hcl(ph值为2.5),再生时间为60s,流速为30μl/min。采用数据分析软件evaluation software3.1对试验结果进行分析,将样品实验流路采集所得传感信号进行参比流路、样品空白双扣减,并选用动力学
″
1∶1
″
模型进行拟合,得出动力学参数(ka为结合速率,kd为解离速率;kd为结合解离平衡常数)。
[0199]
如表7所示,抗体(p59-l1、p59-l6、p59-l12、p59-l17)与hcd73-his具有良好的结合能力;尤其是抗体p59-l17。
[0200]
表7抗cd73抗体与hcd73-his结合的亲和力常数
[0201]
抗体ka(1/ms)kd(1/s)kd(m)p59-l17.26e 055.57e-037.67e-09p59-l61.07e 051.98e-041.85-09p59-l128.27e 056.8e-038.25e-09p59-l172.21e 051.26e-045.69e-10
[0202]
实施例4抗体与不同种属cd73结合情况的检测
[0203]
采用elisa的方法进行检测:先用2μg/ml的人源hcd73-his(北京义翘神州科技股份有限公司,catalog为10904-h08h)、食蟹猴ccd73-his(近岸生物,catalog为cd3-c52h9)或鼠源mcd73-his(近岸生物,catalog为cd3-m52h9)包被96孔elisa板,4℃过夜;用含5%bsa(牛血清白蛋白)的pbs缓冲液封闭2小时;封闭结束后,用含0.05%tw-20的pbs洗涤,之后加入用含0.05%tw-20和0.5%bsa的pbs稀释的抗体溶液(抗体的初始浓度为4μg/ml,3倍稀释,10个梯度);37℃孵育1小时;洗板后,加入hrp(辣根过氧化物酶)标记的二抗anti-h-kappa-hrp(购自sigma,货号为a7164)孵育1h;洗板,加入tmb(四甲基联苯胺)显色液进行显色读取od450。
[0204]
如表8所示,抗体p59-l17与人、食蟹猴cd73进行良好地结合,与小鼠cd73不结合。
[0205]
表8抗体p59-l17与cd73-his结合的ec
50
(ng/ml)
[0206]
抗体hcd73-hisccd73-hismcd73-hisec
50
33.942.7na
[0207]
na表示不结合或基本不结合。
[0208]
实施例5抗体与表达cd73细胞的结合力的检测
[0209]
mda-mb-231细胞为人乳腺癌细胞,其细胞膜表面高表达cd73蛋白(https://www.proteinatlas.org/ensg00000101017-cd40/cell)。本实施例采用mda-mb-231细胞用于检测抗cd73抗体与细胞膜表面cd73分子的结合能力。
[0210]
试验方法为:培养状态良好的mda-mb-231细胞收集离心后用同型对照igg1-fc(浓度为10ug/ml,单浓度点)或梯度稀释的抗cd73抗体(初始浓度为10 ug/ml,2倍稀释,8个浓度梯度)进行孵育;30min后离心洗去上清,用pbs缓冲液洗涤一次,pbs缓冲液重悬加入荧光标记的抗人igg流式抗体anti-humanfc-pe(购自invitrogen,货号为12-4998-82);孵育30min后离心洗去上清,pbs缓冲液洗涤两次,pbs缓冲液重悬细胞后进行流式检测,统计mfi并用softmax pro处理数据。
[0211]
如表9所示,抗体p59-l17结合mda-mb-231细胞,而阴性对照igg1-fc与mda-mb-231细胞不结合。
[0212]
表9抗体与mda-mb-231细胞结合的ec
50
(ng/ml)
[0213]
抗体p59-l17igg1-fcec
50
438.1na
[0214]
实施例6抗体抑制细胞膜上cd73的活性
[0215]
检测试剂盒(购自promega,货号为g7570)的检测原理为:过量amp能够抑制atp依赖性的检测试剂发荧光,而细胞膜cd73能够分解amp从而解除amp的抑制作用抗cd73抗体能够抑制cd73酶活性从而保持amp对荧光发光过程的抑制,最终表现为:随着抗体浓度的提高,荧光强度相应地减弱。本实施例检测抗cd73抗体对细胞膜cd73酶活性的抑制情况。
[0216]
试验方法为:用含10%fbs的dmem培养基将生长状态良好的mda-mb-231细胞以2.5
×
104cells/孔铺于96孔细胞培养平板,置于37℃细胞培养箱培养过夜;第二天去掉培养基上清,加入无血清dmem梯度稀释的抗体溶液(初始浓度为5ug/ml,2倍稀释,8个浓度梯度)和终浓度为600μm的amp,置于37℃细胞培养箱反应3小时;反应结束后取上清50μl每孔于96孔白板中,加入50μl浓度为200μm的atp,最后加入100μl检测试剂,立即在酶标仪读取荧光值。
[0217]
如图2所示,随着抗体p59-l17浓度的提高,荧光强度相应地减弱,即抗体p59-l17浓度梯度依赖地抑制cd73的酶活性,其ic
50
为126.8ng/ml;而阴性对照igg1-fc对cd73酶活性基本没有影响。
[0218]
实施例7流式检测外周血的t细胞和b细胞中cd73的表达
[0219]
部分t细胞和b细胞会表达cd73,且cd73参与了淋巴细胞活性。本实施例为探索cd73在外周血的t细胞和b细胞的表达情况而进行流式检测。
[0220]
试验方法为:抽取健康成年人外周血,采用淋巴分离液(购自北京达科为生物技术有限公司,货号为7912011)分离得到新鲜的pbmc(外周血单核细胞);于冰上,先用1mg/ml无关抗体igg1(抗体nr)封闭pmbc的fc受体30min;离心洗去封闭液后加入10μg/ml生物素标记的抗cd73抗体或生物素标记的igg1-fc,冰上孵育30min;离心洗去上清,加入荧光标记的链霉亲和素sa-pe(购自invitrogen,货号为21627)和anti-cd3-apc(购自elabscience,货号为fw2671)或anti-cd19-apc(购自elabscience,货号为fw1075)流式二抗,冰上孵育30min,离心洗细胞两次后进行流式检测cd3
t细胞和cd19
b细胞上的cd73表达情况。
[0221]
如图3a所示,表达cd73的t细胞阳性率达47%;如图3b所示,表达cd73的b细胞阳性率达80%。
[0222]
实施例8抗体解除amp对t细胞增殖的抑制
[0223]
cd73呈阳性的t细胞的细胞膜上cd73可将胞外的amp分解为腺苷,而腺苷通过与t细胞上的腺苷受体结合从而介导免疫抑制,抑制t细胞增殖及细胞因子的分泌。本实施例检测抗cd73抗体解除amp对t细胞增殖抑制的功能。
[0224]
试验方法为:抽取健康成年人外周血,采用淋巴分离液分离得到新鲜的pbmc(外周血单核细胞),在含10%fbs的rpmi-1640培养基(购于gibco公司)中加入cd3/cd28抗体偶联磁珠(北京同立海源生物科技有限公司,catalog为tl-601)刺激培养pbmc;第二天加入
100iu/ml il2进行扩增培养,扩增培养6天后得到纯度较高的cd3
t细胞,用磁力架去除培养基中的磁珠并离心洗涤细胞两次;将t细胞以2.5
×
104cells/孔铺于96孔细胞培养板中,加入梯度稀释的抗cd73抗体溶液或阴性对照igg1-fc(初始浓度为1ug/ml开始,3倍稀释,7个浓度梯度),同时每孔加入终浓度为300μm的amp,96孔板置于培养箱培养72h;细胞培养结束后将细胞培养板离心,弃尽培养上清,加入检测试剂检测t细胞增殖情况。
[0225]
如图4所示,抗体p59-l17呈浓度梯度依赖地解除amp对t细胞增殖的抑制。
[0226]
实施例9抗cd73抗体上调b细胞激活cd69的表达
[0227]
除了通过抑制cd73酶活性从而阻断腺苷受体介导的免疫抑制,抗cd73抗体具有上调b细胞激活marker表达的功能。本实施例检测了抗cd73抗体上调b细胞激活marker cd69表达的能力。
[0228]
试验方法为:抽取健康成年人外周血,采用淋巴分离液分离得到新鲜的pbmc,用含10%fbs的rpmi-1640培养基培养pbmc,加入抗cd73抗体或igg1-fc,过夜培养;第二天将细胞离心去上清,加入cd19-apc(购自elabscience,货号为fw1075)和cd69-pe(购自elabscience,货号为e-ab-f1138d)流式二抗,冰上孵育30min后进行检测,对cd19
b细胞上的cd69的表达情况进行分析。
[0229]
如图5所示,抗体p59-17显著提高了b细胞激活表达cd69的表达。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。