一种特异性识别baff-r的嵌合抗原受体分子及其应用
1.对ascii文本形式序列表的提交
2.以下ascii文本文件提交内容的全部内容通过引用并入本文:序列表的计算机可读形式(crf)(文件名:tpf02324-sequence listing.txt,记录日期:2022年5月12日,大小:12kb)。
技术领域
3.本技术涉及一种工程化的特异性抗原识别受体分子及包含所述受体分子的工程化免疫效应细胞。
背景技术:
4.最近几十年来,传统的肿瘤治疗方法(外科手术、化学治疗、放射治疗等)取得了很大的进步,但是在生存率、复发和转移等方面仍存在巨大的挑战。随着肿瘤生物学和免疫学研究的快速发展,近年来,免疫治疗逐步成为肿瘤治疗的新星。其中,嵌合抗原受体t细胞(chimeric antigen receptor t-cell,car-t)疗法成为目前最有发展前景的肿瘤免疫疗法之一。
5.t淋巴细胞在肿瘤免疫应答中起主要作用,对肿瘤细胞有极强的杀伤能力,但其作用的发挥具有mhc限制性。利用基因工程的方法将非mhc限制性方式识别目标抗原的单链抗体与铰链区、跨膜结构域和t细胞的活化基序等连接组装成car结构,并借助病毒等载体将car结构整合入t细胞,最终使t细胞能特异性结合肿瘤细胞表面相关抗原而被激活,即为car-t。car-t一方面通过释放穿孔素、颗粒酶素b等直接杀伤肿瘤细胞;另一方面,活化的car-t进一步释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,达到有效抑制肿瘤的目的;同时,还可形成免疫记忆t细胞,获得特异性的抗肿瘤长效机制。
6.一般而言,嵌合抗原受体由胞外结构域、跨膜结构域和活化刺激结构域组成。通常,胞外结构域由抗原识别结构域及一段起连接作用的铰链区(hinge)构成。抗原识别结构域是car特异性结合肿瘤抗原的基础,其主要结构是scfv,通常由单克隆抗体的轻链(vl)和重链(vh)通过多肽连接而成,保留有抗体对抗原的特异性和亲和力。铰链区连接scfv和跨膜结构域,大多数car的铰链区由igg的铰链或cd8α/cd28胞外区衍变而来。跨膜结构域将car的胞外结构域与胞内的活化刺激结构域连接,并将受体锚定到t细胞膜上,常用的跨膜结构域包括来源于cd4,cd8α,cd28和cd3ζ的跨膜结构域。活化刺激结构域由胞内共刺激结构域和信号转导结构域组成,共刺激结构域通常来自cd28受体家族(cd28,icos)或肿瘤坏死因子受体家族(4-1bb、ox40、cd27),而信号转导结构域通常为t细胞受体tcr/cd3ζ链,含有免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs,itams)。活化刺激结构域在介导t细胞信号传递直至t细胞活化增殖从而最终完成杀伤肿瘤的过程中起着关键作用。
7.b细胞恶性肿瘤为高发恶性肿瘤,全球每年新病发患者约30万人,年增长率5%-7%。嵌合抗原受体t细胞(car-t)已广泛应用于治疗b细胞恶性肿瘤,以cd19为靶点的car-t
细胞疗法对难治性b细胞恶性肿瘤有很好的疗效,在急性淋巴细胞性白血病(all)和各种非霍奇金淋巴瘤亚型患者中的应答率高达80%-90%。然而,只有大约40%到50%的患者具有长期疗效,大约30%的患者中会发生cd19表达下调/阴性复发。不管是基因修饰造成的cd19表达量下调,甚至完全丢失,或者剪切成其它形式,造成cd19 car-t细胞的无法识别等都给cd19 car-t治疗带来了极大挑战。虽然近年来伴随着免疫治疗和靶向药的突破,b细胞恶性肿瘤的临床预后得到了巨大的改善,但是高复发率仍旧是个难题。因此,探索高表达于b细胞表面的其他抗原靶点,是目前解决复发及难治型b细胞恶性肿瘤的重要研究方向。
8.肿瘤坏死因子(tumor necrosis factor,tnf)超家族成员之一的b淋巴细胞刺激因子(b lymphocyte stimulator,简称blys),又名tnf及凋亡配体相关白细胞表达配体1(tnf-and apol related leukocyte-expressed ligand 1,tall-1),激活细胞凋亡,核因子κb和c-jun氨基端激酶的tnf同源因子(tnf homologue that activates apoptosis,nuclear factor-κb and c-jun nh2-terminal kinase,thank),肿瘤超家族成员13b(tnf superfamily member 13b,tnfsf13b),b细胞刺激因子(b cell-activating factor,baff)以及ztnf4,属于ii型跨膜蛋白,能特异地与b细胞结合,对b细胞的存活、增殖、发育和分化等起着关键的作用。baff有三种受体,分别是baff受体(baff receptor,baff-r)、b细胞成熟抗原(b cell maturation antigen,bcma)和跨膜激活、钙调和亲环素配基相互作用因子(tnfr homology transmembrane activator and calcium modulator and cyclophilin ligand intergrator,taci),均为iii型跨膜蛋白。bcma和taci不仅能与baff相结合,也能与tnf配体家族的另一成员增殖诱导配体(a proliferation-inducing ligand,april)相结合,而baff-r是baff的特异性受体,在b淋巴细胞的调控方面比其他两种受体发挥着更重要的作用。
9.baff-r(b-cell activating factor receptor,b细胞活化因子受体),又名肿瘤坏死因子超家族成员13c(tumor necrosis factor receptor superfamily member 13c,tnfrsf13c),是b细胞膜上的tnf受体超家族(tumor necrosis factor receptors,tnfr)成员之一,是缺少信号肽的iii型跨膜蛋白。已公开的人baff-r氨基酸序列全长184个氨基酸,其中1-78位氨基酸为胞外区,79-99位氨基酸为跨膜结构域,100-184位氨基酸为胞内区,其编码基因位于染色体22q13.1区。baff-r主要表达于b细胞,通过激活nf-k
b通路促进b细胞存活和增殖,在多种b细胞恶性肿瘤细胞表面高表达。
10.baff-baff-r信号通路的失衡会引起机体免疫失衡,包括由baff-r在异常或正常细胞异常高表达引起的一系列病变,比如自身免疫性疾病、移植物抗宿主疾病和肿瘤等。该靶点覆盖在b细胞成熟过程中较广泛的阶段,可以靶向除浆细胞病变(多发性骨髓瘤)以外的所有b细胞恶性疾病,适用范围广,且该靶点不表达在干细胞和b祖细胞,因此不会永久伤害正常b细胞的恢复和功能重建,具有良好的安全性。
11.伴随着免疫治疗和靶向药物的突破,b细胞恶性肿瘤的临床预后得到了巨大的改善,但是高复发率仍旧是个难题。因此,需要探索高表达于b细胞表面的其他抗原靶点和治疗药物,以期解决复发及难治型b细胞恶性肿瘤。
12.发明概述
13.本技术针对由b细胞baff-baff-r信号通路失衡引起的疾病,例如b细胞恶性肿瘤,提供了一种特异性识别baff-r的嵌合抗原受体分子(car分子)和工程化免疫效应细胞(例
如嵌合抗原受体t细胞(car-t))。通过研究证明,本技术的靶向baff-r的嵌合抗原受体t细胞对肿瘤细胞有极强的杀伤作用和体内抑瘤作用,具有开发潜力。
14.具体地,本技术涉及:
15.1.一种特异性识别baff-r的嵌合抗原受体分子,包含特异性识别结构域及活化刺激结构域,以及位于所述特异性识别结构域和活化刺激结构域之间的跨膜结构域,其中,所述特异性识别结构域包含选自seq id no:6、seq id no:7、seq id no:8、seq id no:10、seq id no:11、seq id no:12的氨基酸序列或与它们具有约70%以上序列同一性的氨基酸序列,例如与它们具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
16.2.项1的特异性识别baff-r的嵌合抗原受体分子,所述特异性识别结构域包含:
17.重链可变区,所述重链可变区包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列;以及
18.轻链可变区,所述轻链可变区包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
19.在一些实施方案中,本技术涉及一种特异性识别baff-r的嵌合抗原受体分子,包含特异性识别结构域及活化刺激结构域,以及位于所述特异性识别结构域和活化刺激结构域之间的跨膜结构域,其中,所述特异性识别结构域包含重链可变区和轻链可变区,其中,所述重链可变区包含三个互补决定区cdr h1、cdr h2和cdr h3,并且所述cdr h1包含seq id no:6所示的氨基酸序列,所述cdr h2包含seq id no:7所示的氨基酸序列,所述cdr h3包含seq id no:8所示的氨基酸序列;所述轻链可变区包含cdr l1、cdr l2和cdr l3,并且所述所述cdr l1包含seq id no:10所示的氨基酸序列,所述cdr l2包含seq id no:11所示的氨基酸序列,所述cdr l3包含seq id no:12所示的氨基酸序列。所述cdr h1、cdr h2、cdr h3以及cdr l1、cdr l2、cdr l3是依照kabat等(kabat et al.,sequences of proteins of immunological interest,fifth edition,nih publication 91-3242,bethesda md(1991),vols.1-3)确定的。
20.3.根据项2的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区和轻链可变区还进一步包含人抗体骨架区。在一些实施方案中,所述人抗体骨架区为人通用骨架区。在一些实施方案中,所述人通用骨架区包含vl的kappa i亚组(κi subgroup)骨架区序列和vh的iii亚组(vh iii subgroup)骨架区序列。所述骨架区序列是依照kabat等(kabat et al.,sequences of proteins of immunological interest,fifth edition,nih publication 91-3242,bethesda md(1991),vols.1-3)确定的。在一些实施方案中,所述人通用骨架区包含1-15,1-10,2-9,3-8,4-7或5-6个氨基酸的变化。
21.4.根据项2或3的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区包含如seq id no:5中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列;以及所述轻链可变区包含如seq id no:9中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以
上序列同一性的氨基酸序列。
22.5.根据项4的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区与所述轻链可变区相连接(例如通过肽链连接,所述肽链例如由(g)n(s)m组成的连接子或接头,其中n或m可为1-10之间的任一整数)形成scfv,所述scfv包含如seq id no:4所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
23.6.根据项1-5中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述活化刺激结构域包含含有免疫受体酪氨酸活化基序的信号转导结构域。
24.7.根据项6中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述信号转导结构域源自cd3ζ、cd3γ、cd3δ、cd3ε、fcεriγ、fcεr1β、cd79α、cd79β、fcγriia、dap10、或dap12分子的胞内区。在一些实施方案中,所述信号转导结构域包含cd3ζ、cd3γ、cd3δ、cd3ε、fcεriγ、fcεr1β、cd79α、cd79β、fcγriia、dap10或dap12分子胞内区的信号转导结构域,或保有其相同功能的变体。在一些实施方案中,所述信号转导结构域包含cd3ζ或fcεriγ的胞内区的信号转导结构域,或保有其相同功能的变体。
25.8.根据项7中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述信号转导结构域包含如seq id no:20所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
26.9.根据项6-8中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述活化刺激结构域进一步包含一个、两个或更多个共刺激结构域。在一些实施方案中,所述共刺激结构域源自cd28受体家族或肿瘤坏死因子受体家族的共刺激结构域。
27.10.根据项9中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述共刺激结构域包含如下的一种或多种分子的胞内区:cd27、cd28、4-1bb、ox40、cd30、cd40、cd2、lfa-1、light、nkg2c、b7-h3、pd-l、icos、cds、icam-1、gitr、baffr、lightr、slamf7、cd7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-l、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-l、itgb7、tnfr2、trance/rankl、dnaml、slamf4、cd84、cd96、ceacam1、crtam、cd229、cd160、psgl1、cd100、cd69、slamf6、slamf1、slamf8、cd162、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、与cd83特异性结合的配体,及它们保有相同功能的变体;优选地为4-1bb胞内区、cd28胞内区、ox40胞内区的共刺激结构域,或它们保有相同功能的变体。
28.11.根据项10中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述共刺激结构域包含如seq id no:18所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
29.12.根据项1-11中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域包含选自下组分子的跨膜结构域或其保有相同功能的变体:tcrα、tcrβ、tcrγ、cd3ζ、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd28、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、lfa-l、icos(cd278)、4-1bb、ctla-4、gitr、
cd40、baffr、lightr、slamf7、nkp80、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49α、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、itgb7、tnfr2、cd226、slamf4、cd84、cd96、ceacam1、crt am、cd229、cd160、psgl1、cdioo、slamf6、slamf1、slamf8、cd162、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d、nkg2c;优选地为cd4、cd8α、cd28、cd3ζ、pd1、或4-1bb的跨膜结构域或其保有相同功能的变体。
30.13.根据项12所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域包含cd8α的跨膜结构域或其保有相同功能的变体。在一些实施方案中,所述跨膜结构域包含如seq id no:16中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
31.14.根据项1-13中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域与所述特异性识别结构域直接连接。
32.15.根据项1-13中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域与所述特异性识别结构域之间通过铰链区相连接。在一些实施方案中,所述铰链区包含选自下组的氨基酸序列:人cd8α或抗体的fc片段或其功能等效物、片段或衍生物,人cd8α或抗体的铰链区或其功能等效物、片段或衍生物,抗体的ch2区,抗体的ch3区,人工间隔序列以及它们的组合。在一些实施方案中,所述铰链区包含igg、igd、cd8α或cd28的铰链区氨基酸序列,或其保有相同功能的变体。
33.16.根据项15所述的特异性识别baff-r的嵌合抗原受体分子,其中所述铰链区包含如seq id no:14中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
34.17.根据项1-16中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其进一步包含一段信号肽,所述信号肽选自任意分泌蛋白或膜蛋白的信号肽序列。在一些实施方案中,所述信号肽序列为cd8α的信号肽。
35.18.根据项17中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述信号肽序列包含如seq id no:2中的氨基酸序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
36.19.编码如项1-18中任一项所述特异性识别baff-r的嵌合抗原受体分子的核酸分子。
37.20.根据项19所述的核酸分子,其包含如seq id no:3所示的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。在一些实施方案中,所述核酸分子包含由seq id no:3中的核苷酸序列针对特定细胞或组织进行密码子优化后得到的核苷酸序列。
38.21.根据项要求19或20所述的核酸分子,其包含膜定位信号肽分子的编码序列。在一些实施方案中,所述膜定位信号肽分子的编码序列包含如seq id no:1所示的多核苷酸
序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。
39.22.根据项21中所述的核酸分子,其从5’端到3’端依次包含如下所述的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列:seq id no:1、seq id no:3、seq id no:13、seq id no:15、seq id no:17和seq id no:19。
40.23.一种工程化免疫效应细胞,其包含如项1-18中任一项所述的特异性识别baff-r的嵌合抗原受体分子或如项19-22中任一项所述的核酸分子。
41.24.根据项23中所述的工程化免疫效应细胞,其中所述工程化免疫效应细胞为car-t和/或car-nk细胞。
42.25.一种特异性识别baff-r的工程化t细胞受体,其包含选自seq id no:6、seq id no:7、seq id no:8、seq id no:10、seq id no:11、seq id no:12的氨基酸序列或与它们具有约70%以上序列同一性的氨基酸序列,例如与它们具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
43.26.根据项25中所述的t细胞受体,其包含α链可变区(vα)和β链可变区(vβ),其中:
44.所述vα包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列,且所述vβ包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;
45.或所述vβ包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列,且所述vα包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列。
46.27.编码如项25或26所述t细胞受体的核酸分子。
47.28.一种工程化免疫效应细胞,其包含如项25或26的t细胞受体和/或如项27所述的核酸分子。
48.29.根据项28中所述的工程化免疫效应细胞,其中所述工程化免疫效应细胞为tcr-t细胞。
49.30.一种药物组合物,其包含治疗有效量的如项1-18中任一项所述的特异性识别baff-r的嵌合抗原受体分子或如项25或26所述的t细胞受体、如项19-22或项27中任一项所述的核酸分子、或如项23、24、28或29中所述的工程化免疫效应细胞。
50.31.一种治疗或预防有需要的受试者的疾病的方法,所述方法包括向受试者施用如项30所述的药物组合物,所述疾病选自由b细胞baff-baff-r信号通路失衡引起的疾病。
51.32.项31的方法,其中所述疾病包括:自身免疫性疾病、移植物抗宿主疾病和肿瘤。
52.本技术的示例性实施方案还包含:
53.1.一种特异性识别baff-r的嵌合抗原受体分子,包含特异性识别结构域及活化刺激结构域,以及位于所述特异性识别结构域和活化刺激结构域之间的跨膜结构域,其中,所述特异性识别结构域包含重链可变区和轻链可变区,其中,
54.所述重链可变区包含三个互补决定区cdr h1、cdr h2和cdr h3,并且cdr h1包含seq id no:6所示的氨基酸序列,cdr h2包含seq id no:7所示的氨基酸序列,cdr h3包含seq id no:8所示的氨基酸序列;
55.所述轻链可变区包含cdr l1、cdr l2和cdr l3,并且所述cdr l1包含seq id no:10所示的氨基酸序列,cdr l2包含seq id no:11所示的氨基酸序列,cdr l3包含seq id no:12所示的氨基酸序列。
56.2.根据项1的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区和轻链可变区还进一步包含人抗体骨架区。
57.3.根据项1或2的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区包含如seq id no:5所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列;以及所述轻链可变区包含如seq id no:9所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
58.4.根据项3的特异性识别baff-r的嵌合抗原受体分子,其中所述重链可变区与所述轻链可变区连接形成scfv,所述scfv包含如seq id no:4所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
59.5.根据项1-4中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述活化刺激结构域包含信号转导结构域,所述信号转导结构域含有免疫受体酪氨酸活化基序。
60.6.根据项5中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述信号转导结构域包含cd3ζ、cd3γ、cd3δ、cd3ε、fcεriγ、fcεr1β、cd79α、cd79β、fcγriia、dap10或dap12分子胞内区的信号转导结构域,或保有其相同功能的变体。
61.7.根据项6中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述信号转导结构域包含如seq id no:20所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
62.8.根据项5-7中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述活化刺激结构域进一步包含一个、两个、三个或更多个共刺激结构域。
63.9.根据项8中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述共刺激结构域来自如下的一种或多种分子的胞内区:cd27、cd28、4-1bb、ox40、cd30、cd40、cd2、lfa-1、light、nkg2c、b7-h3、pd-l、icos、cds、icam-1、gitr、baffr、lightr、slamf7、cd7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-l、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-l、itgb7、tnfr2、trance/rankl、dnaml、slamf4、cd84、cd96、ceacam1、crtam、cd229、cd160、psgl1、cd100、cd69、slamf6、slamf1、slamf8、cd162、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、及与cd83特异性结合的配体。
64.10.根据项9中所述的特异性识别baff-r的嵌合抗原受体分子,其中所述共刺激结构域包含如seq id no:18所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
65.11.根据项1-10中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域包含选自下组的跨膜结构域或其保有相同功能的变体:cd4、cd8α、cd28或cd3ζ的跨膜结构域。
66.12.根据项11所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构
域包含如seq id no:16所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
67.13.根据项1-12中任一项所述的特异性识别baff-r的嵌合抗原受体分子,其中所述跨膜结构域与所述特异性识别结构域之间通过铰链区相连接,所述铰链区选自igg、igd、或cd8α/cd28的铰链区。
68.14.根据项13所述的特异性识别baff-r的嵌合抗原受体分子,其中所述铰链区包含如seq id no:14所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列。
69.15.编码如项1-14中任一项所述特异性识别baff-r的嵌合抗原受体分子的核酸分子。
70.16.根据项15所述的核酸分子,其包含如seq id no:3所示的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列。
71.17.根据项要求15或16所述的核酸分子,其进一步包含膜定位信号肽分子的编码序列。
72.18.根据项17中所述的核酸分子,其中所述膜定位信号肽分子的编码序列包含如seq id no:1所示的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列。
73.19.根据项18中所述的核酸分子,其从5’端到3’端依次包含如下所述的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列:seq id no:1、seq id no:3、seq id no:13、seq id no:15、seq id no:17和seq id no:19。
74.20.一种工程化免疫效应细胞,其包含如项1-14中任一项所述的特异性识别baff-r的嵌合抗原受体分子和/或如项15-19中任一项所述的核酸分子。
75.21.根据项20中所述的工程化免疫效应细胞,其中所述工程化免疫效应细胞为car-t细胞。
76.22.一种药物组合物,其包含治疗有效量的如项1-14中任一项所述的特异性识别baff-r的嵌合抗原受体分子、如项15-19中任一项所述的核酸分子、和/或如项20或21中所述的工程化免疫效应细胞。
77.23.一种治疗或预防有需要的受试者的疾病的方法,所述方法包括向受试者施用如项22所述的药物组合物,其中,所述疾病选自由b细胞baff-baff-r信号通路失衡引起的疾病。
78.24.项23的方法,其中所述疾病包括:自身免疫性疾病、移植物抗宿主疾病和肿瘤。
79.本技术提供的特异性识别baff-r的嵌合抗原受体分子,可特异性识别并结合baff-r后激活下游信号通路,引起、促进或提升针对baff-r的免疫应答反应,例如在体外或体内特异性杀伤表达baff-r的靶细胞,最终达到治疗或预防由b细胞baff-baff-r信号通路失衡引起的疾病的目的。
附图说明
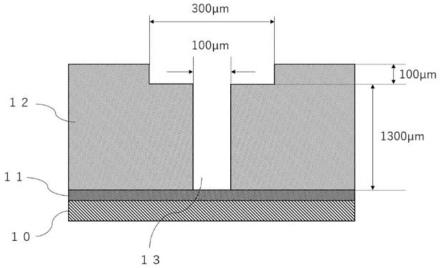
80.图1为本发明baff-r的嵌合抗原受体的结构示例。
81.图2为示例性的抗baff-r的嵌合抗原受体慢病毒表达载体pcdh-ef1a-h90-11car-4-1bb-egfrt的质粒图谱。
82.图3为作为对照的慢病毒表达载体pcdh-ef1a-egfrt-at-free(delete t2a)的质
粒图谱。
83.图4为使用fitc-egfrt抗体检测car阳性率的流式检测结果。
84.图5为使用baff-r蛋白检测car阳性率的流式检测结果。
85.图6为h90-11 car-t细胞特异性杀伤nalm6-荧光素酶靶细胞的结果图。
86.图7a-7b为h90-11 car-t细胞与nalm6-荧光素酶靶细胞共培养后上清中il-2(图a)和ifn-γ(图b)的分泌结果图。
87.图8a-8c为h90-11 car-t在小鼠体内的抗肿瘤效果图。其中图8a为在不同时间点小鼠体内活体成像结果图;图8b为绘制的在不同时间点小鼠体内绝对发光量曲线图;图8c为绘制的在22天时间内小鼠体重变化曲线图。
88.发明详述
89.为进一步改善和提升b细胞恶性肿瘤的治疗效果,本技术针对在b细胞表面特异性高表达的baff-r蛋白设计了一种新型的识别baff-r的嵌合抗原受体分子,并提供了编码所述受体的核酸分子、包含所述受体的工程化免疫效应细胞、药物组合物,及其用途,用于治疗或预防由b细胞baff-baff-r信号通路失衡引起的疾病例如b细胞恶性肿瘤的目的。
90.定义
91.为了解释本说明书的目的,将应用以下定义,并且在适当时,单数形式使用的术语也将包括复数形式,反之亦然。如果以下提出的任何定义与通过引用并入本文的任何文件相冲突,则以提出的定义为准。
92.如本文所用,“受体”是指能够同激素、神经递质、药物或细胞内信号分子等结合并能引起细胞功能变化的生物大分子。根据受体在细胞中的位置,受体可分为细胞膜受体和细胞内受体两大类。受体本身至少含有两个活性部位:一个是识别并结合配体的活性部位(在本技术中称为“特异性识别结构域”);另一个是负责产生应答反应的功能活性部位(在本文中称为“活化刺激结构域”)。所述活化刺激结构域只有在所述受体与配体结合形成二元复合物并变构后才能产生应答反应,由此启动一系列的生化反应,最终导致所述受体所在的效应细胞产生生物效应。如本文所用,所述“活化刺激结构域”包含信号转导结构域,或包含一个或多个信号转导结构域和一个或多个共刺激结构域。在本文中,如非特别指出,“信号转导结构域”提供活化淋巴细胞,例如活化t细胞或nk细胞的第一信号,而“共刺激结构域”提供活化淋巴细胞的第二信号。在一些实施方案中,在所述抗原识别区与所述活化刺激结构域之间还进一步包含跨膜结构域。在一些实施方案中,所述抗原识别区与跨膜结构域之间通过铰链区相连接。
93.如本文所用,“胞内结构域”与“胞内区”可互换使用,可指受体分子位于胞内并在受体与配体结合后起信号转导作用的结构域。
94.如本文所用,“嵌合抗原受体(car)”是一类工程化的细胞表面受体,一般表达在免疫细胞上,介导工程化免疫细胞针对特定靶点肿瘤细胞或其他病变细胞的杀伤。作为一种受体,car同样也包含了特异性识别结构域和活化刺激结构域。car的特异性识别结构域可特异性识别抗原,因此又称为抗原识别区。通常car的抗原识别区位于细胞膜外。在一些实施方案中,所述抗原识别区是ig的单链可变片段(scfv),“scfv”包含ig的一个重链可变区(vh)和一个轻链可变区(vl)。在一些特定的实施方案中,所述vl和vh区通过一条肽链连接在一起。
95.术语“重链”(“ch”)、“轻链”(“cl”)、“轻链可变区”(“vl”)、“重链可变区”(“vh”)、“骨架区”(“framework region,fr”)是指天然存在的免疫球蛋白中的结构域和合成的(例如重组的)结合蛋白(例如人源化抗体)的相应结构域。天然存在的免疫球蛋白(例如igg)的基本结构单元是具有两个轻链和两个重链的四聚体。每条链的氨基端(“n”)部分包括约100至110或更多个氨基酸的可变区,主要负责抗原识别。每条链的羧基端(“c”部分)定义一个恒定区,轻链具有单个恒定结构域,重链通常具有三个恒定结构域和一个铰链区。因此,天然存在的轻链结构igg分子是n-vl-cl-c,igg重链的结构是n-vh-ch1-h-ch2-ch3-c(其中h是铰链区)。其中ch1,ch2和ch3是抗体重链恒定区的组成部分,ch3区域涉及到细胞膜表面受体结合,ch2涉及补体激活途径,是补体结合位点,ch1具有ig同种异型遗传标志。igg的可变区由互补决定区(cdr)和非cdr片段(称为骨架区)组成。其中,cdr包含与抗原接触的残基,骨架区用于维持可变区结构并决定cdr环的位置。因此,vl和vh结构域具有以下结构:n-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4-c。
96.在一些实施方案中,所述特异性识别结构域为scfv以外的多肽或蛋白配体,例如经修饰白细胞介素-13(il-13)分子可用于制备特异性识别结构域,从而得到用于治疗胶质母细胞瘤的il-13rα2特异性的car。
97.在本文中,术语“单链可变片段”、“单链抗体可变片段”或“scfv”抗体是指包含仅重链(vh)和轻链(vl)的可变区的抗体形式,通过接头肽连接。scfv能够被表达为单链多肽。scfv保留了其所源自的完整抗体的特异性。轻链和重链可以为任何顺序,例如,vh-接头-vl或vl-接头-vh,只要保留scfv对靶抗原的特异性即可。在一些特殊的实施方案中,也可以省去接头。
98.如本文所用,术语“接头”是指长度为约1至100个氨基酸的寡肽或多肽区,其将本发明的car的任何结构域/区连接在一起。接头可由柔性残基(如甘氨酸和丝氨酸)组成,以便相邻的蛋白质结构域相对于彼此自由移动。当期望确保两个相邻结构域在空间上不相互干扰时,可使用较长的接头。可选的接头是本领域技术人员已知的,可以结合本发明的替代性实施方案使用。
99.如本文所用,术语“抗体”是指完整的免疫球蛋白或具有fc(可结晶的片段)区或fc区的fcrn结合片段(在本文中称为“fc片段”或“fc结构域”)的单克隆或多克隆抗原结合片段。抗原结合片段可以通过重组dna技术或通过完整抗体的酶促切割或化学切割产生。抗原结合片段尤其包括fab、fab’、f(ab’)2、fv、dab和互补决定区(cdr)片段、单链抗体(scfv)、单结构域抗体、嵌合抗体、双抗体和这样的多肽,其至少含有免疫球蛋白足以赋予该多肽特异性抗原结合的部分。fc结构域包括两条重链的ch2和ch3部分,可以通过重组dna技术或通过完整抗体的酶促(例如木瓜蛋白酶切割)或通过完整抗体的化学切割来产生。术语“抗体片段”是指仅包含完整抗体的一部分的蛋白质片段,通常包括完整抗体的抗原结合位点,因此保留结合抗原的能力。本文所述的抗体片段实例包括但不限于:(i)具有vl、cl、vh和ch1结构域的fab片段;(ii)fab’片段,即在ch1结构域的c末端具有一个或多个半胱氨酸残基的fab片段;(iii)具有vh和ch1结构域的fd片段;(iv)具有vh和ch1结构域以及在ch1结构域的c-末端的一个或多个半胱氨酸残基的fd’片段;(v)具有抗体单臂的vl和vh结构域的fv片段;(vi)由vh结构域组成的dab片段(ward等,nature 341,544-546(1989));(vii)分离的cdr区;(viii)f(ab’)2片段,包含在铰链区通过二硫键桥接的两个fab’片段的二价片段;
(ix)单链抗体分子(例如,单链fv;scfv)(bird等,science 242:423-426(1988);和huston等,pnas(usa)85:5879-5883(1988));(x)具有两个抗原结合位点的“双抗体”,其包含与同一多肽链中的轻链可变结构域(vl)连接的重链可变结构域(vh)(参见,例如,ep404,097;wo93/11161;和hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993));(xi)“线性抗体”,其包含一对串联fd区段(vh-ch1-vh-ch1),所述fd区段与互补的轻链多肽一起形成一对抗原结合区(zapata等,protein eng.8(10):1057-1062(1995);和美国专利no.5,641,870)。
100.如本文所用,术语“特异性结合”是指抗体与特定抗原相结合,而不与所述特定抗原以外的其它抗原结合。其中所述特定抗原可以是一种或多种,在一些实施方式中,所述特定抗原包含相同或相近的抗原表位。在一些实施方案中,所述特异性结合的结合亲和力为至少10-6
m的抗体与抗原之间的接触。在某些实施方案中,所述抗体以至少约10-7
m,优选10-8
m、10-9
m、10-10
m、10-11
m或10-12
m的亲和力结合。
101.本技术中,术语“多核苷酸”或“核酸”、“核酸分子”可互换使用,包括但不限于dna、rna、cdna(互补dna)、mrna(信使rna)、rrna(核糖体rna)、shrna(小发夹rna)、snrna(小核rna)、snorna(短核仁rna)、mirna(微小rna)、基因组dna、合成dna、合成rna和/或trna。
102.如本文所用,“载体”、“克隆载体”和“表达载体”是指通过其可以将多核苷酸序列(例如外来基因)引入宿主细胞中,以转化宿主并促进引入序列的表达(例如转录和翻译)的载体。所述载体包括质粒、噬菌体、病毒等。
103.如本文所用,所述“信号转导结构域”通常包含免疫受体的酪氨酸活化基序(immune-receptor tyrosine-based activation motifs,itam),其基本组成是:yxxl/v。其中y为酪氨酸,l/v指亮氨酸或缬氨酸,x可为任意氨基酸。当受体与相应配体结合后,与其连接的itma中的酪氨酸在与细胞膜相连的一类蛋白酪氨酸激酶ptk的作用下,可被磷酸化,从而招募胞内游离的其他蛋白激酶或衔接蛋白,向细胞内传导活化信号。在一些实施方案中,所述“信号转导结构域”选用tcrζ(cd3ζ)或fcεriγ的胞内信号转导结构域。
104.如本文所用,所述“共刺激结构域”又称为“共刺激信号域”,主要用于提供共刺激信号来增强免疫细胞的能力,包括例如增强记忆细胞的增殖、存活和/或发育。在一些实施方案中,所述“共刺激结构域”选自cd28、4-1bb(cd137)、ox40(cd134)等。
105.如本文所用,所述“跨膜结构域”又称“跨膜区”,是指锚定在细胞膜内具有热力学稳定的蛋白质结构区域。跨膜结构域可以从天然蛋白质中获得,例如来源于t细胞受体(tcr)的跨膜结构域。在一些实施方案中,所述跨膜结构域选自cd4,cd8α,cd28和cd3ζ的跨膜结构域。
106.如本文所用,所述“铰链区”是连接抗原识别区及跨膜结构域的一段肽链,通常具有弹性。在一些实施方案中,所述铰链区由igg的铰链或cd8α/cd28的胞外区衍变而来。其中igg的“铰链”是指igg的ch1和ch2功能区之间的区域,通常含大量脯氨酸。
107.如本文所用,“抗baff-r的嵌合抗原受体”是“特异性识别baff-r的受体”中的一种。其特指抗原识别区中含有抗baff-r抗体重链可变区和轻链可变区的嵌合抗原受体。所述嵌合抗原受体能特异性识别baff-r,并通过信号传导激活所述受体所在细胞的下游通路。在一些实施方案中,所述抗baff-r的嵌合抗原受体位于选自nk细胞、巨噬细胞、中性粒细胞、t细胞等免疫细胞的表面,在特异性识别baff-r之后,激活所述免疫效应细胞产生体
液免疫、细胞免疫、和/或细胞毒性作用等免疫效应;或激活所述免疫细胞进一步增殖等。
108.如本文所用,“免疫效应细胞”是指能够针对靶抗原或靶细胞实现免疫效应和免疫反应,例如免疫杀伤效应、免疫应答效应的细胞,例如t细胞及自然杀伤(nk)细胞。
109.如本文所用,“car-t”即嵌合抗原受体t细胞,是在细胞表面表达有嵌合抗原受体分子的t细胞,可识别细胞表面的靶抗原。car-t目前已开发到第4代。其中第1代car-t的car分子由cd3ζ链或fcεriγ的信号转导结构域与抗原识别区连接融合而成,不含有共刺激结构域。第1代car-t在体内的增殖能力有限,容易凋亡。第2代car增加了1个共刺激结构域,例如cd28或4-1bb(cd137)。cd28具有较强的抗肿瘤活性,而4-1bb的优点是能延长t淋巴细胞的存活时间并维持其抗肿瘤作用。第2代car增殖能力较第1代强,且能分泌更多细胞因子、抗凋亡蛋白。第3代car-t不仅可以同时表达2个共刺激信号分子,而且能够分泌更多的ifn-γ,抗肿瘤细胞毒作用更高。第4代car-t还能够在肿瘤中分泌特定的细胞因子(如il-12),从而改变肿瘤微环境,并影响和激活其他免疫细胞产生免疫反应。
110.如本文所用,所述“信号肽”是指是引导新合成的蛋白质向分泌通路转移的短肽链,长度通常为5-30个氨基酸。在一些实施方案中,所述信号肽为膜定位信号肽,即用于指导蛋白质的跨膜转移(定位)的氨基酸序列。在多数情况下,信号肽位于氨基酸序列的n端。在mrna中,信号肽的编码序列通常位于起始密码子后,是一段编码疏水性氨基酸序列的rna区域。在信号肽引导蛋白质完成定位后,通常会在信号肽酶的作用下被切除。
111.如本文所用,所述蛋白或核酸的“变体”是指与特定蛋白或核酸相比,具有相同功能,但序列存在一个或多个突变的蛋白或核酸。例如某一蛋白的“变体”即是指通过人为或天然突变,使所述某一蛋白的氨基酸序列发生一个或多个氨基酸的插入、缺失、替换等突变,获得的与所述某一蛋白具有相同功能以及至少70%序列同一性的蛋白。
112.如本文所用序列的“同一性”是指氨基酸序列之间或核苷酸序列之间通过序列比对软件,例如blast,确定的相似程度。
113.本领域技术人员应当知晓baff-baff-r信号通路失衡可引起多种疾病,包括:自身免疫性疾病、移植物抗宿主疾病和肿瘤等。所述肿瘤包括除浆细胞病变(多发性骨髓瘤)以外的所有b细胞恶性疾病,例如套细胞淋巴瘤、滤泡淋巴瘤、弥漫性大b细胞淋巴瘤、边缘区淋巴瘤、伯基特氏淋巴瘤、淋巴母细胞白血病、慢性淋巴细胞白血病、毛细胞白血病等。所述自身免疫疾病包括例如:类风湿性关节炎、全身性红斑狼疮、多发性硬化症、肾小球肾炎、舍格伦综合征或自身免疫性溶血性贫血等。
114.如本文所用,术语“有效量”或“治疗有效量”是指包含一种或多种本技术公开的肽、蛋白、核酸或其突变型、变体、类似物或衍生物的药物组合物的量,且接受所述“有效量”或“治疗有效量”的药物组合物的患者或受试者可获得医学治疗的合理益处/风险比,从而减轻或预防疾病或病症的至少一种或更多种症状,达到期望的治疗或预防效果。
115.如本文所用,术语“约”是指本技术领域的技术人员容易知道的各个值的通常误差范围。提及“约”值或参数在本文中包括(及描述)针对该值或参数本身的实施方案。如本文所使用的,当术语“约”在数值之前时,表示该数值上或下10%的范围内。例如,“约100”涵盖90和110。
116.如本文所用,除非另外指出,否则单数形式“一个”,“一种”和“该”包括复数形式。
117.除非本文另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域
的普通技术人员通常所理解的相同含义。
118.嵌合抗原受体
119.本技术提供了一种特异性识别baff-r的受体。在一些实施方案中,所述特异性识别baff-r的受体为嵌合抗原受体(car)。
120.当所述特异性识别baff-r的受体为嵌合抗原受体(car)时,其包含特异性识别结构域及活化刺激结构域,以及位于所述特异性识别结构域和活化刺激结构域之间的跨膜结构域,其中,所述特异性识别结构域是指car特异性结合靶细胞上的靶抗原的部分。在一些实施方案中,所述特异性识别结构域包含抗体或其功能等效物或其片段或其衍生物,例如可包含全长重链、fab片段、单链fv(scfv)片段、二价单链抗体或双抗体,其各自对靶抗原是特异性的。然而,也存在许多替代物,例如细胞因子(其识别携带细胞因子受体的细胞)、亲和体、来自天然存在的受体的配体结合结构域、受体的可溶性蛋白质/肽配体(例如在肿瘤细胞上)等,其可各自用于本发明的各种实施方案中。本领域技术人员应理解,以高亲和力结合所述靶抗原的几乎任何分子或结构域都可用作特异性识别结构域。在一些实施方案中,所述特异性识别结构域包含t细胞受体(tcr)或其抗原识别部分,例如单链tcr(sctcr)。制备此类tcr的方法是本领域已知的。例如,可以将sctcr改造成含有通过接头(例如,柔性肽)连接的来自t细胞克隆的vα1和vβ基因。
121.在一些实施方案中,所述特异性识别结构域包含选自seq id no:6、seq id no:7、seq id no:8、seq id no:10、seq id no:11、seq id no:12的氨基酸序列或与它们具有约70%以上序列同一性的氨基酸序列,例如与它们具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。在一些实施方案中,所述特异性识别结构域包含:
122.重链可变区,所述重链可变区包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列;以及
123.轻链可变区,所述轻链可变区包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
124.在一些实施方案中,所述重链可变区包含3个互补决定区,分别为cdr h1、cdr h2和cdr h3,且所述cdr h1、cdr h2和cdr h3分别包含seq id no:6、seq id no:7、seq id no:8的氨基酸序列或分别与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列;并且所述轻链可变区也包含3个互补决定区,分别为cdr l1、cdr l2和cdr l3,且所述cdr l1、cdr l2和cdr l3分别包含seq id no:10、seq id no:11、seq id no:12的氨基酸序列或分别与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
125.在一些实施方案中,所述重链可变区和轻链可变区还进一步包含骨架区,优选的为人抗体骨架区。
126.在一些实施方案中,所述重链可变区包含如seq id no:5中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、85%、90%、95%、
97%、98%、或99%以上序列同一性的氨基酸序列;以及所述轻链可变区包含如seq id no:9中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
127.在一些实施方案中,所述重链可变区与所述轻链可变区通过接头连接,形成scfv,所述scfv包含如seq id no:4所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
128.car通常包括特异性识别结构域、活化刺激结构域,以及他们之间的跨膜结构域。而常规的car构造有三种,其区别主要在于活化刺激结构域的差异,包括:
129.第一代car,其活化刺激结构域包含细胞内信号转导结构域并且没有共刺激结构域;
130.第二代car,其活化刺激结构域包含细胞内信号转导结构域和一个共刺激结构域。
131.第三代car,其活化刺激结构域包含细胞内信号转导结构域和两个共刺激结构域。
132.因此,在本技术的一些实施方案中,所述car是第一代car,其中的信号转导结构域可以是细胞质的并且可以转导效应子功能信号并指导细胞执行其特化功能。所述信号转导结构域的实例包括但不限于t细胞受体的ζ链或任何其同源物(例如,η链、fcεr1γ、β链、mb1(igα)链、b29(igβ)链等),cd3多肽(γ、δ和ε),syk家族酪氨酸激酶(syk、zap 70等),src家族酪氨酸激酶(lck、fyn、lyn等)和参与t细胞转导的其它分子,例如cd2、cd5和cd28。具体地,细胞内信号转导结构域可以是人cd3ζ链、fcγriii、fcεri、fc受体的胞质尾区、带有免疫受体酪氨酸激活基序(itam)的细胞质受体或其组合。另外的细胞内信号转导结构域对于本领域技术人员而言是显而易见的,并且可以结合本发明的替代性实施方案使用。在一些实施方案中,所述活化刺激结构域包含的信号转导结构域为含有免疫受体酪氨酸活化基序的信号转导结构域。在一些实施方案中,细胞内信号转导结构域包含选自以下之中的一种或多种的信号转导结构域:cd3ζ、cd3γ、cd3δ、cd3ε、fcεriγ、fcεr1β、cd79α、cd79β、fcγriia、dap10、dap12分子的胞内区,或保有其相同功能的变体。在一些优选的实施方案中,所述细胞内信号转导结构域包含cd3ζ或fcεriγ的胞内区,或保有其相同功能的变体。在一些优选的实施方案中,所述细胞内信号转导结构域源自cd3ζ的胞内区。在一些实施方案中,所述胞内信号转导结构域包含如seq id no:20所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
133.在本技术的一些实施方案中,所述car是第二代car,其中的信号转导结构域为如上所述的信号转导结构域,且其中进一步包含的共刺激结构域为以下分子胞内区中的任一个:cd27、cd28、4-1bb、ox40、cd30、cd40、cd2、lfa-1、light、nkg2c、b7-h3、pd-l、icos、cds、icam-1、gitr、baffr、lightr、slamf7、cd7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-l、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-l、itgb7、tnfr2、trance/rankl、dnaml、slamf4、cd84、cd96、ceacam1、crtam、cd229、cd160、psgl1、cd100、cd69、slamf6、slamf1、slamf8、cd162、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、及与cd83特异性结合的配体,或与它们保有相同功能
no:16中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
139.在一些实施方案中,所述跨膜结构域与所述特异性识别结构域直接连接。在一些实施方案中,所述跨膜结构域与所述特异性识别结构域之间通过铰链区相连接。在一些实施方案中,所述铰链区包含选自下组的氨基酸序列:人cd8α或抗体的fc片段或其功能等效物、片段或衍生物,人cd8α或抗体的铰链区或其功能等效物、片段或衍生物,抗体的ch2区,抗体的ch3区,人工间隔序列以及它们的组合;优选地为igg、igd、cd8α或cd28的铰链区氨基酸序列。在一些示例性实施方案中,所述铰链区包含以下之中的任何一种或多种:(i)igg4的铰链区、ch2区和ch3区,(ii)igg4的铰链区,(iii)igg4的铰链区和ch2区,(iv)cd8α的铰链区,(v)igg1的铰链区、ch2区和ch3区,(vi)igg1的铰链区,(vi)igg1的铰链区和ch2区,或(vii)其组合。在一些特定的实施方案中,所述铰链区为人cd8α的铰链区。在一些特定的实施方案中,所述铰链区包含如seq id no:14中所示的氨基酸序列或与其具有约70%以上序列同一性的氨基酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
140.在一些实施方案中,所述car进一步包含一段信号肽。通常信号肽(sp)位于蛋白质的n端,并携带蛋白质分泌信息,参与决定了蛋白质的分泌途径及分布。本领域技术人员应当知晓,定位于核内、线粒体内、胞质的蛋白,以及胞浆中的游离蛋白及分泌或最终锚定在细胞膜上的蛋白通常具有不同的信号肽。本领域技术人员可以通过软件预测及信号肽数据库挑选出适于某种蛋白质发挥功能的信号肽序列。因此,在本技术的一些实施方案中,所述信号肽选自任意分泌蛋白或细胞膜蛋白的信号肽序列,或与他们保有相同功能的变体。在一些实施方案中,所述信号肽序列为cd8α的信号肽。在一些实施方案中,所述信号肽序列包含如seq id no:2中的氨基酸序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的氨基酸序列。
141.工程化t细胞受体
142.一方面,本技术还提供了一种特异性识别baff-r的工程化t细胞受体(tcr)。t细胞表面的特异性受体,负责识别由主要组织相容性复合体(mhc)所呈递的抗原。t细胞受体是异源二聚体,由两个不同的亚基所构成。通常情况下,95%的t细胞的受体由α亚基和β亚基构成,另外5%的受体由γ亚基和δ亚基构成。每一个亚基都含有两个细胞外的结构域:可变区与恒定区。每个亚基的可变区(例如α亚基可变区vα,β亚基可变区vβ,γ亚基可变区vγ,δ亚基可变区vδ)又至少包含三个高度易变的互补决定区:cdr1、cdr2和cdr3。其中,cdr3负责直接与mhc所呈递的多肽结合,α亚基和β亚基的cdr1分别作用于多肽的n端和c端,而cdr2则参与识别mhc。
143.在一些实施方案中,所述工程化t细胞受体包含:
144.vα,其包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;以及vβ,其包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;或
145.vβ,其包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;以及vα,其包含选自seq id no:10、seq id no:
11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列。
146.在另一些实施方案中,所述工程化t细胞受体包含:
147.vγ,其包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;以及vδ,其包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;或
148.vδ,其包含选自seq id no:6、seq id no:7、seq id no:8的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列;以及vγ,其包含选自seq id no:10、seq id no:11、seq id no:12的氨基酸序列,或与它们具有约70%以上序列同一性的氨基酸序列。
149.所述工程化tcr可特异性识别由mhc呈递的baff-r,并与负责信号传递的cd3δ/ε二聚体、cd3γ/ε二聚体以及cd247ζ/ζ或ζ/η二聚体,以及在一些实施方案中,与协同受体,共同激活下游信号通路。
150.核酸分子
151.本技术还提供了编码特异性识别baff-r的受体或其片段的核酸分子,在一些实施方案中,所述特异性识别baff-r的受体为前述嵌合抗原受体;在一些实施方案中,所述特异性识别baff-r的受体为前述工程化t细胞受体。所述核酸分子包含编码前述嵌合抗原受体或工程化t细胞受体或其片段的多核苷酸序列。所述核酸分子可以为dna亦可以为rna。在一些实施方案中,所述核酸分子为线状,在一些实施方案中,所述核酸分子为环状。在一些实施方案中,所述核酸分子为双链。在一些实施方案中,所述核酸分子为单链。在一些实施方案中,所述核酸分子经化学合成。在一些实施方案中,所述核酸分子包含化学修饰以使其在细胞中或动物体中更加稳定。在一些实施方案中,所述核酸分子通过细菌、真菌或动物细胞合成。在一些实施方案中,所述核酸分子为质粒、病毒载体或寡核苷酸。
152.在一些实施方案中,所述多核苷酸序列包含编码识别所述特异性识别baff-r的受体的特异性识别结构域。在一些实施方案中,所述特异性识别结构域为scfv。在一些实施方案中,所述多核苷酸序列包含如seq id no:3所示的dna序列和/或与其互补的dna,或与其相对应的或互补的rna序列,或与本段所述dna或rna序列具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。如本文所用,核酸的“互补”是指两条多核苷酸可在严格条件下杂交,所述严格杂交,即是指所述两条多核苷酸在杂交时,其每个碱基或每个核苷酸,均按照watson-crick碱基配对原则,即a与t或u、c与g或i配对。如本文所用,所述与dna序列“相对应的”rna,是指与所述dna序列的碱基排列顺序一致,且所有t碱基均被u碱基替代的核糖核苷酸(rna)序列。
153.在一些实施方案中,所述核酸分子包含膜定位信号肽分子的编码序列。在一些实施方案中,所述其中所述膜定位信号肽为cd8α的膜定位信号肽。在一些实施方案中,所述其中所述膜定位信号肽分子的编码序列包含如seq id no:1所示的dna序列和/或与其互补的dna,或与其相对应的或互补的rna序列,或与本段所述dna或rna序列具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。
154.在一些实施方案中,所述核酸分子包含编码铰链区的序列。在一些实施方案中,所
述编码铰链区为cd8α的铰链区。在一些实施方案中,所述编码铰链区的序列包含如seq id no:13所示的dna序列和/或与其互补的dna,或与其相对应的或互补的rna序列,或与本段所述dna或rna序列具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。
155.在一些实施方案中,所述核酸分子包含编码信号转导结构域的序列。在一些实施方案中,所述信号转导结构域为cd3ζ的信号转导结构域。在一些实施方案中,所述编码信号转导结构域的序列包含如seq id no:19中所示的dna序列和/或与其互补的dna,或与其相对应的或互补的rna序列,或与本段所述dna或rna序列具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。
156.在一些实施方案中,所述核酸分子包含编码共刺激结构域的序列。在一些实施方案中,所述共刺激结构域为4-1bb的信号转导结构域。在一些实施方案中,所述编码信号转导结构域的序列包含如seq id no:17中所示的dna序列和/或与其互补的dna,或与其相对应的或互补的rna序列,或与本段所述dna或rna序列具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列。
157.在一些实施方案中,所述核酸分子包含前述编码共刺激结构域的序列、前述编码信号转导结构域的序列、前述编码铰链区的序列、前述膜定位信号肽分子的编码序列、以及前述编码特异性识别结构域序列。如何排列前述核酸分子中所包含的序列以使所述核酸分子,以及加入哪些调控表达的相关部件,以使所述核酸分子导入细胞后成功合成完整的识别所述特异性识别baff-r的受体,对于本领域技术人员是显而易见的。在一些特定的实施方案中,所述核酸分子从5’端到3’端依次包含如下所述的多核苷酸序列或与其具有约70%以上序列同一性的多核苷酸序列,例如与其具有约75%、80%、85%、90%、95%、97%、98%、或99%以上序列同一性的多核苷酸序列:seq id no:1、seq id no:3、seq id no:13、seq id no:15、seq id no:17和seq id no:19,其中所述多核苷酸序列之间可以包含其它序列。
158.本技术还提供了包含多个核酸分子的混合物。所述多个核酸分子分别包含选自下述的一项或多项:前述编码共刺激结构域的序列、前述编码信号转导结构域的序列、前述编码铰链区的序列、前述膜定位信号肽分子的编码序列、前述编码特异性识别结构域序列。将所述混合物共同导入细胞,则可合成完整的识别所述特异性识别baff-r的受体。
159.工程化免疫效应细胞
160.一种工程化免疫效应细胞,其包含前述特异性识别baff-r的受体或前述核酸分子。
161.在一些实施方案中,所述特异性识别baff-r的受体为前述嵌合抗原受体,所述工程化免疫效应细胞为car-t或car-nk细胞。
162.在一些实施方案中,所述特异性识别baff-r的受体为前述工程化t细胞受体,所述述工程化免疫效应细胞为tcr-t细胞。在一些实施方案中,所述特异性识别baff-r的受体为前述工程化t细胞受体,所述述工程化免疫效应细胞为tcr-nk细胞。
163.病毒颗粒、脂质体、脂质纳米颗粒、药物组合物
164.本技术还提供了一种病毒质粒,其中包装的病毒载体包含如前所述的嵌合抗原受体或工程化t细胞受体和/或编码所述嵌合抗原受体或工程化t细胞受体的多核苷酸序列。本技术还提供了脂质体或脂质纳米颗粒,所述脂质体或脂质纳米颗粒包含如前所述的特异性识别baff-r的受体或其片段或编码所述受体或其片段的核酸分子。
165.本技术还进一步提供了一种药物组合物,其包含治疗有效量的选自下述的一项或多项:前述嵌合抗原受体、前述t细胞受体、前述核酸分子、前述工程化免疫效应细胞,前述病毒颗粒、脂质体、脂质纳米颗粒。在一些实施方案中,所述药物组合物还进一步包括合适的赋形剂、载剂、和/或稳定剂。所述可接受的载剂、赋形剂或稳定剂在所采用的剂量和浓度下对接受者无毒,并且包括例如:缓冲液,诸如磷酸盐、柠檬酸盐或乙酸盐,ph通常为5.0至8.0,任选地6.0至7.0;实现等渗的盐,诸如氯化钠、氯化钾等等;抗氧化剂;防腐剂;低分子量多肽;蛋白;亲水性聚合物,诸如聚山梨醇酯80;氨基酸,诸如甘氨酸;碳水化合物;螯合剂;糖;以及本领域的技术人员已知的其他标准成分(remington:the science and practice of pharmacy,第22版,loyd v.allen等人编,pharmaceutical press(2012))。
166.疗法
167.本技术同时公开了一种治疗或预防有需要的受试者的疾病或症状的方法,所述方法包括向受试者施用有效量的如前所述的药物组合物,所述疾病选自由b细胞baff-baff-r信号通路失衡引起的疾病。任选地,所述方法还包括向受试者施用第二治疗剂,例如能够结合cd20抗原的单克隆抗体、能够结合cd19的单克隆抗体、能够结合免疫检查点,例如pd-1/pd-l1的单克隆抗体,或靶向cd20、cd19、pd-l1的工程化免疫效应细胞等。在一些实施方案中,所述疾病选自下述的任一种:自身免疫性疾病、移植物抗宿主疾病或肿瘤。
168.在一些实施方案中,所述疾病是癌症。任选地,所述癌症是淋巴瘤、白血病或骨髓瘤。任选地,所述癌症是淋巴瘤。任选地,所述淋巴瘤是套细胞淋巴瘤、滤泡淋巴瘤、弥漫性大b细胞淋巴瘤、边缘区淋巴瘤或伯基特氏淋巴瘤。任选地,所述癌症是白血病。任选地,所述白血病是淋巴母细胞白血病、慢性淋巴细胞白血病或毛细胞白血病。任选地,所述癌症是骨髓瘤。任选地,所述骨髓瘤是多发性骨髓瘤。
169.在一些实施方案中,所述疾病是自身免疫疾病。任选地,所述自身免疫疾病是类风湿性关节炎、全身性红斑狼疮、多发性硬化症、肾小球肾炎、舍格伦综合征或自身免疫性溶血性贫血。
170.在另一个方面中,本技术还提供一种抑制细胞增殖的方法。所述方法包括将所述细胞与如本技术所提供的药物组合物接触,从而形成接触细胞。使抗baff-r受体或其功能片段结合接触细胞上的baff-r蛋白,从而抑制细胞增殖。任选地,所述细胞是淋巴细胞。任选地,所述细胞是b细胞或癌细胞。任选地,所述细胞是淋巴瘤细胞。
171.如本文所用,治疗或预防疾病或症状是指获得有益或所需结果(包括临床结果)的方法。有益或所需临床结果可包括但不限于:缓解或改善一个或多个症状或病状;减轻病状、病症或疾病的程度;稳定病状、病症或疾病的状态;预防病状、病症或疾病的发展;预防病状、病症或疾病的蔓延;延缓或减慢病状、病症或疾病进展;延缓或减慢病状、病症或疾病发作;改善或缓和病状、病症或疾病状态;以及好转,不管是部分还是全部。治疗还可意味延长受试者的存活,超过在不存在治疗的情况下预期的存活。治疗还可意味抑制病状、病症或疾病的进展,暂时减慢病状、病症或疾病的进展,但是在一些情况下,其涉及永久地停止病
状、病症或疾病的进展。
172.以上详细描述了本发明的优选实施方案,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
173.应当理解,以上描述以及随后的实施例旨在说明而不是限制本发明的范围。在本发明范围内的其他方面,优点和修改对于本发明所属领域的技术人员将是显而易见的。
实施例
174.实施例1:靶向baff-r的嵌合抗原受体的设计
175.本发明构建了抗baff-r的嵌合抗原受体(h90-11 car,其包含如美国申请公开文本:us 2021/0261676 al所示的h90-11 mab单克隆抗体的重链可变区和轻链可变区,所述美国申请公开文本us 2021/0261676 a1的内容在此通过引用并入本文),如结构示意图图1所示,该嵌合抗原受体包括一段cd8α的信号肽序列(leader),与baff-r抗原特异性结合的单链抗体序列(scfv),人cd8α的铰链区(hinge)和跨膜结构域序列(transmembrane),4-1bb共刺激域序列和cd3ζ信号传导域序列,具体各部分序列如下所示,具体序列参见表1:
176.人cd8α分子信号肽(leading signal)的多核苷酸序列如seq id no:1所示,氨基酸序列如seq id no:2所示;
177.人源baff-r单链抗体(scfv)的多核苷酸序列如seq id no:3所示,氨基酸序列如seq id no:4所示;其中所述scfv的重链可变区(vh)为seq id no:5,所述vh包含的三个互补决定区cdr h1、cdr h2、cdr h3的氨基酸序列分别为:seq id no:6、seq id no:7、seq id no:8;所述scfv的轻链可变区(vl)为seq id no:9,所述vl包含的三个互补决定区cdr l1、cdr l2、cdr l3的氨基酸序列分别为:seq id no:10、seq id no:11、seq id no:12;
178.人cd8α铰链区(cd8 hinge)的多核苷酸序列如seq id no:13所示,氨基酸序列如seq id no:14所示;
179.人cd8α跨膜结构域(cd8 tm)的多核苷酸序列如seq id no:15所示,氨基酸序列如seq id no:16所示;
180.人4-1bb分子胞内区(4-1bb)的多核苷酸序列如seq id no:17所示,氨基酸序列如seq id no:18所示;
181.人cd3ζ分子胞内区(cd3ζ)核苷酸序列如seq id no:19所示,氨基酸序列如seq id no:20所示;
182.表1:
183.184.[0185][0186]
[0187]
实施例2构建嵌合抗原受体表达载体
[0188]
抗baff-r的h90-11 car慢病毒表达载体pcdh-ef1a-h90-11car-4-1bb-egfrt以及对照egfrt car慢病毒表达载体pcdh-ef1a-egfrt-at-free(delete t2a)均由南京金斯瑞公司合成并构建,具体实验步骤如下:
[0189]
抗baff-r的scfv基因序列由南京金斯瑞公司合成,按照in-fusion snap assembly无缝克隆试剂生产商使用说明书,将基因合成的scfv序列插入到pcdh-ef1a-4-1bb-egfrt载体(南京金斯瑞,订单编号:c046eee310)中,获得抗baff-r的嵌合抗原受体慢病毒表达载体pcdh-ef1a-h90-11car-4-1bb-egfrt(南京金斯瑞,订单编号:c9401fg210),载体图谱见图2。
[0190]
pcdh-ef1a-t2a-egfrt(icartab提供)慢病毒表达载体,因t2a连接子中存在一个atg起始密码子,因移码突变导致egfrt不能正常表达,按照in-fusion snap assembly无缝克隆试剂生产商使用说明书,将pcdh-ef1a-t2a-egfrt载体中的t2a删除,获得对照egfrt car慢病毒表达载体pcdh-ef1a-egfrt-at-free(delete t2a)(由南京金斯瑞构建),载体图谱见图3。
[0191]
实施例3慢病毒包装及滴度测定
[0192]
慢病毒的包装
[0193]
准备15cm培养皿,接种1
×
107个293t细胞,加入含10%fbs(gibco,货号:10099-141)的dmem(gibco,货号:41965-062)完全培养基,置于37℃、5%co2培养箱,过夜培养。取2ml pbs(gibco,货号:14190-250)至6孔板的一个孔,分别加入20μg慢病毒表达质粒(pcdh-ef1a-h90-11 car-4-1bb-egfrt或pcdh-ef1a-egfrt-at-free(delete t2a))、30μl慢病毒包装质粒mix(icartab,货号:lvp2mix),移液枪上下吹打充分混匀后,加入150μl lvtransm转染试剂(icartab,货号:lvtran100),立即用移液器上下吹打混匀,室温下静置10分钟。将前述dna/pei复合物逐滴加入到15cm培养皿中,轻轻晃动培养皿,充分混匀。将培养皿置于37℃、5%co2培养箱,培养6~8小时后,将含有转染试剂的培养基弃掉,更换为新鲜的完全培养基。连续培养48小时后,收集培养皿中含有病毒的培养基上清,用0.45μm的滤膜过滤,转至离心管中,20000g 4℃离心2小时。离心结束后,在生物安全柜中,将离心管中的液体弃掉,加入500μl pbs缓冲液重悬病毒沉淀,分装后,将病毒置于-80℃冰箱保存。
[0194]
病毒滴度测定
[0195]
复苏293t细胞,将细胞状态调整至对数生长期。取一块新的6孔板,按照每孔8
×
105个细胞接种293t细胞,补充培养基至终体积为2ml,将6孔板置于37℃、5%co2培养箱中,过夜培养。将浓缩后的慢病毒按照50μl的量加入至前述6孔板中,同时添加终浓度为6μg/ml的polybrene(sigma,货号:107689-10g),将6孔板重新放回37℃、5%co2培养箱中,连续培养48小时。
[0196]
培养结束后,使用pbs洗涤每孔的细胞,然后使用minibest universal genomic dna extraction kit(takara,货号:9765)提取基因组dna,并使用nanodrop2000测定所提取的基因组dna的浓度。按照下表2所示的pcr反应体系,制备荧光定量pcr反应预混液。
[0197]
表2:
[0198][0199]
所用引物的序列及荧光基团如下表3所示。
[0200]
表3:
[0201][0202][0203]
从冰箱中取出puc-ltr(购自:icartab)和puc-alb质粒(购自:icartab),分别按照10倍稀释,共6个点,准备荧光定量pcr所需的标准曲线样品。取一块新的96孔pcr反应板,按照每孔加入5μl基因组样品或标准曲线样品,然后向每孔加入15μl前述制备的pcr反应预混液,使用封膜密封后,短暂离心1分钟。根据如下表4的pcr程序进行pcr反应。
[0204]
表4:
[0205][0206]
pcr反应结束后,使用roche 480的配套软件获取标准曲线的ct值及样品的ct值;以ct值为纵坐标,以拷贝数的log值为横坐标,制作标准曲线;根据标准曲线计算样品的拷贝数。并根据以下公式计算病毒的滴度:
[0207]
[0208]
根据公式(1)计算得到的慢病毒滴度结果如下表5所示。
[0209]
表5:
[0210]
慢病毒名称活性滴度(tu/ml)pcdh-efia-h90-11car-4-1bb-egfrt慢病毒1.77
×
108pcdh-ef1a-egfrt-at-free(delete t2a)慢病毒1.6
×
108[0211]
从表5可以看出,包装出了高滴度的慢病毒,可以用于后续感染t细胞制备car-t细胞。
[0212]
实施例4 car-t细胞的制备
[0213]
外周血pbmc分离t细胞
[0214]
将10ml抗凝外周血血样转移至一个15ml无菌离心管内,800g离心20分钟,去掉上层浅黄色血清层,然后向下层的外周血细胞层加入等体积的pbs,轻轻上下颠倒混匀。取出淋巴细胞分离液(灏洋生物,货号:1077),并上下颠倒数次,充分混匀。另取一个15ml离心管,加入5ml淋巴细胞分离液,将稀释后的血样沿管壁缓慢加至淋巴细胞分离液的上层,避免分离液与血样的混合,800g离心20分钟。离心结束后,轻轻的取出离心管,将处于中间的白色单核细胞层吸至一个新的无菌离心管中,加入等体积的生理盐水轻轻混匀,800g离心5分钟,离心结束后,去除上清,重复清洗一次pbmc,调整细胞密度至5
×
107个细胞/ml,以1ml/支转移至2ml细胞冻存管中。
[0215]
使用pbs洗涤human t-expander cd3/cd28(thermo,货号:11141d)2遍,取适量的human t-expander cd3/cd28加入到2ml细胞冻存管中的pbmc中,轻轻混匀,室温孵育20分钟。将2ml细胞冻存管插入磁极,室温静置1分钟,轻轻倒置,将管内的液体倒出。将细胞冻存管从磁极中取出,加入适量x-vivo 15培养基(含200iu/ml il-2(北京远策药业有限责任公司,货号:20150713b),10ng/ml il-7(primegene,货号:101-07),5ng/ml il-15(primegene,货号:101-15)重悬并计数,调整细胞密度至0.5~1
×
106个细胞/ml,转移至6孔板中,置于37℃、5%co2培养箱中连续培养48h。
[0216]
慢病毒感染t细胞
[0217]
将培养后的t细胞密度调整至1
×
106个/ml,从-80℃超低温冰箱中取出慢病毒,迅速在37℃水浴锅中解冻,向准备好的t细胞中,加入聚凝胺(sigma,货号:107689-10g)至终浓度为6μg/ml,加入适量体积病毒(感染复数moi=25),用移液器轻轻吹打混匀,使用封口膜将培养器皿密封,800g室温离心1小时。离心结束后,继续培养24小时后,进行换液,然后在37℃、5%co2培养箱继续培养。
[0218]
t细胞大量扩增
[0219]
每天轻轻吹打培养体系中的/细胞团至完全分开并计数,当细胞密度大于1
×
106个/ml时,添加x-vivo 15培养基(含200iu/ml il-2,10ng/ml il-7,5ng/ml il-15)调整细胞密度至0.5
×
105个/ml,继续培养。扩增培养到第10天,收集细胞,并保存在细胞冻存液中。
[0220]
car-t阳性率检测
[0221]
通过使用fitc-anti-egfr抗体(icartab,货号:iab006a)(终浓度10μg/ml)分别与h90-11 car-t(感染pcdh-efia-h90-11car-4-1bb-egfrt慢病毒的t细胞)和egfrt car-t细
胞(感染pcdh-ef1a-egfrt-at-free(delete t2a)慢病毒的t细胞)孵育,室温避光孵育30分钟后,流式检测egfrt的表达反应car-t细胞阳性率,结果如图4所示,h90-11 car-t细胞阳性率为36.1%,egfrt car-t细胞阳性率为78.1%。同时使用baff-r liama igg2b fc tag重组蛋白(acro,货号:bar-h5258)(终浓度10μg/ml)分别与h90-11 car-t和egfrt car-t细胞孵育,室温孵育30分钟后,500g离心5分钟后弃上清,用0.5%bsa pbs按照1:1000稀释fitc-anti liama igg(h l)(novus,货号:nbp1-47627),以100μl/样品重悬细胞沉淀,室温避光孵育30分钟后,facs检测car-t细胞阳性率,结果如图5所示,h90-11 car-t细胞阳性率为30.2%,egfrt car-t细胞阳性率为0.65%。h90-11 car-t细胞既表达egfrt蛋白又表达抗baff-r car分子,且阳性率基本保持一致;而egfrt car-t细胞只表达egfrt蛋白不表达抗baff-r car分子,说明h90-11car-t和egfrt car-t细胞均制备成功。
[0222]
实施例5评估靶向baff-r的嵌合抗原受体t细胞在体外对肿瘤细胞杀伤情况
[0223]
car-t细胞对靶细胞的裂解
[0224]
nalm6-荧光素酶细胞是高表达人baff-r的急性淋巴细胞白血病细胞,该细胞是通过慢病毒感染nalm6细胞(购自:吉尼欧生物)获得的过表达luciferase(荧光素酶)的细胞。用luciferase检测试剂盒(promega,货号:e2610)检测h90-11 car-t细胞对nalm6-荧光素酶靶细胞的细胞毒性实验,并用egfrt car-t细胞作为对照,具体步骤如下:
[0225]
将nalm6-荧光素酶靶细胞重悬于完全培养基(rpmi1640 10%fbs)中,按2
×
104个/孔接种靶细胞至96孔板中,置于37℃、5%co2培养箱中,过夜培养。离心收集制备的car-t细胞,使用10%fbs的1640培养基重悬;从培养箱中取出96孔板,将孔中的培养基完全吸出,用无菌pbs轻轻将细胞洗涤一遍,按照效靶比为0.5:1、1:1、2.5:1、5:1、10:1加入car-t细胞,设置双复孔并将最终体积补至200μl/孔;maxi lysis孔和mini lysis孔接种同样数量的靶细胞,但是不加car-t细胞。将96孔板置于37℃、5%co2培养箱中,培养18小时。培养结束后,按照luciferase检测试剂盒(promega,货号:e2610)使用说明书,通过检测luciferase活性反映重组car-t细胞对靶细胞的裂解能力。靶细胞裂解百分数计算公式:lysis%=(1-[rlu]_sample/[rlu]_max)
×
100%
[0226]
结果如图6所示,h90-11 car-t细胞对表达baff-r的nalm6-荧光素酶细胞的杀伤效果远远高于egfrt car-t组,在效靶比为0.5:1、1:1、2.5:1、5:1、10:1时,h90-11 car-t对靶细胞杀伤率分别为62.7%、83.1%、95.4%、98.9、99.7%,egfrt car-t组对靶细胞的杀伤率分别为2.1%、10.5%、10.5%、18.1、24.7%。由此说明经本发明方法制备的靶向baff-r的嵌合抗原受体t细胞具有很强的肿瘤杀伤能力。
[0227]
car-t细胞因子分泌水平检测
[0228]
通过elisa方法检测靶细胞nalm6-荧光素酶和制备的car-t细胞共培养上清中il-2和ifn-γ的表达水平,具体实验步骤如下:
[0229]
将nalm6-荧光素酶靶细胞重悬于完全培养基中,按2
×
104个/孔接种靶细胞至96孔板中,置于37℃、5%co2培养箱中,过夜培养。分别以重组h90-11car-t细胞和egfrt car-t细胞为效应细胞,建立效应细胞与靶细胞的共培养体系,效靶比为0.5:1、1:1、2.5:1,5:1和10:1,设置双复孔。将孔板置于37℃、5%co2培养箱中,培养18小时。培养结束后,将孔板从培养箱中取出,1200g室温离心96孔板5分钟,轻轻的将孔板取出,转移上清通过il-2(福麦斯生物,货号:fms-elh003)和ifn-γ检测试剂盒(福麦斯生物,货号:fms-elh035)检测
il-2和ifn-γ的表达水平(具体步骤见elisa检测试剂盒说明书)。
[0230]
结果如图7a(il-2)和7b(ifn-γ)所示,表达baff-r的nalm6-荧光素酶细胞与h90-11 car-t共培养上清中il-2和ifn-γ细胞因子水平较egfrt car-t组有显著性升高,且呈梯度增加。结果表明,h90-11 car-t细胞在表达baff-r的靶细胞的刺激下,能够分泌th1类细胞因子。
[0231]
实施例6评估靶向baff-r的嵌合抗原受体t细胞在小鼠体内对肿瘤细胞杀伤情况
[0232]
将急性淋巴细胞白血病nalm6-荧光素酶细胞系异种移植至nsg小鼠模型中,用于评估h90-11 car-t的体内活性。
[0233]
取6-8周龄nsg小鼠(购自北京百奥赛图基因生物技术有限公司)(体重18-22g)20只,适应饲养一周后,尾静脉接种nalm6-荧光素酶,每只小鼠接种1
×
106个肿瘤细胞,尾静脉接种肿瘤细胞5天后,进行第一次活体成像,成像效果不理想,接种8天后,对于造模不成功的小鼠从后续的实验组中剔除,根据小鼠的活体成像结果进行分组,将小鼠随机分为2组,每组8只,经尾静脉分别输注2.25
×
106个h90-11 car-t细胞或egfrt car-t细胞,每隔7天对小鼠腹腔注射d-luciferin(上海乐辰,货号:bc219-10)同时使用气体麻醉机对小鼠进行麻醉,采集肿瘤活体成像数据,并记录小鼠体重变化同时绘制小鼠的生存曲线。
[0234]
分别于建模后第8、15、22天时,利用小动物活体成像设备,进行活体成像观察,成像结果在图8a中,绘制的绝对发光量曲线呈现于图8b中,根据成像结果,与egfrt car-t对照组相比,h90-11 car-t对肿瘤细胞有显著地杀伤效果;第8天进行car-t细胞输注治疗后,相较于egfrt car-t输注对照组,h90-11 car-t输注组小鼠在输注后至第15天肿瘤负荷(绝对发光量)增加放缓,第15天之后肿瘤负荷出现快速下降。绘制的小鼠的体重变化曲线图如图8c所示,输注egfrt car-t对照细胞的小鼠体重与输注h90-11 car-t细胞的小鼠体重相当;实验期间小鼠体重维持缓慢增长,说明car-t细胞输注不会造成严重毒性反应。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。