1.本发明属于酶活力检测技术领域,尤其涉及一种基于内滤效应的用于样品中碱性磷酸酶活力测定的比率荧光分析法。
背景技术:
2.碱性磷酸酶是一种重要的磷酸单酯酶,存在于包括血清在内的绝大多数人体组织中。碱性磷酸酶活力的异常变化与肝胆疾病、骨骼疾病、肾病以及癌症有关,因此便捷、灵敏、高选择性的alp活力检测对于疾病诊断至关重要。比色法,电化学法以及荧光分析法已经被用于alp活力检测。这些方法各有优势,但是都存在一些不可避免的问题,例如比色法灵敏度较低,电化学方法要求复杂的原理设计与化学修饰。荧光法简便、灵敏,在酶活力分析、免疫分析中得到广泛应用,然而常规的荧光法往往由于有机小分子染料较差的光稳定性、水不溶性而受到限制,此外生物基质对荧光团得影响也不容忽视。
3.近年来,量子点(qds)以其优异的光稳定性、良好的水溶性以及明亮的荧光而受到关注,并且作为一种新型荧光材料被广泛应用于药物、生物标志物、病毒的检测。在多数与量子点相关的荧光检测方法中,荧光信号的增强或者猝灭依赖于量子点与目标物或其他中间分子的相互作用,实现这种特异性相互作用的有效途径是将qds与分子印迹、适配体、抗体等识别工具偶联,然而这种偶联容易导致qds的聚集或发光强度的降低。实际上,构建高质量的识别工具功能化量子点仍是一个巨大的挑战。此外,荧光信号容易受到环境因素以及加样误差的影响,导致传统的荧光分析法检测结果波动较大、稳定性与重现性差。内滤效应(ife)是指体系中吸光物质的吸收光谱与荧光团的激发光谱或发射光谱重叠时,通过竞争性吸收激发光或发射光而导致荧光团猝灭的现象。内滤效应只需满足光谱重叠即可实现,并不要求吸光物质与荧光团之间有某种相互作用,因此这是一种实现无标记检测的重要途径。此外,由于量子点具有宽泛的激发光谱,以量子点作为荧光团时吸光物质的选择以及检测方法的设计更为灵活。近年来,基于量子点与内滤效应构建的荧光分析法已经应用于农药、治疗药物、生物标志物的检测。
4.在以往的报道中,荧光分析法已经用于碱性磷酸酶的活力检测。然而,生物基质对单波长荧光信号的严重干扰限制了这些方法在血清等复杂生物基质中的应用。在一些研究中,通常会采取稀释样品或者提取目标物等措施来降低基质对荧光信号的干扰,然而对样品的稀释也会导致目标物的稀释,这要求方法的灵敏度必须足够高;另外,繁琐的样品前处理过程既增加了操作人员的工作量,也可能导致检测结果的准确性下降。与单波长荧光分析法不同,比率荧光分析法以多个波长荧光强度比值作为检测信号。在某些情况下,多波长处的荧光强度在干扰物质存在时具有相同的变化趋势,虽然单波长处的荧光强度受到严重干扰,但多波长的荧光强度比值却几乎不受影响。比率荧光分析法已经成为一种降低生物基质干扰的重要途径,并且已经被用于生物基质中大分子与小分子的检测。因此,基于量子点与内滤效应的比率荧光分析法是实现生物基质中高选择性、高灵敏度、简便的碱性磷酸
酶活力检测的一种有前景的方法。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种基于内滤效应的用于样品中碱性磷酸酶活力测定的比率荧光分析法,本发明提出的基于内滤效应的比率荧光分析法具有无标记检测、无需样品前处理、较低的生物基质干扰的明显优势,为复杂生物基质中碱性磷酸酶活力检测提供了一种简便、灵敏、选择性、样品消耗少的新方法。
6.为了实现上述发明目的,本发明提供了以下技术方案:
7.本发明提供了一种基于内滤效应的用于样品中碱性磷酸酶活力测定的比率荧光分析法,包括以下步骤:
8.1)将样品与孵育缓冲液混合、孵育、静置,得到静置液;
9.所述孵育缓冲液包括:50mm二乙醇胺、1mm mgcl2和200~1000μm对硝基苯磷酸二钠,ph值为7.5~11.0;
10.所述孵育的温度为4~45℃,所述孵育的时间为15~120min;
11.2)将所述步骤1)得到的静置液与量子点溶液混合,得到混合液,以310nm激发,测定所述混合液在405nm和585nm下的荧光强度,得到585nm与405nm的荧光强度比值,定义为r,将空白样品的荧光强度比值定义为r0,得到r/r0;
12.所述量子点溶液包括:10mg/ml mn:zns和0.1mg/ml znse@zns;
13.3)将所述步骤2)得到的r/r0代入以下公式,得到样品中碱性磷酸酶活力;
14.当所述样品为alp溶液时,公式为:r/r0=0.03688c
alp
0.7513,r2=0.9969,其中c
alp
的单位为u/l;
15.当所述样品为血清时,公式为:r/r0=0.02085c
alp
1.098,r2=0.9907,其中c
alp
单位为:u/l;
16.当所述样品为hepg2细胞裂解液时,公式为:r/r0=0.0597c
hepg2
0.9932,r2=0.9983其中c
hepg2
的单位:个/ml。
17.优选的,所述mn:zns的制备方法包括以下步骤:
18.a、将硬脂酸锌、硬脂酸和1-十八烯在140℃下混合,得到锌储备液;
19.b、将硬脂酸锌、硬脂酸锰、硫粉、油胺和1-十八烯在100℃下混合,得到澄清溶液;
20.c、将所述步骤a得到的锌储备液与步骤b得到的澄清溶液在250℃下混合,温度持续30min,将得到的混合物抽滤、洗涤,将得到的沉淀物干燥,得到油溶性mn:zns;
21.d、将所述步骤c得到的油溶性mn:zns与氯仿、3-巯基丙酸混合、超声、离心,得到沉淀;
22.e、将所述步骤d得到的沉淀与四甲基氢氧化铵溶液混合、超声、离心,得到上清液,调节上清液的ph值为7~8后进行真空干燥,得到水溶性mn:zns,即得到mn:zns。
23.优选的,所述步骤a中硬脂酸锌的摩尔、硬脂酸的摩尔与1-十八烯的体积比为10mmol:10mmol:10ml;
24.所述步骤b硬脂酸锌的摩尔、硬脂酸锰的摩尔、硫粉的摩尔、油胺的摩尔和1-十八烯的体积比为1mmol:0.05mmol:5mmol:7.5mmol:50ml;
25.所述步骤c锌储备液与澄清溶液的体积比为1:5。
26.优选的,所述步骤d油溶性mn:zns的质量与氯仿的体积、3-巯基丙酸的体积比为1.5g:10ml:1.6ml;
27.所述超声的时间为30min;
28.所述离心的条件包括:离心力为2500g,离心时间为2min。
29.优选的,所述步骤e沉淀的质量与四甲基氢氧化铵溶液的体积比为1.5g:10ml;
30.所述超声的时间为5min;
31.所述离心的条件包括:离心力为2500g,离心时间为2min;
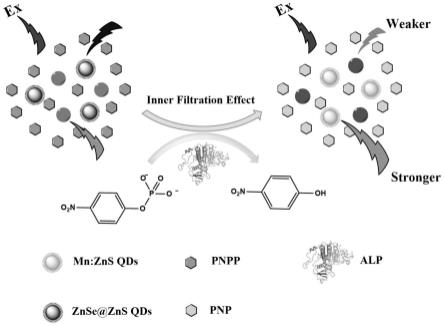
32.所述真空干燥的温度为50℃。
33.优选的,所述znse@zns的制备方法包括以下步骤:
34.a、将硒粉、硼氢化钠和去离子水混合、搅拌、冰浴,收集上清液;
35.b、将硫酸锌、还原型谷胱甘肽、去离子水混合,调节ph值为10.5后加入步骤a得到的上清液,依次搅拌、回流,得到znse量子点溶液;
36.c、将所述步骤b得到的znse量子点溶液与硫酸锌、3-巯基丙酸混合,调节ph值为10.5后,依次搅拌、回流得到znse@zns溶液,与无水乙醇混合、离心,得到的沉淀为znse@zns。
37.优选的,所述步骤a中硒粉的摩尔、硼氢化钠的摩尔和去离子水的体积比为0.1mmol:0.6mmol:1ml;所述搅拌的时间为40min;所述冰浴的时间为10min;
38.所述步骤b中硫酸锌的摩尔与还原型谷胱甘肽的摩尔、去离子水的体积比为0.4mmol:0.5mmol:100ml;所述搅拌的时间为30min;所述回流的时间为1.5h。
39.优选的,所述步骤c中znse量子点溶液的体积与硫酸锌的摩尔、3-巯基丙酸的体积比为20ml:0.1mmol:26μl;
40.所述搅拌的时间为1h;
41.所述回流的时间为1h;
42.所述离心的条件包括:离心力为2500g,离心时间为30min。
43.优选的,所述孵育缓冲液中对硝基苯磷酸二钠的含量为600μm,所述孵育缓冲液的ph值为10.0;
44.所述孵育的温度为37℃,所述孵育的时间为75min。
45.本发明提供的方法的原理如下:
46.本发明提出了一种基于内滤效应与两种量子点(znse@zns与mn:zns)的比率荧光分析法,用于生物基质中碱性磷酸酶活力的简便、高选择性、高灵敏检测。首先,由于对硝基苯磷酸二钠(pnpp)与两种量子点激发光谱高度重叠,在310nm激发光的照射下,两种量子点均由于pnpp的内滤效应而被猝灭。碱性磷酸酶(alp)存在时,pnpp被催化水解为对硝基酚(pnp),后者吸收带从310nm红移至405nm。随着pnpp的消耗,mn:zns量子点在585nm处的荧光强度随着内滤效应的解除而逐渐增强。同时,pnp的吸收带与znse@zns发射峰产生重叠,随着pnp浓度的升高,znse@zns量子点在405nm处的荧光强度随着内滤效应的增强而逐渐下降。585nm与405nm处的荧光强度比值(f
585
/f
405
)随着碱性磷酸酶活力的升高而增大,并在4~96u/l范围内呈现良好的线性,检测限低至0.57u/l。该方法在血清与hepg2细胞裂解液中也表现出良好的适用性。此外,将此方法在实际样品中的检测性能与商品化碱性磷酸酶检测试剂盒进行比较,两种方法检测结果相似,表明此方法在临床样品检测中有很大的潜力。
47.本发明的有益效果为:
48.(1)本发明对于碱性磷酸酶活力检测有较高的灵敏度和较好的定量性能。
49.在所采用的的最适条件下,对于不同活力的碱性磷酸酶溶液样品进行检测。随着alp样品活力的升高,孵育体系在585nm附近的荧光强度明显升高,而在405nm附近的荧光强度则逐渐降低,这与设计原理相符。比率荧光信号r/r0与样品碱性磷酸酶活力呈现正相关(图3中e),并且在4-96u/l范围内r/r0与碱性磷酸酶活力呈现良好的线性(r/r0=0.03688c
alp
0.7513,r2=0.9969),根据3σ/k原则推算,检测限可低至0.57u/l。根据以往的研究,正常成年人血清alp活力范围为20~140u/l,该方法的灵敏度完全可以满足临床检测的要求。
50.(2)本发明对于碱性磷酸酶的检测具有很好的选择性
51.为了评估此方案的选择性,以临床样品中的常见物质作为干扰样品,以干扰样品溶液替换碱性磷酸酶样品,按照与碱性磷酸酶检测相同的方法进行检测。血清中常见的金属离子以及常见氨基酸对比率荧光信号r/r0的影响较小,接近于对照组(图3中g);而100u/l的碱性磷酸酶样品导致了r/r0的明显升高,表明检测方法对血清样品中的金属离子、氨基酸以及葡萄糖等常见小分子有良好的选择性。
52.此外,在考察范围内,所有的大分子均几乎不影响检测信号,与对照组结果高度一致(图3中h)。更重要的是,以热灭活人血清(内源性alp在65℃下处理10min后可失去活性)进一步考察了血清基质的干扰,结果表明即使是未经稀释的灭活血清也不会导致比率荧光信号r/r0产生明显变化,结果与对照组极为接近。上述结果表明此方法对蛋白质有良好的选择性,并且几乎不受血清基质的干扰。
53.(3)该方案性能可靠,不仅可以用于血清样品检测,还可以用于细胞裂解液中的碱性磷酸酶活力分析与肿瘤细胞检测。操作简便,由于几乎不受生物基质影响,无需进行任何样品前处理,极大简化了检测过程。检测结果准确性好,精密度高。
54.检测结果进一步表明,即使将alp样品基质由缓冲液替换为灭活人血清,比率荧光信号r/r0在4~96u/l范围内依旧存在良好的线性关系(r/r0=0.02085c
alp
1.098,r2=0.9907);进一步地,以三名健康志愿者的血清作为检测样本,分别以本方案的方法与商品化试剂盒的方法进行检测,结果显示两种方法检测结果总体趋势一致(图4中b);此外,以商品化人血清进行加标回收率实验,结果显示加标回收率为109.8%~116.7%,rsd≤2.9%(表3)。上述结果表明本方案的提出的方法能够用于真实血清样品中的碱性磷酸酶活力检测,且准确度高,精密度好,总体性能与商品化试剂盒接近。
55.此外,本发明所提出的方法还可用于细胞裂解液碱性磷酸酶活力检测。不同细胞密度的hepg2悬浮液按照本方案所提出的裂解方式进行化学裂解后,按照本方案所提出的方法进行检测,比率荧光信号r/r0与细胞密度在0.2
×
105~3.2
×
105cells/ml范围内线性良好(r/r0=0.05927c
hepg2
0.9932,r2=0.9983)。图4中d显示只有经过化学裂解后hepg2悬浮液才能导致比率荧光信号r/r0升高,并且热灭活后或碱性磷酸酶抑制剂原钒酸钠处理后信号再次降低,表明本发明所采用的化学裂解法是可行的。通过这种方式,考虑到所使用的样品量仅为20μl,实际上可以检测到的hepg2细胞数目可低至400个,证明本发明所提出的方法不仅可以用于血清样品碱性磷酸酶检测,还有望用于肿瘤细胞的定量检测。
56.(4)本发明所使用的纳米材料毒性低,环境友好,操作过程安全。
57.与含有镉、汞、碲等高毒性成分的传统量子点不同,本发明采用的znse@zns量子点与mn:zns量子点不含高毒性元素,环境友好,对操作人员的潜在危害更小。在本发明的方法中,mn:zns量子点的终浓度为2.5mg/ml,znse@zns量子点终浓度为25μg/ml。根据实验结果,在此浓度下,两种量子点对hepg2细胞活力影响较小,提示两种量子点在生物毒性较低,操作过程更加安全。
附图说明
58.图1为znse@zns qds与mn:zns qds的形貌、结构、光学特性表征,其中(a-c)油溶性mn:zns qds,水溶性mn:zns qds,znse@zns qds的tem图像与sead图像;(d-e)油溶性mn:zns qds与水溶性znse@zns的eds图谱;(f-g)水溶性mn:zns qds与znse@zns qds的荧光光谱与紫外-可见吸收光谱,其中插图为254nm紫外灯照射以及日光灯下的照片;
59.图2为znse@zns qds与mn:zns qds的生物相容性与表面基团表征,其中(a)znse@zns qds与mn:zns qds的ftir图谱;(b-c)hepg2细胞在含有不同浓度mn:zns qds或znse@zns qds的培养液中孵育24h后的细胞活力;(d)znse@zns qds与mn:zns qds在加入以下物质后在室温下孵育1h后的荧光强度:(a)不加入其他物质;(b)加入600μm pnpp;(c)加入600μm pnpp与100u/l碱性磷酸酶;(e)mn:zns qds(c)与znse@zns qds(b)的激发光谱与pnpp吸收光谱(a)的重叠情况;(f)不同活力的alp(0、16、32、64、96u/l)存下在检测体系的吸收光谱;(g)znse@zns qds(b)、mn:zns qds(d)发射光谱与pnpn(a)、pnp(c)吸收光谱的重叠情况;
60.图3为alp检测条件优化与alp溶液样品检测方法验证,其中(a-d)孵育缓冲液ph、孵育温度、pnpp浓度、孵育时间对检测信号r/r0的影响;其中r与r0分别为alp存在与不存在时体系中585nm与405nm处的荧光强度比值(f
585
/f
405
);(e)不同活力的alp(0、4、8、16、32、64、96u/l)存在下孵育体系的荧光光谱;(f)在0~256u/l范围内比率荧光信号r/r0与alp活力的关系图,插图为二者在4~96u/l范围内的线性关系;(g)比率荧光分析法对小分子干扰物质的选择性,其中na
、k
、so
42-的浓度为100mm,ca
2
、mg
2
浓度为1mm,zn
2
、fe
3
、mn
2
浓度为5μm,谷胱甘肽以及所有的氨基酸浓度均为1mm,葡萄糖浓度为10mm,alp活力为100u/l;(h)比率荧光分析法对大分子干扰物质的选择性,其中胰蛋白酶(trypsin)、胃蛋白酶(pepsin)、蛋白酶k(proteinase k)、牛血清白蛋白(bsa)浓度为1mg/ml,凝血酶(thrombin)活力为100000u/l,灭活人血清由正常人血清在65℃下水浴加热10min制备得到,alp活力为100u/l;
61.图4为人血清与hepg2裂解液样品检测结果,其中(a)比率荧光信号r/r0与加标灭活人血清中alp活力之间的线性关系;其中r与r0分别为alp存在与不存在时体系中585nm与405nm处的荧光强度比值(f
585
/f
405
);(b)商用试剂盒与本发明所建立的比率荧光分析法对3名成年志愿者血清样品的检测结果;(c)比率荧光信号r/r0与细胞悬液中hepg2细胞密度的线性关系;(d)hepg2细胞悬液(3.2
×
105个/ml)经过不同处理后(不经裂解、化学裂解、化学裂解 热灭活)的比率荧光信号r/r0的变化;(e)hepg2裂解液(1
×
105个/ml)经过不同浓度的alp抑制剂原钒酸钠处理后比率荧光信号r/r0的变化,细胞裂解液在检测前与原钒酸钠溶液在4℃下孵育30min;
62.图5为基于内滤效应的碱性磷酸酶检测原理图。
具体实施方式
63.本发明提供了一种基于内滤效应的用于样品中碱性磷酸酶活力测定的比率荧光分析法,包括以下步骤:
64.1)将样品与孵育缓冲液混合、孵育、静置,得到静置液;
65.所述孵育缓冲液包括:50mm二乙醇胺、1mm mgcl2和200~1000μm对硝基苯磷酸二钠,ph值为7.5~11.0;
66.所述孵育的温度为4~45℃,所述孵育的时间为15~120min;
67.2)将所述步骤1)得到的静置液与量子点溶液混合,得到混合液,以310nm激发,测定所述混合液在405nm和585nm下的荧光强度,得到585nm与405nm的荧光强度比值,定义为r,将空白样品的荧光强度比值定义为r0,得到r/r0;
68.所述量子点溶液包括:10mg/ml mn:zns和0.1mg/ml znse@zns;
69.3)将所述步骤2)得到的r/r0代入以下公式,得到样品中碱性磷酸酶活力;
70.当所述样品为alp溶液时,公式为:r/r0=0.03688c
alp
0.7513,r2=0.9969,其中c
alp
的单位为u/l;
71.当所述样品为血清时,公式为:r/r0=0.02085c
alp
1.098,r2=0.9907,其中c
alp
单位为:u/l;
72.当所述样品为hepg2细胞裂解液时,公式为:r/r0=0.0597c
hepg2
0.9932,r2=0.9983其中c
hepg2
的单位:个/ml。
73.本发明将样品与孵育缓冲液混合、孵育、静置,得到静置液;所述孵育缓冲液包括:50mm二乙醇胺、1mm mgcl2和200~1000μm对硝基苯磷酸二钠,ph值为7.5~11.0;所述孵育的温度为4~45℃,所述孵育的时间为15~120min。
74.在本发明中,所述孵育缓冲液中对硝基苯磷酸二钠的含量优选为600μm,所述孵育缓冲液的ph值优选为10.0;所述孵育的温度优选为37℃,所述孵育的时间优选为75min。在本发明中,所述样品包括alp溶液和/或血清和/或hepg2细胞裂解液,本发明对所述alp溶液、血清和hepg2细胞裂解液的处理方法没有特殊限定,本领域技术人员按照常规操作即可。在本发明中,所述静置的时间优选为10min。
75.本发明将得到的静置液与量子点溶液混合,得到混合液,以310nm激发,测定所述混合液在405nm和585nm下的荧光强度,得到585nm与405nm的荧光强度比值,定义为r,将空白样品的荧光强度比值定义为r0,得到r/r0;所述量子点溶液包括:10mg/ml mn:zns和0.1mg/ml znse@zns。
76.在本发明中,所述mn:zns的制备方法优选包括以下步骤:
77.a、将硬脂酸锌、硬脂酸和1-十八烯在140℃下混合,得到锌储备液;
78.b、将硬脂酸锌、硬脂酸锰、硫粉、油胺和1-十八烯在100℃下混合,得到澄清溶液;
79.c、将所述步骤a得到的锌储备液与步骤b得到的澄清溶液在250℃下混合,温度持续30min,将得到的混合物抽滤、洗涤,将得到的沉淀物干燥,得到油溶性mn:zns;
80.d、将所述步骤c得到的油溶性mn:zns与氯仿、3-巯基丙酸混合、超声、离心,得到沉淀;
81.e、将所述步骤d得到的沉淀与四甲基氢氧化铵溶液混合、超声、离心,得到上清液,调节上清液的ph值为7~8后进行真空干燥,得到水溶性mn:zns,即得到mn:zns。
82.本发明优选将硬脂酸锌、硬脂酸和1-十八烯在140℃下混合,得到锌储备液。在本发明中,所述硬脂酸锌的摩尔、硬脂酸的摩尔与1-十八烯的体积比优选为10mmol:10mmol:10ml。在本发明中,所述硬脂酸锌的摩尔、硬脂酸锰的摩尔、硫粉的摩尔、油胺的摩尔和1-十八烯的体积比优选为1mmol:0.05mmol:5mmol:7.5mmol:50ml。在本发明中,所述锌储备液与澄清溶液的体积比优选为1:5。在本发明中,所述油溶性mn:zns的质量与氯仿的体积、3-巯基丙酸的体积比优选为1.5g:10ml:1.6ml。在本发明中,所述超声的时间优选为30min。在本发明中,所述离心的条件优选包括:离心力为2500g,离心时间为2min。在本发明中,所述沉淀的质量与四甲基氢氧化铵溶液的体积比优选为1.5g:10ml。在本发明中,所述超声的时间优选为5min。在本发明中,所述离心的条件优选包括:离心力为2500g,离心时间为2min。在本发明中,所述真空干燥的温度优选为50℃。
83.在本发明中,所述znse@zns的制备方法优选包括以下步骤:
84.a、将硒粉、硼氢化钠和去离子水混合、搅拌、冰浴,收集上清液;
85.b、将硫酸锌、还原型谷胱甘肽、去离子水混合,调节ph值为10.5后加入步骤a得到的上清液,依次搅拌、回流,得到znse量子点溶液;
86.c、将所述步骤b得到的znse量子点溶液与硫酸锌、3-巯基丙酸混合,调节ph值为10.5后,依次搅拌、回流得到znse@zns溶液,与无水乙醇混合、离心,得到的沉淀为znse@zns。
87.在本发明中,所述硒粉的摩尔、硼氢化钠的摩尔和去离子水的体积比优选为0.1mmol:0.6mmol:1ml;所述搅拌的时间为40min;所述冰浴的时间为10min。在本发明中,所述硫酸锌的摩尔与还原型谷胱甘肽的摩尔、去离子水的体积比优选为0.4mmol:0.5mmol:100ml。在本发明中,所述搅拌的时间优选为30min。在本发明中,所述回流的时间优选为1.5h。在本发明中,所述znse量子点溶液的体积与硫酸锌的摩尔、3-巯基丙酸的体积比优选为20ml:0.1mmol:26μl。在本发明中,所述搅拌的时间优选为1h。在本发明中,所述回流的时间优选为1h。在本发明中,所述离心的条件优选包括:离心力为2500g,离心时间为30min。
88.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
89.实施例1
90.(1)制备水溶性mn:zns量子点
91.为了制备高质量的mn:zns量子点,首先在1-十八烯中合成了油胺修饰的油溶性mn:zns量子点,然后在在氯仿中进行了配体交换得到表面3-巯基丙酸修饰的水溶性mn:zns量子点。
92.在一个50ml烧杯中加入硬脂酸锌(10mmol)、硬脂酸(10mmol)、1-十八烯(10ml),预热到140℃得到锌储备液,在140℃下保温备用。在一个100ml四颈烧瓶中加入硬脂酸锌(1mmol)、硬脂酸锰(0.05mmol)、硫粉(5mmol)、油胺(7.5mmol)、1-十八烯(50ml),加热至100℃得到澄清溶液,氮气鼓泡10min。封闭反应体系,继续通入氮气并保持20min以充分除去空气。迅速加热至270℃,持续5min,然后降温至250℃,一次性注入锌储备液,在250℃下保持30min。停止加热,冷却到室温。反应混合物抽滤并用正己烷洗涤三次以除去1-十八烯,沉淀物在40℃下烘干并研成细粉,加入100ml正己烷并超声5min,抽滤,沉淀物重复用正己烷提取至滤液几乎没有荧光。滤液合并后旋蒸浓缩并在65℃下烘干,得到褐色固体,即为油溶性
mn:zns量子点。
93.油溶性mn:zns量子点的相转移采用配体交换策略。将1.5g油溶性mn:zns溶解于氯仿(10ml)中,在剧烈搅拌下加入3-巯基丙酸(1.6ml),超声30min,2500g离心2min,弃去上清液,沉淀用氯仿洗涤3次以除去过量的3-巯基丙酸。在沉淀中加入10ml四甲基氢氧化铵溶液(1m),超声5min,2500g离心2min,收集上清液。沉淀重复用四甲基氢氧化铵溶液提取直至上清液几乎没有荧光。上清液合并后用浓盐酸调节ph至7~8,旋蒸浓缩,50℃真空干燥过夜,得到水溶性mn:zns量子点。
94.(2)制备水溶性znse@zns量子点
95.首先,在一个25ml三颈烧瓶中加入硒粉(0.1mmol)、硼氢化钠(0.6mmol),加入去离子水(1ml),迅速通入氮气,在室温下搅拌40min,得到无色透明溶液,冰浴10min,上清液即为nahse溶液。在一个250ml三颈烧瓶中加入七水合硫酸锌(0.4mmol)与还原型谷胱甘肽(0.5mmol),加入去离子水(100ml),用氢氧化钠溶液(1m)调节ph至10.5,注入nahse溶液,剧烈搅拌30min,然后回流1.5h,得到znse量子点溶液。在20ml znse量子点溶液中加入七水合硫酸锌(0.1mmol)与3-巯基丙酸(26μl),用氢氧化钠溶液(1m)调节ph至10.5。剧烈搅拌1h,回流1h,得到znse@zns溶液。znse@zns溶液旋蒸浓缩至原体积的1/3,加入三倍体积无水乙醇,2500g离心30min收集沉淀,50℃真空干燥得到znse@zns量子点。
96.(3)基于内滤效应的碱性磷酸酶比率荧光检测
97.为了得到最强的检测信号,分别对孵育缓冲液ph、孵育温度、pnpp浓度、孵育时间进行了考察。
98.孵育缓冲液ph考察:孵育温度为25℃,pnpp浓度为400μm,孵育时间为60min;孵育缓冲液ph值分别为7.5、8.0、8.5、9.0、9.5、10.0、11.0。每个ph条件设置3个平行的实验组。
99.孵育温度考察:孵育缓冲液ph为10.0,pnpp浓度为400μm,孵育时间为60min;孵育温度分别为4℃、25℃、37℃、45℃。每个温度条件设置3个平行的实验组。
100.pnpp浓度考察:孵育温度为37℃,孵育缓冲液ph为10.0,孵育时间为60min;pnpp浓度分别为0、200、400、600、800、1000μm。每个pnpp浓度条件设置3个平行的实验组。
101.孵育时间考察:孵育温度为37℃,孵育缓冲液ph为10.0,pnpp浓度为600μm;孵育时间分别为0、15、30、45、60、75、90、105、120min。每个孵育时间条件设置3个平行的实验组。
102.进行条件考察时的检测程序如下:首先,在96孔板中加入20μl不同浓度的alp样品或空白样品,加入130μl孵育缓冲液(50mm二乙醇胺,不同ph,含1mm mgcl2,不同浓度的pnpp),吹打混匀。反应液在不同温度下孵育不同时间,在室温下静置10min后,加入50μl量子点溶液(含10mg/ml mn:zns,0.1mg/ml znse@zns),吹打混匀。以310nm激发,测定405nm与585nm荧光强度。
103.基于ife效应的溶液样品碱性磷酸酶活力测定采用以下最适方式进行。首先,在96孔板中加入20μl不同活力(0、4、8、16、32、64、96、128、192、256u/l)的alp样品或空白样品,加入130μl孵育缓冲液(50mm二乙醇胺,ph=10.0,含1mm mgcl2,600μm pnpp),吹打混匀。反应液在37℃下孵育75min,在室温下静置10min后,加入50μl量子点溶液(含10mg/ml mn:zns,0.1mg/ml znse@zns),吹打混匀。以310nm激发,测定405nm与585nm荧光强度。
104.标准曲线的制备方式如下所示:将样品检测结果中585nm与405nm荧光强度比值(f
585
/f
405
)定义为r,空白样品的对应数值定义为r0,以r/r0作为与碱性磷酸酶活力相关的
检测信号。检测数据通过graphpad prism 5.0软件进行数据处理,以r/r0对样品碱性磷酸酶活力进行回归分析,以1/x作为权重(其中x为碱性磷酸酶活力)。
105.进行灵敏度考察时,分别在上述最适条件下测定6份空白样品,以f
585
/f
405
作为对应样品的r值,以6份样品r值的均值作为r0,并分别得到6份空白的r/r0比值。以6份空白样品的r/r0的标准偏差(sd)作为σ,以标准曲线方程斜率作为k,将3σ/k的数值定义为方法检测限。
106.结果:
107.znse@zns qds与mn:zns qds的表征
108.tem图像显示油溶性和水溶性mn:zns量子点为球形颗粒,大小分别为3.68
±
0.78nm(图1中a)和4.49
±
0.73nm(图1中b),sead图像显示mn:zns量子点在配体交换和相转移过程中晶型没有发生变化。图1中c显示znse@zns量子点形貌为粒径2.93
±
0.50nm的球形颗粒。mn:zns量子点的eds谱图显示了锰元素的特征谱线(图1中d),表明锰已经成功掺杂到zns晶格中。
109.量子点的光学性质如图1中f和图1中g所示,mn:zns量子点和znse@zns量子点的最大发射峰分别为585nm和385nm。吸收光谱显示znse@zns量子点在360nm附近存在激子吸收峰(图1中g),这与以往的报道一致。从表1和表2中可以看出,mn:zns量子点和znse@zns量子点的相对荧光量子产率分别为27.8%和24.6%,这说明所合成的量子点具有明亮的荧光,有助于获得更强的检测信号。
110.表1 mn:zns qds荧光量子产率的计算
[0111][0112]
表2 znse@zns qds荧光量子产率的计算
[0113][0114]
油溶性mn:zns qds的ftir光谱在2850cm-1
、2918cm-1
和721cm-1
处出现明显的吸收峰(图2中a),分别归属于亚甲基对称、不对称伸缩振动和弯曲振动。亚甲基的弯曲振动表明油溶性mn:zns量子点表面存在油胺的长碳链(碳原子数》4)。而水溶性mn:zns量子点则没有上述峰。此外,1732cm-1
处的峰虽然不明显,但仍然可以表明羰基的存在。以上结果表明,3-巯基丙酸已经成功地取代了油溶性mn:zns qds表面的油胺,此外,橙黄色的荧光从氯仿层迁移到水层也证实了相转移的发生。
[0115]
znse@zns量子点的ftir光谱如图2中a所示,1604cm-1
和1398cm-1
处的峰归属于c=o在电离羧基中的不对称和对称伸缩振动。在1531cm-1
和1307cm-1
处的峰归属于n-h键的弯曲振动和酰胺键中c-n键的对称伸缩振动。这些结果表明,3-巯基丙酸与谷胱甘肽实际上在znse@zns表面是共存的。
[0116]
此外,znse@zns qds和mn:zns qds具有良好的生物相容性。即使znse@zns qds和mn:zns qds的浓度分别达到25μg/ml(图2中c)和1.5mg/ml(图2中b),也未见明显的细胞毒性。低毒性的量子点不仅对操作人员具有的潜在危险更小,而且对环境更为友好。
[0117]
alp检测的可行性分析结果:
[0118]
首先,进行了基于ife的alp检测的可行性分析。znse@zns qds和mn:zns qds在600μm pnpp的存在下荧光急剧淬灭(图2中d),这是因为pnpp的吸收光谱和两种量子点的激发光谱之间存在广泛的重叠(图2中e)。图2中d中的c线显示在alp存在下mn:zns qds的荧光在一定程度上恢复了。这是因为在alp存在下,pnpp被水解为pnp,导致反应体系吸收光谱红移(图2中f)。因此,pnpp对mn:zns qds产生的ife随着pnpp的水解逐渐减轻,而pnp的吸收带不再与mn:zns qds的激发波长重叠。与此同时,znse@zns量子点的荧光强度却进一步降低,图2中g中的b线和c线清楚地显示了znse@zns量子点的pnp吸收光谱和发射光谱存在高度的重叠,这导致pnp对znse@zns qds产生了强烈地ife,并导致了znse@zns qds进一步地猝灭。
[0119]
简单来说,当alp催化pnpp水解时,mn:zns量子点和znse@zns量子点的荧光强度相反,导致比率荧光信号(f
585
/f
405
)增大,从而将比率荧光信号与alp活力联系起来。
[0120]
基于内滤效应的alp活力比率荧光检测结果:
[0121]
为了获得更高的灵敏度,对孵育缓冲液的ph、孵育温度、pnpp浓度和孵育时间进行了考察。由于碱性磷酸酶活性受ph和温度的影响较大,因此首先对孵育缓冲液ph和孵育温度进行了考察。当孵育缓冲液ph为10.0时(图3中a),孵育温度为37℃时(图3中b),比率荧光信号(r/r0)达到最大值。根据以往的报道,碱性环境能够为底物的去磷酸化反应提供足够的氢氧根离子,有助于提高alp的活性。因此,在最佳的ph和温度下,由于alp活力增强,比率荧光信号也得以增强。
[0122]
孵育缓冲液中pnpp浓度对比率荧光信号的影响比较复杂。一方面,底物(pnpp)浓度过低时去磷酸化反应速度较慢,因此在有限的孵育时间内检测信号较弱;另一方面,当pnpp浓度过高时,由于pnpp消耗率较低,在孵育结束后pnpp浓度仍然很高,这导致znse@zns qds和mn:zns qds在孵育结束后仍然会被完全猝灭,无法观测到比率荧光信号的变化。由图3中c可知,随着pnpp浓度的增加,比率荧光信号r/r0值逐渐增大,当pnpp浓度达到600μm时,r/r0达到最大值,因此在后续的检测中,pnpp的浓度选择为600μm。最后,为了缩短分析周期,同时兼顾较强的检测信号,考察了孵育时间。由图3中d可以发现,随着孵育时间的延长,r/r0值逐渐增大。当孵育时间大于75min时,r/r0变化幅度明显降低,因此选择75min为最佳孵育时间。
[0123]
在最佳条件下(孵育缓冲液ph为10.0,孵育温度为37℃,pnpp浓度为600μm,孵育时间为75min)进行碱性磷酸酶活力的体外检测。如图3中e所示,随着alp活性的增加,检测体系在585nm处的荧光强度逐渐增大,而在405nm处的荧光强度逐渐减小。比率荧光信号(r/r0)与alp活力在4~96u/l范围内线性良好(fig.4f,r/r0=0.03688c
alp
0.7513,r2=0.9969),检测限为0.57u/l(3σ/k)。所建立的比率荧光分析法的检测限(lod)与以往报道的
方法相当或更低(表4)。根据文献报道,人血清中alp活力的正常水平为20~140u/l,所建立的比率荧光分析法的灵敏度完全能够满足人血清中alp活力的测定。
[0124]
比率荧光分析法的选择性结果:
[0125]
为了验证所建立的比率荧光分析法对alp活力检测的选择性,在alp活力检测相同的条件下检测无机离子(na
、k
、ca
2
、mg
2
、fe
3
、zn
2
、mn
2
、so
42-)、氨基酸(lys、his、arg、trp、cys、met、ser)、葡萄糖、gsh和蛋白质(胰蛋白酶、胃蛋白酶、牛血清白蛋白、蛋白酶k、凝血酶)。如图3中g所示,实验中所考察的绝大部分小分子物质并没有导致比率荧光信号r/r0明显上升。并且,在实验中考察的所有蛋白质对r/r0的影响可以忽略不计(图3中h)。此外,我们还研究了灭活人血清对比率荧光信号的影响,结果显示,灭活人血清的检测信号与对照组的检测信号即为接近(图3中h)。上述实验结果表明该方法具有良好的选择性,对人血清中碱性磷酸酶活性的检测具有很大的潜力。
[0126]
实施例2
[0127]
人血清样品制备与血清样品检测磷酸酶活力检测:
[0128]
人血清制备采用以下方式进行。全血在室温下静置1h后,1500g离心10min,淡黄色上清液即为血清。采集得到的血清在-20℃下保存直至检测。
[0129]
血清样品的检测方法与实施例1最佳的方法相同,但是将alp溶液样品替换为等体积的血清样品。
[0130]
结果为:
[0131]
如图4中a所示,在加标灭活人血清中,比率荧光信号r/r0与加标alp活力线性良好(4~96u/l,r2=0.9907)。为探讨该检测方法在临床样品alp活力检测中的适用性,采用商品化试剂盒和本发明建立的比率荧光分析法对3名成人志愿者的血清样品分别进行检测。从图4中b可以看出,两种方法检测所得结果接近。
[0132]
为了进一步验证比率荧光分析法准确检测人血清alp活性的准确性,对加标人血清样品进行了检测,实验结果显示加标血清样品的平均加标回收率为109.8%~116.7%(表3)。上述结果表明,本发明所建立的比率荧光分析法对能够准确测定临床样品中的碱性磷酸酶活力,在alp活力的临床检测中有着巨大的应用前景。
[0133]
表3加标人血清样品的加标回收率(means
±
sd,n=6)
[0134][0135]
实施例3
[0136]
hepg2细胞裂解液制备与hepg2细胞裂解液碱性磷酸酶活力检测:
[0137]
hepg2细胞裂解液的制备采用以下方式进行。hepg2细胞在添加1%青霉素/链霉素
与10%胎牛血清的rpmi1640培养基中培养,培养温度为37℃,含5%二氧化碳。hepg2培养物以胰蛋白酶-edta消化液消化2min后,重悬浮于10mm hepes缓冲液(ph=7.4,含137mm nacl,3mm kcl)中,1000g离心5min,收集hepg2细胞,细胞重分散于10mm hepes缓冲液(ph=7.4,含137mm nacl,3mm kcl)中并以hepes缓冲液稀释至所需细胞密度。100μl hepg2细胞悬浮液中加入20μl裂解缓冲液(10mm hepes,ph=7.4,含137mm nacl,3mm kcl,0.2%tritonx-100),混匀,再4℃下孵育30min,即得hepg2细胞裂解液。
[0138]
hepg2细胞裂解液碱性磷酸酶检测方法与实施例1的最佳方法相同,但是将alp溶液替换为等体积的hepg2细胞裂解液。
[0139]
hepg2裂解液中的alp活力检测结果:
[0140]
根据文献报道,alp活力的上调通常出现在包括hepg2在内的某些肿瘤细胞中,因此我们用hepg2细胞来评价所建立的比率荧光分析法检测肿瘤细胞裂解液中alp活力的性能。
[0141]
由图4中c可知,比率荧光信号r/r0随着hepg2细胞密度的增加而严格增加,在0.2
×
105~3.2
×
105个/ml范围内线性良好(r2=0.9983)。考虑到样品体积较低(20μl),此方法对hepg2细胞的检测范围能够低至400个细胞。为了排除基质的干扰,在相同条件下对未裂解的hepg2细胞悬液和灭活的hepg2细胞裂解液样品进行检测,结果显示只有未经热灭活的hepg2裂解液的比值荧光信号(r/r0)增加,与对照组相比,未经裂解的hepg2悬浮液和以及灭活裂解液的信号变化不大(图4中d)。此外,随着na3vo4(一种经典的碱性磷酸酶抑制剂)浓度的增加,经na3vo4处理的hepg2裂解液的信号也明显降低(图4中e)。上述实验结果表明,在hepg2裂解液中,导致r/r0值升高的是alp而不是基质,同时也说明所建立的比率荧光分析法能够应用于肝癌细胞的检测。
[0142]
本发明建立了一种基于ife的比率荧光分析法用于测定生物样品中的alp活力,其中mn:zns qds和znse@zns qds能够响应pnpp和pnp浓度的变化,随着alp活性的增加,比率荧光信号(r/r0)增强。该方法灵敏度高,检出限为0.57u/l,样品消耗少(20μl)。值得一提的是,改方法在生物基质中进行碱性alp活力测定时具有极佳的特异性,检测过程简单,无需对样品进行任何预处理。在实际样品的检测中,比率荧光分析法的检测性能与商品化试剂盒接近,对血清样品的加标回收率为109.8%~116.7%。此外,该方法还成功应用于hepg2细胞中alp活性的测定,并且检测信号与hepg2细胞数目之间存在良好的线性关系,有望用于肿瘤的早期诊断。总而言之,本发明所开发的基于ife的比率荧光分析法将为检测复杂生物基质中的alp活力提供一种新颖的策略。
[0143]
表4不同分析方法对碱性磷酸酶活力检测的性能比较
[0144][0145][0146]
表4中的文献来源:
[0147]
[1]cai,m.,ding,c.,wang,f.,ye,m.,zhang,c.,xian,y.,2019.biosens.bioelectron.137,148
–
153.
[0148]
[2]huang,x.,lan,m.,wang,j.,guo,l.,lin,z.,zhang,f.,zhang,t.,wu,c.,qiu,b.,2021.anal.chim.acta.1142,65
–
72.
[0149]
[3]li,y.,xie,r.,pang,x.,zhou,z.,xu,h.,gu,b.,wu,c.,li,h.,zhang,y.,2019.talanta 205.120143.
[0150]
[4]mao,g.,zhang,q.,yang,y.,ji,x.,he,z.,2019.anal.chim.acta.1047,208
–
213.
[0151]
[5]qi,w.,fu,y.,zhao,m.,he,h.,tian,x.,hu,l.,zhang,y.,2020.anal.chim.acta.1097,71
–
77.
[0152]
[6]sun,w.,han,x.,qu,f.,kong,r.m.,zhao,z.,2021.analyst 146,2862
–
2870.
[0153]
[7]tong,x.,zhu,y.,tong,c.,shi,s.,long,r.,guo,y.,2021.anal.chim.acta.1178.338829.
[0154]
[8]wang,w.x.,jiang,w.l.,guo,h.,li,y.,li,c.y.,2021.chem.commun.57,480
–
483.
[0155]
[9]zhang,x.,ren,c.,hu,f.,gao,y.,wang,z.,li,h.,liu,j.,liu,b.,yang,c.,2020.anal.chem.92,5185
–
5190.
[0156]
[10]zhang,y.j.,guo,l.,chen,s.,yu,y.l.,wang,j.h.,2020.anal.chim.acta.1108,54
–
60.
[0157]
[11]zhao,m.,gao,y.,ye,s.,ding,j.,wang,a.,li,p.,shi,h.,2019.analyst 144,6262
–
6269.
[0158]
[12]zhu,y.,tong,x.,wei,q.,cai,g.,cao,y.,tong,c.,shi,s.,wang,f.,2022.biosens.bioelectron.196.113691.
[0159]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。