1.本发明涉及免疫治疗领域,更具体地,涉及一种用于预测肿瘤免疫治疗疗效的基因集、评分体系及其应用。
背景技术:
2.免疫治疗开创了肿瘤治疗的新纪元,为多种肿瘤如黑色素瘤、非细胞肺癌、膀胱癌、结直癌、胃癌、头颈部肿瘤、肝癌及淋巴瘤等带来了新的希望,尤其是免疫检查点抑制剂(immune checkpoint blockade,icb)免疫治疗,如:pd-1/pd-l1、ctla4抑制剂在多种肿瘤中均起到有效的治疗作用。约有20%的患者在接受免疫检查位点抑制剂治疗即免疫治疗后会取得长期获益,并最终延长生存期,但是,也有大部分患者对免疫治疗反应效果不佳。因此,通过生物标志物筛选出适合免疫治疗的人群显得十分必要,便于对不同患者选择合适的治疗方案,达到有效治疗。而且,虽然免疫治疗单药不良反应率较低,但随着免疫联合治疗效果的体现和广泛应用,其带来的相关副作用也不可忽视,尤其是一些严重的免疫相关副反应,如免疫相关性肺炎、心肌炎等,该类严重的免疫副反应甚至可能导致病人死亡。因此,能有效预测免疫治疗疗效的生物标志物也可以排除获益可能性低的患者,避免不必要的免疫毒性。
3.目前,作为药物伴随诊断被美国食品药品监督管理局(food and drug administration,fda)批准的免疫治疗生物标志物主要包括pd-l1(免疫组化检测)和肿瘤突变负荷(tumor mutation burden,tmb)。一般情况下,认为pd-l1表达量高或者tmb≥10个/mb的患者更容易从免疫治疗中获益。但实际上,这两种生物标志物存在十分明显的缺点。对于pd-l1而言,目前针对其检测的抗体已经有5种以上,不同抗体检测的一致性不佳,难以做到统一;同时,pd-l1作为生物标志物的筛选效力不足,在pd-l1低表达的患者中,也有相当一部分能够从免疫治疗中获益;尤其是在免疫联合治疗中,pd-l1难以区分能够获益和不能获益的人群。因此,以pd-l1作为免疫治疗生物标志物可能会给临床决断带来困扰,难以给出准确的指导意见。而tmb作为生物标志物,存在相同的问题,即筛选效力不足,如,在低tmb患者中,也有一部分能够获益,而在高tmb患者中,也有一部分不能获益;而且不同肿瘤间tmb中位数相差过大,对于高tmb的定义在不同肿瘤间难以做到统一;此外,用于检测tmb的测序panel并未达成共识,每个panel检测的tmb值一致性也难以确定。除了上述pd-l1、tmb外,另一种被美国fda批准的免疫治疗标志物是微卫星高度不稳定或错配修复缺陷(microsatellite instability-high/mismatch repair deficient,msi-h/dmmr),现有技术表明,msi-h/dmmr的实体瘤更容易从免疫治疗中获益;然而,msi-h或dmmr在不同肿瘤间发生频率差距大,在结直肠癌、皮肤癌中超过10%为msi-h/dmmr,而在肺癌、膀胱癌等中频率却低于2%。因此,该标志物不能作为所有癌症的有效生物标志物,目前仅能应用于结直肠癌免疫治疗疗效预测。
4.所以,现有技术亟需有效的、泛癌种的免疫治疗疗效预测标志物、方法等以弥补现
有技术中pd-l1、tmb等标志物的局限性,以便提供免疫治疗疗效预测结果作为指导意见,制定针对性的治疗方案,助力临床用药,改善肿瘤患者治疗效果。
技术实现要素:
5.本发明旨在克服上述现有技术的至少一种不足,提供一种用于预测肿瘤免疫治疗疗效的基因集、评分体系及其应用,以在多种类型癌症中获得有效的免疫治疗疗效预测结果。
6.利于弥补现存免疫治疗疗效预测生物标志物存在的不足,促进对癌症患者的精确治疗,提高每个肿瘤患者用药的准确性,减少不必要的免疫毒性。
7.本发明的目的之一在于提供一种用于预测肿瘤免疫治疗疗效的基因集,包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c基因中的一个或多个基因,即包含上述基因中单个基因或多个基因组成的组合。对于免疫治疗,部分患者能从其中长期受益,得以延长生存期,但也有部分患者不能或者只能较少的获益,且还可能无法避免免疫治疗带来的副反应,不仅治疗效果不佳,且可能耽误其有限的生存期、治疗时期。因此,为了促进免疫治疗的实际应用,提高各类患者的治疗效果,精确筛选出能从免疫治疗中长期获益人群显得十分必要。然而现存的包括晚期恶性肿瘤等肿瘤的免疫治疗疗效预测生物标志物均有明显的局限性,在此背景下,本发明人基于公共数据库中发表的接受免疫治疗的患者临床、基因突变谱数据,获取到与免疫治疗后长期生存相关的基因位点集合,并构建相应预测评分体系,以便应用于免疫治疗疗效预测上,克服上述问题。具体的,本发明人先获取人类基因组中与ddr通路相关的基因进行分析,所述ddr通路相关基因包括但不限于如下56个基因:abl1、arid1a、atm、atr、atrx、babam1、bap1、bard1、blm、brca1、brca2、brip1、cdk12、chek1、chek2、cul3、dnmt3a、ercc2、ercc3、ercc4、ercc5、fam175a、fanca、fancc、idh1、mdc1、mlh1、mre11a、msh2、msh3、msh6、mutyh、nbn、nthl1、palb2、parp1、pms1、pms2、pold1、pole、ppp4r2、rad50、rad51、rad51b、rad51c、rad51d、rad52、rad54l、recql、recql4、rtel1、slx4、smarca4、tceb1、tp53bp1、xrcc2。利用已发表在公共数据中的数据,寻找接受免疫治疗并用含上述基因位点panel进行突变分析的病人,分析每个患者中以上56个ddr通路相关基因突变情况,进一步通过lasso回归分析及多因素cox回归等方法找到上述其中跟长期生存显著相关的基因位点。且验证了基于包含上述基因位点的基因集检测,能获得有效的预测结果。进一步地,上述基因集中基因不仅作为标志物而存在,还能用于构建疗效预测评分体系,促进在临床上的实际应用。
8.即在本发明的一个实施例中,对肿瘤患者样本数据进行了突变分析,从而获得了ddr通路中与免疫治疗后生存时间相关的基因集。且至少还发现携带上述基因位点有意义突变患者与免疫治疗后具有更长生存期相关。所以,且在本发明的一个实施例以上,上述基因集中的单基因、多个基因及其自由组合在肿瘤免疫治疗疗效、预后上均能取得有效的预测结果。通过检测所述基因集中基因,有利于获取患者是否携带相应的突变,从而以及时的确认患者是否适合免疫治疗,换言之,能预测患者是否能从免疫治疗中获益。若无法获益或获益甚微,甚至具有更大的免疫治疗毒副作用,则便于及时确认、调整治疗方案,以便患者得到更为有效的治疗,获得更长的生存期。
9.进一步地,包含abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因中的一个或多个基因,即包含上述基因中单个基因或多个基因组成的组合。在本发明的一个以上实施例中,基因集中的单个、两个、三个、六个、十个、十五个基因分别组成的基因集子集均能达到预测效果,且由于上述基因的突变均与具有更长的生存期相关,所以,基因集中任一单个基因、任一多个基因组成的组合都应被保护。进一步地,在基因集中选取更多的基因用于预测免疫治疗疗效则会获得准确性更高的预测结果,如,利用包含上述全部十个基因形成的基因集预测,预测结果较少数基因预测结果更佳;进一步地,基因集包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c全部基因。对于单个基因或少数基因组成的子集,其同样能获得有效的预测结果,且需要检测的基因数量较少,便于实现快速检测。即能应实际检测需求而选择基因集为上述基因集中一个、多个或者全部基因组成的基因子集合。
10.优选的方案是包含atrx基因或包含atrx及abl1、arid1a、atm、atr、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b或rad51c中的至少一个或多个基因。所述atrx是基因集的核心构成,可以选择与其他十四个基因构成不同的基因集。
11.所述abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c依据突变频率由大到小的排序为atrx、atm、pole、brip1、fanca、abl1、rad50、mre11a、rad51b、rad51c。所述基因集可以为至少包含atrx基因,或包含atrx和atm基因,或包含atrx、atm和pole基因,或包含atrx、atm、pole、brip1、fanca、abl1基因,或包含abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因,或包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c基因的基因集组合,其他基因可以选择包括但不限于来自ddr通路的其他基因。优选的方案是由atrx组成的单基因集、由atrx、atm组成的双基因集、由atrx、atm、pole组成的三基因集,由atrx、atm、pole、brip1、fanca、abl1组成的六基因集,由abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c组成的十基因集,或由abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c十五基因组成的十五基因集。
12.进一步地,应用于基因组合(基因panel)中,基因组合(基因panel)为上述基因集中一个或多个基因组成的基因集。进一步地,提供上述基因panel在制备预测免疫治疗疗效的产品中的用途。
13.进一步地,所述肿瘤可以为非小细胞肺癌、小细胞肺癌、黑色素瘤、膀胱癌、泌尿上皮癌、肾癌、头颈部癌、头颈部鳞癌、食管癌、神经胶质瘤、结直肠癌、淋巴瘤、肝癌、胃癌、宫颈癌、默克尔细胞癌、鼻咽癌、原发不明的肿瘤、乳腺癌和非黑色素瘤皮肤癌中的一种或多种。
14.进一步地,所述免疫治疗包括ctla4抑制剂、pd-1/pd-l1抑制剂免疫治疗或ctla4抑制剂与pd-1/pd-l1抑制剂的联合免疫治疗。
15.进一步地,上述基因集应用于构建预测肿瘤免疫治疗疗效的评分体系中。进一步地,所述评分体系为一种晚期恶性肿瘤免疫治疗生存获益预测评分体系。便于判断患者是否适合免疫治疗,以及时为可长期获益患者提供相应的免疫治疗方案。
16.本发明的另一目的在于提供一种用于预测肿瘤免疫治疗疗效的评分体系,尤其是作为晚期恶性肿瘤免疫治疗生存获益预测评分体系而存在;本发明人结合公共数据库中接
受免疫治疗的患者的临床、基因突变谱数据获得上述基因集中基因,并以基因集基因为变量建立一种能够预测免疫治疗生存获益的评分体系。进一步地,评分体系包含通过逻辑回归获得的计算公式:p=b1x1 b2x2 b3x3
……
b
k-1
x
k-1
bkxk,其中,p为治疗获益预测评分;b1、b2、
……
、b
k-1
、bk分别是基因集中各个基因位点的突变状态系数;x1、x2、
……
、x
k-1
、xk分别对应于各个基因位点的权重因子,k为所使用的基因集基因位点数。
17.进一步地,一种用于预测肿瘤免疫治疗疗效的评分体系,评分体系中的预测评分为上述基因集中各基因的基因突变状态系数加权之和,其中,所述基因突变状态系数反映相应基因是否发生突变。进一步地,对于各个发生有意义突变的基因位点,基因突变状态系数相同,且不为0;对于未发生有意义突变的基因位点,则不计入预测评分的计算,即其基因突变状态系数为0。进一步地,当基因位点发生有意义突变时,相应基因的基因突变状态系数为1,否则为0。所述突变为有意义突变,包括错义突变、无义突变和/或插入/缺失突变。
18.进一步地,abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因突变状态系数的权重依次为0.90、0.25、0.23、0.40、0.49、0.75、0.33、0.66、0.87、0.86。
19.进一步地,所述基因集包含abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c,评分体系包含的计算公式为p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6 b7x7 b8x8 b9x9 b
10
x
10
,所述p为治疗获益预测评分,b1、b2、b3、b4、b5、b6、b7、b8、b9、b
10
分别对应abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因位点的突变状态系数,x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
分别是对应于所述10个基因位点的权重因子。在本发明的一个实施例中,上述计算公式中abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c权重因子分别为0.90、0.25、0.23、0.40、0.49、0.75、0.33、0.66、0.87、0.86。
20.进一步地,对于由abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c形成的评分体系,在肺癌和膀胱癌中,当p≥0.25时,预测能够从免疫治疗获益;当p《0.25,预测不能从免疫治疗获益。在黑色素瘤中,当p≥0.4时,预测能够从免疫治疗获益;在p《0.4,预测不能从免疫治疗获益。在结肠癌中,p≥0.66时,预测能够从免疫治疗获益;p《0.66时,预测不能从免疫治疗获益。在乳腺癌、食管癌、神经胶质瘤和头颈部癌中,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中生存获益。
21.进一步地,本领域技术人员易于理解,上述肿瘤免疫治疗疗效预测评分体系,包括晚期恶性肿瘤免疫治疗生存获益预测评分体系等,也可以为其他数学形式。
22.进一步地,所述评分体系的数据处理过程通过编程、数据软件包形式被输入计算机或者基因检测设备,进一步地,所述计算机包括常见的电脑、手机等计算客户端以及云服务器形成的智能医疗系统。所述评分体系能应用于基因检测设备、计算机中,以直接在测序进行或测序后完成分析过程,快速简便的获取有效的预测结果。如,以计算机程序形式被输入基因测序设备的信息处理模块,进行基因检测数据的处理和预测分析。结合上述基因集,构成相应覆盖基因集且含有相应检测探针的基因检测panel,利用包含相应评分体系数据处理过程的处理程序,即能快速获得样本预测结果,以及时确定相应患者对免疫治疗的获益预测。而且,当所述评分体系、基因集作为程序数据被输入智能医疗系统、医疗人员使用设备中,更有利于直接、快速辅助医疗人员判断患者是否适合免疫治疗,如,转化为指导意见,确定患者能否从免疫治疗中获得长期获益,从而实现精确用药。
23.本发明的再一目的在于提供一种用于预测肿瘤免疫治疗疗效的基因检测panel,
所述基因检测panel以产品形式存在,用于检测上述基因集中的基因及其突变状态。更进一步地,所述基因检测panel含有检测上述基因集中基因的探针。
24.进一步地,所述的基因检测panel,富集捕获的基因区域包括上述基因集中一个以上基因的外显子,以检测其有意义的突变。当上述基因位点发生上述有意义突变时即形成了免疫治疗生存获益预测的生物标志物,利于鉴定患者是否适合采用免疫治疗技术治疗。进一步地,基因panel,富集捕获的基因区域包含上述abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b和/或rad51c基因的外显子。
25.本发明的再一目的在于提供上述基因集、上述评分体系、上述基因检测panel在制备预测肿瘤免疫治疗疗效的产品中的应用。
26.进一步地,所述产品在确定是否使用免疫治疗方式治疗癌症患者的方法中使用,所述方法包括以下步骤:使用所述产品检测从癌症患者获得的癌细胞样品中的上述基因集的突变状态;基于上述基因集的基因突变状态,使用上述评分体系计算预测评分;将评分与相应癌症截断值比较,并基于比较结果确定是否使用免疫治疗方式治疗相应癌症患者。
27.进一步地,产品包括检测装置、检测试剂盒。
28.本发明的再一目的在于提供一种检测装置、试剂盒,包括用于检测上述基因集中基因突变的引物、探针和/或上述基因检测panel。进一步地,所述检测装置包括成套的测序试剂、测序设备;所述试剂盒、基因检测panel至少包括捕获、检测上述基因集中基因的探针。
29.本发明的再一目的在于提供一种预测肿瘤免疫治疗疗效的评分体系的构建方法,包括步骤:s1、获取人类基因组中ddr通路相关基因位点,并基于经免疫治疗的癌症患者的样本数据筛选其中与长期生存显著相关的多个基因位点;s2、通过多因素cox回归分析获得步骤s1中多个基因位点在免疫治疗获益预测中的权重,构建用于获得治疗获益预测评分的免疫治疗疗效预测计算公式;s3、将步骤s1癌症患者样本数据导入免疫治疗疗效预测计算公式中计算,获得全部样本治疗获益预测评分,对应相应癌种从大到小排序,将每类癌症中评分在18~22%以前的对应样本作为获益样本,对比获益样本与其他样本的生存率,从18~22%中选出临界点,将临界点相应治疗获益预测评分值作为相应癌种的治疗获益预测评分截断值。
30.优选的将每类癌症中评分在20%以前的对应样本作为获益样本,20%临界点相应治疗获益预测评分值作为相应癌种的治疗获益预测评分截断值。
31.本发明还创建一种预测肿瘤免疫治疗疗效的评分体系,包括:由atrx和atm两个基因构成的基因集,计算公式:p=b1x1 b2x2;其中,p为治疗获益预测评分,b1和b2分别对应atrx和atm基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1和x2分别对应atrx和atm基因位点的权重因子,且分别为0.23和0.25;或,由atrx、atm和pole三个基因构成的基因集,计算公式:p=b1x1 b2x2 b3x3;其中,p为治疗获益预测评分,b1、b2和b3分别对应atrx、atm和pole基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变
状态系数为1,否则为0;x1、x2和x3分别对应atrx、atm和pole基因位点的权重因子,且分别为0.23、0.25和0.33;或,由atrx、atm、pole、brip1、fanca、abl1六个基因构成的基因集,计算公式:p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6;其中,p为治疗获益预测评分,b1、b2、b3、b4、b5、b6分别对应atrx、atm、pole、brip1、fanca、abl1基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2、x3、x4、x5、x6分别对应atrx、atm、pole、brip1、fanca和abl1基因位点的权重因子,且分别为0.23、0.25、0.33、0.40、0.49和0.90;或,由abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c十个基因构成的基因集,计算公式:p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6 b7x7 b8x8 b9x9 b
10
x
10
;其中,p为治疗获益预测评分,b1、b2、b3、b4、b5、b6、b7、b8、b9、b
10
分别对应abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
分别对应abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因位点的权重因子,且分别为0.90、0.25、0.23、0.40、0.49、0.75、0.33、0.66、0.87、0.86;或,由abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c十五个基因构成的基因集,计算公式:p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6 b7x7 b8x8 b9x9 b
10
x
10
b
11
x
11
b
12
x
12
b
13
x
13
b
14
x
14
b
15
x
15
;其中,p为治疗获益预测评分,b1、b2、b3、b4、b5、b6、b7、b8、b9、b
10
、b
11
、b
12
、b
13
、b
14
、b
15
分别对应abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mer11a、nbn、parp1、pole、rad50、rad51b、rad51c基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
、x
11
、x
12
、x
13
、x
14
、x
15
分别对应abl1、arid1a、atm、atrx、brip1、ercc4、fanca、mer11a、nbn、parp1、pole、rad50、rad51b、rad51c基因位点的权重因子,且分别为0.83、0.08、0.20、0.23、0.19、0.34、0.34、0.44、0.66、0.35、0.33、0.29、0.62、0.75、0.77;中的一种或多种;p截断值,用于区分免疫治疗获益、免疫治疗不获益的治疗获益预测评分值。
32.在上述体系中:由atrx和atm两个基因构成的基因集的评分体系,在膀胱癌、乳腺癌、原发不明肿瘤、结肠癌、食管癌、神经胶质瘤、头颈部肿瘤、黑色素瘤、非小细胞肺癌、肾癌中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中生存获益;由atrx、atm和pole三个基因构成的基因集的评分体系,在膀胱癌、乳腺癌、原发不明肿瘤、结肠癌、食管癌、神经胶质瘤、头颈部肿瘤、黑色素瘤、非小细胞肺癌、肾癌中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中
生存获益;由atrx、atm、pole、brip1、fanca、abl1六个基因构成的基因集的评分体系,在膀胱癌中,p截断值为0.25,当p≥0.25时,预测能够从免疫治疗获益,当p《0.25,预测不能从免疫治疗获益;在黑色素瘤中,p截断值为0.33,当p≥0.33时,预测能够从免疫治疗获益,在p《0.33,预测不能从免疫治疗获益;在乳腺癌、食管癌、胶质瘤、头颈部肿瘤、非小细胞肺癌和肾癌中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中生存获益,当p《0.23时,预测不能从免疫治疗中获益;由abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c十个基因构成的基因集的评分体系,在肺癌和膀胱癌中,p截断值为0.25,当p≥0.25时,预测能够从免疫治疗获益,当p《0.25,预测不能从免疫治疗获益;在黑色素瘤中,p截断值为0.4,当p≥0.4时,预测能够从免疫治疗获益,在p《0.4,预测不能从免疫治疗获益;在结肠癌中,p截断值为0.66,p≥0.66时,预测能够从免疫治疗获益,p《0.66时,预测不能从免疫治疗获益;在乳腺癌、食管癌、神经胶质瘤和头颈部癌中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中生存获益;
33.由abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c十五个基因构成的基因集的评分体系,在膀胱癌中,p截断值为0.34,当p≥0.34时,预测能够从免疫治疗获益,当p《0.34,预测不能从免疫治疗获益;在结肠癌中,p截断值为0.68,p≥0.68时,预测能够从免疫治疗获益,p《0.68时,预测不能从免疫治疗获益;在食管癌和胶质瘤中,p截断值为0.20,p≥0.20时,预测能够从免疫治疗获益,p《0.20时,预测不能从免疫治疗获益;在黑色素瘤中,p截断值为0.37,当p≥0.37时,预测能够从免疫治疗获益,在p《0.37,预测不能从免疫治疗获益;在非小细胞肺癌中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗获益,在p《0.23,预测不能从免疫治疗获益;在乳腺癌、头颈部肿瘤和肾癌中,p截断值为0.08,当p≥0.08时,预测能从免疫治疗中生存获益,当p《0.08时,预测不能够从免疫治疗中获益。
34.基于上述评分体系,本发明提供一种计算机可读存储介质,其上存储有计算机程序,其特征在于,所述计算机程序被处理器执行时实现上述预测肿瘤免疫治疗疗效的评分体系的数据处理。
35.本发明的再一目的在于提供一种用于预测肿瘤免疫治疗疗效的系统,所述系统包括:(1)装置,所述装置被配置为确定来自肿瘤患者的生物样品的上述基因集中基因的突变状态;(2)硬件逻辑,所述硬件逻辑被配置为执行操作,所述操作包括:a、接收来自肿瘤患者的生物样品的上述基因集中基因的突变数据;b、将所述突变数据应用至上述计算公式中计算疗效预测评分;c、比较疗效预测评分与截断值,给出是否通过免疫治疗方式治疗所述肿瘤患者的意见,确定是否通过免疫治疗方式治疗所述肿瘤患者。
36.本发明的再一目的在于提供一种预测肿瘤免疫治疗疗效的方法,包括步骤:s1、检测肿瘤患者生物样品中上述基因集中基因的突变状态;s2、利用上述评分体系中计算公式获取预测评分并于相应癌症截断值进行比较;
s3、依据比较结果预测肿瘤免疫治疗疗效,确定是否通过免疫治疗方式治疗所述肿瘤患者。
37.进一步地,上述基因检测生物样本来自活检样本、术后肿瘤组织、石蜡包块样本或血浆样本。所述样本可以来源于新鲜组织,也可以来源于石蜡标本或者血浆,易于操作和保存。相对于mrna构成的免疫标志物而言,稳定性更强。
38.相比于现有技术,本发明的有益效果:本发明提供的基因集包含人类基因组ddr相关基因中体现免疫治疗长期生存获益的特征性基因位点,基于该基因集、评分体系及应用能够有效挑选出可能从免疫治疗中获得长期生存的患者。便于实现有针对性的治疗方案,如,对能从免疫治疗中获益的患者制定相应的免疫治疗方案,如选择合适的免疫检查点抑制剂治疗,对无法从免疫治疗获益的患者采取其他治疗方式,避免免疫治疗无效的同时带来较大的副作用。从而对各类患者实行有效治疗方式,促进肿瘤治疗,延长肿瘤患者生存期。而且,在预测效果良好的同时,本发明中的基因集数量较现有技术常见免疫治疗预测所需基因位点数量少,相比于其他标志物,成本更低,易实施,也容易推广;也便于实现快速的检测,具有良好的临床应用前景。同时,较现有技术,如tmb免疫治疗疗效预测标志物,具有在免疫治疗疗效预测上的优势,如本发明在ctla4、ctla4与pd-1/pd-l1抑制剂免疫联合治疗疗效预测上也能获得有效的预测结果,而tmb标志物预测准确性则较差,相较于tmb标志物预测,本发明提供的基因集、评分体系总体预测效果更好。而且,本技术上述基因集、评分体系及应用在多种类型肿瘤的免疫治疗疗效预测中都能取得有效的预测结果,是一种泛癌种预测标志物、预测方式。
附图说明
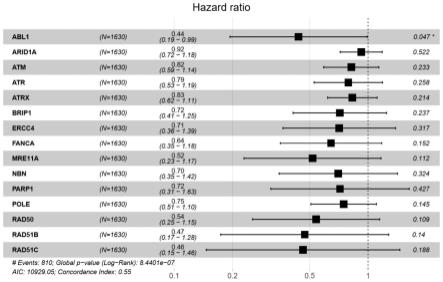
39.图1显示:携带abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c基因位点的有意义突变(包括错义突变、无义突变、插入/缺失突变)与免疫治疗后更长的生存相关。
40.图2显示:以本发明中十五基因免疫治疗疗效预测评分体系对每个患者进行评分,每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%的患者接受免疫治疗后生存显著优于评分后80%的患者。
41.图3显示:将每种癌症和免疫治疗方式细分,以本发明十五基因免疫治疗疗效预测评分体系评分,每种癌症前20%的分值作为截断值,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式(pd-1/pd-l1抑制剂、ctla-4抑制剂或免疫联合治疗)均有预测价值。
42.图4显示:以本发明中十基因免疫治疗疗效预测评分体系对每个患者进行评分,每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%的患者接受免疫治疗后生存显著优于评分后80%的患者。
43.图5显示:将每种癌症和免疫治疗方式细分,以本发明十基因免疫治疗疗效预测评分体系评分,每种癌症前20%的分值作为截断值,除肾癌外,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式(pd-1/pd-l1抑制剂、ctla-4抑制剂或免疫联合治疗)均有预测价值。
44.图6显示:以本发明中二基因免疫治疗疗效预测评分体系对每个患者进行评分,评
分≥0.23的患者相较于评分《0.23的患者生存时间更长。
45.图7显示:以本发明中三基因免疫治疗疗效预测评分体系对每个患者进行评分,评分≥0.23的患者相较于评分《0.23的患者生存时间更长。
46.图8显示:以本发明中六基因免疫治疗疗效预测评分体系对每个患者进行评分,每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%的患者接受免疫治疗后生存显著优于评分后80%的患者。
47.图9显示:将每种癌症和免疫治疗方式细分,以本发明六基因免疫治疗疗效预测评分体系评分,每种癌症前20%的分值作为截断值,除肾癌外,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式(pd-1/pd-l1抑制剂、ctla-4抑制剂或免疫联合治疗)均有预测价值。
48.图10显示:对验证集1中接受免疫治疗(以pd-1/pd-l1单药为主)的240名晚期非小细胞肺癌患者以本发明十基因免疫治疗疗效预测评分体系进行评分,评分大于或等于0.25的患者接受免疫治疗后无进展生存时间(progression-free survival,pfs)显著优于评分小于0.25的患者。
49.图11显示:对验证集2中接受pd-1/pd-l1抑制剂联合ctla4抑制剂的75例晚期非小细胞肺癌患者以本发明十基因免疫治疗疗效预测评分体系进行评分,评分大于或等于0.25的患者接受免疫治疗后pfs显著优于评分小于0.25的患者。
50.图12显示:对验证集3中接受ctla-4抑制剂的100例晚期黑色素瘤患者以本发明十基因免疫治疗疗效预测评分体系进行评分,发现评分大于或等于0.40的患者接受免疫治疗后生存时间显著优于评分小于0.40的患者。
51.图13显示:以tmb进行分层,每种癌症前20%的tmb值作为截断值,tmb作为预测标志物的预测在各种癌症和免疫治疗方式中的预测效果。
具体实施方式
52.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
53.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
54.现结合具体实例对本发明作进一步的说明,以下实施例仅是为了解释本发明,但不构成对本发明的限制。实施例1
55.筛选出能预测免疫治疗疗效的基因集合
56.本实施例中所选基因位点来自mkscc-impact panel,这是一种被美国fda批准的用于检测癌症基因突变的测序panel,选取其中与ddr通路相关的基因进行分析,包括但不限于如下56个基因:abl1、arid1a、atm、atr、atrx、babam1、bap1、bard1、blm、brca1、brca2、brip1、cdk12、chek1、chek2、cul3、dnmt3a、ercc2、ercc3、ercc4、ercc5、fam175a、fanca、
fancc、idh1、mdc1、mlh1、mre11a、msh2、msh3、msh6、mutyh、nbn、nthl1、palb2、parp1、pms1、pms2、pold1、pole、ppp4r2、rad50、rad51、rad51b、rad51c、rad51d、rad52、rad54l、recql、recql4、rtel1、slx4、smarca4、tceb1、tp53bp1、xrcc2。
57.结合上述ddr相关基因进行分析。纳入美国纪念斯隆凯特琳癌症中心(memorial sloan-kettering cancer center,mskcc)接受免疫治疗(包括pd-1/pd-l1抑制剂、ctla4抑制剂及免疫联合治疗)的1630名患者,其中335名非小细胞肺癌、317名黑色素瘤、212名膀胱癌、150名肾癌、138名头颈部癌、126名食管癌、115名神经胶质瘤、110名直肠癌、86名原发不明的肿瘤、43名乳腺癌和1名非黑色素瘤皮肤癌。所有患者均用mskcc-impact panel进行了突变分析,其基因突变信息和临床信息均在cbioportal(https://www.cbioportal.org)上可以获得。
58.应用lasso回归分析出可能与免疫治疗后生存时间相关的基因集,包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c。本发明人发现携带以上基因位点的有意义突变(包括错义突变、无义突变、插入/缺失突变)与免疫治疗后更长的生存相关,如图1。
59.进一步地,在经过lasso回归后筛选后获得的15个基因位点基础上,再用逐步回归法进一步筛选基因位点,获得10个基因位点:abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c。实施例2
60.建立十五基因的肿瘤免疫治疗疗效预测评分体系
61.本实施例中利用实施例1中lasso回归筛选得到的15个基因位点,建立晚期恶性肿瘤免疫治疗疗效预测评分体系。通过多因素cox回归获得每个基因位点的加权系数,建立的评分体系如下:
62.p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6 b7x7 b8x8 b9x9 b
10
x
10
b
11
x
11
b
12
x
12
b
13
x
13
b
14
x
14
b
15
x
15
;其中p为治疗获益预测评分,b1、b2、b3、b4、b5、b6、b7、b8、b9、b
10
、b
11
、b
12
、b
13
、b
14
、b
15
分别对应abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mer11a、nbn、parp1、pole、rad50、rad51b、rad51c基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
、x
11
、x
12
、x
13
、x
14
、x
15
分别对应abl1、arid1a、atm、atrx、brip1、ercc4、fanca、mer11a、nbn、parp1、pole、rad50、rad51b、rad51c基因位点的权重因子,且分别为0.83、0.08、0.20、0.23、0.19、0.34、0.34、0.44、0.66、0.35、0.33、0.29、0.62、0.75、0.77。
63.考虑到每种肿瘤的评分分值中位数不一样,本实施例中以各个癌症前20%分值作为截断值,用以预测免疫治疗疗效。具体地,在膀胱癌中,当p≥0.34时,预测能够从免疫治疗获益;当p《0.34,预测不能从免疫治疗获益。在结肠癌中,p≥0.68时,预测能够从免疫治疗获益;p《0.68时,预测不能从免疫治疗获益。在食管癌和胶质瘤中,p≥0.20时,预测能够从免疫治疗获益;p《0.20时,预测不能从免疫治疗获益。在黑色素瘤中,当p≥0.37时,预测能够从免疫治疗获益;在p《0.37,预测不能从免疫治疗获益。在非小细胞肺癌中,当p≥0.23时,预测能够从免疫治疗获益;在p《0.23,预测不能从免疫治疗获益。在乳腺癌、头颈部肿瘤和肾癌中,当p≥0.08时,预测能从免疫治疗中生存获益;当p《0.08时,预测不能够从免疫治疗中获益。
实施例3
64.建立十基因的肿瘤免疫治疗疗效预测评分体系
65.本实施例中采用实施例1中利用逐步回归法进一步筛选得到的10个基因位点,建立晚期恶性肿瘤免疫治疗疗效预测评分体系。通过多因素cox回归获得每个基因位点的加权系数,建立的评分体系如下:
66.p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6 b7x7 b8x8 b9x9 b
10
x
10
;其中,p为治疗获益预测评分;b1、b2、b3、b4、b5、b6、b7、b8、b9、b
10
分别对应abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c基因位点的突变状态系数,x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
分别是对应于所述10个基因位点的权重因子。具体地,10个基因中若某一基因发生一个以上有意义突变(包括错义突变、无义突变、插入/缺失突变)时,其相应基因的突变状态系数赋值为1,否则其突变状态系数赋值为0;本实施例中,x1是0.90、x2是0.25、x3是0.23、x4是0.40、x5是0.49、x6是0.75、x7是0.33、x8是0.66、x9是0.87、x10是0.86,即abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c权重因子分别为0.90、0.25、0.23、0.40、0.49、0.75、0.33、0.66、0.87、0.86。
67.考虑到每种肿瘤的评分分值中位数不一样,本实施例中以各个癌症前20%分值作为截断值,用以预测免疫治疗疗效。具体地,在肺癌和膀胱癌中,当p≥0.25时,预测能够从免疫治疗获益;当p《0.25,预测不能从免疫治疗获益。在黑色素瘤中,当p≥0.4时,预测能够从免疫治疗获益;在p《0.4,预测不能从免疫治疗获益。在结肠癌中,p≥0.66时,预测能够从免疫治疗获益;p《0.66时,预测不能从免疫治疗获益。在乳腺癌、食管癌、神经胶质瘤和头颈部肿瘤中,当p≥0.23时,预测能从免疫治疗中生存获益;当p《0.23时,预测不能够从免疫治疗中获益。实施例4
68.建立二基因的肿瘤免疫治疗疗效预测评分体系
69.组成实施例3中免疫治疗疗效预测评分体系的10个基因位点在所有1630个恶性肿瘤患者中的频率如下:atrx(7.2%)、atm(6.4%)、pole(5.3%)、brip1(2.5%)、fanca(2.3%)、abl1(1.8%)、rad50(1.7%)、mre11a(1.6%)、rad51b(1.0%)、rad51c(0.7%)。以突变率前二的基因集合即atrx、atm作为基因集合,建立预测评分体系如下:
70.p=b1x1 b2x2,其中,b1和b2分别对应atrx和atm基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1和x2分别对应atrx和atm基因位点的权重因子,且分别为0.23和0.25。考虑到两个基因组合在每种癌症中突变频率均较低,因此采取统一标准,在包括膀胱癌、乳腺癌、原发不明肿瘤、结肠癌、食管癌、神经胶质瘤、头颈部肿瘤、黑色素瘤、非小细胞肺癌、肾癌的所有癌症中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中生存获益。实施例5
71.建立三基因的肿瘤免疫治疗疗效预测评分体系
72.组成实施例3中免疫治疗疗效预测评分体系的10个基因位点在所有1630个恶性肿瘤患者中的频率如下:atrx(7.2%)、atm(6.4%)、pole(5.3%)、brip1(2.5%)、fanca(2.3%)、abl1(1.8%)、rad50(1.7%)、mre11a(1.6%)、rad51b(1.0%)、rad51c(0.7%)。以突变率前三的基因集合即atrx、atm和pole作为集合,建立预测评分体系如下:
73.p=b1x1 b2x2 b3x3,其中,b1、b2和b3分别对应atrx、atm和pole基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2和x3分别对应atrx、atm和pole基因位点的权重因子,且分别为0.23、0.25和0.33。考虑到三基因组合在每种癌症中突变频率较低(未超过20%),因此采取统一标准,在包括膀胱癌、乳腺癌、原发不明肿瘤、结肠癌、食管癌、神经胶质瘤、头颈部肿瘤、黑色素瘤、非小细胞肺癌、肾癌的所有癌症中,p截断值为0.23,当p≥0.23时,预测能够从免疫治疗中获益,当p《0.23时,预测不能从免疫治疗中生存获益。实施例6
74.建立六基因的肿瘤免疫治疗疗效预测评分体系
75.组成实施例3中免疫治疗疗效预测评分体系的10个基因位点在所有1630个恶性肿瘤患者中的频率如下:atrx(7.2%)、atm(6.4%)、pole(5.3%)、brip1(2.5%)、fanca(2.3%)、abl1(1.8%)、rad50(1.7%)、mre11a(1.6%)、rad51b(1.0%)、rad51c(0.7%)。以突变率前六的基因即atrx、atm、pole、brip1、fanca、abl1组成集合,建立预测评分体系如下:
76.p=b1x1 b2x2 b3x3 b4x4 b5x5 b6x6,其中,b1、b2、b3、b4、b5、b6分别对应atrx、atm、pole、brip1、fanca、abl1基因位点的突变状态系数,当基因位点发生有意义突变时,相应基因突变状态系数为1,否则为0;x1、x2、x3、x4、x5、x6分别对应atrx、atm和pole基因位点的权重因子,且分别为0.23、0.25、0.33、0.40、0.49、0.90。
77.考虑到每种肿瘤的评分分值中位数不一样,本实施例中以各个癌症前20%分值作为截断值,用以预测免疫治疗疗效。具体地,在膀胱癌中,当p≥0.25时,预测能够从免疫治疗获益;当p《0.25,预测不能从免疫治疗获益。在黑色素瘤中,当p≥0.33时,预测能够从免疫治疗获益;在p《0.33,预测不能从免疫治疗获益。在乳腺癌、食管癌、胶质瘤、头颈部肿瘤、非小细胞肺癌和肾癌中,当p≥0.23时,预测能够从免疫治疗中生存获益,当p《0.23时,预测不能从免疫治疗中获益。实施例7
78.免疫治疗疗效预测评分体系的验证
79.一、将上述1630例患者突变结果输入十五基因评分体系,对每个患者的结果进行评分
80.取每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%的患者接受免疫治疗后生存显著优于评分后80%的患者,如图2所示。
81.进一步地,将每种癌症和免疫治疗方式进行细分讨论,发明人发现以每种癌症前20%的分值作为截断值,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式,均有预测价值,如图3所示。
82.因此,在每种癌症中,当大于评分大于或等于截断值时,即表示其能够从免疫治疗中获得总生存获益;当评分小于截断值时,表示相应癌症不能够从免疫治疗中获得总生存获益,具体的,每种癌症截断值如图3所示。
83.二、将上述1630例患者突变结果输入十基因评分体系,对每个患者的结果进行评分
84.取每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%
的患者接受免疫治疗后生存显著优于评分后80%的患者,如图4所示。
85.进一步地,将每种癌症和免疫治疗方式进行细分讨论,发明人发现以每种癌症前20%的分值作为截断值,除肾癌外,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式,均有预测价值,如图5所示。
86.因此,在每种癌症中,当大于评分大于或等于截断值时,即表示其能够从免疫治疗中获得总生存获益;当评分小于截断值时,表示相应癌症不能够从免疫治疗中获得总生存获益,具体的,每种癌症截断值如图5所示。
87.三、将上述1630例患者突变结果输入二基因评分体系,对每个患者的结果进行评分
88.以突变率前二的基因集合即atrx、atm构成评分体系在所有癌症中,当p《0.23时,预测不能从免疫治疗中生存获益;当p≥0.23时,预测能够从免疫治疗中获益。发明人发现评分≥0.23的患者相较于评分《0.23的患者生存时间更长,如图6所示。
89.四、将上述1630例患者突变结果输入三基因评分体系,对每个患者的结果进行评分
90.以突变率前三的基因集合即atrx、atm和pole构成评分体系。在所有癌症中,当p《0.23时,预测不能从免疫治疗中生存获益;当p≥0.23时,预测能够从免疫治疗中获益。发明人发现评分≥0.23的患者相较于评分《0.23的患者生存时间更长,如图7所示。
91.五、将上述1630例患者突变结果输入六基因评分体系,对每个患者的结果进行评分
92.以突变率前六的基因即atrx、atm、pole、brip1、fanca、abl1组成集合,构成评分体系。取每种癌症评分前20%的患者与评分在后80%的患者进行生存对比,评分前20%的患者接受免疫治疗后生存显著优于评分后80%的患者,如图8所示。
93.进一步地,将每种癌症和免疫治疗方式进行细分讨论,发明人发现以每种癌症前20%的分值作为截断值,除肾癌外,所有癌症的hr均小于1,提示评分在前20%的患者更容易从免疫治疗取得生存获益;同时,对于不同免疫治疗方式,均有预测价值,如图9所示。
94.因此,在每种癌症中,当大于评分大于或等于截断值时,即表示其能够从免疫治疗中获得总生存获益;当评分小于截断值时,表示相应癌症不能够从免疫治疗中获得总生存获益,具体的,每种癌症截断值如图9所示。实施例8
95.将其他接受免疫治疗的患者突变信息输入十基因评分体系,进行评分体系的外部验证
96.在cbioportal网站获取第一个验证组,构成验证集1。验证集1为接受免疫治疗的240名晚期非小细胞肺癌患者,其中206位接受了pd-1/pd-l1抑制剂单药治疗,34位接受了免疫联合治疗。将这组患者突变结果输入十基因评分体系,进行评分,发现评分大于或等于0.25的患者接受免疫治疗后无进展生存时间(progression-free survival,pfs)显著优于评分小于0.25的患者,如图10所示。
97.在cbioportal网站获取第二个验证组,构成验证集2。验证集2为接受pd-l1抑制剂联合ctla-4抑制剂治疗的75例晚期非小细胞肺癌患者。这组患者突变结果输入十基因评分体系,进行评分,发现评分大于或等于0.25的患者接受免疫治疗后pfs显著优于评分小于
0.25的患者,如图11所示。
98.进一步地,在cbioportal网站获取第三个验证组,构成验证集3。验证集3为接受ctla4抑制剂治疗的100例晚期黑色素瘤患者。这组患者突变结果输入十基因评分体系,进行评分,发现评分大于或等于0.40的患者接受免疫治疗后生存时间显著优于评分小于0.40的患者,如图12所示。实施例9
99.将本发明中构建的十基因评分体系与tmb预测进行比较
100.获得接受免疫治疗的1630患者的tmb数值,以前20%的tmb数值作为截断值区分高低tmb,其预测价值如图13所示。在总体人群中,高tmb患者相较于低tmb患者死亡风险下降36%(hr=0.64;95%ci,0.53-0.77)。而应用本发明十基因评分体系,高评分者相较于低评分者死亡风险下降46%(hr=0.54;95%ci,0.43-0.67),如图4所示。即本发明提供的基因集及相应的评分体系能实现较tmb更佳的预测效果。同时,本实施例结果还表明tmb并不能很好预测ctla4、ctla4与pd-1/pd-l1抑制剂免疫联合治疗后生存获益(p》0.05),而本发明评分体系可以很好预测ctla4、ctla4与pd-1/pd-l1抑制剂免疫联合治疗疗效(p《0.05)。
101.以上实施例对本发明的技术方案进行了验证,证明了评分体系的可靠性,且通过该预测评分体系,有助于医疗人员获得能够经免疫治疗获得无进展生存或总生存获益的晚期恶性肿瘤患者,助力临床用药。实施例10
102.本实施例提供一种用于预测肿瘤免疫治疗疗效的基因检测panel,检测基因集中基因的外显子区域是否发生有意义突变,以便进行肿瘤免疫治疗疗效预测,所述基因集包含atrx基因或包含atrx及abl1、arid1a、atm、atr、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b或rad51c中的至少一个或多个基因;或,基因集包含atrx和atm两个基因,或包含atrx、atm和pole三个基因,或包含atrx、atm、pole、brip1、fanca、abl1六个基因,或包含abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c十个基因,或包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c十五个基因。所述基因检测panel包括检测上述基因集中基因是否突变的相应探针和/或引物。实施例11
103.本实施例提供一种检测装置,包括成套的测序试剂、测序设备。所述测序试剂至少用于检测基因集中部分或全部基因的序列,所述基因集包含atrx基因或包含atrx及abl1、arid1a、atm、atr、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b或rad51c中的至少一个或多个基因;或,基因集包含atrx和atm两个基因,或包含atrx、atm和pole三个基因,或包含atrx、atm、pole、brip1、fanca、abl1六个基因,或包含abl1、atm、atrx、brip1、fanca、mer11a、pole、rad50、rad51b、rad51c十个基因,或包含abl1、arid1a、atm、atr、atrx、brip1、ercc4、fanca、mre11a、nbn、parp1、pole、rad50、rad51b、rad51c十五个基因。
104.具体地,在获得肿瘤样本后,按照测序试剂的说明书进行操作,进行上机前的样本处理。待完成上机前的准备后,通过测序设备获取处理后样本的序列数据;所述测序设备统计基因集中基因的突变数据后进行基因突变情况的可视化显示,至少显示是否有基因集中的基因在外显子区域发生有意义突变,或,测序设备还在统计过程中直接通过基因集相应
的评分体系计算评分,如,采用atrx、atm二基因组成的基因集,则还在统计过程中直接采用实施例6评分体系进行计算,可视化结果包含肿瘤免疫治疗疗效预测评分。
105.本实施例还提供一种试剂盒,所述试剂盒至少用于检测本实施例中基因集中基因的突变,且所述试剂盒包含dna提取试剂、完整扩增体系所需试剂、测序所需试剂、扩增引物、测序引物、基因探针和/或蛋白质检测探针。实施例12
106.本实施例提供一种用于预测肿瘤免疫治疗疗效的系统,所述系统包括:(1)装置,所述装置被配置为确定来自肿瘤患者的生物样品的基因突变状态;(2)硬件逻辑,所述硬件逻辑被配置为执行操作,所述操作包括:a、接收来自肿瘤患者的生物样品的如实施例1所述基因集中基因的突变数据;b、将所述突变数据应用至实施例2~6任一所述评分体系中获取预测评分;c、比较预测评分与截断值,给出是否通过免疫治疗方式治疗所述肿瘤患者的意见,确定是否通过免疫治疗方式治疗所述肿瘤患者。实施例13
107.本实施例提供一种预测肿瘤免疫治疗疗效的方法,包括步骤:s1、检测从癌症患者获得的癌细胞样品中实施例1所述基因集中基因的突变状态;s2、利用实施例2~6任一所述评分体系包含的计算公式获取预测评分并于相应癌症截断值进行比较;s3、依据比较结果预测肿瘤免疫治疗疗效,确定是否通过免疫治疗方式治疗所述肿瘤患者。实施例14
108.一种计算机可读存储介质,其上存储有计算机指令,所述计算机指令运行时执行本发明上述任一实施例中评分体系的数据处理。具体的,所述计算机可读存储介质连接于计算机设备,所述计算机设备还包括数据接收模块、处理器,所述计算机设备与测序平台直接或间接连接。所述测序平台利用上述实施例基因集形成的相应基因检测panel进行肿瘤样本的基因突变检测。并在获取检测结果后传输至计算机设备,所述计算机设备通过数据接收模块接收数据后,处理器调用计算机可读存储介质中的计算机指令,采用与基因集相应的评分体系进行数据处理。最终计算获得免疫治疗疗效预测评分,并通过计算所得或设定的截断值以确认肿瘤样本对应患者是否能从免疫治疗中获益。
109.本领域技术人员可以理解的是:上述实施例评分体系数据处理过程中的全部或部分步骤是可以通过程序来指示相关的硬件来完成,该程序可以存储于本实施例所述计算机可读存储介质中,存储介质可以包括:rom、ram、磁盘或光盘等。
110.显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。