1.本发明属于药物化学领域,涉及组蛋白乙酰转移酶p300小分子抑制剂。本发明所涉及的化合物能够抑制组蛋白乙酰转移酶p300溴结构域的活性,对前列腺癌细胞、恶性血液肿瘤细胞、乳腺癌细胞等肿瘤细胞具有显著的抑制作用,抑制强度强于目前该靶点唯一临床在研药物ccs1477;且本发明所公开的具有式(i)结构类型的化合物在细胞渗透性、代谢稳定性方面均优于ccs1477,具有更好的类药性。
背景技术:
2.现有技术公开了组蛋白和其他蛋白质的可逆乙酰化反应是细胞调节的一种主要机制,这种共价修饰是细胞生物学中的一种重要调节方式。通常,组蛋白的高乙酰化是活跃转录的标志,组蛋白赖氨酸乙酰化与基因激活相关,而低乙酰化则与转录抑制相关,组蛋白赖氨酸脱乙酰化与基因抑制和沉默相关
1.。蛋白赖氨酸残基的乙酰化由组蛋白乙酰转移酶(hats)催化,乙酰基-lys裂解由组蛋白脱乙酰酶(hdac)进行。研究显示,上述酶和相关的乙酰化事件已经涉及多种生理和疾病过程
2.。
3.有研究表明组蛋白乙酰基转移酶及其复合体除具有调控基因转录起始的功能外,还参与了细胞周期调控、dna复制、修复以及染色体组装等许多重要的生理过程
3.。
4.有研究表明,组蛋白乙酰化会影响细胞分化、基因表达、血管重塑、神经元可塑性、炎症或代谢等生理过程。研究还发现了细胞中某些癌基因和抑癌基因的乙酰化状态相关与某些恶性肿瘤的发生发展密切相关
[4
,5
,6]
。
[0005]
有研究表明,组蛋白乙酰转移酶(hat)家族中p300蛋白作为一特殊的转录辅因子本身具有组蛋白乙酰化转移酶活性,所以它具有调节染色体结构的功能
3.;同时p300还是多细胞生物中特有的乙酰化酶,多细胞生物所特有的细胞分化、信号转导都与其密切相关
[7]
。p300参与了许多生理进程,包括增殖、分化、凋亡。同时,p300作为转录调节因子,也参与了许多信号依赖的转录事件。许多病毒癌蛋白(如腺病毒eia、sv40大t抗原等)都能特异性地靶向p300
[8]
。p300与病毒癌蛋白形成复合物后导致细胞生长失去控制,增强dna合成,抑制细胞分化。近期的研究结果表明
[9]
,p300基因的改变导致许多人类癌症的形成。p300/cbp溴结构域也是目前仅次于bet家族溴结构域的第二大溴结构域靶标家族,且较其它非乙酰转移酶的溴结构域具有更高效的kac识别能力[10]。p300/cbp溴结构域可以特异性结合乙酰化的赖氨酸残基,有助于p300/cbp以依赖于乙酰化的方式与组蛋白n端结合,并参与染色质结构的重排,是组蛋白乙酰化和体外染色质转录激活所必需的
[10]
。研究表明,p300/cbp溴结构域的活性的异常与包括去势抵抗性前列腺癌在内的多种肿瘤的发生发展密切相关
[11]
。
[0006]
目前已报道的p300/cbp溴结构域抑制剂主要包括苯并咪唑衍生物、哌啶衍生物、苯并二氮杂卓衍生物和吲哚衍生物等
[12-13]
。但目前仅ccs1477一个化合物进入临床ii期阶段,且适应症类型比较有限。因此,目前仍需要发现结构新颖、高活性、高选择性的p300/cbp
溴结构域抑制剂进行抗肿瘤药物的开发研究。
[0007]
本发明团队前期建立了较系统的p300/cbp溴结构域抑制剂生物评价体系,并得到了一类活性好、结构类型新颖的小分子抑制剂,其中活性最好的化合物不仅在分子水平与ccs1477相当,而且克服了ccs1477外排率高的缺陷,对肿瘤细胞表现出更强的增值抑制活性,是一类具有临床潜力的化合物。
[0008]
下述参考文献因被本发明引用,其内容包含在本发明中。
[0009]
参考文献:
[0010]
[1].esteller.m,et al.“epigenetics provides a new generation of oncogenes and tumour-suppressor genes”.br.j.cancer 94:179
–
183
[0011]
[2].s.d.furdas,et al.“small molecule inhibitors of histone acetyltransferases as epigenetic tools and drug candidates”.arch.pharm.chem.life sci.2012,345,7
–
21
[0012]
[3].beverley m.dancy,philip a.cole.“protein lysine acetylation by p300/cbp”chem.rev.2015,115,2419-2452
[0013]
[4].l.ellis,p.w.atadja,r.w.johnstone,“epigenetics in cancer:targeting chromatin modifications”.mol cancer ther 2009,8,1409
–
1420.
[0014]
[5].m.esteller,et al.“molecular origins of cancer:epigenetics in cancer”n engl j med 2008,358,1148
–
1159.
[0015]
[6].loren m.lasko,clarissa g.jakob,p.a.cole,saul h.rosenberg,michael r.michaelides,albert lai&kenneth d.bromberg.“discovery of a selective catalytic p300/cbp inhibitor that targets lineage-specific tumours”nature 2017,550,128
–
132.
[0016]
[7].arany,z.;sellers,w.r.;livingston,d.m.;eckner,r.“e1a-associated p300 and creb-associated cbp belong to a conserved family of coactivators”cell 1994,77,799.
[0017]
[8].eckner,r.;ewen,m.e.;newsome,d.;gerdes,m.;decaprio,j.a.;lawrence,j.b.;livingston,d.m.“molecular cloning and functional analysis of the adenovirus e1a-associated 300-kd protein(p300)reveals a protein with properties of a transcriptional adaptor.”genes dev.1994,8,869.
[0018]
[9].teufel dp,freund sm,bycroft m,fersht ar."four domains of p300 each bind tightly to a sequence spanning both transactivation subdomains of p53".proceedings of the national academy of sciences of the united states of america.104(17):7009
–
14.
[0019]
[10].a.a.ebrahimi,k.sevinc,g.gurhan sevinc,a.p.cribbs,m.philpott,f.uyulur,t.morova,j.e.dunford,s.goklemez,s.ari,u.oppermann,t.t.onder,bromodomain inhibition of the coactivators cbp/ep300 facilitate cellular reprogramming,nat.chem.biol.2019,15,519-528.b.s.d.furdas,et al.―small molecule inhibitors of histone acetyltransferases as epigenetic tools and drug candidates||.arch.pharm.chem.life sci.2012,345,7-21
[0020]
[11].h.j.dyson,p.e.wright,role of intrinsic protein disorder in the function and interactions of the transcriptional coactivators creb-binding protein(cbp)and p300,j.biol.chem.2016,291,6714-6722.
[0021]
[12].a:y.xiong,m.zhang,y.li,recent advances in the development of cbp/p300 bromodomain inhibitors,curr.med.chem.2019,26,1-15.b:z.-x.he,b.-f.wei,x.zhang et al.current development of cbp/p300 inhibitors in the last decade.european journal of medicinal chemistry 2021,209,112861.c.d.a.hay,o.fedorov,s.martin,d.c.singleton,c.tallant,c.wells,s.picaud,m.philpott,o.p.monteiro,c.m.rogers,s.j.conway,t.p.rooney,a.tumber,c.yapp,p.filippakopoulos,m.e.bunnage,s.muller,s.knapp,c.j.schofield,p.e.brennan,discovery and optimization of small-molecule ligands for the cbp/p300 bromodomains,j.am.chem.soc.2014,136,9308-9319.
[0022]
[13].a:k.w.lai,f.a.romero,v.tsui,m.h.beresini,g.de leon boenig,s.m.bronner,k.chen,z.chen,e.f.choo,t.d.crawford,p.cyr,s.kaufman,y.li,j.liao,w.liu,j.ly,j.murray,w.shen,j.wai,f.wang,c.zhu,x.zhu,s.magnuson,design and synthesis of a biaryl series as inhibitors for the bromodomains of cbp/p300,bioorg.med.chem.lett.2018,28,15-23.b:f.a.romero et al.―gne-781,a highly advanced potent and selective bromodomain inhibitor of cyclic adenosine monophosphate response element binding protein,binding protein(cbp),j.med.chem.2017,60,9162-9183.c:y.chen,x.bi,f.zhang,z.sun,p.xu,h.jiang,w.lu,t.lu,h.ding,n.zhang,h.jiang,k.chen,b.zhou,c.luo,design,synthesis,and biological evaluation of tetrahydroquinolin derivatives as potent inhibitors of cbp bromodomain,bioorg.chem.2020,101,103991.;d:nct03568656 study to evaluate ccs1477 in advanced tumors.https://clinicaltrials.gov/ct2/show/nct03568656.(accessed 24 february 2021).e:p.katavolos,g.cain,c.farman,f.a.romero,s.magnuson,j.q.ly,e.f.choo,a.k.katakam,r.andaya,j.maher,preclinical safety assessment of a highly selective and potent dual small-molecule inhibitor of cbp/p300 in rats and dogs,toxicol.pathol.2020,48,465-480.。
技术实现要素:
[0023]
本发明的目的是克服现有技术存在的缺陷,提供了一种具有式(i)结构类型的化合物或者其药学上可接受的盐;本发明所涉及的化合物能够抑制组蛋白乙酰转移酶p300溴结构域的活性,对前列腺癌细胞、恶性血液肿瘤细胞、乳腺癌细胞等肿瘤细胞具有显著的抑制作用,抑制强度强于目前该靶点唯一临床在研药物ccs1477;且本发明所公开的具有式(i)结构类型的化合物在细胞渗透性、代谢稳定性方面均优于ccs1477,具有更好的类药性。
[0024]
具体的,本发明提供了具有通式(i)结构的化合物或其药学上可接受的盐作为p300小分子抑制剂。所述化合物能显著抑制组蛋白乙酰转移酶p300溴结构域的活性、抑制相关肿瘤细胞的生长且具有较好的类药性。
[0025]
本发明的目的通过以下技术方案得以实现:
[0026]
本发明提供了一种具有式(i)结构类型的化合物或者其药学上可接受的盐作为p300溴结构域小分子抑制剂,能够抑制组蛋白乙酰转移酶p300溴结构域的活性,对前列腺癌细胞、恶性血液肿瘤细胞、乳腺癌细胞等肿瘤细胞具有显著的抑制作用,抑制强度强于目前该靶点唯一临床在研药物ccs1477;且本发明所公开的具有式(i)结构类型的化合物在细胞渗透性、代谢稳定性方面均优于ccs1477,具有更好的类药性。
[0027][0028]
式中,r1代表带1~4个碳原子的酰基或亚磺酰基或磺酰基、取代或非取代的五元杂环;
[0029]
r2代表带取代的4-8元环;
[0030]
r3代表带取代基的苯环。
[0031]
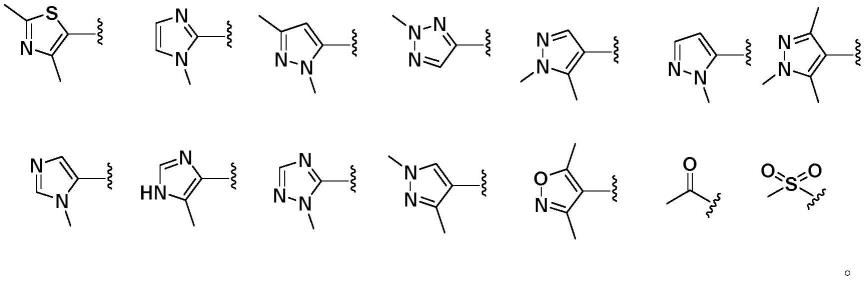
本发明的式(i)结构所示化合物或其药学上可接受的盐,其中所述r1选自如下结构式的基团:
[0032][0033]
本发明的式(i)结构所示化合物或其药学上可接受的盐,其中所述r2选自如下结构式的基团:
[0034][0035]
本发明的式(i)结构所示化合物或其药学上可接受的盐,其中所述r3选自如下结构式的基团:
[0036][0037]
优选地,本发明所述的一类具有组蛋白乙酰转移酶p300溴结构域抑制活性的化合物及其药学上可接受的盐,其包括下列化合物:
[0038][0039]
本发明提供了一种治疗肿瘤的药用组合物,其药学活性成分为上述的具有通式(i)所示结构的化合物或其药学上可接受的盐。
[0040]
本发明的进一步目的是提供上述的具有通式(i)所示结构的化合物或其药学上可接受的盐作为组蛋白乙酰转移酶p300溴结构域抑制剂在用于制备治疗与组蛋白乙酰转移酶p300活性异常有关的癌症药物中的应用;
[0041]
所述的癌症包括前列腺癌、恶性血液肿瘤、乳腺癌、宫颈癌、卵巢癌、非小细胞肺癌、肾细胞癌、黑色素瘤、胃癌、膀胱癌、子宫内膜癌。
[0042]
本发明提供了一种具有式(i)结构类型的化合物或者其药学上可接受的盐作为p300溴结构域小分子抑制剂,能够抑制组蛋白乙酰转移酶p300溴结构域的活性,对前列腺癌细胞、恶性血液肿瘤细胞、乳腺癌细胞等肿瘤细胞具有显著的抑制作用,抑制强度强于目前该靶点唯一临床在研药物ccs1477;且本发明所公开的具有式(i)结构类型的化合物在细胞渗透性、代谢稳定性方面均优于ccs1477,具有更好的类药性。
具体实施方式
[0043]
以下实施例对本发明做进一步的描述,仅表达了本发明的几种实施方式,其描述的较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以作出若干变形和改进,这些都属于本发明的保护范围。
[0044]
实施例1:合成化合物1:(s)-6-(5-(3,5-二甲基异恶唑-4-基)-1-((1s,4r)-4-甲氧基环己基)-1h-苯并[d]咪唑-2-基)-1-(3-(三氟甲氧基)苯基)哌啶-2-酮
[0045][0046]
步骤1,tert-butyl(trans-4-hydroxycyclohexyl)carbamate
[0047][0048]
在氮气保护下,将氢氧化钠水溶液缓慢滴入反式4-氨基环己-1-醇(2.50g,21.7mmol)和二碳酸二叔丁酯(4.73g,21.7mmol)的甲苯(25ml)溶液中。滴加完毕后将反应体系在室温下搅拌过夜。反应完毕后将反应体系过滤并收集固体,干燥后得白色固体(4.07g,86%)。1h nmr(400mhz,cdcl3)δ4.38(br.s.,1h),3.61(m,1h),3.44(m,1h),1.99(m,4h),1.44(s.,9h),1.40-1.32(m,2h),1.17(m,2h).
[0049]
步骤2,trans-(tert-butoxy)-n-(4-methoxycyclohexyl)carboxamide
[0050][0051]
将氢化钠(60%,278mg,6.96mmol)悬浮在thf(5ml)中,并冷却至0℃。向里加入反式-叔丁氧基-n-(4-羟基环己基)羧酰胺(1g,4.64mmol)和15-crown-5(0.965ml,4.88mmol),并将反应混合物在室温下搅拌约30分钟。然后向反应体系中加入碘甲烷(0.289ml,4.64mmol),并将反应在0℃搅拌约1小时。反应完成后用甲醇淬灭反应,真空除去溶剂,并将粗产物通过柱色谱法纯化(etoac∶pe=1:1)得到淡黄色液体(642mg,85.1%)。es-ms:230(m 1)。1h nmr(400mhz,cdcl3)δ4.36(br.s.,1h),3.61(m,1h),3.42(m,1h),3.30(s,3h),1.99(m,4h),1.44(s.,9h),1.39-1.30(m,2h),1.17(m,2h).
[0052]
步骤3,trans-4-methoxycyclohexylamine
[0053][0054]
将反-(叔丁氧基)-n-(4-甲氧基环己基)羧酰胺(642mg,2.80mmol)溶解在乙醇(5ml)中并冷却至0℃。加入乙酰氯(1.5ml),并使反应升至室温并在室温下搅拌过夜。反应
完毕后真空除去溶剂即得到所需产物(458mg,98.2%)。es-ms:130(m 1)。
[0055]
步骤4,4-(4-fluoro-3-nitrophenyl)-3,5-dimethylisoxazole
[0056][0057]
将pd(dppf)cl2(1.81g,2.47mmol)、4-溴-1-氟-2-硝基苯(10.87g,49.4mmol)和3,5-二甲基异恶唑-4-硼酸频哪醇酯(12.68g,56.8mmol)溶于dme(100ml)中。将混合物抽真空并充入氮气(
×
3)进行脱气,然后在80℃加热10h。反应完毕后使反应物冷却,用水(100ml)稀释,然后用etoac(100ml x 3)萃取。合并有机相,然后加入mgso4干燥,过滤固体,然后蒸发滤液。将所得残余物通过柱色谱法纯化(etoac∶pe=1:5)得到米色固体的产物(8.57g,73.0%)1h nmr(400mhz,cdcl3)δ7.96(dd,j=7.0,2.5hz,1h),7.54(ddd,j=8.5,4.0,2.5hz,1h),7.41(dd,j=10.5,8.5hz,1h),2.44(s,3h),2.29(s,3h).
[0058]
步骤5,
[0059]
4-(3,5-dimethylisoxazol-4-yl)-n-(trans-4-methoxycyclohexyl)-2-nitroaniline
[0060][0061]
将4-(4-氟-3-硝基苯基)-3,5-二甲基异恶唑(326mg,1.38mmol)、反式-4-氨基环己醇(185mg,1.60mmol)和碳酸钾(400mg,2.89mmol)溶于乙腈(50ml)中并加热回流3小时。反应完毕后将反应体系在剧烈搅拌中用水(100ml)逐滴稀释。稀释完毕后静置,过滤,收集沉淀物得到亮橙色固体(565mg,79.1%)。1h nmr(400mhz,cdcl3)δ8.41(brs,1h),8.08(d,j=2.0hz,1h),7.33(dd,j=9.0,2.0hz,1h),6.96(d,j=9.0hz,1h),4.36(br.s.,1h),3.61(m,1h),3.42(m,1h),3.30(s,3h),2.40(s,3h)2.26(s,3h),1.99(m,4h),1.41-1.31(m,2h),1.17(m,2h).
[0062]
步骤6,
[0063]
4-(3,5-dimethylisoxazol-4-yl)-n7-(trans-4-methoxycyclohexyl)benzene-1,2-diamine
[0064][0065]
将中间体18溶于水(50ml)和thf(50ml)的混合溶剂中。依次向反应体系中加入浓氨水(2.0ml,51.5mmol)和连二亚硫酸钠(4.49g,25.8mmol),并将反应在室温下搅拌2h。反应完毕后加入etoac(250ml)稀释并将稀释后的混合物转移至分液漏斗,依次用1m naoh(150ml)和饱和食盐水(100ml)洗涤。有机相在真空下浓缩得到灰色固体,不经纯化直接进行下一步。
[0066]
步骤7,
[0067]
(s)-6-(5-(3,5-dimethylisoxazol-4-yl)-1-((1s,4r)-4-methoxycyclohexyl)-1h-benzo[d]imidazol-2-yl)piperidin-2-one
[0068][0069]
将(s)-6-氧杂哌啶-2-羧酸(399mg,2.79mmol)、中间体19(800mg,2.54mmol)和dipea(0.532ml,3.04mmol)溶于dmf(10ml)中,然后加入hatu(1061mg,2.79mmol),在氮气保护下室温搅拌过夜。反应完毕后将反应体系用水(20ml)稀释,然后用乙酸乙酯(3
×
50ml)萃取。合并的有机相依次用1m hcl(10ml)、饱和nahco3水溶液(10ml)洗涤、饱和食盐水(3
×
10ml)洗涤,无水mgso4干燥,过滤并浓缩,得到棕色油状物质。将所得的油状物质溶于冰醋酸(20ml)中,80℃下搅拌16h。反应完毕后使反应物冷却,用水(100ml)稀释,然后用etoac(100mlx 3)萃取。合并有机相,然后加入mgso4干燥,过滤固体,然后蒸发滤液。所得粗产品通过柱色谱法纯化(meoh∶dcm=1:15)得到粉红色固体(279.2mg,48.2%)。1h nmr(400mhz,cdcl3)δ7.78(d,j=8.5hz,1h),7.69(d,j=1.6hz,1h),7.14(dd,j=8.5,1.7hz,1h),5.77(t,j=4.6hz,1h),4.45
–
4.29(m,1h),3.45
–
3.34(m,1h),3.28(s,3h),2.63
–
2.52(m,2h),2.40(s,3h),2.37
–
2.28(m,2h),2.23(s,3h),2.21
–
2.11(m,2h),2.07(s,3h),1.87
–
1.71(m,2h),1.46
–
1.29(m,2h),1.26
–
1.10(m,1h).
[0070]
步骤8,
[0071]
(s)-6-(5-(3,5-dimethylisoxazol-4-yl)-1-((1s,4r)-4-methoxycyclohexyl)-1h-benzo[d]imidazol-2-yl)-1-(3-(trifluoromethoxy)phenyl)piperidin-2-one
[0072][0073]1h nmr(600mhz,meod)δ7.83(d,j=8.5hz,1h),7.64(d,j=1.4hz,1h),7.34(t,j=8.3hz,1h),7.27(dd,j=8.5,1.6hz,1h),7.25
–
7.19(m,1h),7.07(d,j=8.2hz,1h),5.77(t,j=4.6hz,1h),4.45
–
4.29(m,1h),3.45
–
3.34(m,1h),3.28(s,3h),2.63
–
2.52(m,2h),2.40(s,3h),2.37
–
2.28(m,2h),2.23(s,3h),2.21
–
2.11(m,2h),2.07(s,3h),1.87
–
1.71(m,2h),1.46
–
1.29(m,2h),1.26
–
1.10(m,1h)。
[0074]
实施例2:合成化合物2:(s)-1-(3,4-二氟苯基)-6-(1-(((1r,4s)-4-甲氧基环己基)-5-(2-甲基-2h-1,2,3-三唑-4-yl)-1h-苯并[d]咪唑-2-基)哌啶-2-酮
[0075][0076]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ8.11(d,j=1.0hz,1h),8.01(s,1h),7.72(dd,j=8.6,1.5hz,1h),7.69(d,j=8.6hz,1h),7.26(ddd,j=11.3,7.3,2.4hz,1h),7.15(dd,j=19.1,8.9hz,1h),7.06-7.01(m,1h),5.68(t,j=5.5hz,1h),4.33(tt,j=12.3,4.0hz,1h),4.22(s,3h),3.45-3.38(m,1h),3.40(s,3h),2.80(dt,j=17.9,6.1hz,1h),2.66
–
2.60(m,1h),2.49
–
2.44(m,1h),2.42-2.32(m,1h),2.27
–
2.15(m,5h),2.00
–
1.96(m,1h),1.92-1.84(m,1h),1.52
–
1.46(m,1h),1.41
–
1.36(m,1h),1.24-1.15(m,1h)。
[0077]
实施例3:合成化合物3:(s)-6-(5-(3,5-二甲基异恶唑-4-基)-1-((1r,4s)-4-甲氧基环己基)-1h-苯并[d]咪唑-2-基)-1-(4-甲氧基-3-甲基苯基)哌啶-2-酮
[0078][0079]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ7.88(d,j=8.5hz,1h),7.64(d,j=1.4hz,1h),7.29(dd,j=8.5,1.5hz,1h),6.93(d,j=2.3hz,1h),6.74(d,j=8.8hz,1h),6.64(d,j=6.9hz,1h),5.68(t,j=5.5hz,1h),4.33(tt,j=12.3,4.0hz,1h),3.45-3.38(m,1h),3.40(s,3h),3.26(s,3h),2.80(dt,j=17.9,6.1hz,1h),2.66
–
2.60(m,1h),2.49
–
2.44(m,1h),2.42-2.32(m,1h),2.40(s,3h),2.29(s,3h),2.27
–
2.15(m,5h),2.16(s,3h),2.00
–
1.96(m,1h),1.92-1.84(m,1h),1.52
–
1.46(m,1h),1.41
–
1.36(m,1h),1.24-1.15(m,1h)。
[0080]
实施例4:合成化合物4:(s)-1-(3,4-二氟苯基)-6-(5-(1,5-二甲基-1h-吡唑-4-基)-1-((1r,4s)-4-甲氧基环己基)-1h-苯并[d]咪唑-2-基)哌啶-2-酮
[0081][0082]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ7.78(d,j=8.5hz,1h),7.69(d,j=1.6hz,1h),7.42
–
7.28(m,2h),7.14(dd,j=8.5,1.7hz,1h),7.08
–
7.01(m,1h),6.93(s,1h),5.77(t,j=4.6hz,1h),4.45
–
4.29(m,1h),4.23(s,3h),3.45
–
3.34(m,1h),3.28(s,3h),2.63
–
2.52(m,2h),2.40(s,3h),2.37
–
2.28(m,2h),2.21
–
2.11(m,2h),2.07(s,3h),1.87
–
1.71(m,2h),1.46
–
1.29(m,2h),1.26
–
1.10(m,1h).
[0083]
实施例5:合成化合物5:(s)-1-(3,4-二氟苯基)-6-(5-(1,3-二甲基-1h-吡唑-5-基)-1-((1r,4s)-4-甲氧基环己基)-1h-苯并[d]咪唑-2-基)哌啶-2-酮
[0084][0085]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ7.76(d,j=8.5hz,1h),7.64(d,j=1.6hz,1h),7.40
–
7.25(m,2h),7.14(dd,j=8.5,1.7hz,1h),7.08
–
7.01(m,1h),6.81(s,1h),5.77(t,j=4.6hz,1h),4.45
–
4.29(m,1h),4.23(s,3h),3.45
–
3.34(m,1h),3.32(s,3h),2.72(s,3h),2.62
–
2.53(m,2h),2.37
–
2.28(m,2h),2.21
–
2.11(m,2h),2.07(s,3h),1.87
–
1.71(m,2h),1.44
–
1.26(m,2h),1.23
–
1.08(m,1h)。
[0086]
实施例6:合成化合物6:(s)-6-(5-乙酰基-1-(((1r,4s)-4-甲氧基环己基)-1h-苯并[d]咪唑-2-基)-1-(3,4-二氟苯基)哌啶-2-酮
[0087][0088]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ8.38(d,j=1.4hz,1h),7.94(dd,j=8.7,1.6hz,1h),7.76(d,j=8.7hz,1h),7.28(ddd,j=11.3,7.3,2.4hz,1h),7.18(dd,j=19.1,8.9hz,1h),7.09
–
7.03(m,1h),5.73(t,j=5.3hz,1h),4.38(ddd,j=16.4,8.2,4.0hz,1h),3.48
–
3.43(m,1h),3.42(s,3h),2.81(dt,j=18.0,5.9hz,1h),2.69(s,3h),2.68
–
2.62(m,1h),2.54
–
2.47(m,1h),2.38(d,j=11.8hz,1h),2.29
–
2.16(m,5h),2.02
–
1.96(m,1h),1.92-1.87(m,1h),1.50(ddd,j=24.2,13.0,3.8hz,1h),1.42(ddd,j=24.3,12.9,3.8hz,1h),1.31-1.20(m,1h)。
[0089]
实施例7:合成化合物7:(s)-1-(3,4-二氟苯基)-6-(5-(3,5-二甲基异恶唑-4-基)-1-(1,1-二氧化四氢-2h-硫代吡喃-4-基)-1h-苯并[d]咪唑-2-基)哌啶-2-酮
[0090][0091]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ7.86(d,j=8.5hz,1h),7.64(d,j=1.4hz,1h),7.29(dd,j=8.5,1.5hz,1h),6.93(d,j=2.3hz,1h),6.74(d,j=8.8hz,1h),6.64(d,j=6.9hz,1h),4.33(tt,j=12.3,4.0hz,1h),3.45-3.38(m,1h),2.80(dt,j=17.9,6.1hz,1h),2.66
–
2.60(m,1h),2.49
–
2.44(m,1h),2.42-2.32(m,1h),2.40(s,3h),2.29(s,3h),2.27
–
2.15(m,5h),2.16(s,3h),2.00
–
1.96(m,1h),1.92-1.84(m,1h),1.52
–
1.46(m,1h),1.41
–
1.36(m,1h),1.24-1.15(m,1h)。
[0092]
实施例8:合成化合物8:(s)-1-(3-氯-4-甲氧基苯基)-6-(1-(4,4-二氟环己基)-5-(3,5-二甲基异恶唑-4-基)-1h-苯并[d]咪唑-2-基)哌啶-2-酮
[0093][0094]
合成方法如实施例1,得白色固体。1h nmr(600mhz,meod)δ7.82(s,1h),7.60(d,j=8.6hz,1h),7.48(s,1h),7.32(d,j=8.6hz,1h),7.11(d,j=8.3hz,1h),6.79(d,j=8.3hz,1h),4.00(dd,j=14.6,7.2hz,1h),3.89(s,3h),3.74(dd,j=14.6,7.2hz,1h),3.22
–
3.15(m,2h),3.12
–
3.01(m,2h),2.90
–
2.81(m,2h),2.79
–
2.68(m,3h),2.64
–
2.52(m,2h),2.48(s,3h),2.46
–
2.33(m,2h),2.31(s,3h),1.17-1.11(m,3h).
[0095]
实施例9:化合物对组蛋白乙酰转移酶p300抑制活性测试
[0096]
检测化合物对p300/cbp蛋白溴结构域的抑制率采用tr-fret技术。fret技术利用了能量供体donor和能量受体acceptor荧光基团的能量转移,前者的发射光谱与后者的激发光谱重叠。当donor被外来能源激发并且它与acceptor在足够近的距离之内(1-10nm),可以将能量共振转移到acceptor上。acceptor受到激发,会发出特定波长的发射光。检测体系中用5μl 1x tr-fret assay buffer稀释化合物或阴性对照,使化合物浓度为4x最终工作浓度。加入10μl cbp溴结构域europium chelate,避光孵育15分钟。加入5μl cbp bromodomain ligand/apc acceptor混合物,避光孵育1小时。利用酶标仪读取激发光340nm/发射光620nm/670nm检测荧光信号,计算ic
50
值。
[0097]
实验方法:
[0098]
1)用assay buffer稀释p300 enzyme,acetyl coa,inhibitors and histone h3(1-21)peptide;
[0099]
2)将以下试剂依次加入384微孔板白板:
[0100]
‑‑‑
5μl of inhibitor(2x)or assay buffer
[0101]
‑‑‑
2.5μl of enzyme(4x)
[0102]
‑‑‑
incubate for 10min at 37
[0103]
‑‑‑
2.5μl of histone h3(1-21)peptide/acetyl coa mix(4x);
[0104]
3)用topseal封住微孔板,室温孵育90min;
[0105]
4)配制1x epigenetics buffer 1;
[0106]
5)用1x epigenetics buffer 1配置anti-acetyl-histone h3 lysine 9(h3k9ac)alphalisa acceptor beads(100ug/ml),终浓度为20ug/ml;
[0107]
6)加入5ul的5x anti-acetyl-histone h3 lysine 9(h3k9ac)alphalisa acceptor beads,封口孵育60mins;
[0108]
7)用1x epigenetics buffer 1配置streptavidin donor beads(50ug/ml),终浓度为20ug/ml;
[0109]
8)加入10ul的streptavidin donor beads,封口避光孵育30min;
[0110]
9.使用envision读数。
[0111]
代表性的化合物的ic
50
如表1所示:
[0112]
表1:化合物对p300溴结构域抑制活性
[0113]
化合物编号ic
50
1 2 3 4 5 6 7 8 ccs1477
[0114]
:代表ic
50
《1μm
[0115]
:代表1μm≤ic
50
<10μm
[0116]
:代表ic
50
≥10μm。
[0117]
实施例10:srb法检测细胞增殖实验
[0118]
原理:磺酰罗丹明b(sulforhodamine b,srb)比色法,主要用于检测细胞增殖情况。srb是一种粉红色阴离子染料,易溶于水,在酸性条件下可特异性地与细胞内组成蛋白质的碱性氨基酸结合;在540nm波长下产生吸收峰,吸光值与细胞量成线性正相关,故可用作细胞数的定量检测。
[0119]
srb法步骤如下:
[0120]
1)将处于对数生长期的实体瘤细胞以800个/孔,血液瘤3000-5000个/孔的密度种于96孔培养板中;
[0121]
2)细胞培养过夜后每孔10μl加入梯度稀释的ep300溴结构域抑制剂,各浓度梯度分别为50μm、25μm、12.5μm、6.25μm、3.625μm、1.56μm、0.78μm、0.39μm、0.20μm、0.10μm、0.05μm(dmso含量不超过1
‰
),每个浓度设三复孔,并设定相应浓度的dmso溶液对照及无细胞空白孔对照;
[0122]
3)固定:化合物作用6天后,弃培液,每孔加入100μl预冷10%三氯乙酸(tca)于4℃固定1h。然后用蒸馏水洗涤5次,60℃烘箱干燥;
[0123]
4)染色:每孔加入100μl磺酰罗丹明b(srb)染液(4mg/ml,溶于1%冰乙酸),室温染色30min后弃去染色液,1%(v/v)冰乙酸洗涤96孔板除去未与细胞蛋白结合srb,60
°
烘箱干燥;
[0124]
5)检测:每孔加入150μl 10mm tris溶液,溶解与细胞蛋白结合的srb,在酶标仪560nm或515nm波长下测定吸光度od值。
[0125]
抑制率的计算公式:抑制率(%)=(odvehicle-odtreated)/odvehicle
×
100%。采用软件softmaxpro 5.4.1(molecular device)中四参数法logit method计算待测化合物的ic
50
。实验重复三次以上,数据表示为均值
±
s.d.。
[0126]
代表性的化合物对肿瘤细胞增殖抑制ic
50
如表2、表3所示:
[0127]
表2:化合物敏感肿瘤增殖抑制实验结果
[0128][0129]
表3:部分活性化合物敏感肿瘤增殖抑制实验结果
[0130][0131][0132]
实施例11:caco-2细胞渗透性试验
[0133]
caco-2细胞用高糖dmem培养基,置于37℃、5%co2、空气相对湿度90%的培养箱中培养,培养基中添加10%胎牛血清、10mmol/l hepes、1mmol/l丙酮酸钠、1%谷氨酰胺、1%
非必需氨基酸、100u/ml青霉素和100μg/ml链霉素;每隔7天传一代,传代比率1:10。实验使用40至60代之间的细胞;培养21天以后,用teer值检测细胞单层的紧密程度(须大于400ω
·
cm2);同时考察从细胞顶层(a侧)到基底层(b侧)和b侧到a侧的药物转运。试验方法如下:用hbss洗细胞三次以后,20μm的化合物以及化合物加抑制剂(gf120918)分别加到对应的细胞孔中(a侧ph6.8,b侧ph7.4);在37℃培养箱中培养95分钟,分别在5分钟和95分钟时给药侧取样,在35分钟和95分钟时接收侧取样;用lc-ms/ms检测样品的浓度;测定被试化合物的papp和efflux值。
[0134]
表4:caco-2细胞渗透性试验结果
[0135][0136]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。