一种与绵羊脂肪相关的mirna及其应用
技术领域
1.本发明属于农业基因工程技术领域,具体涉及一种与绵羊脂肪相关的mirna及其应用。
背景技术:
2.mirna是短链内源性非编码rna,保守性高,在动物、植物以及病毒体内广泛分布。在许多生物过程中,mirna会参与基因转录后的调控,通过与互补mrna的3'utr碱基配对从而阻碍mrna翻译或者使mrna降解。mirna对脂肪细胞分化既有促进作用又有抑制作用。mir
‑
143是第一个被发现在成脂分化过程中起到调控作用的mirna,通过抑制map2k5表达进而促进成脂分化。mir
‑
21在3t3
‑
l1脂肪细胞分化进程里,扮演的角色可对前脂肪细胞分化起到明显促进作用,并增加脂联素的表达。在前脂肪细胞分化过程中lpl是mir
‑
152的直接靶基因,mir
‑
152可以抑制3t3
‑
l1前脂肪细胞的增殖,通过负性调节lpl使3t3
‑
l1前脂肪细胞的分化得到促进。
3.羊的品种不同,其脂肪沉积能力也有所差异。多浪羊与小尾寒羊同为我国优质地方绵羊品种,但是多浪羊相对于小尾寒羊来说脂肪沉积能力更强,属于肉脂兼用型绵羊,而小尾寒羊属于短瘦尾型绵羊,皮下脂肪较少,二者的差异为我们研究绵羊脂肪沉积提供了良好素材。
4.为探讨脂肪发育的分子机制,本研究以多浪羊与小尾寒羊皮下脂肪组织为研究对象,使用rna
‑
seq技术对基因进行测序分析,以期为培育优质肉用绵羊及预防治疗肥胖、脂代谢综合征等疾病提供基础。
技术实现要素:
5.本发明的首要目的是提供一种与绵羊脂肪相关的mirna,所述mirna是经过测序及生信分析筛选并使用分子实验验证获得的。
6.一种与绵羊脂肪相关的mirna,所述mirna为nc_040278.1_37602,序列与seq id no.1具有90%以上序列同源性。
7.优选的,nc_040278.1_37602序列与seq id no.1具有95%以上序列同源性;更优选的,mirna序列为seq id no.1。
8.优选的,脂肪为皮下脂肪或肌内脂肪。
9.一种与绵羊脂肪相关的pre
‑
mirna,所述prerna序列与seq id no.2具有90%以上序列同源性;优选的,pre
‑
mirna序列为seq id no.2。
10.本发明的第二目的是提供一种检测与绵羊脂肪或肉用性能相关的试剂。
11.所述试剂通过测序技术、核酸杂交技术或核酸扩增技术检测样本中nc_040278.1_37602和/或其靶基因的表达水平。
12.优选的,所述nc_040278.1_37602的靶基因为tbc1d19、pde3b、clic4、psd3、vav3、tasor2、spata6、ptgs2基因中的一种或几种,更优选的,靶基因为ptgs2基因。
13.所述肉用性能是指产肉量、胴体组成、肉中脂肪含量、肉品等级、脂肪色泽、肌内脂肪含量等方面的性能。
14.优选的,脂肪为皮下脂肪或肌内脂肪。
15.本发明的第三目的是提供一种检测与绵羊脂肪或肉用性能相关的试剂盒。
16.所述试剂盒包含进行dna微阵列、寡核苷酸微阵列、rna印迹法、rnase保护试验和反转录聚合酶链反应所必需的dna芯片、寡核苷酸芯片、探针或引物,以检测nc_040278.1_37602和/或其靶基因的表达水平。
17.优选的,该试剂盒包括qpcr实验中使用的反转录引物和/或扩增引物,所述反转录引物是oligo(dt)特异性的rt引物。
18.优选的,试剂盒包含用于核酸扩增的引物对,检测nc_040278.1_37602基因的表达水平。
19.本发明的第四目的是提供nc_040278.1_37602和/或其靶基因用于制备与绵羊脂肪或肉用性能相关的检测试剂中的应用。
20.优选的,通过测序技术、核酸杂交技术或核酸扩增技术检测样本中nc_040278.1_37602和/或其靶基因的表达水平。
21.优选的,核酸扩增技术采用特异性引物扩增nc_040278.1_37602;核酸杂交包括与nc_040278.1_37602的核酸序列杂交的探针。
22.优选的,核酸扩增技术采用一对特异性引物扩增nc_040278.1_37602靶基因;核酸杂交包括与nc_040278.1_37602靶基因的核酸序列杂交的探针。
23.优选的,用于nc_040278.1_37602核酸扩增的引物序列为seq id no.2。
24.优选的,用于nc_040278.1_37602靶基因核酸扩增的引物对序列为seq idno.3和seq id no.4。
25.优选的,所述样本为组织。更优选的,样本为脂肪组织。
26.本发明的第五目的是上述mirna、pre
‑
mirna、试剂及试剂盒在检测与绵羊脂肪或肉用性能相关产品中的应用。
27.本发明的第六目的是上述mirna、pre
‑
mirna、试剂及试剂盒在选育肉用绵羊中的应用。
[0028]“多核苷酸”或“核酸”在本文中可互换使用,指任何长度的核苷酸聚合物,包括dna和rna。核苷酸可以是脱氧核糖核苷酸,核糖核苷酸,经过修饰的核苷酸或碱基,和/或其类似物,或者是可通过dna或rna聚合酶,或者通过合成反应掺入聚合物中的任何底物。如此,例如,本文中所定义的多核苷酸包括但不限于单链和双链dna,包含单链区和双链区的dna,单链和双链rna,及包含单链区和双链区的rna,包含dna和rna的杂合分子,它可以是单链的,或者更典型的是双链的,或者包含单链区和双链区。另外,术语“多核苷酸”在用于本文时指包含rna或dna或rna和dna二者的三链区。此类区中的链可来自相同分子或来自不同分子。所述区可包含一种或多种分子的整个,但是更典型的是只包含有些分子的一个区。三股螺旋区的分子之一常是寡核苷酸。术语“多核苷酸”明确包括cdna。
[0029]
多核苷酸可包含经过修饰的核苷酸,诸如甲基化核苷酸及其类似物。对核苷酸结构的修饰可以在装配聚合物之前或之后进行。核苷酸序列可以由非核苷酸组分中断。多核苷酸可以在合成后进一步修饰,诸如通过与标记物缀合。其它类型的修饰包括例如“帽”,将
一个或多个天然存在的核苷酸用类似物替代,核苷酸间修饰诸如例如具有不带电荷连接(例如甲基膦酸酯,磷酸三酯,磷酰胺酯(phosphoamidate),氨基甲酸酯等)和具有带电荷连接(例如硫代磷酸酯,二硫代磷酸酯等)的修饰,含有悬垂模块(pendant moiety)诸如例如蛋白质(例如核酸酶,毒素,抗体,信号肽,聚l
‑
赖氨酸等)的修饰,具有嵌入剂(例如吖啶,补骨脂素等)的修饰,含有螯合剂(例如金属,放射性金属,硼,氧化性金属等)的修饰,含有烷化剂的修饰,具有经修饰连接(例如α端基异构核酸)的修饰,以及未修饰形式的多核苷酸。另外,通常存在于糖类中的任何羟基基团可以用例如膦酸基团,磷酸基团替换,用标准保护基团保护,或活化以制备与别的核苷酸的别的连接,或者可缀合至固体或半固体支持物。可磷酸化或者用胺或1
‑
20个碳原子的有机加帽基团模块取代5’和3’末端oh。其它羟基也可衍生成标准保护基团。多核苷酸也可含有本领域普遍知道的核糖或脱氧核糖糖类的类似物形式,包括例如2
’‑
氧
‑
甲基
‑
,2
’‑
氧
‑
烯丙基
‑
,2
’‑
氟
‑
或2
’‑
叠氮
‑
核糖,碳环糖类似物,α
‑
端基异构糖,差向异构糖诸如阿拉伯糖,木糖或来苏糖,吡喃糖,呋喃糖,景天庚酮糖,无环类似物及脱碱基核苷类似物诸如甲基核糖核苷。可用备选连接基团替换一个或多个磷酸二酯连接。并非多核苷酸中的所有连接都必需是相同的。多核苷酸可含有一处或多处不同类型的本文中描述的修饰和/或多处相同类型的修饰。前述描述适用于本文中提及的所有多核苷酸,包括rna和dna。
[0030]
如本文中所使用的,“寡核苷酸”一般指短的,单链的多核苷酸,其在长度上小于约250个核苷酸,但这不是必须的。寡核苷酸可以是合成的。术语“寡核苷酸”和“多核苷酸”并不互相排斥。上文关于多核苷酸的描述同样且完全可适用于寡核苷酸。
[0031]
如本文所用“引物”指能够与核酸杂交并允许互补核酸的聚合作用(一般通过提供游离的3
’‑
oh基团)的单链多核苷酸。
[0032]
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。这些技术包括但不限于:核酸测序、核酸杂交、核酸扩增技术。
[0033]
核酸测序技术的示例性非限制性实例包括但不限于链终止子(sanger)测序和染料终止子测序。本领域的普通技术人员将认识到,由于rna在细胞中不太稳定并且在实验中更易受到核酸酶攻击,因此在测序前通常将rna逆转录成dna。
[0034]
核酸测序技术的另一示例性非限制性实例包括下一代测序(深度测序/高通量测序),高通量测序技术是一种基于单分子簇的边合成边测序技术,基于专有的可逆终止化学反应原理。测序时将基因组的dna的随机片段附着到光学透明的玻璃表面,这些dna片段经过延伸和桥式扩增后,在玻璃表面形成数以亿计的簇,每个簇是具有数千份相同模板的单分子簇,然后利用带荧光基团的四种特殊脱氧核糖核苷酸,通过可逆性的边合成边测序技术对待测的模板dna进行测序。
[0035]
核酸杂交技术的示例性非限制性实例包括但不限于原位杂交(ish)、微阵列和southern或northern印迹。原位杂交(ish)是一种使用标记的互补dna或rna链作为探针以定位组织一部分或切片(原位)或者如果组织足够小则为整个组织(全组织包埋ish)中的特异性dna或rna序列的杂交。dna ish可用于确定染色体的结构。rna ish用于测量和定位组织切片或全组织包埋内的mrna和其他转录本(例如,ncrna)。通常对样本细胞和组织进行处理以原位固定靶转录本,并增加探针的进入。探针在高温下与靶序列杂交,然后将多余的探
针洗掉。分别使用放射自显影、荧光显微术或免疫组织化学,对组织中用放射、荧光或抗原标记的碱基标记的探针进行定位和定量。ish也可使用两种或更多种通过放射性或其他非放射性标记物标记的探针,以同时检测两种或更多种转录本。
[0036]
本发明可在检测前或与检测同时地对核酸(例如,ncrna)进行扩增。核酸扩增技术的示例性非限制性实例包括但不限于:聚合酶链式反应(pcr)、逆转录聚合酶链式反应(rt
‑
pcr)、转录介导的扩增(tma)、连接酶链式反应(lcr)、链置换扩增(sda)和基于核酸序列的扩增(nasba)。本领域的普通技术人员将认识到,某些扩增技术(例如,pcr)需要在扩增前将rna逆转录成dna(例如,rt
‑
pcr),而其他扩增技术则直接扩增rna(例如,tma和nasba)。
[0037]
通常称为pcr的聚合酶链式反应使用变性、引物对与相反链的退火以及引物延伸的多个循环,以指数方式增加靶核酸序列的拷贝数;tma的转录介导的扩增(在基本上恒定的温度、离子强度和ph的条件下自身催化地合成靶核酸序列的多个拷贝,其中靶序列的多个rna拷贝自身催化地生成另外的拷贝;lcr的连接酶链式反应使用与靶核酸的相邻区域杂交的两组互补dna寡核苷酸;其他扩增方法包括例如:通常称为nasba的基于核酸序列的扩增;使用rna复制酶(通常称为qβ复制酶)扩增探针分子本身的扩增;基于转录的扩增方法;以及自我维持的序列扩增。
[0038]
在本发明中,试剂盒包括检测nc_040278.1_37602的试剂,以及选自下组的一种或多种物质:容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂。
[0039]
本发明的试剂盒中还可附有试剂盒的使用说明书,其中记载了如何采用试剂盒进行检测,和如何利用检测结果对肿瘤发展进行判断、对治疗方案进行选择
[0040]
本发明的优点和有益效果:(1)首次发现了序列如seq id no:1所示的mirna及其与绵羊肉用性能相关;(2)在实际生产中,可以通过mirna调控相关基因的表达,从而改善绵羊的肉用性能,提高肉感,因此本发明为畜牧业生产提供了理论基础和技术启示。
附图说明
[0041]
图1为脂肪组织差异表达mirna靶基因go分析图;
[0042]
图2为脂肪组织差异表达mirna靶基因kegg富集分析;
[0043]
图3为差异表达mirna qrt
‑
pcr验证结果;
[0044]
图4为nc_040278.1_37602及其靶基因差异表达qrt
‑
pcr验证结果。
具体实施方式
[0045]
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
[0046]
实施例1样品的采集剂rna提取
[0047]
1.1样品的采集
[0048]
本试验以脂肪沉积存在差异的多浪羊(d)与小尾寒羊(x)为对象进行研究。选取的羊只均为成年雌性,并且个体体况良好、健壮无病,体重相近(约50kg),每组有三个生物学
重复。
[0049]
1.2样本rna的提取和质量检测
[0050]
取出各样品中等量的脂肪组织用作提取总rna,确保整个流程在无菌环境下进行,步骤如下:
[0051]
(1)分别在加有液氮的研钵里研磨脂肪组织;
[0052]
(2)将研磨好的组织放入加有trizol试剂的离心管中静置;
[0053]
(3)加入氯仿混匀并在室温下静置10分钟;
[0054]
(4)放入离心机中,在4℃条件下,转速12000,离心15分钟;
[0055]
(5)将最上层无色液体放入rnase free管中,用等量异丙醇来沉淀rna,室温下混合均匀静置10分钟;
[0056]
(6)再次在温度为4℃、转速为12000条件下离心15分钟;
[0057]
(7)将上清液去除,在沉淀中加入乙醇(75%)充分混匀后,再一次在上述条件下离心;
[0058]
(8)去除上清液,继续加乙醇清洗rna2
‑
3次;
[0059]
(9)弃乙醇,沉淀干燥处理5
‑
10分钟;
[0060]
(10)最后沉淀物用rna无酶水处理。
[0061]
为保证总rna纯度及完整性,将其进行质量检测:
[0062]
建库测序的要求是rna总量不少于2ug,本试验对longrna(mrna、lncrna、circrna)和smallrna(mirna)分别建库。对longrna的文库构建采用truseqtm stranded total rna kit试剂盒,rna总量为2μg,浓度在100ng/μl以上,od260/280范围是1.8
‑
2.2。对smallrna文库采用illumina truseq small rna试剂盒进行构建。
[0063]
分别对多浪羊和小尾寒羊的6个皮下脂肪组织提取总rna并进行质量检测,结果可见28s条带亮度相对于18s来说均显著较高;各样本rna浓度高于200ng/μl;rin值均大于8,od260/280≥1.8,od260/230≥1.0,说明rna没有被碳水化合物和蛋白质等杂质污染,且完整性较好,可在后续试验中继续应用。
[0064]
实施例2测序及数据分析
[0065]
使用illumina novaseq 6000测序平台测序。对longrna
‑
seq与smallrna
‑
seq数据的质控分别用软件fastp和fastx_toolkit进行。序列比对分析所用参考物种为绵羊(ovis_aries),在ncbi数据库中获得参考基因组(gcf_002742125.1)。将与参考基因组相匹配的reads,比对mirbase数据库中绵羊的mirna前体和成熟体序列,分别获得各样本中已知mirna的包括序列信息、长度信息、前体序列和位置等信息。如果所研究物种在mirase中不存在对应的信息,可以选择与所研究动物亲缘关系相近的mirna序列信息的物种作为已知mirna的参考信息,利用亲缘相近物种的mirna序列鉴定去研究目的物种已知mirna。经统计共得到868个mirna,其中已知和新mirna的数量分别为149和719个。
[0066]
样本表达量差异分析。多浪羊与小尾寒羊脂肪组织沉积情况存在明显差异,通过对比两品种羊基因表达情况,筛选出在两品种羊皮下脂肪中差异表达的基因,由此更进一步研究二者脂肪沉积出现显著差异的分子机制。对多浪羊和小尾寒羊皮下脂肪组织(d
‑
pf vs x
‑
pf)中mirna与mrna(均包含已知基因和新鉴定到的基因)进行严格筛选,从中挑选得到符合条件的差异表达基因。经筛选mirna中约有95%左右被过滤掉,余下差异表达的
mirnas共有38个,其中上调的有10个,下调的有28个。共有2439个mrnas(1102个上调表达,1337个下调表达)存在差异。其中新发现的mirna(nc_040278.1_37602)作为候选基因进行后续验证。
[0067]
为了了解差异表达基因以及基因产物的功能,使用go注释对差异表达基因进行三方面的注释分析,包括生物过程、细胞成分和分子功能。在多浪羊与小尾寒羊皮下脂肪组织中共有649个基因存在go term注释,并且这些基因显著富集到132条go term中,包括101条生物学过程(仅选取其中显著富集的go term和与脂肪发育、脂代谢及相关疾病密切相关的term进行展示),14条细胞组分和17条分子功能。如图1所示,在分子功能上差异表达靶基因,主要富集在肝素结合(heparin binding)、甾醇c
‑
8异构酶活性(c
‑
8sterol isomerase activity)、甘油酸激酶活性(glycerate kinase activity)以及糖基磷脂酰肌醇磷脂酶d活性(glycosylphosphatidylinositol phospholipase d activity)等酶活性调节过程。在细胞组分方面,显著富集在细胞表面(cell surface)、细胞外基质(extracellular matrix)、质膜(plasma membrane part)等相关条目中。在生物过程方面,显著富集到蛋白质磷酸化的调节(regulation of protein phosphorylation)、脂质分解代谢过程的调控(regulation of lipid catabolic process)、mapk级联反应的调控(regulation of mapk cascade)、对甘油三酸酯的反应(response to triglyceride)、对胰岛素的反应(response to insulin)等条目中。通过go分析表明差异mirna主要调控了多浪羊与小尾寒羊脂肪细胞分化过程及脂代谢过程中酶的活性,从而导致两品种羊脂肪沉积存在差异。
[0068]
利用kegg富集对靶基因功能进行分析,共富集到284条通路上,设置校正后padjust<0.05对通路进行筛选,共得到43条显著富集通路(图2)。其中显著富集的通路为pi3k
‑
akt信号通路,此外还显著富集到ampk、类固醇生物合成(steroid biosynthesis)、胰岛素(insulin signaling pathway)、淀粉和蔗糖代谢(starch and sucrose metabolism)、磷脂酶d(phospholipase d signaling pathway)以及mapk等与脂代谢相关通路中,由此可见差异表达mirnas可能通过改变信号转导对脂肪发育进行调控。
[0069]
mirna与mrna的靶向关系网络分析。为更直接观察mirna与mrna之间的相互作用情况,选取显著富集在go和kegg中与脂肪细胞分化、脂质代谢及相关疾病有关基因进行网络图的绘制。其中oar
‑
mir
‑
493
‑
3p作为网络中连接度(degree)最多的基因,靶向了15个mrnas。nc_040278.1_37602基因的靶基因为tbc1d19、pde3b、clic4、psd3、vav3、tasor2、spata6、ptgs2等基因。
[0070]
实施例3实时荧光定量pcr检测验证
[0071]
3.1测序结果的可靠性验证
[0072]
本实验在两个比较组(多浪羊和小尾寒羊)之间随机选择差异表达的mirna进行pcr检测,每个基因3个重复,验证每个mirna的表达趋势,主要方法如下:
[0073]
逆转录
[0074]
(1)逆转录。利用试剂盒在逆转录体系为:总rna 0.5μg,2
×
ts mirna reaction mix 5μl,transscrip mirna rt enzyme mix 0.5μl,nuclease
‑
free无酶水加至10μl。设定程序:abi 9700型pcr仪上37℃持续60分钟,85℃持续5秒终止反应。
[0075]
表2 pcr反应体系
[0076][0077]
将准备好的pcr mix分装至384孔板,依次加入1μl相应的cdna,每个脂肪样品做3个复孔。贴膜刮平后振荡混匀,离心机2000rpm离心1分钟。结束后取出384孔板。pcr程序为:94℃30秒;94℃5秒,60℃30秒,45次循环。结束后,检测产物特异性。从60℃到97℃过程中需缓慢升温。
[0078]
反应结束后导出数据,用2
‑
δδct
法计算样本相对表达情况,t
‑
检验统计分析相对表达情况,数据显示为平均数
±
标准差(mean
±
sd),p<0.05为显著。
[0079]
pcr数据分析及结果
[0080]
随机选择差异表达的5个mirna进行qrt
‑
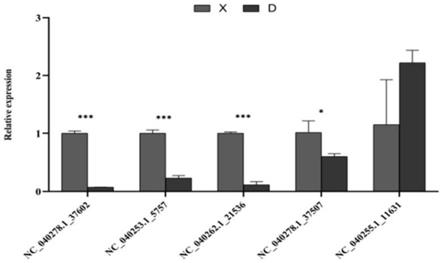
pcr验证,结果表明,nc_040278.1_37602、nc_040253.1_5757、nc_040262.1_21536、nc_040278.1_37507在多浪羊皮下脂肪组织中上调表达,nc_040255.1_11631在多浪羊皮下脂肪组织中下调表达(图3)。图中:*表示p<0.05,**表示p<0.01,***表示p<0.001,以上结果与测序相吻合,可知测序结果可靠。
[0081]
3.2候选基因的验证
[0082]
本实验分别收集20只多浪羊和小尾寒羊,在两个组之间对差异表达的nc_040278.1_37602及其靶基因进行pcr检测,每个基因3个重复,验证nc_040278.1_37602及其靶基因差异表达情况,实验步骤参考3.1。
[0083]
pcr数据分析及结果,利用2
‑△△
ct
法计算nc_040278.1_37602及其靶基因ptgs2在各个样本间的相对表达量,数据表示为平均数
±
标准差(mean
±
sd),p<0.05表示该基因在两组间差异显著。结果表明,nc_040278.1_37602基因在多浪羊皮下脂肪组织中显著下调表达,ptgs2基因在多浪羊皮下脂肪组织中显著上调表达(具体见图4)。
[0084]
表3
[0085][0086]
通过功能注释及富集分析筛选得到与脂肪沉积紧密相关的基因,并与差异mirna
进行靶关系预测。本研究发现未知的mirna:nc_040278.1_37602,其通过靶向调控ptgs2基因来行使功能,有研究显示ptgs2(前列腺素
‑
内过氧化物合酶2)在安格斯和中国西门塔尔牛脂肪组织中差异表达,被初步确定为脂肪沉积的候选基因,本研究发现nc_040278.1_37602通过靶向ptgs2对多浪羊与小尾寒羊脂肪沉积进行调控来调控两品种绵羊皮下脂肪的代谢以及脂肪细胞的分化,荧光定量pcr实验结果进一步验证了该结论。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

