1.本发明涉及三维组织体及其制造方法。
背景技术:
2.作为人工地制作模仿生物体组织的结构体的方法,例如已知有下述方法等:一种制造三维组织体的方法(专利文献1),其通过对培养细胞的表面整体由粘附膜包覆的包覆细胞进行培养来制造三维组织体;一种制造三维组织体的方法(专利文献2),其包含将由包含胶原的被膜涂敷的细胞三维地配置而形成三维组织体的工序;一种三维组织体的制造方法(专利文献3),其包含形成在细胞的表面形成有被膜的包覆细胞的工序、及将包覆细胞三维地配置的工序,其中,包覆细胞的形成包含使细胞浸渍于含有被膜成分的液体中的工序、及利用透液性膜将浸渍后的细胞与含有被膜成分的液体分离的工序;一种立体性细胞组织的制造方法(专利文献4),其包含下述工序:将细胞与阳离子性物质和细胞外基质成分混合而得到混合物,从得到的混合物收集细胞,在基材上形成细胞集合体。另外,本发明者们还提出了一种制造胶原浓度高的三维组织体的方法(专利文献5),其通过使细胞与内源性胶原接触,优选进一步与纤维性的外源性胶原接触来制造胶原浓度高的三维组织体。期待上述这样的三维组织体作为实验动物的替代品、移植材料等的用途。
3.现有技术文献
4.专利文献
5.专利文献1:日本特开2012
‑
115254号公报
6.专利文献2:国际公开第2015/072164号
7.专利文献3:国际公开第2016/027853号
8.专利文献4:国际公开第2017/146124号
9.专利文献5:国际公开第2018/143286号
10.非专利文献
11.非专利文献1:k.holzl et al.,biofabrication 2016,8,032002.
12.非专利文献2:acta biomaterialia,2015,vol.25,p.131
‑
142
技术实现要素:
13.发明所要解决的课题
14.通过上述三维组织体的制造方法,虽然能够制作三维组织体,但由于能够制作的三维组织体的大小依赖于培养容器的大小,因此难以根据目的来控制大小、形状等。
15.作为控制形状而将细胞放置在基材上的方法,存在被称为生物打印的技术(例如非专利文献1),但生物油墨对于细胞生存来说粘度高,生物油墨中的细胞大量受到损伤。
16.因此,本发明的目的在于提供一种简便地制造形状得到控制的三维组织体的方法。
17.用于解决课题的手段
18.即,本发明例如涉及以下的各发明。
19.[1]一种三维组织体的制造方法,其具备在包含经片段化的细胞外基质成分、纤维蛋白及水性介质的培养液中对细胞进行培养的培养工序。
[0020]
[2]根据[1]所述的三维组织体的制造方法,其中,在所述培养工序之前,具备将纤维蛋白原及凝血酶混合的混合工序。
[0021]
[3]根据[1]或[2]所述的三维组织体的制造方法,其中,所述经片段化的细胞外基质成分的至少一部分发生了交联。
[0022]
[4]根据[1]~[3]中任一项所述的三维组织体的制造方法,其中,所述经片段化的细胞外基质成分的平均长度为100nm以上且200μm以下。
[0023]
[5]根据[1]~[4]中任一项所述的三维组织体的制造方法,其中,所述细胞包含细胞外基质产生细胞。
[0024]
[6]根据[1]~[5]中任一项所述的三维组织体的制造方法,其中,所述细胞进一步包含选自血管内皮细胞、癌细胞、心肌细胞、平滑肌细胞、成纤维细胞和上皮细胞中的1种或多种细胞。
[0025]
[7]根据[1]~[6]中任一项所述的三维组织体的制造方法,其中,所述细胞至少包含血管内皮细胞和成纤维细胞。
[0026]
[8]根据[7]所述的三维组织体的制造方法,其中,所述成纤维细胞的含有率相对于总细胞数为25%以上。
[0027]
[9]根据[1]~[8]中任一项所述的三维组织体的制造方法,其中,所述经片段化的细胞外基质成分的含有率以经片段化的细胞外基质成分和细胞的总质量为基准,为0.33质量%以上且90质量%以下。
[0028]
[10]根据[1]~[9]中任一项所述的三维组织体的制造方法,其中,所述经片段化的细胞外基质成分的含有率以经片段化的细胞外基质成分和细胞的总质量为基准,为0.5质量%以上且90质量%以下。
[0029]
[11]根据[1]~[10]中任一项所述的三维组织体的制造方法,其中,在使所述培养液在大致水平方向上移动的同时进行配置。
[0030]
[12]一种含细胞组合物的制造方法,其具备将第一液滴和第二液滴以液滴彼此接触的方式进行配置的工序,所述第一液滴至少包含经片段化的细胞外基质成分、纤维蛋白、水性介质及细胞,所述第二液滴至少包含水性介质。
[0031]
[13]根据[12]所述的含细胞组合物的制造方法,其中,将所述第二液滴配置在所述第一液滴上。
[0032]
[14]一种三维组织体,其包含经片段化的细胞外基质成分、纤维蛋白及细胞。
[0033]
发明效果
[0034]
根据本发明,能够控制三维组织体的形状,简便地制作三维组织体。根据本发明,能够在抑制对细胞的损伤的同时,形成所希望的形状的三维组织体。
[0035]
根据本发明的一个方面,除了能够稳定地制作三维组织体以外,还能够制作具有更厚厚度的三维组织体。根据本发明的一个方面,能够容易地打开血管的内腔。根据本发明的一个方面,能够在一定程度上控制细胞的排列方向。在本发明中,由于改变水性介质中的细胞的种类而形成多个液滴,因此能够观测细胞彼此的相互作用。另外,由于能够在液滴上
重叠地形成液滴,因此能够制作具有更高高度的的三维组织体。
附图说明
[0036]
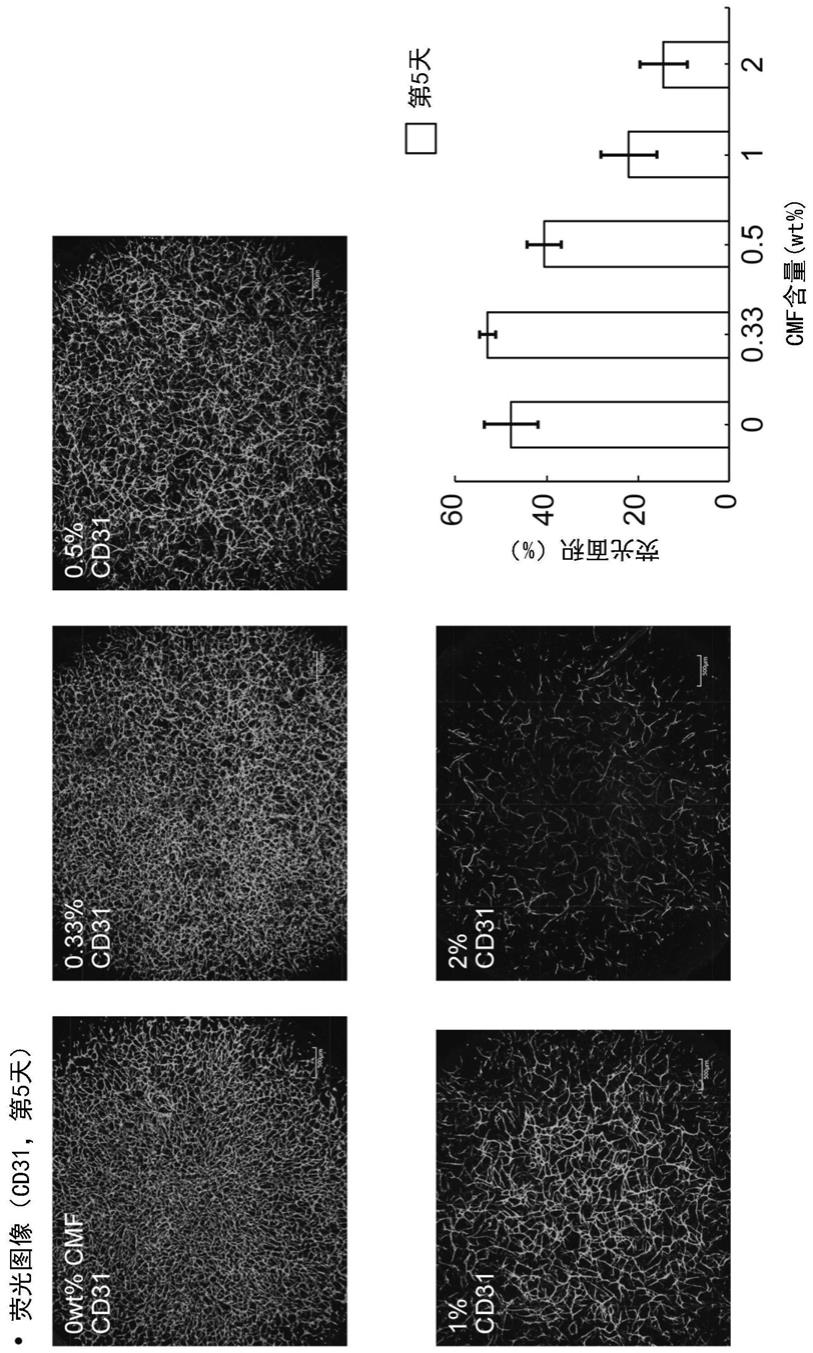
图1是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片及图表。
[0037]
图2是在试验例2中制作的具有毛细血管的三维组织体的显微镜照片。
[0038]
图3是表示在试验例2中制作的三维组织体的厚度的测定结果的图表。
[0039]
图4是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0040]
图5是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察的分析结果的图表。
[0041]
图6是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0042]
图7是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0043]
图8是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察的分析结果的图表。
[0044]
图9是试验例2中制作的具有毛细血管的三维组织体的显微镜照片。
[0045]
图10是表示在试验例2中制作的三维组织体的厚度的测定结果的图表。
[0046]
图11是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0047]
图12是表示在试验例2中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0048]
图13是表示在试验例3中通过3d打印制作的三维组织体的观察结果的图。
[0049]
图14是表示在试验例3中通过3d打印制作的三维组织体的观察结果的图。
[0050]
图15是表示在试验例3中通过3d打印制作的三维组织体的观察结果的图。
[0051]
图16是表示在试验例4中确认到nhdf的效果的结果的图表和照片。
[0052]
图17是表示在试验例4中制作的具有毛细血管的三维组织体的荧光观察结果的照片以及表示内腔的直径的图表。
[0053]
图18是表示在试验例4中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0054]
图19是表示在试验例5中制作的具有毛细血管的三维组织体的荧光观察结果的照片。
[0055]
图20是表示在试验例5中制作的具有毛细血管的三维组织体的荧光观察的分析结果的图表。
[0056]
图21是表示在试验例6中制作的具有毛细血管的三维组织体的荧光观察结果的照片及图表。
[0057]
图22是表示试验例7的稳定性试验的评价结果的照片。
[0058]
图23是表示试验例8中的细胞集团的行为的观察结果的显微镜照片。
[0059]
图24是表示试验例8中的细胞集团的行为的观察结果的显微镜照片。
[0060]
图25是表示试验例8中的细胞集团的行为的观察结果的显微镜照片。
具体实施方式
[0061]
以下,对用于实施本发明的方式详细地进行说明。但是,本发明并不限定于以下的实施方式。
[0062]
<三维组织体的制造方法>
[0063]
本实施方式的三维组织体的制造方法具备在包含经片段化的细胞外基质成分(片段化细胞外基质成分)、纤维蛋白及水性介质的培养液中对细胞进行培养的培养工序。
[0064]
(三维组织体)
[0065]
在本说明书中,“三维组织体”是指细胞介由胶原成分三维地配置的细胞的集合体,是指通过细胞培养而人工制作的集合体。三维组织体的形状没有特别限制,例如可举出片状、球体状、椭圆体状、长方体状等。在此,生物体组织包含血管、汗腺、淋巴管、皮脂腺等,构成比三维组织体复杂。因此,三维组织体和生物体组织能够容易地区别。
[0066]
细胞外基质成分是在三维组织体中填埋至少一部分细胞间的间隙的材料。细胞外基质成分是由多个细胞外基质分子形成的细胞外基质分子的集合体。细胞外基质分子可以是在生物中存在于细胞外的物质。作为细胞外基质分子,只要不对细胞的生长及细胞集合体的形成造成不良影响,就可以使用任意的物质。作为细胞外基质分子,可举出胶原、层粘连蛋白、纤连蛋白、波连蛋白、弹性蛋白、细胞粘合素、巢蛋白、纤维蛋白、及蛋白多糖等,但并不限定于这些。细胞外基质成分可以单独使用其中的1种,也可以组合使用。细胞外基质成分例如可以包含胶原,也可以由胶原构成。在细胞外基质成分包含胶原的情况下,胶原作为细胞粘附的支架发挥功能,进一步促进三维的细胞结构体的形成。需要说明的是,只要不对细胞的生长及细胞集合体的形成造成不良影响,细胞外基质分子可以是上述的细胞外基质分子的修饰体及突变体,也可以是化学合成肽等多肽。细胞外基质分子可以具有胶原特征性的由gly
‑
x
‑
y表示的重复序列。在此,gly表示甘氨酸残基,x和y各自独立地表示任意的氨基酸残基。多个gly
‑
x
‑
y分别可以相同也可以不同。通过具有由gly
‑
x
‑
y表示的重复序列,对分子链的配置的束缚少,作为支架材料的功能更为优异。在具有由gly
‑
x
‑
y表示的重复序列的细胞外基质分子中,由gly
‑
x
‑
y表示的序列的比例在全部氨基酸序列中可以为80%以上,优选为95%以上。另外,细胞外基质分子也可以是具有rgd序列的多肽。rgd序列是指由arg
‑
gly
‑
asp(精氨酸残基
‑
甘氨酸残基
‑
天冬氨酸残基)表示的序列。通过具有rgd序列,细胞粘附得到进一步促进,作为支架材料更为合适。作为包含由gly
‑
x
‑
y表示的序列和rgd序列的细胞外基质分子,可举出胶原、纤连蛋白、波连蛋白、层粘连蛋白、钙黏着蛋白等。
[0067]
作为胶原,例如可举出纤维性胶原及非纤维性胶原。纤维性胶原是指成为胶原纤维主成分的胶原,具体而言,可举出i型胶原、ii型胶原、iii型胶原等。作为非纤维性胶原,例如可举出iv型胶原。
[0068]
作为蛋白多糖,可举出硫酸软骨素蛋白多糖、硫酸乙酰肝素蛋白多糖、硫酸角质素蛋白多糖、硫酸皮肤素蛋白多糖,但并不限定于这些。
[0069]
细胞外基质成分可以包含选自胶原、层粘连蛋白和纤连蛋白中的至少1种,优选包含胶原。胶原优选为纤维性胶原,更优选为i型胶原。作为纤维性胶原,可以使用市售的胶
原,作为其具体例,可举出日本ham株式会社制的猪皮来源的i型胶原。
[0070]
细胞外基质成分可以是动物来源的细胞外基质成分。作为成为细胞外基质成分的来源的动物种,例如可举出人、猪、牛等,但并不限定于这些。细胞外基质成分可以使用一种动物来源的成分,也可以将多种动物来源的成分并用。成为细胞外基质成分的来源的动物种与进行三维组织化的细胞的来源可以相同也可以不同。
[0071]
片段化细胞外基质成分可以通过将上述的细胞外基质成分片段化而得到。“片段化”是指使细胞外基质分子的集合体成为更小的尺寸。片段化可以在切断细胞外基质分子内的键的条件下进行,也可以在不切断细胞外基质分子内的键的条件下进行。经片段化的细胞外基质成分可以包含通过施加物理性的力对上述的细胞外基质成分进行解纤而得到的成分、即经解纤的细胞外基质成分(解纤细胞外基质成分)。解纤是片段化的一个方式,例如是在不切断细胞外基质分子内的键的条件下进行的。
[0072]
作为将细胞外基质成分片段化的方法,没有特别限制。作为对细胞外基质成分进行解纤的方法,例如可以通过施加超声波式均化器、搅拌式均化器、及高压式均化器等物理性的力来对细胞外基质成分进行解纤。在使用搅拌式均化器的情况下,可以将细胞外基质成分直接均化,也可以在生理盐水等水性介质中进行均化。另外,通过调整进行均化的时间、次数等,也可以得到毫米尺寸、纳米尺寸的解纤细胞外基质成分。解纤细胞外基质成分也可以通过反复进行冷冻融解进行解纤而得到。
[0073]
片段化细胞外基质成分可以至少一部分地包含经解纤的细胞外基质成分。另外,片段化细胞外基质成分也可以仅由经解纤的细胞外基质成分构成。即,片段化细胞外基质成分可以是经解纤的细胞外基质成分。经解纤的细胞外基质成分优选包含经解纤的胶原成分(解纤胶原成分)。解纤胶原成分优选维持胶原来源的三重螺旋结构。解纤胶原成分可以是部分地维持胶原来源的三重螺旋结构的成分。通过使片段化胶原成分分散在水性介质中,在水性介质中容易与细胞接触,可促进三维组织体的形成。
[0074]
作为片段化细胞外基质成分的形状,例如可举出纤维状。纤维状是指由丝状的胶原成分构成的形状、或者丝状的细胞外基质成分在分子间交联而构成的形状。片段化细胞外基质成分的至少一部分可以为纤维状。在纤维状的细胞外基质成分中包括将多个丝状细胞外基质分子集合而形成的细丝状物(细纤维)、细纤维进一步集合而形成的丝状物、将这些丝状物解纤而得到的物质等。在纤维状的细胞外基质成分中,rgd序列不被破坏地得以保存,能够更有效地作为用于细胞粘附的支架材料发挥功能。
[0075]
片段化细胞外基质成分的平均长度可以为100nm以上且400μm以下,也可以为100nm以上且200μm以下。在一个实施方式中,从容易形成厚的组织的观点出发,片段化细胞外基质成分的平均长度可以为5μm以上且400μm以下,可以为10μm以上且400μm以下,可以为22μm以上且400μm以下,也可以为100μm以上且400μm以下。在另一实施方式中,从组织形成容易稳定的观点和再分散性更为优异的观点出发,片段化细胞外基质成分的平均长度可以为100μm以下,可以为50μm以下,可以为30μm以下,可以为15μm以下,可以为10μm以下,也可以为1μm以下,且可以为100nm以上。片段化细胞外基质成分整体中,大部分的片段化细胞外基质成分的平均长度优选在上述数值范围内。具体而言,优选片段化细胞外基质成分整体中的95%的片段化细胞外基质成分的平均长度在上述数值范围内。片段化细胞外基质成分优选为平均长度在上述范围内的片段化胶原成分,更优选平均长度在上述范围内的解纤胶
原成分。
[0076]
片段化胶原成分的平均直径可以为50nm以上且30μm以下,可以为4μm以上且30μm以下,可以为5μm以上且30μm以下。片段化细胞外基质成分优选为平均直径在上述范围内的片段化胶原成分,更优选平均直径在上述范围内的解纤胶原成分。
[0077]
上述的平均长度和平均直径的范围从组织形成的观点出发是最优化的,因此期望在用于组织形成的阶段收束于上述的平均长度或平均直径的范围内。
[0078]
片段化细胞外基质成分的平均长度及平均直径可以通过利用光学显微镜测定各片段化细胞外基质成分并进行图像分析而求出。在本说明书中,“平均长度”是指所测定的试样的长度方向的长度的平均值,“平均直径”是指所测定的试样的与长度方向正交的方向的长度的平均值。
[0079]
片段化细胞外基质成分的至少一部分可以在分子间或分子内交联。经片段化的细胞外基质成分可以在构成经片段化的细胞外基质成分的分子内交联,也可以在构成经片段化的细胞外基质成分的分子间交联。
[0080]
作为进行交联的方法,例如可举出通过施加热、紫外线、放射线等进行的物理交联、通过交联剂、酶反应等进行的化学交联等方法,但其方法并没有特别限定。交联(物理交联和化学交联)可以是介由共价键的交联。
[0081]
在片段化胶原成分中,交联可以在胶原分子(三重螺旋结构)之间形成,也可以在由胶原分子形成的胶原细纤维之间形成。交联可以是通过热进行的交联(热交联)。热交联例如可以通过使用真空泵在减压下进行加热处理来实施。在进行胶原分子的热交联的情况下,解纤胶原成分可以通过胶原分子的氨基与同一或其他胶原分子的羧基形成肽键(
‑
nh
‑
co)而交联。
[0082]
片段化细胞外基质成分也可以通过使用交联剂来使其交联。交联剂例如可以为能够使羧基与氨基交联的交联剂、或者能够使氨基彼此交联的交联剂。作为交联剂,例如从经济性、安全性及操作性的观点出发,优选醛类、碳二亚胺类、环氧化物类和咪唑系交联剂,具体而言,可举出戊二醛、1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐、1
‑
环己基
‑3‑
(2
‑
吗啉基
‑4‑
乙基)碳二亚胺磺酸盐等水溶性碳二亚胺。
[0083]
交联度的定量可以根据片段化细胞外基质成分的种类、进行交联的手段等适当选择。交联度可以为1%以上、2%以上、4%以上、8%以上、或12%以上,且可以为30%以下、20%以下、或15%以下。
[0084]
在细胞外基质分子中的氨基用于交联的情况下,交联度可以基于非专利文献2等中记载的tnbs法进行定量。基于tnbs法的交联度可以在上述的范围内。基于tnbs法的交联度是细胞外基质所具有的氨基中用于交联的氨基的比例。
[0085]
交联度也可以通过对羧基进行定量来计算。例如,在不溶性于水的细胞外基质成分的情况下,可以通过tbo(甲苯胺蓝o)法进行定量。通过tbo法得到的交联度可以在上述的范围内。
[0086]
三维组织体中的片段化细胞外基质成分的含有率例如以经片段化的细胞外基质成分和细胞的总质量为基准,可以为0.33质量%以上、0.5质量%以上或5质量%以上。三维组织体中的片段化细胞外基质成分的含量例如以经片段化的细胞外基质成分和细胞的总质量为基准,可以为90质量%以下、80质量%以下、70质量%以下、60质量%以下、50质量%
以下、40质量%以下、30质量%以下、20质量%以下、10质量%以下、5质量%以下或1质量%以下。三维组织体中的片段化细胞外基质成分的含量例如以经片段化的细胞外基质成分和细胞的总质量为基准,可以为0.33质量%以上且90质量%以下,也可以为0.5质量%以上且90质量%以下。
[0087]
(纤维蛋白)
[0088]
纤维蛋白是凝血酶作用于纤维蛋白原而从aα链、bβ链的n末端释放出a链、b链而产生的成分。纤维蛋白是聚合物,一般不溶于水。纤维蛋白是通过使纤维蛋白原与凝血酶接触而形成的。
[0089]
[培养工序]
[0090]
培养工序中,在包含片段化细胞外基质成分、纤维蛋白及水性介质的培养液中对细胞进行培养。通过使培养液包含片段化细胞外基质成分和纤维蛋白,培养液的粘度变得适度,因此能够在控制了形状的培养液中进行细胞的培养。细胞的培养可以在使其形成为液滴状的培养液中进行。
[0091]
细胞没有特别限定,例如可以是人、猴、狗、猫、兔、猪、牛、小鼠、大鼠等动物来源的细胞。细胞的来源部位也没有特别限定,可以是骨、肌肉、内脏、神经、脑、骨、皮肤、血液等来源的体细胞,也可以是生殖细胞。此外,细胞可以是诱导多能性干细胞细胞(ips细胞)、胚胎干细胞(e s细胞),另外也可以是原代培养细胞、传代培养细胞及细胞株细胞等培养细胞。具体而言,作为细胞,例如可举出神经细胞、树突状细胞、免疫细胞、血管内皮细胞(例如人脐带静脉来源的血管内皮细胞(huvec))、淋巴管内皮细胞、成纤维细胞、大肠癌细胞(例如人大肠癌细胞(ht29))、肝癌细胞等癌细胞、上皮细胞(例如人牙龈上皮细胞)、角化细胞、心肌细胞(例如人ips细胞来源的心肌细胞(ips
‑
cm))、肝细胞、胰岛细胞、组织干细胞、平滑肌细胞(例如主动脉平滑肌细胞(aorta
‑
smc)等,但并不限定于这些。细胞可以包含选自血管内皮细胞、癌细胞、心肌细胞、平滑肌细胞、成纤维细胞、及上皮细胞中的一种或多种细胞。细胞可以单独使用一种,也可以将多种细胞组合使用。细胞可以至少包含血管内皮细胞和成纤维细胞。
[0092]
作为细胞,优选包含分泌细胞外基质分子的细胞外基质分泌细胞。作为细胞外基质分泌细胞,例如可举出分泌纤维性胶原等胶原的胶原分泌细胞。作为胶原分泌细胞,例如可举出成纤维细胞、软骨细胞、成骨细胞等间充质细胞,优选为成纤维细胞。作为优选的成纤维细胞,例如可举出人皮肤来源的成纤维细胞(nhdf)、人心脏成纤维细胞(nhcf)和人牙龈成纤维细胞(hgf)。
[0093]
成纤维细胞的含有率相对于总细胞数,可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为100%以下、95%以下、90%以下、80%以下、或75%以下。
[0094]
通过使用包含细胞外基质分泌细胞(例如胶原分泌细胞)的细胞,可获得更稳定且细胞均匀地分布的三维组织体。得到这样的三维组织体的机理的详细情况尚不清楚,但推测如下。
[0095]
在利用了以往的支架的三维组织体的制造方法中,由于向预先准备的支架中注入目标细胞,因此难以使细胞均匀地分布到支架的内部。在细胞为包含胶原产生细胞的细胞的情况下,首先,细胞接触并粘附于含细胞外基质组合物。之后,细胞自身产生构成细胞外
基质成分的蛋白(例如纤维性胶原等胶原)。所产生的蛋白接触并粘附于含细胞外基质组合物,由此作为含细胞外基质组合物间的交联剂发挥作用,在细胞均匀存在的环境下,构成细胞外基质成分的蛋白等的结构化进展。其结果,能够得到更稳定且细胞均匀地分布的三维组织体。但是,上述推测并不是为了限定本发明。
[0096]
在将胶原产生细胞与其他细胞一起使用的情况下,胶原产生细胞的细胞数与其他细胞的比率之比(胶原产生细胞/其他细胞之比)可以为9/1~99/1,可以为50/50~80/20,可以为20/80~50/50,也可以为10/90~50/50。
[0097]
在培养工序中,可以使用包含胶原产生细胞及除胶原产生细胞以外的其他细胞的细胞。作为胶原产生细胞及除胶原产生细胞以外的其他细胞,可以分别使用上文所述的细胞。通过将胶原产生细胞及除胶原产生细胞以外的其他细胞一起使用来制造三维组织体,能够制造各种模型组织。例如,在使用了nhcf和huvec的情况下,能够得到在内部具有毛细血管的三维组织体。在使用了nhcf和大肠癌细胞的情况下,能够得到大肠癌的模型组织。另外,在使用了nhcf和ips
‑
cm的情况下,能够得到显示心悸搏动的心肌的模型组织。
[0098]
对细胞进行培养的方法没有特别限制,可以根据所培养的细胞的种类以适当的培养方法进行。例如,培养温度可以为20℃~40℃,也可以为30℃~37℃。培养基的ph可以为6~8、也可以为7.2~7.4。培养时间可以为1天~14天、可以为7天~14天、可以为14天~30天、可以为30天~60天、也可以为60天~90天。
[0099]
培养液例如可以在使其沿大致水平方向上移动的情况下配置。通过使培养液沿大致水平方向移动,能够在某种程度上控制培养液中的细胞及细胞外基质等的取向。通过使培养液的配置在使其沿大致水平方向移动的情况下进行,能够控制三维组织体的内部的组织结构。
[0100]
培养液中的细胞密度可以根据目标三维组织体的形状、厚度等适当确定。例如,培养液中的细胞密度可以为1~108cells/ml,也可以为103~107cel ls/ml。例如,培养液中的细胞密度可以与后述的混合工序中的水性介质中的细胞密度相同。
[0101]“水性介质”是指以水作为必须构成成分的液体。作为水性介质,只要细胞外基质成分能够稳定地存在,就没有特别限制。例如作为水性介质,可举出磷酸缓冲生理盐水(pbs)等生理盐水、dulbecco’s modified eagle培养基(dmem)、血管内皮细胞专用培养基(egm2)等液体培养基,但不限于此。
[0102]
水性介质的ph优选不对细胞的生长及细胞集合体的形成造成不良影响的范围。从减轻投入细胞时对细胞的负荷的观点出发,水性介质的ph例如可以为7.0以上,且可以为8.0以下。具体而言,水性介质的ph可以为7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0。水性介质优选在上述ph的范围内具有缓冲能力,更优选为液体培养基。液体培养基没有特别限制,可以根据所培养的细胞的种类选择适当的培养基。作为该培养基,例如可举出eagle’s mem培养基、dmem、modified eagle培养基(mem)、minimum essential培养基、rpmi、及glutamax培养基等。培养基可以是添加有血清的培养基,也可以是无血清培养基。此外,液体培养基也可以是将两种以上的培养基混合而成的混合培养基。
[0103]
[其他工序]
[0104]
本实施方式的三维组织体的制造方法在培养工序之前可以具备准备包含经片段化的细胞外基质成分、纤维蛋白、水性介质及细胞的培养液的工序。纤维蛋白例如可以通过
将纤维蛋白原及凝血酶混合而形成。
[0105]
三维组织体的制造方法中,在培养工序之前可以具备在水性介质中混合细胞、纤维蛋白原及凝血酶的工序(混合工序)作为准备工序。经片段化的细胞外基质成分(片段化细胞外基质成分)及细胞优选在将纤维蛋白原及凝血酶混合而形成纤维蛋白前,与纤维蛋白原和/或凝血酶混合。
[0106]
混合工序例如可以是将含有纤维蛋白原的第一液体与含有凝血酶的第二液体混合的工序。经片段化的细胞外基质成分(片段化细胞外基质成分)可以包含于第一液体和/或第二液体中,细胞可以包含于第一液体和/或第二液体中。第一液体和第二液体包含水性介质。第一液体和第二液体中的水性介质可以为同种也可以为不同种。
[0107]
混合工序例如可以通过准备包含细胞和经片段化的细胞外基质成分(片段化细胞外基质成分)的混合物1,将混合物1与纤维蛋白原混合而准备混合物2,将混合物2与凝血酶混合来实施。
[0108]
另外,例如混合工序可以包含将纤维蛋白原和片段化细胞外基质成分混合而准备第一混合液的工序、将细胞和凝血酶混合而准备第二混合液的工序、以及将第一混合液和第二混合液混合的工序。混合工序中的各成分的混合可以在水性介质中进行。
[0109]
在混合工序中,片段化细胞外基质成分的浓度可以根据目标三维组织体的形状、厚度等适当确定。例如,水性介质中的片段化细胞外基质成分的浓度可以为0.1~90质量%,也可以为1~30质量%。
[0110]
在混合工序中,片段化细胞外基质成分的量相对于1
×
105cells的细胞可以为0.1~100mg,也可以为1~50mg。
[0111]
在混合工序中,片段化细胞外基质成分与细胞的质量比(片段化细胞外基质成分/细胞)优选为1/1~1000/1,更优选为9/1~900/1,进一步优选为10/1~500/1。
[0112]
在混合工序后、培养工序前,可以包含使包含细胞、片段化细胞外基质成分和纤维蛋白的培养液凝胶化的工序。凝胶化例如可以通过在37℃的条件下在数十分钟至数小时、或1~5小时、或1.5~2.5小时的条件下保持培养液来进行。在凝胶化的工序中进行保持的时间的特征是,比在上文所述的培养工序中进行保持的时间短。
[0113]
<三维组织体>
[0114]
本实施方式的三维组织体包含细胞、片段化细胞外基质成分、和纤维蛋白。细胞的至少一部分可以与片段化细胞外基质成分接触。作为接触的一个方式,可以进行粘附。
[0115]
在三维组织体包含细胞外基质分泌细胞作为细胞的情况下,三维组织体可以包含内源性细胞外基质。“内源性细胞外基质”是指构成三维组织体的细胞外基质产生细胞所产生的细胞外基质。
[0116]
在三维组织体包含胶原分泌细胞作为细胞的情况下,三维组织体可以包含内源性胶原成分。“内源性胶原”是指构成三维组织体的胶原产生细胞所产生的胶原成分。内源性胶原可以是纤维性胶原,也可以是非纤维性胶原。由于片段化胶原成分是除构成三维组织体的胶原产生细胞所产生的胶原成分以外的胶原成分,因此可以称为外源性胶原成分。
[0117]
在三维组织体包含细胞外基质分泌细胞作为细胞的情况下,三维组织体可以包含:包含细胞外基质分泌细胞的细胞、片段化细胞外基质成分、内源性细胞外基质成分、和纤维蛋白。在该情况下,包含细胞外基质分泌细胞的细胞中的至少一部分可以粘附于片段
化细胞外基质成分和/或内源性细胞外基质成分。
[0118]
三维组织体可以包含细胞外基质分泌细胞和除细胞外基质分泌细胞以外的细胞作为细胞。作为除细胞外基质产生细胞以外的细胞,可举出血管内皮细胞(例如人脐带静脉来源的血管内皮细胞(huvec))、大肠癌细胞(例如人大肠癌细胞(ht29))、肝癌细胞等癌细胞、心肌细胞(例如人ip s细胞来源的心肌细胞(ips
‑
cm))、上皮细胞(例如人牙龈上皮细胞)、角化细胞、淋巴管内皮细胞、神经细胞、肝细胞、组织干细胞、胚胎干细胞、人工多能性干细胞、粘附性细胞(例如免疫细胞)、平滑肌细胞(例如主动脉平滑肌细胞(aorta
‑
smc))等。构成上述三维组织体的细胞优选还包含选自血管内皮细胞、癌细胞、心肌细胞、平滑肌细胞和上皮细胞中的一种或多种细胞。
[0119]
三维组织体中的片段化细胞外基质成分的含有率例如可以以经片段化的细胞外基质成分和细胞的总质量为基准,在上文所述的范围内。
[0120]
在三维组织体含有外源性胶原成分的情况下,三维组织体中的胶原含有率以上述三维组织体(干燥重量)为基准,可以为0.01~90质量%,优选为10~90质量%,优选为10~80质量%,优选为10~70质量%,优选为10~60质量%,优选为1~50质量%,优选为10~50质量%,更优选为10~30质量%,更优选为20~30质量%。
[0121]
在此,“三维组织体中的胶原”是指构成三维组织体的胶原分子,可以来源于内源性胶原成分,也可以来源于片段化胶原成分(也可以称为外源性胶原成分)。即,在三维组织体包含内源性胶原成分和片段化胶原成分的情况下,构成上述三维组织体的胶原含有率是指内源性胶原成分及片段化胶原成分的总量。上述胶原含有率可以根据所得到的三维组织体的体积和经脱细胞化的三维组织体的质量来计算。
[0122]
作为对三维组织体中的胶原量进行定量的方法,例如可举出以下那样的对羟基脯氨酸进行定量的方法。在溶解有三维组织体的溶解液中混合盐酸(hcl),在高温下孵育规定的时间后恢复至室温,将离心分离后的上清液稀释至规定的浓度,由此制备样品。将羟基脯氨酸标准溶液与样品同样地进行处理后,阶段性地进行稀释而制备标准溶液。对样品和标准溶液分别用羟基脯氨酸分析缓冲液和检测试剂进行规定的处理,测定570nm的吸光度。通过将样品的吸光度与标准溶液进行比较来计算胶原成分量。需要说明的是,也可以将三维组织体直接悬浮在高浓度的盐酸中,将溶解后的溶解液离心分离,回收上清液,用于胶原定量。另外,所溶解的三维组织体可以为直接从培养液中回收的状态,也可以在回收后进行干燥处理,在除去液体成分的状态下使其溶解。但是,在将直接从培养液中回收的状态的三维组织体溶解而进行胶原定量的情况下,由于预想由于三维组织体所吸收的培养基成分以及由于实验手法的问题而导致的培养基残留的影响,三维组织体重量的测量值会产生偏差,因此从稳定地测量组织体的重量和每单位重量中所占的胶原量的观点出发,优选以干燥后的重量为基准。
[0123]
作为对胶原量进行定量的方法,更具体而言,例如可举出以下方法。
[0124]
(样品的制备)
[0125]
将进行了冷冻干燥处理的三维组织体的总量与6mol/l hcl混合,用加热块在95℃下孵育20小时以上后,恢复至室温。以13000g离心分离10分钟后,回收样品溶液的上清液。在后述的测定中,以结果收束于标准曲线的范围内的方式用6mol/l hcl进行适当稀释后,用100μl的超纯水稀释200μl,由此制备样品。样品使用35μl。
[0126]
(标准溶液的制备)
[0127]
在螺口试管中加入125μl的标准溶液(1200μg/ml醋酸溶液)和125μl的12mol/l hcl进行混合,用加热块在95℃下孵育20小时后,恢复至室温。以13000g离心分离10分钟后,用超纯水稀释上清液,制作300μg/ml的s1,将s1阶段性地稀释,制作s2(200μg/ml)、s3(100μg/ml)、s4(50μg/ml)、s5(25μg/ml)、s6(12.5μg/ml)、s7(6.25μg/ml)。也准备仅4mol/l hcl 90μl的s8(0μg/ml)。
[0128]
(分析)
[0129]
将35μl的标准溶液和样品分别加入到平板(quickzyme total collage n assay试剂盒附带、quickzyme biosciences公司)中。将75μl的分析缓冲液(上述试剂盒附带)加入到各孔中。用密封件封闭平板,在摇动20分钟的同时在室温下孵育。将密封件剥离,将75μl的检测试剂(试剂a:b=30μl:45μl,上述试剂盒附带)加入到各孔中。用密封件封闭平板,通过摇动混合溶液,在60℃下孵育60分钟。在冰上充分冷却,剥离密封件,测定570nm的吸光度。通过将样品的吸光度与标准溶液进行比较来计算胶原量。
[0130]
三维组织体中所占的胶原成分可以通过其面积比或体积比确定。“通过面积比或体积比确定”是指,例如在使三维组织体中的胶原成分为能够通过已知的染色方法(例如使用了抗胶原抗体的免疫染色、或马松三色染色)等与其他组织构成物区别的状态的基础上,使用肉眼观察、各种显微镜和图像分析软件等,计算在三维组织体整体中所占的胶原成分的存在区域的比率。在通过面积比确定的情况下,并不限定是通过三维组织体中的怎样的截面或表面来确定面积比,例如在三维组织体为球状体等的情况下,可以通过从其大致中心部通过的剖视图来确定。
[0131]
例如,在通过面积比确定三维组织体中的胶原成分的情况下,其面积的比例以上述三维组织体整体的面积为基准为0.01~99%,优选为1~99%,优选为5~90%,优选为7~90%,优选为20~90%,更优选为50~90%。“三维组织体中的胶原成分”如上所述。构成三维组织体的胶原成分的面积的比例是指将内源性胶原成分和外源性胶原成分合起来的面积的比例。胶原成分的面积的比例例如可以将所得到的三维组织体用马松三色染色,作为蓝色染色的胶原成分的面积与从三维组织体的大致中心部通过的截面的整体面积的比例来计算。
[0132]
三维组织体在胰蛋白酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胰蛋白酶处理后的残留率优选为70%以上,更优选为80%以上,进一步优选为90%以上。这样的三维组织体在培养中或培养后不易发生由酶引起的分解,是稳定的。上述残留率例如可以根据胰蛋白酶处理前后的三维组织体的质量来计算。
[0133]
上述三维组织体可以在胶原酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胶原酶处理后的残留率可以为70%以上,更优选为80%以上,进一步优选为90%以上。这样的三维组织体在培养中或培养后不易发生由酶引起的分解,是稳定的。
[0134]
上述三维组织体的厚度优选为10μm以上,更优选为100μm以上,进一步优选为1000μm以上。这样的三维组织体为更接近生物体组织的结构,适合作为实验动物的替代品和移植材料。三维组织体的厚度的上限没有特别限制,例如可以为10mm以下,可以为3mm以下,可以为2mm以下,可以为1.5mm以下,也可以为1mm以下。
[0135]
在此,“三维组织体的厚度”在三维组织体为片状或长方体状的情况下,是指与主面垂直的方向上的两端的距离。在上述主面存在凹凸的情况下,厚度是指上述主面的最薄部分的距离。
[0136]
另外,在三维组织体为球体状的情况下,厚度是指其直径。另外,在三维组织体为椭圆体状的情况下,厚度是指其短径。在三维组织体为大致球体状或大致椭圆体状且表面存在凹凸的情况下,厚度是指从三维组织体的重心通过的直线与上述表面交叉的2点间的距离中的最短的距离。
[0137]
通过使用包含片段化细胞外基质成分和纤维蛋白的培养液,能够在形状得到控制的培养液内进行细胞培养。即,根据一个实施方式,能够形成形状得到控制的包含片段化细胞外基质成分、纤维蛋白及细胞的含细胞组合物。通过对含细胞组合物进行培养,形成三维组织体。培养液(含细胞组合物)的形状的控制例如可以使用3d打印等方法来实施。在使用3d打印的方法来实施的情况下,可以使用3d打印机,也可以使用移液管通过手动作业来进行。
[0138]
在本发明的一个实施方式中,提供一种含细胞组合物的制造方法,其具备将第一液滴和第二液滴以液滴彼此接触的方式进行配置的工序(配置工序),所述第一液滴至少包含经片段化的细胞外基质成分、纤维蛋白、水性介质及细胞(第一细胞),所述第二液滴至少包含水性介质。根据该制造方法,可提供能够评价使第一液滴与第二液滴接触时的第一液滴中的细胞集团的行为(作为细胞集团的行为)的含细胞组合物。根据该含细胞组合物,能够容易地进行观察细胞集团的行为时的图像分析,因此能够进行更高效的评价。含细胞组合物的制造方法可以在配置工序之后进一步包含对细胞进行培养的工序。细胞的培养条件等如上文所述。通过本实施方式的方法得到的含细胞组合物在整个细胞培养期间容易维持形状,因此适合于细胞集团的行为的评价。
[0139]
第二液滴可以以第一液滴的侧面的一部分(例如第一液滴的外周的一部分)接触的方式配置,也可以配置在第一液滴上。第二液滴可以进一步包含片段化细胞外基质成分,可以进一步包含纤维蛋白,可以进一步包含检样,可以包含片段化细胞外基质成分、纤维蛋白和检样。检样可以是能够作用于第一细胞的物质,例如可以是与第一细胞不同种类的细胞(第二细胞)。在第一细胞为huvec的情况下,对于检样,例如可举出nhdf、vegf或它们的组合。可以将1个或2个以上的第二液滴以与第一液滴接触的方式配置。
[0140]
具备上文所述的配置工序的含细胞组合物的制造方法也可以理解为评价细胞集团的行为(作为细胞集团的行为)的方法的一部分。例如,首先,准备至少包含片段化细胞外基质成分、纤维蛋白、水性介质和第一细胞的第一液滴。以与第一液滴接触的方式配置至少包含水性介质的第二液滴。通过利用显微镜等观察第一液滴与第二液滴的界面附近的部分以及第二液滴的不与第一液滴接触的部分,由此观察作为第一液滴中的第一细胞的集团的行为。
[0141]
实施例
[0142]
以下,基于实施例对本发明具体地进行说明,但本发明并不限定于这些实施例。
[0143]
<试验例1:经解纤的胶原成分的制作>
[0144]
将日本ham株式会社制的猪皮来源的i型胶原冻结干燥体100mg用真空检样干燥器hd
‑
15h(石井理化机器制作所制),在设为减压状态的同时,在200℃下加热24小时。由此,得
到至少一部分交联的胶原成分(交联胶原成分)。需要说明的是,在200℃的加热前后,胶原在外观上未确认到大的变化。
[0145]
将50mg所制作的交联胶原成分悬浮于5ml超纯水中,使用超声波式均化器,在4℃的条件下重复10次20秒的循环,进行均化,由此对交联胶原成分进行解纤。将得到的液体用孔径为35μm的过滤器过滤,得到包含经解纤的胶原成分(scmf)的分散液。
[0146]
scmf的平均长度为14.8
±
8.2μm(n=20)。
[0147]
<试验例2:三维组织体的制作及评价>
[0148]
在三维组织体的制作中使用的试剂、器具及制作条件如下。
[0149]
牛血浆来源的纤维蛋白原(sigma f8630、type i
‑
s,65
‑
85%蛋白)
[0150]
牛血浆来源的凝血酶(sigma t4648、66n1h unit/mg蛋白)
[0151]
总细胞数:5
×
106cells/ml(nhdf:huvec=2:1)
[0152]
培养基(ebm
‑
2:dmem(高葡萄糖)=1:1)
[0153]
ebm
‑
2:lonza、endothelial cell basal medium
‑2[0154]
dmem(高葡萄糖):nacalai tesque
[0155]
玻璃底培养皿(松浪硝子工业、35mmφ培养皿、d1114oh)
[0156]
培养基:4ml(每2天更换)、37℃、5%co2[0157]
在37℃的恒温槽内,将纤维蛋白原以20mg/ml的浓度溶解于无血清dmem(nacalai tesque,08489
‑
45)中,制备纤维蛋白原溶液。在37℃的恒温槽内,将凝血酶以100unit/ml的浓度溶解于dmem中,制备凝血酶溶液。使scmf以60mg/ml的浓度分散于dmem,制备scmf分散液。
[0158]
在1.5ml样品管(watson,131
‑
7155c)中加入细胞、18μl的dmem和2μl的凝血酶溶液。将纤维蛋白原溶液和scmf分散液以1:1混合而得到的混合液40μl加入到装有细胞和凝血酶的样品管中,进行吹吸,由此制备组织体形成用的试验液。将样品管内的组织体形成用的试验液30μl滴加到玻璃底培养皿上,形成液滴。在37℃下孵育2小时后,加入3ml的dmem,开始培养。培养进行5~14天。由此,制作具有毛细血管的三维组织体。
[0159]
以scmf和细胞的总质量为基准,以使scmf达到0.33质量%、0.5质量%、1质量%或2质量%的方式制作三维组织体。另外,除了不使用scmf以外,与上述同样地制作比较用的组织体(scmf的含量:0质量%)。
[0160]
通过以下的步骤进行三维组织体的荧光成像。在室温(25℃)下,使用4%多聚甲醛(pfa)固定所得到的三维组织体。对于固定的三维组织体,以1%pbs实施3次15分钟的清洗。接着,将三维组织体用triton
‑
x100(sigma)0.2%的pbs在室温下处理15分钟,再次实施3次利用1%pbs进行的15分钟的清洗。将得到的三维组织体用1%bsa(牛血清白蛋白,sigma,a3294)
‑
pbs在室温下处理1小时。对于处理后的三维组织体,使用含有cd31(单克隆抗体小鼠抗人cd31、内皮细胞、克隆jc70a、dako)的1%bsa
‑
pbs 1ml,在4℃、12小时的条件下使其作用。重复3次利用1%pbs进行的15分钟的清洗后,将alexa fluor 647(alexa fluor 647,山羊抗小鼠igg(h l),invitrogen)或alexa fluor 488和hoescht(hoechst 33342)用1%bsa
‑
pbs分别稀释到1/200和1/100,使其作用于所得到的三维组织体。
[0161]
在染色的三维组织体的观察中,使用共聚焦激光显微镜(yokogawa,c qi),激光激发光为488nm或640nm和405nm。荧光面积通过image j进行分析。
[0162]
三维组织体的厚度通过evos fl auto software in measure model进行测定(n=30)。毛细血管的直径通过image j进行测定(n=100)。
[0163]
图1表示具有毛细血管的三维组织体的荧光观察结果。在包含scmf的情况下,显示了形成了毛细血管。
[0164]
图2表示所制作的三维组织体的显微镜观察结果。图2中的箭头表示血管的管腔。图3是表示三维组织体的厚度与scmf的含量的关系的图表。如图2~3所示,显示了在包含scmf的情况下,能够得到更厚的三维组织体。
[0165]
使总细胞数(nhdf:huvec=2:1)为1.5
×
105cells/ml、3.0
×
104cell s/ml、或1.5
×
104cells/ml,通过上述方法制作具有毛细血管的三维组织体。将在scmf 0.5质量%的条件下制作的三维组织体的荧光观察结果示于图4。图5是表示细胞数与荧光面积或管腔直径的关系的图表。确认了随着细胞数的增加,变得容易形成毛细血管。
[0166]
将培养期间为5天、7天、或14天的三维组织体和比较用的组织体的荧光观察结果示于图6~7。图8是表示培养天数与荧光面积或管腔直径的关系的图表。如图6~8所示,任一组织体均随着培养期间变长,荧光面积变大,管腔的直径也变大。图9中示出了培养期间为5天、7天或14天的三维组织体的观察结果。图10是表示比较用的组织体及三维组织体的厚度的图表。如图10所示,确认了通过使用scmf,可形成更厚的组织体。
[0167]
显示了通过调整组织体形成用的试验液的滴加量,能够容易地控制具有毛细血管的三维组织体的形状(图11)。
[0168]
图12表示将组织体形成用的试验液的滴加量设为300μl而制作的三维组织体。图12所示的三维组织体的厚度为6.1mm。
[0169]
<试验例3:通过3d打印制作三维组织体及评价>
[0170]
将通过上述方法制备的组织体形成用的试验液通过3d打印按照成为图13所示的形状(线状)的方式配置在培养皿上。此时的3d打印条件如下。将结果示于图13。
[0171]
0.5质量%纤维蛋白原
[0172]
10unit/ml凝血酶
[0173]5×
106cells(nhdf:huvec为2:1)
[0174]
凝胶化时间为20
‑
30分钟
[0175]
将通过上述方法制备的组织体形成用的试验液通过3d打印按照成为图14所示的形状的方式配置在培养皿上。将试验液配置在培养皿上时,以扩展试验液的方式配置。此时的3d打印条件如下。将结果示于图14。
[0176]
0.5质量%纤维蛋白原
[0177]
10unit/ml凝血酶
[0178]5×
106cells(nhdf:huvec为2:1)
[0179]
凝胶化时间为20
‑
30分钟
[0180]
将通过上述方法制备的组织体形成用的试验液通过3d打印按照成为图15所示的形状(点状)的方式配置在培养皿上。将试验液配置在培养皿上时,不扩展试验液,通过滴加而配置。此时的3d打印条件如下。将结果示于图15。
[0181]
0.5质量%纤维蛋白原
[0182]
10unit/ml凝血酶
tesque,lonza,cc
‑
3202)50%,培养1周。使用cd31(dako,m0823)和alexa 647(invitrogen,a21235)进行免疫染色,使用共聚焦定量图像细胞仪cq(yokogawa)进行荧光观察,评价毛细血管网的形成。将结果示于图23~25。
[0198]
确认了在图24~25的界面附近,诱导了血管新生。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。